El beneficio de la endarterectomía carotídea en pacientes asintomáticos es actualmente cuestionado por la reducción observada en la tasa de infarto cerebral con tratamiento médico actual. Se realiza una revisión de la evidencia disponible.
El uso perioperatorio de estatinas, mejor estandarización de técnica quirúrgica, concentración de endarterectomías en cirujanos de mayor volumen quirúrgico e identificación de pacientes de mayor riesgo han permitido una disminución paralela de los infartos postendarterectomía. Se ha identificado una subpoblación asintomática con mayor riesgo de desarrollar eventos neurológicos: estenosis carotídeas severas, rápida progresión de estenosis, presencia de infartos hemisféricos silentes, microembolias en doppler transcraneal, menor reserva cerebrovascular y placas inestables.
El futuro de la endarterectomía carotídea radica en la identificación de lesiones de mayor riesgo de infarto y realizar cirugía con mínima morbimortalidad. Los estudios de imágenes han mostrado un rápido avance, pero se requiere de mejor validación antes de cambiar las guías de manejo vigentes.
The benefit of carotid endarterectomy in asymptomatic patients is currently questioned, due to an observed reduction in stroke rate with current medical treatment. A review is carried out on the available evidence.
The perioperative use of statins, better standardisation of surgical techniques, concentration of endarterectomy by surgeons with a higher surgical volume, and identification of high-risk patients, have led to a parallel decrease in post-endarterectomy stroke. An asymptomatic subpopulation has been identified with an increased risk of developing neurological events: severe carotid stenosis, rapid progression of stenosis, presence of silent hemispherical infarcts, micro-emboli in transcranial doppler, lower cerebrovascular reserve, and unstable plaques.
The future of carotid endarterectomy in asymptomatic patients lies in the identification of lesions with increased risk of stroke and performing surgery with minimal morbidity and mortality. Imaging studies have rapidly progress, but better validation is required before changing current management guidelines.
El accidente vascular encefálico es una patología relevante por su morbimortalidad asociada, siendo una de las tres principales causas de muerte en el mundo y responsable de secuelas permanentes invalidantes, con alto impacto económico a nivel familiar, social y estatal1,2.
Muchos de los infartos cerebrales son prevenibles. La estenosis carotídea aterosclerótica es una de las principales causas de infartos isquémicos, en especial en pacientes que presentan déficit neurológico transitorio. La estenosis carotídea asintomática también es importante ya que puede comenzar con un infarto cerebral, siendo responsable de 11 de cada 100 infartos2.
Las indicaciones de endarterectomía carotídea en pacientes asintomáticos se establecieron en estudios prospectivos randomizados de la década de los 80 y 901, destacando los estudios de ACAS3 y ACST a 54 y 10 años5 que mostraron reducción relativa de la tasa de infarto cerebral/muerte en alrededor de 50% en pacientes tratados con endarterectomía respecto a aquellos con tratamiento médico exclusivo, siendo significativa si sobrevivían más de 5 años. Se redujo el riesgo de infarto cerebral de 2,2% por año en los pacientes tratados solo con medicamentos a 1,1% por año en los tratados con endarterectomía a 5 años3, considerando que la tasa de infarto/muerte perioperatorio fue de 2,3% en ACAS3 y de 2,8% en ACST4. Estos estudios mostraron que por cada 1.000 endarterectomías en pacientes asintomáticos se previenen de 46 a 59 infartos cerebrales a 5 años, es decir, deben operarse entre 17 y 22 pacientes para prevenir un solo infarto cerebral. Los beneficios de la endarterectomía carotídea encontrados en estos estudios son menores que los obtenidos en estudios de diseño similar en pacientes sintomáticos y son dudosos para mujeres y pacientes mayores de 75 años, pero presentan la ventaja de perdurar en el tiempo5,6.
El tratamiento médico exclusivo en estos estudios comprendía el control de factores de riesgo y el mejor tratamiento farmacológico disponible en esos años (principalmente antiagregantes plaquetarios). La mejoría del tratamiento médico en los últimos años, en el que suman mejores antihipertensivos y se masifica el uso de estatinas con sus efectos pleiotrópicos con estabilización de la placa aterosclerótica, han disminuido los infartos cerebrales en pacientes con estenosis carotídeas a valores inferiores al 1% de infarto cerebral por año2. Esto debe cuestionar la vigencia de los estudios mencionados, así como los beneficios médicos y de costo-efectividad de la endarterectomía en pacientes asintomáticos2.
Pese a los múltiples reportes que describen una reducción significativa en la tasa de infartos isquémicos con el tratamiento médico actual, no existen estudios prospectivos randomizados que apoyen que este tratamiento sea mejor que la endarterectomía. La información disponible debe ser analizada cuidadosamente ya que algunas publicaciones de tratamiento médico: estudiaron cohortes pequeñas, con seguimiento escaso, objetivos definidos deficientemente, cruce de tratamiento a endarterectomía o inclusión de poblaciones mixtas de pacientes sintomáticos y asintomáticos y/o con lesiones con grados no significativos de estenosis, etc. Esto impide obtener conclusiones valederas, requiriéndose de mejor evidencia antes de cambiar las guías de manejo vigentes6.
El stenting carotídeo en pacientes asintomáticos no ha mostrado ser mejor que la endarterectomía carotídea por lo que no será considerado en esta revisión. Al igual que múltiples estudios, hemos publicado resultados auspiciosos7, pero su indicación no es abierta para pacientes asintomáticos y se deberá esperar los resultados de estudios prospectivos randomizados en curso (SPACE-28 y CREST-29).
ObjetivoSe realiza una revisión en Pubmed de la evidencia disponible que permita establecer el rol actual de la endarterectomía carotídea en pacientes asintomáticos.
DesarrolloSe analiza la información recopilada en tres aspectos:
- I.
Los resultados contemporáneos de la endarterectomía carotídea son mejores.
- i)
Los resultados quirúrgicos han mejorado en los últimos años como muestran una revisión sistemática y análisis con metarregresión realizada por Munster AB et al.10 con una curva de tasa de infarto postendarterectomía decreciente y tasa de infarto cerebral/muerte actual de 1,2%. Otras publicaciones muestran tasa de infarto cerebral/muerte de 1,5%6, que es menor que la de estudios de décadas pasadas.
- ii)
Existe mayor evidencia respecto a la técnica quirúrgica: uso rutinario de parche, de shunt, tipo de endarterectomía usada (endarterectomía longitudinal o eversión) y a la técnica anestésica6,11.
- iii)
El uso de estatinas perioperatoria en endarterectomía carotídea se asocia a una significativa menor tasa de infarto cerebral y de déficit cognitivo postoperatorio12.
- iv)
Los resultados son mejores en cirujanos que realizan esta cirugía con mayor frecuencia, más de 30 endarterectomías al año13, mientras que aquellos con menos de 10 endarterectomías en el año previo tienen peores resultados en regresión logística14.
- v)
Los mejores resultados de la endarterectomía carotídea se dan tanto en hospitales universitarios como en los comunitarios, como muestra Woo et al.15 a partir de la base de datos del National Surgical Quality Improvement Program que contempla 10.423 pacientes sometidos a endarterectomía carotídea (5.009 asintomáticos) entre el año 2.005 y 2.007 en 110 hospitales, la mitad de ellos comunitarios. La tasa de infarto cerebral perioperatorio fue de un 0,96%.
- vi)
La identificación de condiciones de alto riesgo quirúrgico por razones locales (reestenosis, lesiones altas o bajas, cuellos hostiles, parálisis de cuerdas vocales contralateral, etc.) o condiciones médicas de alto riesgo anestésico (patología coronaria, pulmonar, hepática, renal avanzada) permite una mejor selección de pacientes para cirugía intravascular en vez de abierta16.
- vii)
Se han demostrado beneficios de la endarterectomía carotídea más allá de la prevención de infartos cerebrales, encontrándose mejoría en funciones cognitivas en pacientes asintomáticos sometidos a intervenciones carotídeas por estenosis17,18.
- i)
- II.
Consideraciones en pacientes que recibirán tratamiento médico exclusivo.
- i)
Los infartos cerebrales isquémicos de origen carotídeo ocurren en pacientes que presentaban estenosis aterosclerótica inicialmente asintomática. Un 80% de la totalidad de los infartos isquémicos por estenosis carotídeas no son precedidos de un accidente isquémico transitorio2. El tratamiento médico exclusivo exige una actitud crítica y vigilante ya que estos pacientes mantienen el riesgo de infarto cerebral en el tiempo y el hecho de vivir con una lesión amenazante tiene efectos psicológicos6.
- ii)
La baja prevalencia de estenosis carotídea en frecuencia y significación no justifica realizar programas de tamizaje en poblaciones. La mayor frecuencia de estenosis carotídea en enfermedad arterial oclusiva extremidades inferiores (15-25%), aneurisma aorta abdominal (12%), cardiopatía coronaria (30-50%, significativa: 5-12%), expone a este subgrupo de pacientes a riesgo de infarto cerebral tres a cuatro veces mayor1,2. Adicionalmente aquellos pacientes que deberán ser intervenidos por estas otras patologías arteriales presentan aún mayor riesgo de infarto cerebral debido a eventuales cambios hemodinámicos perioperatorios. En estos casos se realiza primero endarterectomía carotídea o cirugía combinada (coronaria y carotídea) de manera de prevenir infartos cerebrales postoperatorios o tomar una conducta expectante asumiendo un mayor riesgo19,20. Más aún, Evans y Wijdicks21 estudiaron 284 pacientes sometidos a cirugía general, con anestesia general y que presentaban estenosis carotídea en ultrasonido realizado dentro de un año antes de la cirugía. En el grupo de 224 pacientes con estenosis mayor de 50%, la tasa de infarto cerebral perioperatorio fue de un 3,6%.
- iii)
Existen dudas respecto al impacto y la aplicabilidad del tratamiento médico en grandes poblaciones debido a mala tolerancia o efectos colaterales de algunos medicamentos, costos mayores de nuevos fármacos, disminución en la adherencia después de que los pacientes dejan de pertenecer a estudios clínicos, metas terapéuticas cada vez más exigentes, etc.6,22 Aún mayor resistencia ocurre cuando se requiere de cambios de hábitos adictivos como el tabaquismo. El estudio de corte transversal EURO ASPIRE IV23, auspiciado por la Sociedad Europea de Cardiología en 78 centros de 24 países europeos, incluyó 7.998 pacientes con cardiopatía coronaria y síndrome coronario agudo que fueron evaluados a los 6 meses de seguimiento. El sobrepeso estaba presente en el 82,1% de los pacientes y la obesidad en el 38% (central en 58%), solo un 48% siguieron las recomendaciones dietéticas postinfarto. Más del 60% se encontraba con presión arterial mayor de 130/80 (mayor de 140/90: 43%), 81% tenía valores de LDL ≥ 1,8mmol/litro y en los diabéticos, 47% con mal control metabólico. En cuanto al estilo de vida, solo un 40% de los pacientes practicaba actividad deportiva rigurosa de 20 min una a dos veces por semana y se encontró que el 49% de los tabáquicos continuaba fumando.
- i)
- III.
El futuro de la endarterectomía carotídea en pacientes asintomáticos está en la selección de aquellos con mayor riesgo de desarrollar infarto.
Estudios han permitido identificar características clínicas, exámenes de laboratorio y estudio de imágenes que permiten identificar subgrupo de pacientes con estenosis carotídea asintomática con mayor riesgo de infarto cerebral.
- i.
Grado de estenosis. Tanto el estudio ACAS3, como el ACST4,5 no mostraron diferencias en frecuencia de infartos cerebrales según grado de estenosis. Posteriormente el estudio ACSRS publicado por Nicolaides et al.24, estudio de cohortes y multicéntrico más grande sobre este tema, permitió identificar diversas variables que se asociaron con mayor riesgo de infarto. Estudió 1.121 pacientes con 48 meses de seguimiento promedio, encontrándose una mayor frecuencia de infartos en el seguimiento en pacientes asintomáticos que presentaban inicialmente mayor grado de estenosis. En 1.115 pacientes con estenosis 50-99% por dúplex (criterio ECST)25, agrupados por rangos de estenosis, se realizó seguimiento promedio de 37,1 meses: grupo con estenosis inicial 50-69% presentó 0,8% de infarto ipsilateral por año, el 70-89% un 1,4% por año y el 90-99% un 2,4% por año.
- ii.
Progresión de la estenosis. En estudio realizado por Hirt et al.26 se realizó un análisis retrospectivo de 1.469 pacientes del estudio ACST con un seguimiento promedio mayor a 5 años. En base a criterios NASCET en dúplex carotídeo, se establecieron cinco categorías de pacientes asintomáticos según severidad de estenosis: 0-49%, 50-69%, 70-89%, 90-99% y de 100% u oclusión. En el seguimiento se encontró una tasa anual promedio de incidencia de progresión de lesiones de 5,2% y de regresión de 4,5%. Aquellos pacientes que aumentaban en una categoría de severidad el riesgo de infarto aumentaba en 1,4 veces, mientras que si aumentaba en dos categorías este era de 4,0 y ante una progresión en tres categorías fue de 7,6 veces mayor riesgo, siendo las dos últimas estadísticamente significativas (p=0,150, <0,001, <0,010 respectivamente). Expresado, en otros términos, en una categoría de progresión el porcentaje de infarto cerebral por año fue de 6,3%, dos categorías 18,0%, y tres categorías 20,0% por año. El ACSRS27 estudió la evolución del grado de estenosis a 8 años de seguimiento promedio: 19,8% progresaba, 76,4% no presentaban cambios y solo un 3,8% presentaba regresión. Los pacientes que presentaban regresión no presentaban infarto ipsilateral isquémico, mientras que los que no presentaban cambios presentaban un riesgo de infarto de un 9% en 8 años (1,1% por año) y aquellos que evolucionan con progresión presentaron 16% infarto ipsilateral correspondiendo a una tasa de 2,0% por año.
- iii.
Características clínicas. El estudio ACST4 publicó mayor incidencia significativa de eventos neurológicos ipsilaterales a 5 años en pacientes del grupo de tratamiento médico que presentaban síntomas neurológicos contralaterales previos (OR 1,66; 95% IC 1,28-2,15; p<0,001). El ACSRS24,25 identificó que pacientes con antecedentes de tabaquismo crónico de más de 10 paquetes-año, presión arterial sistólica elevada, insuficiencia renal crónica o eventos isquémicos contralaterales presentaban mayor riesgo de isquemia ipsilateral. Asimismo, Hirt et al.26 identifican que subgrupos de pacientes con diabetes mellitus o eventos isquémicos contralaterales previos son los que presentan mayor riesgo.
- iv.
Infartos silentes de encéfalo en estudios de imágenes. La presencia de infartos silentes en tomografía axial computada (TAC) o en resonancia nuclear magnética (RNM) en pacientes con estenosis carotídea significativa se asocian a un mayor riesgo de infarto hemisférico ipsilateral en el seguimiento. En estudio realizado por Kakkos et al.28, se seleccionaron los 821 pacientes del estudio ACSRS que tenían TAC de encéfalo basal, observándose en estos 146 (17,8%) infartos ipsilaterales asintomáticos, de etiología predominante embólica según clasificación de Stevens. En seguimiento de 44,6 meses promedio, se encontraron 102 eventos isquémicos. En el subgrupo de 462 pacientes con estenosis asintomáticas 60-99% y un TAC basal sin infartos silentes la tasa de infartos cerebrales ipsilaterales fue de 1,0% por año, mientras que aquellos que sí los tenían presentaban 3,6% de infarto por año (log-rank p= 0,002; regresión de Cox HR 3,0; 95% IC 1,46-6,29).
- v.
Microembolias en Doppler transcraneal (DTC). Las microembolias detectadas en DTC es otro indicador de inestabilidad de la placa traduciendo desprendimientos de material a partir de la placa supuestamente asintomática. El estudio multicéntrico, prospectivo y observacional ACES29 involucró 26 centros y eligió 467 pacientes asintomáticos con estenosis mayor a 70% que se sometieron a DTC para evaluación de microembolias. Se repitió el DTC cada 6 meses en el seguimiento. Signos embólicos basales se encontraron en 77 pacientes (16,5%) mientras que hubo 32 (6,6%) eventos isquémicos en el seguimiento (26 accidentes isquémicos transitorios, 6 infartos cerebrales). Pacientes sin embolias presentaron riesgo de infartos ipsilaterales en un 0,7% por año, mientras aquellos que presentaron embolias en DTC presentaron 3,6% de infartos por año (HR 5,57; IC 1,61-19,32; p=0,007). En metaanálisis incluido en esta publicación, se aprecia que otros estudios presentaron resultados similares estableciendo una tasa conjunta de infartos cerebrales ipsilaterales de 1,4% en pacientes sin evento embólicos vs. 8,7% en pacientes con embolias detectadas en DTC (OR 6,63; 95% IC 2,85-15,44). Posteriormente Topakian et al.30 seleccionan 435 pacientes del estudio ACES y les realiza seguimiento durante 2 años. El grupo de 164 (37,7%) pacientes con placas ecolúcidas (según Geroulakos31) presentaron mayor riesgo de infarto cerebral ipsilateral (HR 6,43; 95% IC 1,36–30,44; p=0,019). Al combinar las variables de placa ecogénica con microembolias en DTC el riesgo se aumentó considerablemente (HR 10,61; 95% IC 2,98–37,82; p<0,001). Mandani et al.32 reportaron 253 pacientes con estenosis asintomáticas>60% estudiados con DTC para detección de microembolias y con dúplex 3D para estudio de úlceras en la placa. Encontraron que pacientes con más de 3 úlceras (18 vs. 2%, p=0,03) y aquellos con microembolias (20 vs. 2%, p=0,003) tenían significativo mayor riesgo de infarto cerebral/muerte a tres años.
- vi.
Reserva cerebrovascular. En pacientes con agotamiento de la capacidad vasodilatadora en territorios vasculares cerebrales presentan un mayor riesgo de infarto cerebral en presencia de una estenosis carotídea asintomática según metaanálisis de Gupta et al.33. Contempló 13 estudios de pacientes con estenosis asintomáticas mayores a 70%, no intervenidos, con al menos un año de seguimiento. Se analizaron 991 pacientes que fueron seguidos durante 32,7 meses promedio con DTC o cintigrafía, en los que se midió la disminución de la capacidad reactiva ante la disminución de perfusión antes y después de estímulo vasodilatador con variación de CO2 inspirado o administración de acetozolamida. En pacientes con disminución de la reserva de perfusión los eventos isquémicos ipsilaterales aumentaron con OR 4,70 (95% IC 2,00-11,07) para pacientes asintomáticos. Esta interpretación es independiente del método de evaluación y concluye que existe una falta de adaptabilidad a la disminución de flujo por estenosis significativa. A diferencia de las condiciones antes expuestas que tienen mecanismo embólico, este factor sería de origen hemodinámico causado por estenosis de alto grado.
- vii.
Estado de otras arterias involucradas en la perfusión cerebral. El estudio ACST2 encontró un mayor riesgo de infarto cerebral/muerte postendarterectomía en pacientes que tenían una oclusión carotídea contralateral (3,8%). Maatz et al.34 en un estudio retrospectivo más metaanálisis de otras 19 publicaciones involucrando 13.438 endarterectomías carotídeas, encontró un 2,4% de infartos perioperatorios en pacientes sin oclusión contralateral, mientras que aumentaba a 3,7% cuando existía oclusión contralateral (p=0,002).
La asociación de enfermedad carotídea intra- y extracraneana simultánea (lesiones en tándem) es infrecuente y su implicancia en pacientes asintomáticos es controversial35. Rouleau et al.36 comentan que las lesiones en tándem infrecuentemente cambian la decisión de endarterectomía, mientras que Stelagowski et al.37 encontraron en estos pacientes mayor infarto postoperatorio y menor beneficio de la cirugía a un año de seguimiento. Estudio reciente de Ballota et al.38 no muestra mayor riesgo postendarterectomía en 1.143 pacientes sintomáticos y asintomáticos operados (219 con lesiones en tándem).
- viii.
Morfología de la placa carotídea. Los infartos isquémicos ocurren más frecuentemente en presencia de placas blandas, vulnerables o inestables. Se define como tal la presencia de una rotura de la cápsula fibrosa o cápsula delgada, hemorragia intraplaca, core necrótico rico en lípidos, inflamación de la pared vascular con presencia de macrófagos, neovasculatura de la placa.
- i.
- Histología. Mauriello et al.39 estudiaron 437 pacientes intervenidos de endarterectomía carotídea en los que se realizó estudio histológico: 220 asintomáticos, 119 con déficit neurológico transitorio y 118 con infarto cerebral. Definieron como placas trombóticas aquellas que presentan rotura, erosión, hemorragia intraplaca o trombo asociado, mientras que las placas no trombóticas se clasificaban en estables (fibro-calcificadas) o vulnerables (cápsula fibrosa delgada). En el grupo de pacientes intervenidos con infarto cerebral, se encontró 79 (66,9%) placas trombóticas y 39 (33,1%) no trombóticas; mientras que en los pacientes asintomáticos había 59 (26,8%) con placas trombóticas y 161 (73,2%) no trombóticas. El subgrupo de pacientes asintomáticos con placas trombóticas (26,8%) podría haber sido susceptible de presentar síntomas en caso de no haber sido operados.
- Ultrasonido. Geroulakos et al.31 realizaron estudio de placas carotídeas en 121 pacientes con estenosis>70% en los que se realizó dúplex carotídeo que identificó 72 placas sintomáticas y 75 asintomáticas. Se definieron 5 tipos de placas: las de tipo 1 y 2 que eran ecolúcidas (blandas en la histología): tipo 1 uniformemente ecolúcida, tipo 2 con predominio ecolúcido; las placas tipo 3 y 4 ecogénicas (más fibrinógeno y colágeno): tipo 3 con predominio ecogénico, tipo 4 uniformemente ecogénica, y las tipo 5 indeterminables por calcificación intensa. Este estudio describió una relación entre el tipo de placa y la presentación clínica: pacientes sintomáticos presentaban 57 (81%) placas ecolúcidas (tipos 1 y 2), mientras que los asintomáticos presentaban 43 (59%) placas ecogénicas (tipos 3 y 4). Debe destacarse que un 41% de los pacientes asintomáticos presentaban placas ecolúcidas. Posteriormente y utilizando esta misma clasificación, el estudio ACSRS24 reportó riesgo de infarto cerebral de 3% por año en placas ecogénicas tipo 1-2, mientras que fue de 0,8% por año para el tipo 3 y de 0,4% por año para el tipo 4, con diferencia significativa. Adicionalmente el estudio ACSRS también estudia tipo de área de placa, escala de grises (gray scale median) y área negra yuxtaluminal (JBL, probable marcador de inestabilidad), encontrando diferencias significativamente mayores de riesgo de infarto cerebral en área de placa mayor de 80 mm2, gray scale median menor de 15 y JBL mayor de 10 mm2.
El ultrasonido presenta limitaciones en la evaluación de placas carotídeas ya que se requiere visión ortogonal para evitar el efecto anisotrópico, es operador dependiente, placas calcificadas presentan una sombra acústica que impide una adecuada evaluación y existen dificultades para distinguir la hemorragia intraplaca de core lipídico.
- RNM. Estudio de imágenes promisorio para el estudio de placas inestables. El Dr. Hatsukami (Washington University en Seattle) ha participado en múltiples publicaciones que han favorecido el desarrollo y divulgación de este método de estudio. La RNM ha progresado en este campo en base a los tres elementos fundamentales del estudio: desarrollo de coils de superficie que permiten un aumento de la señal libre de ruido, creación de nuevas secuencias de imágenes y posprocesamiento de las imágenes adquiridas.
Cada nueva técnica de evaluación de placa con RNM requiere de la comparación con otras técnicas de RNM más establecidas y posteriormente su corroboración con estudios de histología, extrayéndose placas indemnes para estudio histológico (patrón de referencia), calculándose especificidad, sensibilidad e índice kappa.
Las técnicas de secuencia de imágenes más conocidas para evaluación de placas inestables son T1-weighted (T1W), T2-weighted (T2W), time of flight, Proton density-weighted. Algunos ejemplos de avances en técnicas de imágenes en RNM son las siguientes. A) Magnetization-prepared rapid acquisition gradient-echo40: secuencia especial de T1W 3D que ha sido optimizado para detección de hemorragia intraplaca. B) 3D MERGE (3D motion sensitized driven equilibrium prepared rapid gradient echo)41: secuencia de sangre negra 3D que permite entregar una calidad de precisión de imágenes similar a las de una arteriografía, con un tiempo de examen de 2 min y una resolución espacial de 0,7×0,7×0,7 mm3. C) Simultaneous non-contrast angiography and intraplaque hemorrhage42: fuerte correlación con histología en la identificación de hemorragia intraplaca (κ=0,82, p<0,001) y con otros métodos de evaluación en MR (time of flight, magnetization-prepared rapid acquisition gradient-echo) para la determinación de ulceraciones y del grado de estenosis (ICC=0,96, p<0,001). El tiempo de examen es corto (3,5 min), la resolución espacial alta (0,8×0,8×0,8 mm3) y tiene la ventaja de no ocupar gadolinio. Esta técnica permite diferenciar claramente hemorragia intraplaca.
Un tercer nivel de evaluación de estos avances en RNM son los estudios que evalúan la RNM con la evolución clínica. Takaya et al.43 estudiaron 154 pacientes asintomáticos con estenosis 50-79% y seguimiento promedio de 38,2 meses. Se realizó RNM cada 3 meses con protocolo TOF, T1-weighted (T1W), Proton density-weighted, T2-weighted, encontrándose la presencia de una cápsula fibrosa delgada o rota como el principal factor de riesgo de desarrollo de eventos neurológicos ipsilaterales con HR de 17,0 (p≤0,001). Por otro lado, Underhill et al.44 en 108 pacientes asintomáticos con estenosis 50-79% estudiados con protocolos T1W, T2-weighted, Proton density-weighted, encontraron que en estudio de base 23 (21,3%) de los pacientes presentaban disrupción de la superficie placa. En el seguimiento a 3 años, 9 (10,6%) de los 85 pacientes restantes desarrollaron una nueva disrupción de la placa. El parámetro más relevante en el desarrollo de la rotura de cápsula fibrosa en el seguimiento fue el tamaño del núcleo necrótico rico en lípidos (LRNC) (AUC=0,95; ROC). Saam et al.45 publicaron un metaanálisis de 8 estudios que comprenden 689 pacientes estudiados con RNM (712 arterias), 62,5% con eventos isquémicos transitorios y el resto asintomáticos. La prevalencia basal de hemorragia intraplaca fue de 51% de los estudios. En seguimiento promedio de 19,6 meses ocurrieron 108 eventos neurológicos (15,7%). La presencia de hemorragia intraplaca incrementó el riesgo de infarto cerebral en 6 veces, siendo también válido para el subgrupo de pacientes asintomáticos (HR 3,50; IC 2,59-4,73).
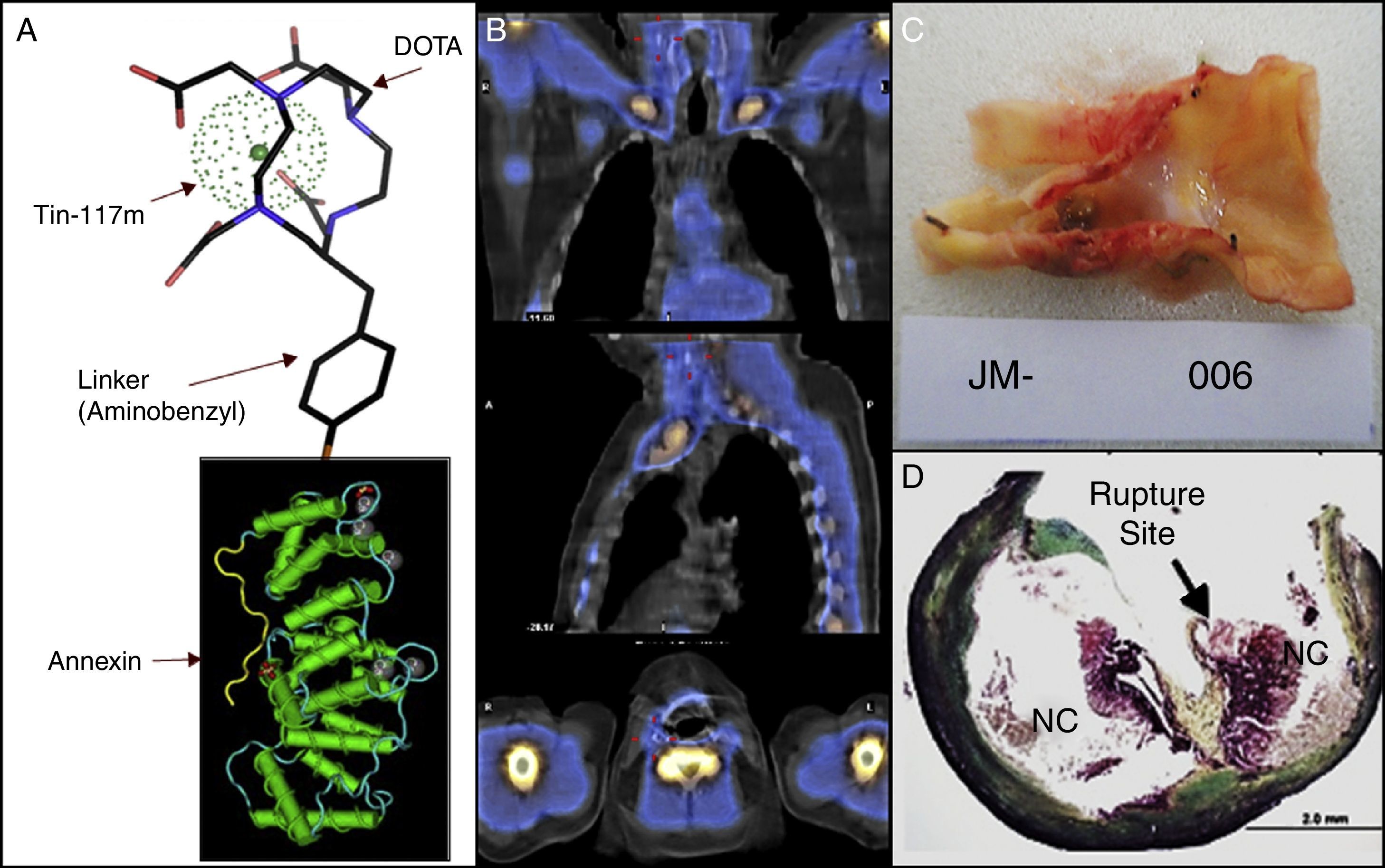
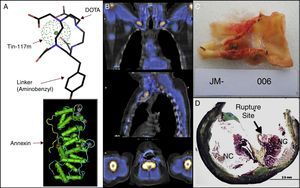
- Medicina nuclear. Menos desarrollo ha tenido la evaluación de placas inestables con técnicas de medicina nuclear. Nuestro departamento ha participado de un estudio de bioseguridad y de fase inicial de un estudio de cintigrafía que permita identificar pacientes con placas inestables. Este examen se basa en las propiedades de la anexina V, proteína que tiene la propiedad de unirse a fosfolípidos de membrana que se exponen cuando las células entran en fase apoptótica. Se utiliza anexina unida a molécula de estaño y con marcador radioactivo Tin-117m. Este complejo es administrado intravenoso y detectado posteriormente por una gamma-cámara. En estudio preliminar, la molécula ha mostrado ser captada por placas inestables, pero no en las estables, como es corroborado en estudio histológico posterior a endarterectomía en pacientes asintomáticos (fig. 1).
Cintigrafía con anexina (protocolo de estudio). A) Se observa la molécula de anexina, unida a molécula de estaño y al marcador radiactivo Tin-117m; que luego fue administrada a paciente con estenosis carotídea derecha 80% asintomática. B) Se observan imágenes obtenidas con la gamma-cámara en proyecciones coronal, sagital y transaxial. El examen fue positivo, cuatro marcas rojas pequeñas señalan sitio de decoloración blanquecina en localización de placa aterosclerótica a intervenir. Carótida contralateral sin lesiones ni decoloración. C) Se observa la placa íntegra obtenida en la endarterectomía carotídea. Se observan elementos de hemorragia intraplaca y trombo intraluminal asociado. D) Se observa el estudio histológico realizado, señalándose con flecha el sitio de rotura de la placa.
- Estudios de laboratorio. No se han identificado determinaciones serológicas de mayor riesgo de infarto cerebral. La presencia de Lp-PLA2 (lipoproteína plasmática asociada a fosfolipasa A2) se encuentra elevada en pacientes con estenosis carotídea 70-90% que presentan placas inestables en histología postendarterectomía, pero se desconoce si constituye un factor de riesgo independiente46.
Al analizar en forma combinada estos y otros parámetros clínicos y estudios de imágenes es posible identificar sinergia en el aumento de riesgo24, pero se requiere aún de mayor validación. Debe considerarse situación de mayor riesgo si la tasa anual de infarto cerebral ipsilateral es sobre 4% y menor riesgo si es bajo 1%.
ConclusionesLa evidencia expuesta permite plantear qué tipo de pacientes asintomáticos obtendrían mayor beneficio con la cirugía o con el tratamiento médico (tabla 1), pero se requiere de una mejor validación clínica y reproducibilidad antes de poder cambiar las guías vigentes de manejo de patología carotídea.
Condiciones determinantes en la selección de pacientes asintomáticos para endarterectomía carotídea
| Mayor beneficio | Beneficio dudoso o ausente |
|---|---|
| Paciente menor de 75 años | Mayores de 75 años |
| Bajo riesgo quirúrgico | Alto riesgo quirúrgico |
| Estenosis mayor de un 80% | Mujeres |
| Progresión de estenosis | Expectativa de vida<5 años |
| Infartos silentes en la TAC | Oclusión carotídea contralateral |
| Microembolias en DTC | Placa fibrosa estable |
| Baja reserva cerebrovascular | |
| Síntomas contralaterales | |
| Placa carotídea inestable |
Es probable que en un futuro próximo tengamos nuevos métodos de estudio no invasivo que permitirán definir la inestabilidad de la placa de mejor manera y así realizar endarterectomía en paciente aún asintomático. También sabremos los resultados de estudios prospectivos y randomizados en curso como el SPACE-28 y el CREST-29 que aportarán mejor nivel de evidencia. Por ahora, los pacientes asintomáticos deberán ser estudiados selectivamente con los métodos antes mencionados, como manera de identificar placas asintomáticas inestables, en las que la endarterectomía evitará un infarto cerebral inminente.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.
Este manuscrito fue presentado en la XV Convención de Cirujanos Vasculares de Habla Hispana. Quito, Ecuador–octubre de 2015.