Os aneurismas da aorta abdominal (AAA) são atualmente corrigidos por método endovascular (EVAR) em cerca de 75% dos casos nos EUA. A diminuição diâmetro máximo do saco aneurismático representa o principal marcador de ausência de rotura ou mortalidade relacionada com o aneurisma. Porém, em cerca de 40% dos casos não se verifica diminuição, podendo inclusivamente ocorrer aumento do mesmo.
Vários fatores de risco pré‐operatórios podem prever um aumento do saco aneurismático pós‐EVAR. O principal objetivo desta revisão passa pela descrição detalhada de todos esses fatores de risco, de modo a que seja possível uma correta estratificação dos doentes.
Vários fatores de risco são descritos nesta revisão de literatura: idade avançada, existência de colos hostis, ocorrência de endoleak e até inflamação sistémica. Estes constituem determinantes importantes, que condicionam um pior prognóstico pré‐operatório.
A identificação atempada destes fatores de risco reveste‐se de enorme relevância pela correta orientação que permite a cada doente individualmente. Desta forma, doentes com poucos ou nenhum fatores de risco poderão ser incluídos num follow‐up por ecografia abdominal, enquanto o grupo de doentes que apresentam vários destes fatores beneficiariam de uma vigilância mais intensiva, nomeadamente por angio‐tomografia computadorizada, a qual apresenta maior sensibilidade na deteção de complicações, apesar da sua maior iatrogenia.
About 75% of the Abdominal Aortic Aneurysms (AAA) are currently repaired by endovacular means (EVAR). Aneurysm sac shrinkage post‐EVAR represents the principal marker of absence of rupture or mortality aneurysm related. However, in about 40% of cases aneurysm sac does not shrink or even enlarges.
Several pre‐operative risk factors may predict aneurysm sac enlargement post‐EVAR. The aim of this review is to summarize all risk factors that may condition an aneurysm sac enlargement so that one could adapt the best follow‐up method to each patient according to the risk score.
Most of those risk factors are described in this review: advanced age, hostile necks, endoleak occurrence or even systemic inflammation. These constitute important determinants that predict a worst prognosis pre‐operatively.
The early identification of these risk factors have remarkable implications in the follow up strategy. Patients with none or only one risk factor may be suitable for a US‐Dupplex follow‐up, while those patients with several pre‐operative risk factors could be good candidates for Angio‐Computed Tomography surveillance, which presents more sensivity in the detection of complications, despite its greater iatrogeny.
O aneurisma da aorta abdominal (AAA) representa uma situação de risco de vida, cuja mortalidade em caso de rotura pode atingir os 90%1. Aquando do seu diagnóstico, torna‐se mandatório considerar a reparação eletiva, que apresenta uma mortalidade inferior a 5%. Em caso de rotura, esta pode atingir os 90%2.
O AAA está presente em cerca de 4‐7% da população com mais de 65 anos e é mais frequente em indivíduos do sexo masculino2,3.
A etiologia não se encontra perfeitamente estudada3. Pensa‐se que possam ser causados por processos degenerativos (como o «remodelling» da matriz pelas metaloproteinases da matriz [MMP]), aterosclerose, doenças genéticas, doenças inflamatórias, autoimunes e infeciosas e trauma2–4.
A principal complicação do aneurisma é a rotura, sendo que a sua probabilidade é diretamente proporcional ao diâmetro aneurismático5.
A correção dos AAA pode ser realizada por cirurgia convencional ou por método endovascular (endovascular aneurysm repair – EVAR). Esta última técnica foi publicada pela primeira vez em 1991 por Parodi e desde então tem vindo a reconhecer‐se como a técnica padrão para tratamento do AAA infrarrenal6.
O EVAR cresceu significativamente, sendo neste momento realizado em mais de 75% dos pacientes nos EUA, com a porção remanescente apresentando anatomia inadequada para o procedimento7.
Quando comparado com a cirurgia convencional, o EVAR está associado a taxas de mortalidade e complicações a curto prazo menores8. A vantagem na sobrevida é mais significativa em indivíduos mais velhos. Reintervenções tardias relacionadas com os aneurismas abdominais são mais comuns após correção endovascular, mas são contrabalançadas com as complicações da laparotomia9.
O endoleak representa a mais frequente complicação pós‐EVAR10. A sua classificação é feita em 5 tipos, baseado na fonte comunicante entra a circulação sistémica e o saco aneurismático11. Os endoleaks tipo I resultam do fluxo sanguíneo entre a parede do vaso e a prótese na zona de ancoragem proximal (tipo Ia), distal (Ib) ou devido a inadequada selagem (tipo Ic). Endoleaks tipo II, os mais frequentes, resultam de fluxo de sangue para o saco aneurismático proveniente de vasos viscerais e/ou lombares através de um vaso único (tipo IIa) ou de vários vasos (tipo IIb). Endoleaks tipo III resultam da entrada de sangue no aneurisma proveniente de defeito na prótese, por separação dos módulos da mesma (tipo IIIa) ou rotura do material protésico (tipo IIIb). Endoleaks tipo IV resultam do fluxo através da prótese devido a porosidade elevada e, por fim, o tipo 5 em que se verifica um aumento continuado da expansão do saco aneurismático sem deteção de qualquer endoleak imagiologicamente12,13.
Cerca de 15‐25% dos EVAR complicam com endoleaks, podendo até 12% destes pacientes necessitar de reintervenção13,14.
A presença de endoleaks tem sido associada a roturas pós‐cirúrgicas, principalmente se proximais. Embora menos comum, roturas têm também sido observadas em pacientes com endoleak tipo II, mesmo sem necessidade de aumento do saco aneurismático15.
Embora o tratamento cirúrgico seja habitualmente necessário no caso do endoleak tipo I, os endoleaks tipo II resolvem‐se habitualmente sem necessidade de correção cirúrgica15.
A vigilância por método de imagem é, portanto, mandatória para a identificação e tratamento precoce estas complicações. Correntemente, não existe consenso quanto ao melhor método de vigilância pós‐EVAR1,16. A angio‐tomografia computadorizada (TC) constitui ainda o método padrão, dada a sua boa precisão na deteção de endoleaks, variações do tamanho do aneurisma e na posição da prótese17.
Contudo, a alta dose de radiação, a administração de agentes de contraste nefrotóxicos aliados aos elevados custos constituem uma limitação ao seu uso ao longo dos anos. A ecografia abdominal tem sido investigada como alternativa dado a ausência de radiação e de risco associado ao contraste. Para além destes fatores, trata‐se também de um método de imagem menos dispendioso. O reforço da ecografia abdominal com contraste não nefrotóxico tem também revelado resultados promissores18.
Mais estudos são, portanto, necessários para comprovar um custo‐efetividade superior à TC no follow‐up pós‐EVAR.
Controvérsia existe também quanto à periodicidade da vigilância: atualmente está preconizada a execução de TC ao primeiro mês, 6 meses e um ano após EVAR. Porém, em centros de referência, casos não complicados podem seguir um protocolo menos intensivo, principalmente se a TC for normal ao final do primeiro mês19,20.
ObjetivosEsta revisão pretende fazer uma descrição detalhada de todos os fatores de risco para aumento do saco aneurismático pós‐EVAR, de forma a adaptar a estratégia de follow‐up ao risco pré‐operatório de cada paciente.
Fatores preditores de evolução do saco aneurismáticoO principal preditor de sucesso pós‐EVAR é a diminuição do máximo diâmetro transverso do aneurisma21,22.
Alterações precoces do saco aneurismático representam um forte preditor complicações a longo prazo após EVAR. Cieri et al. descreveram que uma diminuição persistente do saco aneurismático (>5mm) estava associada a ausência de mortalidade relacionada com o aneurisma aos 3 e 10 anos de 100 e 99,7%, respetivamente23.
Num outro estudo levado a cabo por Bastos‐Gonçalves et al., os pacientes foram estratificados em 3 grupos de acordo com a diminuição do saco aneurismático até 18 meses após cirurgia: pacientes com diminuição acentuada do saco aneurismático se >5mm, diminuição moderada se entre 1‐5mm e pacientes sem diminuição. Os autores concluíram que a não diminuição do saco aneurismático representava, por si só, um fator de risco independente para complicações tardias. O grupo sem diminuição apresentou também maior taxa de reintervenção, tendo a frequência de endoleaks sido menor no grupo com diminuição acentuada24.
Contudo, a diminuição major do saco aneurismático só é verificada em 60% dos doentes submetidos a EVAR22.
Vários outros estudos têm nos últimos anos identificado fatores de risco para aumento do saco aneurismático.
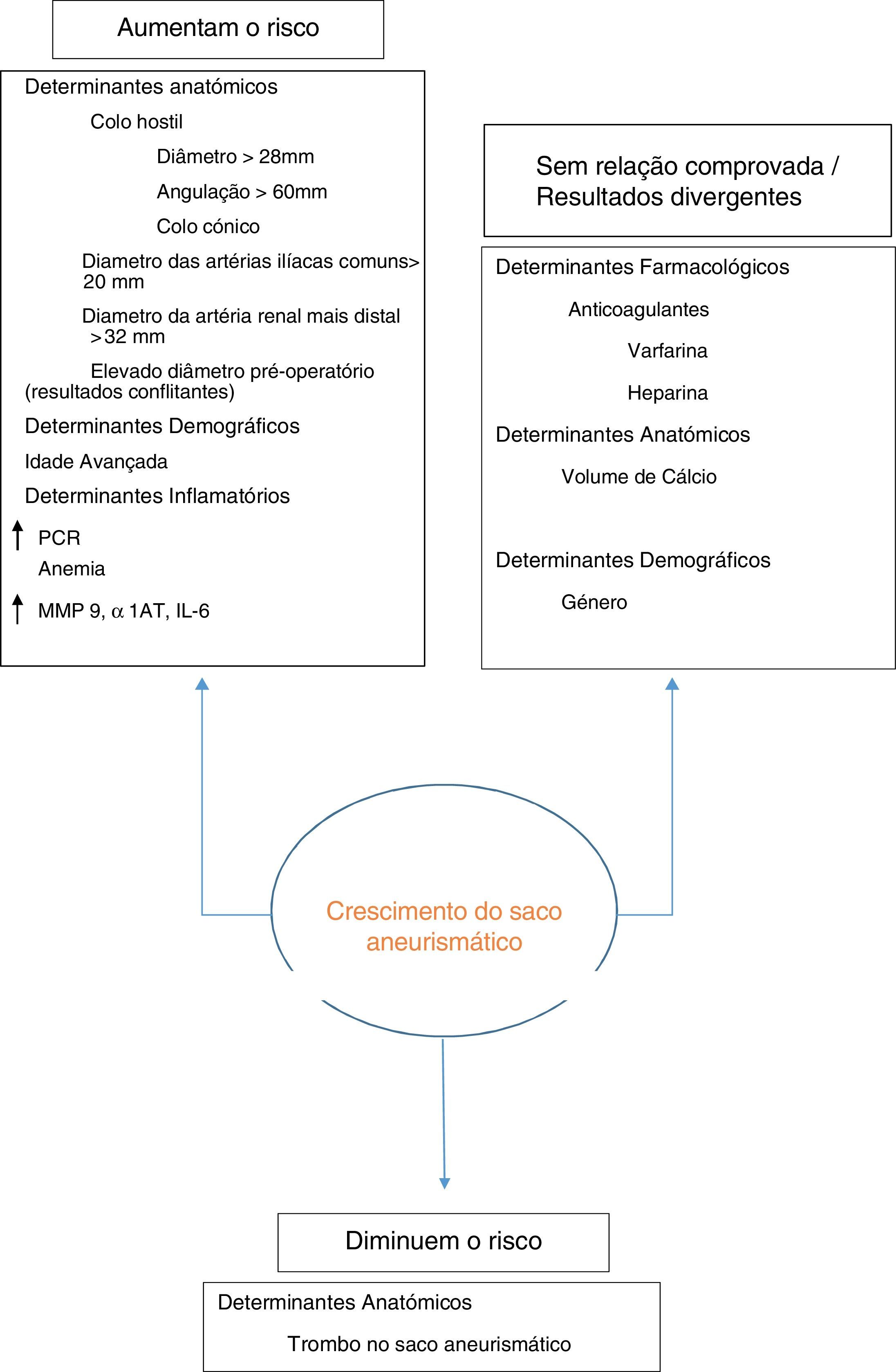
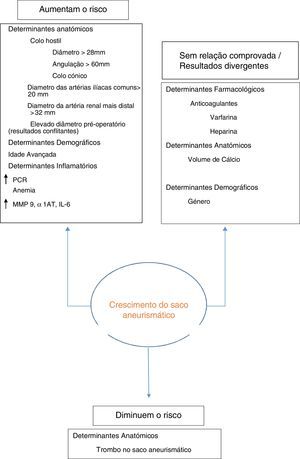
Um estudo multicêntrico retrospetivo que incluiu uma população de 10.228 doentes submetidos a EVAR entre 1999‐2008 nos EUA verificou que a prevalência de aumento do saco aneurismático era de aproximadamente 41% aos 5 anos e identificou como fatores de risco: idade superior a 80 anos, presença de colo cónico, diâmetro do colo proximal >28mm, angulação do colo proximal >60°, diâmetro das artérias ilíacas comuns >20mm. Neste mesmo estudo foi realizada uma análise multivariada de todos estes fatores de risco e concluiu‐se que o seu determinante primário era a presença de endoleak. Verificou‐se também que a idade >80 anos, o diâmetro do colo proximal >28mm, angulação do colo proximal >60° e diâmetros das artérias ilíacas internas >20 constituíam fatores de risco independentes para aumento do saco aneurismático25. Deve‐se, porém, notar que o estudo acima citado foi elaborado por recurso a análise de uma base de dados de software de reconstrução 3D, para a qual apenas uma minoria dos centros enviam casos de uma forma sistemática. Podemos, portanto, estar perante um caso de potencial viés negativo, dado que a maioria dos centros envia para reconstrução apenas os casos em que a anatomia se revela desfavorável ou com possível suspeita de complicações, o que explica uma taxa superior de complicações neste estudo quando comparada com a restante literatura.
Greenberg confirmou também a idade avançada como fator de risco, descrevendo que uma maior dimensão do aneurisma pré‐operatoriamente se correlacionava com aumento do saco aneurismático26.
Condições pró‐inflamatórias basais poderão também conferir um pior prognóstico pós‐EVAR. Segundo Diehm et al., a concentração basal de hemoglobina está independentemente associada ao tamanho do aneurisma, assim como uma redução da sobrevida pós‐EVAR. O racional para este estudo seria a anemia como marcador de inflamação sistémica, a qual está também associada à patogenia do AAA27. A proteína c reativa, marcador inflamatório rotineiramente usado na prática clínica, encontra‐se elevada em doentes com patologia aneurismática e correlaciona‐se com o tamanho do aneurisma28. Uma meta‐análise recente demonstrou elevação significativa de outras proteínas séricas como MMP‐9, TIMP‐1, IL‐6, CRP, α1AT e triglicerídeos, quando comparados com pacientes sem AAA29. Parece, portanto, relevante averiguar através de marcadores séricos as condições inflamatórias pré‐operatoriamente.
O efeito da terapêutica anticoagulante e antiagregante tem também sido alvo de estudos, sendo que existem relatos divergentes na literatura. Estudos anteriores sugeriram que a varfarina estaria associada a um aumento de 30% na taxa de endoleaks, assim como de aumento do saco aneurismático30. Porém, Wild et al. refutaram esta hipótese estabelecendo que a sua administração é segura nestes doentes15. Em conflito com este último estudo, De Rango revela que administração de terapia anticoagulante, varfarina ou heparina estão sujeitos a maior taxa de endoleak imediato e aos 5 anos, assim como a maior taxa de reintervenção. Por fim, os autores concluem ainda uma menor sobrevida aos 5 anos dos doentes submetidos a anticoagulação31.
Outro aspeto que pode influenciar as variações do diâmetro aneurismático prende‐se com a presença de trombo: pacientes com maior área trombótica de AAA no pré‐operatório parecem apresentar maior taxa de diminuição do saco aneurismático pós‐EVAR dada a cessação de fluxo que se cria dentro do saco aneurismático32.
A corroborar estes resultados, um artigo publicado em 2013 revela que uma proporção >50% de trombo pré‐operatória parece protetora quanto ao surgimento de endoleak, assim como do aumento do saco aneurismático. O mesmo estudo revela que a percentagem de cálcio, assim como os diâmetros aneurismáticos pré‐operatórios não se revelaram preditores do aumento do saco aneurismático33 (fig. 1).
ConclusãoVários estudos têm sido publicados nos últimos anos, descrevendo a influência de fatores clínicos, anatómicos, hematológicos e até farmacológicos na evolução do saco aneurismático após EVAR. Embora a literatura apresente divergência entre alguns dados, vários fatores têm sido consistentemente referidos. A deteção pré‐operatória destes determinantes permite estratificar grupos de risco com vista uma orientação adequada do follow‐up pós‐EVAR.
Apesar da controvérsia quanto aos melhores métodos para follow‐up de EVAR, a TC permanece ainda como gold standard. Porém, a repetição de TC acarreta aumento de exposição a radiações, risco de nefropatia de contraste e aumento dos custos de saúde. Por sua vez, a ecografia representa um método menos invasivo e dispendioso, mas também menos sensível que a TC.
Vários trabalhos têm reportado o uso de ecografia para vigilância, reservando a TC apenas para casos com achados anormais ou suspeitos na ecografia. Um estudo publicado em 2007 envolveu 160 doentes submetidos a EVAR e que tinham sido seguidos apenas por ecografia abdominal, ficando a TC reservada para casos em que fosse detetável a presença de endoleak ou alargamento do saco aneurismático. Num total de 359 ecografias foram detetados 41 endoleaks, 35 dos quais foram posteriormente estudados por TC, tendo 14 deles sido confirmados. Em apenas 3 casos a TC demonstrou presença de endoleak que não tinha sido detetada por ecografia34.
Segundo Dias et al., menos de 10% dos pacientes seguidos após EVAR com prótese Zenith beneficiaram do seguimento periódico. Este benefício poderia provavelmente ser sustentado por um protocolo baseado nas medições do diâmetro aneurismático através de ecografia e radiografia abdominal. As TC devem, porém, ser realizadas até um ano pós‐intervenção ou sempre que haja suspeição de alguma intercorrência ou planeamento de reintervenção35,36.
Também Verhoeven et al. sugeriram a possibilidade de reservar a TC para casos de ecografia inconclusiva, sinais de complicações e anatomia desfavorável37.
Porém, segundo uma meta‐análise publicada em 2010, a ecografia ainda não se revelou um método suficientemente sensível para a deteção de endoleak. Parte destes resultados poderão explicar‐se pela heterogeneidade da população estudada. Já a ecografia com utilização de contraste não nefrotóxico revela‐se uma modalidade segura e mais sensível que a ecografia convencional para a deteção de endoleaks, tornando‐se por isso um método promissor18.
Dada a possibilidade de uma vigilância mais custo‐efetiva e com menor invasibilidade, urge a necessidade de averiguar exaustivamente todos os determinantes de risco desta população, de forma a identificar os grupos de menor risco clínico e anatómico e possibilitar a este estrato uma vigilância com protocolos mais custo‐efetivos, remetendo apenas a fração de maior risco para vigilância mais intensiva.
Este trabalho não foi apresentado ao público.
Não há fundos de investigação a reportar.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interessesOs autores declaram não haver conflito de interesses.