Os autores apresentam um caso clínico referente a um doente com antecedentes de bypass aorto-femoral esquerdo complicado por infeção, pelo que foi submetido a resseção parcial do mesmo e construção de bypass femoro-femoral, com necessidade de transversostomia subsequente por fistulização entre o cólon descendente, a loca da prótese removida e a parede abdominal. Após episódios de hemorragia gastrointestinal associados a investigação inconclusiva, a última TC abdominopélvica levantou suspeita de fístula aorto-entérica secundária e o doente foi submetido a laparotomia exploradora, laqueação da aorta abdominal e bypass axilo-“cross over” femoro-femoral. Segue-se uma revisão literária das fístulas aorto-entéricas.
The authors present a case report of a patient with previous history of a left aorto-femoral bypass complicated by infection, then submitted to partial resection of the prosthesis and femoro-femoral bypass, with subsequent transversostomy for fistula between the descendent colon, the loca of the removed prosthesis and the abdominal wall. After a few episodes of gastrointestinal bleeding with no conclusive investigation, a secondary aorto-duodenal fistula was suspected in the last abdominopelvic CT performed. The patient was submitted to laparotomy for abdominal aorta closure suture and axilo-“cross over” bypass. This is followed by a literary review of aorto-enteric fistulae.
A fístula aorto-entérica foi descrita pela primeira vez em 1829, por Astley Cooper, mas a primeira correcção cirúrgica foi realizada em 1954, por Zenker1.
A incidência desta patologia é rara e, em muitos casos, o seu diagnóstico é tardio ou não é reconhecido porque manifesta-se de forma semelhante a outras causas de hemorragia gastrointestinal1–4. A limitação diagnóstica, os riscos e as complicações inerentes ao tratamento cirúrgico contribuem para as elevadas taxas de mortalidade e de morbilidade associadas à fístula aorto-entérica, tornando-a fatal na maioria dos casos1–6.
O diagnóstico precoce desta patologia implica um elevado grau de suspeição num doente que apresente hemorragia gastrointestinal e que já tenha sido submetido a um procedimento cirúrgico que envolva a aorta abdominal.
Caso clínicoDoente do sexo masculino, 66 anos, com história prévia de rutura crónica contidade aneurisma ilíaco comum e interno esquerdo, em 2006, submetido a laqueação / exclusão do aneurisma e bypass aorto-ilíaco externo. Em 2007, foi diagnosticado falso aneurisma da anastomose distal do bypass, motivo pelo qual procedeu-se a ressecção do falso aneurisma e extensão da prótese à artéria femoral comum esquerda. Em 2008, o doente apresentou infeção da prótese, com abcesso do psoas e fistulização cutânea a nível inguinal, pelo que foi submetido a ressecção parcial da prótese aorto-femoral esquerda e construção de bypass femoro-femoral direito-esquerdo. No mesmo ano, foi diagnosticada fístula entre o cólon descendente, a loca da prótese removida e a parede abdominal, pelo que o doente foi submetido a transversostomia. A reconstrução do trânsito intestinal foi subsequentemente protelada por evidência de persistência da fístula nos exames de reavaliação.
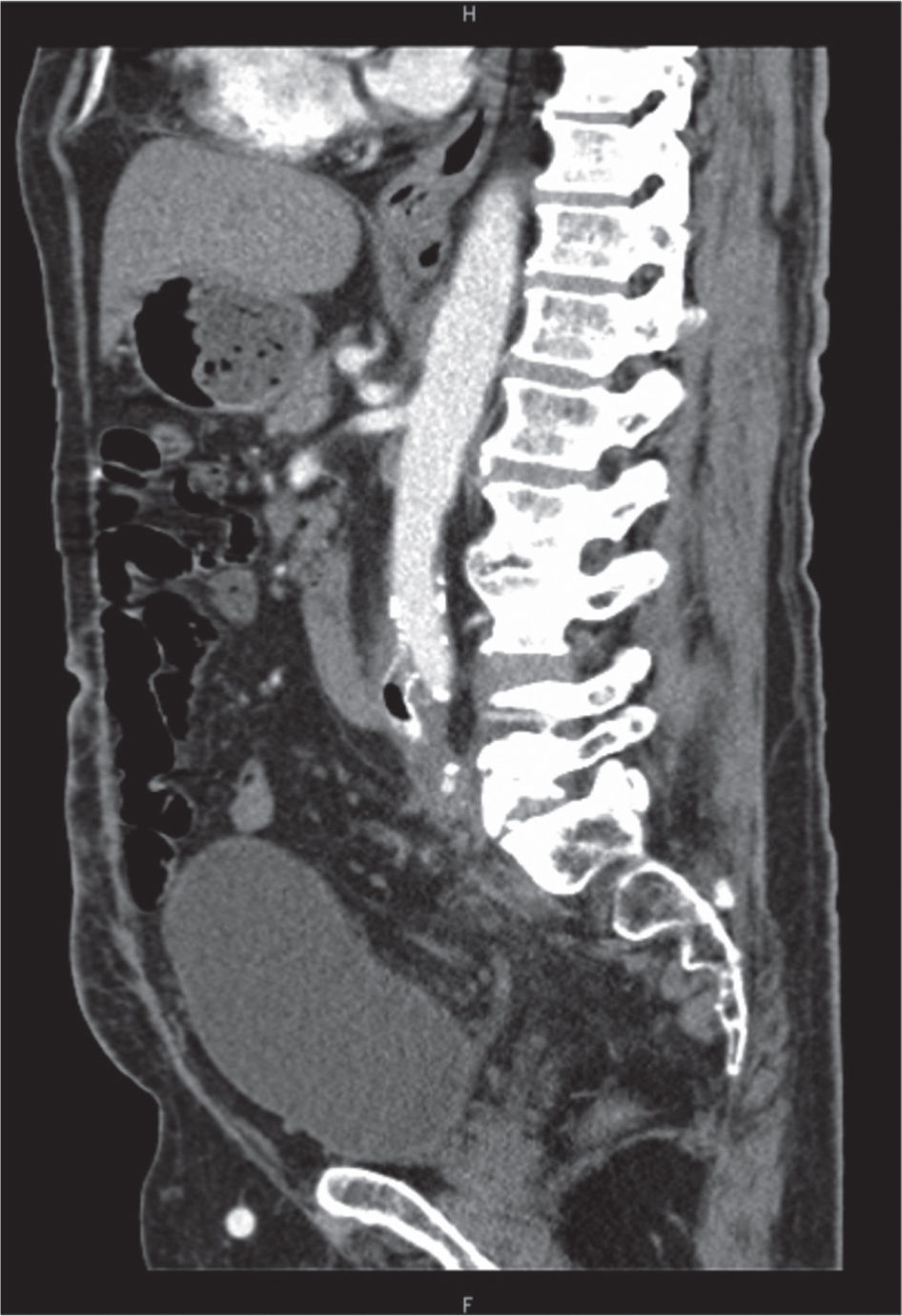
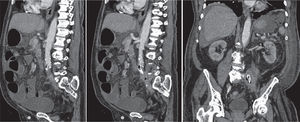
Em 2013, o doente recorreu à urgência por hemorragia através do estoma e hemorragia do cólon excluído manifestada por retorragia. A TC abdominopélvica inicialmente levantou suspeita de fístula protésico-entérica, pela presença de ar intraluminal em local de adjacência com ansa de delgado, sem outras alterações, o que corresponde ao segmento protésico proximal excluído (fig. 1). O doente foi submetido a esofagogastroduodenoscopia, que não revelou alterações, e a colonoscopia que revelou hemorragia do estoma e hemorragia difusa do cólon excluído. Após internamento no Serviço de Gastrenterologia para vigilância, o doente teve alta sem recidiva de hemorragia.
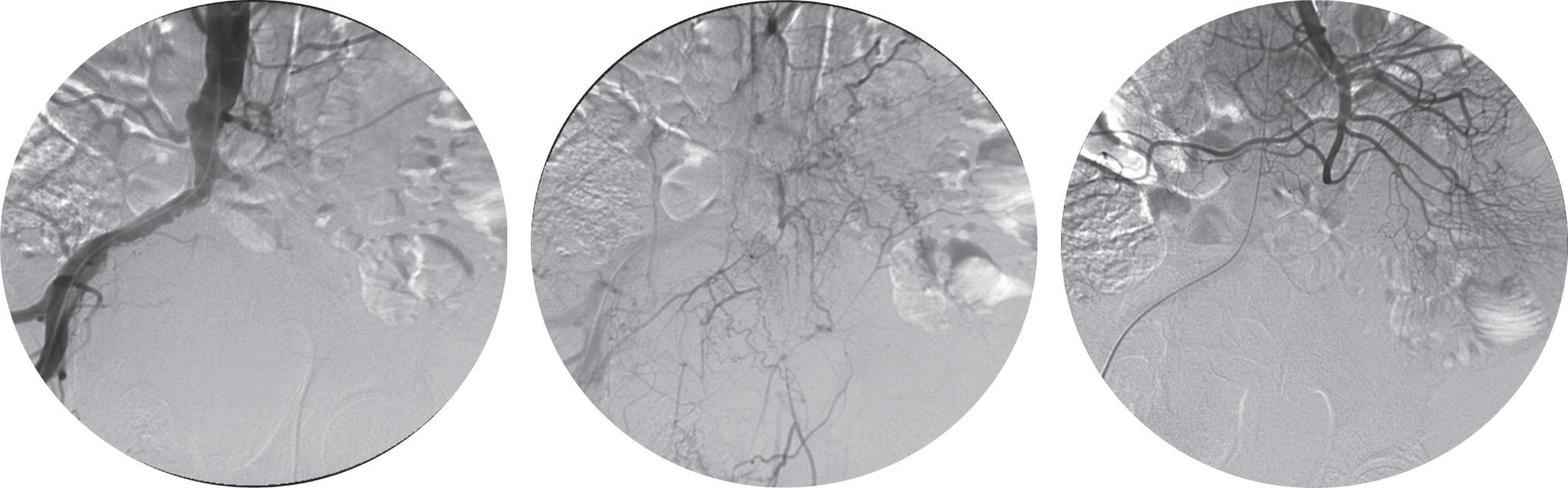
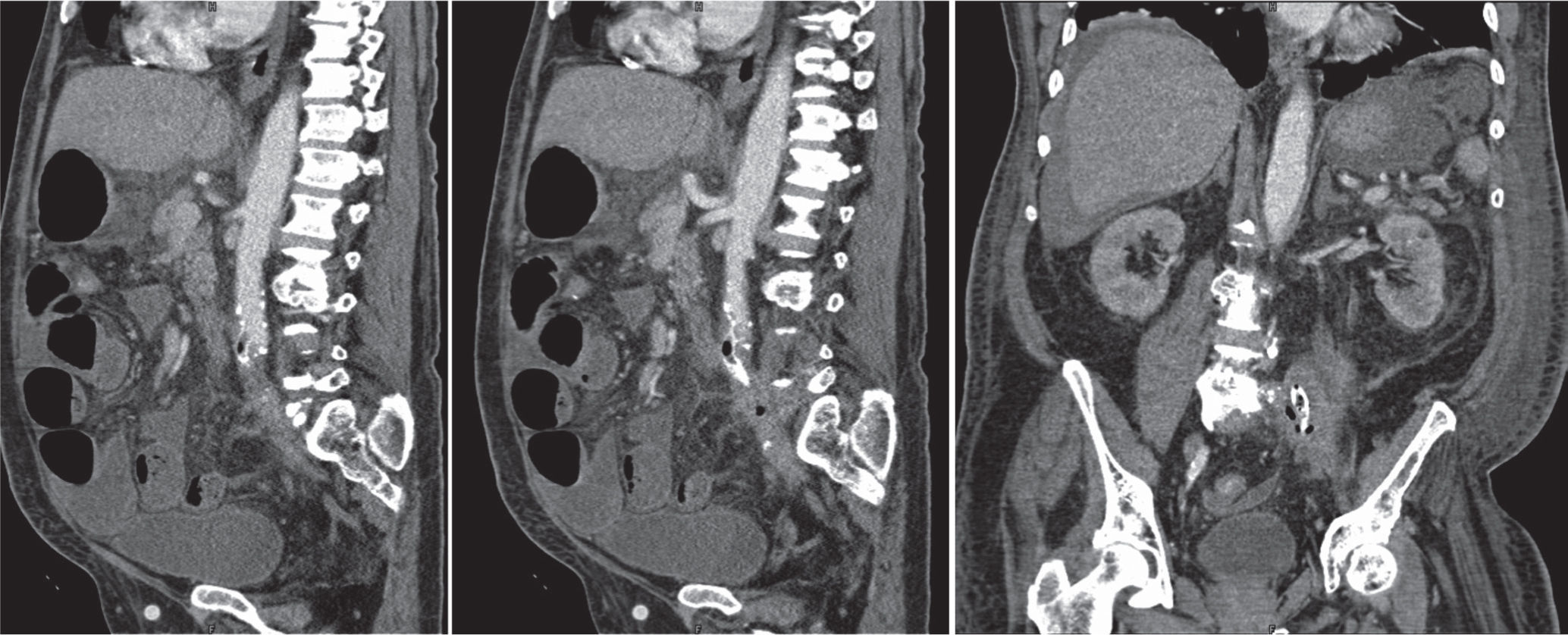
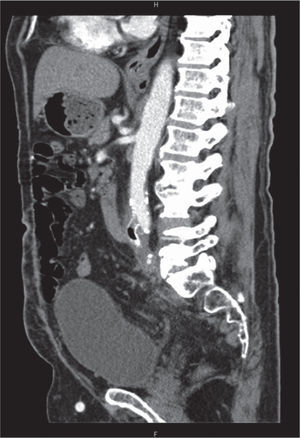
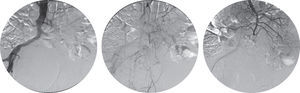
Um mês após a alta, o doente recorreu novamente ao Serviço de Urgência por retorragia maciça. A TC abdominopélvica, a esofagogastroduodenoscopia e a colonoscopia foram sobreponíveis às anteriores e o doente foi submetido a arteriografia aorto-visceral, ilíaca e seletiva da artéria mesentérica superior, sem evidência de fístula aorto-entérica (fig. 2). O doente apresentou hemorragia persistente, com necessidade de laparotomia exploradora e ressecção do cólon descendente e sigmóide previamente excluídos. A cirurgia decorreu sem intercorrências e o doente manteve-se estável até às duas semanas após a cirurgia, quando apresentou hematemese abundante. A esofagogastroduodenoscopia revelou hemorragia com ponto de partida em erosão duodenal e a TC abdominopélvica revelou densificação do tecido periprotésico, com presença de focos gasosos no interior do mesmo, sem extravasamento de contraste mas com hemoperitoneu (fig. 3).
O doente foi submetido a laparotomia, com confirmação de fístula aorto-duodenal secundária, a partir de deiscência da anastomose aorto-protésica. Tendo em conta os sinais de infeção do tecido periprotésico e a presença intraperitoneal de conteúdo entérico, procedeu-se a resseção do segmento protésico remanescente, laqueação da aorta abdominal infrarrenal, colocação de tubo em T no orifício duodenal e construção de bypass axilo – “cross over” femoro-femoral pré-existente. O pós-operatório decorreu sem intercorrências e o doente encontra-se clinicamente estável, com colostomia funcionante e pulsos periféricos palpáveis.
DiscussãoA fístula aorto-entérica é uma comunicação entre a aorta abdominal e o sistema digestivo, que na maioria dos casos ocorre entre o segmento aórtico infrarrenal e a terceira ou quarta parte do duodeno. Esta entidade pode classificar-se como primária, quando ocorre espontaneamente e associada a patologia da aorta abdominal nativa ou do sistema digestivo, ou secundária, quando ocorre após um procedimento cirúrgico que envolva a aorta abdominal1–5.
A classificação de Vollmar e Kogel divide as fístulas aorto-entéricas em Tipo I e Tipo II. As fístulas tipo I referem-se a comunicações aorto-entéricas diretas, podendo subdividir-se em subtipos IA e IB, consoante a ausência ou presença de um falso aneurisma associado, respetivamente. As fístulas tipo II não são comunicações aorto-entéricas diretas, mas correspondem a comunicação entre o enxerto protésico e o sistema digestivo, portanto denominadas “erosões enxerto-entéricas”1.
As fístulas aorto-entéricas primárias são raras, apresentando uma incidência de 0,04 a 0,07%. A sua etiologia, em 70% dos casos, é o aneurisma da aorta abdominal1–3,7. As outras causas que contribuem para a formação destas fístulas são aortite primária, perfuração de úlcera péptica, neoplasia do sistema digestivo com invasão da aorta, pseudocisto pancreático, linfadenite mesentérica tuberculosa, radiação e, mais raramente, diverticulite, apendicite ou ingestão de corpo estranho1,3,7. O fator mais importante para a formação de uma fístula aorto-entérica primária parece ser a pressão pulsátil contínua exercida por um aneurisma em expansão1.
As fístulas aorto-entéricas secundárias são mais frequentes que as primárias e surgem após cirurgia aórtica prévia, com uma incidência de 0,3 a 4%3–5,7,8. Os fatores etiológicos para o desenvolvimento destas fístulas são a infeção da prótese, a pressão pulsátil contínua do enxerto protésico e a lesão duodenal. Estas fístulas podem ocorrer sob duas formas: a comunicação direta entre o lúmen aórtico e o intestinal, através da anastomose aórtica, cuja causa subjacente é a infeção; ou, menos frequentemente, a erosão enxerto-protésica, que se deve à pressão pulsátil contínua da prótese1–4,8.
A lesão duodenal como fator contribuinte para a formação de fístula aorto-entérica secundária, pode ser causada por lesão duodenal iatrogénica ou presença de isquemia duodenal, aquando da cirurgia aórtica1,3.
Os fatores de risco, quer para a formação da fístula aorto-entérica secundária, quer para a formação da erosão enxerto-entérica, são a cirurgia de emergência, as cirurgias “redo”, a cobertura inadequada do enxerto pelo retroperitoneu e a presença de sépsis aquando do procedimento cirúrgico1. Na presença de infeção protésica, o risco de formação de uma fístula aorto-entérica secundária atinge os 40%1.
A manifestação clínica das fístulas aorto-entéricas, em aproximadamente 70% dos doentes, é a hemorragia gastrointestinal, estando muitas vezes associada a sintomas e sinais de infeção. A hemorragia gastrointestinal maciça é habitualmente precedida de episódios de hemorragia transitórios e auto-limitados, que são causados não pela fístula, mas sim por ulceração ou necrose da mucosa intestinal. Em 25% dos doentes, existe evidência de infeção sem hemorragia gastrointestinal, manifestando-se por febre, mau estar geral e leucocitose ligeira. A sépsis é pouco frequente nas fístulas aorto-entéricas, mas envolve 60% dos doentes com sinus aortoparaprotésico-entérico. Em 27% dos doentes, pode ocorrer embolia séptica dos membros inferiores. Outras manifestações remotas podem ser a osteomielite multicêntrica ou a osteoartropatia hipertrófica1–6,7.
A dor abdominal é rara, envolvendo apenas aproximadamente 11% dos doentes com fístula aorto-entérica secundária, assim como também a trombose do enxerto1.
A investigação diagnóstica vai depender das condições clínicas com que o doente se apresente. Um doente que se encontre hemodinamicamente instável e com hemorragia ativa, tem que ser submetido a cirurgia de emergência. O doente hemodinamicamente estável e sem evidência de hemorragia ativa deve ser submetido a investigação diagnóstica urgente, porque o risco de recidiva de hemorragia é de 40% em 24 horas. Os exames complementares de diagnóstico mais frequentes são a esofagogastroduodenoscopia e a TC abdominopélvica com contraste / angio TC. Os achados sugestivos de fístula aorto-entérica que podem ser encontrados na primeira são a compressão duodenal por uma massa extrínseca, ulcerações do segmento distal do duodeno, hemorragia e, raramente, visualização de material protésico. A TC abdominopélvica com contraste, apesar de apresentar um intervalo muito variado de sensibilidade e especificidade, entre 40 e 94% para a primeira e entre 33 a 100% para a segunda, é considerada o exame imagiológico de primeira linha. Os achados sugestivos de fístula aorto-entérica neste exame são a acumulação de ar ou líquido periaórtico, a presença de falso-aneurisma, a inflamação retroperitoneal, a perda do plano de tecido adiposo entre a aorta e o intestino e o espessamento da parede intestinal. O extravasamento de contraste aórtico para o lúmen entérico ou de contraste entérico para o espaço periprotésico são sinais diretos de fístula aorto-entérica, mas raramente visualizados na TC1–4,6–10. Os diagnósticos diferenciais da fístula aorto-entérica, devido aos achados imagiológicos que apresentam e que podem confundir-se com esta patologia, são a aortite infeciosa, o aneurisma aórtico infetado, a fibrose retroperitoneal e a infeção protésica sem fistulização3,6.
A arteriografia aórtica raramente diagnostica uma fístula aorto-entérica, porque a maioria dos doentes estáveis apresentam um trombo que oclui temporariamente a fístula. Este exame é mais importante para o planeamento cirúrgico, no que respeita à reparação da fístula aorto-entérica1,3.
O tratamento da fístula aorto-entérica é cirúrgico, sendo o mesmo influenciado pela presença ou ausência de hemorragia ativa, tipo de fístula, anatomia do aneurisma ou de doença arterial obstrutiva associados e a extensão da sépsis1.
Os objetivos da cirurgia são salvar a vida do doente, em primeiro lugar, e manter a viabilidade dos membros inferiores, pelo que os princípios do tratamento são o controlo da hemorragia, reparação do trato gastrointestinal, controlo da infeção e manutenção de perfusão adequada para os membros inferiores1.
A terapêutica médica adjuvante deve englobar a antibioterapia de largo espetro, a reposição de fluidos e a nutrição parentérica1,11.
A intervenção cirúrgica a realizar vai depender da apresentação clínica do doente. A hemorragia ativa e a instabilidade hemodinâmica do doente obrigam a uma intervenção cirúrgica emergente, que implica laparotomia exploradora e controlo da aorta abdominal, seguidos de resseção e reconstrução in situ, na ausência de infeção, ou de resseção, desbridamento retroperitoneal, drenagem e bypass extra-anatómico, na presença ou suspeita de infeção. O intestino pode ser reparado por sutura transversa, resseção e anastomose ou reconstrução em Y de Roux1,7,11.
As opções cirúrgicas no tratamento da fístula aorto-entérica secundária são a correção cirúrgica local, a resseção do material protésico e reparação intestinal com ou sem reconstrução in situ ou bypass extra-anatómico. A resseção cirúrgica sem reconstrução poderá ser viável no caso dos doentes que inicialmente tenham sido revascularizados por doença oclusiva, cujo enxerto esteja ocluído e tenham desenvolvido colaterais suficientes para manter a viabilidade dos membros. Nos doentes em que este procedimento isolado não seja viável e necessitem de revascularização dos membros inferiores, apenas numa minoria poder-se-á recorrer à reconstrução in situ, devido ao risco elevado de infeção. O tratamento cirúrgico mais popular na fístula aorto-entérica secundária é a resseção do material protésico aórtico e a construção de um bypass extra-anatómico, o qual pode ser realizado imediatamente após o encerramento da laparotomia abdominal, ou então optar-se por um procedimento faseado, quando as condições do doente o permitam, e proceder à construção do bypass extra-anatómico 1 a 3 dias antes da laparotomia. Na correção cirúrgica das fístulas aorto-entéricas, quer primárias, quer secundárias, deve interpor-se um retalho de epíploon entre a aorta ou o enxerto e o trato gastrointestinal1,4,9,10,12.
O tratamento endovascular relativamente às fístulas aorto-entéricas secundárias ainda é limitado, porque a técnica aplicada contradiz os princípios do tratamento descritos para esta patologia, na medida em que o segmento entérico da fístula não é tratado e pode contaminar a prótese endovascular, com consequente infeção persistente, assim como não se procede ao desbridamento retroperitoneal ou drenagem. Por este motivo, alguns autores defendem que a intervenção endovascular seja reservada para o controlo da hemorragia ativa num doente que necessite de intervenção emergente, mas apenas para estabilização até que reúna as condições clínicas para ser submetido a cirurgia convencional1,11,13.
Nas fístulas aorto-entéricas primárias, o tratamento endovascular não é aconselhado por alguns autores devido ao elevado risco de desenvolvimento de fístula aorto-entérica secundária, pelo contato direto da prótese endovascular com o intestino1. Apesar disso, existem alguns casos publicados de fístulas aorto-entéricas tratadas por via endovascular, em doentes com condições clínicas e anatómicas desfavoráveis à cirurgia abdominal, os quais foram bem sucedidos14,15. Um estudo multicêntrico retrospetivo que tinha como objetivo a comparação dos resultados a curto e a longo prazo entre o tratamento cirúrgico e o tratamento endovascular das fístulas aorto-entéricas, revelou uma taxa de mortalidade e de morbilidade intra-hospitalar significativamente inferior nos doentes tratados por via endovascular. No entanto, este grupo de doentes apresentou uma maior tendência para recidiva de fístula, sépsis e reintervenção cirúrgica. A taxa de sobrevivência a longo prazo (após dois anos de follow-up) foi semelhante nos dois grupos16.
A taxa de mortalidade associada à fístula aorto-entérica não tratada cirurgicamente é de 100%7,10. A fístula aorto-entérica primária, quando o doente é submetido a reconstrução aórtica e reparação intestinal, na ausência de infeção, tem um prognóstico favorável, ao passo que a mortalidade operatória das fístulas aorto-entéricas primárias associadas a aneurismas infetados é superior a 50%7. A mortalidade operatória das fístulas aorto-entéricas secundárias, nas séries publicadas, varia entre 13 e 86%1,9,17.
O nosso doente apresentou vários episódios de hemorragia gastrointestinal, que enquadrados na história prévia de cirurgia de reconstrução aorto-ilíaca, complicada por infeção, falso aneurisma da anastomose distal e fístula entre o cólon descendente, a loca da prótese e a parede abdominal, colocaram em primeiro lugar a hipótese de fístula aorto-entérica secundária. Apesar da panóplia de exames imagiológicos realizados e da evidência de sinais indiretos de fístula aorto-entérica na última TC, o diagnóstico final só foi obtido durante a laparotomia exploradora.
ConclusãoA hemorragia gastrointestinal é uma manifestação com diversas etiologias. No entanto, num doente com antecedentes de cirurgia aórtica, a fístula aorto-entérica secundária tem que ser sempre considerada, porque o diagnóstico precoce desta patologia é imperativo para a sobrevivência do doente.
Apresentado sob a forma de poster no XIII Congresso da Sociedade Portuguesa de Angiologia e Cirurgia Vascular – Coimbra – 13 a 15 de Junho de 2013.