Introducción
El tromboembolismo pulmonar (TEP) es la tercera causa más común de enfermedad cardiovascular, después del infarto al miocardio y de los eventos vasculares cerebrales.1 En las últimas décadas, la incidencia del TEP ha disminuido en 45%, mientras que la de la trombosis venosa profunda (TVP) no se ha modificado.2 Se ha señalado una mortalidad de 3.5% a 15%, de los cuales, 65% de los casos ocurre en la primera hora y 92.9% en las primeras 2.5 horas.3 El registro alemán Management Strategy and Prognosis of Pulmonary Embolismregis Try (MAPPET), demostró una alta mortalidad hospitalaria (31%) en pacientes con inestabilidad clínica,4 y de acuerdo al estudio Registro Internacional de Tromboembolismo Pulmonar (ICOPER, por sus siglas en inglés), la mortalidad a 90 días reportada en nuestro país fue del 23%.5
Aún en nuestros días, la tromboembolia pulmonar es considerada un reto diagnóstico, entidad con una presentación clínica inespecífica y variada y se estima que alrededor del 70% o más de los pacientes no son diagnosticados en primera instancia.6 Además, de acuerdo a datos del estudio Prospective Investigation of Pulmonary Embolism Detection (PIOPED), sólo en un tercio de los 755 pacientes en quienes se practicó angiografía pulmonar, el diagnóstico de TEP fue confirmado.7
Por este motivo, es de vital importancia el apoyo de herramientas diagnósticas no invasivas para identificar de forma rápida y precisa a aquellos pacientes con TEP y de ser posible el reconocer aquellos pacientes considerados de alto riesgo, quienes deben de ser llevados a terapias semi-invasivas (trombólisis sistémica) o invasivas (trombectomía, trombólisis intra arterial o fragmentación con aspiración, entre otras).
Los objetivos del presente trabajo son: 1) revisar brevemente las ventajas y desventajas de los métodos de evaluación paraclínica, 2) mostrar la evidencia disponible al momento sobre la utilidad de la tomografía computarizada multidetector (TCMD) en la evaluación de pacientes con sospecha de TEP y las recomendaciones actuales de las diferentes sociedades médicas en relación al uso de la TCMD en el diagnóstico de tromboembolismo venoso, 3) enumerar los hallazgos tomográficos y potenciales artificios durante la interpretación del estudio, y 4) describir el papel de la TCMD como herramienta pronóstica.
Métodos paraclínicos del diagnóstico
La evaluación del paciente con sospecha de TEP debe ser rápida y eficaz. En primer lugar, se debe de estratificar el riesgo del paciente con base a sus antecedentes, datos hemodinámicos y paraclínicos básicos (por ejemplo radiografía simple del tórax). Para esto, existen varias escalas como la de Ginebra, Ginebra revisada o la Canadiense (Wells), en donde los pacientes son clasificados como de riesgo bajo (prevalencia < 10%), intermedio (prevalencia aproximada de 30%) o alto (prevalencia mayor a 70%).7 La estratificación del paciente en categorías de riesgo de TEP es fundamental para una adecuada decisión diagnóstica e interpretación de los estudios diagnósticos.
La radiografía de tórax es usualmente el primer estudio de imagen solicitado.8 Aunque cuenta con un valor diagnóstico limitado es incuestionable su utilidad en la actualidad ya que facilita la toma de decisiones sobre la prueba diagnóstica a seguir: TCMD vs. gammagrafía pulmonar. En el caso de que cualquier anormalidad sea observada en la radiografía (por ejemplo atelectasia, derrame pleural, etcétera), la prueba diagnóstica que debe entonces solicitarse es una angio TCMD, mientras que en el escenario de una radiografía completamente normal, la gammagrafía V/Q es el método de elección. De hecho, el utilizar a la radiografía de tórax dentro del algoritmo de decisión diagnóstica, ha permitido reducir de manera significativa el número de estudios no diagnósticos por gammagrafía.9
En relación a los métodos de imagen convencionales, la angiografía pulmonar invasiva empleada desde finales de la década de los sesentas, ha sido considerada como la prueba más exacta (prueba de referencia) en la evaluación del embolismo pulmonar. Sin embargo, en la actualidad la angiografía pulmonar es un método invasivo, infrautilizado, poco disponible, costoso y que posee un riesgo pequeño, pero bien definido.13-15 Sólo en 12% a 14% de los pacientes con una prueba de V/Q indeterminada, subsecuentemente se realiza una angiografía pulmonar. Muchos pacientes con sospecha de TEP son tratados con anticoagulantes sólo con base en la sospecha clínica y a los resultados paraclínicos inespecíficos. Su uso exclusivamente diagnóstico se limita a facilidades médicas que no cuentan con TCMD, o cuando los hallazgos clínicos son discordantes con los resultados TCMD.1 Los avances recientes en la tecnología de la TC han demostrado que la angiografía invasiva es una prueba de referencia imperfecta, menos exacta de lo que previamente se pensaba, tanto a nivel de los vasos pulmonares centrales como a nivel subsegmentario en donde además existe una variabilidad interobservador del 34%.16,17 En el estudio PIOPED II, la angiografía pulmonar invasiva tuvo mayor cantidad de falsos negativos que la TCMD.18 Por este motivo, recientemente se ha cuestionado si la prueba de referencia en la búsqueda de TEP debería seguir siendo la angiografía invasiva.
El ecocardiograma es un método principalmente útil en el estudio de pacientes inestables con el fin demostrar datos de morfológicos (dilatación) y disfunción del ventrículo derecho (VD) (trastornos de la movilidad y datos de hipertensión arterial pulmonar). Eventualmente permite identificar defectos de llenado en vasos pulmonares proximales y distinguir eventos agudos (signo de McConell, dilatación del VD), y crónicos (hipertrofia del VD pared de 5 mm a 6 mm).19
Sin embargo, las estrategias de diagnóstico por imagen para embolismo pulmonar han evolucionado en las últimas décadas con el desarrollo de nuevas técnicas que van desde la angiografía pulmonar convencional, la centellografía o gammagrafía ventilatoria/perfusoria, hasta llegar a la TCMD y finalmente a la angiografía por Resonancia Magnética (RM).20 Asimismo, la evaluación paraclínica de este grupo de pacientes también se ha modificado en fechas recientes. La elevación del dímero-D mediante prueba de ELISA cuantitativa, considerada como un indicador indirecto de actividad trombótica, es una herramienta indispensable en este grupo de pacientes y que se ha integrado a los árboles de decisión diagnóstica por imagen. De acuerdo con las recomendaciones de la sociedad Fleischner20 y del grupo de investigadores del estudio PIOPED II,21 la evaluación inicial de todo paciente con sospecha de TEP y riesgo bajo o intermedio debe de basarse en el dímero-D, prueba con una elevada sensibilidad y valor predictivo negativo (97% y 94% respectivamente).22 Esto significa que un estudio negativo excluye prácticamente toda posibilidad de TEP, con una incidencia a los tres meses de embolismo pulmonar menor a 0.5%,21
Por otra lado, aquellos pacientes con un dímero-D positivo y radiografía de tórax anormal, deben de evaluarse por angiografía pulmonar por Tomografía Computarizada Multidetector (TCMD); si el dímero-D es positivo pero la radiografía de tórax es normal, la gammagrafía pulmonar debe ser la prueba inicial. Finalmente, en el escenario de sospecha alta de TEP el dímero-D no es de utilidad. En este grupo de pacientes la siguiente prueba diagnóstica recomendada es directamente una angiografía pulmonar por TCMD.
La gammagrafía de ventilación-perfusión (V/Q) había sido, hasta fechas recientes, la técnica de imagen no invasiva de elección durante décadas. Es un método no invasivo, de baja radiación y bajo costo, con una alta sensibilidad, aunque poco específica. Un estudio V/Q negativo, es decir sin defectos de perfusión, excluye prácticamente toda posibilidad de embolia pulmonar con un valor predictivo negativo (VPN) cercano a 100%, mientras que una gammagrafía de alta probabilidad es altamente específica para el diagnóstico de la EP;23 sin embargo, ambos extremos del espectro diagnóstico representan de acuerdo a los datos referidos en el estudio PIOPED II sólo 13% de los pacientes, mientras que 73% de los pacientes son reportados como con un riesgo intermedio o como estudios no diagnósticos.24 En el grupo de pacientes con embolismo pulmonar demostrado, sólo 41% de los pacientes tuvieron una prueba de alta probabilidad; mientras que 57% restante tuvieron un estudio de probabilidad intermedia o baja.23 Asimismo, cuando se considera a la totalidad de los pacientes, es decir incluyendo desde aquellos pacientes con probabilidad muy baja hasta los de probabilidad alta, la especificidad global del método es tan sólo de 20%.23 Además, su baja disponibilidad en los departamentos de urgencias, el alto número de estudios no diagnóstico o indeterminados, su incapacidad de generar diagnósticos alternos o diferenciales, baja resolución espacial y su baja especificidad han llevado a la búsqueda de otros métodos.25 Finalmente, la evidencia de TEP es indirecta, es decir, el tromboembolismo no se visualiza directamente, en su lugar se observa su defecto perfusorio. Estos problemas ocasionan que el diagnóstico se establezca en base a criterios de probabilidad. Por lo tanto, el principal problema ocurre en el numeroso grupo de pacientes con pruebas de probabilidad intermedia. Por este motivo, en la actualidad, las principales indicaciones de la gammagrafía de V/Q son aquellos pacientes con radiografía de tórax normal y sospecha intermedia de EP y en aquellas personas en quienes está contraindicada la TCMD (por ejemplo: insuficiencia renal definida como una creatinina sérica > 1.5 mg/dL, historia de alergia al yodo o al medio de contraste).26
Con el advenimiento de nuevas técnicas de adquisición y secuencias ultra-rápidas (imagen paralela, echo sharing con gadolinio, y gradientes en estado estable) por RM, es posible estudiar aquellos pacientes con sospecha de TEP. La población potencialmente beneficiada sería aquella con alguna contraindicación potencial al estudio angiotomográfico (embarazo, alergia al contraste yodado, etcétera), la cual llega a representar hasta 24% de los casos.27 Sus principales ventajas incluyen el ser un método que no emplea radiación ionizante, su capacidad multiplanar y la evaluación precisa de la función ventricular. Sin embargo tiene varias desventajas, entre ellas el requerir una alta selección de pacientes, una baja disponibilidad en las áreas de urgencias, el alto número de estudios no diagnósticos en niveles segmentarios/subsegmentarios, los elevados tiempos de adquisición que condicionan numerosos artificios de movimiento, y la reciente contraindicación del gadolinio en pacientes con falla renal por el riesgo incrementado de desarrollo de fibrosis nefrogénica sistémica.27,28 De acuerdo con los resultados previos al estudio PIOPED III basados en pequeñas series y meta-análisis, la angio RM era considerada una prueba con adecuada sensibilidad (77% a 100%) y especificidad (95% a 98% para los vasos principales), aunque con menor especificidad para vasos segmentarios (80%) y subsegmentarios (40%).29,30 Sin embargo, el principal problema de la angio RM durante el estudio de pacientes con sospecha de TEP es la gran cantidad de estudios indeterminados o no diagnósticos (11% a 52%, con un promedio de 25%) como fue recientemente publicado en el estudio PIOPED III.31
En este estudio prospectivo multicéntrico que incluyó 371 pacientes de siete centros y cuyos resultados fueron comparados contra la TCMD y/o gammagrama V/Q, la RM tuvo una sensibilidad de 78% y una especificidad de 99% cuando sólo fueron incluidos los estudios considerados adecuados para el diagnóstico de TEP. Sin embargo, su desempeño cuando el análisis consideró a todos los pacientes (incluyendo aquellos con pruebas inadecuadas) bajó considerablemente, con una sensibilidad de tan sólo 57%.31
Angiotomografía computarizada de arterias pulmonares
Utilidad: ¿por qué tomografía computarizada?
La TC, inventada por Godfrey Hounsfield en 1972, ha tenido una evolución insospechada y un empleo prácticamente ilimitado.32 Mientras los sistemas de primera generación adquirían una imagen en aproximadamente 300 segundos, en la actualidad los equipos multidetector de tercera y cuarta generación realizan la adquisición de hasta 320 imágenes en un tercio de segundo, es decir son de 900 a 1000 veces más rápidos que sus antecesores de primera generación.32,33 Godwin y colaboradores, en 1980, fueron los primeros en describir imágenes de TEP por TC.34 Actualmente, esta técnica no invasiva se ha convertido en la prueba de elección de múltiples instituciones en la evaluación inicial de pacientes con sospecha de TEP.
La angiotomografía computarizada helicoidal de 1D surgió como una técnica novedosa a principios de la década de los noventas. La principal ventaja que ofrecía, era la visualización directa del trombo/émbolo alojado en la(s) arteria(s) pulmonar(es). Con esta tecnología era posible identificar con cortes de 5 mm de grosor y posteriormente de 3 mm,35 defectos de llenado en las arterias centrales y segmentarias. Sin embargo, este grosor de corte limitaba la detección de trombos en vasos de menor calibre debido a la aparición de defectos de volumen parcial. La sensibilidad oscilaba entre 53% y 93%, con una especificidad del 81% a 97% al compararla con la angiografía convencional.20,21 No permitía la evaluación de los vasos subsegmentarios,36,37 por lo que de acuerdo a los reportes iniciales no era considerada como el método de imagen inicial. A finales de los años noventa, fueron desarrollados equipos más rápidos (tiempo de rotación del gantry de 0.75 segundos) que a su vez permitían cortes de 2 mm de grosor. Se sugirió por primera vez que la TC pudiera reemplazar a las pruebas de V/Q como el método de imagen inicial en caso de sospecha de TEP.38-41 La sensibilidad y especificidad en la evaluación de defectos de llenado centrales y segmentarios mejoraron siendo similares a los reportados en las pruebas de V/Q.42,43 Sin embargo, dado que la visualización de las regiones subsegmentarias continuaba limitada con equipos helicoidales de un detector, hoy día este método no es considerado como prueba de referencia.
La introducción de la TCMD ha revolucionado la práctica radiológica. Los nuevos sistemas adquieren imágenes tridimensionales del cuerpo entero en segundos, incluso de estructuras y procesos dinámicos como el sistema cardiovascular de forma exitosa.26,44 En comparación con los tomógrafos helicoidales de 1D, el incremento en el número de detectores aumenta de manera significativa el número de estudios sin artificios por movimiento respiratorio (36.5% vs. 63%).45 Las ventajas que ofrece la TCMD son las siguientes: es un método no invasivo, rápido (tiempo en sala de aproximadamente cinco minutos y para tecnología de ≥ 64D un tiempo de adquisición de uno a cinco segundos), con capacidad multiplanar, en donde las imágenes son generadas sin la interferencia o sobreposición de estructuras adyacentes y con gran detalle anatómico. La TCMD cuenta con una resolución espacial submilimétrica (hasta 0.5 mm) determinada por el grosor de los detectores, que permite evaluar de manera precisa y reproducible los vasos pulmonares hasta niveles subsegmentarios (vasos de 5º y 6º orden, con un diámetro vascular mínimo de 1.5 mm).46Además, los voxeles son prácticamente isotrópicos, lo cual permite una evaluación multiplanar sin distorsión de las imágenes. La resolución temporal, principalmente determinada por el tiempo de rotación del gantry y los algoritmos de reconstrucción, también ha mejorado. El tiempo de rotación ha disminuido de 750 mseg en los tomógrafos de 1D hasta los 280 a 400 mseg en los de 64 a 320 detectores disponibles hoy día.26,32,44 En resumen, la mayor velocidad de giro del tubo de rayos-X, el menor tamaño de los detectores y el incremento en su número, permiten una sustancial mejoría de la resolución temporal, resolución espacial y reducción de los tiempos de adquisición respectivamente.
Al comparar a la TCMD con la TC helicoidal de 1D, la TC multicorte ha demostrado mayor calidad de los estudios principalmente en aquellos pacientes con neumopatía de base, así como mejor evaluación de las arterias pulmonares distales (arterias segmentarias y subsegmentarias).46,47 El empleo de cortes finos (1 mm) incrementa en más de 40% la detección de émbolos de localización subsegmentaria, disminuye hasta en 70% el número de estudios clasificados como indeterminados, e incrementa la concordancia interobservador.46,48 El método de interpretación también ha evolucionado de manera sustancial. La interpretación en placas ha sido sustituida por la lectura en estaciones de trabajo y diagnóstico, las cuales mejoran la sensibilidad en el diagnóstico de TEP hasta en 25%.49
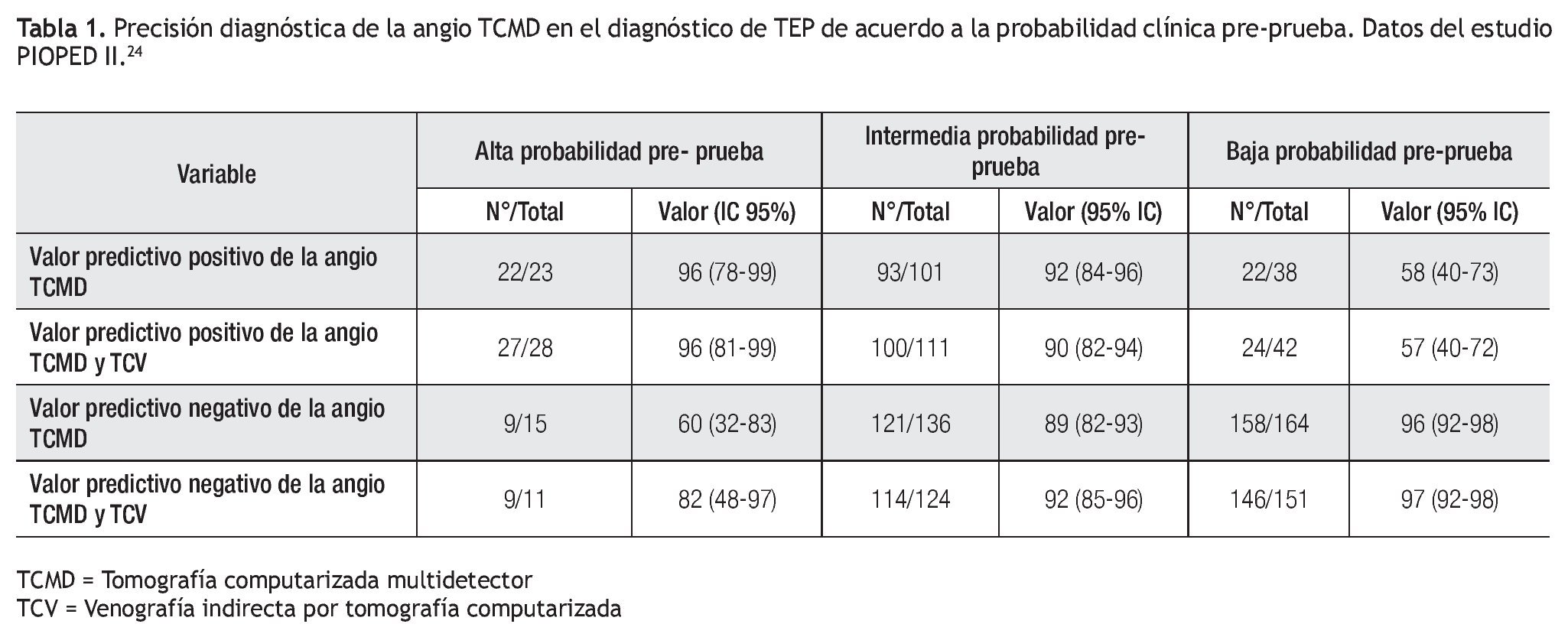
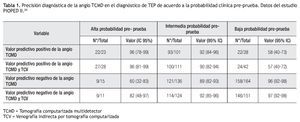
Estudios recientes han demostrado que la TCMD es una prueba con alta sensibilidad y especificidad en la detección de émbolos pulmonares hasta niveles subsegmentarios.17,50 De acuerdo al PIOPED II, que comparó a la TCMD contra un estándar de oro compuesto por la gammagrafía de V/Q, el ultrasonido Doppler de las extremidades inferiores y la angiografía pulmonar, la sensibilidad, especificidad y valores predictivos de la angio TCMD de las arterias pulmonares en el diagnóstico de TEP, dependen de la probabilidad preprueba del estudio (Tabla 1).24 En general, el valor predictivo positivo (VPP) se incrementa a la par de la probabilidad clínica pre-prueba (96% con probabilidad alta, y 58% en caso de baja probabilidad), mientras que el valor predictivo negativo (VPN) aumenta en pacientes con baja sospecha clínica de TEP (96% con baja probabilidad y 60% con alta probabilidad). En este mismo trabajo, los valores predictivos mejoraron cuando la evaluación arterial pulmonar por tomografía se combinó con el protocolo de venografía indirecta por TC (Tabla 1).24
Finalmente, en la actualidad las imágenes se pueden adquirir con sincronización cardiaca (acoplamiento ECG) mediante la colocación de electrodos a nivel de la caja torácica del paciente y la obtención del trazo ECG en la consola del tomógrafo. En estos protocolos con reconstrucción retrospectiva se emite radiación durante la totalidad del ciclo cardiaco, lo cual permite la reconstrucción de imágenes en cualquier punto del ciclo y por ende el cálculo de la función cardiaca tanto derecha como izquierda.51-52
¿Qué tan exacta y segura es la angio TC?
La TC ha sido validada clínicamente en numerosos estudios enfocados a conocer el desenlace de aquellos pacientes con sospecha de TEP con TC negativa y quienes no recibieron tratamiento anticoagulante.16,53-56 La incidencia de tromboembolismo venoso (TEV) a tres meses en pacientes con una TC negativa es de 1.5% (IC 1.1%-1.8%) y la mortalidad atribuida a TEP es de 0.51% (IC 0.33-0.87%).55
Estos valores son similares a los reportados para la angiografía pulmonar: 1.7% (IC1.7-2.7%) para eventos de TEV y de 0.3% (IC 0.02-0.7%) para mortalidad atribuida a TEP.6,16 De acuerdo a un meta-análisis con 3500 pacientes, que incluyó 15 estudios (12 con TC helicoidal de 1D, 2 con TCMD y 1 con TC por emisión de haz de electrones), el VPN de la TC para eventos de TEV con un seguimiento mínimo de tres meses fue de 99.1% y de 99.4% en el caso de mortalidad,57 en comparación con el bajo VPN de la scintigrafía V/Q (75.9-88%).16,39 La baja incidencia de TEV durante el periodo de seguimiento en todos estos estudios demuestra que incluso con la presencia de émbolos periféricos no detectados por la TC, los desenlaces de morbimortalidad no se modifican de manera adversa. Con base a estos resultados, posiblemente sería seguro el no administrar terapia anticoagulante en pacientes con una TC negativa y con probabilidad baja o intermedia de TEP.
El meta-análisis de Moores y colaboradores, enfocado a conocer los desenlaces (TEP o mortalidad asociada a TEP) posteriores a una angio-TC pulmonar negativa, demostró que para descartar de manera precisa la posibilidad de eventos tromboembólicos en pacientes con una TC negativa, eran necesarios métodos de imagen de las extremidades inferiores sin evidencia de TVP o que el paciente tuviese una probabilidad baja a intermedia de TEP.55 Además, de acuerdo al PIOPED II, los valores predictivos de la angio-TC pulmonar aislada y de su combinación con venografía por TC son elevados cuando existe concordancia con la probabilidad clínica de la enfermedad. De acuerdo a este estudio, los métodos de imagen adicionales (por ej. angiografía pulmonar invasiva) únicamente serían necesarios cuando la probabilidad clínica es inconsistente con los hallazgos tomográficos;24 es decir, en el caso de poblaciones de alto riesgo es posible que sean necesarias pruebas adicionales en caso de una TC negativa.
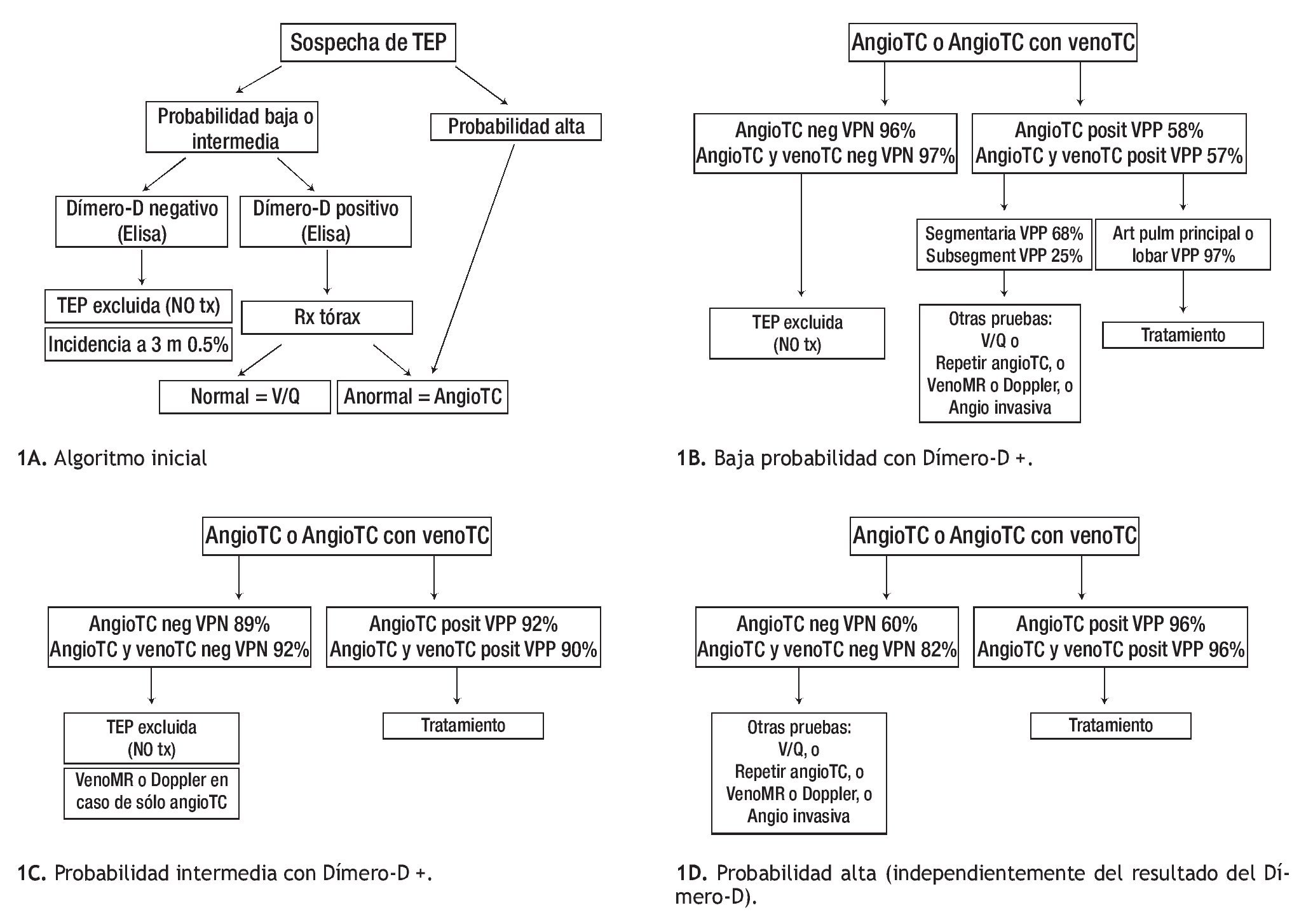
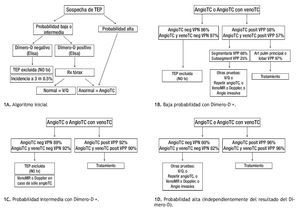
A diferencia de las pruebas de V/Q donde de acuerdo a datos del estudio PIOPED II el porcentaje de resultados no diagnósticos, indeterminados o de probabilidad intermedia representan cerca de dos terceras partes de los estudio, los estudios considerados como indeterminados en la TCMD sólo representan entre 1% a 6.6% de los casos y de 9.1% en el caso de TC helicoidal de 1D.56,58,59 Además, la concordancia interobservador es mayor en la TC que con la scintigrafía V/Q (k 0.72 vs. 0.22, respectivamente).39 La gran mayoría de los autores y de acuerdo a las recomendaciones de la sociedad Fleischner, basadas en los resultados del PIOPED II, estos datos son justificación suficiente para que la angio-TC pulmonar reemplace a la medicina nuclear en el algoritmo diagnóstico de pacientes con sospecha de TEP (Figuras 1A a 1D).28,60
Figura 1. Algoritmos para el abordaje integral de la TEP.
En la práctica clínica diaria se recomienda que en caso de que el diagnóstico de TEP no se pueda confirmar ni descartar de forma confiable, el estudio sea reportado como indeterminado. En estos casos, el radiólogo debe de mencionar hasta que nivel anatómico el estudio no permite evaluar adecuadamente la presencia o ausencia de defectos de llenado ya que esto repercute en el tratamiento. Por ejemplo, si el radiólogo visualiza claramente los vasos segmentarios, no así los vasos subsegmentarios (indeterminados), es probable que el clínico no requiera estudios por imagen adicionales en el grupo de pacientes con baja probabilidad pre-prueba. Sin embargo, como ya fue mencionado previamente, existe un grupo de pacientes en quienes una TC indeterminada deberá de ser seguida de estudios complementarios.
La principal desventaja es el empleo de radiación ionizante. No obstante, estudios en fantomas demuestran que la exposición en TC helicoidal de 1D es hasta cuatro veces menor que para la angiografía convencional.61,62 La exposición en TCMD es aproximadamente 50% menor que con la angiografía pulmonar (4.2 mSv vs. 7.1 mSv).63 Las técnicas de modulación de dosis reducen 15% a 20% más la exposición.64 En pacientes jóvenes, delgados o con embarazo, se pueden obtener estudios con bajo kilovoltaje (hasta 80 kVp) para disminuir la exposición sin afectar la calidad diagnóstica.65
Venografía indirecta por TC
La TVP proximal se asocia a TEP aguda y crónica, con el subsecuente riesgo de hipertensión pulmonar. De 26% a 32% de los pacientes con EP, tiene TVP sintomática.9
Hasta mediados de la década de los ochentas, la venografía convencional era utilizada de manera rutinaria para su diagnóstico.66 En la actualidad, la ultrasonografía (US) Doppler con maniobra de compresión ha sustituido a la venografía invasiva. El US con compresión es un método no invasivo, de gran disponibilidad y económico, por lo que se ha convertido en la técnica de evaluación de elección.67 La sensibilidad y especificidad en el diagnóstico de TVP en venas proximales a la vena poplítea es de 92% a 100% y del 80% a 100%, respectivamente.68 La sensibilidad disminuye considerablemente cuando se trata de las venas distales a la poplítea (11% a 92%).69 Sin embargo, el US con compresión es un método operador dependiente con limitaciones en la evaluación de las venas abdominales y pélvicas, pacientes obesos, y en aquellos pacientes con anatomía venosa compleja. La venografía por RM muestra una excelente sensibilidad y especificidad, sin embargo su alto costo y disponibilidad limitan su uso, por lo que únicamente se reserva para aquellos casos con alergia al MC o en casos técnicamente difíciles de evaluar mediante US.70
La venografía indirecta por TC, es decir la fase venográfica del sistema profundo de las extremidades después de una angiotomografía, descrita por primera vez en 1998, es un método adyuvante a la angio-TC pulmonar que no requiere de mayor administración de contraste intravenoso y por ende no altera el protocolo de angiotomografía de las arterias pulmonares.71 Este estudio tiene una sensibilidad y especificidad similares al US Doppler de los miembros inferiores.24,72-75 La sensibilidad oscila de 71% a 100%, mientras que la especificidad es de 94% a 100%, con valores promedio de 94.5% y 98.2%, respectivamente y con una adecuada concordancia interobservador (k 0.59-0.88).73 En el estudio de Cham y colaboradores, quienes compararon a la venografía por TC contra el US con compresión, la TC correctamente identificó todos los casos de trombosis sin ningún falso negativo.74 En pacientes con sospecha de embolismo, la angiografía y la fase venográfica por TC tienen mayor sensibilidad cuando se evalúan de forma conjunta que cuando se realizan de forma independiente.24
Cuando los hallazgos en la angiografía pulmonar por TC son equívocos o subóptimos (3% a 8% de los estudios), los resultados de la venografía indirecta, sean positivos o negativos, facilitan la toma de decisiones sobre si tratar o no tratar al paciente. Finalmente, numerosos estudios demuestran el beneficio adicional de diagnóstico de la TC flebografía, que van desde 0.2% a 30%.24 De acuerdo con el PIOPED II, la combinación de ambos brinda una sensibilidad de 90% con especificidad de 95%.24
Cabe mencionar, que uno de los inconvenientes principales de la venografía indirecta es la dosis de radiación adicional de 3.2 y 9.1 mSv, sin embargo diversos protocolos han logrado disminuir la radiación a 0.6 a 2.3-mSv.71,72
Hallazgos por TC
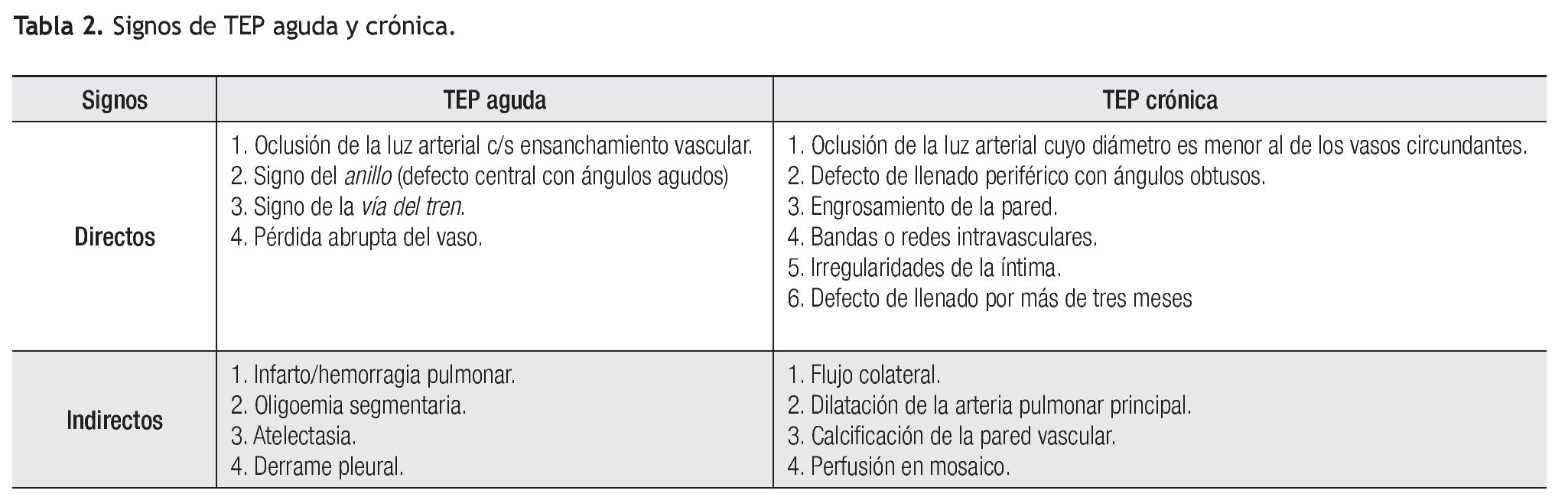
Los hallazgos tomográficos de TEP se agrupan en signos directos e indirectos de TEP aguda y crónica (Tabla 2).74,76-80 El diagnóstico requiere la presencia de signos directos, ya que los indirectos son inespecíficos y existen otros diagnósticos diferenciales. Asimismo, el EP es clasificado de acuerdo al vaso afectado: central (arteria principal, ramas derecha e izquierda, arteria interobar o lobar) y periférico (vasos segmentarios y subsegmentarios).
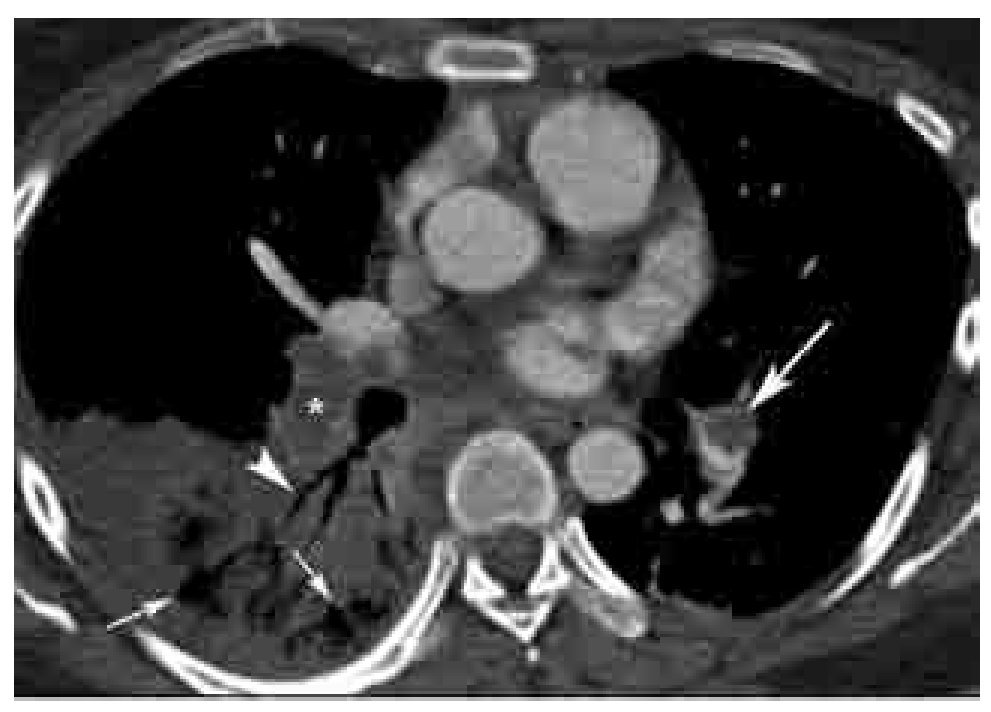
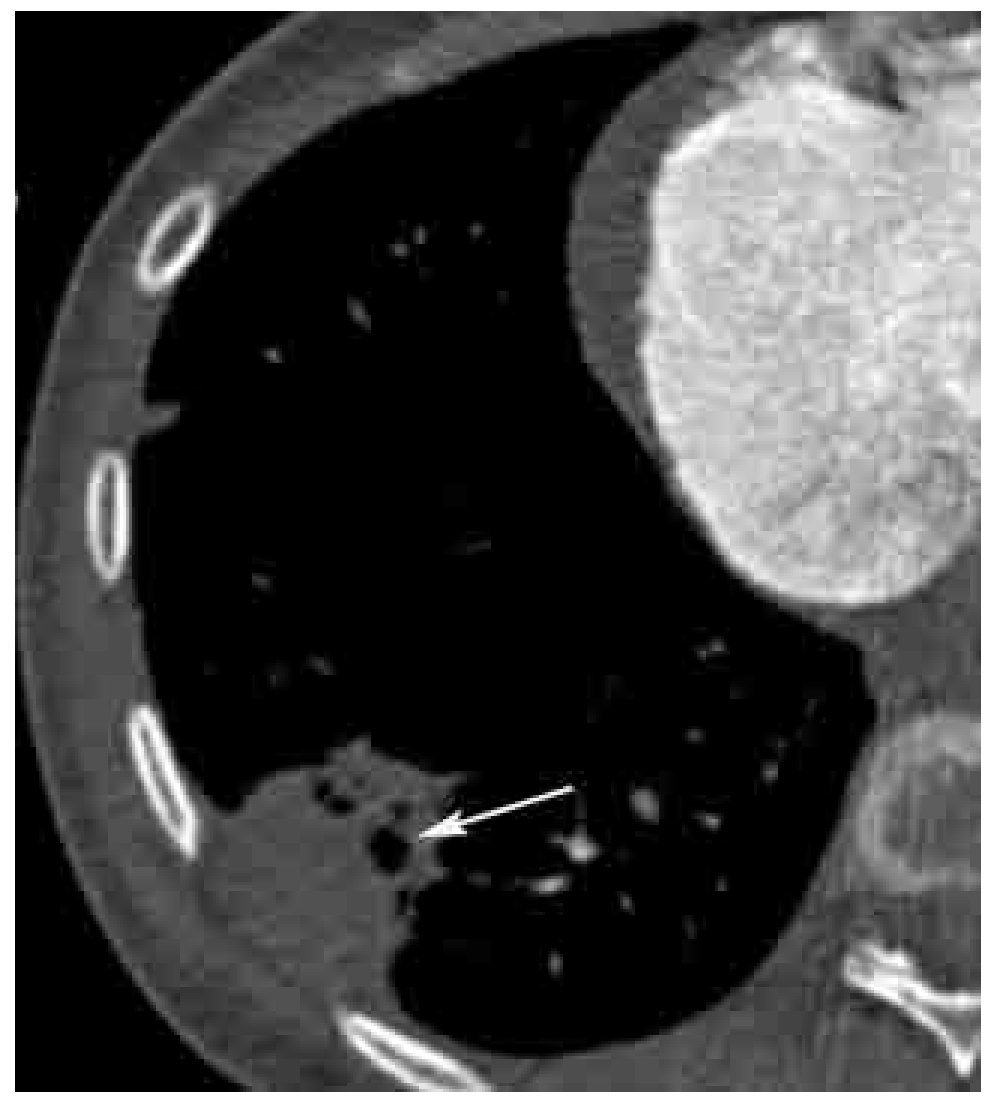
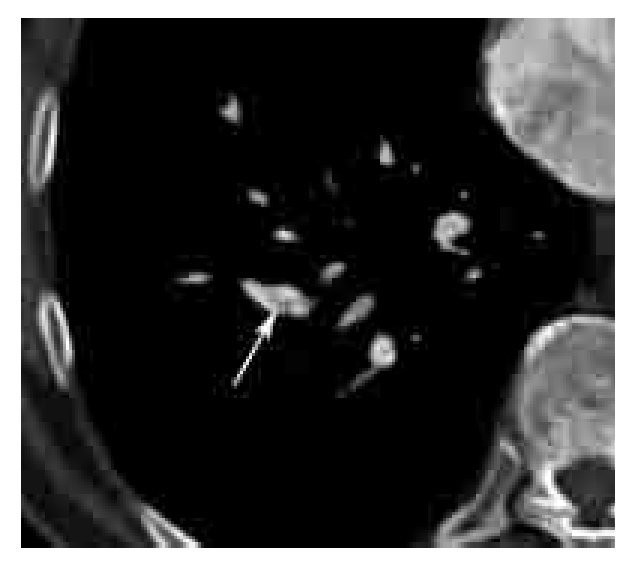
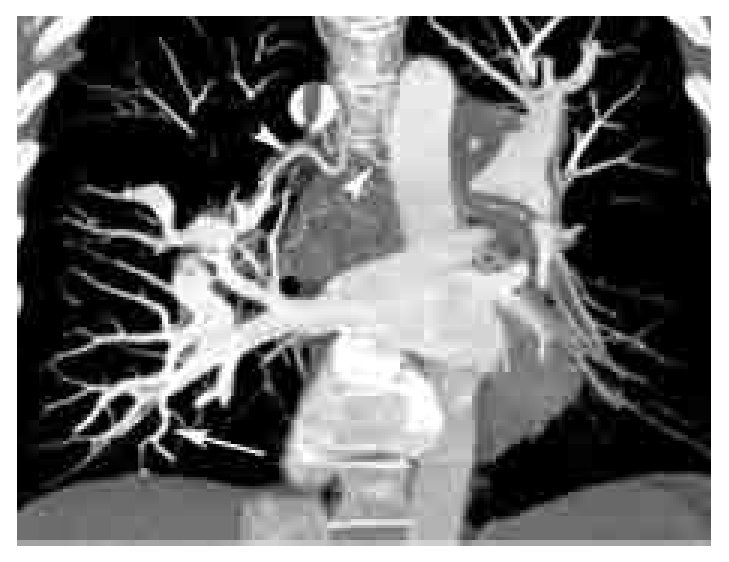
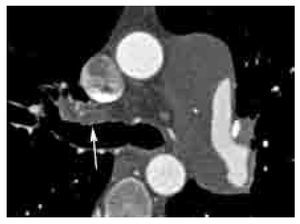
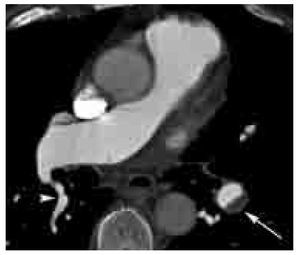
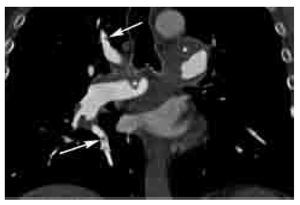
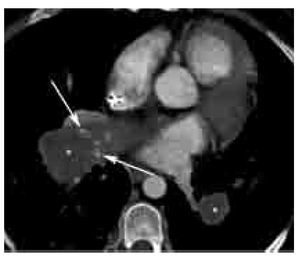
Los signos directos de TEP aguda incluyen: 1). Defecto de llenado que ocluye completa o parcialmente la luz arterial con o sin ensanchamiento de la misma (Figura 2). En caso de una oclusión parcial y en la periferia del vaso, los bordes del trombo forman un ángulo agudo con la pared del vaso (Figura 2). 2). Signo del anillo: defecto de llenado central rodeado por material de contraste (Figura 3). 3). Signo de la vía del tren: defecto de llenado rodeado por contraste. Se observa en el eje largo del vaso (Figura 4). 4). Pérdida abrupta de la visualización del vaso.
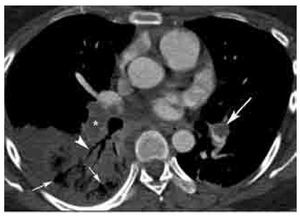
Figura 2. TEP aguda. Imagen axial de angiografía de arterias pulmonares por tomografía computarizada en un paciente con TEP grave. Nótense los defectos de llenado completo (*) y parcial (flecha grande) en las arterias lobares inferiores bilaterales. La oclusión completa del vaso en el lado derecho se asocia a zona de consolidación triangular con base pleural con lucencias centrales (flechas pequeñas) y broncograma aéreo (cabeza de flecha). Las lucencias centrales representan un signo característico de infarto pulmonar. Los ángulos formados entre las paredes del trombo y del vaso, en el caso del defecto de llenado parcial en el lado izquierdo, son agudos. Este parámetro ha sido descrito como un signo de TEP aguda.
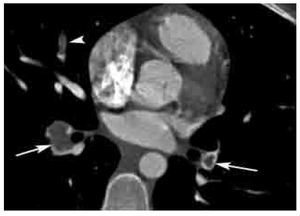
Figura 3. Signo del anillo en TEP aguda. Imagen axial de angio-TC de arterias pulmonares que muestra defectos de llenado parciales de localización central y con paso periférico del medio de contraste (signo del anillo, flechas) en ambas arterias de los lóbulos inferiores, así como oclusión total de vaso segmentario del lóbulo medio (cabeza de flecha).
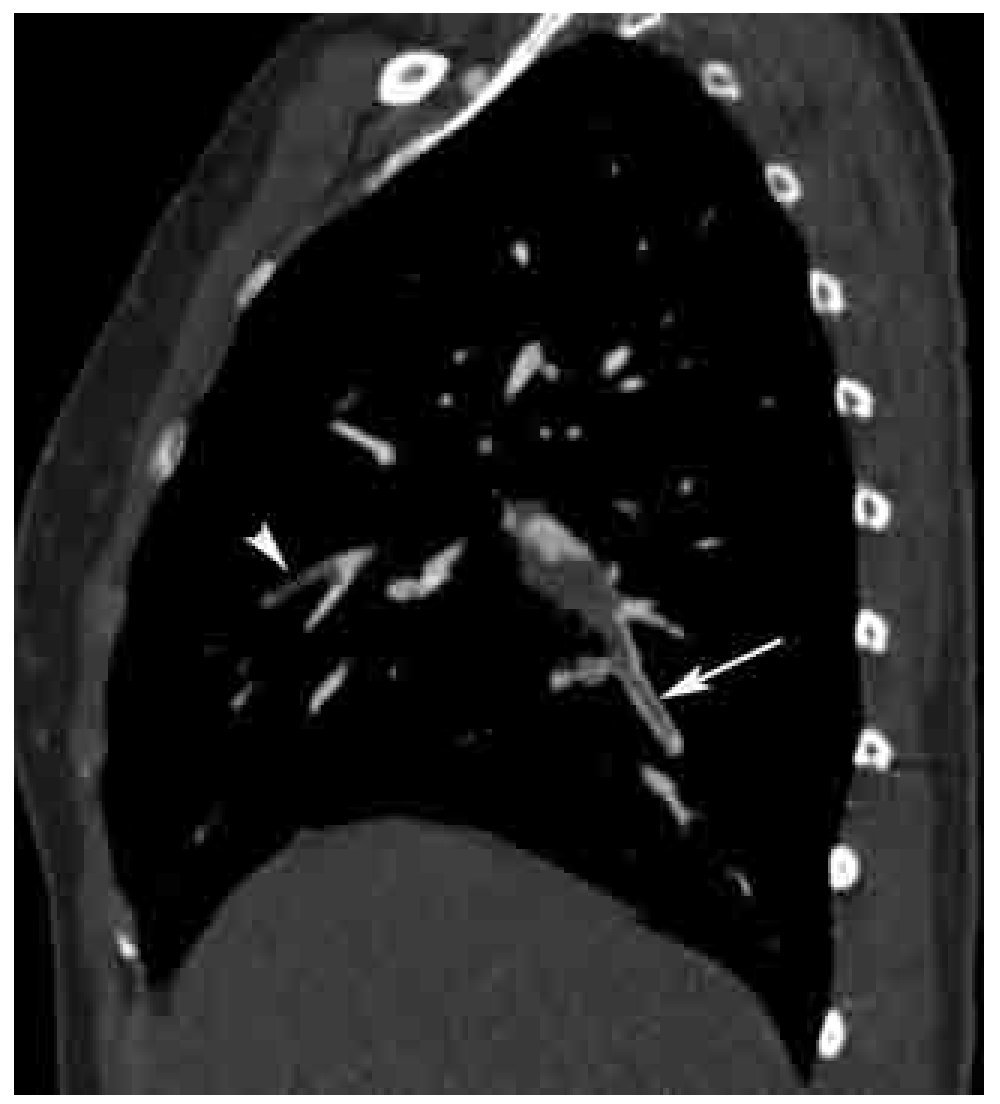
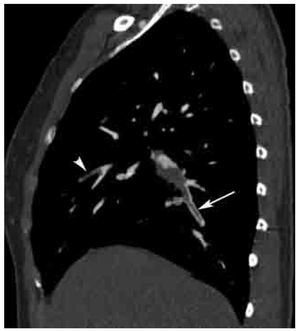
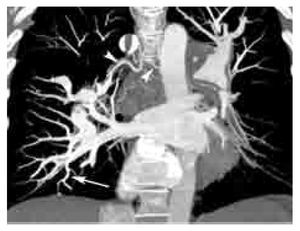
Figura 4. Signo de las vías del tren en TEP aguda. Reformateo sagital derecho de un estudio angiográfico de las arterias pulmonares por TCMD. Este signo (flecha) se presenta en defectos de llenado centrales con paso del contraste en la periferia del vaso, el cual característicamente se observa únicamente cuando se identifica al vaso en su eje largo, en este caso se trata de un vaso subsegmentario del lóbulo inferior. Nótese otro defecto de llenado total a nivel subsegmentario en el lóbulo medio (cabeza de flecha).
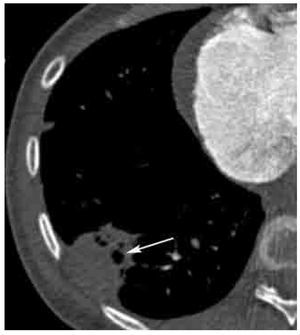
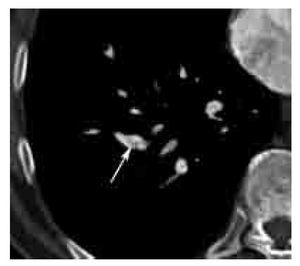
Figura 5. Infarto pulmonar en TEP aguda. Ejemplo característico de infarto pulmonar en paciente con TEP. Observe la zona de consolidación triangular de base pleural y localización periférica, la cual no muestra reforzamiento con el contraste y presenta lucencias centrales (flecha). El defecto de llenado arterial pulmonar causante del infarto no se muestra en el presente corte.
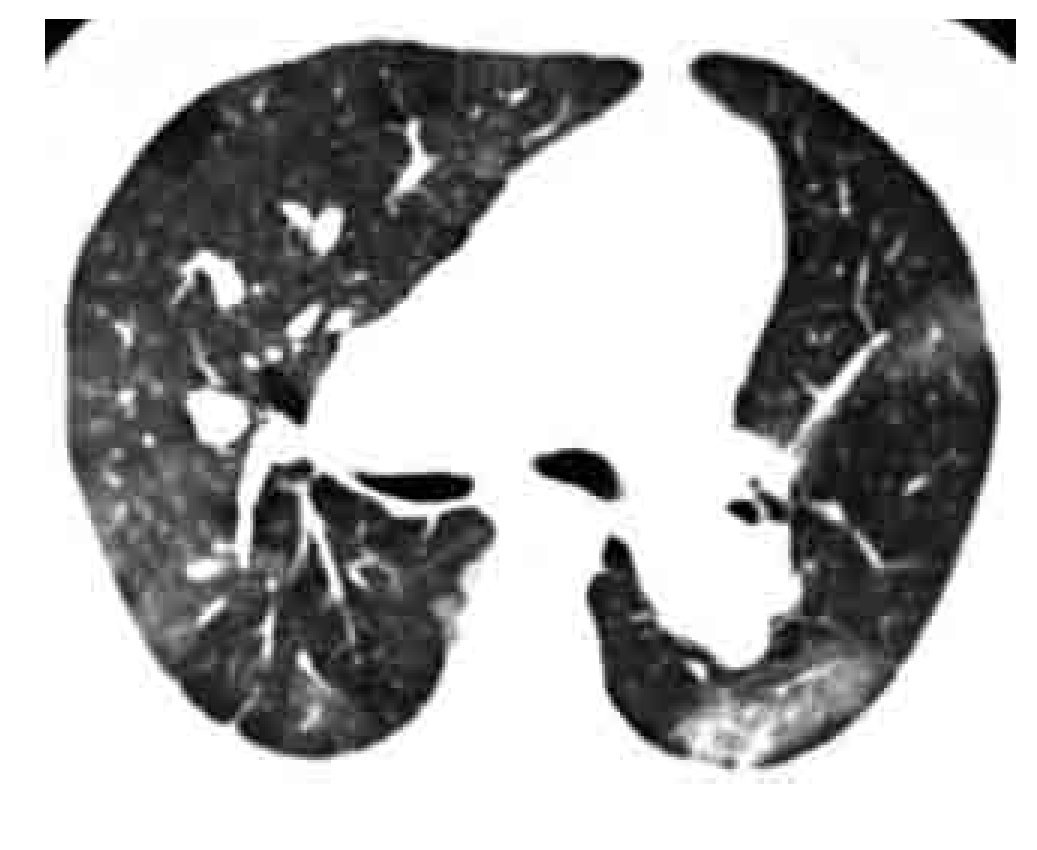
Los signos indirectos ya sean vasculares o parenquimatosos/pleurales de TEP aguda incluyen: 1). Infarto, más frecuente en los lóbulos inferiores y en las zonas periféricas en forma de consolidación triangular con baja atenuación central y sin reforzamiento con el contraste. La presencia de hipodensidades o lucencias centrales sin seguir un patrón de ramificación bronquial o bronquiolar en áreas de consolidación son altamente sugestivas de infarto pulmonar (Figuras 2 y 5).81 2). Hemorragia pulmonar, manifiesta como zona irregular de mayor atenuación o en vidrio despulido y que generalmente resuelve en una semana. 3). Oligohemia del segmento afectado. 4). Atelectasias, generalmente lineales. 5). Derrame pleural pequeño. Estos signos parenquimatosos son frecuentes.
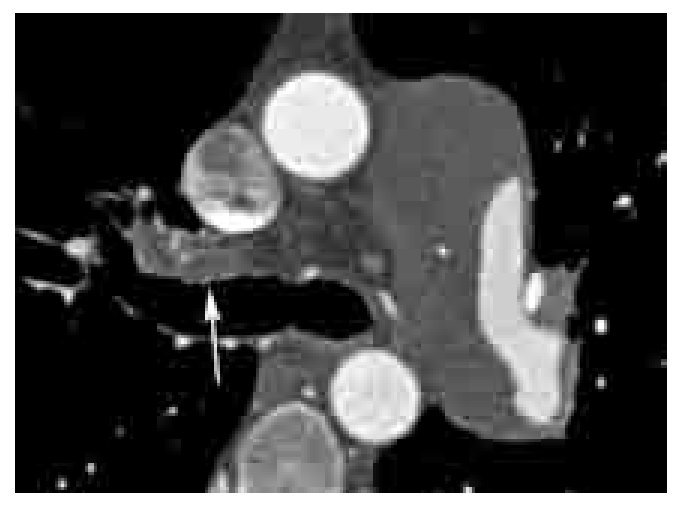
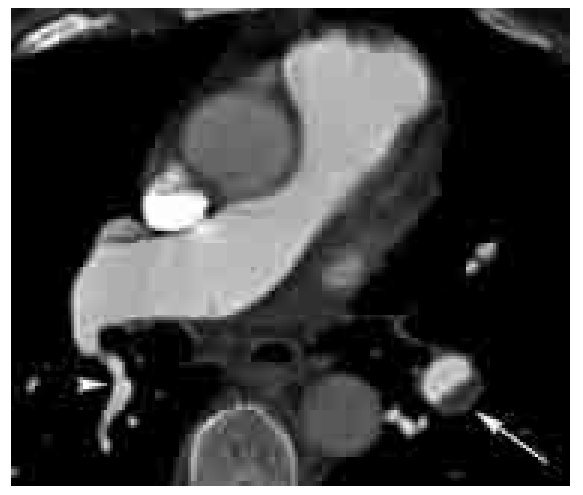
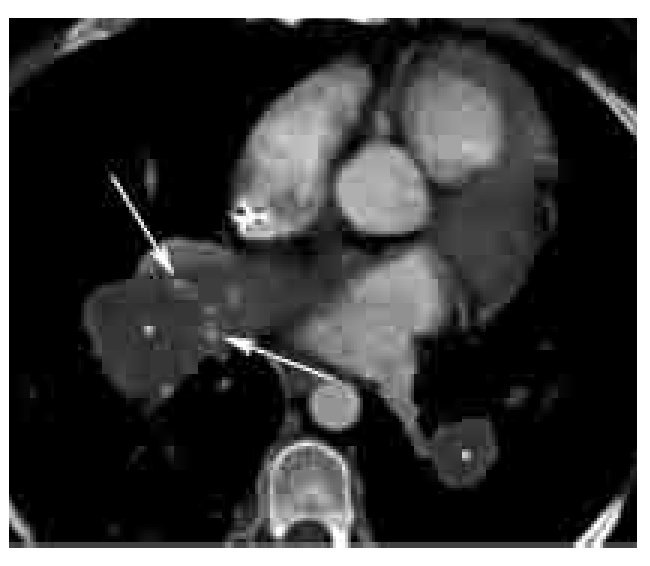
Los signos directos de TEP crónica incluyen: 1). Oclusión completa de un vaso cuyo diámetro es menor que el de los vasos circundantes (Figura 6). 2). Defecto de llenado de localización periférica en el lumen, y que forma ángulos obtusos con las paredes del vaso (Figuras 6-8). 3). Medio de contraste visible a través de un vaso cuyas paredes se encuentran engrosadas (signo de recanalización). 4). Bandas o redes intravasculares (Figuras 8 y 9). 5). Dilatación posestenótica. 6). Irregularidades de la íntima y calcificación del trombo (Figura 10). 7). Defecto de llenado intraluminal con morfología de trombo agudo pero que se encuentre presente por más de tres meses.
Figura 6. TEP crónica. Imagen en el plano axial de la arteria pulmonar principal y ramas derecha e izquierda, la cual muestra un gran defecto de llenado (*) en la periferia de la arteria pulmonar principal y que se extiende hacia la arteria pulmonar izquierda. Nótense los ángulos formados entre las paredes del trombo y del vaso, los cuales son obtusos. Existe otro defecto de llenado total en la arteria lobar superior derecha (flecha). Este trombo es crónico, ya que ha condicionado remodelado negativo vascular, es decir disminución del calibre de la arteria.
Figura 7. TEP crónica con ángulos obtusos. Imagen axial de estudio de angio-TC de arterias pulmonares. Defecto de llenado de localización periférica en la arteria lobar inferior izquierda, cuyos ángulos formados entre la pared del vaso y del trombo son obtusos.
Figura 8. Redes vasculares en TEP crónica. Reformateo en el plano coronal de paciente con TEP crónica, la cual muestra nuevamente defectos de llenado periféricos (*) en la arteria pulmonar principal y rama derecha con ángulos obtusos. Nótese además la presencia de defectos de llenado lineales (flechas) en ramas segmentarias del lóbulo superior e inferior derecho en relación a redes (webs) vasculares. Estos defectos representan remanentes de trombos crónicos.
Figura 9. Red vascular. Imagen representativa de una red vascular por TEP crónica en un vaso subsegmentario del lóbulo inferior derecho. Observe la morfología lineal y con aspecto reticular del defecto de llenado.
Figura 10. Calcificaciones del trombo en TEP crónica. Imagen axial de estudio angiotomográfico, la cual muestra calcificaciones (flechas) en el trombo que ocluye la totalidad de la arteria pulmonar derecha (*). Existe otro defecto de llenado completo en la arteria lobar inferior izquierda (*).
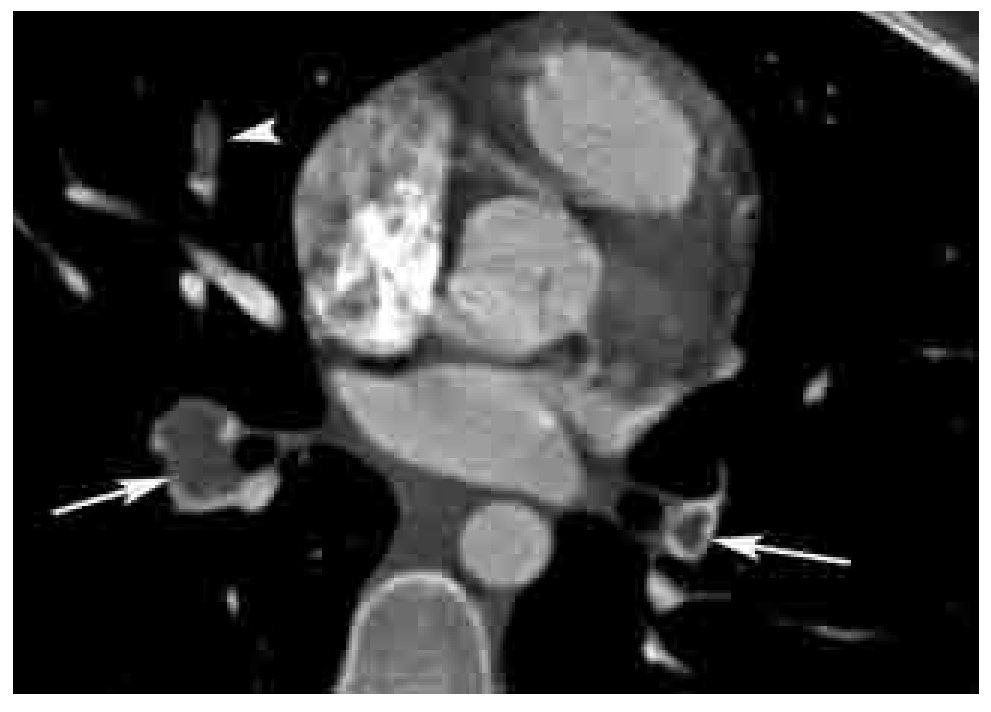
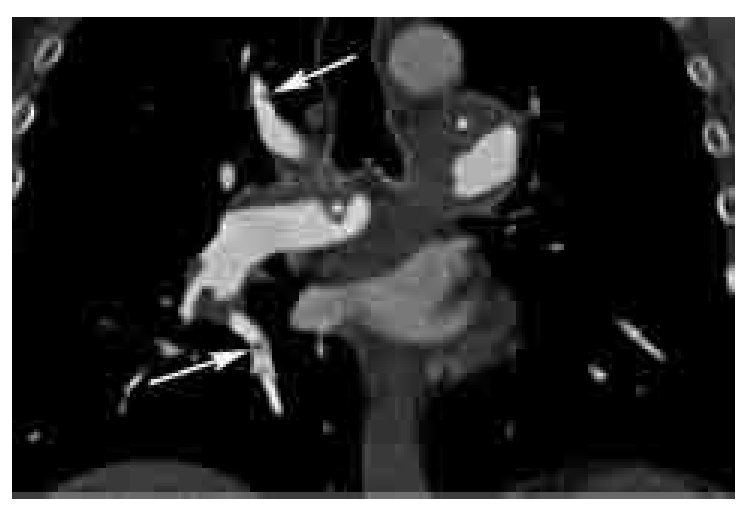
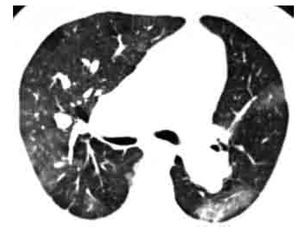
Los signos indirectos de TEP crónica son: 1). Presencia de flujo colateral a través de las arterias bronquiales (Figura 11). 2). Dilatación de la arteria pulmonar. Calcificación excéntrica de la pared vascular. 3). Perfusión en mosaico del parénquima pulmonar (Figuras 12 y 13). Este signo puede presentarse también en casos de TEP aguda, aunque es más frecuente en casos crónicos. 4). Derrame pericárdico.
Figura 11. Hipertrofia de arterias bronquiales y tortuosidad vascular por TEP crónica. Reformateo en máxima intensidad de proyección (MIP) en plano coronal, el cual muestra tortuosidad vascular periférica (flecha), asociado a prominencia de las arterias bronquiales (cabezas de flecha), secundarios a TEP crónica (*).
Figura 12. Perfusión en mosaico por TEP. Imagen axial con ventana para pulmón. Nótese el patrón de perfusión en parches, con zonas hipodensas alternadas con zonas de mayor densidad secundarias a hipertensión pulmonar por TEP. Las zonas hipodensas corresponden a áreas hipoperfundidas debido a los defectos de llenado de las arterias pulmonares.
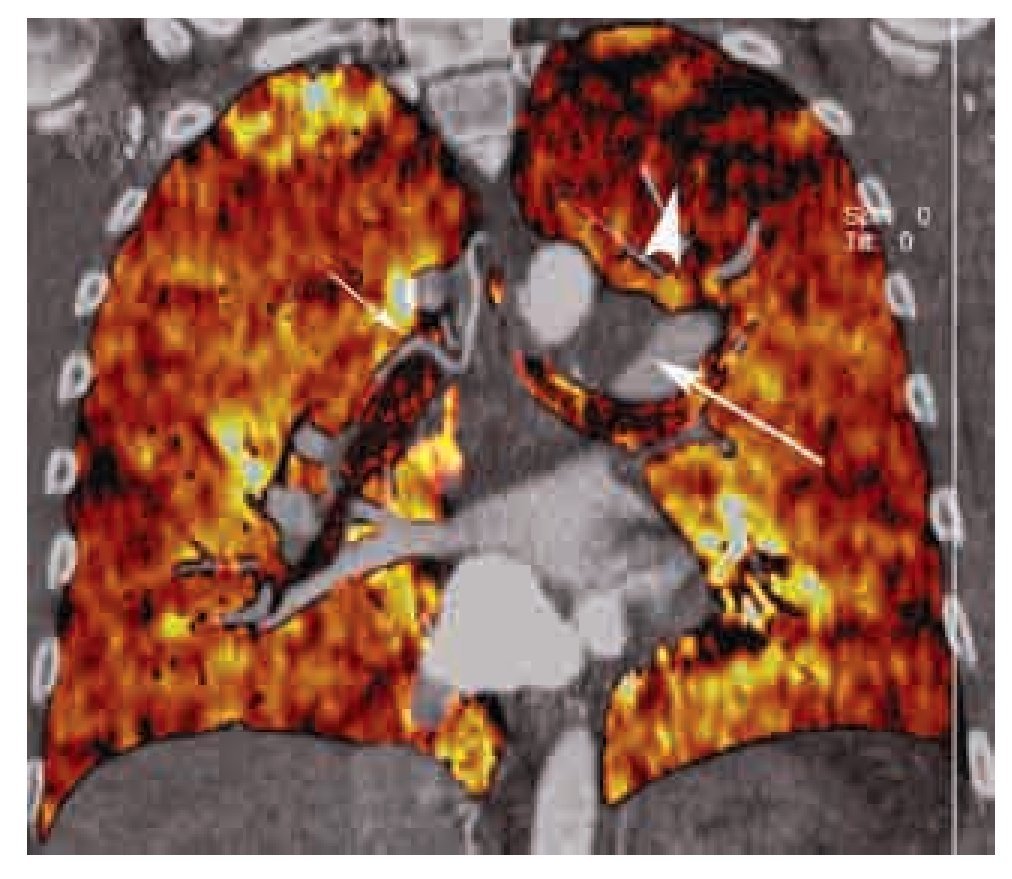
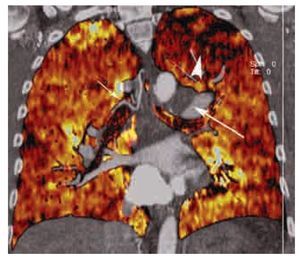
Figura 13. Patrón de perfusión en mosaico visto con energía dual. Reformateo coronal de estudio angiográfico pulmonar por TC practicado con un protocolo de energía dual. Este tipo de estudios permiten la evaluación cuantitativa y cualitativa en escala de colores de los defectos de perfusión (cabeza de flecha), y realizar una correlación con el defecto de llenado intraluminal (flecha grande). En este caso de TEP crónica, también se observa la prominencia de las arterias bronquiales (flecha pequeña).
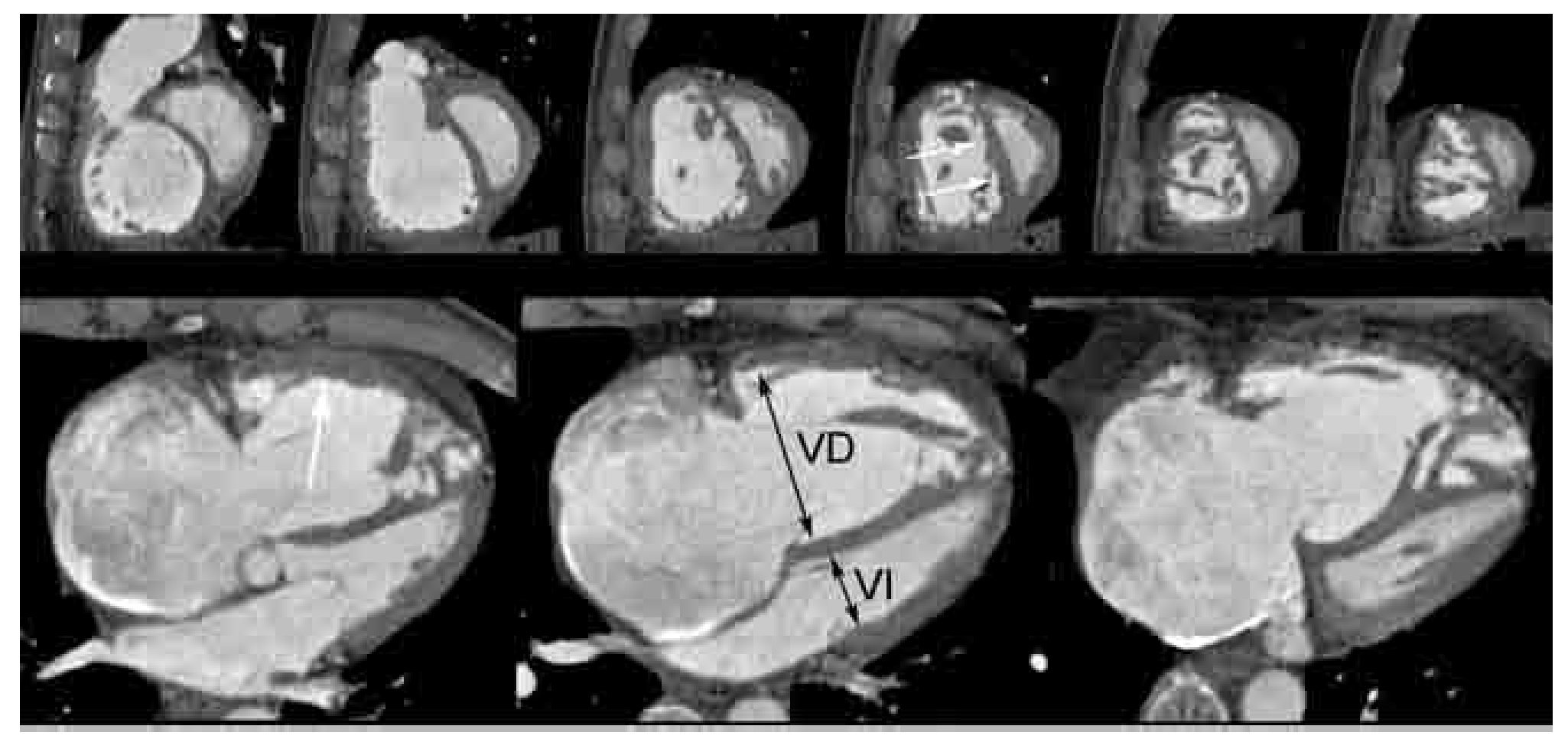
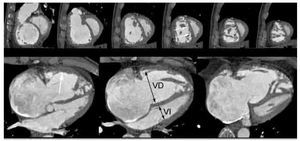
Por otra parte, se debe enfatizar que una de las principales ventajas de la TC respecto a la scintigrafía V/Q y la angiografía pulmonar invasiva, es la posibilidad de establecer diagnósticos diferenciales de patologías que pueden simular clínicamente al embolismo pulmonar, como las áreas consolidación y otras enfermedades del parénquima e intersticio pulmonar, patología del espacio pleural y pericárdico, disección aórtica, enfermedad cardiovascular, mediastinitis, ruptura esofágica, y malignidad; las cuales se presentan hasta en 70% de los estudios tomográficos.73,80 También es posible determinar la gravedad de la TEP, por la presencia de signos de cor pulmonale: disminución del diámetro diastólico del ventrículo izquierdo (normal > 4 cm), incremento en el diámetro diastólico del ventrículo derecho (normal < 4 cm), incremento en el índice del ventrículo derecho: ventrículo izquierdo (normal = 1), aumento en el diámetro de la arteria pulmonar principal (normal hasta 3 cm), el engrosamiento y desplazamiento a la izquierda del septum interventricular, normalmente desplazado a la derecha durante la sístole (Figura 14).82
Figura 14. Evaluación funcional del ventrículo derecho en paciente con TEP. Ejes cortos (fila superior) y cuatro cámaras (fila inferior) de estudio angiográfico pulmonar practicado con sincronización electrocardiográfica. Este tipo de protocolos permiten una evaluación de la función ventricular. En este caso, observe la dilatación del ventrículo derecho (VD), el cuales mayor al ventrículo izquierdo (VI), y presenta hipertrofia (flecha blanca en fila inferior). Nótese la posición anómala del septum interventricular (flechas blandas en fila superior), el cual está rectificado y en algunas áreas, convexo al VI.
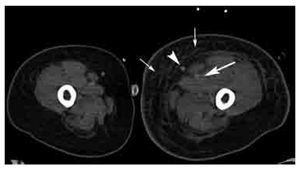
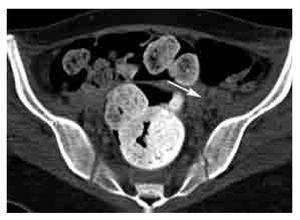
Respecto a la TVP, en cuanto a mejor sea la densidad intravenosa, el diagnóstico de TVP aguda será más preciso. Los hallazgos de TVP aguda son similares a los de TEP e incluyen: un defecto de llenado parcial o completo (Figuras 15 y 16), incremento en el diámetro del vaso en TVP aguda (Figura 16), realce en anillo de la pared vascular, edema de los tejidos blandos (Figura 16), y estriación de la grasa perivascular. En el caso de TVP crónica, los signos incluyen un defecto de llenado con disminución del diámetro vascular (en comparación con la arteria adyacente y con la vena contralateral), circulación colateral y calcificación de la pared vascular.
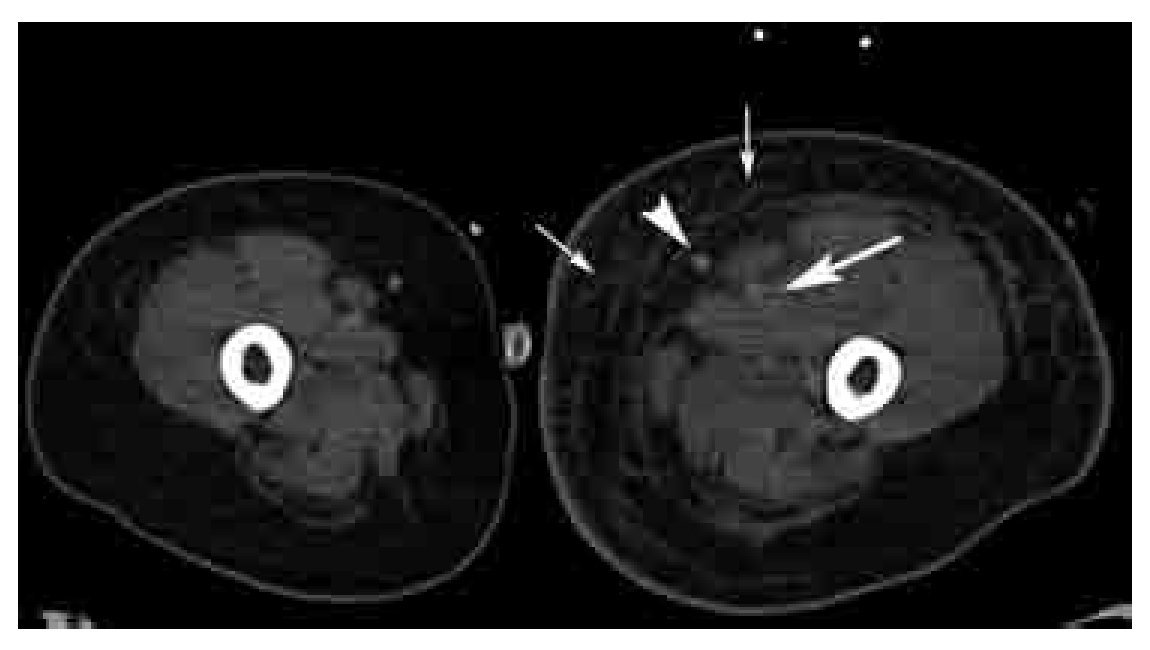
Figura 15. Corte axial de venotomografía indirecta a nivel del tercio superior de los muslos. Nótese la asimetría de los muslos, con estriación de la grasa del tejido celular subcutáneo en el lado izquierdo (flechas pequeñas), secundario a trombosis venosa profunda del tercio proximal de la vena femoral (flecha grande) y que explica la dilatación secundaria del sistema safeno mayor (cabeza de flecha).
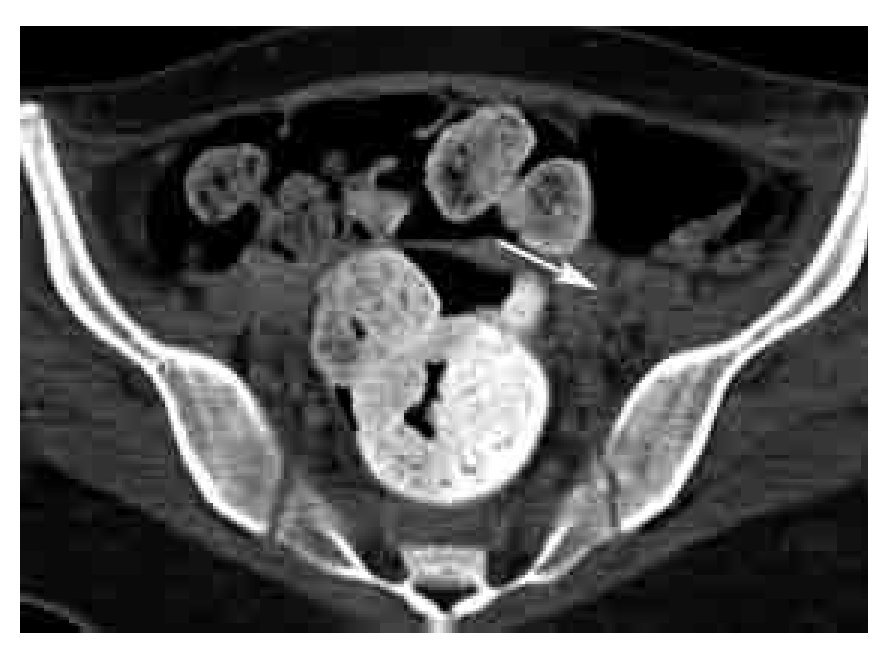
Figura 16. Corte axial de venotomografía indirecta a nivel de la pelvis. Defecto de llenado que ocupa la totalidad de la luz de la vena iliaca externa izquierda en relación a trombosis (flecha).
Situaciones especiales
La TEP durante el embarazo es infrecuente (1:2000 embarazos), pero representa la principal causa de muerte durante el mismo.83 Este diagnóstico tiene implicaciones importantes: anticoagulación prolongada, profilaxis en embarazos posteriores, y surge la preocupación sobre la seguridad de estrógenos en el futuro.
Para decidir cómo evaluar a este grupo de pacientes, la pregunta sería ¿cuál es la dosis de radiación que recibe el feto en la scintigrafía V/Q y en la angio-TC? Estas dosis varían de acuerdo al trimestre del embarazo.84 Debido a que el 99mTC- DTPA se elimina por vía renal, la dosis que recibe el feto es de 0.9 a 1.8 mGy, mientras que la dosis por radiación dispersa de la TC que recibe el producto se estima es menor a 0.14 mGy.85 Estas dosis de acuerdo a la Comisión Internacional de Protección Radiológica (IRCP) son consideradas bajas y muy bajas, respectivamente.86
De acuerdo al ICRP, casi siempre, si el estudio diagnóstico está clínicamente indicado, el riesgo de la madre de no realizarse el procedimiento es mayor que el riesgo de daño potencial al feto.
Con base en estos datos, el abordaje diagnóstico recomendado en este grupo de pacientes sería: US con compresión de miembros inferiores, que en caso de ser positivo, indica terapia anticoagulante sin la necesidad de otros estudios por imagen. Por el contrario, si el estudio es negativo, entonces se sugiere una angio-TC pulmonar sin venografía indirecta por TC, con un FOV limitado (dos centímetros por arriba del arco aórtico hasta el domo diafragmático) para limitar el campo de radiación y el volumen de contraste se reduce a 70 mL, debido al potencial riesgo de hipotiroidismo neonatal inducido por cargas elevadas de angosto que el empleado en la evaluación del protocolo de TEP.
Angiotomografía computarizada como herramienta pronóstica
Estudios ecocardiográficos han demostrado previamente la importancia pronóstica de la disfunción del VD en pacientes con TEP.10 La disfunción del VD se ha asociado con una duplicación de la tasa de mortalidad a 14 días, y a una tasa de mortalidad a los tres meses hasta 1.5 veces mayor que en los pacientes sin disfunción del VD.7
Resultados de numerosos estudios han demostrado la utilidad clínica de la TCMD en la evaluación de la gravedad de la TEP, y como herramienta de pronóstico de mortalidad a corto y mediano plazo así como de mayor riesgo de complicaciones hospitalarias, a través de la medición de diferentes parámetros que reflejan falla ventricular derecha.19,87-89 Al compararse con otras modalidades diagnósticas como la ecocardiografía, la RM y la ventriculografía por radio núclidos, la TCMD con sincronización electrocardiográfica ha demostrado una buena correlación de los volúmenes y función del ventrículo derecho.52,90,91
La adquisición sincronizada electrocardiográficamente de tipo retrospectivo facilita la detección de la disfunción del VD, ya que permite la medición cuantitativa de los parámetros de función ventricular derecha, la evaluación de la configuración y posición del septum interventricular al final de la diástole, así como la medida de la relación del diámetro entre el VD y el VI, hallazgos relacionados con la severidad del embolismo.19,51,87-89Araoz P y colaboradores, en un estudio retrospectivo de 1105 pacientes con diagnóstico de TEP agudo documentaron que el movimiento septal paradójico se encuentra asociado a mayor compromiso hemodinámico.92 Asimismo, junto el estudio reportado por Subramaniam y colaboradores, se sugiere que la sobrevida es menor en aquellos pacientes con obstrucción vascular importante medida a través de un índice Qanadli mayor a 45%.10,92
No obstante, el incremento en los tiempos de adquisición y de la dosis de radiación al ser comparados con estudios sin sincronización cardiaca (1.37-4.2 vs. 5.2-8.1 mSv),51,65,90,91,93,94 así como su potencial baja aplicación en pacientes con ritmos cardiacos irregulares o frecuencias cardiacas elevadas limitan su uso,28,95 por lo que los protocolos convencionales siguen siendo los más ampliamente recomendados.
Conclusiones
Hoy en día existen numerosas herramientas en la evaluación de pacientes con sospecha de TEP y TVP. La TCMD es un estudio no invasivo, rápido, disponible, exacto y con alta concordancia interobservador y junto con la alta frecuencia de estudios no diagnósticos obtenidos con la scintigrafía V/Q, es considerada actualmente como la primer herramienta diagnóstica por imagen. Asimismo, existen numerosos beneficios de la combinación de la angio-TC pulmonar y la venografía indirecta por TC en un mismo tiempo.
Es posible que en un futuro próximo con el mayor desarrollo y disponibilidad de los nuevos sistemas, la TCMD funcional sea un método cada vez más utilizado como herramienta pronóstica.
Correspondencia: Eric Takehiro Kimura Hayama.
Juan Badiano No. 1. Col. Sección VXI. 14080. México, D.F.
Teléfono: 55732911 extensión: 1518 y 1526.
Correo electrónico:erickimura@ctcardiomexico.com
aceptado el 14 de noviembre de 2010.