La aterosclerosis es una enfermedad que involucra múltiples mecanismos fisiopatológicos cuyo conocimiento no se ha dilucidado por completo. Con frecuencia, los avances científicos sobre la fisiopatología aterogénica generan que a diversas moléculas no consideradas previamente en el panorama de dicha enfermedad se les atribuyan acciones sobre el inicio o progresión de la misma. Un ejemplo representativo es el estudio de un nuevo mecanismo involucrado en el proceso aterogénico, consistente en la asociación entre el sistema de factores de crecimiento similares a la insulina (IGF) y la proteína plasmática A asociada al embarazo (PAPP-A). El sistema IGF es una familia de péptidos compuesto por 3 hormonas peptídicas, 4 receptores transmembranales y 6 proteínas transportadoras. El factor de crecimiento similar a la insulina tipo 1 (IGF-1) es el principal ligando del sistema IGF involucrado en la aterosclerosis coronaria y ejerce sus efectos mediante la activación del receptor IGF-1R en células de músculo liso vascular de las arterias coronarias o en macrófagos de placas ateroscleróticas. En células de músculo liso vascular promueve la migración y previene la apoptosis aumentando la estabilidad de la placa, y en macrófagos disminuye el transporte reverso de colesterol propiciando la formación de células espumosas. La regulación de la biodisponibilidad de IGF-1 en el endotelio se lleva a cabo por las proteasas de proteínas IGFBP, principalmente por la PAPP-A. En la presente revisión se abordan los mecanismos involucrados entre el sistema IGF y la PAPP-A en aterosclerosis coronaria con énfasis en los efectos moleculares producidos en células de músculo liso vascular y en macrófagos.
Atherosclerosis is a condition that involves multiple pathophysiological mechanisms and whose knowledge has not been fully elucidated. Often, scientific advances on the atherogenic pathophysiology generate that molecules not previously considered in the scene of this disease, were attributed actions on the onset or progression of it. A representative example is the study of a new mechanism involved in the atherogenic process, consisting of the association between the insulin-like growth factor (IGF) system and pregnancy-associated plasma protein-A (PAPP-A). Insulin-like growth factor system is a family of peptides that include 3 peptide hormones, 4 transmembrane receptors and 6 binding proteins. Insulin-like growth factor-1 (IGF-1) is the main ligand of the IGF system involved in coronary atherosclerosis. IGF-1 exerts its effects via activation of the IGF-1R receptor on vascular smooth muscle cells or macrophages. In vascular smooth muscle cells promotes migration and prevents apoptosis which increases plaque stability while in macrophages reduces reverse cholesterol transport leading to the formation of foam cells. Regulation of IGF-1 endothelial bioavailability is carried out by IGFBP proteases, mainly by PAPP-A. In this review, we address the mechanisms between IGF system and PAPP-A in atherosclerosis with emphasis on molecular effects on vascular smooth muscle cells and macrophages.
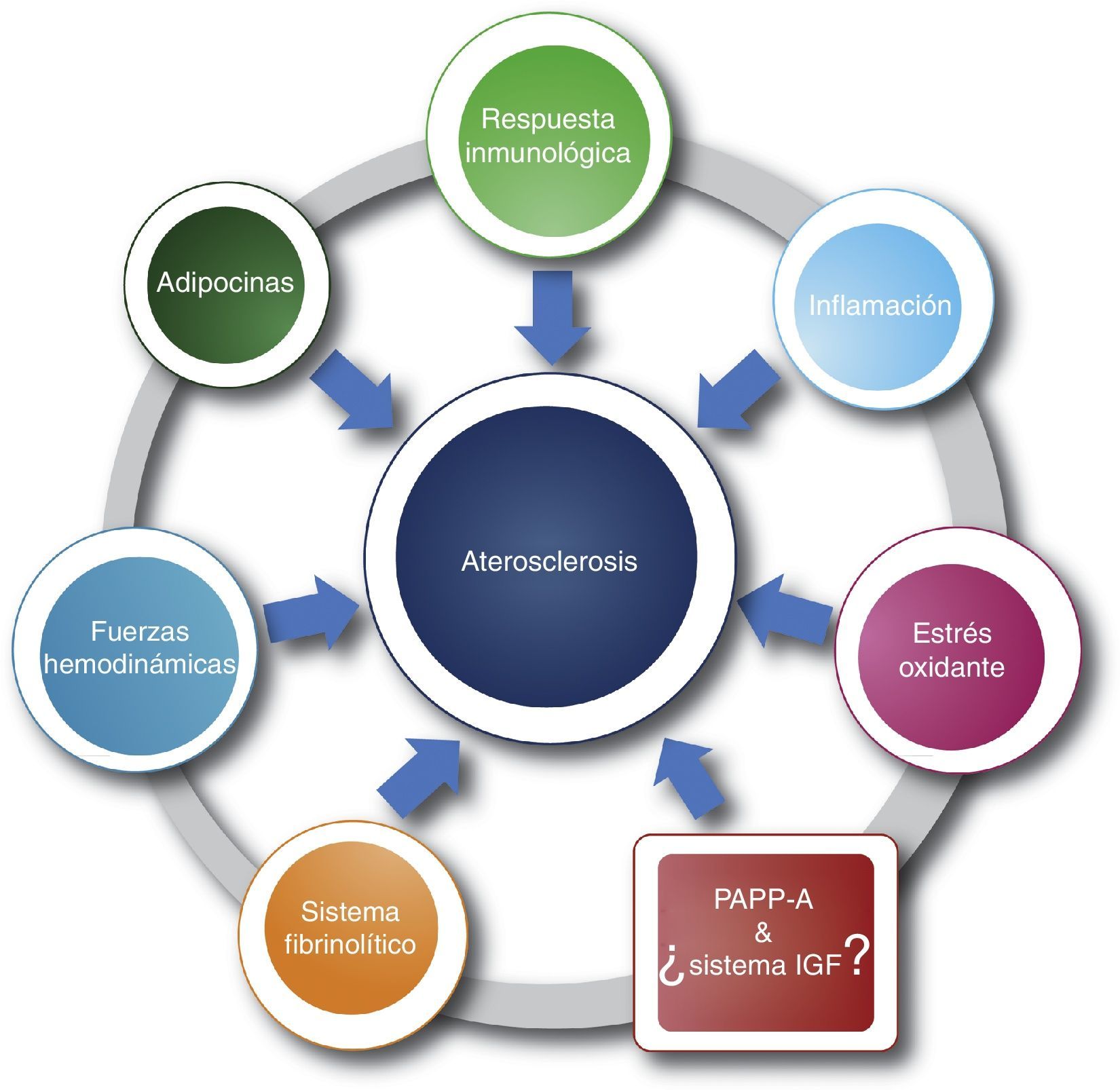
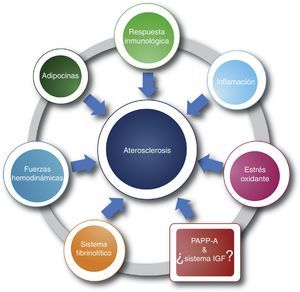
La cardiopatía isquémica constituye una de las principales causas de morbimortalidad a nivel mundial, su principal causa es la aterosclerosis, una enfermedad que se caracteriza por depósito de calcio y colesterol en las arterias en forma de placa1–3. A su vez, la aterosclerosis es de origen multifactorial y comprende, entre otros, los siguientes mecanismos: fuerzas hemodinámicas, respuesta inmunológica, inflamación, estrés oxidante, sistema fibrinolítico, adipocinas, etc. (fig. 1)4–9.
Etiología multifactorial de la aterosclerosis. Se aprecian algunos de los mecanismos fisiopatológicos más relevantes en aterogénesis, incluyendo la nueva propuesta del sistema IGF y su asociación con la PAPP-A (cuadro); los signos de interrogación delimitan múltiples interrogantes sobre el conocimiento en este mecanismo. Como se puede observar, los factores proaterogénicos no son independientes, se encuentran relacionados entre sí (línea).
Recientemente, se ha estudiado un nuevo mecanismo involucrado en el proceso aterogénico que consiste en la asociación entre el sistema de factores de crecimiento similares a la insulina (sistema IGF) con una enzima proteolítica denominada proteína plasmática A asociada al embarazo (PAPP-A) (fig. 1). La presente revisión tiene como objetivo analizar los principales mecanismos moleculares del sistema IGF y de PAPP-A en la aterosclerosis coronaria.
Sistema de factores de crecimiento similares a la insulinaEl sistema IGF es una familia de péptidos con acciones pleiotrópicas que incluyen: desarrollo, crecimiento, metabolismo, efectos neuroprotectores, plasticidad neuronal, funciones cognitivas y regulación del sistema inmunológico. Se compone por 3 hormonas peptídicas, 4 receptores transmembranales y 6 proteínas transportadoras (tabla 1)10,11.
Componentes del sistema de factores de crecimiento similares a la insulina
| Hormonas peptídicas | Receptores | Proteínas de unión a los factores de crecimiento similares a la insulina |
|---|---|---|
| IGFBP-1 | ||
| IGF-1 | IGF-1R | IGFBP-2 |
| IGF-2 | IGF-2R | IGFBP-3 |
| Insulina | IR | IGFBP-4 |
| Híbrido IR/IGF-1R | IGFBP-5 | |
| IGFBP-6 |
IGF-1: factor de crecimiento similar a la insulina tipo 1; IGF-2: factor de crecimiento similar a la insulina tipo 2; IGF-1R: receptor del factor de crecimiento similar a la insulina tipo 1; IGF-2R: receptor del factor de crecimiento similar a la insulina tipo 2; IGFBP: proteína de unión al factor de crecimiento similar a la insulina; IR: receptor de insulina.
El IGF tipo 1 (IGF-1) a diferencia del tipo 2 (IGF-2), actúa principalmente durante la etapa posnatal; fue aislado en el año 1957, denominado «factor de sulfatación»12,13. Sin embargo, la secuencia completa de aminoácidos del IGF-1 no fue establecida hasta el año 1978, se determinó que su estructura consiste en una cadena polipeptídica simple de 7.5kDa formada por 70 aminoácidos unidos mediante 3 puentes disulfuro14.
El IGF-1 se sintetiza casi en su totalidad en el hígado y circula en el torrente sanguíneo hacia los tejidos efectores en un complejo ternario con una proteína IGFBP y con la glucoproteína subunidad acidolábil (ALS, por sus siglas en inglés)11,15,16. De las 6 proteínas tipo IGFBP, la más abundante es la IGFBP-3 y se encarga de transportar más del 75% del IGF-1, mientras que las demás proteínas IGFBP transportan aproximadamente un 20% y menos del 1% del IGF-1 circula libre11,16. Debido a que el IGF-1 presenta una mayor afinidad por las proteínas IGFBP que por sus receptores, es necesaria la escisión proteolítica del complejo ternario para aumentar la cantidad de IGF-1 libre, permitiendo así la unión con sus receptores. Aunque el IGF-1 tiene la capacidad de activar cualquiera de los 4 receptores del sistema IGF, presenta mayor afinidad por el receptor del factor de crecimiento similar a la insulina tipo 1 (IGF-1R)17.
En una menor proporción, el IGF-1 puede sintetizarse en la mayoría de los tejidos efectores por células específicas, donde actúa de forma autocrina o paracrina11,17.
Las concentraciones séricas del IGF-1 se pueden ver afectadas por un gran número de factores como la edad, el sexo, el estado nutricional y la secreción de la hormona de crecimiento. Las concentraciones plasmáticas son bajas al nacimiento pero aumentan durante la infancia y pubertad, para disminuir a partir de la tercera década de la vida; siendo acorde al patrón de secreción de la hormona de crecimiento, ya que esta hormona es la encargada de la síntesis hepática de IGF-117.
Vía de señalización intracelular del receptor del factor de crecimiento similar a la insulina tipo 1 en aterosclerosis coronariaEl IGF-1 ejerce su acción en células blanco a través de su receptor específico, el IGF-1R. El receptor IGF-1R presenta estructura similar al receptor de insulina con 4 subunidades transmembranales y un dominio intracelular de tirosina cinasa18.
Algunos mecanismos importantes del IGF-1R incluyen la disminución de la tasa de apoptosis, aumento de la diferenciación y migración celular, aumento de la tasa de captación de la glucosa, incremento en la síntesis de glucógeno y aumento de la síntesis proteica19–22.
Sin embargo, los 2 principales mecanismos del IGF-1R involucrados en la aterosclerosis coronaria son inducir la migración así como prevenir la apoptosis en las células de músculo liso vascular (VSMC, por sus siglas en inglés). La expresión de IGF-1R en VSMC es regulada por diversos factores: la angiotensina ii, la trombina y el factor de crecimiento de fibroblastos aumentan la expresión de IGF-1R; por otro lado, la LDL oxidada y los estrógenos disminuyen su expresión23–28.
La unión de IGF-1 a IGF-1R induce una modificación conformacional en su estructura, estimulando la actividad intrínseca de tipo tirosin cinasa29. Esta actividad tirosin cinasa, activa a su vez una cascada de fosforilación de diversos sustratos que incluyen a la familia de receptores de insulina, como el receptor de la insulina tipo 1 y la proteína adaptadora SHC, entre otros11,30–33.
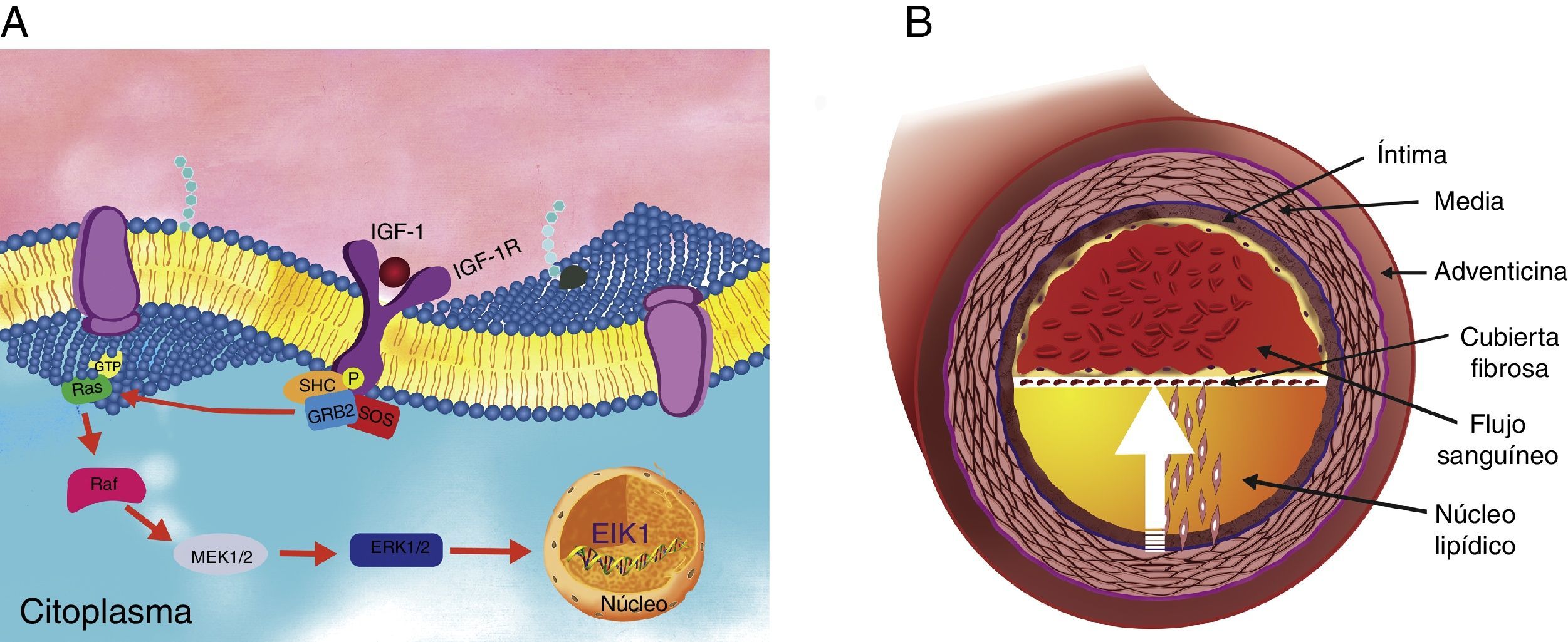
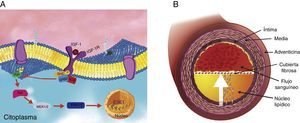
Se ha demostrado que la migración celular ocurre cuando el IGF-1R se fosforila, reclutando a las proteínas SHC en los residuos de tirosina fosforilados de este receptor. Una vez activada, SHC se une a GRB2, y a su vez este complejo recluta a SOS para posteriormente activar a Ras; lo anterior desencadena la cascada de fosforilación de la serina treonina cinasa Raf, MEK1/2 (MAP cinasas) y ERK1/2 (cinasas reguladas por señal extracelular) para activar a factores de transcripción nuclear como al factor de transcripción nuclear 1 (Elk-1) (fig. 2A)34–36. En las arterias coronarias, esta migración de VSMC ocurre desde la capa media hacia la capa íntima y se ha relacionado con las características del ateroma (fig. 2B)37,38.
Vía de señalización intracelular del IGF-1R en células de músculo liso vascular. (A) El receptor IGF-1R al hacer contacto con su ligando desencadena una serie de señales intracelulares a través de la vía de MAP cinasas hacia el núcleo, donde se activan factores de transcripción. (B) Como consecuencia, las células de músculo liso vascular de la capa media migran hacia la capa íntima (flecha interlineada).
Por su parte, la regulación de la apoptosis en VSMC por IGF-1R se lleva a cabo a través de diversos mediadores. Esto sucede en la vía del fosfatidilinositol-3-cinasa (PI3K), el cual produce la conversión de fosfatidilinositol 4-5-bifosfato (PIP2) en fosfatidilinositol 3-4-5-trifosfato (PIP3). Posteriormente, PIP3 activa a la proteincinasa 1 dependiente de fosfoinosítido (PDK1), la cual, fosforila a la proteincinasa B (Akt). Finalmente, Akt inhibe proteínas proapoptóticas como la caspasa-9, el antagonista de BLC2 de muerte celular (Bad) y al factor de transcripción Forkhead-139,40.
Proteína plasmática A asociada al embarazoLa PAPP-A fue aislada en el año 1974 como una de 4 proteínas de origen placentario en el plasma de mujeres embarazadas41. Forma parte de la superfamilia de metzincina de metaloproteinasas y de la subfamilia de las papalisinas42.
La estructura de PAPP-A se compone de 5 dominios principales con un peso total aproximado de 200kDa: (a) dominio LG, (b) dominio proteolítico, (c) dominio central de identidad desconocida, (d) dominio CCP y (e) dominio C-terminal43. Cuando la PAPP-A se encuentra en su estado proteolítico activo, su composición consiste de un homodímero de 400kDa mientras que durante el embarazo circula como un complejo hetero-tetramérico con la proforma de la proteína básica mayor de eosinófilo (proMBP) con un peso aproximado a los 500kDa43.
El conocimiento de la expresión génica tejido específica de PAPP-A es parcial; se ha demostrado su expresión en VSMC, células X de origen fetal, osteoblastos, células granulosas del ovario y fibroblastos43. Estudios in vitro han demostrado que la regulación de la expresión génica de PAPP-A en VSMC es estimulada por ciertas citocinas proinflamatorias: interleucina 1-β, interleucina 6 y por el factor de necrosis tumoral alfa44–46.
En la actualidad, la principal utilidad clínica de PAPP-A consiste en ser un marcador sérico eficaz para la detección prenatal de trisomía 21 y trisomía 1847–49.
Papel del sistema de factores de crecimiento similares a la insulina y la proteína plasmática A asociada al embarazo en aterosclerosis coronariaDebido a que las proteínas IGFBP participan en la regulación de la biodisponibilidad del IGF-1, se ha mostrado interés por la investigación de las proteasas del sistema IGF. Actualmente, se están realizando investigaciones con el objetivo de identificar, clasificar y determinar la significación biológica de las proteasas de IGFBP en una gran variedad de sistemas biológicos.
En el año 1999 se logró identificar por primera vez in vitro una proteasa específica de IGFBP-4, en un medio condicionado con fibroblastos humanos. La secuencia nucleotídica de la proteasa hizo posible determinar que se trataba de PAPP-A, una enzima cuya función permanecía elusiva50. Este hallazgo hizo posible la conexión entre el sistema IGF y PAPP-A, así como su posible asociación en la aterosclerosis coronaria.
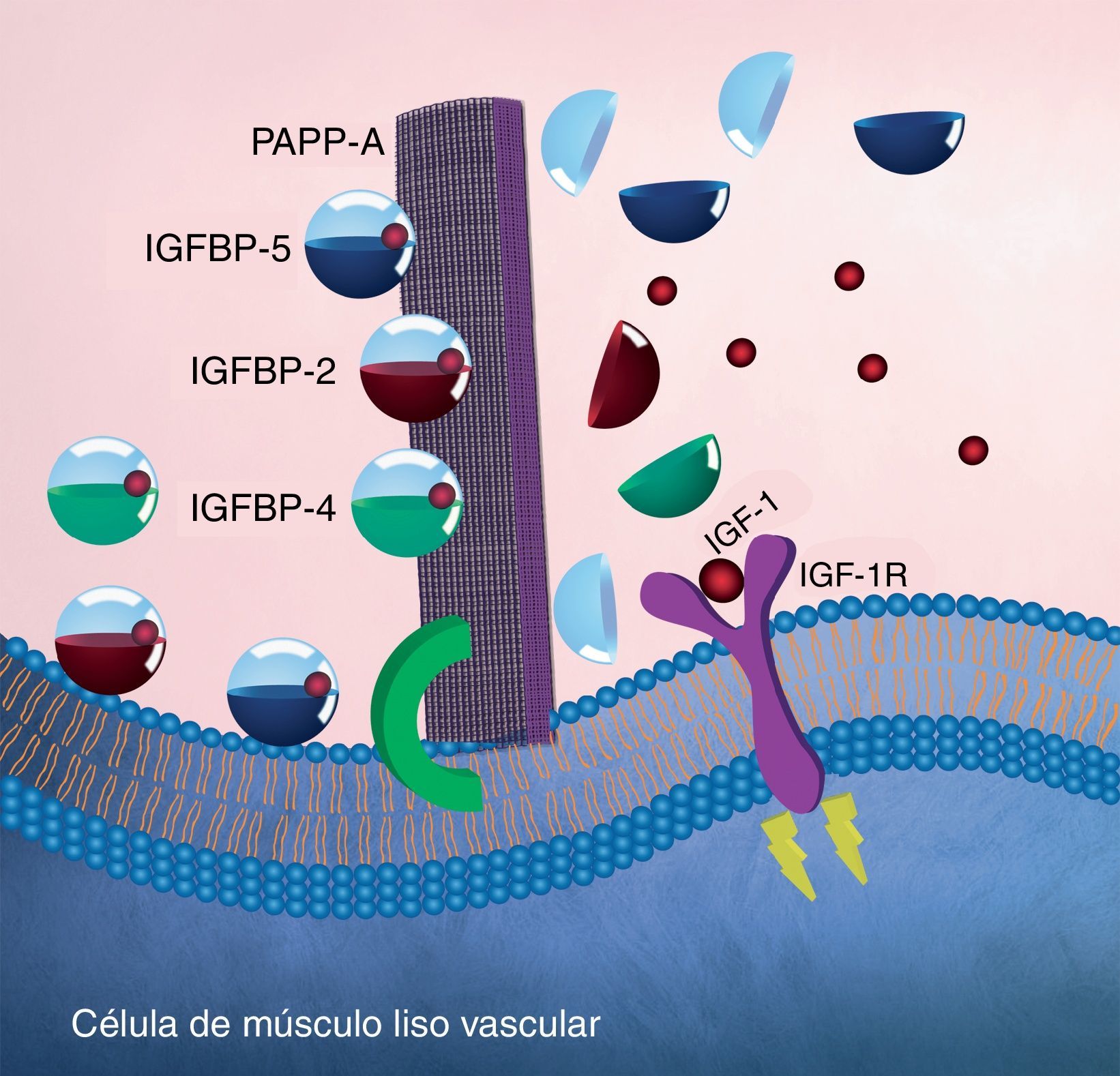
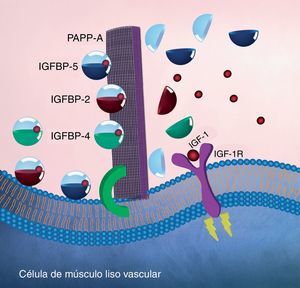
Asimismo, se comprobó que la PAPP-A no muestra afinidad por el IGF-1 libre circulante y que la proteólisis de IGFBP-4 es independiente del IGF-1 libre. Lo anterior demuestra que la unión de IGFBP-4 con el IGF-1 produce un cambio conformacional en su estructura y, por lo tanto, se convierte en un sustrato de PAPP-A. Además, se demostró que IGFBP-5 e IGFBP-2 también son sustratos de PAPP-A y presentan las mismas características en su escisión; sin embargo, no se ha documentado actividad proteolítica contra IGFBP-3 (fig. 3)51–54.
Modelo endocrino de la actividad enzimática (proteolítica) de la PAPP-A. Se muestra la enzima PAPP-A anclada en la membrana de una célula de músculo liso vascular a través de un proteoglucano (verde). Se representa a PAPP-A como una malla (morado) que escinde a IGFBP-2, IGFBP-4 y/o IGFBP-5 liberando de esta forma a IGF-1 y permitiendo que se una con su receptor. A su vez, la modificación conformacional en la estructura de IGF-1R iniciará la cascada de señalización intracelular (amarillo) con la consecuente migración de VSMC de la capa media hacia la capa íntima en las arterias coronarias.
Como se ha comentado anteriormente, el mecanismo endocrino de IGF-1 que inicia tras su síntesis en el hígado por acción de la hormona de crecimiento y continúa con el transporte del mismo en un complejo ternario (IGF-1/IGFBP-3/ALS), para su posterior liberación en VSMC es tema de discusión. Debido a que la evidencia sustenta que PAPP-A no presenta actividad proteolítica contra la principal proteína transportadora en el mecanismo endocrino (IGFBP-3), es factible hipotetizar que el efecto de PAPP-A en aterosclerosis sea mínimo.
Por otro lado, diversos estudios han demostrado un mecanismo autocrino/paracrino alterno de IGF-1 en aterosclerosis coronaria. El mecanismo consiste en la síntesis de proteínas IGFBP (IGFBP2-6) e IGF-1 en VSMC y se encuentra regulado por diversos factores como especies reactivas de oxígeno, angiotensina ii, factor de necrosis tumoral alfa, LDL oxidada, factor de crecimiento derivado de plaquetas y FGF55–58. En este mecanismo alterno, la IGFBP-4 es la principal proteína tipo IGFBP expresada en las VSMC59–63. Por consiguiente, la interacción entre PAPP-A e IGFBP-4 en aterosclerosis coronaria adquiere relevancia al ser el principal regulador de la biodisponibilidad de IGF-1 en VSMC.
Estudios realizados en diferentes modelos animales confirman el aumento en la expresión de PAPP-A y la mayor actividad de IGF-1 en VSMC después de una lesión endotelial64,65. En efecto, cuando se estudiaron ratones con deleción del gen que codifica para PAPP-A sometidos a ligación de carótidas fue evidente la disminución en la actividad de IGF-1; también se observó una reducción del 75% en formación de neoíntima en comparación con controles65. En otro estudio se logró demostrar el aumento en la expresión de PAPP-A, IGFBP-4 e IGF-1 en lesiones ateroescleróticas de ratones con deleción del gen que codifica para apolipoproteína E; sin embargo, este hallazgo no se observó en las áreas de la aorta sin lesiones endoteliales66. Por su parte, Conover et al.67 desarrollaron un estudio en ratones con sobreexpresión de PAPP-A en VSMC; sus resultados demostraron que PAPP-A acelera la progresión de las lesiones ateroscleróticas en este modelo animal.
Los estudios previos hacen evidente la actividad proteolítica de PAPP-A contra IGFBP-4, con la consecuente biodisponibilidad de IGF-1 en VSMC de placas ateroscleróticas. No obstante, existe controversia si su expresión se traduce en un mecanismo compensatorio que trata de limitar el desarrollo de las lesiones o si es fundamentalmente proaterogénico. Para responder esta cuestión es imprescindible saber que la interacción de PAPP-A con el sistema IGF es compleja y que no solo ejercen sus efectos en las VSMC, sino también en macrófagos.
El transporte reverso de colesterol (TRC) es un mecanismo que previene la acumulación de colesterol en los macrófagos, evento obligado para la formación de células espumosas. Los transportadores ABCA1, ABCG1 y SR-B1 son los principales mediadores del flujo de salida de colesterol en macrófagos; estos transportadores son activados por el receptor nuclear LXRα68–73. Tang et al.74 realizaron un estudio donde demostraron que el IGF-1 disminuye la expresión de LXRα en macrófagos a través de la vía de señalización de PI3K-Akt, disminuyendo a su vez, la expresión de ABCA1, ABCG1 y SR-B1. Lo anterior se traduce en una alteración en el TRC y, por consiguiente, en una mayor formación de células espumosas.
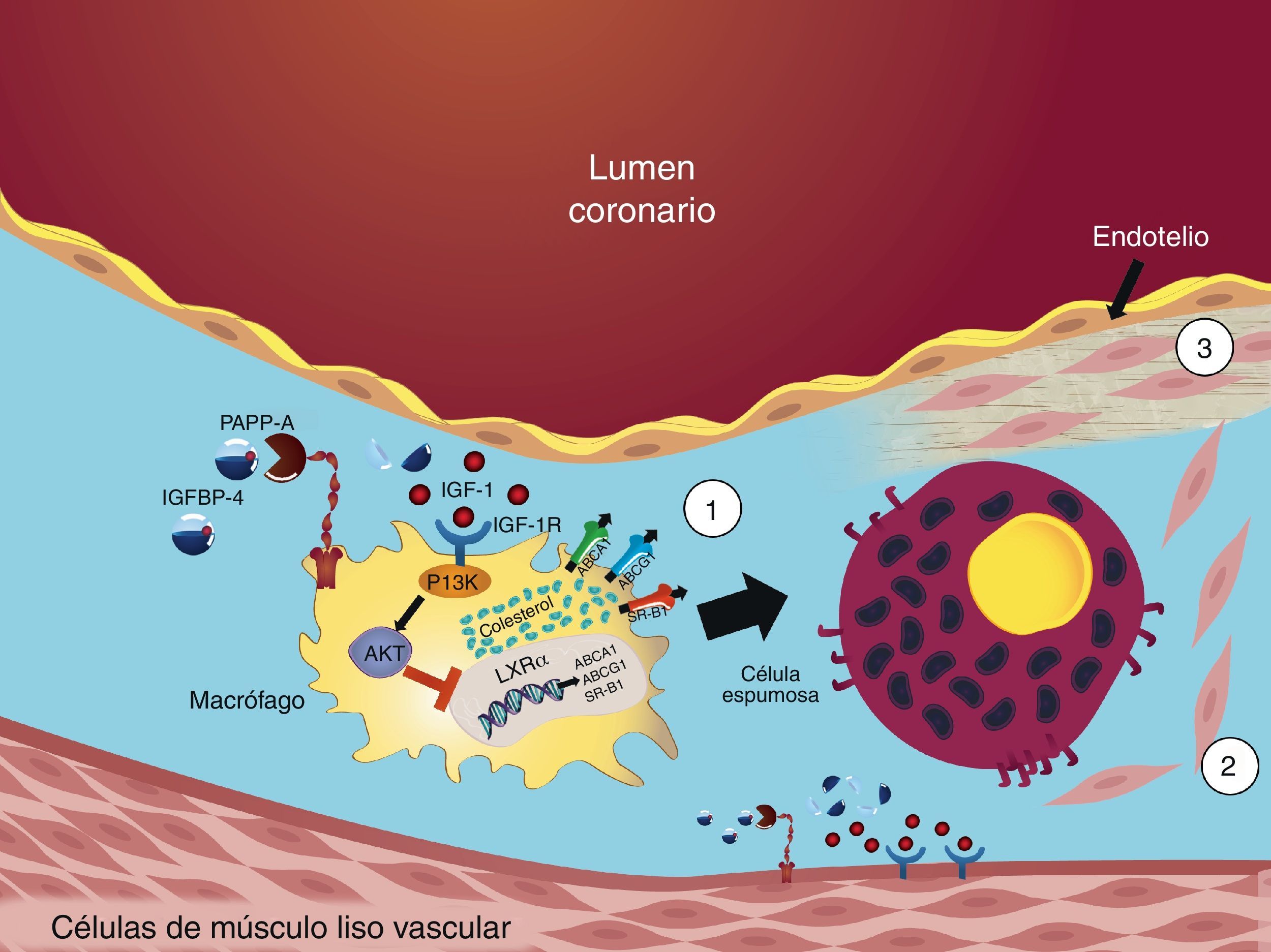
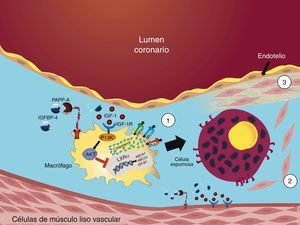
La evidencia discutida hasta este punto se resume en que la interacción de PAPP-A con el sistema IGF en aterosclerosis coronaria ocurre en VSMC (promoviendo la migración y previniendo la apoptosis) y en macrófagos (disminuyendo el TRC y propiciando la formación de células espumosas) (fig. 4).
Mecanismos del sistema IGF y PAPP-A en aterosclerosis coronaria. 1) La actividad proteolítica de PAPP-A contra IGFBP-4 en macrófagos aumenta la biodisponibilidad de IGF-1 y la activación de IGF-1R. El IGF-1R activa a PI3K y este a su vez, activa a Akt. Akt inhibe la expresión de LXRα con la consecuente disminución de la actividad de los receptores ABCA1, ABCG1 y SR-B1; este mecanismo se ve reflejado en una disminución en el transporte reverso de colesterol en macrófagos con la posterior formación de células espumosas. 2) La actividad proteolítica de PAPP-A contra IGFBP-4 en células de músculo liso vascular induce la migración de las mismas de la capa media hacia la capa íntima; 3) además, previene la apoptosis de las células que recubren el núcleo lipídico.
Bayes-Genis et al.75 realizaron un estudio en el que demostraron una marcada expresión de PAPP-A en placas inestables erosionadas o con rotura en comparación de placas estables, donde la expresión de PAPP-A fue mínima; además, los valores plasmáticos de PAPP-A se correlacionaron directamente con los valores de IGF-1. Según sus resultados, se comprueba que PAPP-A se expresa de manera notoria en las placas inestables y que es regulador de la biodisponibilidad de IGF-1. Además, estos resultados han sido reproducibles en múltiples estudios76–78.
Por ende, se puede proponer que las mayores concentraciones plasmáticas de PAPP-A en pacientes con placas inestables se deben a un mecanismo compensatorio del organismo por tratar de disminuir la lesión, promoviendo la migración de VSMC y disminuyendo su apoptosis. En cambio, las concentraciones plasmáticas mínimas de PAPP-A en pacientes con placas estables crónicas ponen de manifiesto el mecanismo del sistema IGF en el TRC de macrófagos, que consiste en promover la formación de placas ateromatosas.
Asimismo, los estudios clínicos que evaluaron los valores plasmáticos de IGF-1 han demostrado una correlación inversa con la cardiopatía isquémica clínicamente detectable pero una correlación directa con la aterosclerosis coronaria en etapas tempranas, lo cual es acorde con el efecto en VSMC y en TRC79–86. Por ejemplo, en un estudio de casos y controles donde se incluyeron 23 pacientes con diagnóstico de infarto agudo de miocardio (<24h desde el inicio de los síntomas) y 11 controles, se observó que los pacientes con infarto presentaron un incremento significativo en las concentraciones plasmáticas de IGF-1 en comparación con los pacientes del grupo control (115±112 vs. 615±300ng/mL, p<0.0001)79. En otro estudio de casos y controles, que incluyó a 231 pacientes con diagnóstico de cardiopatía isquémica y 374 pacientes controles, se evaluaron las concentraciones plasmáticas de IGF-1 en cuartiles: 48-161ng/mL, 162-192ng/mL, 193-226ng/mL y 227-462ng/mL. Después de un periodo de seguimiento de 15 años se demostró que los pacientes en el cuartil más bajo de IGF-1 (48-161ng/mL) se asociaron significativamente con un riesgo mayor de presentar cardiopatía isquémica, probablemente debido a una mayor inestabilidad de la placa80. Además, en un estudio de cohorte prospectivo con 717 pacientes sin antecedente de infarto de miocardio ni insuficiencia cardiaca al inicio del estudio, se observó que valores plasmáticos de IGF-1≥140 μg/L se asociaron con una disminución del 50% para insuficiencia cardiaca, esto debido al efecto antiapoptótico de IGF-1 en cardiomiocitos81.
De forma similar, Kawachi et al.82 realizaron un estudio cuyo objetivo fue evaluar la aterosclerosis carotídea subclínica en 330 pacientes japoneses sin antecedentes de enfermedad cardiovascular. Se realizó la medición del grosor íntima-media con ultrasonido en las arterias carótidas comunes y, según los resultados obtenidos, los pacientes con mayores concentraciones de IGF-1 presentaron más grosor íntima-media. Estos resultados son similares a los reportados por Hietaniemi et al.83 quienes evaluaron las concentraciones plasmáticas de IGF-1 en 1,008 pacientes; aunque la elevación del grosor íntima-media a mayores concentraciones de IGF-1 solo fue significativa en mujeres (p=0.009). Igualmente, los resultados obtenidos en estudios recientes comprueban que los niveles elevados de IGF-1 se asocian significativamente con una mayor estabilidad en las placas ateromatosas84–86.
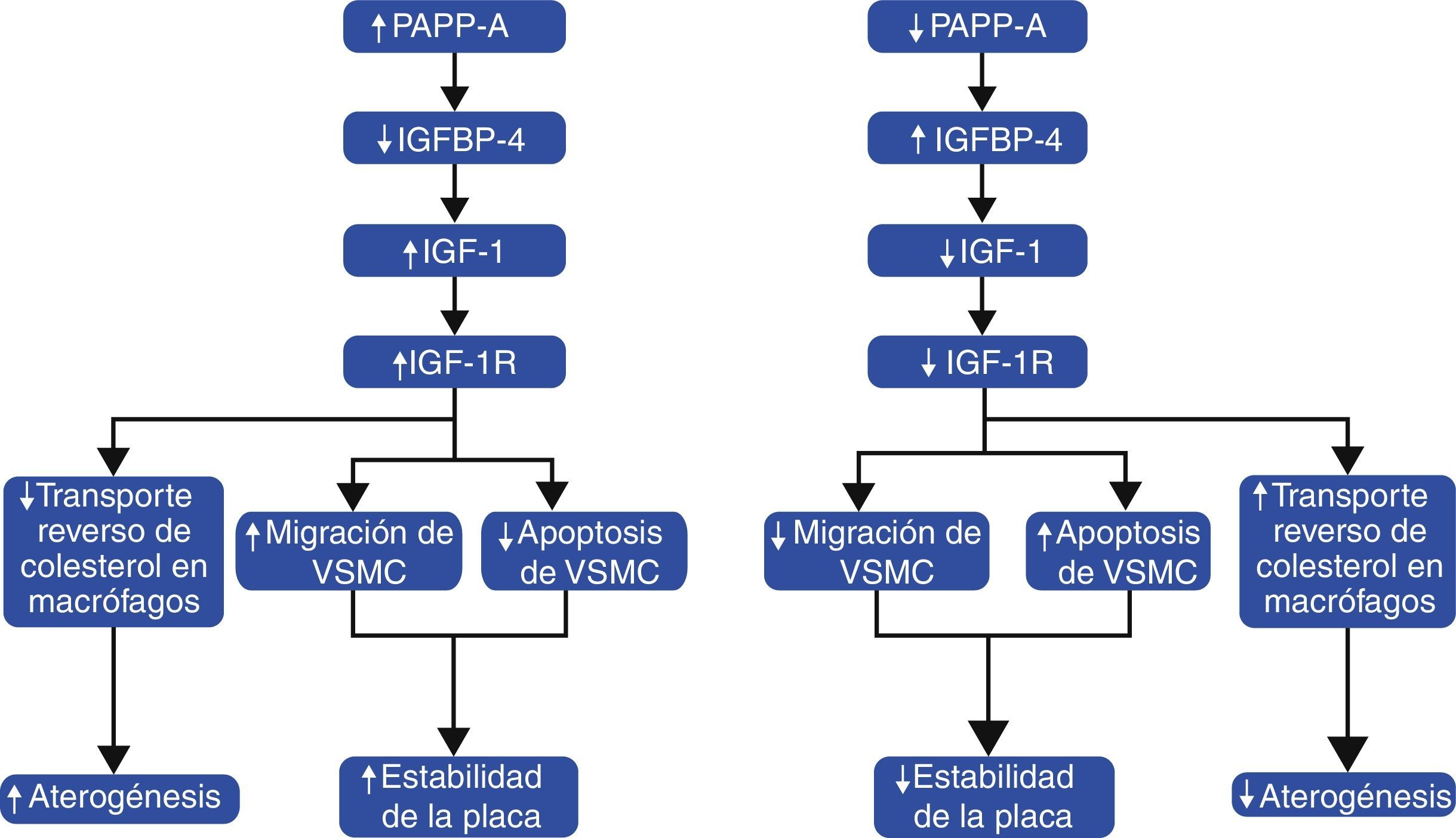
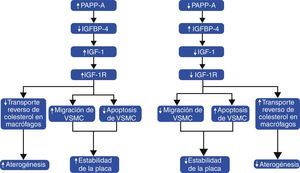
Finalmente, la evidencia sobre la asociación entre el sistema IGF y PAPP-A en aterosclerosis indica que tiene un papel dual. Por un lado, promueve el desarrollo de la aterosclerosis coronaria en etapas tempranas al disminuir el TRC en macrófagos, propiciando la formación de células espumosas, y por otro, participa como un sistema compensatorio para disminuir la lesión endotelial al conferir estabilidad a la placa aterosclerótica mediante la migración y prevención de apoptosis en VSMC (fig. 5). No obstante, el proponer esta vía como blanco terapéutico resultaría complejo debido al papel dual comentado. Aunque la inhibición en la actividad de PAPP-A, IGF-1 y/o IGF-1R pudiera disminuir la progresión de la aterosclerosis coronaria en etapas tempranas, la inhibición de esta vía en las placas crónicas pudiera propiciar su inestabilidad con sus obvias complicaciones clínicas. Sin embargo, su utilidad como marcadores diagnósticos o pronósticos es favorable y resulta factible su futura aplicación en la práctica clínica.
Papel dual de la asociación entre el sistema IGF y PAPP-A en aterosclerosis coronaria. La mayor expresión de PAPP-A aumenta la proteólisis de IGFBP-4 con la consecuente elevación de la biodisponibilidad de IGF-1 y activación de IGF-1R. El receptor IGF-1R promueve la formación de placa ateromatosa al disminuir el transporte reverso de colesterol en macrófagos; sin embargo, incrementa la estabilidad de la placa mediante el aumento en la migración y disminución de la apoptosis en VSMC. Una menor expresión de PAPP-A se refleja en disminución de la aterogénesis pero también en una menor estabilidad de la placa.
La asociación entre el sistema IGF con PAPP-A en aterosclerosis coronaria es compleja y adquiere relevancia en un modelo autocrino o paracrino, donde tanto el IGF-1 como la IGFBP-4 son sintetizados en VSMC y en macrófagos. Esta asociación se ve reflejada en una mayor formación de células espumosas mediante la disminución del TRC en macrófagos, pero también en una mayor estabilidad de las placas ateroescleróticas debido al aumento de la migración de VSMC desde la capa media hacia la capa íntima en las arterias coronarias así como una disminución en su apoptosis.
De esta forma, es plausible que la elevación aguda de las concentraciones plasmáticas de PAPP-A e IGF-1 en eventos de isquemia miocárdica secundarios a erosión o rotura de las placas se deba a un mecanismo compensatorio que trata de limitar la lesión. Además, los valores plasmáticos de IGF-1 presentan una correlación positiva con la aterosclerosis coronaria en etapas tempranas. Por lo tanto, resulta interesante realizar estudios de investigación clínica enfocados a dilucidar la utilidad clínica de estos marcadores en la enfermedad arterial coronaria.
FinanciaciónNinguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.