Evaluar la asociación entre las diferencias de mediciones de 2 ECG separados en el tiempo, con el desarrollo de fibrilación auricular (FA).
MétodoCohorte retrospectiva de 9,975 pacientes adultos, afiliados a la prepaga del Hospital Italiano de Buenos Aires, Argentina, con realización de al menos 2 ECG sinusales digitales entre 2006-2011. Se siguieron clínicamente para la detección de FA. Todas las mediciones electrocardiográficas y los deltas (diferencias entre los 2 ECG) fueron estandarizadas. Se estimaron los hazard ratio para desarrollo de FA, para cada delta de los distintos componentes electrocardiográficos utilizando un modelo de regresión de Cox.
ResultadosDurante una mediana de seguimiento de 3,5 años se detectaron 189 episodios de FA. El delta FC, delta intervalo ST y delta amplitud onda P se asociaron significativamente a FA. Ajustado por características clínicas y mediciones de ECG basal, el hazard ratio ajustado para FA fue 0.86 (IC95%: 0.75-0.98, p=0.024) para delta FC; 1.12 (IC95%0.98-1.27, p=0.082) para delta intervalo ST; y 1.21 (IC95%: 1.05-1.38, p=0.006) para delta amplitud onda P.
ConclusionesLas diferencias FC y amplitud onda P, entre mediciones de ECG, predicen FA en forma independiente de características clínicas y mediciones de ECG basal.
To evaluate the association between delta variations in the parameters of 2 sinusal ECG with atrial fibrillation (AF) onset.
MethodRetrospective cohort of 9,975 adult patients and members of the prepaid system at Hospital Italiano de Buenos Aires from Argentina, who had at least 2 sinusal ECG between 2006 and 2011. Population was followed up for detection of AF. All measurements and electrocardiographic deltas (differences between the 2 ECG) were standardized. Hazard ratio (HR) was estimated for the development of AF for each delta of the different ECG parameters using a Cox regression model.
ResultsDuring a median follow up of 3.5 years, 189 patients (1.89%) developed AF. Heart rate delta, ST interval delta and P wave amplitude were predictors of AF. Hazard ratio Adjusted for clinical characteristics and ECGbasal values was 0,86 (CI95%: 0.75-0.98, p=0.024) for heart rate delta, 1.12 (CI95%: 0.98-1.27, p=0.082) for ST interval delta and 1.21 (CI95%: 1.05-1.38, p=0.006) for P wave amplitude delta.
ConclusionDifferences of heart rate and P wave amplitude between ECG's measurements may predict AF, independently of clinical features and ECGbasal values.
La fibrilación auricular (FA) es la arritmia más frecuente de la práctica clínica, afecta aproximadamente al 1% de los adultos. Se conoce que el riesgo aumenta con la edad1,2 y la enfermedad subyacente del corazón3, y que los pacientes afectados tienen mayor riesgo de mortalidad y morbilidad cardiovascular, insuficiencia cardíaca y eventos tromboembólicos4,5. Genera una carga importante para los sistemas de salud, con una incidencia y prevalencia en aumento en todo el mundo6–8. De hecho, los pacientes con FA tienen que ser hospitalizados frecuentemente y se ha estimado que en EE. UU. las hospitalizaciones por esta causa aumentaron un 23% entre 2000 y 20109.
La mayoría de los pacientes que desarrollan FA presentan cambios microarquitecturales y anisotrópicos en el miocardio auricular que ocurren lentamente en el tiempo. Estos causan alteraciones heterogéneas y discontinuas en los patrones de propagación del impulso, activación auricular heterogénea y acortamiento del periodo refractario auricular10,11. La diferencia entre 2 electrocardiogramas (ECG) convencionales del mismo individuo separados en el tiempo podría reflejar estos cambios y aportar información útil para la detección de pacientes en riesgo de desarrollo de FA12.
Debido a que estos cambios paulatinos podrían ser imperceptibles o pasar inadvertidos a la inspección visual de 2 trazados electrocardiográficos, nos propusimos estudiar el efecto de las variaciones de mediciones automáticas entre 2 ECG sobre el desarrollo de FA en una cohorte retrospectiva de adultos de una población cautiva.
MétodosSe diseñó una cohorte retrospectiva de pacientes>18 años, pertenecientes a la prepaga Plan de Salud (PS) del Hospital Italiano de Buenos Aires, que tuvieran registro de al menos 2 ECG durante el periodo de reclutamiento en el que se obtuvieron los registros ECG entre 2006 y 2011. Se excluyeron los ECG con ritmo diferente al sinusal.
El Hospital Italiano de Buenos Aires es un hospital universitario de alta complejidad (tercer nivel), que ofrece servicios médicos integrales a una población de 150,000 afiliados a la prepaga PS en Buenos Aires, Argentina. La población del PS tiene atención exclusiva dentro del sistema del hospital. Toda la información clínica (como, por ejemplo, diagnósticos clínicos, laboratorios, estudios, evoluciones, internaciones, atenciones no programadas) y administrativa es recolectada y almacenada en un único repositorio de datos accesible a través de la historia clínica electrónica. Los diagnósticos clínicos son codificados en tiempo real utilizando un servidor de terminología y se mapean con vocabulario controlado SNOMED. Toda la información del estudio se obtuvo del repositorio de datos de la historia clínica electrónica.
Se recuperaron consecutivamente la totalidad de los ECG de afiliados activos al PS durante el periodo de reclutamiento en el ámbito ambulatorio (evaluación prequirúrgica y/o ECG de rutina). Se obtuvieron ECG de 12 derivaciones simultáneas de 15seg con electrocardiógrafos digitales Exxer13. Se seleccionaron las derivaciones unipolares de los miembros aVR, aVL y AVF y las derivaciones bipolares DI, DII y DIII. No se utilizaron las derivaciones precordiales debido a la variabilidad en la posición de los electrodos que puede provocar cambios apreciables entre 2 ECG diferentes y sucesivos realizados al mismo individuo.
El registro analógico presenta un ancho de banda de 0.05-150Hz (± 10%) en el amplificador de entrada y una relación de rechazo de modo común mayor a 100dB. La digitalización se realiza a una frecuencia de muestreo de 1,200Hz con un submuestreo posterior a 300Hz con 12 bits de resolución y 5micro volts/lsb de sensibilidad. Todas las señales fueron procesadas con algoritmos de filtro rechaza banda en 50Hz, filtro pasa bajos con frecuencia de corte a 40Hz y filtro pasa altos con frecuencia de corte a 0.25Hz, para disminuir la incidencia de alteraciones ajenas al ECG de diverso origen (red eléctrica, actividad muscular esquelética, deriva de línea de base, entre otras)14,15.
Entre todos los ECG del mismo individuo durante el periodo de reclutamiento, se seleccionaron solo 2: designados como ECGanterior y ECGposterior. Todos los ECG adicionales no fueron considerados en este análisis. Los cambios entre los ECG se calcularon cuantificando la diferencia (delta) entre la medición en el ECGposterior y el ECGanterior. Se tuvieron en cuenta los deltas para: duración de la onda P, QRS, ST y onda T; los intervalos PR, QRS, ST, QT, QTc; y amplitudes de las ondas P, R y T.
En los pacientes que desarrollaron FA, se definió como ECGposterior el último ECG con ritmo sinusal previo al desarrollo de FA. En los pacientes que no desarrollaron FA, se definió como ECGposterior el último ECG sinusal dentro del periodo de reclutamiento. En ambos casos se consideró como ECGanterior al primer ECG sinusal realizado dentro de los 24 meses previos al elegido como ECGposterior para cada paciente. Debido a que se trata de una cohorte clínica, no existían periodos fijos de tiempo entre ambos ECG.
Se realizó el análisis descriptivo, se presentaron las variables categóricas como cantidad y porcentaje, mientras que las variables continuas lo fueron como media y desvíación estándar o mediana e intervalo intercuartílico, según distribución observada.
El seguimiento se realizó desde el ECGposterior hasta el diagnóstico de FA, desafiliación por cualquier causa o fecha de censura administrativa (19/08/2011). Se definió desarrollo de FA por la evidencia electrocardiográfica de la misma, constatada durante el seguimiento del paciente con el patrón característico: ausencia de onda P en el trazado ECG, presencia de ondas f (frecuencia entre 350 y 600 por minuto) de amplitud y morfología variables, e intervalos RR irregulares16. Todas las FA detectadas fueron reconfirmadas por evaluación de la historia clínica electrónica del paciente.
Todas las mediciones de ECG y los deltas fueron estandarizadas (a cada medición se le restó la media y se dividió por la desviación estándar para expresarlo en unidades de Z o desviación estándar) para medir su impacto con el desarrollo de FA. Se evaluó la asociación univariada de los deltas de las mediciones electrocardiográficas y el desarrollo de FA con un modelo de riesgos proporcionales de Cox. Se realizó adicionalmente un análisis multivariado para ajustar por confundidores (edad, sexo, obesidad, tensión arterial sistólica, hipertensión arterial, insuficiencia cardíaca, valvulopatía, infarto agudo de miocardio, colesterol LDL, y tiempo entre ECG). Se presentan los hazard ratios con sus intervalos de confianza de 95% (IC95%) estimados. El análisis estadístico se realizó utilizando STATA 12.0.
El protocolo fue evaluado y aprobado por un Comité de Ética de Protocolos de Investigación independiente y registrado en ClinicalTrials.gov con el número NCT01405209.
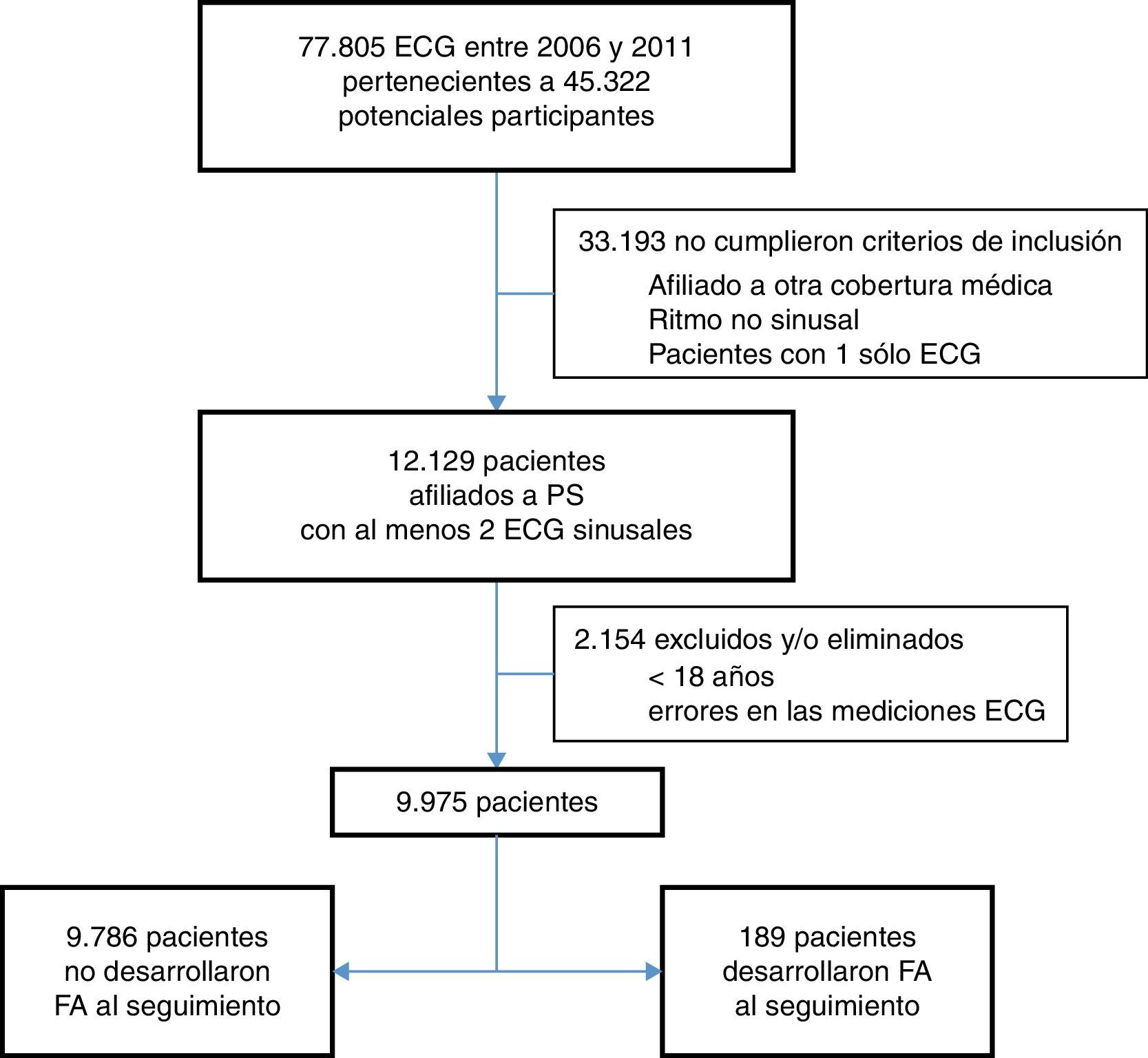
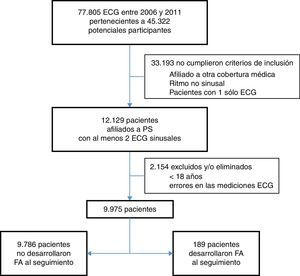
ResultadosSe preseleccionaron 77,805 ECG realizados en áreas ambulatorias entre 2006 y 2011, correspondientes a 45,322 pacientes potenciales participantes. Sin embargo, 33,193 pacientes no cumplieron criterios de inclusión debido a: edad<18 años, eran afiliados de otras obras coberturas médicas (no PS), los ECG no presentaban ritmo sinusal, y/o solo había un ECG aislado por paciente. Restaron 12,129 pacientes con al menos 2 ECG sinusales, de los cuales adicionalmente se excluyeron 2,154 por varias razones: tiempo entre ECG<24h, y/o presentaban errores de las mediciones según datos del informe, y/o tenían antecedente de FA previo (pese a los ECG sinusales). Por lo que quedaron un total 9,975 pacientes incluidos en este estudio (fig. 1).
Flujograma de pacientes incluidos. Durante el periodo del estudio (2006-2011) se realizaron 77,805 electrocardiogramas en áreas ambulatorias. Finalmente se incluyeron en el análisis 9,975 pacientes que cumplieron todos los criterios de inclusión y ninguno de exclusión, con al menos 2 ECG sinusales.
La mediana de edad fue 70 años (rango intercuartílico 19.21) de los cuales 61.2% (6,103) eran mujeres. La mediana de tiempo de seguimiento fue de 3.5 años (rango intercuartílico 1.8; entre 14.6 días y 4.68 años). La mediana de tiempo entre el ECGanterior y el ECGposterior fue de 690 días (rango intercuartílico 680; percentil25,362-percentil75 1,042). Se detectaron un total de 189 episodios de FA durante el periodo de seguimiento, con una prevalencia del 1.89% (IC95%: 1.63-2.18).
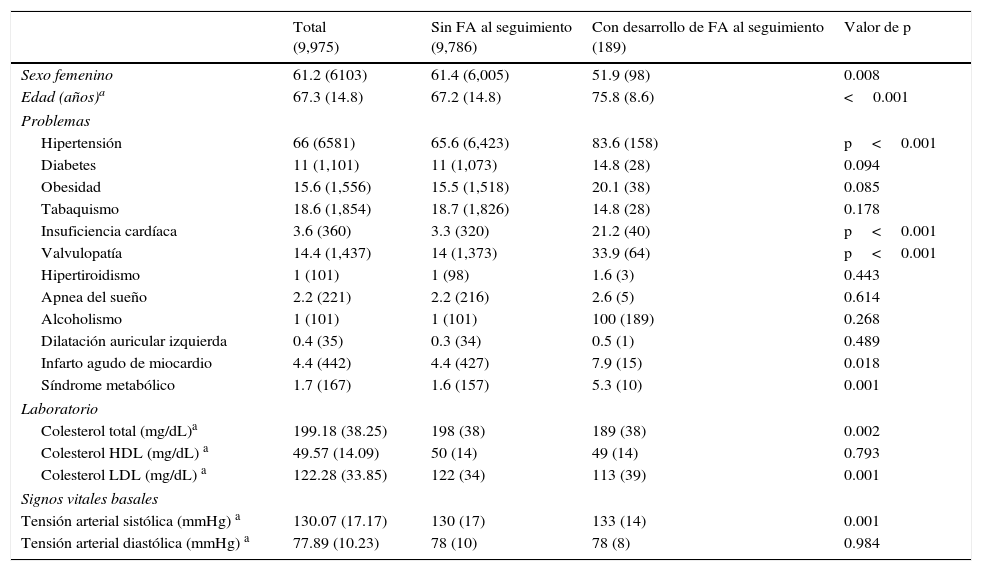
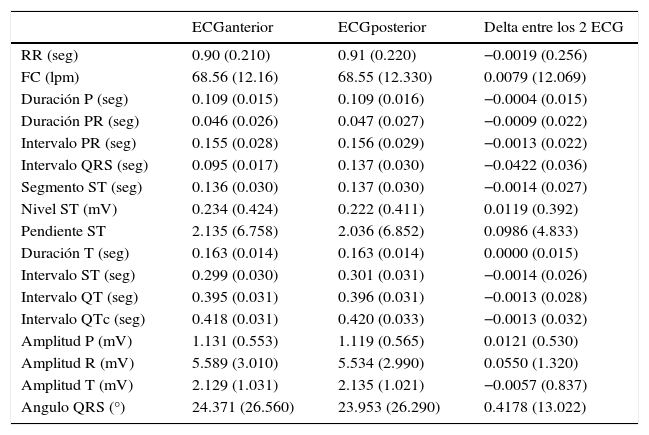
La tabla 1a describe las características basales de la totalidad de la población incluida en el estudio, y según subgrupo de pacientes que desarrollaron FA o no, durante el periodo de seguimiento. La presencia de hipertensión arterial, insuficiencia cardíaca, valvulopatía/s, infarto agudo de miocardio, síndrome metabólico, colesterol total, colesterol LDL y la tensión arterial sistólica fueron significativamente diferentes entre ambos grupos. La tabla 1b describe las mediciones basales del ECGanterior y ECGposterior de toda la población, con sus respectivos diferencias o deltas. En la tabla 2 se presentan los deltas entre mediciones de ambos ECG, divididas en los pacientes que desarrollaron FA y los que no, durante el periodo de seguimiento.
Características basales de pacientes incluidos
| Total (9,975) | Sin FA al seguimiento (9,786) | Con desarrollo de FA al seguimiento (189) | Valor de p | |
|---|---|---|---|---|
| Sexo femenino | 61.2 (6103) | 61.4 (6,005) | 51.9 (98) | 0.008 |
| Edad (años)a | 67.3 (14.8) | 67.2 (14.8) | 75.8 (8.6) | <0.001 |
| Problemas | ||||
| Hipertensión | 66 (6581) | 65.6 (6,423) | 83.6 (158) | p<0.001 |
| Diabetes | 11 (1,101) | 11 (1,073) | 14.8 (28) | 0.094 |
| Obesidad | 15.6 (1,556) | 15.5 (1,518) | 20.1 (38) | 0.085 |
| Tabaquismo | 18.6 (1,854) | 18.7 (1,826) | 14.8 (28) | 0.178 |
| Insuficiencia cardíaca | 3.6 (360) | 3.3 (320) | 21.2 (40) | p<0.001 |
| Valvulopatía | 14.4 (1,437) | 14 (1,373) | 33.9 (64) | p<0.001 |
| Hipertiroidismo | 1 (101) | 1 (98) | 1.6 (3) | 0.443 |
| Apnea del sueño | 2.2 (221) | 2.2 (216) | 2.6 (5) | 0.614 |
| Alcoholismo | 1 (101) | 1 (101) | 100 (189) | 0.268 |
| Dilatación auricular izquierda | 0.4 (35) | 0.3 (34) | 0.5 (1) | 0.489 |
| Infarto agudo de miocardio | 4.4 (442) | 4.4 (427) | 7.9 (15) | 0.018 |
| Síndrome metabólico | 1.7 (167) | 1.6 (157) | 5.3 (10) | 0.001 |
| Laboratorio | ||||
| Colesterol total (mg/dL)a | 199.18 (38.25) | 198 (38) | 189 (38) | 0.002 |
| Colesterol HDL (mg/dL) a | 49.57 (14.09) | 50 (14) | 49 (14) | 0.793 |
| Colesterol LDL (mg/dL) a | 122.28 (33.85) | 122 (34) | 113 (39) | 0.001 |
| Signos vitales basales | ||||
| Tensión arterial sistólica (mmHg) a | 130.07 (17.17) | 130 (17) | 133 (14) | 0.001 |
| Tensión arterial diastólica (mmHg) a | 77.89 (10.23) | 78 (10) | 78 (8) | 0.984 |
Todos los valores se presentan como frecuencia relativa % (frecuencia absoluta), excepto los marcados con a que se presentan como promedios (desviación estándar).
Características del ECGanterior, ECGposterior y la diferencia entre las 2 mediciones de ambos o delta. Todas se presentan para la totalidad de los 9,975 pacientes incluidos
| ECGanterior | ECGposterior | Delta entre los 2 ECG | |
|---|---|---|---|
| RR (seg) | 0.90 (0.210) | 0.91 (0.220) | −0.0019 (0.256) |
| FC (lpm) | 68.56 (12.16) | 68.55 (12.330) | 0.0079 (12.069) |
| Duración P (seg) | 0.109 (0.015) | 0.109 (0.016) | −0.0004 (0.015) |
| Duración PR (seg) | 0.046 (0.026) | 0.047 (0.027) | −0.0009 (0.022) |
| Intervalo PR (seg) | 0.155 (0.028) | 0.156 (0.029) | −0.0013 (0.022) |
| Intervalo QRS (seg) | 0.095 (0.017) | 0.137 (0.030) | −0.0422 (0.036) |
| Segmento ST (seg) | 0.136 (0.030) | 0.137 (0.030) | −0.0014 (0.027) |
| Nivel ST (mV) | 0.234 (0.424) | 0.222 (0.411) | 0.0119 (0.392) |
| Pendiente ST | 2.135 (6.758) | 2.036 (6.852) | 0.0986 (4.833) |
| Duración T (seg) | 0.163 (0.014) | 0.163 (0.014) | 0.0000 (0.015) |
| Intervalo ST (seg) | 0.299 (0.030) | 0.301 (0.031) | −0.0014 (0.026) |
| Intervalo QT (seg) | 0.395 (0.031) | 0.396 (0.031) | −0.0013 (0.028) |
| Intervalo QTc (seg) | 0.418 (0.031) | 0.420 (0.033) | −0.0013 (0.032) |
| Amplitud P (mV) | 1.131 (0.553) | 1.119 (0.565) | 0.0121 (0.530) |
| Amplitud R (mV) | 5.589 (3.010) | 5.534 (2.990) | 0.0550 (1.320) |
| Amplitud T (mV) | 2.129 (1.031) | 2.135 (1.021) | −0.0057 (0.837) |
| Angulo QRS (°) | 24.371 (26.560) | 23.953 (26.290) | 0.4178 (13.022) |
lpm: latidos por minuto; mV: milivoltios; seg: segundos (seg); ¿: grados.
Todos los valores se presentan como promedios (desviación estándar).
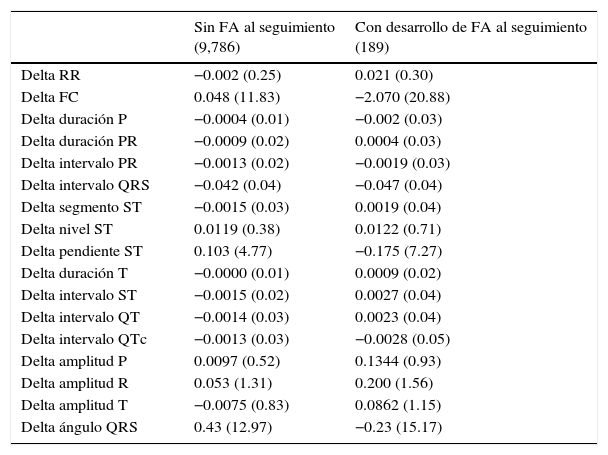
Comparación de deltas de mediciones de ECG entre pacientes que desarrollaron o no FA durante el seguimiento
| Sin FA al seguimiento (9,786) | Con desarrollo de FA al seguimiento (189) | |
|---|---|---|
| Delta RR | −0.002 (0.25) | 0.021 (0.30) |
| Delta FC | 0.048 (11.83) | −2.070 (20.88) |
| Delta duración P | −0.0004 (0.01) | −0.002 (0.03) |
| Delta duración PR | −0.0009 (0.02) | 0.0004 (0.03) |
| Delta intervalo PR | −0.0013 (0.02) | −0.0019 (0.03) |
| Delta intervalo QRS | −0.042 (0.04) | −0.047 (0.04) |
| Delta segmento ST | −0.0015 (0.03) | 0.0019 (0.04) |
| Delta nivel ST | 0.0119 (0.38) | 0.0122 (0.71) |
| Delta pendiente ST | 0.103 (4.77) | −0.175 (7.27) |
| Delta duración T | −0.0000 (0.01) | 0.0009 (0.02) |
| Delta intervalo ST | −0.0015 (0.02) | 0.0027 (0.04) |
| Delta intervalo QT | −0.0014 (0.03) | 0.0023 (0.04) |
| Delta intervalo QTc | −0.0013 (0.03) | −0.0028 (0.05) |
| Delta amplitud P | 0.0097 (0.52) | 0.1344 (0.93) |
| Delta amplitud R | 0.053 (1.31) | 0.200 (1.56) |
| Delta amplitud T | −0.0075 (0.83) | 0.0862 (1.15) |
| Delta ángulo QRS | 0.43 (12.97) | −0.23 (15.17) |
Todas las mediciones se presentan como promedios (desviación estándar).
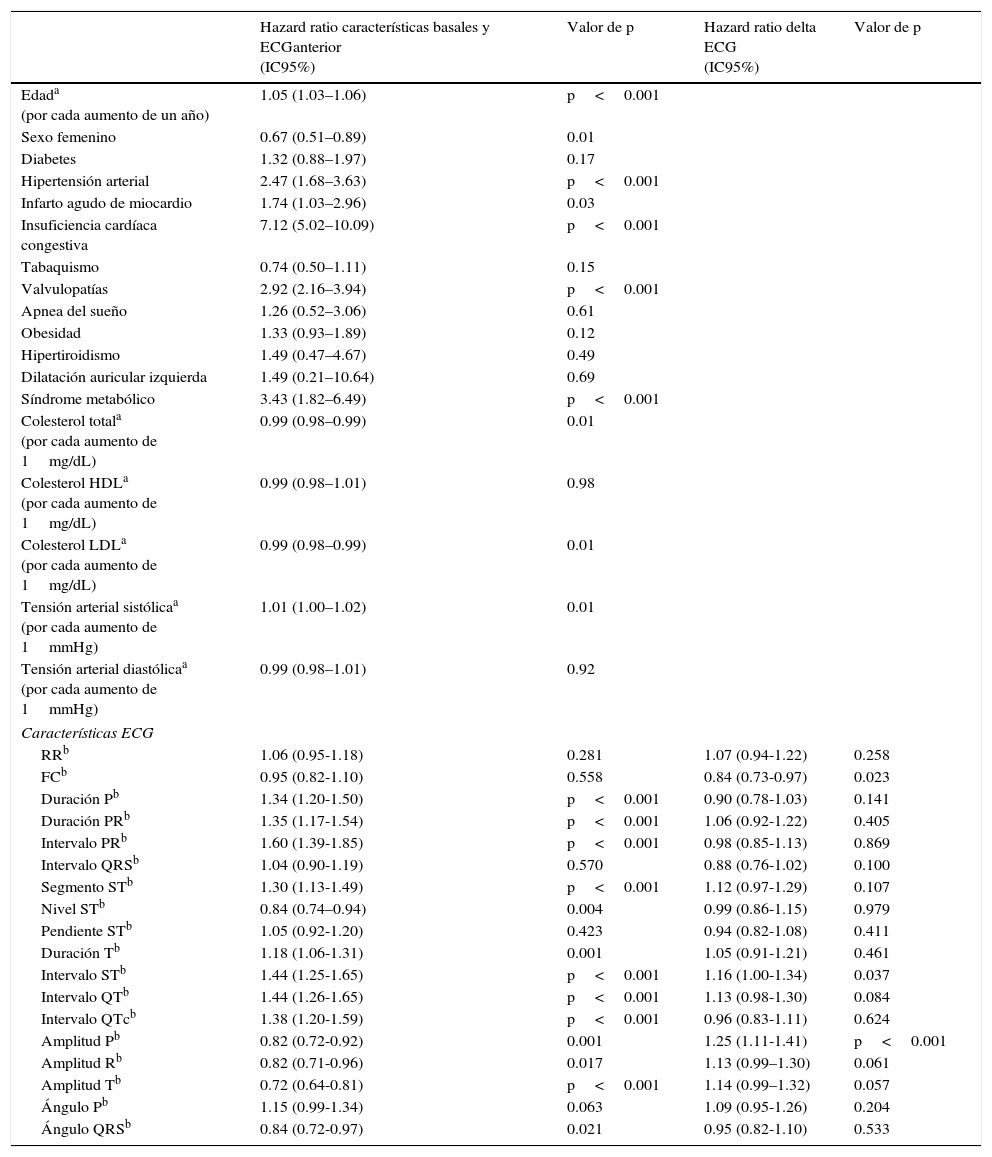
En la tabla 3 se presentan las medidas de asociación crudas (HR con sus intervalos de confianza) para desarrollo de FA y las características clínicas basales, las mediciones del ECGanterior y los deltas entre ambos ECG sinusales.
Se presentan los hazard ratios crudos de las mediciones electrocardiográficas basales (ECGanterior) y de los deltas para el desarrollo de fibrilación auricular
| Hazard ratio características basales y ECGanterior (IC95%) | Valor de p | Hazard ratio delta ECG (IC95%) | Valor de p | |
|---|---|---|---|---|
| Edada (por cada aumento de un año) | 1.05 (1.03–1.06) | p<0.001 | ||
| Sexo femenino | 0.67 (0.51–0.89) | 0.01 | ||
| Diabetes | 1.32 (0.88–1.97) | 0.17 | ||
| Hipertensión arterial | 2.47 (1.68–3.63) | p<0.001 | ||
| Infarto agudo de miocardio | 1.74 (1.03–2.96) | 0.03 | ||
| Insuficiencia cardíaca congestiva | 7.12 (5.02–10.09) | p<0.001 | ||
| Tabaquismo | 0.74 (0.50–1.11) | 0.15 | ||
| Valvulopatías | 2.92 (2.16–3.94) | p<0.001 | ||
| Apnea del sueño | 1.26 (0.52–3.06) | 0.61 | ||
| Obesidad | 1.33 (0.93–1.89) | 0.12 | ||
| Hipertiroidismo | 1.49 (0.47–4.67) | 0.49 | ||
| Dilatación auricular izquierda | 1.49 (0.21–10.64) | 0.69 | ||
| Síndrome metabólico | 3.43 (1.82–6.49) | p<0.001 | ||
| Colesterol totala (por cada aumento de 1mg/dL) | 0.99 (0.98–0.99) | 0.01 | ||
| Colesterol HDLa (por cada aumento de 1mg/dL) | 0.99 (0.98–1.01) | 0.98 | ||
| Colesterol LDLa (por cada aumento de 1mg/dL) | 0.99 (0.98–0.99) | 0.01 | ||
| Tensión arterial sistólicaa (por cada aumento de 1mmHg) | 1.01 (1.00–1.02) | 0.01 | ||
| Tensión arterial diastólicaa (por cada aumento de 1mmHg) | 0.99 (0.98–1.01) | 0.92 | ||
| Características ECG | ||||
| RRb | 1.06 (0.95-1.18) | 0.281 | 1.07 (0.94-1.22) | 0.258 |
| FCb | 0.95 (0.82-1.10) | 0.558 | 0.84 (0.73-0.97) | 0.023 |
| Duración Pb | 1.34 (1.20-1.50) | p<0.001 | 0.90 (0.78-1.03) | 0.141 |
| Duración PRb | 1.35 (1.17-1.54) | p<0.001 | 1.06 (0.92-1.22) | 0.405 |
| Intervalo PRb | 1.60 (1.39-1.85) | p<0.001 | 0.98 (0.85-1.13) | 0.869 |
| Intervalo QRSb | 1.04 (0.90-1.19) | 0.570 | 0.88 (0.76-1.02) | 0.100 |
| Segmento STb | 1.30 (1.13-1.49) | p<0.001 | 1.12 (0.97-1.29) | 0.107 |
| Nivel STb | 0.84 (0.74–0.94) | 0.004 | 0.99 (0.86-1.15) | 0.979 |
| Pendiente STb | 1.05 (0.92-1.20) | 0.423 | 0.94 (0.82-1.08) | 0.411 |
| Duración Tb | 1.18 (1.06-1.31) | 0.001 | 1.05 (0.91-1.21) | 0.461 |
| Intervalo STb | 1.44 (1.25-1.65) | p<0.001 | 1.16 (1.00-1.34) | 0.037 |
| Intervalo QTb | 1.44 (1.26-1.65) | p<0.001 | 1.13 (0.98-1.30) | 0.084 |
| Intervalo QTcb | 1.38 (1.20-1.59) | p<0.001 | 0.96 (0.83-1.11) | 0.624 |
| Amplitud Pb | 0.82 (0.72-0.92) | 0.001 | 1.25 (1.11-1.41) | p<0.001 |
| Amplitud Rb | 0.82 (0.71-0.96) | 0.017 | 1.13 (0.99–1.30) | 0.061 |
| Amplitud Tb | 0.72 (0.64-0.81) | p<0.001 | 1.14 (0.99–1.32) | 0.057 |
| Ángulo Pb | 1.15 (0.99-1.34) | 0.063 | 1.09 (0.95-1.26) | 0.204 |
| Ángulo QRSb | 0.84 (0.72-0.97) | 0.021 | 0.95 (0.82-1.10) | 0.533 |
Con excepto de las variables marcadas con una a que se presentan sin estandarizar, todas las variables continuas fueron estandarizadas (b).
Todos los hazard ratios de las variables continuas fueron estimados para un aumento en una desviación estándar de cada variable explicativa.
En el análisis univariado las variables clínicas que resultaron predictoras de FA fueron edad, sexo femenino, hipertensión arterial, infarto agudo de miocardio, insuficiencia cardíaca congestiva, valvulopatía, síndrome metabólico, colesterol total, LDL, y tensión arterial sistólica.
De todas las variables medidas en el ECGanterior que se asociaron significativamente al desarrollo de FA en el análisis univariado, al incorporarlas todas juntas en un modelo de regresión multivariado, solo permanecieron como estadísticamente significativas para el desarrollo de FA: HR ajustado 0.71 (IC95%: 0.58-0-85, p<0.001) para la amplitud de onda P; y HR ajustado 1.63 (IC95%: 1.36-1.97, p<0.001) para el ángulo de onda P.
Con respecto a los deltas, el delta de frecuencia cardíaca, delta de intervalo ST y el delta de la amplitud de la onda P se asociaron significativamente al desarrollo de FA en el análisis univariado. Se ajustaron los deltas significativos en el análisis univariado por las características clínicas basales y las mediciones del ECGanterior significativas. Ajustado por edad, sexo, obesidad, hipertensión arterial, tensión arterial sistólica, insuficiencia cardíaca congestiva, valvulopatías, infarto agudo de miocardio, tiempo entre ECG, colesterol LDL sérico, amplitud de onda P basal y ángulo de onda P basal. El HR ajustado para desarrollo de FA fue de 0.86 (IC95%: 0.75-0.98, p=0.024) para el delta de frecuencia cardíaca, de 1.12 (IC95%: 0.98-1.27, p=0.082) para el delta del intervalo ST, y de 1.21 (IC95%: 1.05-1.38, p=0.006) para el delta de amplitud de onda P.
DiscusiónNuestros hallazgos evidencian que al tomar 2 ECG separados en el tiempo de un mismo paciente, las diferencias entre mediciones de la amplitud de la onda P y el delta de frecuencia cardíaca, son predictores independientes de futura aparición de FA, ajustado por características clínicas y mediciones del ECG basal.
Desde 1911, el ECG convencional17 (aproximadamente 15seg de registro y ancho banda 0.05-150Hz) es la herramienta más utilizada para la evaluación de pacientes con arritmias, debido a su bajo costo y alta disponibilidad. Se conocen distintos patrones electrocardiográficos predictores de FA evidenciables por la inspección visual directa, por ejemplo la prolongación de la duración de la onda P durante el ritmo sinusal se correlacionaría con cambios estructurales como aumento del tamaño de la cavidad auricular izquierda (aumento de la presión en la aurícula izquierda) o con disminución del tiempo de conducción18. Estos cambios favorecerían la aparición de circuitos de reentrada, responsables del desarrollo y del mantenimiento de FA.
El registro de la actividad eléctrica cardíaca a través del ECG convencional aporta mayor información que la evidenciable por inspección visual directa. El procesamiento de estas bioseñales mediante técnicas específicas permite detectar potenciales eléctricos anormales causados por retrasos en la conducción del miocardio que favorecerían los mecanismos de reentradas19–23. Para ello se utilizan ECG prolongados con 1,000Hz de frecuencia de muestreo. El conocimiento sobre la predicción del desarrollo de FA con el ECG estándar no evidente en la inspección visual es limitado. La creciente disponibilidad de ECG convencionales digitales constituye una oportunidad única, ya que es posible desarrollar herramientas informáticas que podrían incorporar en el informe automático la presencia de factores de riesgo en trazados del ECG no evidenciables por inspección visual directa.
Si bien los cambios entre 2 ECG fueron poco explorados, las mediciones objetivas de un ECG puntual están más estudiadas. Algunos autores, en concordancia con nuestros hallazgos, sugieren que cuanto mayor sea el tiempo de conducción intraauricular mayor es la posibilidad de desarrollar FA24. Sin embargo, otros autores que analizaron tanto la duración como la dispersión de la onda P, solo encontraron que la duración de la onda P resultó predictora independiente de desarrollo de FA25. Las variaciones en la frecuencia cardíaca podrían correlacionarse con los cambios en el tono autonómico y de esa forma contribuir al desarrollo de la FA26. Sin embargo, ninguno de estos estudios evaluó el efecto del cambio de estos parámetros entre 2 ECG del mismo paciente.
Un estudio de 200922 identificó que los predictores más fuertes de FA fueron el índice de la onda P (la diferencia entre las ondas P más anchas y más estrechas, que representa una medición de despolarización auricular desorganizada) y la duración de la onda P. Sin embargo, presentaba algunas limitaciones tales como: los pacientes con FA tenían un aumento de 3 veces en el número de ECG realizados (es posible que un control más frecuente pueda tener aumento en la probabilidad de detectar FA), el diagnóstico de la FA se basó en la interpretación computarizada (aunque eficiente para una gran población, se ha producido en un cierto grado de clasificación errónea), y característica de población incluida (cohorte predominantemente de hombre, raza blanca, y veteranos de guerra). Nuestro estudio representa población general (si bien son pacientes afiliados a prepaga en la que predominan adultos mayores) y las evaluaciones de FA fueron detectadas clínicamente y confirmadas por cardiólogo especialista en electrofisiología.
La predicción del comienzo de FA basado en técnicas no invasivas es clínicamente relevante y podría ser de gran valor para evitar el uso innecesario de intervenciones y minimizar el riesgo para los pacientes27. Actualmente existen modelos de predicción para desarrollo de FA utilizando el Framingham Heart Study28,29, que predice el riesgo absoluto a 10 años de una persona e incluye variables como: edad, sexo, tensión arterial sistólica, tratamiento antihipertensivo, intervalo PR, soplo cardíaco clínicamente significativo, índice de masa corporal e insuficiencia cardíaca. Este modelo ha sido validado en 2 diversas cohortes geográficas y raciales, en el rango de edad de 45-95 años, y predijo la incidencia a 5 años de la FA con una precisión moderada (estadístico C: 0.66-0.68)29,30.
La principal limitación de este estudio radica en que toda la información evaluada se obtuvo de bases de datos secundarias, no habiéndose podido ajustar por la totalidad de las características clínicas ya conocidas como predictores de FA. Probablemente hubiera aportado información adicional considerar otras variables no disponibles, como la indicación del ECG (discriminar entre solicitud en forma rutinaria, motivo de consulta y/o paciente sintomático), consumo de betabloqueantes, marcadores ecocardiográficos. Tampoco se dispuso de información relativa a la duración de la FA desarrollada, si esta fue sintomática o no, o su carácter (persistente o permanente).
En muchos modelos de regresión multivariados, las unidades naturales de las variables independientes puede hacer que los HR de cada variable tengan mucha variabilidad en magnitud, lo que dificulta la comparación entre los efectos de distintas variables explicativas entre sí. La estandarización de todas las variables explicativas continuas incorporadas en los modelos permitió comparar directamente la magnitud del efecto de cada medición, incluyendo los deltas. Este paso permite considerar cada HR como el incremento de riesgo por cada aumento en una unidad de desviación estándar de la variable explicativo. Creemos que es un paso fundamental ya que independiza de las unidades de medición, y expresa homogéneamente el efecto de cada variable explicativa en unidades de desviación estándar.
En concordancia con muchos estudios previos, en nuestro estudio muchas características del ECG basal se asocian a desarrollo de FA de manera individual. Solo 2 de ellas fueron predictores independientes al incorporarlas todas las mediciones del ECGanterior juntas en un modelo predictivo: la amplitud y el ángulo de la onda P. Probablemente gran parte de la información predictiva de desarrollo de FA se encuentre en el ECGanterior, no agregando demasiada información el cambio con respecto al ECGposterior. Sin embargo, ajustado por predictores clínicos y mediciones de ECGanterior, 2 características son predictores independientes para el desarrollo de FA: delta de frecuencia cardíaca y delta de amplitud de onda P. Estos resultados no habían sido descriptos previamente y abren un campo a explorar con respecto cambios sutiles de ECG convencionales de superficie que reflejan cambios en la estructura o histoarquitectura miocárdica que podrían predisponer a distintos eventos. Estos hallazgos deberían ser confirmados en cohortes sistemáticas de individuos sanos sin enfermedad, ya que en nuestra cohorte gran parte de la información predictiva ya se encontraba en las mediciones del ECGanterior.
De alguna manera, nuestros hallazgos sustentarían el desarrollo de posteriores estudios de bioseñales en profundidad en esta enfermedad y el valor de análisis más profundos sobre los ECG de superficie digitales.
ConclusionesLas diferencias de frecuencia cardíaca y amplitud de onda P, entre 2 mediciones automáticas de ECG digitales con ritmo sinusal, fueron predictores de desarrollo de FA en forma independiente de las características clínicas y de las mediciones del ECG basal.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesEste estudio no recibió financiamiento, y los autores declaran que no hubo conflicto de intereses.
A todas las personas que colaboraron en el proyecto brindando ayuda técnica como asistencia en la redacción del manuscrito, y a los jefes que brindaron apoyo general.