Introducción
El tratamiento de los síndromes coronarios agudos (SICA) ha evolucionado de forma importante en los últimos veinte años.1,2 El conocimiento de los mecanismos intrínsecos de la hemostasia, ruptura de la placa aterosclerosa y su repercusión, ha permitido el desarrollo de fármacos y estrategias cada vez más potentes que, en conjunto, han mejorado el pronóstico de los pacientes que sufren un SICA.1,3 Los avances en el tratamiento de los SICA (trombolisis, anticoagulación, antiagregación plaquetaria, stents medicados, etcétera) no han estado exentos de complicaciones y éstas se hacen más evidentes y relevantes a medida que se aplican en un mayor número de enfermos. Entre las complicaciones, la hemorragia asociada al tratamiento de los SICA (H-SICA) ha pasado al primer plano del tratamiento y cada vez se reconoce con mayor claridad su impacto negativo en el pronóstico del paciente.3 En el pasado, la H-SICA, se reconocía como un efecto adverso de trascendencia limitada, cuyo tratamiento (uso de hemoderivados y suspensión del tratamiento anticoagulante) influía de manera limitada en el pronóstico del paciente4 pero, a medida que la evidencia se ha ido acumulando, se ha mostrado que la H-SICA incrementa la estancia intrahospitalaria,5 costos6 y, lo más relevante, la morbimortalidad a corto y largo plazo.7,8 Por estos motivos, los estudios más recientes incluyen a estas complicaciones dentro de sus desenlaces primarios, las últimas guías de tratamiento de SICA las enfatizan1,3,9 y, actualmente, la H-SICA se reconoce como la complicación no cardiaca más común del tratamiento.3,10
Epidemiología
Es difícil determinar la incidencia, prevalencia y repercusión de la H-SICA debido a que su importancia ha sido reconocida de forma reciente; un gran número de estudios no la documentó de forma adecuada y la estandarización de su definición ha sido controversial y difícil.4
En estudios aleatorizados, la incidencia de hemorragia mayor oscila entre <2%11-13 y 8%.14 Un meta-análisis señaló incidencia de 2.3%,8 y se estima que uno de cada 35 pacientes con SICA cursa con un evento hemorrágico mayor.15 En la publicación del registro GRACE en 2003,10 3.9% de los pacientes desarrolló una hemorragia mayor que disminuyó a 2.8% en la de 2007, lo que podría explicarse por el uso de medicamentos más específicos y refinamiento en la posología.16,17 La incidencia de hemorragia menor, oscila entre 2.1%18 y 36.8%6 y en relación con el sitio de sangrado, en el GRACE se localizó en sitios de punción vascular 29%, intracraneal 6%, otros sitios 53% y sin localización exacta 12%.15 En nuestro medio, la única referencia disponible al momento, es el RENASICA II que señaló una incidencia de hemorragia mayor de 1% y menor de 2%.19 Si se analiza de forma exclusiva el grupo de pacientes llevados a intervención coronaria percutánea (ICP), la proporción de pacientes que desarrollan alguna hemorragia es superior, hasta 30%20,21 y, si sólo se consideran eventos de hemorragia mayor, la incidencia oscila entre 4% y 7%.7,14,15 La disminución en la incidencia de las complicaciones isquémicas asociadas a la ICP ha sido tan importante que, en el momento actual, se considera a la hemorragia como la complicación más frecuente asociada al tratamiento intervencionista de los SICA.22
Relevancia clínica
Aunque en un inicio se consideró que la H-SICA tenía una repercusión limitada en el pronóstico, actualmente se reconoce que impacta negativa y significativamente en el desenlace clínico del paciente6,8,10,23-25 Por ejemplo, en el registro GRACE, los pacientes que presentaron hemorragia mayor, tuvieron una probabilidad mayor de morir (25.7% vs. 9.3%, p <0.0001) y uno de cada cinco pacientes que la desarrolló, falleció.10 Un meta-análisis observó que la hemorragia mayor se asoció con un incremento significativo en la probabilidad de muerte en los primeros 30 días (HR 5.37), el efecto fue visible a los 180 días8 y otro estudio observó que el efecto negativo permaneció a un año de seguimiento [OR 3.53, (IC 95% 1.9 - 6.53)].26 Se ha calculado que uno de cada diez pacientes que desarrolla un evento de hemorragia mayor, fallece a los 30 días, en comparación con uno de cada 40 pacientes que no lo desarrollan.8 Ésta relación entre hemorragia y mortalidad es independiente de las características basales del paciente, comorbilidades, tratamiento y la H-SICA no sólo se asocia a mortalidad, sino también, a isquemia recurrente (23.1% vs. 6.8%, p <0.0001) y trombosis intrastent (3.4% vs. 0.6%, p <0.0001).7 Es notable que la variable más asociada a mortalidad en otro meta-análisis fue la hemorragia mayor, incluso superando al mismo SICA.27
Finalmente, un subestudio del ACUITY mostró que los pacientes con un mayor riesgo de eventos isquémicos (en quienes el tratamiento anti-isquémico normalmente es más enérgico) fueron los mismos que tuvieron mayor riesgo de sangrado, lo que resalta la importancia de prevenir, identificar y tratar de forma adecuada a los pacientes que desarrollan este tipo de complicaciones.28
Fisiopatología
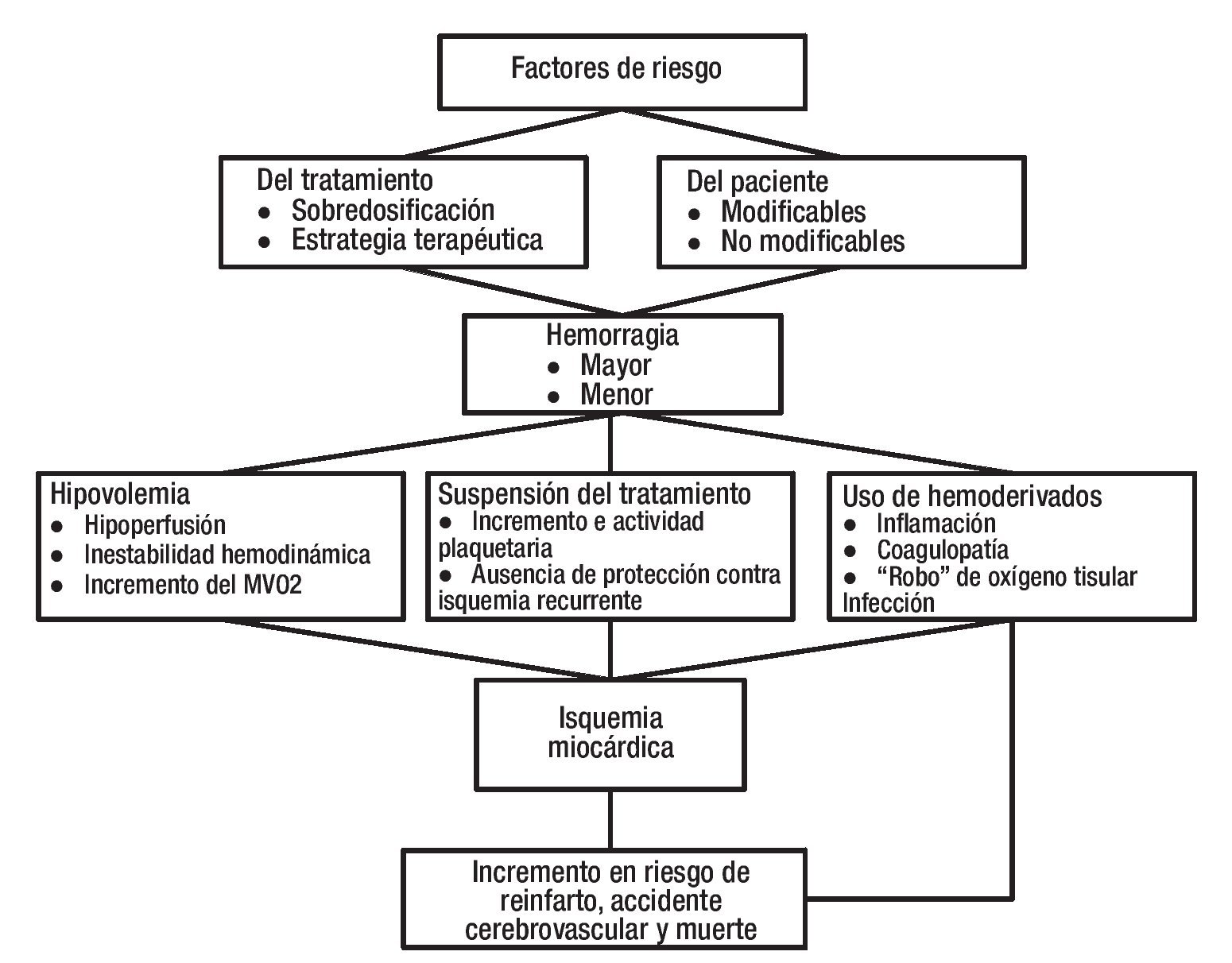
Se ha determinado que la asociación entre hemorragia, reinfarto, accidente cerebrovascular (ACV) y muerte existe y es consistente entre los diferentes estudios. Los mecanismos propuestos para explicar esta asociación incluyen a la misma hemorragia, la suspensión del tratamiento anti-isquémico y el uso de hemoderivados (Figura 1). Si la hemorragia es suficientemente grave, puede producir hipovolemia, inestabilidad hemodinámica, taquicardia, incremento en el consumo de oxígeno miocárdico (MVO2), hipoperfusión y agravamiento de la isquemia miocárdica.29-32 Por ejemplo, los cambios dinámicos en el segmento ST fueron más prevalentes (26.6% vs. 44.8%, p = 0.03) en pacientes con hemorragia mayor en el estudio INTERACT.33 Por otro lado, la hemorragia puede forzar al médico a suspender el tratamiento antitrombótico, situación que ha mostrado producir un aumento en la actividad plaquetaria e incrementar el riesgo de reinfarto (incluyendo trombosis intrastent), ACV y muerte cardiovascular.8,34 En el registro GRACE, la suspensión del tratamiento por HSICA incrementó la mortalidad y la magnitud fue diferente dependiendo del fármaco: heparina no fraccionada (HNF) 1.91 (IC 95% 1.09 - 3.36), aspirina 7.55 (IC 95% 4.4 - 12.8) y tienopiridinas 8.9 (IC 95% 4.39 - 18.12).15
Figura 1. Implicaciones de la hemorragia asociada al tratamiento de lo SICA.
No sólo la hemorragia per se es deletérea, sino también, su tratamiento con hemoderivados (concentrado eritrocitario, plasma fresco, crioprecipitados y aféresis plaquetaria). Estos productos tienen la capacidad de aumentar la respuesta inflamatoria, atenuar la respuesta inmune30,31,35 y en diversos estudios, han sido asociados a incremento en el riesgo de infecciones perioperatorias, ACV, falla orgánica múltiple y muerte.5,30,35-38 Aunque los mecanismos implicados no son claros, se ha mostrado que los hemoderivados producen alteraciones metabólicas e inflamatorias (coagulopatía, hipotermia, hiperkalemia, entre otras) con posible impacto clínico.31,39 Por ejemplo, los hemoderivados pueden atenuar la respuesta inmune a través de disminución o disfunción de: macrófagos, células NK, CD4 y CD8 positivas31,40 y, debido a citocinas proinflamatorias como P selectina y VCAM 1, podrían promover isquemia local.41 Los eritrocitos almacenados pierden rápidamente el 2,3 difosfoglicerato, lo que desvía la curva de disociación de la hemoglobina hacia la izquierda aumentado así, su afinidad por oxígeno. Este fenómeno, teóricamente podría producir un robo de oxígeno a los tejidos y, a pesar de un incremento en la concentración de hemoglobina (Hb), la oxigenación tisular podría no mejorar e incluso disminuir.42-44 De igual forma, los eritrocitos transfundidos pierden óxido nítrico, situación que favorece la vasoconstricción e hipoxia tisular con el deterioro hemodinámico microvascular subsecuente.44,45 Éstos últimos mecanismos parecen ser clínicamente relevantes ya que los pacientes que reciben hemoderivados más antiguos (más de 14 días vs. menos de 14 días) desarrollan con mayor frecuencia insuficiencia renal, sepsis, falla multiorgánica y su mortalidad se incrementa (7.4% vs. 11.0%, p <0.001).46
En este punto, hay que enfatizar la posible relevancia clínica de estos fenómenos ya que el uso de hemoderivados en pacientes con SICA es frecuente. Por ejemplo, en el registro CRUSADE,47 14.9% de los pacientes con SICA recibió transfusiones y en el GRACE,10 57% de los casos de hemorragia mayor recibieron hemoderivados. Finalmente, Moscucci y colaboradores revisaron las indicaciones del uso de hemoderivados en su centro hospitalario y observaron que hasta 64% de las transfusiones probablemente eran innecesarias, lo que enfatiza la importancia y necesidad de utilizar de forma juiciosa estos productos con pleno conocimiento de sus riesgos y beneficios.48
Impacto económico
En los Estados Unidos de Norteamérica, se ha calculado que la H-SICA aumenta en 10 000 dólares (US$) el costo por cada evento y, en total, suman 400 US$ al costo de cada ICP.6,22 Los resultados del subestudio económico del GUSTO IIb6 demuestran un incremento en los costos netos y en la estancia intrahospitalaria directamente relacionados con el evento hemorrágico: sin hemorragia: 5.4 días (14 282 US$), hemorragia leve: 6.9 días (21 674 US$), moderada: 15 días (45 798 US$) y mayor: 16.9 días (66 564 US$). En el estudio CURE,49 la hemorragia mayor prolongó la estancia intrahospitalaria en 5.94 días, la hemorragia que pone en riesgo la vida (según definición del estudio) en 4.57 días y la ocurrencia de ambas en 9.91 días. El incremento en los costos es muy importante ya que disminuye el beneficio clínico neto de las estrategia terapéuticas, concepto que se refiere a la diferencia entre el éxito del tratamiento y las complicaciones asociadas al mismo.50 Por ejemplo, en el estudio TRITON TIMI-38, el prasugrel disminuyó de forma significativa las complicaciones isquémicas a expensas de un incremento en el riesgo de hemorragia, lo que disminuyó su beneficio clínico neto51 y en el estudio EPIC,52 que comparó el costo/beneficio del abciximab más heparina no fraccionada (HNF), la reducción en el costo por complicaciones isquémicas (523 US$) fue opacada por un incremento en el costo de las complicaciones hemorrágicas (458 US$) disminuyendo el beneficio económico neto a 65 US$.53 Otro ejemplo es el de la bivalirudina, que demostró un ahorro neto de 405 US$ por paciente producto casi exclusivamente de una disminución en las complicaciones hemorrágicas7 lo que sugiere que los análisis económicos deben de orientar al clínico en la toma de decisiones y ser incluidos en políticas de salud pública.54,55
Definición
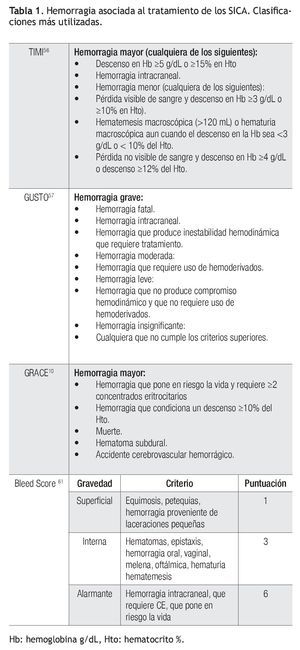
La definición de la H-SICA ha sido y es tema de controversia. Se han propuesto muchas definiciones (Tabla 1) y han sido diseñadas acorde a los requerimientos de los estudios, lo que podría limitar su utilidad en la práctica clínica. La clasificación del grupo TIMI56 divide al sangrado en mayor, menor o insignificante en base al descenso en la Hb o el hematocrito (Hto), mientras que la utilizada en el estudio GUSTO57 se basa en parámetros clínicos. Esta diferencia produce resultados diferentes; por ejemplo, la incidencia de hemorragia mayor en el estudio TIMI I56 fue de 16% mientras que en el GUSTO57 fue de sólo 0.45%. Rao y colaboradores58,59 compararon la utilidad de las definiciones de hemorragia TIMI56 y GUSTO57 y encontraron que ambas definiciones fueron capaces de identificar a pacientes en riesgo de desarrollar desenlaces adversos pero, sólo la definición del grupo GUSTO57 tuvo poder pronóstico, lo que sugiere que las definiciones que utilizan variables clínicas y no sólo paraclínicas son más útiles en la práctica cotidiana.60
Las definiciones presentan diversas limitaciones; por ejemplo, las más utilizadas [TIMI56 y GUSTO57], fueron diseñadas para evaluar la terapia fibrinolítica en pacientes con SICA con elevación del segmento ST (SICA CEST) y no han sido validadas con las estrategias actuales de tratamiento (terapia de reperfusión mecánica, asociación de nuevos antiagregantes, anticoagulantes y antitrombínicos). Es posible que la limitación más importante de utilizar diferentes definiciones, sea la dificultad para comparar frente a frente nuevos tratamientos por lo que se ha propuesto la necesidad que deben de ser simplificadas y estandarizadas.61 Recientemente se ha propuesto una nueva definición (Bleed score, Tabla 1),61 mientras que otros proponen la estandarización de las variables operacionales.60 Aún queda por ver en el futuro cuál de estas dos estrategias es superior.
Factores de riesgo
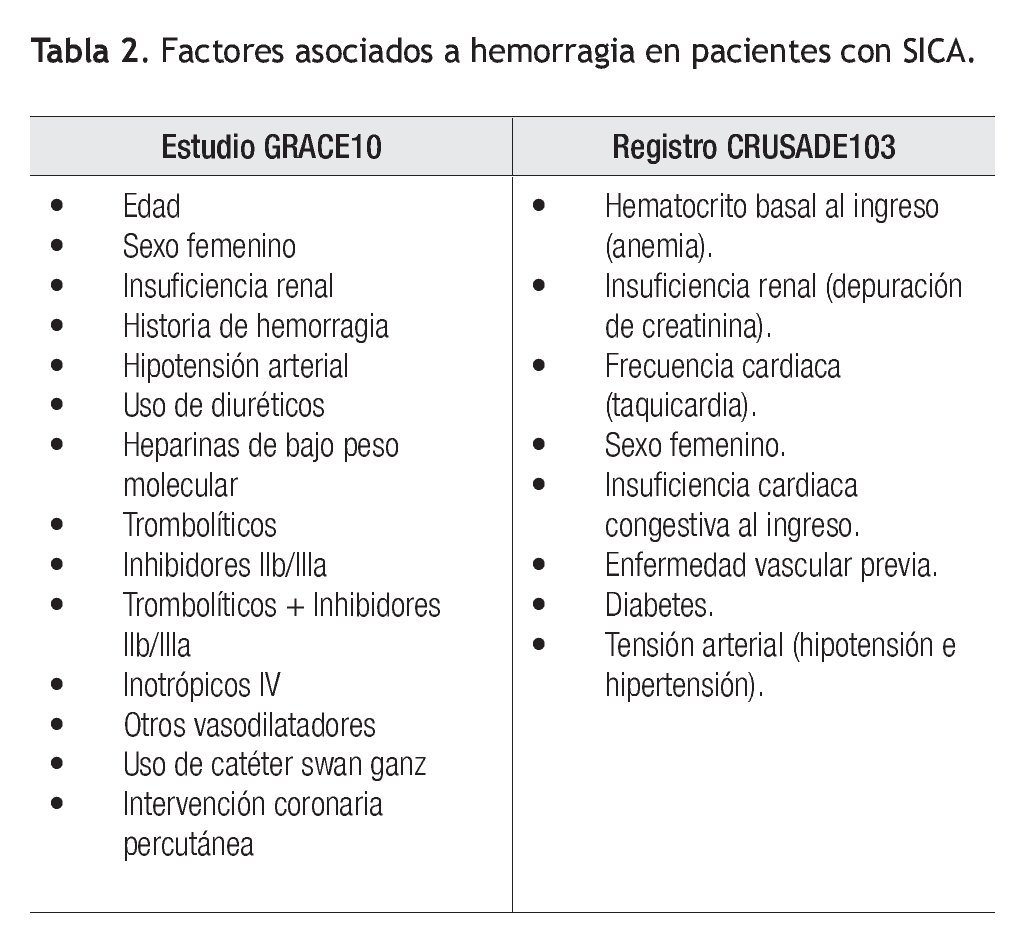
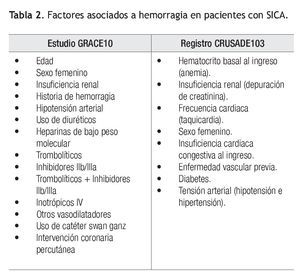
La identificación y caracterización del riesgo tanto trombótico como hemorrágico en pacientes con un SICA, debe de ser prioritario, rutinario y establecerse antes de seleccionar e iniciar el tratamiento (Tabla 2). Eikelboom y colaboradores analizaron la información de 34 146 pacientes y encontraron que la edad, la cifra de creatinina y el antecedente de ECV previa fueron predictores positivos significativos de hemorragia.8 En el registro GRACE10,62 múltiples variables se asociaron con un incremento en el riesgo de hemorragia y recientemente, el registro CRUSADE publicó una constructo que permite estimar la probabilidad de presentar una hemorragia mayor. Éste toma en cuenta variables de la historia del paciente, exploración física y paraclínicas.63
Los factores de riesgo para hemorragia se pueden dividir en dos grupos:27 no modificables y modificables.
A) Factores de riesgo no modificables:
Edad: Diversos análisis colocan a la edad como uno de los predictores positivos más potentes para el desarrollo de esta complicación.21 Por ejemplo, en el estudio REPLACE-2, el riesgo de hemorragia y de transfusión fue significativamente mayor en pacientes mayores de 75 años (6.7% vs. 2.7%, p <0.0001 y 5.0% vs. 1.7%, p <0.0001 respectivamente) y esta afirmación se extiende también a los pacientes llevados a ICP, como lo demostró el TACTICS-TIMI 18 (16.6% vs. 6.5%, p = 0.009).2,7 El incremento en el riesgo de hemorragia en personas mayores parece ser multifactorial y en parte, se explica por mayor fragilidad capilar, incremento en comorbilidades, menor peso, deterioro en la función renal y problemas en la posología.
Deterioro en la función renal: Se asocia de forma consistente con el riesgo de hemorragia, recurrencia de eventos isquémicos y se ha observado una relación exponencial inversa entre el descenso en la depuración de creatinina y las complicaciones hemorrágicas.64-67 Los pacientes con insuficiencia renal suelen tener mayor edad y comorbilidades, lo que los hace potencialmente más susceptibles a la sobredosificación, especialmente de HNF e Inhibidores de la glicoproteína IIb/IIIa (IGP). Por ejemplo, en los pacientes con insuficiencia renal en quienes no se ajustó de forma adecuada el eptifibatide, la incidencia de hemorragia fue muy superior (0.0% vs. 20%, p = 0.01) en el estudio PROTECT-TIMI-30.68
Anemia: En los pacientes con un SICA, la anemia es un factor de riesgo mayor para hemorragia, eventos cardiovasculares, transfusiones, hospitalización prolongada e incluso mortalidad.69,70 En el REPLACE-2 23% de los pacientes presentaron este diagnóstico y entre ellos, la incidencia de hemorragia (4.9% vs. 2.8%, p = 0.0001) y la mortalidad a un año (4.3% vs. 1.5%, p = 0.0001), fueron significativamente mayores.69
Presión arterial al ingreso: Tanto la hipertensión como la hipotensión se han asociado a hemorragia. La hipertensión (tanto sistólica como diastólica) se ha asociado con hemorragia intracraneal (HIC)71,72 y también la hipotensión (PAD ≤ 70 mmHg) fue un factor de riesgo para HIC en el ASSENT-2 (OR 1.33, IC 95%, 1.14 - 1.54).73
Sexo femenino: Aunque en este punto la evidencia es controversial, varios estudios han reportado un incremento en el riesgo de hemorragia entre las mujeres, entre estos: el registro GRACE10: OR 1.43 (IC 95%, 1.21 - 1.37), el ACUITY28: OR 1.92 (IC 95%, 1.61 - 2.29), el análisis combinado del REPLACE-1 y REPLACE-2:74 OR 1.57 (IC 95%, 1.11 - 1.22) y un análisis retrospectivo en más de 735 000 pacientes llevados a ICP, mostró que ser mujer75 es un factor de riesgo independiente para mortalidad intrahospitalaria.75 Este incremento en el riesgo de hemorragia y mortalidad parece multifactorial y aún está por establecerse si no es sólo debido a un mayor número de comorbilidades.
B) Factores de riesgo modificables:
Este grupo incluye a los medicamentos utilizados, la dosificación y en aquellos llevados a ICP, las características del procedimiento. Las dosis inadecuadas, especialmente la sobredosificación parece ser muy frecuente, ya que, por ejemplo, en el registro CRUSADE, hasta 40% de los pacientes recibieron dosis excesivas de uno o más medicamentos y ésto se asoció a un mayor riesgo de hemorragia, hospitalización prolongada y muerte.76 En relación con los pacientes llevados a ICP, se ha observado una asociación positiva entre la duración del procedimiento, el tamaño del introductor, la vía femoral y las complicaciones técnicas con la H-SICA.53
Fármacos y riesgo de hemorragia
Cada uno de los diferentes medicamentos utilizados en el tratamiento de los SICA afecta en diferente nivel y con diferente potencia la coagulación, trombogénesis y trombolisis. Aunque se puede suponer que el riesgo de hemorragia aumenta conforme aumenta la eficacia antitrombótica, la evidencia clínica no avala este razonamiento, por lo que es de gran importancia que el clínico conozca a profundidad el perfil de seguridad/riesgo de cada medicamento utilizado y de igual forma los resultados netos de la combinación de los mismos. Por ejemplo, en el ISIS-2 la aspirina y la estreptoquinasa disminuyeron de forma equiparable la mortalidad de causa isquémica, pero sólo la estreptoquinasa se asoció a HIC o necesidad de transfusión.77
Trombolíticos: El tratamiento fibrinolítico se asocia con un aumento en el riesgo de hemorragia y la más temida es la HIC.78 En el registro GRACE,10 de 5931 pacientes que recibieron fibrinolítico, 3.1% cursó con una hemorragia mayor y este riesgo es superior con esquemas fibrinolíticos más intensivos (alteplasa y heparina vs. estreptoquinasa y aspirina).79 Al comparar estreptoquinasa,57 alteplasa57 y tenecteplasa,73 encontramos lo siguiente: mortalidad a 30 días: 7.4%, 6.3%* y 6.2%, ACV total: 1.4%, 1.55% y 1.78%, ACV hemorrágico: 0.54%, 0.72%* y 0.94% y hemorragia mayor: 6.3%, 5.4% y 4.7%* (*diferencia significativa). En el GUSTO-1,57 hubo dos ACV hemorrágicos más por cada 1000 pacientes tratados con alteplasa que con estreptoquinasa (p = 0.03) aunque la incidencia de hemorragia mayor fue similar en ambos grupos. Aunque los nuevos trombolíticos como la reteplasa, tenecteplasa y lanoteplasa no han sido superiores a la alteplasa en reducir la mortalidad, el estudio ASSENT-2 mostró que tenecteplasa se asoció a menor hemorragia mayor (4.7% vs. 5.9%, p = 0.0002) y requerimiento de transfusión (4.3% vs. 5.5%, p = 0.0002) que alteplasa siendo esta diferencia más notable en las mujeres mayores de 75 años y peso menor de 67 kg.73
Antiplaquetarios: De forma indirecta se ha observado que las dosis pequeñas de aspirina son más seguras que las altas, ya que reducen con la misma magnitud la probabilidad de eventos isquémicos con un menor riesgo de hemorragia;1 por ejemplo, en el estudio CURE la probabilidad de hemorragia mayor se incrementó de manera directa con la dosis de aspirina: <100 mg: 2%, 100 mg a 200 mg: 2.3% y >200 mg: 4%, sin observarse beneficio en relación a eventos isquémicos con dosis >75 mg.49 En cuanto al clopidogrel, en el mismo estudio se observó un incremento en el riesgo de hemorragia total en el grupo de clopidogrel (2.7% placebo vs. 3.7% clopidogrel, p = 0.003) pero no en hemorragia fatal ni en hemorragia capaz de poner en peligro la vida.49 Este riesgo de hemorragia fue muy superior en los primeros cinco días posteriores a la suspensión del clopidogrel en pacientes llevados a revascularización quirúrgica, por lo que su uso en pacientes con sospecha de requerir este tratamiento, debe de valorarse con extrema cautela. Recientemente se compararon dosis bajas y altas tanto de aspirina como de clopidogrel en pacientes con SICA en un ensayo clínico con diseño factorial y no se observaron diferencias significativas entre las diferentes dosis de aspirina pero, en aquellos llevados a ICP, sí hubo una menor incidencia de mortalidad cardiovascular, reinfarto o ACV con dosis altas de clopidogrel a expensas de un incremento en hemorragia mayor.80
Heparinas y fondaparinux: El riesgo hemorrágico asociado al uso de heparinas es bien conocido y dosis excesivas han mostrado incrementarlo. Un meta-análisis de pacientes llevados a ICP mostró, que aunque la incidencia de muerte, infarto y revascularización fue la misma entre los cuartiles de tiempo de tromboplastina activado (estrategia utilizada para medir el efecto de la heparina), la hemorragia sí fue significativamente mayor entre los cuartiles.81 Las heparinas de bajo peso molecular tienen ventajas en relación a la heparina convencional pero han sido asociadas a mayores incidencias de sangrado. Por ejemplo, el estudio SYNERGY que comparó a la HNF con la enoxaparina, no logró demostrar un beneficio a favor de ninguna estrategia en el desenlace primario (infarto y muerte); sin embargo, el riesgo de hemorragia fue significativamente mayor con enoxaparina (9.1% vs. 7.6%, p = 0.008).14 En el ESSENCE, la enoxaparina fue superior a HNF en relación a complicaciones isquémicas y no hubo diferencias en hemorragia mayor, aunque la hemorragia menor fue más prevalente con enoxaparina.82 Al comparar enoxaparina con fondaparinux en pacientes con SICA SEST), el estudio OASIS-5 mostró un beneficio a favor de fondaparinux en el desenlace compuesto por muerte, infarto, ACV o hemorragia mayor (7.3% vs. 9%, p <0.001) y este efecto benéfico se explicó principalmente por la disminución en los eventos hemorrágicos (2.2% vs. 4.2%, p = 0.001). Se concluyó que el fondaparinux disminuye el riesgo de hemorragia mayor en 54% pero duplica el riesgo de trombosis intrastent.83 Estos resultados fueron la base para que tanto la guía del ACC/AHA1 como la europea3 para el tratamiento del SICA SEST, incluyeran al fondaparinux en el tratamiento invasivo temprano y conservador. En la guía europea es el tratamiento de elección para ambas estrategias (conservadora e invasiva) mientras que en la del ACC/AHA es el tratamiento de elección sólo en la estrategia conservadora.
Inhibidores de la glicoproteína IIb/IIIa: Este grupo de medicamentos ha mostrado ser efectivo en disminuir las complicaciones isquémicas, pero también incrementan el riesgo de hemorragia que típicamente es mucocutánea o en sitios de acceso vascular.1,84-87 En el estudio EPIC la incidencia de hemorragia mayor y de uso de hemoderivados fue significativamente mayor con el uso de abciximab (placebo: 3.3%, bolo de abciximab: 8.6% y 10.6% en los que recibieron bolo e infusión).52 En el PRISM-PLUS88 no se observaron diferencias en hemorragia mayor entre tirofibán y placebo y en el PURSUIT,89 la hemorragia mayor se presentó en 10.6% de los pacientes que recibieron eptifibatide vs. 9.1% en el grupo placebo (p = 0.02). Un punto importante es que ningún estudio ha encontrado un incremento en el riesgo de hemorragia intracraneal asociado al uso de IGP.
Inhibidores directos de trombina: La bivalirudina ha mostrado disminuir el riesgo de complicaciones hemorrágicas sin ser menos efectiva en términos de complicaciones isquémicas.64,84,90-92 El estudio REPLACE-293 comparó bivalirudina como monoterapia vs. HNF + IGP y mostró que la incidencia de complicaciones isquémicas (muerte, infarto o necesidad de revascularización urgente) fue similar en ambos grupos pero la hemorragia mayor y menor fueron significativamente menores con bivalirudina (mayor: 2.4% vs. 4.1% y menor: 13.4% vs. 25.7%). El estudio ACUITY comparó monoterapia con bivalirudina vs. bivalirudina más IGP vs. HNF más IGP y encontró resultados similares, ya que, aunque la prevalencia de complicaciones isquémicas fue similar en los tres grupos, en el grupo de bivalirudina las complicaciones hemorrágicas (mayores y menores) fueron significativamente menores.94
Prevención
Es sumamente importante identificar a los pacientes que presentan riesgo elevado de hemorragia y la prevención de las complicaciones hemorrágicas es tan importante como la prevención de nuevos eventos isquémicos.93 Se debe valorar de forma integral la estrategia terapéutica a utilizar, evitar la sobredosificación, no prolongar la duración de la terapia anticoagulante y ajustar para peso y función renal la dosis de los fármacos. En caso de ICP, hay que minimizar el tiempo de la intervención, favorecer el uso de introductores de diámetros menores, preferir la vía radial, medios de contraste de baja viscosidad, la deambulación y alta temprana.27,42 En pacientes con un elevado riesgo de hemorragia se prefiere utilizar, si se desea una estrategia conservadora, fondaparinux y bivalirudina si la estrategia será invasiva.3
Un meta-análisis que evaluó la seguridad de la HNF en pacientes llevados a intervencionismo, mostró que dosis mayores a 5000 unidades (o bolo de hasta 90 U/kg), se asocian a un riesgo mayor de hemorragia sin producir un efecto benéfico en cuanto a la incidencia de infarto, necesidad de revascularización o muerte.81 Al utilizar HNF, el tiempo de tromboplastina activada (TTP) debe determinarse cada cuatro a seis horas y sólo después de dos determinaciones en rango terapéutico se puede medir cada 24 horas. Es recomendable medir de forma diaria el nivel de hemoglobina, hematocrito y plaquetas ya que hasta 20% de los pacientes pueden sufrir trombocitopenia leve y de 1% a 5% trombocitopenia significativa (menos de 100 000 plaquetas/mm3). Siempre debe tenerse en cuenta la posibilidad de plaquetopenia inducida por heparinas (HIT), complicación autoinmune grave, que se desarrolla en 0.2% entre el cuarto y catorceavo día. Cuando se usa enoxaparina debe de ajustarse a edad y función renal. Hay que recordar que su efecto es difícilmente cuantificado en el escenario clínico y que la protamina es menos efectiva para revertirla. Para medir su efecto se utiliza la actividad anti-Xa (recomendable entre 0.6 a 1.0 U/mL) y se ha observado un incremento en el riesgo de hemorragia cuando >1.0 U/mL); sin embargo, el nivel óptimo de la inhibición del Xa para las HBPM en SICA no ha sido establecido y no se recomienda el uso rutinario de la medición de la actividad anti-Xa, salvo en casos especiales como pacientes con disfunción renal importante. Al utilizar IGP también se recomienda determinar Hb, Hto y plaquetas diariamente ya que, aunque la trombocitopenia causada por estos medicamentos es rara (0.5%), puede ser grave y se asocia con un incremento en el riesgo de hemorragia. De igual forma en pacientes con historia de hemorragia del tubo digestivo se recomienda administrar medicamentos que minimicen éste riesgo (p. ej. Inhibidores de la bomba de protones) bajo un nivel de evidencia B.1
En cuanto a los pacientes que serán llevados a cirugía, se recomienda suspender los IGP cuatro horas antes (nivel de evidencia B), el clopidogrel cinco a siete días (B), la enoxaparina 12 a 24 horas (B), el fondaparinux 24 horas (B) y la bivalirudina tres horas (B) antes de la cirugía. La aspirina y la HNF deben de continuarse bajo un control estrecho hasta el momento de la misma (nivel de evidencia A y B respectivamente).1
Tratamiento
Todo médico que trate pacientes con SICA debe de conocer a profundidad los fármacos que utiliza incluyendo sus efectos secundarios y complicaciones. La hemorragia menor, a excepción de la persistente, no requiere tratamiento específico ni interrumpir el uso de medicamentos. La hemorragia mayor de difícil control (por ejemplo intracraneal, retroperitoneal o gastrointestinal) requiere de la suspensión y neutralización de los antiplaquetarios y antitrombínicos utilizados valorando siempre el riesgobeneficio. Si la hemorragia puede controlarse localmente (compresión en sitio de punción) no es necesario suspender el tratamiento. Se ha considerado que el riesgo de un evento trombótico asociado a la suspensión del tratamiento es máximo en los primeros cuatro a cinco días aunque puede persistir por 30 días.8
Neutralización de efectos farmacológicos: La actividad antiplaquetaria es difícil de revertir ya que tanto la aspirina como el clopidogrel son inhibidores irreversibles. Posterior a su suspensión, la función plaquetaria se normaliza a razón de 10% a 20% por día por la producción de nuevas plaquetas. Dado que no hay ningún medicamento útil para revertir la inhibición plaquetaria, la transfusión de plaquetas es el único tratamiento disponible en la actualidad. Se recomienda una dosis mínima de 0.5 a 0.7 x 1011 plaquetas por cada 7 kg de peso. En el caso del abciximab, la transfusión de plaquetas rápidamente restaura los niveles disponibles de receptores IIb/IIIa (neutralizando su efecto) mientras que en el caso del tirofibán y eptifibatide, es necesario su eliminación renal, lo que de forma normal tarda entre cuatro y ocho horas.3 La HNF se puede revertir con concentraciones equimolares de sulfato de protamina (que neutraliza la actividad del factor IIa, 1 mg de protamina por cada 100 U de heparina) y, aunque se puede utilizar para neutralizar a la enoxaparina, su utilidad para éste efecto parece ser limitada. Se ha sugerido la utilización de factor VII recombinante para revertir a la enoxaparina aunque la experiencia clínica es escasa.95 Los inhibidores directos de la trombina no pueden ser revertidos, por lo que se requiere además de la suspensión del medicamento, la transfusión de plasma fresco congelado, crioprecipitados o ambos.3 En el caso del fondaparinux, el único posible antídoto sería el factor VII recombinante pero esto no ha sido mostrado clínicamente. Si el tratamiento trombolítico se complica con una hemorragia mayor, se ha sugerido utilizar protamina, aféresis plaquetarias y crioprecipitados aunque estas acciones no han sido validadas clínicamente (Tabla 3).96
La trombocitopenia producida por las heparinas y los IGP se define cuando la cuenta plaquetaria es menor de 100 000/mm3 o existe una disminución superior a 50% en relación a la previa. Se clasifica como leve (50 000 a 100 000 plaquetas/mm3), moderada (20 000 a 50 000 plaquetas/mm3) y grave (menos de 10 000 plaquetas/mm3). En caso de desarrollarse, se debe de buscar el origen y si se considera medicamentoso, suspender si es posible al fármaco causal. Hay que considerar que la primera causa de trombocitopenia es la pseudotrombocitopenia y que hasta 15% de los pacientes en tratamiento con heparina presentan un descenso leve en la cuenta plaquetaria sin repercusiones clínicas. En todos los casos, la terapia antiplaquetaria y antitrombótica se reiniciará hasta que la hemorragia haya permanecido bajo control por 24 horas.
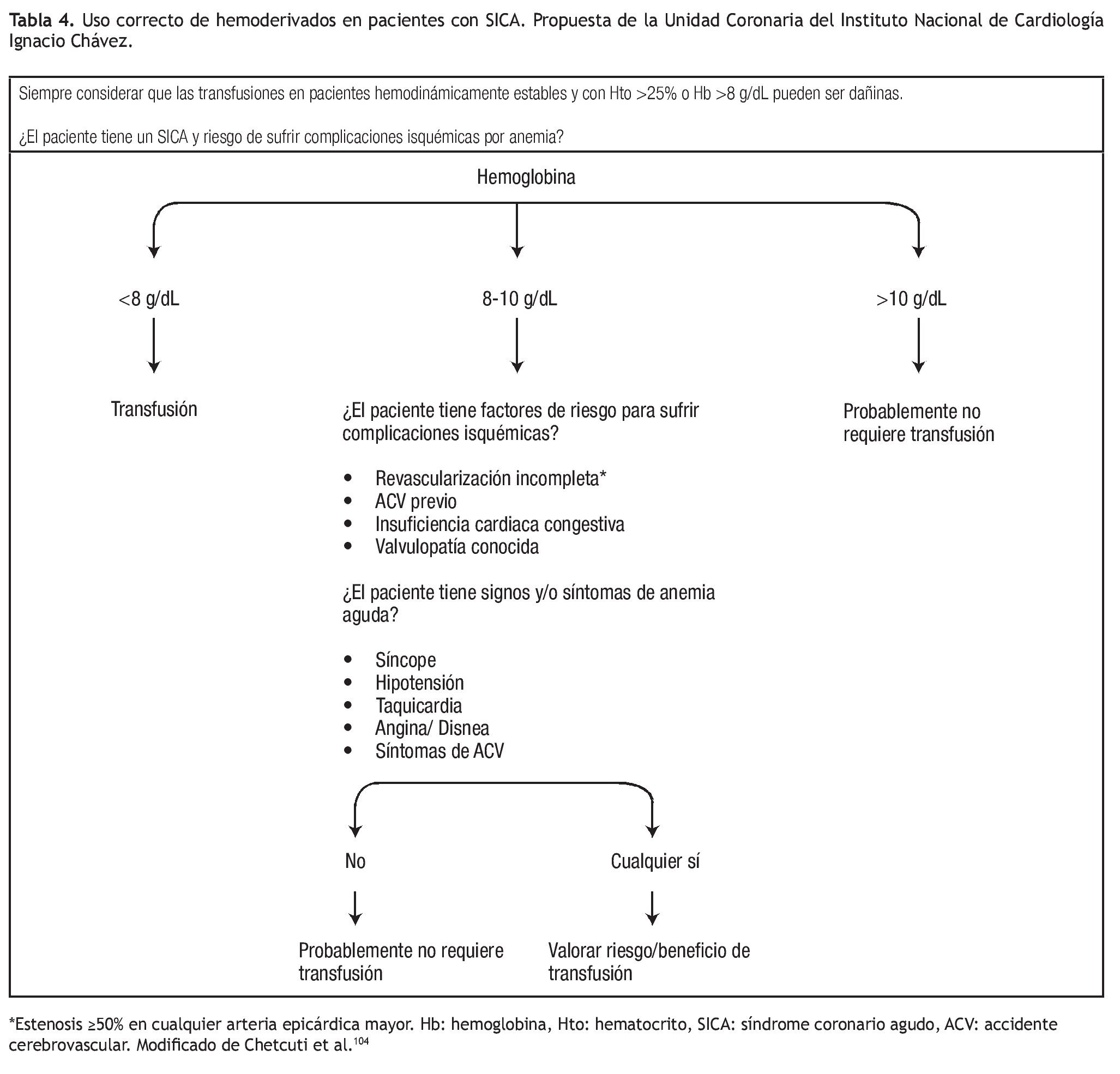
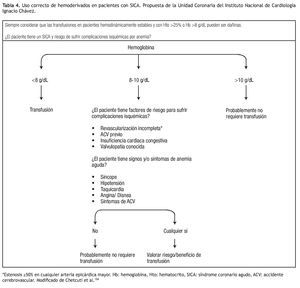
Uso adecuado de hemoderivados: Como ya se comentó, los hemoderivados no son inocuos y se ha propuesto que el refinamiento en sus indicaciones podría mejorar el pronóstico de los pacientes con un SICA.42 Estos productos están indicados para el tratamiento de la anemia con compromiso hemodinámico y, aunque hay información observacional que sugiere un efecto benéfico de su uso en el contexto de pacientes con anemia (Hto menor de 30%) y SICA CEST,97 hay otros estudios que han mostrado resultados adversos incluyendo un metanálisis con más de 24 000 pacientes con SICA.98 Dos estudios aleatorizados en pacientes críticamente enfermos mostraron que una estrategia restrictiva de transfusión (indicación de transfusión con Hb menor de 7 g/dL) fue superior a una estrategia liberal aunque al estudiar exclusivamente el subgrupo de pacientes cardiacos no se encontraron diferencias significativas.30,99 La evidencia actual sugiere que los beneficios de transfundir cuando el Hto es menor a 21% pueden ser superiores a los riesgos y transfundir con Hto mayor de 30%, puede ser dañino en ausencia de hemorragia activa. Por ejemplo, un estudio informó que la mortalidad intrahospitalaria y el reinfarto fueron significativamente mayores en pacientes que recibieron transfusión con niveles de hemoglobina superiores a 10 g/dL (11.5% vs. 3.8% y 13.4% vs. 5.8% respectivamente).47 En 1992 el American College of Physicians propuso una guía para el uso de hemoderivados aunque no ha sido validada en pacientes cardiacos.100 En esta guía, la indicación de transfusión no se basa sólo en el nivel de hemoglobina sino también, en los factores de riesgo para el desarrollo de complicaciones isquémicas y los signos o síntomas secundarios a anemia aguda. Historia de insuficiencia cardiaca congestiva, ACV, valvulopatía y revascularización incompleta se consideran factores de riesgo y, en presencia de signos y síntomas de anemia aguda se indica la transfusión. Recientemente, la guía europea para el tratamiento de pacientes con SICA SEST3 propone que el uso de hemoderivados en pacientes hemodinámicamente estables y con Hto mayor de 25% o Hb superior a 8 g/dL puede ser dañino por lo que cada transfusión debe de ser valorada de forma individual, considerándose siempre sus riesgos y beneficios (Tabla 4).
Por último, se encuentran en investigación diferentes alternativas a la transfusión, por ejemplo, la eritropoyetina que actualmente se encuentra en evaluación en pacientes con SICA debido a sus posibles efectos benéficos citoprotectores en la lesión celular por isquemia. Datos preliminares indican que su uso en dosis de 200 U/Kg/día por tres días, puede ser de utilidad.101 Así mismo, están en estudio nuevos fármacos antitrombóticos con un menor potencial hemorrágico como son los inhibidores del receptor tipo 1 de proteasa activada (PAR-1, por sus siglas en inglés) que inhiben la activación plaquetaria mediada por la trombina sin interferir con la coagulación y la generación de fibrina dependiente de trombina por lo que parecen no incrementar el riesgo de hemorragia.102
Conclusiones
Hasta hace poco, la H-SICA se consideraba como una complicación leve y de importancia limitada; sin embargo, ahora es claro que la H-SICA impacta negativa y decisivamente en el pronóstico de los pacientes con SICA. Por este motivo, el clínico siempre deberá de estimar el riesgo de sangrado en un paciente con SICA, la dosificación farmacológica deberá de ser correcta y la estrategia terapéutica a utilizar deberá de ser lo más efectiva y segura posible. Una vez iniciado el tratamiento, debe mantenerse una alta sospecha clínica, previniendo e identificando precozmente su desarrollo y, en caso de que se presente una H-SICA, el tratamiento debe de ser oportuno considerando siempre el riesgo/beneficio de cada intervención.