Introducción
La arteritis de Takayasu (AT) es una enfermedad inflamatoria crónica, idiopática, que afecta principalmente grandes arterias como la aorta y sus ramas principales.1,2 Su incidencia es de dos por cada millón de personas y la edad promedio de aparición es de 35 años.3-6 La etiología es desconocida, se sabe que el curso clínico incluye dos fases, una temprana y una tardía.7 La presentación clínica incluye fiebre de origen desconocido con sintomatología sistémica totalmente inespecífica.8-10
El Colegio Americano de Reumatología (ACR) estableció los criterios de diagnóstico de la AT los cuales han demostrado contar con una sensibilidad del 90.5% y una especificidad de 97.8%, lo que ha permitido que estos criterios se hayan aceptado internacionalmente.11,12
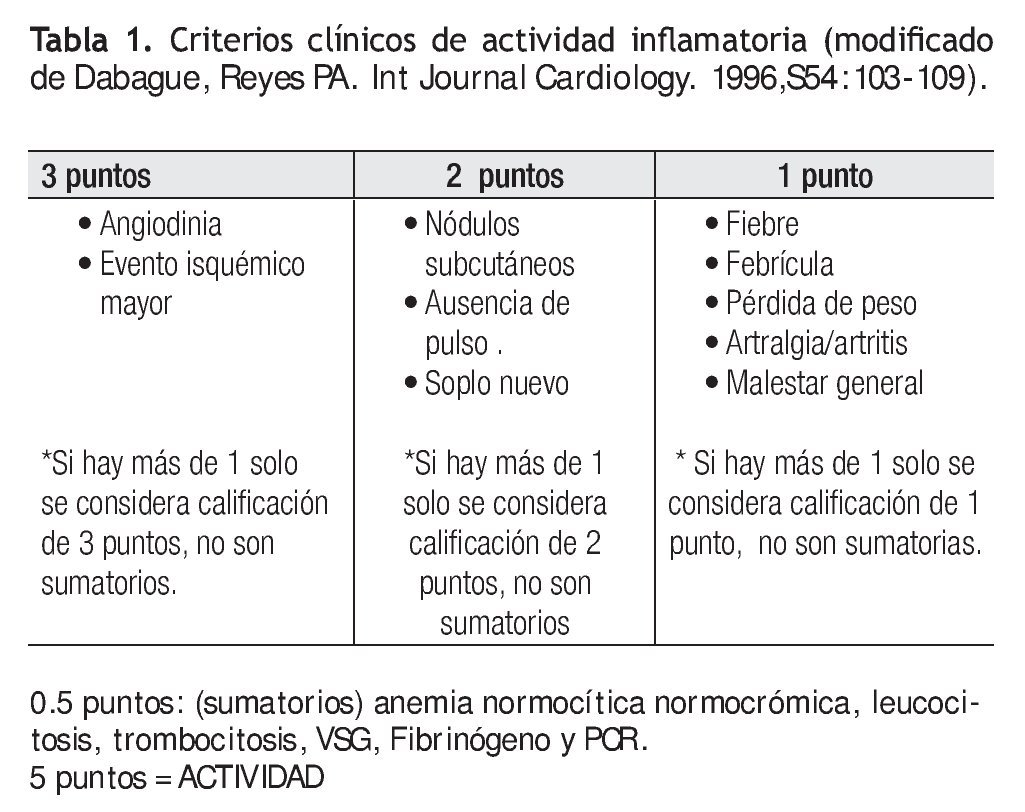
A su vez se han intentado establecer criterios para detectar actividad inflamatoria en los pacientes con AT,1,13 sin embargo, hasta la actualidad no existen marcadores específicos que puedan demostrarla.14
A pesar de la aplicación de estos criterios, se han encontrado aun en estudios histopatológicos datos de actividad inflamatoria hasta en 40% de los pacientes en quienes se consideraban como sin actividad inflamatoria a través de los criterios clínicos mencionados.15
Debido a que en las fases tempranas de la enfermedad se encuentra panarteritis y engrosamiento inflamatorio de la pared de las arterias y en las fases avanzadas de la enfermedad se manifiestan estenosis arteriales, existen algunos métodos de diagnóstico que pueden ayudar en etapas tardías como lo son la angiografía de aorta, el ultrasonido Doppler y la resonancia magnética, sin embargo en la fase de actividad inflamatoria no existen métodos fidedignos para determinar la presencia o ausencia de dicha actividad.16,17
La tomografía por emisión de positrones (PET) es una técnica basada en la distribución regional de glucosa marcada ([18F]FDG).18 Se ha demostrado que las células con actividad inflamatoria tienen una expresión incrementada de transportadores de glucosa y por lo tanto acumulan grandes cantidades de [18F]FDG.19,20
Existen diversos estudios que han demostrado la capacidad del PET para diagnosticar actividad inflamatoria tanto en arteritis a diferentes niveles, como en AT en específico.21-39
El PET tiene una sensibilidad de 92% y una especificidad de 100% para detectar actividad en AT, con un valor predictivo positivo de 100% y un valor predictivo negativo de 85%.40
Existen reportes de casos en los que se ha valorado la respuesta al tratamiento en AT mediante PET.41-43 En nuestro conocimiento, no existe publicado hasta el momento algún estudio en el que se haya evaluado de forma comparativa la capacidad del PET para determinar la existencia de actividad inflamatoria y su seguimiento a largo plazo contra los criterios clínicos de actividad.
Objetivos
Valorar mediante PET la respuesta al tratamiento a través de la presencia o ausencia de actividad inflamatoria en pacientes con AT.
Comparar la capacidad de detección de actividad inflamatoria que tienen los criterios clínicos establecidos con la de la tomografía por emisión de positrones.
Métodos
Se realizó un estudio prospectivo, observacional, longitudinal, comparativo en donde se incluyeron 35 pacientes mayores de 18 años con diagnóstico de AT de acuerdo a los criterios establecidos por el ACR.11,12 Todos los pacientes incluidos en el estudio aceptaron participar mediante un consentimiento informado. Los pacientes con diagnóstico de enfermedad reumatológica diferente a la AT, menores de 18 años, pacientes con glucemia sérica mayor de 200 mg/dL el día del estudio con PET, pacientes en los que se consideró el estudio como riesgoso y aquellos que no expresaran el deseo de participar en el estudio a través del consentimiento informado fueron excluidos del estudio.
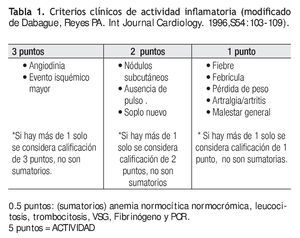
A todos los pacientes se les realizó una revisión clínica inicial por dos reumatólogos expertos en el diagnóstico y tratamiento de la enfermedad. Se determinó en todos los casos los siguientes parámetros de laboratorio: 1) velocidad de sedimentación globular, 2) proteína C reactiva, 3) biometría hemática, 4) fibrinógeno. Se aplicaron los criterios propuestos por Dabague y colaboradores para el diagnóstico de actividad inflamatoria. Se definió como actividad inflamatoria a todos aquellos que tenían cinco o más puntos de la clasificación (Tabla 1).13
Los 35 pacientes fueron sometidos a un PET inicial con inyección de 15 mci de fluorodeoxiglucosa intravenosa. Posterior a la inyección se requirió de reposo absoluto por 120 minutos antes de la toma de imágenes. La adquisición de imagines se realizó por 40 minutos con un equipo PET Scanner ECAT EXACT HR+ (Siemens/CTI. Knoxville, TN, USA) en tercera dimensión. Se realizó reconstrucción de las imágenes con corrección de la atenuación.
Las imágenes fueron analizadas a través de la aplicación de la cuantificación de unidades SUV (Standard Uptake Value = Unidad de concentración tisular de FDG entre el total del FDG inyectado por el peso corporal). Se definió como "actividad inflamatoria mediante PET" a un valor en unidades SUV mayor o igual a 1.2 SUV.33
Los pacientes negativos para actividad mediante PET fueron excluidos de la fase de seguimiento. Todos los pacientes positivos para actividad por PET recibieron tratamiento farmacológico individualizado por dos reumatólogos expertos quienes fueron ciegos al grado de actividad inflamatoria demostrada mediante el PET basal.
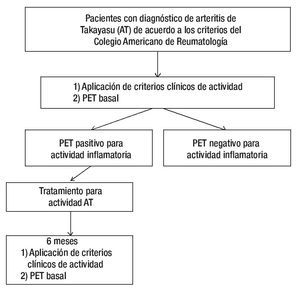
Entre los pacientes con actividad inflamatoria, se seleccionó de manera aleatoria a 10 para ser evaluados mediante un nuevo análisis clínico y una nueva tomografía por emisión de positrones (con un tiempo entre ambos estudios no mayor a una semana) al final de seis meses de tratamiento (Figura 1).
Figura 1. Algoritmo del estudio.
Se compararon los resultados obtenidos en ambas pruebas. Se valoró a través de tablas cruzadas la sensibilidad y especificidad, el valor predictivo positivo y negativo de los criterios clínicos en comparación con PET para detectar actividad inflamatoria. Se estableció el coeficiente de correlación de Spearman entre los criterios clínicos y por tomografía por emisión de positrones. Se compararon las diferencias entre el primer y el segundo PET basados en las unidades SUV a través de una prueba t de Student. Se utilizó el programa SPSS V.16 para el análisis de los datos.
Resultados
Se incluyeron en el estudio 35 pacientes (34 mujeres y un hombre) con una edad promedio de 31 ± 11 años con diagnóstico de AT de acuerdo a los criterios del ACR.
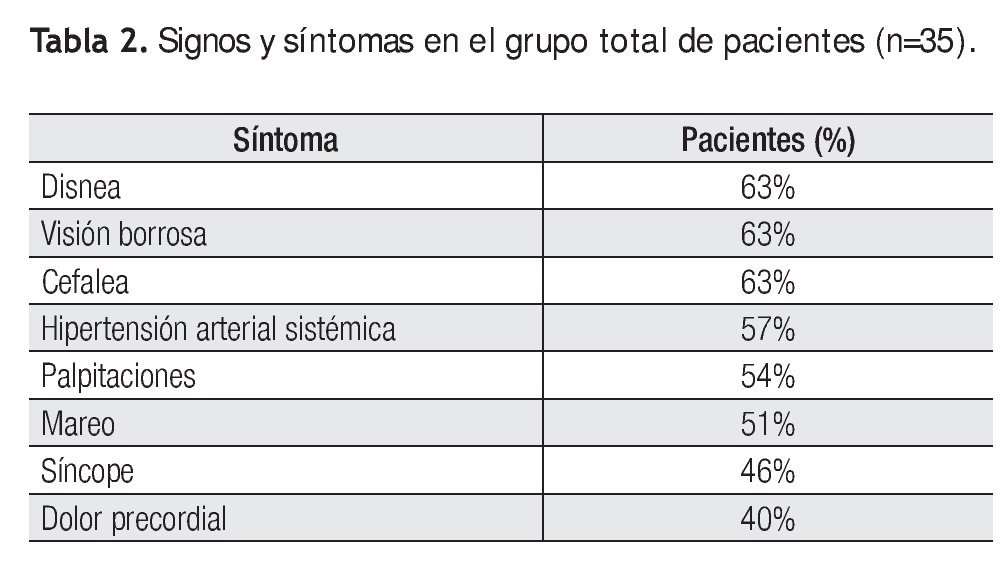
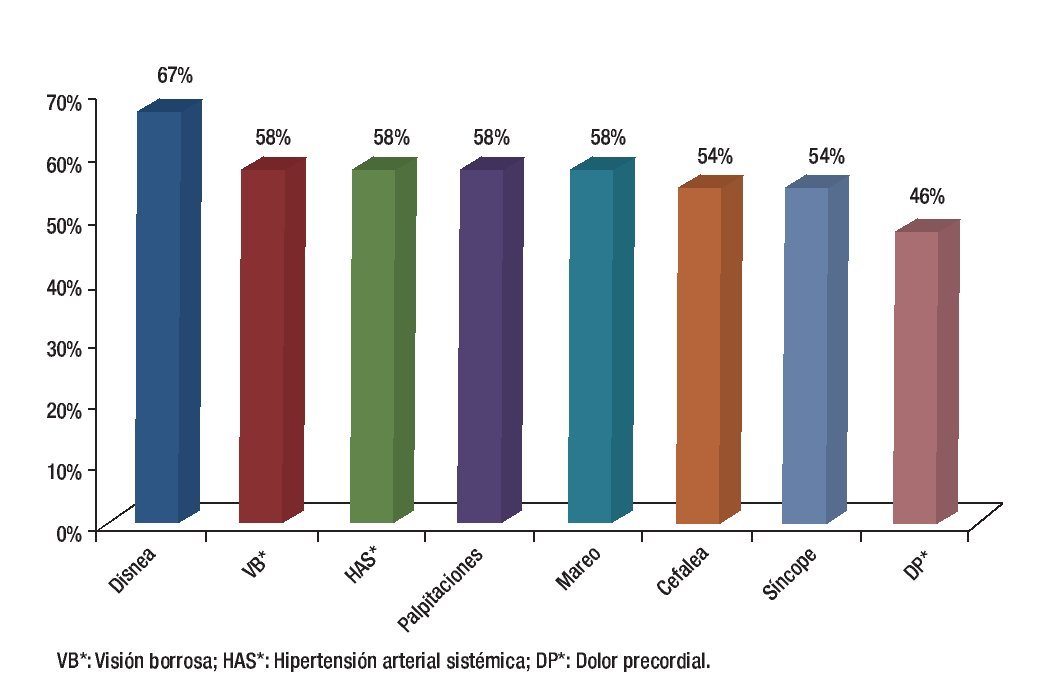
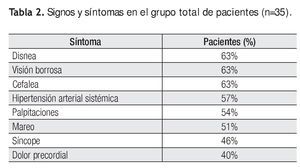
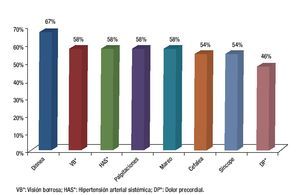
Se analizó la prevalencia de los síntomas principales al momento de inicio del estudio, así como los criterios clínicos y su correlación con la presencia de actividad inflamatoria mediante PET. La disnea, visión borrosa y cefalea fueron los síntomas más frecuentes entre todos los pacientes (63%) al inicio del estudio, sin embargo, al analizar su relación con la presencia de actividad inflamatoria por PET, la disnea fue el que tuvo mayor asociación (67%) (Tabla 2 y Figura 2).
Figura 2. Correlación de los signos y síntomas con la presencia de actividad por PET. n=24.
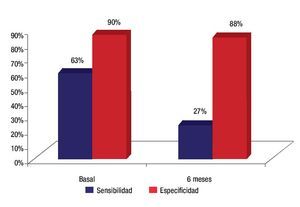
Los criterios clínicos globales en el estudio inicial demostraron una sensibilidad para diagnosticar actividad inflamatoria de 63%, especificidad de 90%, valor predictivo negativo de 52% y un valor predictivo positivo de 93%, con una correlación de 0.49 en comparación con los hallazgos mediante PET.
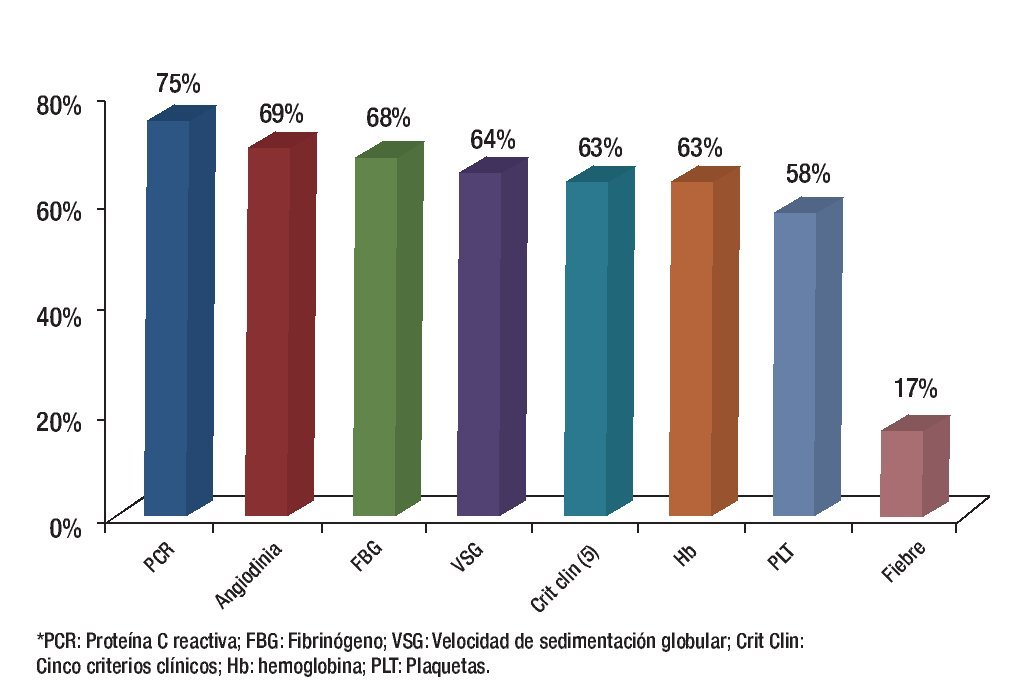
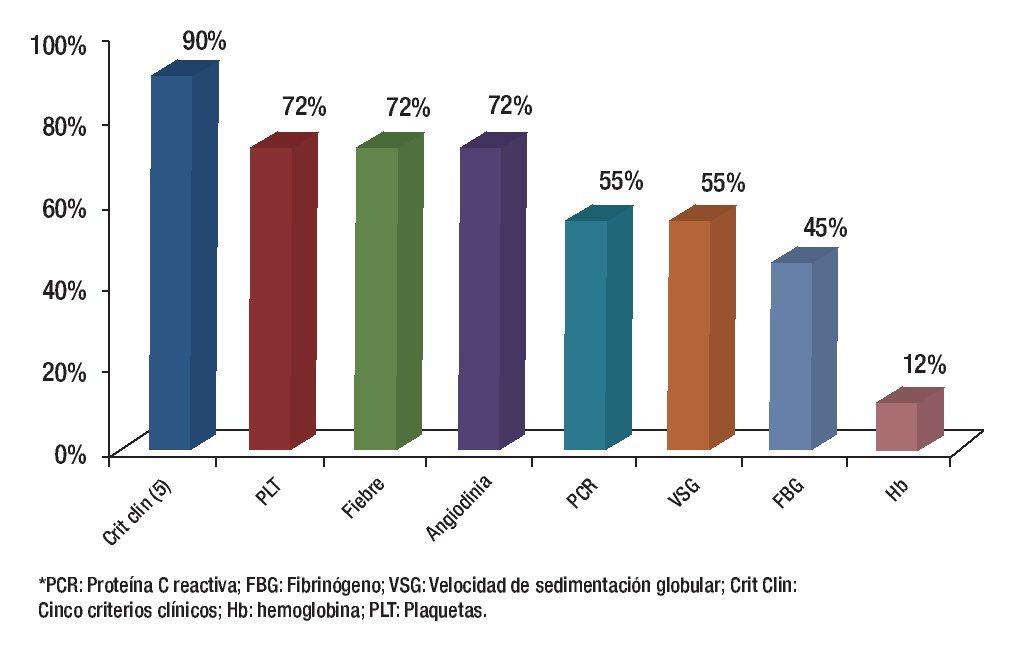
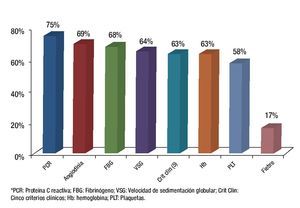
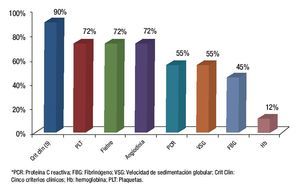
Cuando se analizó cada uno de los criterios clínicos en forma independiente se encontró que la mayor sensibilidad la tuvo la determinación de la PCR y la mayor especificidad la presencia de angiodinia (Figuras 3 y 4).
Figura 3. Sensibilidad de los criterios para demostrar actividad inflamatoria.
Figura 4. Especificidad de los criterios para demostrar actividad inflamatoria.
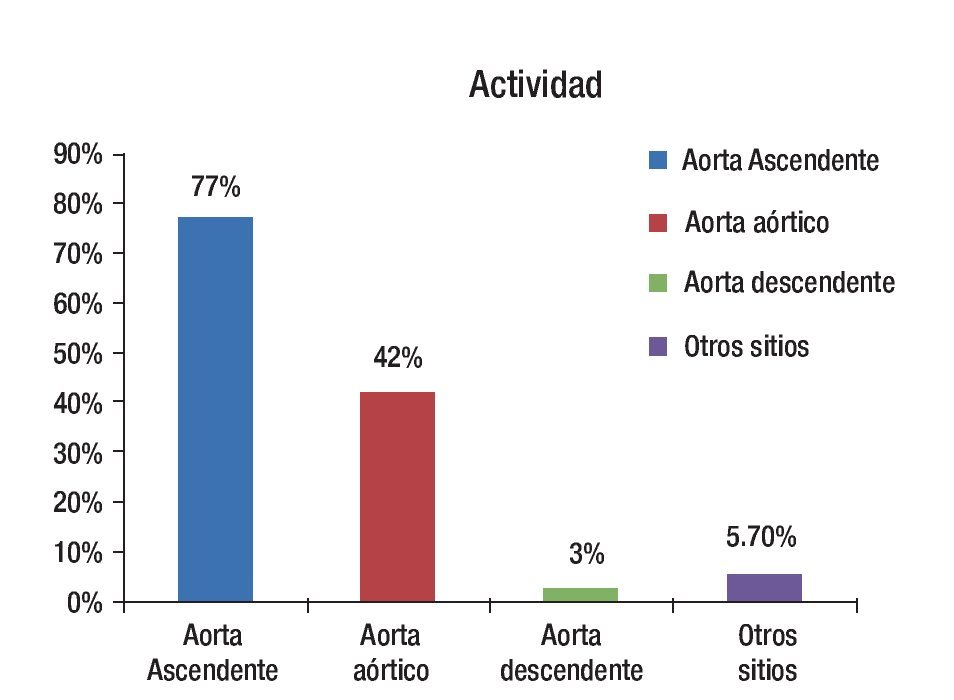
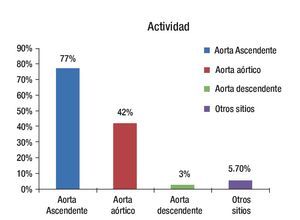
De los 35 pacientes estudiados en forma inicial, 24 tuvieron actividad inflamatoria demostrada mediante PET, el resto de ellos (11 pacientes) no cumplieron con criterios de actividad por PET y no fueron considerados para el estudio de seguimiento. Los sitios de mayor afección en los pacientes con actividad fueron la aorta ascendente y descendente (Figura 5).
Figura 5. Distribución de la actividad por territorios de mayor captación de SUV.
De los 24 pacientes, 19 recibieron manejo con prednisona y metrotexate, dos con prednisona solamente y tres más con ciclofosfamida y prednisona (seis dosis mensuales y cuatro dosis trimestrales de 750 mg/m2 de superficie corporal).
De los 24 pacientes con actividad inflamatoria por clínica, en 19 de ellos se concluyó la fase de seguimiento, 10 pacientes de estos fueron seleccionados de manera aleatoria para un nuevo estudio clínico y por PET al final de seis meses de tratamiento.
Dentro del grupo de seguimiento, se analizó la sensibilidad y especificidad de los criterios clínicos para determinar actividad durante el seguimiento a pacientes que previamente se consideró con actividad inflamatoria y que recibieron tratamiento para la misma.
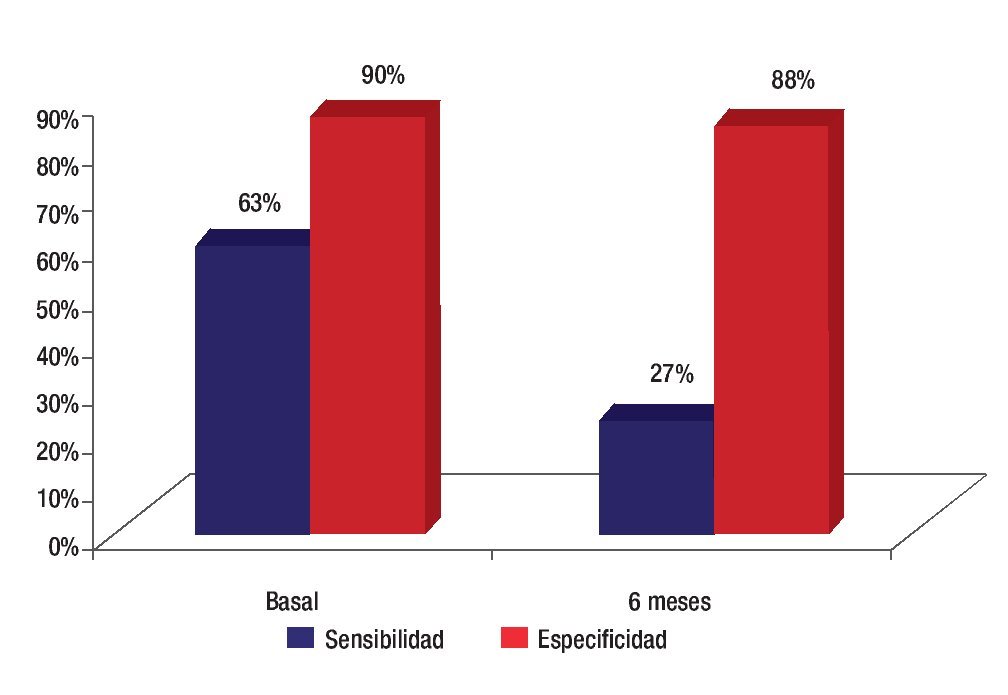
La sensibilidad de los criterios clínicos para detectar actividad infamatoria disminuyó a 27% en el estudio de seis meses sin embargo la especificidad mejoró al 88% al final de este periodo de tiempo (Figura 6).
Figura 6. Sensibilidad y especificidad de los criterios clínicos para detectar.
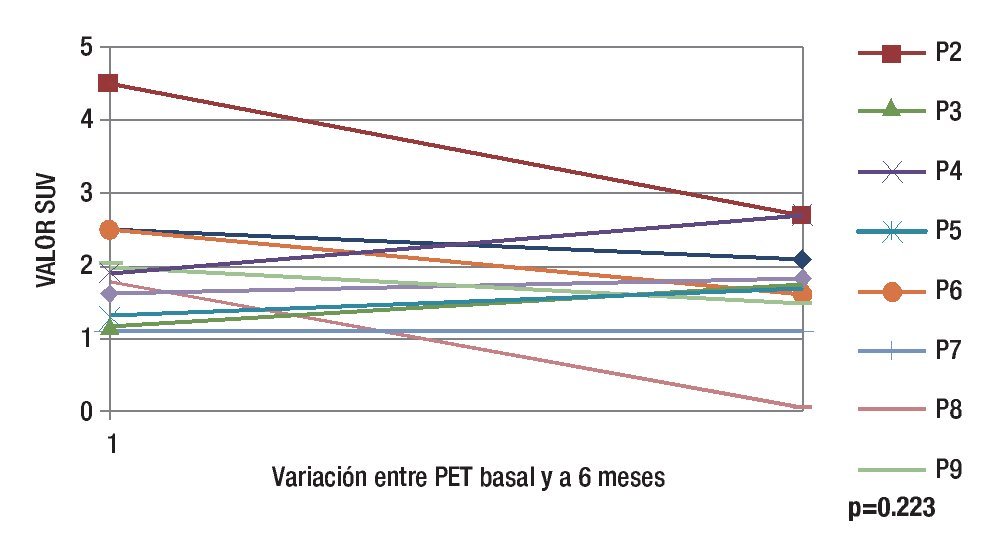
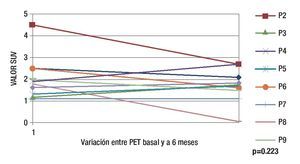
El valor predictivo positivo de los criterios clínicos fue de 75% y el valor predictivo negativo de 47% a los seis meses. El coeficiente de correlación entre los criterios clínicos de actividad y el PET fue de 0.50 a los seis meses de tratamiento. Se compararon los resultados de las SUV obtenidas mediante PET en el estudio basal y en el estudio de control encontrando que a seis meses de tratamiento la diferencia no es significativa cuando se determina actividad inflamatoria por PET (Figura 7).
Figura 7. Comparación entre las unidades SUV en el estudio basal y a 6 meses.
Discusión
Con base en los análisis realizados, se observó que los criterios clínicos para determinar la presencia de actividad inflamatoria son poco sensibles pero altamente específicos al determinar actividad inflamatoria en pacientes con AT, hecho que correlaciona con lo publicado previamente, en donde hasta 40% de los pacientes en los cuales se descartó la presencia de actividad inflamatoria por clínica, en realidad persistían positivos en los estudios de histopatología.1,15,44,45. En nuestro estudio se demuestra cómo posterior al tratamiento, los criterios clínicos pierden sensibilidad, mientras que mediante PET aun pueden detectarse aquellos pacientes que persisten activos pero de forma subclínica.
Debido a la baja sensibilidad de los criterios clínicos para establecer actividad en la AT, se han desarrollado varias técnicas de diagnóstico que han tratado de utilizarse en el diagnóstico de actividad inflamatoria, entre las cuales se encuentran la determinación de reactantes de fase aguda como son la velocidad de sedimentación globular (VSG) y la proteína C reactiva (PCR). En este estudio se encontró a ambas técnicas poco sensibles, hallazgo previamente descrito por Hoffman en donde no se demostraron diferencias entre los resultados de VSG y PCR de pacientes con AT y voluntarios sanos.46
Entre los estudios de imagen mediante los cuales se ha intentado diagnosticar actividad inflamatoria se encuentran la angiografía convencional, la cual tiene algunas limitaciones como son la poca capacidad para evaluar cambios estructurales en etapas tempranas de la enfermedad, así como el inconveniente de ser una técnica invasiva que incluso puede agravar el daño a nivel local.17
Otras técnicas de diagnóstico no invasivas que se han utilizado son el ultrasonido doppler de alta resolución, la tomografía computada y la resonancia magnética.17,47,48
A diferencia del PET, el ultrasonido tiene una baja capacidad para detectar lesiones a nivel de la aorta, en el territorio carotídeo distal, así como a nivel proximal de la subclavia.9 Considerando los hallazgos de este estudio, la mayor afección encontrada fue a nivel de la aorta, por lo que el ultrasonido tendría una baja capacidad para detectar a dichos pacientes.
La angiotomografía ha sido utilizada para valorar pacientes con AT, ésta permite la detección de engrosamiento de la pared arterial en la fase pre-estenótica y ayuda a diferenciar entre la afección aterosclerosa de la causada por AT,49 sin embargo, hasta el momento hay poca información en la literatura actual y existen controversias de su utilidad en la capacidad de valoración de actividad durante el seguimiento de los pacientes.50,51 Una de las limitaciones de la angiotomografía, a diferencia del PET, es que requiere de la administración de material de contraste yodado y la poca capacidad de valorar las ramas distales de la aorta.
La resonancia magnética provee una alta resolución espacial para la detección de alteraciones anatómicas como el engrosamiento de las paredes arteriales, cambios luminales o la formación de aneurismas, con la ventaja de que no utiliza radiación ni contraste yodado.52,53
La resonancia permite valorar la presencia de edema en la pared arterial, la cual se ha intentado correlacionar con el grado de actividad inflamatoria, sin embargo, los resultados son controversiales y parece no existir una correlación directa entre el grado de edema y la progresión de la enfermedad.54
En este estudio encontramos que el PET, al tener una capacidad de detección de cambios fisiológicos (inflamatorios) más que anatómicos, permite valorar la presencia de actividad en forma temprana, así como la capacidad de seguimiento de los pacientes durante el tratamiento, hecho que parece conferirle a esta técnica superioridad sobre las otras, sin embargo se requiere de estudios comparativos entre las diferentes técnicas de imagen para poder establecer cuál de ellas es la más adecuada para determinar actividad inflamatoria en AT.
Ventajas y limitaciones del estudio: A diferencia de los estudios publicados,42,43 una de las ventajas que encontramos en este estudio es que fue diseñado de manera prospectiva para comparar los hallazgos de la tomografía por emisión de positrones en forma inicial y posterior al tratamiento. En nuestro conocimiento, éste es el primer estudio en donde se valora la capacidad de la tomografía por emisión de positrones para determinar actividad inflamatoria en pacientes con AT antes y después del tratamiento. Otra ventaja atribuible a la técnica es la capacidad de demostrar actividad inflamatoria en las fases preestenóticas.34,40,55
Dentro de las limitaciones inherentes a la técnica de tomografía por emisión de positrones se encuentran, su elevado costo, la poca disponibilidad de la técnica, en especial en países en desarrollo y que requiere de radiación.
La limitación más importante de este estudio es que los resultados de la tomografía por emisión de positrones no fueron comparados con el estándar de oro que son los hallazgos histopatológicos de cada paciente, sin embargo, se requeriría realizar biopsias en todos los casos, lo cual implica un procedimiento invasivo que tiene poca aplicabilidad con fines de investigación.
Conclusiones
En base a los hallazgos de este estudio, la tomografía por emisión de positrones, parece ser una técnica útil, no sólo en el diagnóstico, sino también en el seguimiento de los pacientes posterior a su tratamiento.
Los criterios clínicos establecidos para determinar actividad inflamatoria tienen una sensibilidad baja, misma que se ve aun más disminuida en el seguimiento postratamiento; determinar el suspender el mismo con base en la negatividad de los criterios clínicos de actividad, puede llevar a un manejo subóptimo de pacientes activos.
Suponemos que mediante PET se podría dar seguimiento de forma más fehaciente a los pacientes con Takayasu y actividad inflamatoria, determinando el momento óptimo para la suspensión de tratamiento para la fase activa. De esta forma, el PET podría llegar a ser el estándar de oro para el seguimiento de los pacientes con AT y actividad inflamatoria de forma no invasiva.
Tal vez la combinación de una técnica de análisis funcional como es la tomografía por emisión de positrones con una técnica de mayor capacidad de resolución anatómica como son la resonancia magnética o la angiotomografía sean necesarias para la valoración integral de estos pacientes.
* Trabajo ganador del "Premio Manuel Vaquero al Investigador Joven en el Área Clínica" otorgado en el XXVI Congreso Nacional de Cardiología, celebrado en Puebla, 2009 por la Sociedad Mexicana de Cardiología.
Correspondencia: Erick Alexánderson Rosas.
Instituto Nacional de Cardiología Ignacio Chávez, Juan Badiano No.1, Col Sección XVI,
Delegación Tlalpan. México DF. CP. 14080.
Teléfono: +52 (55) 55732911.
Correo electrónico:alexanderick@yahoo.com.mx
Recibido el 5 de noviembre de 2009;
aceptado el 11 de octubre de 2010.