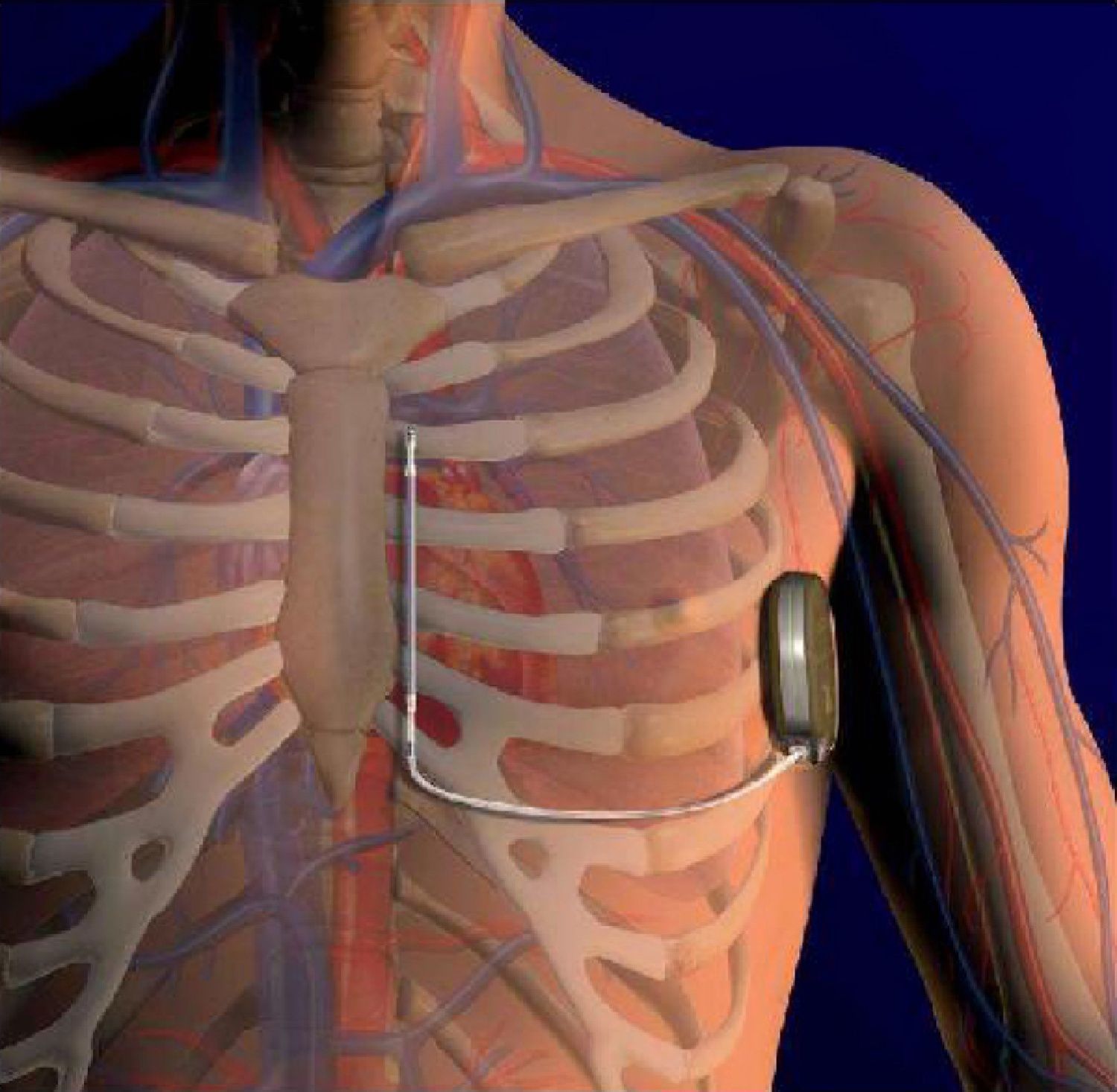
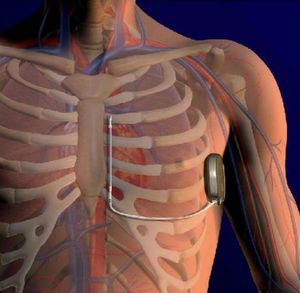
El implante de un cardiodesfibrilador (CDI) se ha transformado hoy, en un procedimiento similar al de un marcapasos. Sin embargo, persisten inconvenientes relacionados principalmente a las vías vasculares en pacientes que portarán el equipo por muchos años, y también merecen una consideración especial los niños y jóvenes, algunos con anomalías de formación del sistema venoso. En tal sentido, puede resultar de utilidad el equipo desarrollado por Bardy y colaboradores para un implante totalmente subcutáneo, incluso sin necesidad de fluoroscopia, ya que el mismo se realiza por marcas anatómicas. El electrodo tripolar se ubica en el tejido celular subcutáneo paralelo al borde esternal izquierdo, y luego paralelo a la quinta o sexta costilla, el generador a la altura de la línea axilar. El equipo puede efectuar una descarga máxima de 80 Joule (J), pero se admite 65J para tener un margen de seguridad adecuado. La tolerancia de los pacientes fue buena. Las pruebas realizadas hasta el presente muestran factibilidad y buenos resultados. Sin duda son necesarios estudios más amplios, aleatorizados, multicéntricos y prospectivos.
The implantable cardioverter-defibrillators (ICD) is a therapy for the prevention of sudden cardiac death. Complications with implant have been associated mainly with transvenous lead insertion. Difficulties in achieving venous access can occasionally result in failed ICD implantation. Lead failures remains a major limitation and often require removal. This procedure is associated with important morbidity and mortality. To eliminate the need for venous access, Bardy et al. designed an entirely subcutaneous ICD system. The subcutaneous ICD consists of a 3-mm tripolar parasternal electrode positioned parallel to the left of the sternal midline and guided exclusively by anatomical landmarks without fluoroscopy. The pulse generator is positioned over the sixth rib between the midaxillary line and the anterior axillary line. The device delivers a maximum of only 80-J shocks. Ventricular fibrillation was converted twice in 58 of 59 patients (98%) with the delivery of 65-J shocks in two tests to ensure a margin of safety. A demand pacing at 50 beats per minute is available for 30seconds after a shock. These studies are preliminary but the system will need to be employ in a long-term, randomized, prospective, multicenter clinical trials.
Desde que en 1980 Mirowski y colaboradores implantaron el primer cardiodesfibrilador (CDI), demostrándose la utilidad de dicho sistema para el tratamiento y la prevención de la muerte súbita, el aparato y la tecnología de implante sufrieron múltiples modificaciones. Lejos estábamos de imaginar en 1985 cuando implantamos el primer equipo en América Latina, que la evolución sería exponencial y vertiginosa.
El procedimiento original requería la ubicación de parches directamente sobre la superficie del corazón, esto implicaba realizar una esternotomía mediana. Pero ya Mirowski había descripto la posibilidad de la desfibrilación transvenosa, que rápidamente se impuso por su menor agresión quirúrgica, sus buenos resultados y la transformación de un procedimiento en principio complejo, a uno de gran parecido con el implante de un marcapasos definitivo. No es este el lugar para describir los múltiples beneficios que entregó el procedimiento, pero si para recordar que también se han sumado inconvenientes y complicaciones, especialmente aquellas relacionadas con el implante de los electrodos transvenosos1.
Las tasas de cualquier complicación fueron declinadas según Al-Khatib y colaboradores, desde 2002 a 2005 del 18.8% a 14.2%. La mayoría de ellas ocurren tempranamente luego del implante, generalmente hasta en el primer día luego del alta. Son más frecuentes si el implante se produce luego de la admisión en un área de emergencia (17.2%), comparada con pacientes ya internados (16.5%) o externos (12.3%) (p=0.002).
Las complicaciones de cualquier tipo estaban en el orden del 10%. Sin embargo, en las publicaciones del Registro Español donde se analizaron 3 291 pacientes, estas descendieron al 0.73%2. Los implantes se hacen comúnmente ingresando por vía de punción de la vena subclavia y aún en las mejores manos, el índice de neumotórax fue del 1.2%. Los hombres vs mujeres tienen menor riesgo de neumotórax (HR 0.50; IC 95% 0.34-0.75, p<0.001). Los hematomas constituyen 2.8%, el taponamiento 0.5% y la infección 0.3%.
En un modelo multivariado, factores independientes asociados con un aumento de complicaciones incluyen edad avanzada, enfermedad pulmonar crónica, demencia, enfermedad renal y recambio de aparato3,4.
Donde el problema se agrava es cuando se trata de pacientes jóvenes y más aún niños que requieren múltiples implantes a lo largo de su vida, con accesos vasculares difíciles por el tamaño, por la anomalía de la disposición venosa o cuando se desarrollan infecciones endovasculares, que obligan a la extracción de los electrodos, entre otros (tabla 1)5–8.
Consideraciones en el implante de electrodos transvenosos
| Necesidad de empleo de fluoroscopia con exposición a la radiación por parte del paciente, y en forma muy importante por el médico que realiza múltiples procedimientos |
| Falta de adecuado acceso vascular |
| Lesión intravascular |
| Fractura o lesión del electrodo con necesidad de reemplazo y/o extracción |
En la prevención de la muerte súbita en pacientes con indicación de trasplante, el CDI se emplea como puente al mismo para reducir el riesgo durante el tiempo de espera del donante. Por tanto, la utilización es baja y generalmente por cortos períodos de tiempo. Es por ello, que en algunos casos puede emplearse el CD externo automático que el paciente lleva permanentemente consigo con parches electrodos adhesivos en el tórax.
Surge entonces la iniciativa de buscar vías alternativas a la transvenosa. El impulso inicial en este sentido surgió de los electrofisiólogos pediatras, quienes más frecuentemente se enfrentaban con el problema5–8.
Los primeros intentos de empleo de electrodos subcutáneos se hicieron para posibilitar el implante más sencillo de un parche −ya que no se aplicaba sobre el epicardio−, en casos de pacientes con dificultad para lograr un adecuado umbral de desfibrilación en el implante total endocavitario9.
Se emplearon luego electrodos subcutáneos en la cara lateral del tórax o en “araña”, que se implantaban desde la cara lateral hacia la pared posterior del mismo10–14.
Evolución del implante totalmente subcutáneoBardy y Capato en 2002 publicaron su experiencia con un prototipo de desfibrilador totalmente subcutáneo, con electrodos no transvenosos ni intratorácicos, concluyendo la posibilidad de ser una alternativa viable al sistema transvenoso15.
Entre 2001 y 2004, Bardy y colaboradores condujeron una serie de estudios tendientes a demostrar la posibilidad de la desfibrilación transcutánea, diseñar la geometría de los electrodos y compararlos con el sistema transvenoso16.
En 2006, Grace y colaboradores presentaron en Heart Rhythm Society los primeros 10 implantes exitosos con electrodos subcutáneos, concluyendo que cuando la energía liberada en el subcutáneo está entre 60 y 80 Joule (J), la localización exacta de los electrodos en el tejido celular subcutáneo de la pared anterior del tórax es poco relevante y no requiere una ubicación muy precisa17.
Un año después confirmaron sus hallazgos al evaluar 150 pacientes con diferentes configuraciones en base a reparos anatómicos, en el implante quirúrgico sin fluoroscopia. Para evaluar el éxito en la desfibrilación se consideró un adecuado margen de seguridad una salida de entre 60J y 80J18,19.
GeneradorEn la actualidad el generador pesa 145g, 69 cm3, tiene caja activa y una longevidad programada de cinco años.
Se chequea programando choques de 65J para tener un adecuado margen de seguridad, ya que libera un máximo de 80J. Permite revertir automáticamente la polaridad si el primer choque fue inefectivo. Además, puede realizar una estimulación transtorácica a demanda a 50 latidos/min durante 30 segundos, mediante una onda de pulso bifásica de 200mA. El marcapasos se activa automáticamente si existe asistolia poschoque.
Son programables la terapia de choque, la estimulación poschoque, discriminación de taquicardia supraventricular (on/off) y frecuencia superior de corte de la zona de choque (entre 170 a 240/min). Se almacenan electrogramas antes del evento y los marcadores del ritmo hasta la terminación del mismo. Puede guardar hasta 24 episodios de hasta 120 segundos.
Técnica de implanteSe efectúa una incisión a lo largo del quinto o sexto espacio intercostal izquierdo inframamario, donde se ubicará el generador entre la línea axilar anterior y media. Desde ese punto se avanza un introductor para tunelizar el electrodo hasta el borde externo izquierdo del esternón, y luego paraesternal izquierdo a 1-2cm hasta la línea media, entre el apéndice xifoides y el manubrio del esternón (fig. 1)20.
El catéter tripolar de 3mm es de policarbonato uretano (pasta de resina). El electrodo de choque tiene 8cm y se coloca adyacente al manubrio esternal. Tiene además dos electrodos de sensado, el distal adyacente al manubrio esternal y el proximal vecino al apéndice xifoides.
Durante los estudios clínicos se ensayaron cuatro configuraciones diferentes de los electrodos, pero la localización del generador lateral izquierdo con un electrodo paraesternal de 8cm tuvo los menores umbrales de desfibrilación, aun cuando no había diferencias significativas con las otras disposiciones (p=0.07).
La optimización en la inserción puede casi olvidarse en vista los buenos resultados, si se emplean energías entre 60J y 80J. El procedimiento se realiza guiándose por reparos anatómicos sin fluoroscopia, aunque en casos de alteraciones anatómicas ésta podría ser de utilidad.
En experiencias tempranas se señala que el implante incluyendo los test, duró 67±33 minutos para los primeros tres implantes por operador, y disminuyó a 55±23 minutos para los siguientes21.
Complicaciones y limitaciones del sistema subcutáneoDurante el seguimiento se observó el desplazamiento del electrodo subcutáneo, que se solucionó con un sistema de anclaje.
La dificultad para la estimulación transtorácica se ha resuelto limitando su empleo a 30 segundos poschoque, esto también restringe la utilización del marcapasos para revertir episodios de taquicardia ventricular, la necesidad de estimulación ventricular definitiva a largo plazo o la imposibilidad de estimulación bicameral.
Por estas razones, el sistema subcutáneo no es una alternativa válida sobre el sistema transvenoso cuando se necesita estimulación permanente.
No obstante, tendría indicaciones precisas y útiles en niños y jóvenes, que necesitarán protección a largo plazo. Como ejemplo baste citar pacientes con síndrome de QT prolongado congénito, enfermedad de Brugada, intervalo QT corto, entre otros (tabla 2)22.
Indicaciones y ventajas del CDI subcutáneo
| Pacientes jóvenes que emplearán el CDI por largo tiempo |
| Prevención primaria de trastornos eléctricos (síndromes congénitos de QT largo/QT corto, síndrome de Brugada, etc.) |
| Complicaciones de los electrodos endocavitarios |
| Dificultad en los accesos vasculares (pacientes con anomalías congénitas y/o correcciones quirúrgicas |
| No requieren una habilidad y un entrenamiento especial para el implante |
| No requiere radioscopia |
| Equipos más económicos, menores requerimientos técnicos en sala y del personal especializado para el implante |
Sin embargo, no existen seguimientos prolongados que evalúen modificaciones de los umbrales de desfibrilación y/o de la posición de los electrodos con el crecimiento.
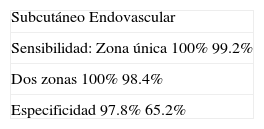
Detección de la arritmiaLos análisis de sensibilidad se realizaron comparando equipos con implante endovascular unicameral y subcutáneo, programando una zona de detección única (frecuencia ≥ 170 latidos/min) y también dos zonas (fibrilación > 240 latidos/min; taquicardia ventricular ≥ 170 latidos/min).
La detección de las arritmias ventriculares no fue diferente con el sistema subcutáneo, comparado con el transvenoso unicameral. El tiempo medio a la administración de la terapia fue 14.0±2.5 segundos. La sensibilidad fue elevada y similar para los dos sistemas de detección, así se hubiera programado para una o dos zonas.
La especificidad en cambio fue significativamente mejor para el sistema subcutáneo, comparado con el endocavitario con electrodo único ventricular 97.8% vs 65.2%, respectivamente (rango: 53.3%-86.7%) (p<0.001) (tabla 3)23.
La mayoría de las clasificaciones inadecuadas fueron por fibrilación auricular. Burke y colaboradores analizaron las señales subcutáneas del electrocardiograma (ECG), tanto QRS como onda T y su relación, concluyendo que eran adecuados para la detección de la arritmia18,24.
Para el sensado, el equipo puede emplear tres configuraciones, 1) entre los dos terminales del electrodo subcutáneo paralelo al esternón, 2) entre el electrodo distal y la caja del aparato ubicada en la cara lateral del tórax y 3) entre el electrodo proximal y la caja. El sistema subcutáneo selecciona automáticamente un vector apropiado para la detección del ritmo, eliminando el doble conteo del QRS y el sobresensado de la onda T, probablemente estas características incrementen la especificidad.
Umbral de desfibrilación con electrodo subcutáneo vs transvenosoCuando se compararon los umbrales para la desfibrilación entre los electrodos subcutáneos (temporarios) y endocavitarios, obviamente estos fueron menores para los transvenosos, umbral medio de desfibrilación transvenoso 11.1±8.5J (IC 95% 8.6-13.5) y con el subcutáneo 36.6±19.8J (IC 95% 31.1-42.5) (p<0.001)25.
Si bien, en la actualidad en los implantes endocavitarios se ha abandonado la búsqueda del umbral verdadero, y se realiza únicamente el test de integridad del sistema, en el implante subcutáneo donde la experiencia es menor, por ahora es prudente buscarlo.
Tolerancia del pacienteA pesar de tratarse de choques de mayor energía que los usados por los sistemas endovasculares, éstos fueron bien tolerados por los pacientes20.
Ensayo clínico europeoBardy y colaboradores26 estudiaron 55 pacientes en un ensayo clínico, quienes recibieron un cardiodesfibrilador subcutáneo. Finalmente, se pudo evaluar a 53 pacientes en cuanto a sensado y desfibrilación. Se indujeron 137 episodios con 100% de detección. En 52 de 53 pacientes (98%) se indujeron dos episodios convertidos exitosamente con 65J, con polaridad estándar en 50 y con reversión de la misma en dos pacientes. Fueron seguidos durante 10±1 meses, 54 de 55 pacientes estaban vivos (98%). Un paciente que pidió ser desconectado falleció en insuficiencia renal.
No hubo fracturas del catéter ni erosiones en la piel. Debido al desplazamiento del electrodo observado en tres pacientes, se sugiere el anclaje del extremo distal del mismo. Por ruido muscular hubo sensado inadecuado en tres pacientes. Se solucionó con reprogramación.
En otro caso, el sensado inadecuado se debió a la modificación de la duración del complejo QRS que durante taquicardia sinusal, se ensanchó con bloqueo de rama derecha.
No se observaron choques inadecuados por fibrilación auricular, taquicardia sinusal o taquicardia supraventricular, tenían frecuencias de más de 170 latidos/min. En tres pacientes se detectaron y trataron adecuadamente 12 episodios de taquicardia ventricular espontánea26.
Recientemente se publicaron los primeros resultados del registro EFFORTLESS S-ICD, que incorporó 149 pacientes con un seguimiento medio de 13 meses. La indicación fue prevención primaria en el 67%, de ellos el 54% presentaba cardiopatía isquémica. La eficacia de la reversión en la inducción intraoperatoria 98.4%, con un choque de 65J. En el seguimiento 16 pacientes tuvieron terapias, nueve apropiadas (6%), cinco por sobresensado de la onda T o ruido y cuatro por taquicardia supraventricular. Las terapias inapropiadas fueron corregidas por reprogramación27.
ConclusionesSi bien son promisorios estos estudios, aún pueden considerarse como preliminares. Se demostró que el sistema totalmente subcutáneo es posible, funciona correctamente en cuanto a la detección y a la desfibrilación con energía suficiente, empleando generadores que cargan hasta 80J y margenes de seguridad adecuados, pues desfibriló eficazmente con una energía submáxima de 65J y un margen de seguridad de 15, el 98% de los pacientes.
La comparación con el sistema transvenoso no debe hacerse, pues los objetivos son diferentes. El sistema subcutáneo tiene además el inconveniente de no poder realizar marcapaseo permanente, sólo temporal luego del choque. Tampoco ha de emplearse en pacientes con taquicardias ventriculares, con frecuencias menores a 170 latidos/min. Además y debido a que si bien el choque ha sido bien tolerado causa disconfort, y por lo tanto, tiene limitaciones para tratar episodios frecuentes y recurrentes de taquicardia ventricular.
Los inconvenientes encontrados con los implantes subcutáneos son realmente de poca importancia, seguramente se irán solucionando con destreza y habilidad a medida que surjan. Un ejemplo de ello es el anclaje del electrodo paraesternal en su extremo distal.
Sin duda este sistema necesita de mayor número de implantes y seguimiento en un estudio aleatorizado, prospectivo y multicéntrico16.
A la luz de la experiencia actual sería ideal para pacientes con difícil acceso endovascular, y de mucha utilidad en jóvenes como prevención primaria en trastornos eléctricos como el síndrome de Brugada o el síndrome de QT prolongado congénito, síndrome QT corto, algunos casos de displasia arritmogénica del ventrículo derecho, donde otros estudios ya han demostrado que se produce un bajo número de episodios, y sin embargo existe la necesidad de cubrir el riesgo de muerte súbita.
FinanciamientoNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.