La cardiopatía isquémica es la principal causa de muerte e insuficiencia cardiaca a nivel mundial. Esto hace de vital importancia el desarrollo de nuevas modalidades terapéuticas, que disminuyan la mortalidad y complicaciones a largo plazo en estos pacientes. Una de las principales líneas de investigación a nivel mundial es la regeneración miocárdica a partir de células progenitoras, con el fin de mejorar la función sistólica y diastólica de los pacientes con cardiopatía isquémica, además de incrementar su sobrevida.
Con bases teóricas y fisiológicas sobre la función de estas células, se han llevado a cabo con gran entusiasmo a nivel mundial, estudios en animales y humanos para tratar de definir la utilidad del empleo de las células madre, en el manejo de los pacientes con cardiopatía isquémica. En la actualidad, la terapia regenerativa en la cardiopatía isquémica es considerada una herramienta terapéutica novedosa, de beneficios teóricos considerables y pocos efectos adversos. En esta revisión presentamos los fundamentos científicos básicos que apoyan el empleo de esta terapia, la evidencia clínica actual sobre su beneficio. Señalamos los puntos controversiales y las perspectivas sobre su empleo y utilidad a corto y largo plazo.
Ischemic heart disease is the leading cause of death and heart failure worldwide. That is why it is important to develop new therapeutic modalities to decrease mortality and long-term complications in these patients. One of the main lines of research worldwide is myocardial regeneration, using progenitor cells in order to improve systolic and diastolic function in patients with ischemic heart disease, as well as to increase their survival.
There have been carried out, with great enthusiasm worldwide, human and animal studies to define the usefulness of stem cells in the management of patients with ischemic heart disease. Today, regenerative therapy in ischemic heart disease is considered a novel therapeutic tool, with substantial theoretical benefits and few side effects. Here we present the scientific principles that support the use of this therapy, discuss the current clinical evidence available; and point out the controversial issues still not clarified on its use and usefulness in the short and long term.
Las enfermedades cardiovasculares son una de las principales causas de muerte y morbilidad en México y en el mundo1. A pesar de que en los últimos años la mortalidad de la cardiopatía isquémica ha disminuido2,3, un gran porcentaje de estos pacientes desarrollan remodelación cardiaca posterior al infarto, proceso que deteriora la función contráctil y que no siempre logra revertirse con el manejo habitual4, por lo cual en la actualidad, la cardiopatía isquémica es la principal causa de insuficiencia cardiaca5. Esto hace de vital importancia el estudio de nuevas modalidades terapéuticas, que disminuyan la mortalidad y complicaciones a largo plazo en estos pacientes6–9.
Una de las principales líneas de investigación a nivel mundial es el desarrollo de fármacos y/o estrategias terapéuticas, que disminuyan la mortalidad y morbilidad de los pacientes con cardiopatía isquémica10,11. Entre estas, se han evaluado con gran interés las técnicas de regeneración miocárdica a partir de células progenitoras, con el fin de mejorar la función sistólica y diastólica de los pacientes con cardiopatía isquémica12–14. Con bases teóricas y fisiológicas acerca del reclutamiento normal de dichas células en el tejido isquémico, y la evidencia de diferenciación de células primitivas en células de tipo miocárdico, así como los resultados favorables, tanto en fracción de expulsión del ventrículo izquierdo (FEVI) como en viabilidad miocárdica, se han llevado a cabo estudios en animales y humanos para tratar de definir la utilidad del empleo de las células madre en el manejo de los pacientes con cardiopatía isquémica15,16, presentándose como una herramienta terapéutica novedosa, de beneficios teóricos considerables y pocos efectos adversos17–19.
En la actualidad, el campo de investigación de células madre sigue siendo intrigante, promisorio y lleno de preguntas sin respuesta20. En esta revisión presentamos los fundamentos básicos que apoyan el empleo de la terapia celular, la evidencia clínica sobre su beneficio y señalamos la necesidad de estudios prospectivos de mayor magnitud, que nos proporcionen resultados sólidos sobre su beneficio a corto y largo plazo.
Mecanismos de acciónEl trabajo sobre la vasculogénesis posnatal a través de células progenitoras endoteliales derivadas de médula ósea (Ashara y colaboradores), abrió la puerta para la investigación de nuevas formas encaminadas a mejorar el flujo sanguíneo en el miocardio dañado. Estos estudios revolucionaron la antigua creencia de la incapacidad de regeneración cardiaca, en la cual se consideraba que los cardiomiocitos no se regeneran después del nacimiento, y que responden a las señales de proliferación sólo con hipertrofia y no con hiperplasia21–23. Los descubrimientos sobre la replicación del miocito dieron pie a la teoría de la “plasticidad miocárdica”, concepto que en la actualidad ha sido demostrado tanto in vitro como in vivo, al observar que las células derivadas de médula ósea pueden diferenciarse en cardiomiocitos, estimulando la regeneración a partir de células infundidas y de las células progenitoras del tejido local24–26. Makino y colaboradores demostraron que las células estromales de la médula ósea de ratón al ser estimuladas con 5-azatidina, adquirían características similares a las del miocardio, como tinción positiva para miosina, actina y desmina, latido espontáneo a las tres semanas, además de una ultraestructura similar a la de los cardiomiocitos27. De igual manera, Orlic informó que al inyectar células derivadas de médula ósea en ratones con infarto, estas eran capaces de anidarse, diferenciarse y regenerar el tejido miocárdico dañado28.
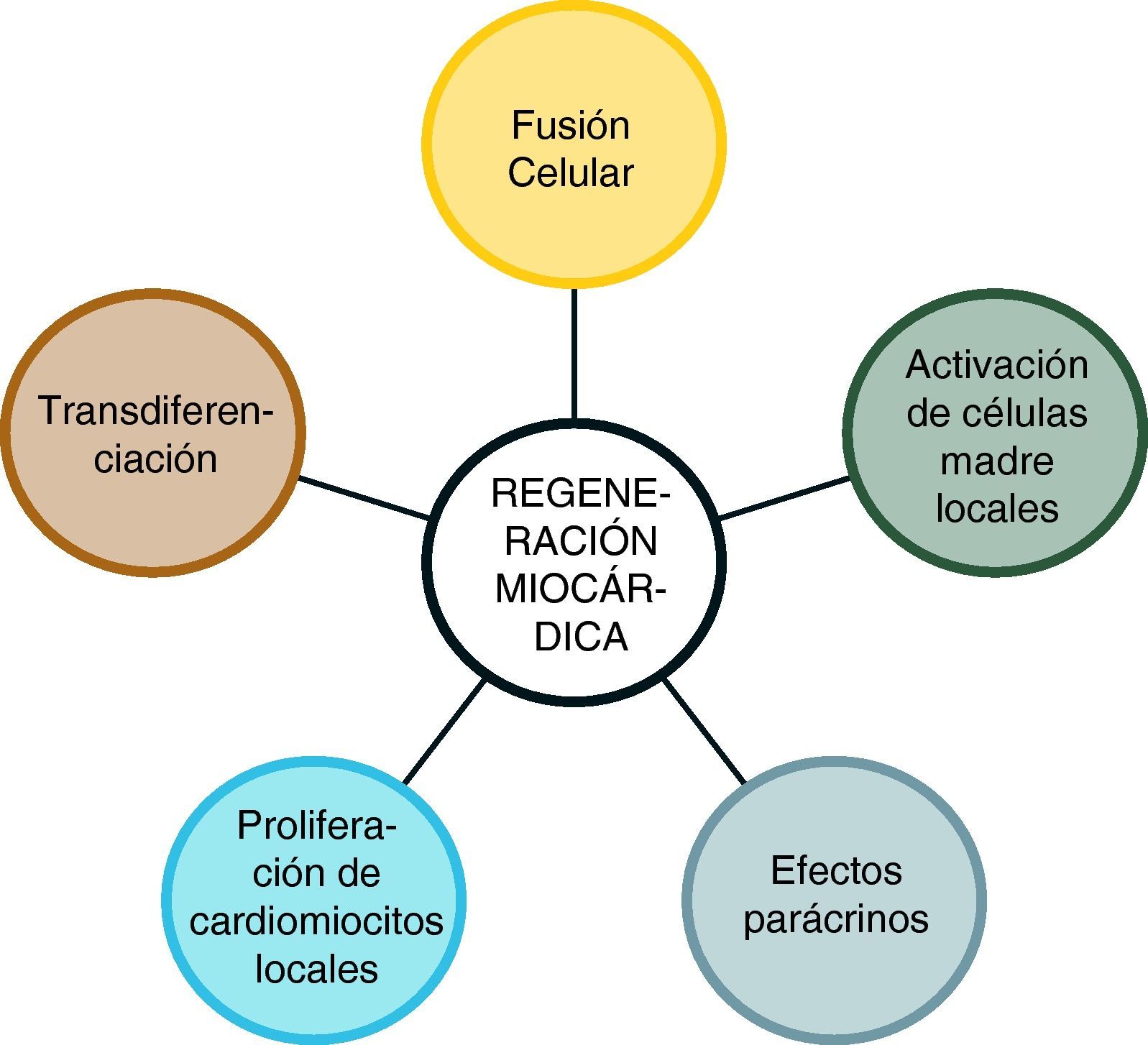
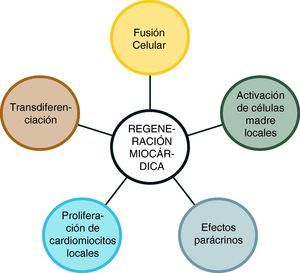
Una de las principales controversias en relación al empleo de las células madre es la capacidad de cierto tipo celular para diferenciarse in vivo a cardiomiocitos (principalmente, las células de origen hematopoyético). Se ha observado diferenciación in vitro e in vivo de células hematopoyéticas progenitoras, pero su relevancia clínica en el contexto de la regeneración de un número importante de células afectadas por la isquemia se desconoce29,30. Rupp publicó un estudio de “prueba de concepto” en el que demostró la expresión de marcadores genéticos cardiacos específicos, en células progenitoras circulantes al ser modificadas ex vivo31. A pesar de esta controversia, la “diferenciación” es uno de los mecanismos postulados como primordiales en el efecto benéfico de la terapia celular. En la actualidad, el debate sigue y se estudia la posibilidad de transdiferenciación de múltiples líneas celulares a cardiomiocitos32. Otro mecanismo postulado para la regeneración miocárdica es la “fusión celular”33, teoría que propone la fusión de las células trasplantadas con las células miocárdicas locales formando células “híbridas” con marcadores celulares de ambas, creando así, una nueva generación celular con capacidad de regeneración. Sin embargo, aún cuando este mecanismo ha sido demostrado in vitro, su importancia clínica es incierta34.
Dado que el porcentaje de células que finalmente se acoplan en el miocardio es variable, y a que el número de cardiomiocitos y vasos sanguíneos que llegan a generarse después del trasplante es también variable y además reducido en relación al tejido dañado7, se ha propuesto otra teoría para explicar el beneficio de la terapia celular. Ésta se basa en la idea de que las células no sólo actúan mediante la diferenciación y proliferación de cardiomiocitos, sino también mediante la producción de factores de crecimiento y citocinas angiogénicas que estimulan la neovascularización, previniendo así la apoptosis y reclutando células madre cardiacas locales, además de mejorar el microambiente para la implantación celular y crecimiento tisular. Lo anterior es conocido como “efecto paracrino” de las células madre35–37. Entre estas sustancias las más estudiadas han sido el factor de crecimiento del endotelio vascular (VEGF), factor de crecimiento fibroblástico (FGF), angiogenina, factor de crecimiento placentario, factores de crecimiento de los hepatocitos, factor de crecimiento similar a la insulina, interleucina (IL)-10, IL-11, adrenomodulina y la proteína morfogénica de hueso-1 (MBP-1)38–40. Los beneficios de estos efectos paracrinos se han observado al administrar el sobrenadante obtenido de cultivos de células madre41. Quienes defienden esta postura consideran que el efecto de las células madre, se basa en la interacción de los diversos mecanismos de acción conocidos en la actualidad con tres principales vías: neovascularización, cardiomiogénesis y reparación cardiaca (fig. 1).
Cabe mencionar que no sólo los aspectos relacionados al mecanismo de acción de esta terapia, sino también los inherentes a las condiciones propias de los pacientes en quienes se emplean, pueden modificar el efecto e influir en el beneficio observado en los ensayos clínicos realizados42 (tablas 1 y 2).
Factores del huésped que influyen en el efecto de la terapia celular
| • Edad |
| • Estadio de la enfermedad cardiovascular |
| • Función ventricular previa |
| • Número de factores de riesgo cardiovascular |
| • Tiempo de isquemia-reperfusión |
| • Tiempo reperfusión-inyección |
| • Localización del infarto |
| • Presencia de circulación colateral |
| • Alteración microvascular |
Características celulares relacionadas con el efecto de la terapia celular
| • Número de células inyectadas |
| • Capacidad de adhesión celular |
| • Capacidad de transdiferenciación |
| • Supervivencia postrasplante |
| • Número de células “anidadas” |
| • Línea celular específica |
| • Capacidad de acoplamiento electromecánico |
| • Capacidad de liberar factores paracrinos |
| • Inducción de angiogénesis |
| • Activación de células madre locales |
| • Estimulación de proliferación miocárdica |
| • Modificación genética previa al trasplante |
| • Estimulación celular previa al trasplante (factor de crecimiento fibroblástico-2, factor de crecimiento similar a insulina- 1, proteína morfogénica de hueso-1) |
La célula madre se define como aquella capaz de regenerarse y diferenciarse a uno o más tipos celulares. Para su estudio pueden ser clasificadas según su función, origen anatómico u embriológico, así como por sus marcadores celulares de superficie, factores de transcripción o proteínas características.
Quizá la división más clara para su agrupación es el origen embrionario, que las divide en dos grupos principales, células madre embrionarias y adultas43–45. Las células madre adultas pueden ser derivadas de médula ósea, circulantes o específicas de tejido. En la médula ósea encontramos la subpoblación de células madre hematopoyéticas (HSC), células madre mesenquimatosas (MSC), células progenitoras endoteliales (EPC), células adultas progenitoras multipotenciales y a una más, que ha sido denominada en inglés como side-population. Otras poblaciones de células madre adultas incluyen aquellas de origen fetal y de cordón umbilical, mioblastos esqueléticos, de tejido adiposo, las células residentes progenitoras cardiacas, además de una novedosa población pluripotente que puede ser inducida a partir de fibroblastos, a través de reprogramación nuclear utilizando genes ectópicos46,47.
Células madre embrionariasSon células pluripotenciales con la mayor capacidad de regeneración tisular, ya que se puede obtener una cantidad indeterminada de cardiomiocitos a partir de estas células. Se derivan del blastocisto y son capaces de diferenciarse a cualquier tipo celular del organismo, incluyendo cardiomiocitos. Su ventaja radica en una menor inmunorreactividad, debido a la menor cantidad de proteínas de superficie antigénicas. Su uso se ha visto limitado por causas de tipo ético, así como el riesgo de teratomas y teratocarcinomas48.
Células madre adultas: células derivadas de la médula óseaCélulas madre hematopoyéticasLas células madre hematopoyéticas son identificadas por sus marcadores de superficie CD34+ y CD133+, son utilizadas para el tratamiento de las enfermedades hematológicas. Pueden distinguirse diversas subpoblaciones de estas células según sus marcadores de superficie. Tienen capacidad de diferenciarse a células endoteliales32.
Células mesenquimatosasRepresentan una rara población celular en los tejidos del adulto con fenotipo CD34− CD133−, CD90+, CD105+, CD166+, y que pueden diferenciarse a osteocitos, condrocitos, cardiomiocitos, células endoteliales, adipocitos y músculo liso49. Pueden obtenerse de la médula ósea y sangre periférica. Las MSC pueden diferenciarse a cardiomiocitos, previniendo la remodelación y mejorando la movilidad miocárdica, además de incorporarse a la neovasculatura con fenotipo de células endoteliales y de músculo liso50,51. Estas células se han manipulado genéticamente mediante transducción con vectores, con fines de mejorar la anidación celular y la sobrevida postransplante52, por lo que representan una de las líneas celulares más estudiadas y más prometedoras en la actualidad.
Células progenitoras endotelialesNormalmente radican en la médula ósea y puede ser liberadas a la circulación, después del daño miocárdico. Expresan las moléculas CD133+, CD34+ y VEGFR-2, poseen la capacidad de incorporarse a los sitios de neovascularización y diferenciarse a células endoteliales53. Han demostrado aumentar la neovascularización, disminuir la dilatación ventricular y preservar la función sistólica posinfarto. Una de sus limitantes es el número restringido de células, que se pueden obtener de cada paciente.
Células de cordón umbilical y origen fetalEstas células poseen gran plasticidad dado su origen prenatal. Sin embargo, a pesar de que han demostrado tener potencial proliferativo y de diferenciación, los resultados en estudios animales han sido contradictorios con respecto a la mejora en la función ventricular izquierda. Hasta el momento no se cuentan con estudios clínicos que utilicen esta población celular.
Mioblastos esqueléticosSon células que se encuentran en las fibras musculares, pueden ser utilizados como precursores celulares para formar nuevos miocitos. Se obtienen mediante biopsia muscular, lo cual facilita su trasplante autólogo. Tienen una mayor resistencia a la isquemia, lo que permite su integración a tejidos con pobre irrigación sanguínea como en los pacientes con cardiopatía isquémica. Han demostrado disminuir la disfunción ventricular izquierda y mejorar la función sistólica, aumentando la capacidad de ejercicio54.
Células residentes progenitoras cardiacasEstas células han sido aisladas en el tejido cardiaco. Sus características principales son el carácter autólogo y la posibilidad de expansión in vitro. Pueden diferenciarse a células endoteliales, de músculo liso y cardiomiocitos, además de poder integrarse funcionalmente al tejido miocárdico local55. Messina y colaboradores han descrito cúmulos celulares denominados “cardioesferas”, derivados de cultivos de células de origen atrial o ventricular de corazones adultos de humanos y murinos, estos cúmulos demostraron marcadores de células progenitoras y vasculares. Además, tienen propiedades de células madre cardiacas y se diferencian en cardiomiocitos y células vasculares56,57.
Células madre de tejido adiposoSe encuentran normalmente en el tejido adiposo y han sido empleadas experimentalmente por su fácil obtención y numerosa cantidad58. Se pueden diferenciar hacia células con características de cardiomiocitos. En estudios experimentales en animales han demostrado mejorar la función y perfusión miocárdica, a través de un incremento en la neovascularización del tejido infartado, estudios como APOLLO y PRECISE, evalúan su aplicación en la clínica con resultados prometedores59.
Cabe mencionar que aún y cuando existen diferencias significativas entre las poblaciones y subpoblaciones de células madre, y se ha demostrado en un modelo animal de infarto del miocardio, que las MSC poseen mayor capacidad de proliferación y diferenciación comparadas con las HSC, la mayor parte de los estudios clínicos se han realizado utilizando HSC. Recientemente se ha centrado la atención en las células residentes progenitoras cardiacas y las de tejido adiposo, en estas últimas por su relativa abundancia y fácil obtención. Se sugiere que dichas poblaciones muestran una mayor capacidad de diferenciación. Sin embargo, hasta hoy no se cuentan con estudios adecuados que permitan asegurar la superioridad de alguna de las diferentes poblaciones de células madre60,61.
Modificación ex vivo de las células madreCon la finalidad de mejorar los resultados obtenidos en estudios previos, se han modificado las células madre ex vivo con la intención de incrementar su capacidad inherente de mejorar la vasculogénesis62. Una de las variantes de modificación génica ha sido la preprogramación celular con TGF-β63. Actualmente, se utiliza de manera experimental una terapia dual, en la cual la terapia celular se combina con la terapia génica para crear “súper células madre” con capacidad incrementada de mejorar la vasculogénesis e inhibir la apoptosis64.
Dosis administradaEl porcentaje de retención celular después del trasplante es menor al 10%. Esto toma importancia, ya que una de las principales diferencias en los estudios realizados hasta la fecha ha sido la dosis de células infundidas. Iwasaki y colaboradores demostraron en un estudio experimental de infarto en ratas, que con una dosis ascendente de células CD34+ (dosis baja 1×103, media 1×105, o alta 5×105), la densidad capilar y limitación de la fibrosis ventricular fue mayor a dosis más altas. Resultados similares se infieren en los ensayos clínicos65, sin embargo, llama la atención que en dichos estudios las dosis empleadas de las líneas celulares vayan desde 7×107 hasta 2.5×109, incluyendo estudios en los que no se menciona la cantidad de células infundidas, todos con resultados variables respecto a mejoría en FEVI y sobrevida66,67. Por esto, podremos concluir que no existe una dosis perfecta para cada línea celular en la actualidad, pero parece que en términos de beneficio, más será mejor.
Vía de administraciónUn objetivo principal en el empleo de las células madre, es que se administre el mayor número de células posibles en el sitio isquémico y que permanezcan ahí, ya que la neovascularización y anidación tienen relación directa con la dosis y la vía de administración, que se emplea para llevar las células al tejido miocárdico68. Existen diferentes vías de administración, entre las que se encuentran:
- •
Infusión intracoronaria: Por esta vía se administran las células mediante el empleo de un catéter con balón, el cual se insufla durante la administración de las células para incrementar el tiempo durante el cual éstas permanecen en el tejido isquémico, incrementando la posibilidad de distribución de una manera homogénea, a diferencia de la distribución que se obtiene por la vía intramiocárdica, en la cual la distribución celular es en “islas”. Se desconoce el tiempo exacto de retención para lograr un mayor número de anidación celular en el tejido isquémico, y disminuir la isquemia inducida por la oclusión arterial, esta técnica es relativamente sencilla en las manos de un operador experimentado13,17.
- •
Inyección intramiocárdica: Esta técnica implica la inyección directa de las células en el tejido miocárdico, ofreciendo la ventaja de una menor cantidad de células inyectadas para lograr la anidación, además de que pueden ser utilizadas en zonas con baja producción de señales de anidación, como es el tejido cicatricial o en sitios con oclusiones arteriales no accesibles por cateterismo, como en la cardiopatía isquémica crónica. Se prefiere esta vía de aplicación para la administración de células de mayor tamaño como los mioblastos y las células mesenquimatosas68, es la utilizada en protocolos diseñados para administración en cirugía cardiaca.
- •
Inyección transendocárdica: Se utiliza un catéter con una aguja especial, la cual se introduce a través de la válvula aórtica y se adosa a la pared endocárdica inyectando las células directamente. Esta técnica requiere un estudio de viabilidad miocárdica previo para delimitar el tejido viable, cicatricial e isquémico. La distribución de las células no siempre es homogénea, lo cual puede causar discinesia miocárdica al mejorar de manera heterogénea la contractilidad regional. Se considera una posibilidad atractiva ya que su aplicación es sencilla y práctica, sin embargo, para una administración precisa de las células en la región de interés, requiere del uso de navegadores que realizan una reconstrucción tridimensional del ventrículo izquierdo o mapeo electromecánico69.
Existen otras vías de administración como: la transvenosa sistémica y venosa retrógrada, a través del seno coronario70. Actualmente, la forma de administración más utilizada es la infusión intracoronaria.
Papel de la imagen cardiovascular en la terapia celularLa imagen cardiovascular tiene un papel primordial en la evaluación de la anidación celular, pero más aún en la evaluación del efecto benéfico de esta terapia en la estructura y función miocárdica. Existen novedosas técnicas que utilizan el marcaje celular combinado con la imagen cardiovascular. Los principales métodos para evaluar el acoplamiento celular son el marcaje radioactivo celular, el marcaje genético y la reacción en cadena de la polimerasa en tiempo real71. Los estudios de imagen pueden evaluar la distribución temprana y tardía de las células, así como su diferenciación y sobrevida en el tejido. Para evaluar la distribución pueden dividirse en dos grandes grupos: los que permiten el marcaje directo de las células, o los que emplean el marcaje génico para identificar la localización de las células. Los más empleados son los basados en la marcación directa con empleo de medio de contraste específico como la 2-(F-18)-fluro-2-deoxy-D-glucosa para la tomografía con emisión de positrones, el In-111 oxine para la tomografía computarizada con emisión de positrones y el óxido de hierro súper-paramagnético para la resonancia magnética72,73. Sin duda, el empleo de esta tecnología en los futuros estudios clínicos ayudará a determinar las características específicas de tipo celular y técnica de aplicación, para obtener los mejores resultados74,75.
Los métodos de imagen más utilizados en los ensayos clínicos para evaluar la función ventricular postrasplante son el ecocardiograma, la resonancia magnética y el SPECT. Una vez más con una gran variabilidad entre los diferentes estudios, en relación al método seleccionado y aún más, en el objetivo a evaluar ya que no todos los estudios informan sobre el grado de tejido isquémico o la viabilidad según corresponda.
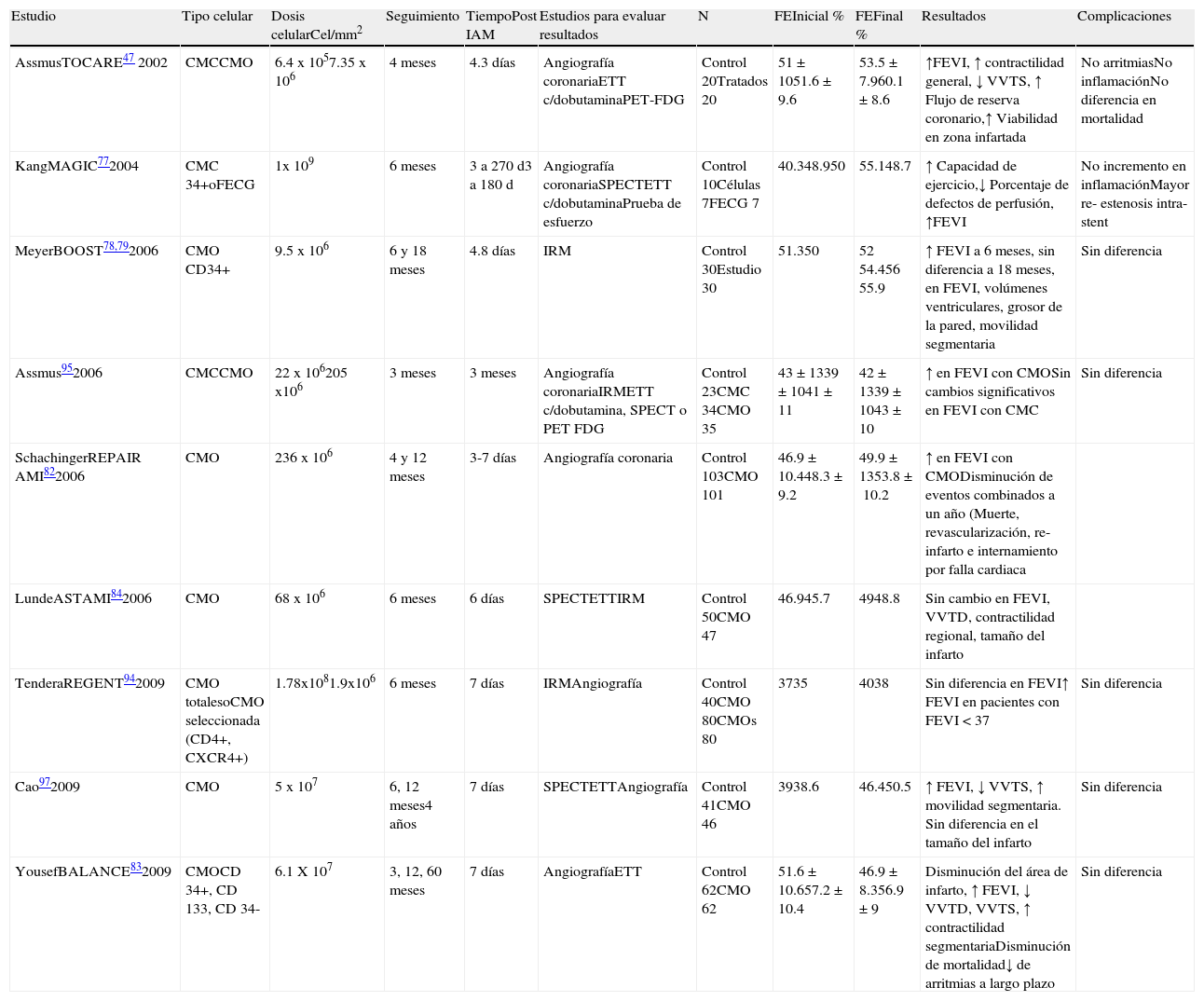
Estudios clínicosLos primeros estudios realizados en humanos incluyeron pacientes con infarto agudo del miocardio tratados con angioplastia primaria, inicialmente se incluyó un número reducido de paciente para evaluar la respuesta hemodinámica y la seguridad del procedimiento (Strauer)46,76 (tabla 3). Assmus y colaboradores publican en el 2002, el estudio TOP CARE AMI, en el cual se analizan pacientes que recibieron tratamiento intracoronario con células madre de médula ósea (n=9), u obtenidas por aféresis plasmática (n=11) en un promedio de 4.3±1.5 días, después del infarto agudo del miocardio, comparándose con 20 controles. El grupo tratado con células madre mejoró su función ventricular, tuvo recuperación en el movimiento de la región infartada así como disminución del volumen ventricular telesistólico, además de mejoría en el flujo de reserva coronario y mayor miocardio viable en la zona infartada. No hubo diferencia en respuesta inflamatoria o arritmias, y no se observaron eventos adversos47. En el estudio MAGIC CELL realizado por Kang y colaboradores, se comparó el empleo intracoronario de células madre movilizadas con factor estimulante de colonias de granulocitos y obtenidas por aféresis plasmática. Se incluyeron pacientes con infarto agudo del miocardio a quienes se les colocó stent intracoronario, 10 pacientes recibieron infusión intracoronaria, 10 sólo factor estimulante de colonia de granulocitos y un grupo control. Se analizaron los cambios en la función ventricular y la perfusión a los seis meses, además de la capacidad de ejercicio mediante prueba de esfuerzo, ecocardiografía de estrés y SPECT con talio/sistamibi. No se encontró incremento en los niveles de marcadores inflamatorios, isquemia, arritmias, falla cardiaca o alteración de la microcirculación. La capacidad de ejercicio mejoró, y disminuyeron los defectos de perfusión miocárdica de 11.6% vs 5.3% (p=0.020). Además hubo mejoría en la FEVI, en el grupo que recibió infusión intracoronaria de células madre. En este estudio se encontró un inesperado aumento en el porcentaje de reestenosis intra stent en ambos grupos de tratamiento, cinco de siete pacientes tratados con infusión celular, y en dos de tres pacientes en el grupo que recibió factor estimulante de colonias de granulocitos. Esto se consideró asociado a la movilización de neutrófilos y plaquetas durante el procedimiento, así como proliferación de músculo liso vascular en el sitio de colocación del stent77, estos resultados adversos no fueron consistentes en estudios posteriores.
Resultados de los principales ensayos clínicos
| Estudio | Tipo celular | Dosis celularCel/mm2 | Seguimiento | TiempoPost IAM | Estudios para evaluar resultados | N | FEInicial % | FEFinal % | Resultados | Complicaciones |
| AssmusTOCARE47 2002 | CMCCMO | 6.4 x 1057.35 x 106 | 4 meses | 4.3 días | Angiografía coronariaETT c/dobutaminaPET-FDG | Control 20Tratados 20 | 51±1051.6±9.6 | 53.5±7.960.1±8.6 | ↑FEVI, ↑ contractilidad general, ↓ VVTS, ↑ Flujo de reserva coronario,↑ Viabilidad en zona infartada | No arritmiasNo inflamaciónNo diferencia en mortalidad |
| KangMAGIC772004 | CMC 34+oFECG | 1x 109 | 6 meses | 3 a 270 d3 a 180 d | Angiografía coronariaSPECTETT c/dobutaminaPrueba de esfuerzo | Control 10Células 7FECG 7 | 40.348.950 | 55.148.7 | ↑ Capacidad de ejercicio,↓ Porcentaje de defectos de perfusión, ↑FEVI | No incremento en inflamaciónMayor re- estenosis intra- stent |
| MeyerBOOST78,792006 | CMO CD34+ | 9.5 x 106 | 6 y 18 meses | 4.8 días | IRM | Control 30Estudio 30 | 51.350 | 52 54.456 55.9 | ↑ FEVI a 6 meses, sin diferencia a 18 meses, en FEVI, volúmenes ventriculares, grosor de la pared, movilidad segmentaria | Sin diferencia |
| Assmus952006 | CMCCMO | 22 x 106205 x106 | 3 meses | 3 meses | Angiografía coronariaIRMETT c/dobutamina, SPECT o PET FDG | Control 23CMC 34CMO 35 | 43±1339±1041±11 | 42±1339±1043±10 | ↑ en FEVI con CMOSin cambios significativos en FEVI con CMC | Sin diferencia |
| SchachingerREPAIR AMI822006 | CMO | 236 x 106 | 4 y 12 meses | 3-7 días | Angiografía coronaria | Control 103CMO 101 | 46.9±10.448.3±9.2 | 49.9±1353.8±10.2 | ↑ en FEVI con CMODisminución de eventos combinados a un año (Muerte, revascularización, re-infarto e internamiento por falla cardiaca | |
| LundeASTAMI842006 | CMO | 68 x 106 | 6 meses | 6 días | SPECTETTIRM | Control 50CMO 47 | 46.945.7 | 4948.8 | Sin cambio en FEVI, VVTD, contractilidad regional, tamaño del infarto | |
| TenderaREGENT942009 | CMO totalesoCMO seleccionada (CD4+, CXCR4+) | 1.78x1081.9x106 | 6 meses | 7 días | IRMAngiografía | Control 40CMO 80CMOs 80 | 3735 | 4038 | Sin diferencia en FEVI↑ FEVI en pacientes con FEVI<37 | Sin diferencia |
| Cao972009 | CMO | 5 x 107 | 6, 12 meses4 años | 7 días | SPECTETTAngiografía | Control 41CMO 46 | 3938.6 | 46.450.5 | ↑ FEVI, ↓ VVTS, ↑ movilidad segmentaria. Sin diferencia en el tamaño del infarto | Sin diferencia |
| YousefBALANCE832009 | CMOCD 34+, CD 133, CD 34- | 6.1 X 107 | 3, 12, 60 meses | 7 días | AngiografíaETT | Control 62CMO 62 | 51.6±10.657.2±10.4 | 46.9±8.356.9±9 | Disminución del área de infarto, ↑ FEVI, ↓ VVTD, VVTS, ↑ contractilidad segmentariaDisminución de mortalidad↓ de arritmias a largo plazo | Sin diferencia |
CMO: células de médula ósea; CMC: células madre circulantes; FECG: factor estimulante de colonias de granulocitos; PET-FDG: tomografía por emisión de positrones con 2-(F-18)-fluro-2-deoxy-D-glucosa; ETT: ecocardiograma transtorácico; SPECT: tomografía computarizada por emisión de fotones individuales; FEVI: fracción de expulsión del ventrículo izquierdo; VVTD: volumen ventricular telediastólico; VVTS: volumen ventricular telesistólico; IRM: imagen por resonancia magnética; IAM: infarto agudo del miocardio.
Woller y colaboradores publicaron el estudio BOOST de 60 pacientes, incluidos en dos grupos de tratamiento con infusión intracoronaria de células madre derivadas de médula ósea durante coronariografía percutánea, comparado con placebo. Se analizó la función ventricular con IRM. Los pacientes tratados con células madre tuvieron mayor FEVI a los seis meses con incremento de 0.7% en el grupo control, y 6.7% en el grupo de células madre (p=0.0026). Además hubo mejoría en el movimiento sistólico en la zona periinfarto. No se encontró diferencia en el desarrollo de arritmias o reestenosis intracoronaria78. En el seguimiento a 18 meses de este estudio, no se observó diferencia en la FEVI entre ambos grupos y no hubo eventos adversos tardíos. Estos datos cuestionaron los mecanismos implicados en el beneficio de esta terapia79.
En un estudio realizado con mioblastos autólogos en pacientes con cardiopatía isquémica sometidos a cirugía de revascularización miocárdica, se analizó la seguridad y efectividad de esta línea celular, así como su efecto a largo plazo con un seguimiento de cuatro años. Se incluyeron 24 pacientes con FEVI<40%, a quienes se les realizó cirugía de revascularización. Se analizó la viabilidad miocárdica mediante PET e IRM, encontrando un aumento en la perfusión de las zonas tratadas, además un incremento en la FEVI de 28% a 35% en un año, y disminución en los volúmenes ventriculares. Con este estudio se demostró la seguridad de los mioblastos como medida de regeneración miocárdica, sin una mayor incidencia de arritmias80.
En el 2006, se publicó el estudio ASTAMI en el cual Lunde y colaboradores evalúan de manera aleatoria y cegada a 47 pacientes con infarto agudo del miocardio, llevados a inyección intracoronaria de células mononucleares derivadas de la médula ósea, sin encontrar diferencia a los seis meses en FEVI, volúmenes ventriculares y tamaño del infarto evaluados mediante SPECT, ecocardiograma e IRM81. De igual manera, en 2006 Schachinger y colaboradores publican el estudio REPAIR–AMI, que es sin duda uno de los trabajos más relevantes sobre el empleo de células madre en la cardiopatía isquémica, pues incluyó el mayor número de pacientes analizados en un solo estudio hasta esa fecha. Es un estudio multicéntrico aleatorizado y doble ciego, se incluyeron 204 pacientes que recibieron infusión intracoronaria de células progenitoras derivadas de médula ósea o placebo, a los tres a siete días posterior a terapia de reperfusión con ACTP. Se evaluó la FEVI mediante ventriculografía a los cuatro y doce meses, y se observó incremento significativo de la FEVI en el grupo tratado en comparación con el placebo (5.5%±7.3% vs 3.0±6.5%; p=0.01), siendo mayor el beneficio en los pacientes con una FEVI basal menor de 48.9%. A un año de seguimiento hubo disminución en el compuesto de muerte, recurrencia de infarto y revascularización (p=0.01)82.
En un meta-análisis publicado en el 2007 por Abdel Latif y colaboradores, se incluyeron 18 estudios casos-control y aleatorizados, con un total de 999 pacientes estudiados, incluyendo terapia con células mesenquimatosas y tanto células mononucleares como células progenitoras circulantes derivadas de médula ósea. Se observó una mejoría en la FEVI del 3.6% (IC 95% 1.93 a 5.4; p=0.01), disminución en el tamaño del infarto (-5.49%, IC 95% −9.10% a −1.8%; p=0.003) y disminución de volumen ventricular telesistólico (−4.8mL, IC 95% −8.2 a −1.4; p=0.006), sin diferencia en eventos adversos66. En ese mismo año es publicado un meta-análisis diseñado para evaluar la mejoría en FEVI en pacientes con isquemia aguda, se incluyeron 10 estudios con un total de 698 pacientes, observando mejoría de la FEVI de 3% (IC 95% 1.9 a 4.1; p=0.001), disminución en el tamaño del infarto (−5.6, IC 95% −8.7% a −2.5) y volumen ventricular telesistólico (−7.4mL, IC 95% −12.2 a −2.7); p=0.002). En este trabajo se observó disminución en infarto recurrente y tendencia a disminución en muerte, rehospitalización por falla cardiaca y necesidad de revascularización, en el análisis de meta-regresión se sugiere una asociación entre la dosis de células infundidas y la mejoría en la FEVI, sin llegar a ser estadísticamente significativo67.
Recientemente, se estudió prospectivamente el efecto de la inyección intracoronaria de células madre autólogas derivadas de la médula ósea a los siete días del infarto, en la hemodinámica, geometría y contractilidad ventricular, así como los beneficios a largo plazo de esta modalidad terapéutica en 124 pacientes aleatorizados. Estos pacientes fueron seguidos por 60 meses, se les realizó angiografía coronaria, electrocardiograma de ejercicio, ecocardiograma, potenciales tardíos, análisis de variabilidad miocárdica y monitoreo Holter de 24 horas. A los tres meses se observó una mejoría en la FEVI y disminución en el tamaño del infarto del 8%, además de mejoría en la contractilidad en la zona del infarto evaluado por un incremento de la velocidad de acortamiento del VI, hubo disminución en la variabilidad de la frecuencia cardiaca, potenciales tardíos y extrasístoles en el grupo de terapia celular. A los 12 y 60 meses los parámetros de mejoría en contractilidad, estado hemodinámico y geometría se mantuvieron sin cambios durante el seguimiento, la capacidad de ejercicio fue mayor en el grupo tratado (como ya había sido descrito en el seguimiento a seis meses del estudio ASTAMI) y la mortalidad fue menor (p=0.03)83,84.
Un tema controversial relacionado con la regeneración celular es el empleo del factor estimulante de colonias de granulocitos, para movilizar a las células madre de médula ósea. Inicialmente esta terapia se asoció a un incremento en el número de estenosis intra stent77, sin embargo este hallazgo no se reprodujo en otros estudios. Si bien en estudios iniciales se observó una mejoría en la FEVI, sin mayor número de eventos adversos como en el estudio FIRSTLINE AMI85, en el meta-análisis realizado por Zohlnhöfer publicado en 2008, que incluye 445 pacientes, no se observó diferencia en FEVI y no hubo reducción del tamaño del infarto. Por tanto, en la actualidad se reconoce que no existe beneficio del empleo del factor estimulante de colonias de granulocitos, en el manejo de los pacientes con infarto agudo del miocardio86.
La mayoría de los estudios actuales acerca de células madre se han enfocado sobre su empleo en los pacientes con infarto agudo del miocardio, y existe un menor número de pacientes incluidos en estudios prospectivos aleatorizados sobre el trasplante de células madre, en el contexto de pacientes con enfermedad arterial coronaria crónica o insuficiencia cardiaca crónica. Sin embargo, hasta el momento los estudios realizados a este respecto han encontrado mejoría en la función ventricular, isquemia y grado de angina87,88.
En la sesión científica del AHA 2011, se presentaron los resultados de dos trabajos que aportan información novedosa a este tema. El seguimiento a cinco años del estudio REPAIR AMI informó un resultado positivo (consistente con lo publicado previamente por este grupo en 2006) en relación a muerte (7 vs 15 placebo; p=0.09), infarto recurrente y necesidad de revascularización, así como una mejoría sostenida a cinco años en la FEVI (diferencia absoluta de 5±8% vs 3.3±7.6% en placebo; p=0.02), y un mayor grosor sistólico del VI analizado mediante IRM89. Además de los resultados iniciales del estudio SCIPIO, en el que se incluyeron 16 pacientes con FEVI<40% posterior a un infarto agudo del miocardio, a quienes se administró 113 días después de cirugía de revascularización, infusión de células madre cardiacas nativas aisladas de fragmentos de miocardio obtenidos durante su propia cirugía, observándose mejoría sustancial en la FEVI a los cuatro y 12 meses (12.3% de cambio en FEVI al año de seguimiento), además de disminución del tamaño del infarto medido por IRM. Este y otros resultados han motivado al desarrollo e investigación de esta línea celular90. En nuestro país, se publicaron este año los resultados iniciales de un ensayo clínico bien estructurado como es el estudio TRACIA, en el cual se demuestra la factibilidad y seguridad de esta terapia en nuestro medio91.
DiscusiónLa terapia celular en la cardiopatía es sin duda uno de los temas de mayor interés a nivel mundial, es un fascinante campo de la ciencia moderna no sólo para el investigador básico sino también para el clínico. Actualmente nos encontramos lejos de saber, si el futuro de la terapia celular se encuentra en la regeneración celular mediada por la infusión celular o en la modulación tisular de la respuesta a la lesión isquémica. Lo que sabemos es que el lograr entender el sustrato molecular de los mecanismos de lesión celular, apoptosis y de autorregeneración tisular será de vital importancia para el futuro terapéutico de la cardiopatía isquémica.
Hasta el momento no se ha establecido cual es el mecanismo exacto relacionado con el beneficio de la terapia celular, se desconoce la cantidad exacta de células necesarias para obtener el máximo beneficio, así como el grupo específico de pacientes que tiene una mejor respuesta a este tratamiento92,93. Aunque la evidencia apunta a los pacientes con FEVI baja después de un infarto, lo cual es de vital importancia ante la necesidad de limitar la pandemia que representa actualmente la insuficiencia cardiaca. Se han obtenido resultados variables con el empleo de diferentes líneas celulares, por lo que se desconoce cuál es el tipo celular que ofrece mayores beneficios, mayor porcentaje de acoplamiento celular y angiogénesis postransplante51,94,95. A pesar de que estudios clínicos han evaluado el acoplamiento y migración periférica de las células madre posterior a la infusión por las diversas vías de administración, no se ha establecido una vía que ofrezca mejores resultados clínicos. El método de evaluación de la respuesta mecánica y funcional del miocardio no ha sido homogéneo en los ensayos clínicos. Sin embargo, hoy sabemos que el perfil de seguridad de la terapia celular es adecuado a corto y largo plazo96,97, y que la mejoría en FEVI y volúmenes ventriculares es consistente en los ensayos clínicos realizados66,67, con beneficios evaluados hasta por cinco años.
La modificación genética de las células madre estimulando la miocardiogénesis y la producción de citocinas proangiogénicas que mejoren la anidación y función de las células entregadas, se postula como una medida que modifique de manera favorable los resultados clínicos con el empleo de las células madre, sin embargo, esto no se ha comprobado clínicamente98. No se ha realizado un estudio prospectivo con un número adecuado de pacientes para evaluar los beneficios en mortalidad. Actualmente se está llevando a cabo el estudio multicéntrico BAMI (Bone Marrow Cells in Acute Myocardial Infarction), en el cual se plantea reclutar 3 000 pacientes para evaluar la mortalidad en aquellos tratados con células mononucleares derivadas de médula ósea, sin duda este estudio responderá a muchas de las preguntas relacionadas con el empleo clínico de las células madre.
ConclusionesMientras las enfermedades cardiovasculares sigan siendo una de las principales causas de mortalidad a nivel mundial, la búsqueda de nuevas modalidades terapéuticas que modifiquen la progresión de la enfermedad y limiten el daño, será sin duda uno de los grandes retos de la medicina. Ante este panorama, el empleo de las células madre como tratamiento de la cardiopatía isquémica se presenta como una nueva y prometedora propuesta. Sin duda se requiere de estudios prospectivos controlados con seguimiento a largo plazo, en los cuales se incluya un mayor número de pacientes y se estandaricen los protocolos de la terapéutica, para poder aceptar de manera contundente el empleo de esta prometedora modalidad en la población general99.
FinanciamientoNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.