Presentamos el caso de una paciente de 22 años de edad con embarazo de 14 semanas y endocarditis infecciosa de válvula mitral nativa con una vegetación de 15mm con amplia movilidad, acompañada de insuficiencia valvular severa. Inicialmente, y pese al riesgo embolígeno, se dio tratamiento antibiótico durante 4 semanas. Por persistencia del tamaño de la vegetación se decide llevar a cirugía para reparación mitral y remoción de la lesión en la semana 18 de gestación, considerando que el balance entre el riesgo fetal y materno estaba a favor del procedimiento quirúrgico. Se usaron técnicas de protección fetal intraoperatoria y se colocó una prótesis biológica previo intento de reparación. La evolución postintervención fue satisfactoria, lográndose parto por cesárea a las 30 semanas.
A 22-year-old pregnant woman was seen at 14 weeks of pregnancy for infective endocarditis with a vegetation of 15mm and wide mobility, which affected the native mitral valve accompanied by severe valvular insufficiency. Antibiotic treatment was given for 4 weeks despite the embolism risk. Due to persistence of vegetation size and after considering the fetal and maternal risk, the surgical procedure was favored. We decided to perform valvuloplasty and removal of lesion at 18 weeks of pregnancy. Fetal protection techniques were used and a bioprosthesis was placed before attempting a repair. The postoperative follow-up was satisfactory, achieving a successful birth by cesarean section at 30 weeks.
La endocarditis infecciosa (EI) es considerada una condición de alto riesgo de morbimortalidad en la población general. Durante el embarazo es una entidad poco frecuente, con una incidencia aproximada de 0.006% (1 por 100,000 embarazos). Las tasas de mortalidad materna se calculan en alrededor del 22%, debidas en su mayoría a falla cardíaca o embolia; por otra parte, el riesgo fetal cuando se requiere cirugía se estima entre el 14 y el 38.5%1–3.
El propósito de este artículo es presentar un caso de EI durante el embarazo con vegetación de gran tamaño, móvil y, por ende, con alto riesgo de embolia, que fue llevada a remoción de la vegetación y reparación de la válvula mitral con preservación del feto. Además, revisar las indicaciones actuales de cirugía en vegetaciones de gran tamaño a la luz de nuevas evidencias, las implicaciones en pacientes embarazadas según la etapa de gestación, el tiempo en que se debe realizar el procedimiento y las técnicas de protección fetal intraoperatoria que podrían mejorar la supervivencia fetal.
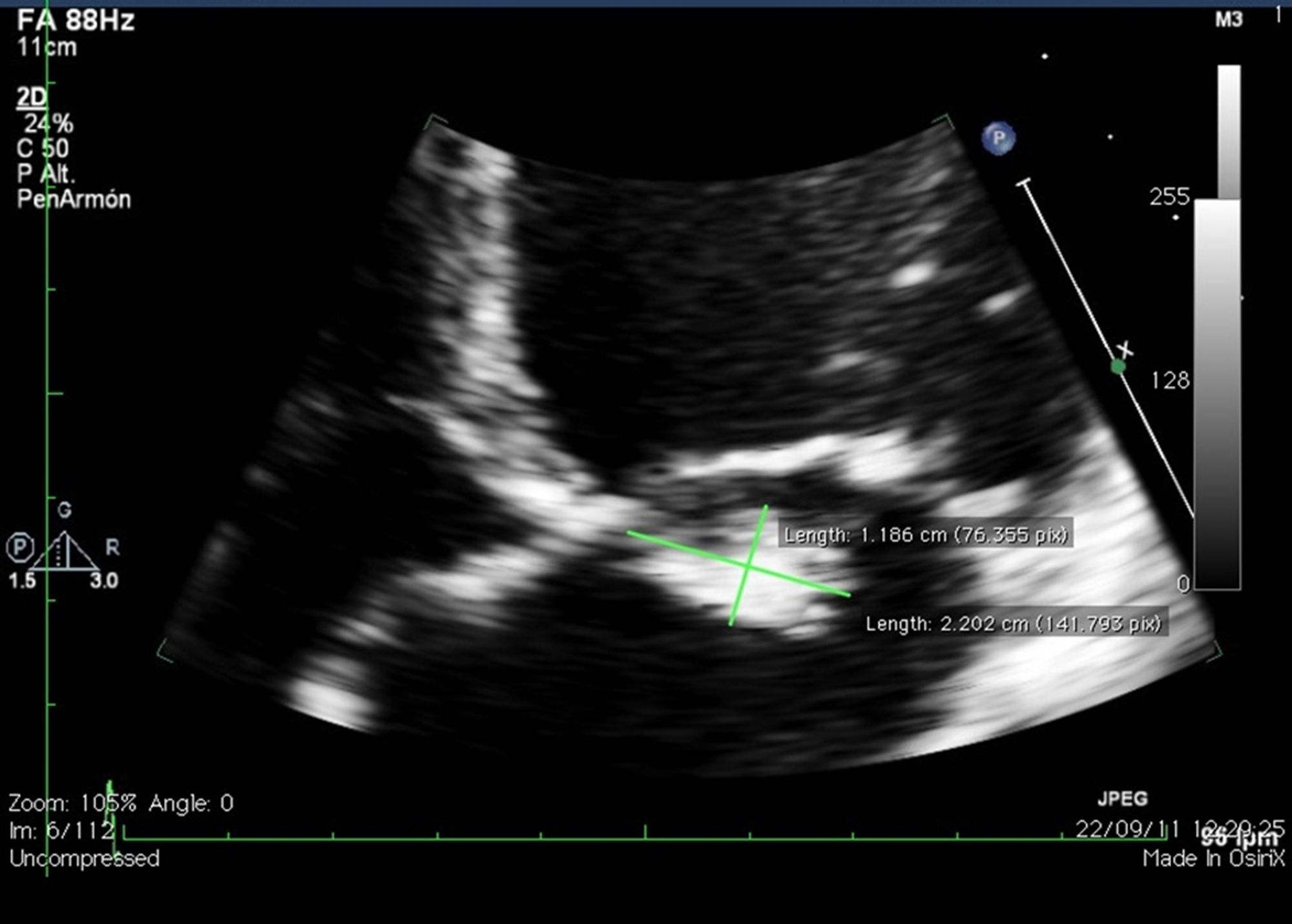
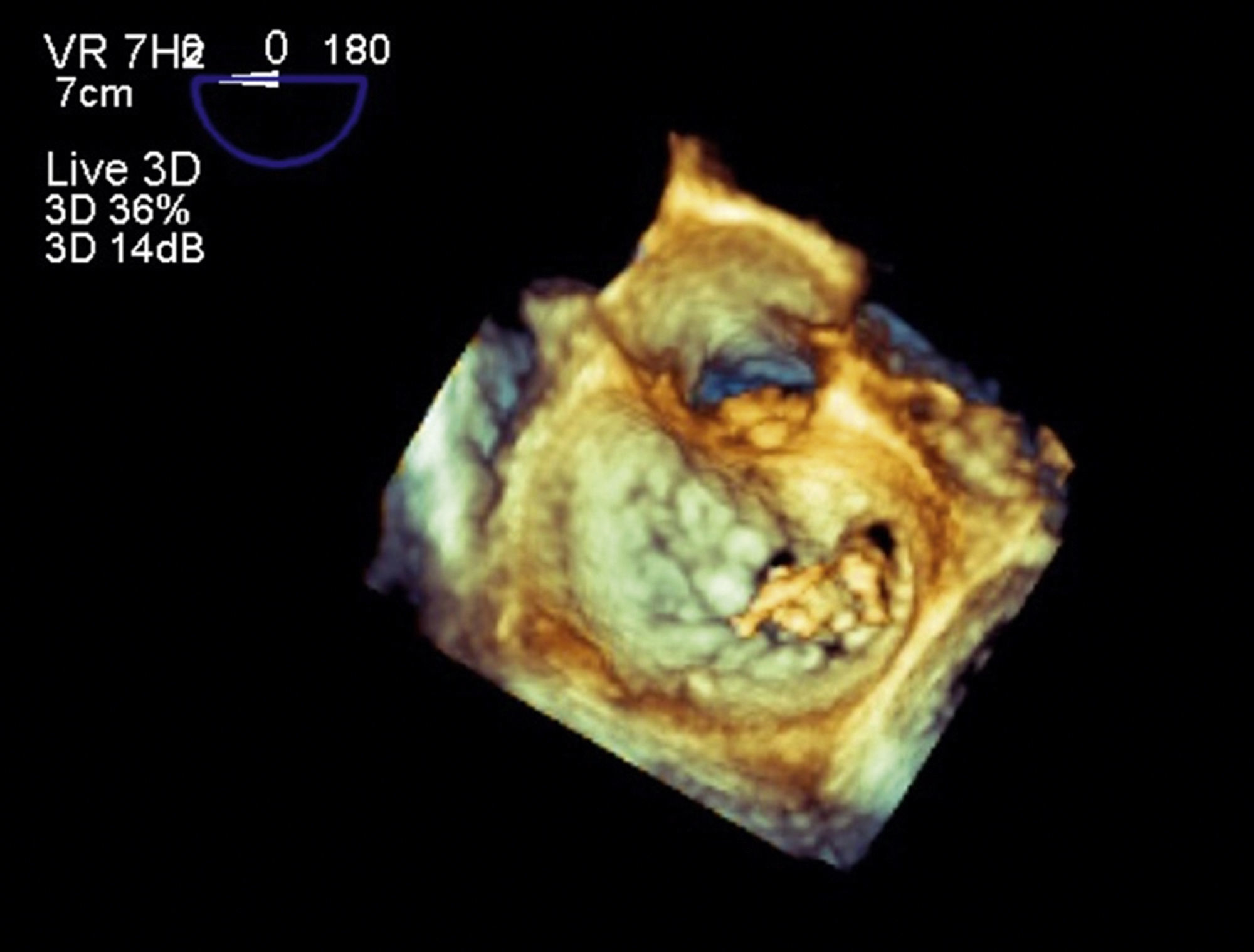
Presentación del casoPaciente primigestante de 22 años de edad con embarazo de 14 semanas, sin antecedentes patológicos ni tóxicos relevantes, con clínica de 2 meses de evolución que inició con síndrome febril y síntomas de infección respiratoria alta. Posteriormente presenta deterioro de la clase funcional hasta ii/iv de la NYHA, además de soplo sistólico irradiado al ápex. Internada en institución local de nivel intermedio, se documenta en el ecocardiograma la presencia de vegetación móvil de 15mm de diámetro en el velo anterior de la válvula mitral (fig. N1-4) asociada a insuficiencia severa. Función sistólica preservada con fracción de expulsión del ventrículo izquierdo del 60%. Se aisló en hemocultivos Streptococcus viridans (sensible a oxacilina) y se inició manejo antibiótico con vancomicina y ceftriaxona. Es referida a nuestra institución por insuficiencia mitral severa y persistencia del tamaño de la vegetación a pesar de hemocultivos de control negativos. Se decide llevar a cirugía para reparación/cambio valvular en la semana 18 del embarazo, considerando que el riesgo materno de embolia era elevado y el balance riesgo beneficio favorecía la cirugía sobre la conducta expectante. Se utilizó monitorización fetal perioperatoria con ecografía transvaginal en tiempo real, se aplicaó progesterona micronizada intravaginal y circulación extracorpórea con normotermia.
Se evalúa la válvula, corroborando los hallazgos ecocardiográficos con vegetaciones que comprometen el velo anterior en los segmentos A2, A3, involucrando además las cuerdas tendinosas. Se intenta plastia y reparación de la válvula mitral en primera instancia con reconstrucción del velo anterior, sin embargo, por destrucción amplia del aparato valvular e insuficiencia residual inaceptable, se realiza reemplazo valvular biológico. La monitorización fetal durante procedimiento con tocodinamómetro y fetocardia normales, sin actividad uterina y frecuencia cardíaca fetal mayor de 110lpm.
Se observa adecuada evolución postoperatoria con bienestar fetal adecuado, se continúa esquema antibiótico y anticoagulación. A la semana 30 presenta rotura prematura de membranas y corioamnionitis, por lo que fue llevada a cesárea con adecuada evolución clínica materna y del lactante en el seguimiento a 6 meses.
DiscusiónA pesar de la baja frecuencia de presentación de la EI durante el embarazo, esta condición muestra una alta tasa de mortalidad atribuible en parte a complicaciones potencialmente prevenibles, entre ellas la falla cardíaca y la embolia. El embolismo sistémico tiene una relación significativa con el tamaño, la localización y la movilidad de la vegetación, ocurre en aproximadamente un tercio de los pacientes con EI y compromete el sistema nervioso central hasta en el 65%, siendo la causa más común de muerte después de la falla cardíaca4. Varios factores se han asociado con un incremento en el riesgo de embolismo, entre ellos se incluye el tipo de microorganismo, el tamaño, la localización y la movilidad de la vegetación5–8.
El papel de la cirugía en el tratamiento de esta enfermedad se ha reservado para pacientes seleccionados en los que existe una endocarditis complicada de cavidades izquierdas y pacientes con falla cardíaca asociada. Con respecto a la cirugía temprana y las características de la vegetación, las guías de la Sociedad Americana del Corazón dan recomendación iia para pacientes con embolismo recurrente y vegetación persistente; la Sociedad Europea de Cardiología da una recomendación iib para vegetaciones aisladas mayores de 15mm, teniendo en cuenta la prevención de embolismo y recomendación I con nivel de evidencia C para vegetaciones mayores de 10mm cuando existan otros factores que puedan complicar el curso clínico (falla cardíaca, persistencia de la infección o absceso)4,5.
Recientemente Kang et al. publicaron un ensayo clínico en el que se encontró que la cirugía temprana en pacientes con EI y vegetaciones mayores de 10mm reduce significativamente el compuesto de mortalidad, eventos embólicos o recurrencia (hazard ratio, 0.08; 95% IC, 0.01 a 0.65; p=0.02) en comparación con el tratamiento convencional, sin aumentar de manera significativa la mortalidad por la cirugía, lo cual sugiere un cambio en la práctica clínica9.
En pacientes en estado de gestación es aun más controvertido definir cuál es la conducta que aporta un beneficio al binomio madre feto, dado que el riesgo materno de mortalidad quirúrgica por circulación extracorpórea es similar al de la población general pero el riesgo fetal se calcula entre el 14 y el 38.5%10–12 encontrando una morbilidad dada por el compromiso neurológico tardío que fluctúa entre el 3-5% de los neonatos, relacionado principalmente con la prematuridad13. Las complicaciones fetales están asociadas a la urgencia del procedimiento quirúrgico, la cirugía de alto riesgo, las comorbilidades fetales y la edad gestacional temprana14,15.
Cuando se realiza el procedimiento entre la semana 13 y 28 de gestación se considera que existe menos tasa de complicaciones, debido a que la cirugía durante el primer trimestre acarrea un riesgo de malformaciones fetales y durante el tercer trimestre aumenta la incidencia de parto pretérmino y complicaciones maternas. Cuando la edad gestacional es avanzada, se debe considerar el parto por cesárea antes de la cirugía cardíaca10,16. Sin embargo, existe controversia sobre cuál es la edad gestacional adecuada para el parto, en la que no aumente el riesgo de morbimortalidad por prematuridad comparado con la cirugía con circulación extracorpórea. La mortalidad de los neonatos prematuros antes de las 26 semanas de gestación es mayor al 40%, por tanto, el parto antes de la cirugía no se recomienda. Después de las 28 semanas de gestación, la mortalidad disminuye a menos del 10% y la morbilidad es baja, por lo cual las guías de manejo recomiendan en este caso el parto antes del bypass cardiopulmonar. Entre la semana 26 y 28 el pronóstico del neonato depende del peso al nacer, de la presencia de malformaciones fetales y de la administración de corticoides. Aunado a esto, la experiencia del equipo médico es importante en la decisión de realizar o no la cesárea antes de la cirugía cardíaca, siendo esta una conducta que requiere ser individualizada10,17,18.
Se conocen algunos factores que contribuyen al riesgo de mortalidad fetal durante el bypass cardiopulmonar. La hipotensión arterial materna puede llevar a hipoperfusión placentaria dado que el flujo uterino no está autorregulado19. La hipotermia asociada a la circulación extracorpórea, con el recalentamiento subsecuente puede inducir irritabilidad uterina y favorecer las contracciones que llevan a la hipoperfusión uteroplacentaria. Una elevación de la presión de la vena cava inferior, debido a la obstrucción de drenaje por el útero grávido, también puede causar insuficiencia placentaria e hipoxia fetal secundaria20. Estudios experimentales han sugerido que el flujo no pulsátil puede llevar a hipoperfusión placentaria21. Además, durante el embarazo la frecuencia cardíaca materna se incrementa y aumenta el consumo de oxígeno hasta un 18%, mientras la hemodilución inducida por el bypass cardiopulmonar puede reducir la capacidad de transporte del mismo19. Actualmente nuevas técnicas de protección fetal y placentaria en la cirugía cardiotorácica pueden disminuir complicaciones relacionadas con el embarazo.
Las experiencias en el manejo médico y quirúrgico de esta entidad durante el embarazo derivan de reportes y series de casos descritos en la literatura médica, encontrando aproximadamente 109 casos de endocarditis desde 1946 hasta la fecha (fuente: Medline. Se usaron los términos: endocarditis AND pregnancy; «cardiopulmonary bypass» AND endocarditis AND pregnancy). Sin embargo fueron Nazarian et al., quienes en 1976 describieron por primera vez la corrección quirúrgica exitosa en este escenario. Actualmente aparecen reportados 10 casos con el uso de bypass cardiopulmonar, de los cuales 8 fueron exitosos con vitalidad materno-fetal2,22–30. Algunos autores describen su experiencia en una intervención guiada por metas, con el objeto de reducir el riesgo fetal proporcionado por la cirugía.
Sepehripour et al. se centran en el cuestionamiento de la seguridad en el embarazo tanto materna como fetal con el uso de bypass cardiopulmonar y recomiendan el empleo de cirugía cardiovascular con bypass cardiopulmonar con parámetros de alto flujo, alta presión, flujo pulsátil y normotérmico, con monitorización fetal y uterina; todo esto, para un adecuado control del riesgo materno-fetal31.
Diferentes autores han establecido metas en los parámetros como la frecuencia cardíaca fetal durante la cirugía, manteniendo los niveles entre 110 y 160lpm13,32. Para disminuir el riesgo de bradicardia fetal y de contracciones uterinas, se recomienda: minimizar el tiempo de bypass y mantener un flujo de bomba mayor de 2.5 L/min/m2, una presión de perfusión mayor de 70mmHg33, un hematocrito materno mayor del 28% evitando las pérdidas de sangre, y un flujo pulsátil y normotérmico (≥34°C)34–36.
Otras revisiones sugieren mantener una saturación de oxígeno adecuada, evitando la hipocapnia, ya que produce vasoconstricción uteroplacentaria, y cuando sea necesario se recomienda el uso de tocolíticos como el sulfato de magnesio10. Otras medidas han sido evaluadas en casos aislados, como el caso de la progesterona con el objetivo de compensar los cambios que están relacionados con la hemodilución y por tanto dilución hormonal, que pueden inducir contracciones uterinas y parto pretérmino; sin embargo, su papel no ha sido demostrado en este escenario con un adecuado nivel de evidencia20,21,28.
En una serie, Pomini et al.35 encontraron una mortalidad fetal del 24% cuando se utilizó flujo hipotérmico versus no mortalidad cuando fue normotérmico. No existen ensayos clínicos aleatorizados en este tipo de pacientes que permitan orientar qué tratamiento es el indicado para disminuir la mortalidad y la morbilidad fetal; sin embargo, en el caso presentado se utilizó flujo normotérmico con los resultados expuestos.
Aunque en esta paciente se decidió iniciar tratamiento antibiótico y se aplazó el tiempo quirúrgico a pesar del tamaño de la vegetación, la evidencia actual apunta a que el beneficio materno, y en especial la disminución del riesgo embólico, depende de la rapidez en que es realizado el procedimiento luego de documentarse la endocarditis. La persistencia del tamaño, la movilidad y el balance de riesgo materno-fetal fueron las indicaciones para definir reparación versus cambio valvular. Durante la cirugía se realizaron las técnicas de protección fetal descritas, sin documentar complicaciones durante el perioperatorio.
ConclusiónEl enfoque multidisciplinario para el manejo de estos pacientes es vital, dada la complejidad de algunas situaciones y las importantes consecuencias para la madre y el feto. La reparación o cambio valvular temprana reduce de manera importante el riesgo embólico y de falla cardíaca, sin aumentar la mortalidad materna con respecto a las no embarazadas, constituyéndose en una opción en pacientes de alto riesgo. A pesar de que la mortalidad fetal es alta, nuevas técnicas empleadas en el perioperatorio pueden impactar favorablemente la supervivencia.