La enfermedad de Kawasaki fue descrita en 1967 por Tomisu Kawasaki. Afecta principalmente a los niños entre uno y 5 años, y se manifiesta con fiebre y vasculitis de vasos medianos que pueden conducir a diversas complicaciones cardiovasculares, tales como aneurismas en las arterias coronarias, miocarditis, daño valvular, derrame pericárdico e infarto del miocardio; eventualmente involucra otros órganos. La etiología aun no es bien conocida, como tampoco lo son los mecanismos patogénicos exactos, pero existen notables avances. Cuando los signos y síntomas clínicos son identificados tempranamente y los niños reciben tratamiento con gammaglobulina y aspirina, la evolución suele ser satisfactoria y pueden evitarse las afecciones coronarias y otras complicaciones. La enfermedad de Kawasaki no se registra frecuentemente en México.
Kawasaki disease was described in 1967 by Tomisu Kawasaki. It affects children aged between one and 5 years, and it evolves with fever and small vessel vasculitis, which leads to cardiovascular complications, including coronary aneurisms, myocarditis, valve injuries, pericardial effusion and myocardial infarction; eventually involving many others organs. The etiology actually is not well known, as the exactly pathogenic mechanisms; however, now there are important advances. If the clinical signs and symptoms are identify early and the children received treatment with aspirin and intravenous immunoglobulin, the patients evolves without sequels. The Kawasaki disease is an infrequent disease in Mexico.
La enfermedad de Kawasaki (EK) es aún de etiología desconocida, se manifiesta por un síndrome febril de curso agudo asociado a vasculitis de pequeños y medianos vasos, que puede conducir a complicaciones cardiovasculares severas, incluidos aneurismas coronarios, miocarditis, pericarditis, lesiones valvulares e infarto del miocardio, involucrando eventualmente diversos órganos. Fue descrita originalmente por T. Kawasaki en 19671.
La incidencia de EK en el mundo no es bien conocida. En Japón, en una encuesta reciente se encontró un aumento de 218 casos por cada100,000 menores de 5 años2. En países de las Américas, es EE. UU. se reportan hasta 20 casos anuales por cada 100,000 en los mismos rangos de edad; otros países europeos registran 8 nuevos casos cada año; en países hispánicos se registran 11 casos por cada 100,0002–4; en México el primer caso de EK fue comunicado por Rodríguez en 19775 y a partir de entonces empezaron a identificar a más pacientes, dando lugar a publicaciones de series y casos clínicos.
En la etiología se ha considerado que existe una activación del sistema inmune desencadenado por un proceso infeccioso en un huésped genéticamente susceptible; esto se aduce por las siguientes razones: en primer lugar, la enfermedad tiene características de un proceso que se autolimita; segundo, desde el punto de vista epidemiológico los casos ocurren estacionalmente y en brotes epidémicos, sin embargo el agente etiológico no se ha precisado; por otro lado, los rasgos genéticos podrían explicar la alta prevalencia en determinados grupos étnicos, pero varía entre países. En lo relativo a la agresividad en el curso de la enfermedad y la posibilidad de lesiones coronarias, observaciones recientes indican la probabilidad de que exista una asociación genética en la identificación de un polimorfismo en el inositol 1,4,5 trifosfato 3 cinasa C (ITPKC) gene en el cromosoma 19q13.2, que puede contribuir a la inmunorreactividad en la enfermedad3,6,7.
Mecanismos patogénicosExiste aun una notable controversia en los mecanismos que activan el sistema inmune. Algunos investigadores piensan que superantígenos bacterianos conducen a una estimulación masiva de linfocitos T, otros sugieren una respuesta oligoclonal de inmunoglobulina A (IgA), siendo más factible que se trate de una respuesta policlonal; esta teoría se sustenta en el descubrimiento de células plasmáticas con IgA, infiltrando las arterias coronarias que presentaban aneurismas en pacientes que fallecieron por EK; así, también se ha comunicado la presencia de células de inclusión citoplasmática parecidas a las virales en el epitelio ciliado de los bronquios de estos pacientes6–9.
Además de con diversos agentes virales bacterianos, ácaros y sustancias químicas, la EK se ha relacionado con toxinas superantigénicas por haber encontrado expansión selectiva de familias de células-T VB2 y VB8. Sin embargo, esta teoría aun es controversial3,10–15, ya que no se ha demostrado diferencia significativa en las cepas productoras de toxinas de pacientes con EK y los controles que manifiestan fiebre por otras causas. En modelos animales se estudiaron las propiedades de proteínas sperantigénicas de bacterias del tracto intestinal de niños con EK, observando que tenían propiedades para expansión de células-T VB2 in vitro. Estos superantígenos se supone que están involucrados en la génesis de este padecimiento6–15; también se ha reportado la presencia de parvovirus B19 y herpesvirus en arteritis de células gigantes, así como un virus en humanos denominado New Haven coronavirus encontrado en secreciones respiratorias de niños con EK, sin que esto indique ser la causa especifica12. En otras publicaciones se ha demostrado el aumento de producción de óxido nítrico y de especies reactivas de oxígeno por los neutrófilos en las fases agudas de la enfermedad, sin elucidar el rol que desempeña en el daño endotelial. Recientemente, en estudios de ultraestructura e inmunofluorescencia se han identificado cuerpos de inclusión citoplasmática en los bronquios de pacientes con EK, que refuerzan la hipótesis de la etiología infecciosa de la enfermedad3,7–17.
En la patogenia se ha estudiado la participación de diferentes metaloproteinasas que se elaboran en la fase aguda dañando la pared de los vasos y que tienen un papel primordial en la génesis de los aneurismas; existe también una sobreproducción de citocinas proinflamatorias con activación de células endoteliales; los niveles de ARN y expresión de citosinas Th1/Th2, interferón gamma, interleucina (IL) 4 (IL-4) han sido analizados junto con Th1/Th2 inductores de factores de transcripción(T-beat y GATA-3) conocidos por la participación que tienen en el desarrollo de Th1/Th23; el incremento de IL-1) actúa como factor activador de leucocitos y pirógeno endógeno, provocando aumento en el nivel del factor de necrosis tumoral (TNF) alfa, que a su vez estimula la IL-1, incrementando en el endotelio vascular la producción de quimosinas y moléculas de adherencia que activan polimorfonucleares generando interferón B, el cual se considera responsable de la duración de la fiebre; el aumento de IL-17 y proteasas de serinas producido por leucocitos TCD4 al ser activados inducen la producción de IL-6, estimulándose células plasmáticas productoras de inmunoglobulinas lo que conduce a trombocitosis.
Desde finales de la década de los 70, se ha descrito miocarditis en pacientes con EK, pero el mecanismo por el que se establece el daño miocárdico no está aun bien aclarado. Se ha considerado que es secundario a la acción de citosinas, TNF, IL-1 y e IL-6 que lesionan los miocitos provocando disfunción en la contractilidad; esta lesión puede estar presente en pacientes con o sin aneurismas coronarios e histológicamente se demuestra hipertrofia, degeneración de miocitos, fibrosis, infiltración de linfocitos y células plasmáticas y disrupción de fibras miocárdicas. La disfunción miocárdica se puede identificar por disfunción diastólica18.
Existen otros mecanismos inmunológicos que se relacionan con los diferentes signos físicos tales como adenomegalias, edema y dilatación de pequeños vasos sanguíneos en la piel, que resultan de diversas interacciones entre, IL-15, células TCD4 y CD8-Th, quimocinas alfa (XCL-0), células T y B3,15–19. A través de la evolución de la lesión arterial se han advertido una serie de cambios que pueden involucrar no solamente las coronarias sino otras arterias (como las musculares, mesentéricas, femorales, iliacas, renales, axilares y braquiales), en los diferentes estadios de la afectación en los cuales la capa media muestra edema, disociación de células musculares, edema del subendotelio, después infiltrado mononuclear, destrucción de la lámina elástica interna, proliferación fibroblástica, remodelación por la matriz de metaloproteínas, inflamación activa, cicatriz fibrosa, remodelación arterial o revascularización. La estenosis progresiva resulta de la remodelación y neoangiogénesis19.
Identificar tempranamente esta enfermedad instaurando el tratamiento con gammaglobulina y aspirina en el curso de la primera semana ha demostrado que evita el desarrollo de lesiones coronarias y lesiones cardiovasculares diversas que ponen en riesgo la vida tanto en la fase aguda como en etapas posteriores3,15–20.
La experiencia mexicanaEn este trabajo se hace una revisión de la experiencia en México, expresada a través de publicaciones médicas5,21–46.
Se revisaron los artículos originales de EK, así como los informes de casos clínicos publicados en revistas mexicanas especializadas en temas pediátricos, de cardiología y enfermedades alérgicas e infecciosas. Se utilizaron los sistemas de información en línea de revistas indizadas en el sistema de Artículos Editados en México de Información en Salud, páginas electrónicas de compilación de revistas médicas mexicanas (Medigraphic, Imbiomed, Dgibliblio, UNAM, LATINDEX), así como también se solicitó apoyo a bibliotecas de hospitales del sector salud.
En las variables analizadas se consideraron: la época del año, la edad, el sexo, signos clínicos básicos y agregados para el diagnóstico; cambios en las constantes de laboratorio y hallazgos en los estudios de gabinete; alteraciones cardiológicas que fueron encontradas; las modalidades de tratamiento empleado, respuesta a los esquemas terapéuticos, los procedimientos quirúrgicos, la evolución y mortalidad. Los resultados se expresaron en estadística paramétrica.
ResultadosEn 1977 se informó del primer caso en México, y hasta el 31 de mayo de 2012 se han registrado en publicaciones mexicanas 13 artículos originales de series de casos y 15 artículos de casos clínicos, sumando un total de 250 pacientes diagnosticados con EK.
En cuanto a la época del año, en 137 casos (55%), la mayoría de los pacientes fueron captados en los hospitales, durante la primavera y el invierno; la otra estación del año en la que en segundo lugar se registraron niños con la EK fue en el otoño; en el verano se presentaron pocos casos. Esto fue registrado en 6 de las 13 series publicadas, de más de 8 casos21,22,25,26,37,39.
Respecto al sexo, predominó el masculino en proporción de 3.3:1; las edades de los 250 pacientes varió de los 2 meses hasta los 18 años; sin embargo el mayor número de casos estaban comprendidos en las edades de 3 a 5 años.
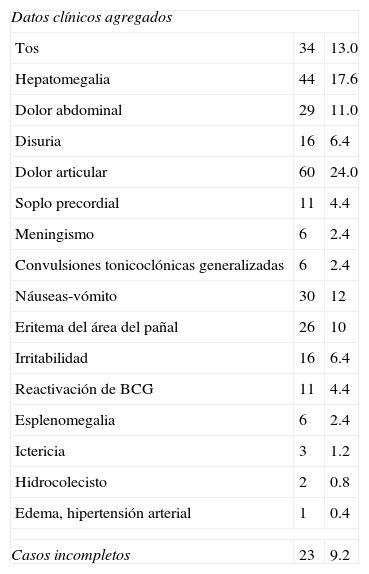
El diagnóstico se sustentó fundamentalmente en los signos básicos de la EK (fiebre, hiperemia conjuntival no supurativa, exantema maculopapular, no vesicular, lesiones en los labios, cavidad bucal y lengua), cambios agudos en piel de extremidades, como son eritema y edema, así como también la adenitis cervical; además se registraron otros signos agregados, entre estos: náuseas, vómito, dolor abdominal, soplo precordial, dificultad respiratoria, eritema del pañal, esplenomegalia, ictericia, reactivación de cicatriz de BCG, hidrocolescisto, disuria, hepatomegalia, artralgias, meningismo y crisis convulsivas, edema e hipertensión arterial; todos aparecen reflejados en las tablas 1 y 2.
Signos clínicos en 250 niños con enfermedad de Kawasaki
| Signos | Casos | % |
| Básicos | ||
| Fiebre de más de 5 días de evolución | 250 | 100 |
| Inyección conjuntival sin exudado | 225 | 90 |
| Exantema (máculo papular en tronco, eritema multiforme [no vesicular]) | 229 | 91 |
| Cambios en labios y cavidad oral (eritema faríngeo, fisuras labiales, lengua en fresa) | 198 | 79 |
| Linfadenopatía cervical de 1.5cm | 142 | 56 |
| Cambios en extremidades | ||
| Agudas | ||
| Eritema y edema | 227 | 90 |
| Convalecencia | ||
| Descamación de las yemas de los dedos | 159 | 63 |
Otros signos clínicos en 250 niños con enfermedad de Kawasaki
| Datos clínicos agregados | ||
| Tos | 34 | 13.0 |
| Hepatomegalia | 44 | 17.6 |
| Dolor abdominal | 29 | 11.0 |
| Disuria | 16 | 6.4 |
| Dolor articular | 60 | 24.0 |
| Soplo precordial | 11 | 4.4 |
| Meningismo | 6 | 2.4 |
| Convulsiones tonicoclónicas generalizadas | 6 | 2.4 |
| Náuseas-vómito | 30 | 12 |
| Eritema del área del pañal | 26 | 10 |
| Irritabilidad | 16 | 6.4 |
| Reactivación de BCG | 11 | 4.4 |
| Esplenomegalia | 6 | 2.4 |
| Ictericia | 3 | 1.2 |
| Hidrocolecisto | 2 | 0.8 |
| Edema, hipertensión arterial | 1 | 0.4 |
| Casos incompletos | 23 | 9.2 |
De las alteraciones de laboratorio, los 7 parámetros más importantes se describen a continuación: la velocidad de sedimentación globular (VSG) estuvo aumentada en 144 (57%), se encontró leucocitosis con neutrofilia en 145 (58%), se presentó trombocitosis en 139 (55%), la proteína C reactiva fue positiva y mayor de 6mg/dl en 128 (51%), la hemoglobina menor de 10g/dl se encontró en 106 (42%), las aspartato y alaninaminotrasnferasas estuvieron más frecuentemente elevadas en niños menores de 18 meses; sumaron 45 casos (18%).
A un grupo de pacientes menos numeroso que los que integraban las diferentes series durante el período revisado, se les hicieron también exámenes de laboratorio adicionales como: reacciones febriles, albúmina sérica con cifras menores a 3g/dl en 25 niños (10%), CPK, CMB, en 3 y otros 3 pacientes respectivamente. En un grupo menor se hizo hemocultivo, cultivo faríngeo, urocultivo, reacciones cutáneas a coccidioidomicosis y derivado proteico purificado para tuberculosis, IgA, IgG, IgM e IgE; a otros 3 se les solicitaron anticuerpos antimicoplasma, factor reumatoide, anticuerpos anti-ADN y anticuerpos anticitoplasma de neutrófilos.
En las radiografías de tórax, en 12 pacientes se encontraron infiltrados de tipo bronconeumónico y en 18 (7.2%), se observó cardiomegalia.
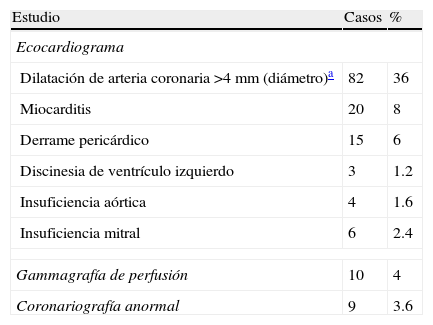
De los estudios de gabinete relativos a la búsqueda de alteraciones cardiológicas, en 91 niños (36%) se registraron cambios electrocardiográficos diversos; por otro lado, a 249 (99.6%) se les realizó ecocardiograma; la dilatación de arterias coronarias se evidenció en 82 (32%), con predominio de las izquierdas; miocarditis en 20 (8%), derrame pericárdico en 15 (6%) y en 10 pacientes se observaron alteraciones valvulares; los gammagramas de perfusión se encontraron alterados en 7 de 10 casos (4%) y en 9 las coronariografías fueron anormales (tabla 3).
Alteraciones cardiológicas en 250 niños con enfermedad de Kawasaki
| Estudio | Casos | % |
| Ecocardiograma | ||
| Dilatación de arteria coronaria >4mm (diámetro)a | 82 | 36 |
| Miocarditis | 20 | 8 |
| Derrame pericárdico | 15 | 6 |
| Discinesia de ventrículo izquierdo | 3 | 1.2 |
| Insuficiencia aórtica | 4 | 1.6 |
| Insuficiencia mitral | 6 | 2.4 |
| Gammagrafía de perfusión | 10 | 4 |
| Coronariografía anormal | 9 | 3.6 |
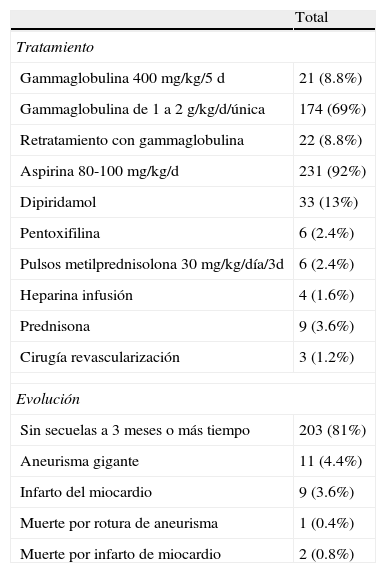
La modalidades terapéuticas que recibieron los pacientes fueron las siguientes: se administró gammaglobulina intravenosa (GGIV) en 195 (78%); en 21 niños (8.8%) la gammaglobulina fue indicada en dosis de 400mg/kg/día durante 5 días, a los otros 174 (69%) se les aplicó GGIV en dosis de 2g/kg en una infusión de 12h. A un total de 231 pacientes (92%) se les administró tratamiento con aspirina a 80mg/kg/d, durante 15 días y después 5mg/kg/d durante 10 a 12 semanas.
En 22 niños (8.8%) hubo necesidad de aplicar gammaglobulina por segunda ocasión, en vista de que había persistencia de la fiebre o por reactivación de la misma, 5 pacientes recibieron GGIV hasta en 3 ocasiones, y en 6 se tuvieron que adicionar también pulsos de metilprednisolona; por otro lado, 33 pacientes recibieron dipiridamol y 3 pentoxifilina (tabla 4).
Tratamiento y evolución en 250 pacientes con enfermedad de Kawasaki
| Total | |
| Tratamiento | |
| Gammaglobulina 400mg/kg/5 d | 21 (8.8%) |
| Gammaglobulina de 1 a 2g/kg/d/única | 174 (69%) |
| Retratamiento con gammaglobulina | 22 (8.8%) |
| Aspirina 80-100mg/kg/d | 231 (92%) |
| Dipiridamol | 33 (13%) |
| Pentoxifilina | 6 (2.4%) |
| Pulsos metilprednisolona 30mg/kg/día/3d | 6 (2.4%) |
| Heparina infusión | 4 (1.6%) |
| Prednisona | 9 (3.6%) |
| Cirugía revascularización | 3 (1.2%) |
| Evolución | |
| Sin secuelas a 3 meses o más tiempo | 203 (81%) |
| Aneurisma gigante | 11 (4.4%) |
| Infarto del miocardio | 9 (3.6%) |
| Muerte por rotura de aneurisma | 1 (0.4%) |
| Muerte por infarto de miocardio | 2 (0.8%) |
También se utilizaron antibióticos del tipo de las penicilinas en 59% de los casos, en la mayoría previos al diagnóstico y en aquellos en los que se consideró necesario por procesos infecciosos agregados durante la hospitalización.
Con relación a la evolución, el tiempo de internamiento referido fue superior a los 15 días entre los años 1977 a 1987; en los años ulteriores, con el uso de GGIV, la estancia se redujo a 8 días o menos.
Doscientos tres (81%) niños asistieron a controles a la consulta ambulatoria. Entre los 82 que desarrollaron dilatación coronaria, 71 de ellos tuvieron muy buena evolución y fueron seguidos por al menos 3 meses después de su egreso. Se observó también que 11 niños (4.4%) tenían aneurismas coronarios gigantes; estos continúan bajo observación. En 8 pacientes (3.2%), los autores no registraron seguimiento8. La complicación más severa, el infarto de miocardio, ocurrió en 9 niños (3.6%), de estos 2 permanecen en control y en 3 se hizo procedimiento de revascularización21,32; 3 pacientes fallecieron (1.2%) uno por rotura de aneurisma y 2 por infarto de miocardio. De la serie de 16 casos de Vizcaíno-Alarcón et al.21 uno fallece después de complicaciones crónicas, habiéndose considerado como portador de secuelas, otro durante su estancia hospitalaria, durante las 2 semanas siguientes al inicio del padecimiento; ambos tenían puntuación mayor de 4, de la clasificación pronóstica. Otro de los pacientes, de un año de edad, falleció 3 semanas después de la detección de los aneurismas32.
DiscusiónA partir de la descripción del primer caso de EK en México, en 1977, hubo un interés creciente por identificar la enfermedad, particularmente en los hospitales pediátricos e instituciones dedicadas a la atención de pacientes cardiológicos. En la revisión de lo publicado pudimos apreciar que hasta ahora el diagnóstico depende en mayor medida del buen juicio clínico. En la actualidad el médico que atiende niños puede identificar con mayor frecuencia la EK; además por tratarse de un padecimiento raro en México, a juzgar por el número de casos clínicos únicos registrados, aparentemente, cuando se identifica y trata suele ser motivo de comunicación escrita; aun así es probable que un determinado número de casos solo quede en los registros de morbilidad hospitalaria.
Es bien conocido que afecta más a niños que habitan en países del oriente; en América Latina no se tienen cifras exactas, aunque se ha estimado aproximadamente en 3 por cada 100,000. En nuestro país los reportes han aumentado, pues tan solo en los últimos 5 años se han publicado 6 series y casos clínico aislados, que suman 193 (77%) del total de los reportados. En esta revisión se incluyen los casos encontrados en las publicaciones entre enero de 1977 a mayo de 2012, aunque probablemente existan más casos identificados y tratados pero todavía no publicados2,3,5–21.
La EK es más frecuente en lactantes menores y preescolares, con pico máximo entre los 2 a 5 años, pero puede diagnosticarse en menores de un año y adolescentes; en esta revisión se encontró un mayor número de casos entre los 3 y 5 años. Los niños menores de un año tienen mayor riesgo de complicaciones y de tener una deficiente respuesta al tratamiento3,4,8,47–49; respecto al sexo, predomina el masculino en razón de 1.5:1 (la proporción en México fue de 3.3:12–46).
En lo relativo a la época del año en que se presentan más casos o brotes epidémicos son los meses de primavera e invierno; en esta revisión se registró el mayor número durante la primavera5,6,10,11,22,39,40,50–52.
Hasta ahora el agente causal no se ha identificado. A lo largo de 45 años se han invocado muchos posibles, aunque en el último decenio se ha insistido en la participación de agentes infecciosos bacterianos y virales. Entre los bacterianos están Sthaphylococcus aureus y Streptococcus, y entre los virales, los virus para influenza, morbilivirus de la familia paramixovirus, bunyavirus; y la acción de toxinas superantigénicas con capacidad de expansión selectiva en células T VB2-VB8 también han sido estudiadas en modelos animales, infiriendo la posibilidad de implicaciones en la génesis del padecimiento3,13–15; asimismo han cobrado importancia las observaciones acerca de la participación de adenovirus y un nuevo coronavirus humano New Haven Coronavirus (Novel human coronavirus Nco-NH) identificado en secreciones de vías respiratorias en un lactante de 6 meses que presentaba EK típica; además también se encontró positivo en 8 de 11 niños, al utilizar, la técnica de la transcriptasa polimerasa reversa. De igual forma, ha sido reportada la infección por Mycoplasma pneumoniae3, como fue mencionado en párrafos anteriores, y mediante estudios de ultraestructura e inmunofluorescencia se han identificado cuerpos de inclusión citoplasmática en células bronquiales que sugieren un nuevo virus ARN, que refuerzan la hipótesis de la etiología infecciosa de la enfermedad3,7–17.
Se ha descrito también la participación del óxido nítrico y especies reactivas de oxígeno por los neutrófilos en las etapas aguda10–16. Las observaciones más recientes que tratan de explicar los fenómenos de marcada expresividad de EK indican la existencia de una asociación genética con la identificación de un polimorfismo en el ITPKC gene en el cromosoma 19q13.2, que actúa como regulador negativo en la activación de células y puede contribuir a una mayor inmunorreactividad en la enfermedad4,7.
Hasta ahora los elementos más importantes para el diagnóstico se basan en los hallazgos clínicos, aun en aquellos considerados incompletos o atípicos53–59; así se puede apreciar que entre el 74 y el 100% de los pacientes tuvieron los 5 principales criterios de EK, la adenitis cervical se encontró en el 56%. Se observaron también signos clínicos adicionales como hepatomegalia, dolor abdominal, artralgias y disuria, meningismo, soplo precordial, eritema del pañal, irritabilidad, ictericia, reactividad de vacuna BCG e hidrocolecisto. Se han descrito otros datos clínicos menos frecuentes pero que es preciso tener presentes, entre los cuales están la leuconiquia estriada, que consiste en bandas lisas generalmente 2, paralelas a la lúnula de las uñas, que aparentemente son secundarias a edema periungueal60.
El enrojecimiento de la cicatriz de BCG se considera secundario a una reacción cruzada25,35,41,61 de la proteína de choque térmico HPS 65, y su homóloga humana HPS es un signo que se observa más frecuentemente en menores de un año, hecho registrado en 11 casos (4.4%). Por otro lado, la vesícula biliar hidrópica o hidrocolecisto y el edema colónico deben buscarse durante la fase aguda de la enfermedad y los nódulos pulmonares son manifestaciones raras, pero deben ser consideradas en caso de manifestaciones respiratorias persistentes21,62–64. En la tabla 1 se concentran los elementos clínicos considerados en el diagnóstico en las diferentes series y casos clínicos aislados registrados en México. La EK puede dar manifestaciones incompletas, o también atípicas. En el primer caso, los denominados incompletos se caracterizan por fiebre durante más de 5 días y solo 2 de los principales signos (así sucedió en 18 pacientes de este reporte); en los casos que se catalogan como atípicos debemos tener presentes los siguientes datos útiles en el diagnóstico: fiebre que dura más de 9 días, exantema en piel por mayor tiempo, 3 o más signos básicos de la enfermedad, leucocitosis con neutrofilia, elevación de transaminasas, albúmina menor de 3.5g/dl, trombocitosis y además la presencia de problema renal, hepático o de otra naturaleza, lo cual ocurrió en 5 pacientes4,6,9,25,44.
Existe también un puntaje para predicción de aneurismas coronarios diseñado por Harada3 en el cual se considera riesgo con 4 o más puntos entre el primero y noveno día; los parámetros son: sexo masculino, edad menor de un año, leucocitos>12,000/mm3, proteína C reactiva>3mg/dl, hematocrito>35, plaquetas >350,000/mm3 y albúmina>3.5g/dl3.
Hasta ahora, no obstante los constantes esfuerzos de los investigadores, no hay estudios específicos de laboratorio. Pero suelen observarse con mayor constancia en las 2 primeras semanas la leucocitosis con neutrofilia, aumento de la VSG y de la proteína C reactiva en concentraciones mayores de 6mg/l, la trombocitosis que persiste de 3 a 6 semanas, anemia moderada, elevación moderada de transaminasas en 40% de los casos y discreta elevación de bilirrubinas en el 10% de los pacientes. En el examen general de orina se pueden encontrar leucocitos elevados en 4 a 6 de cada 10 pacientes. En los casos de esta revisión se encontró que los 6 parámetros más consistentemente alterados en orden de importancia fueron: leucocitosis con neutrofilia en el 58%, elevación de VSG en el 57%, trombocitosis en el 55%, proteína C reactiva elevada en el 51%, hemoglobina menor de 10g/dl en el 42% y transaminasas alteradas en el 18%. Es prudente mencionar que la presencia de leucopenia y trombocitopenia durante la fase aguda se consideran como factores de mal pronóstico6,9.
Se han recomendado otros estudios que suelen encontrarse alterados en los casos de vasculitis tales como: anticuerpos antinucleares anticuerpos anticitoplasma de neutrófilos, los anticuerpos anticélulas endoteliales mismos, que no han demostrado plena utilidad y pueden ocasionar confusiones; la determinación de CPK y fracciones MB son útiles para aquellos pacientes con cuadros más severos y con puntajes de riesgo que aumentan la susceptibilidad a desarrollar infarto. También se han desarrollado métodos como la determinación de triptófano y kyneurinas en plasma por el método de cromatografía líquida, encontrando niveles más elevados en pacientes con EK; es un método que una vez que sea validado podría tener aplicación como índice de laboratorio útil en el diagnóstico. Asimismo, en pacientes con cuadros atípicos se ha sugerido que la determinación de péptido natriurético es un buen marcador de la evolución a infarto de miocardio y se ha recomendado que puede ser adicionado a las pruebas diagnósticas64–69.
La radiografía de tórax puede mostrar infiltrado bronconeumónico especialmente en aquellos pacientes que presentan tos y dificultad respiratoria en el 15% de los casos, aunque también los cambios radiológicos pueden ser provocados por neumonitis, derrames y nódulos pulmonares secundarios a vasculitis. En esta revisión encontramos un 7.2% con infiltrado de tipo neumónico25,64.
El electrocardiograma puede ser normal en las primeras fases o mostrar cambios tales como taquicardia, prolongación del PR-QT y ondas Q anormales (datos de infarto); este estudio se encontró alterado en 23% de los pacientes, predominado la taquicardia y QTc prolongados3,5,21,37.
La ecocardiografía es un estudio de gabinete crucial en el diagnóstico y resulta necesario en la fase aguda y dentro de los primeros 15 días independientemente del tratamiento adecuado, y es especialmente importante en los niños con cuadro atípico o incompleto que manifiestan fiebre y menos de 4 signos básicos. Este procedimiento se realizó a los 249 pacientes, demostrándose cambios cardiológicos de diversa índole, entre los cuales los más relevantes fueron la dilatación coronaria en 32% con predominio de las lesiones izquierdas. La miocarditis se diagnosticó en el 6%, y es conveniente mencionar que esta lesión puede estar presente en pacientes con o sin aneurismas coronarios. El mecanismo de establecimiento del daño miocárdico aun se desconoce; se ha considerado que es secundario a la acción de citosinas, al factor de necrosis tumoral e IL-1 e IL-6, que lesionan los miocitos provocando disfunción en la contractilidad.
El derrame pericárdico ocurrió en el 6% y las lesiones valvulares en el 5.2%3,5–21,46. Respecto a estas lesiones valvulares aórticas, mitral y tricúspides y los cambios en los lúmenes arteriales, han sido reportadas con menos frecuencia aunque este tipo de alteraciones pueden esperarse como consecuencia de la inflamación de las válvulas cardiacas y de los cambios coronarios3,9,70,71.
Existen otros procedimientos de mayor precisión utilizados en la identificación de lesiones coronarias, entre los cuales están los gammagramas de perfusión miocárdica y coronariografías; dichos procedimientos fueron realizados en el 10% de los niños. También es posible solicitar la angiografía coronaria mediante resonancia magnética que proporciona imágenes equivalentes a la angiografía coronaria y además adicionalmente informa sobre el flujo en las arterias dilatadas. Otros procedimientos como la tomografía computarizada por emisión de electrones se utiliza para estimar las características del miocardio y es útil para detectar isquemia miocárdica progresiva; así también la tomografía computarizada en espiral.
La tomografía computarizada por emisión de electrones es un recurso no invasivo comparable con la angiografía coronaria para visualizar estenosis arteriales en niños con lesiones coronarias; últimamente se ha recomendado el empleo de tomografía computarizada dual como un recurso de mayor utilidad que el ecocardiograma Doppler de color para la detección de anormalidades coronarias, no obstante esto, recientemente también se han descrito innovaciones tecnológicas a la ecocardiografía que permiten evaluar la repuesta al tratamiento con GGIV, valorándose las paredes arteriales con dispositivos especiales. Algunos de todos estos procedimientos en un futuro pueden constituir los estándares de diagnóstico y seguimiento en EK3,9,72–75. Buena parte de estos recursos tecnológicos están disponibles en México en los Institutos Nacionales de Salud, pero en el interior de la República se limitan a las grandes ciudades.
El uso de GGIV a dosis de 2g/kg en dosis única para infusión de 12h es el más aceptado y ha permitido reducir la prevalencia de aneurismas a menos del 5% y la mortalidad del 2 al 0.3%6,8,9, aunque también se ha utilizado el esquema de GGIV en dosis de 400mg/kg/d durante 5 días, y además aspirina a 80-100mg/kg/d. Este recurso terapéutico se emplea con base en los siguientes mecanismos de acción: neutralización, aceleración del catabolismo y supresión de la producción de anticuerpos, neutralización del complemento, bloqueo de la producción de anticuerpos de citotoxicidad celular, e inhibición de moléculas de adhesión, modulando la proliferación de células y apoptosis activa de células T, restaurando el balance de Th/Th2, disminuye células CD8 (linfocitosT autorreactivos) de IL-1, TNF alfa, IL-6, interferón gamma modulando la producción de anticuerpos en el endotelio3–6.
De acuerdo a respuesta se puede repetir dosis de GGIV o adicionar corticoides, especialmente en los casos refractarios.
Se han recomendado otros agentes terapéuticos como: ciclosfosfamida, ciclosporina, etanercept, metrotexate, ulinastatin, utilizándose en un limitado número de casos3,4,6,8,13.
El infliximab, a base de anticuerpos monoclonales contra el factor de TNF alfa, se ha utilizado con éxito en casos de resistencia a gammaglobulina3,9,76–79.
Otro anticuerpo monoclonal que inhibe el receptor de glucoproteína plaquetaria IIb/IIIa, el abciximab, se ha invocado que favorece la resolución más rápida de los aneurismas; sin embargo estos fármacos requieren de mayor experiencia clínica.
Las recomendaciones más recientes son en el sentido de que en casos de recaída, resistencia o recurrencia al uso de GGIV se encuentra mejor efectividad si se utilizan pulsos de metilprednisolona adicionados a la gammaglobulina; incluso se ha sugerido la combinación como una terapia inicial más efectiva6–9,76–79.
Entre los años 1977 y 1987, 42 pacientes recibieron tratamiento básico con aspirina. Las series reportadas después de esos años incluyen uso de GGIV más aspirina; de acuerdo a los registros obtenidos, 21niños se trataron con GGIV en dosis de 400mg/kg/d, en un período de 5 días asociado a aspirina; los casos tratados con GGIV a dosis de 2g/kg en dosis única y aspirina a dosis convencionales fueron 174 (69%); a 22 niños tuvieron que aplicarles dosis adicionales de GGIV por persistir fiebre; en 6 se utilizaron pulsos de metilprednisolona, dado que estos pacientes llevaban más de una semana con fiebre al momento de la admisión24–46.
Los pacientes en quienes se aplicó GGIV en el curso de la primera semana en dosis de 2g/kg no desarrollaron alteraciones coronarias y el tiempo de hospitalización fue notablemente menor.
Los pacientes controlados en las consultas ambulatorias fueron 203 (81%), fueron seguidos por períodos al menos de 3 meses y evolucionaron sin secuelas; algunos otros paciente se siguieron por períodos entre 6 y 12 meses. Los autores refirieron que los niños con dilataciones han sido controlados de acuerdo a las estratificaciones de riesgo del i-v de Asociación Americana del Corazón3,24–46.
Se han realizado estudios encaminados a identificar si existen marcadores genéticos de la enfermedad, particularmente en pacientes orientales. Hasta ahora los hallazgos se enfocan a tratar de relacionar dichos marcadores y los riesgos de complicaciones en niños que padecen EK. Los polimorfismos encontrados como el HLA-E se han asociado con la posibilidad de desarrollo de aneurismas coronarios; también los alelos HLA_B35.-B75 y Cw09 se observaron más en pacientes coreanos con EK; asimismo, las complicaciones estuvieron relacionadas con los subgrupos HLA-DRB1*11 y HLADRB1*09. En niños chinos estudiaron el gen de la resistina (RETN), un proinflamatorio, que en seres humanos codifica en el cromosoma 19 p 13.3, sugiriéndose que tiene participación en la patogénesis de la EK. En líneas anteriores se comentó también sobre las observaciones que sugieren la existencia de una asociación genética de un polimorfismo en el ITPKC que estaría relacionado con mayor inmunorreactividad. Por otro lado, las alteraciones de la matriz extracelular relacionadas con procolágeno tipo iii (PIIINP) y metaloproteínas identificadas con biomarcadores en 35 adolescentes y adultos jóvenes que padecieron EK han mostrado una asociación entre la concentración elevada de PIIINP y la severidad de las lesiones coronarias; sin embargo son necesarios más estudios confirmatorios al respecto80–82.
En un estudio hecho en México para identificar la presencia de polimorfismos en 48 niños con EK, específicamente encaminado a determinar la asociación de frecuencia con TNF-308 y linfotoxina alfa (LTA)+252 polimorfismos entre pacientes que tenían EK con y sin aneurismas coronarios, no encontraron diferencias notables entre ambos grupos de pacientes para los alelos y genotipos, concluyendo que se necesita un estudio más amplio7,80–84.
Hasta ahora, en muchos países del mundo y en el nuestro se desconoce el número de pacientes que padecieron EK y que siendo adultos jóvenes han manifestando de manera temprana isquemia miocárdica6,8,9,31–70,85.
Mediante el método de búsqueda seguido en este trabajo y que estuvo basado en la revisión de artículos publicados en México, no se hicieron evidentes registros de EK en adultos, al menos hasta la fecha de corte de esta revisión; por otro lado, aun en la literatura mundial los registros suman cerca de 90 casos85–88.
ConclusionesEl diagnóstico de la EK hasta ahora se sustenta principalmente en bases clínicas. De acuerdo a esta revisión, el número de pacientes con aneurismas coronarios es mayor al esperado según lo señalado en la literatura médica internacional; esto tiene relación con el retraso en el diagnóstico.
El uso de GGIV en dosis altas y aspirina inducen la remisión de los signos y síntomas, evitando el desarrollo de aneurismas coronarios y otras complicaciones.
Los reportes de series de casos de EK se han incrementado en México en los últimos 5 años, sin embargo sería recomendable que a través del sector salud se estableciera un registro nacional anual, al menos en los centros de atención pediátrica e institutos para enfermedades cardiovasculares.
FinanciaciónNo se recibió patrocinio de ningún tipo para la elaboración de este trabajo. No existe conflicto de intereses.