Existe escasa evidencia sobre la evolución de los pacientes portadores de desfibrilador por prevención primaria tras una tormenta arrítmica. Se pretende describir la tasa de la misma, características basales y evolución de este subgrupo comparada con aquellos sin tormenta arrítmica.
MétodosEstudio multicéntrico retrospectivo realizado en 15 hospitales españoles. Cada centro incluyó consecutivamente a los pacientes sometidos a implante de desfibrilador en prevención primaria durante al menos 2010 y 2011.
ResultadosDe 1,174 pacientes, 34 (2.9%) presentaron un episodio de tormenta arrítmica, principalmente secundaria a taquicardia ventricular (82.4%). No se detectaron diferencias basales entre aquellos con y sin tormenta, presentando similar puntuación en los scores de mortalidad (SHOCKED, MADIT y FADES). Se identificó un posible trigger en el 47% de los eventos. Durante un seguimiento medio de 38±21 meses, 20 pacientes fallecieron por cualquier causa (58.8%) frente a 165 (14.4%) de la población sin tormenta arrítmica (p<0.001). De estos, 18 (52.9%) fallecieron por causa de origen cardiovascular frente a 98 pacientes (8.6%) (p<0.001). Presentaron asimismo mayor tasa de terapias inapropiadas que el grupo sin tormenta (14,7 versus 8.6%; p<0.001).
ConclusionesEn la presente muestra de pacientes con desfibrilador por prevención primaria la tasa de tormenta arrítmica fue del 2.9%. No se objetivaron diferencias basales entre pacientes con historia de tormenta arrítmica frente a aquellos sin ella. Sin embargo, hubo diferencias en la tasa de mortalidad de cualquier causa, de origen cardiovascular y terapias inapropiadas.
Little is known about the prevalence of electrical storm, baseline characteristics and mortality implications of patients with implantable cardioverter defibrillator in primary prevention versus those patients without electrical storm. We sought to assess the prevalence, baseline risk profile and survival significance of electrical storm in patients with implantable defibrillator for primary prevention.
MethodsRetrospective multicenter study performed in 15 Spanish hospitals. Consecutives patients referred for desfibrillator implantation, with or without left ventricular lead (at least those performed in 2010 and 2011), were included.
ResultsOver all 1,174 patients, 34 (2,9%) presented an electrical storm, mainly due to ventricular tachycardia (82.4%). There were no significant baseline differences between groups, with similar punctuation in the mortality risk scores (SHOCKED, MADIT and FADES). A clear trigger was identified in 47% of the events. During the study period (38±21 months), long-term total mortality (58.8% versus 14.4%, p<0.001) and cardiac mortality (52.9% versus 8.6%, p<0.001) were both increased among electrical storm patients. Rate of inappropriate desfibrillator intervention was also higher (14.7 versus 8.6%, p<0.001).
ConclusionsIn the present study of patients with desfibrillator implantation for primary prevention, prevalence of electrical storm was 2.9%. There were no baseline differences in the cardiovascular risk profile versus those without electrical storm. However, all cause mortality and cardiovascular mortality was increased in these patients versus control desfibrillator patients without electrical storm, as was the rate of inappropriate desfibrillator intervention.
La tormenta arrítmica (TA) representa una devastadora situación en pacientes portadores de desfibriladores automáticos implantables (DAI), con un manejo complejo y un incremento en la mortalidad según las series disponibles en la actualidad1–10. Sin embargo, la mayoría de estas series se basan en muestras pequeñas y predominantemente en pacientes con DAI por prevención secundaria y escasa proporción de terapia de resincronización cardiaca (TRC).
Con estos antecedentes pretendemos evaluar en una muestra contemporánea de pacientes portadores de DAI (con o sin TRC) por prevención primaria la tasa de TA así como la evolución posterior frente a aquellos pacientes sin TA.
MétodosSe trata de un estudio multicéntrico retrospectivo realizado en 15 centros españoles con experiencia en el implante y seguimiento de pacientes portadores de DAI. Se incluyeron los pacientes consecutivos con primoimplante del dispositivo en prevención primaria entre los años 2010 y 2011 (en base a las recomendaciones vigentes en dicho momento), aunque en 3 centros se recogieron además los casos de los pacientes con implantes realizados desde el año 2008. Se excluyeron aquellos pacientes con canalopatías, displasia arritmogénica del ventrículo derecho, miocardiopatía hipertrófica y cardiopatías congénitas. A los centros participantes se les envío una hoja de recogida de datos uniforme, la cual fue cumplimentada únicamente por cardiólogos quienes recogieron las siguientes variables: variables referentes a factores demográficos (edad, sexo, índice de masa corporal, factores de riesgo cardiovascular, presión arterial y frecuencia cardiaca, tipo de miocardiopatía, en caso de miocardiopatía isquémica se recogió el tipo de revascularización, fracción de eyección ventricular izquierda (FEVI), grado funcional de la New York Heart Association, tratamiento médico, ritmo al implante, historia previa de fibrilación auricular, pro-BNP, función renal, hemoglobina, datos del electrocardiograma, enfermedad pulmonar obstructiva crónica, síndrome de apnea obstructiva del sueño y uso de presión aérea continua positiva, enfermedad arterial periférica (definida como aquellos pacientes con intervención en la arteria carótida, aorta torácica o abdominal o presencia de claudicación intermitente), ingresos hospitalarios previos por causa cardiovascular y opción de monitorización remota.
Referente al seguimiento clínico se hizo hincapié en la hospitalización durante el seguimiento y causa de la misma, mortalidad de cualquier causa y de causa cardiovascular (exitus cardiovascular o trasplante cardiaco), terapias apropiadas del DAI (estimulación antitaquicardia (ATP) o choques), terapias inapropiadas (ATP o choque) y tiempo desde el implante.
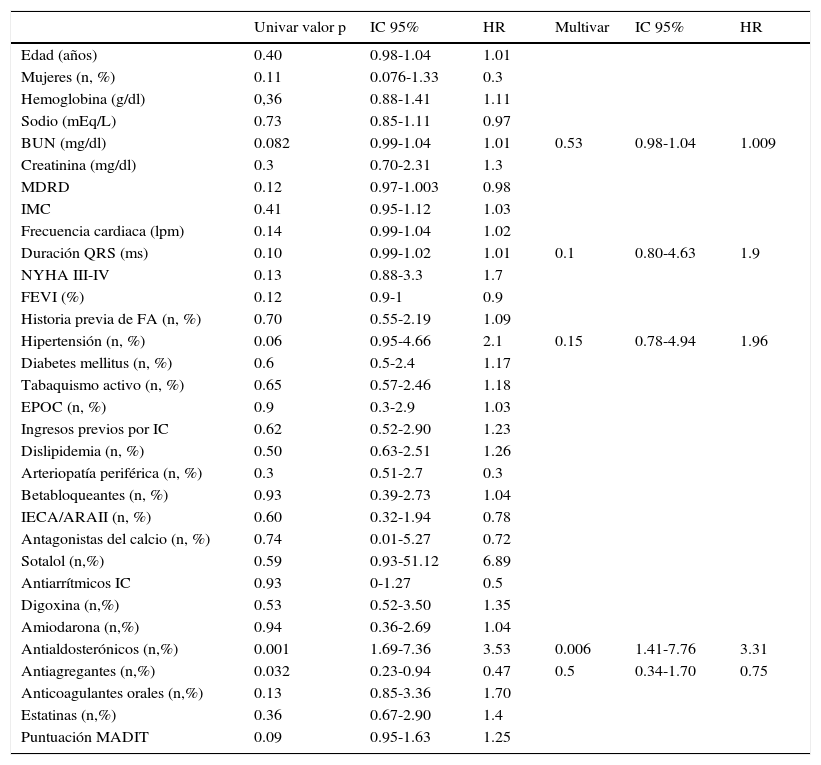
Se definió TA como la presencia de 3 o más choques apropiados en un plazo inferior a 24h. Se registró el tiempo desde el implante del DAI y el manejo del evento agudo (médico y/o ablación de taquicardia ventricular [TV]). Se definió «TA debida a estimulación ventricular izquierda» como más de 3 choques apropiados en menos de 24h dentro del primer mes tras el implante del TRC11. Para la estratificación homogénea del perfil de riesgo de los pacientes se recurrieron a las escalas de mortalidad MADIT12, SHOCKED13 y FADES14. En la tabla 1 se recoge a modo de resumen las variables incluidas en cada modelo y el sistema de puntuación.
Variables incluidas en los 3 modelos de predicción de mortalidad utilizados y sistema de puntuación de los mismos
| Escala | Variable | Categorías |
|---|---|---|
| MADITII | - Edad>70 años (1 punto)- Anchura QRS>120ms (1 punto)- Fibrilación auricular (1 punto)- NYHA>2 (1 punto)- Nitrógeno ureico en sangre>26mg/d (1 punto) | Riesgo bajo: puntuación 0Riesgo intermedio: puntuación 1 o 2Riesgo alto: puntuación≥3 |
| SHOCKED | - Edad ≥ 75 años (62 puntos)- NYHA III (36 puntos)- Fibrilación auricular (27 puntos)- EPOC (62 puntos)- Enfermedad renal crónica (100 puntos)- FEVI≤20% (28 puntos)- Diabetes mellitus (41 puntos) | La ecuación del modelo abreviado se representa en forma de nomogramas, que consta de hasta 360 puntos. Las tasas de mortalidad se basan en quintiles de riesgoEl mayor quintil de riesgo>202 |
| FADES | - NYHA≥III (1 punto)- Edad avanzada:- 65 y 75 (0.5 punto)- Edad≥75 años (2 puntos)- Diabetes mellitus (1 punto)- FEVI≤25% (1 punto)- Historia de tabaquismo (1 punto) | Riesgo bajo: puntuación 0-1.5Riesgo intermedio: puntuación 2-2.5Riesgo alto: puntuación 3-5.5 |
EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección ventricular izquierda; NYHA: grado funcional de la New York Heart Association (i-iv).
Los datos descriptivos se presentan en forma de media±desviación estándar o mediana según sea apropiado. Para las comparaciones de los grupos, se utilizaron pruebas de t de Student bilaterales para muestras independientes en las variables continuas y la prueba de la Chi-cuadrado para las variables binarias. Se calcularon las tasas de eventos acumulativas con el método de Kaplan-Meier y la presencia de predictores mediante análisis de regresión de Cox. Se consideró estadísticamente significativo un valor de p<0.05. Todas las estadísticas se realizaron mediante el programa informático SPSS v19 (SPSS Inc., Chicago, Illinois, EE. UU.).
ResultadosHubo un total de 11 pacientes perdidos, habiendo un total de 1,174 pacientes que se incluyeron en el análisis. Doscientos ochenta y un pacientes fueron implantes previos al año 2010 y el resto posteriores (866). Treinta y cuatro (2.9%) presentaron un episodio de TA.Las características basales de los mismos (población general y según la presencia o no de TA) se muestran en la tabla 2. Destacar que fueron predominantemente hombres (94%), con alta prevalencia de hipertensión arterial (76%), solamente 7 de ellos presentaron previo al implante ingresos por insuficiencia cardiaca (IC). Diecinueve pacientes (55.9%) presentaban miocardiopatía de origen isquémico, un paciente (2.9%) miocardiopatía valvular, uno (2.9%) miocardiopatía secundaria a miocarditis, 2 pacientes (5.8%) miocardiopatía dilatada de origen hipertensivo y el resto (10 pacientes, 29.4%) miocardiopatía dilatada idiopática. No presentaron un perfil de riesgo cardiovascular más adverso según las escalas de predicción de mortalidad (MADIT12, SHOCKED13 y FADES14).
Características basales de la población total y por subgrupos (TA sí/TA no)
| Total n (1,174) | Tormenta arrítmica si (n=34) | Tormenta arrítmica no (n=1140) | p | |
|---|---|---|---|---|
| Edad (años) | 62 (11) | 61.8 (9) | 62.2 (11) | 0.8 |
| Mujeres (n, %) | 218 (18.6) | 2 (5.9) | 216 (18.9) | 0.06 |
| Hemoglobina (g/dl) | 13.47 (1.63) | 13.9 (1.7) | 13.4 (1.6) | 0.09 |
| Sodio (mEq/L) | 139 (3.59) | 138.8 (3.9) | 139 (3.6) | 0.8 |
| BUN (mg/dl) | 25.3 (13.7) | 27.4 (13.2) | 25.2 (13.7) | 0.3 |
| Creatinina (mg/dl) | 1.18 (0.57) | 1.16 (0.3) | 1.18 (0.5) | 0.8 |
| MDRD | 73.62 (26.14) | 71.6 (19.9) | 73.7 (26.3) | 0.6 |
| IMC | 28.7 (4.7) | 29.7 (4.5) | 28.7 (4.7) | 0.3 |
| Frecuencia cardiaca (lpm) | 70.7 (14) | 73.1 (13.5) | 70.6 (14.6) | 0.3 |
| Duración QRS (ms) | 127.7 (32.2) | 131.6 (29.8) | 127.6 (32.2) | 0.5 |
| NYHA III-IV | 456 (38.8) | 14 (41.2) | 442 (38.8) | 0.6 |
| FEVI (%) | 26.19 (7.6) | 24.3 (6.5) | 26.2 (7.6) | 0.1 |
| Historia previa de FA (n, %) | 412 (35.2) | 13 (38.2) | 399 (35.1) | 0.7 |
| Hipertensión (n, %) | 707 (60.2) | 26 (76.5) | 681 (59.7) | 0.04 |
| Diabetes mellitus (n, %) | 387 (33) | 11 (32.4) | 376 (33) | 0.9 |
| Tabaquismo activo (n, %) | 264 (22.5) | 11 (32.4) | 253 (22.2) | 0.1 |
| EPOC (n, %) | 167 (14.2) | 4 (11.8) | 163 (14.3) | 0.6 |
| Ingresos previos por IC | 320 (27.3) | 7 (20.6) | 313 (27.5) | 0.3 |
| Dislipidemia (n, %) | 576 (49.1) | 20 (58.8) | 556 (48.8) | 0.2 |
| Arteriopatía periférica (n, %) | 101 (8.6) | 1 (3) | 100 (8.8) | 0.2 |
| Betabloqueantes (n, %) | 1009 (86) | 29 (85.3) | 980 (86) | 0.9 |
| IECA/ARAII (n, %) | 1026 (87.5) | 28 (82.4) | 998 (87.6) | 0.3 |
| Antagonistas del calcio (n, %) | 56 (4.8) | 1 (2.9) | 55 (4.8) | 0.6 |
| Sotalol (n, %) | 7 (0.6) | 1 (2.9) | 6 (0.5) | 0.07 |
| Antiarrítmicos IC | 2 (0.2) | 0 (0) | 2 (0.2) | 0.8 |
| Digoxina (n, %) | 163 (13.9) | 5 (14.7) | 158 (13.9) | 0.8 |
| Amiodarona (n, %) | 114 (9.7) | 4 (11.8) | 110 (9.7) | 0.6 |
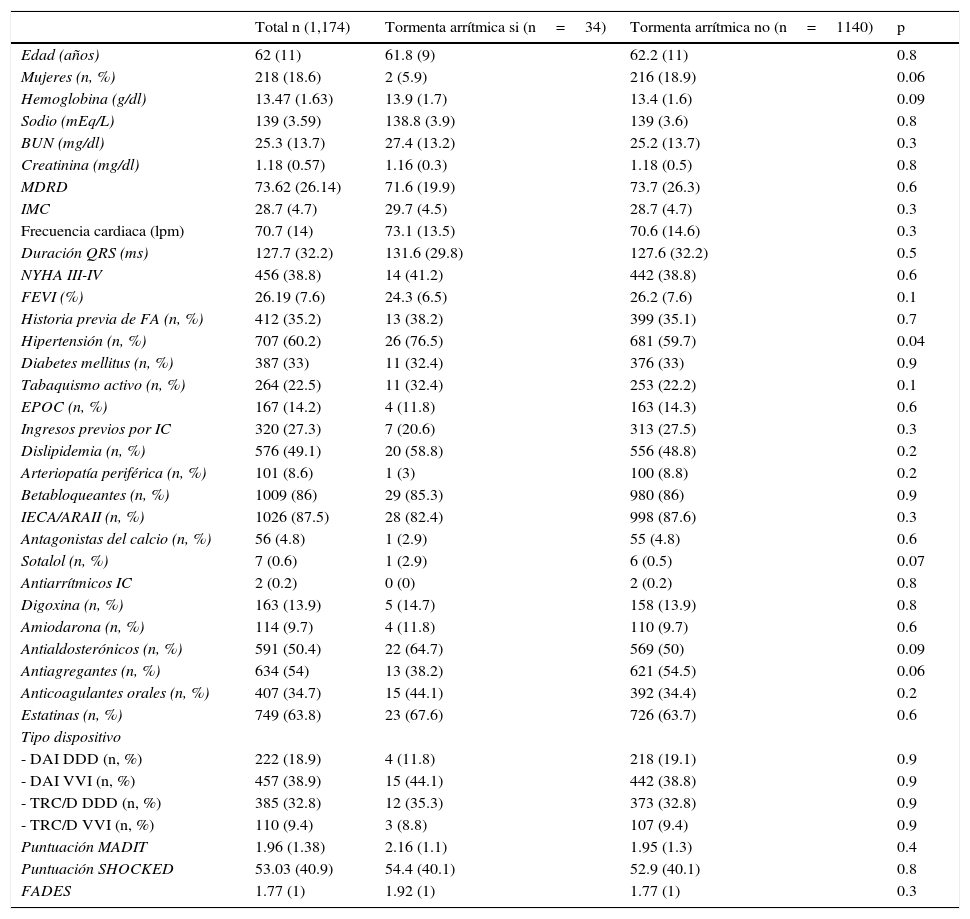
| Antialdosterónicos (n, %) | 591 (50.4) | 22 (64.7) | 569 (50) | 0.09 |
| Antiagregantes (n, %) | 634 (54) | 13 (38.2) | 621 (54.5) | 0.06 |
| Anticoagulantes orales (n, %) | 407 (34.7) | 15 (44.1) | 392 (34.4) | 0.2 |
| Estatinas (n, %) | 749 (63.8) | 23 (67.6) | 726 (63.7) | 0.6 |
| Tipo dispositivo | ||||
| - DAI DDD (n, %) | 222 (18.9) | 4 (11.8) | 218 (19.1) | 0.9 |
| - DAI VVI (n, %) | 457 (38.9) | 15 (44.1) | 442 (38.8) | 0.9 |
| - TRC/D DDD (n, %) | 385 (32.8) | 12 (35.3) | 373 (32.8) | 0.9 |
| - TRC/D VVI (n, %) | 110 (9.4) | 3 (8.8) | 107 (9.4) | 0.9 |
| Puntuación MADIT | 1.96 (1.38) | 2.16 (1.1) | 1.95 (1.3) | 0.4 |
| Puntuación SHOCKED | 53.03 (40.9) | 54.4 (40.1) | 52.9 (40.1) | 0.8 |
| FADES | 1.77 (1) | 1.92 (1) | 1.77 (1) | 0.3 |
ARA: antagonistas de los receptores de la angiotensina; BUN: nitrógeno ureico en sangre; DAI: desfibrilador automático implantable; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; FEVI: fracción de eyección ventricular izquierda; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima convertidora de la angiotensina; IMC: índice de masa corporal; NYHA: New York Heart Association; TA: tormenta arrítmica; TRC: terapia de resincronización cardiaca.
En lo referente al tratamiento médico no hubo diferencias estadísticamente significativas en cuanto a la prescripción de betabloqueantes, inhibidores de la enzima convertidora de angiotensina/antagonistas de los receptores de la angiotensina ii, antialdosterónicos, digoxina, antagonistas del calcio, estatinas, antiagregantes y anticoagulantes. Ningún paciente con TA se encontraba en tratamiento con antiarrítmicos del grupo IC en el momento del evento. Hubo un paciente en el grupo TA con sotalol versus 6 en el grupo no TA.
La mediana de aparición de la TA postimplante de DAI fue de 25 meses (percentil 25 de 8.5 meses–percentil 75 de 38 meses).
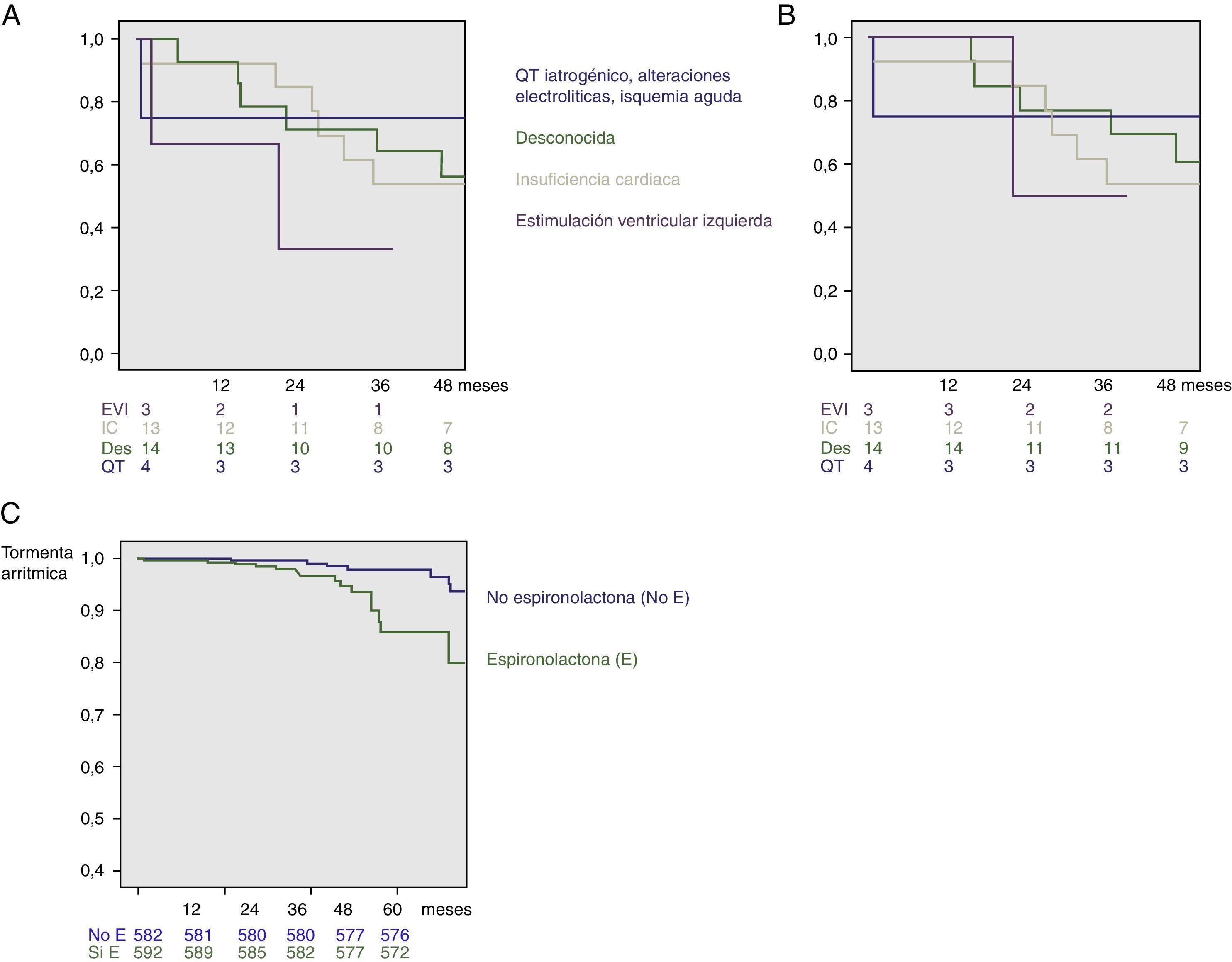
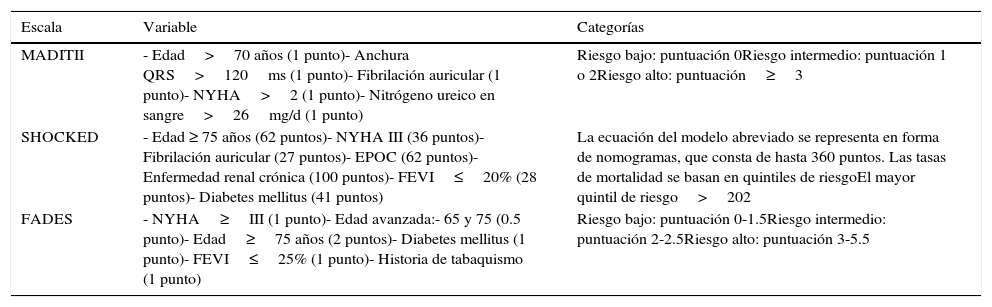
Respecto al factor precipitante de la TA, en 10 pacientes (29.4%) se relacionó con descompensación de IC, en 2 (5.8%) por QT largo iatrogénico, un paciente (2.9%) por isquemia aguda, uno (2.9%) por alteraciones hidroelectrolíticas secundarias a un cuadro de gastroenteritis aguda y 4 (11.76%) por estimulación ventricular izquierda (VI). En el resto (16 pacientes, 47%) no se identificó factor precipitante alguno. La TA se manifestó como TV en 28 (82.4%) de los pacientes mientras que comenzó en forma de fibrilación ventricular en 6 (17.6%).
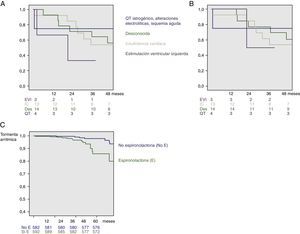
El seguimiento medio fue de 38±21 meses. Durante el mismo, 20 pacientes fallecieron por cualquier causa (58.8%) frente a 165 (14.4%) de la población sin TA (p<0.001). De estos, 18 pacientes (52.9%) del grupo TA fallecieron por causa de origen cardiovascular, frente a 98 pacientes (8.6%) del grupo sin TA (p<0.001) (fig. 1). En la figura 1 se muestran las curvas de supervivencia en función del factor precipitante. En pacientes sin TA la tasa de terapia apropiada (ATP y/o choque) fue del 15.4%. Finalmente también hubo mayor tasa de terapias inapropiadas (ATP y/o choque) en pacientes con historia de TA (n=5; 14.7%) que en aquellos sin TA (n=101; 8.6%, p<0.001), todas debidas a arritmias auriculares.
En cuanto al manejo de los mismos, todos precisaron ingreso hospitalario, y en todos ellos se instauró tratamiento antiarrítmico intravenoso, preferentemente con amiodarona (94%). En el paciente con QT largo iatrogénico la suspensión de la amiodarona que tomaba crónicamente logró el cese de las arritmias ventriculares. El paciente con isquemia aguda fue remitido a angioplastia con posterior resolución del cuadro. En 3 de los 4 pacientes en los que la estimulación VI se identificó como la causa de la misma, su desactivación logró abolir las TV. Además del tratamiento antiarrítmico, 8 pacientes precisaron balón de contrapulsación intraaórtica. Trece pacientes fueron remitidos durante el mismo ingreso a ablación de TV (una de ellas quirúrgica, con aneurismectomía y resección endomiocárdica; otro de estos pacientes fue el del grupo debido a estimulación VI en el que se realizó ablación epicárdica cercana a la ubicación del polo distal del electrodo izquierdo). Este subgrupo de pacientes remitidos a ablación de TV no presentó diferencias significativas frente a aquellos pacientes con TA sin ablación de TV en lo referente a muerte de cualquier causa (5 [38.5%] en el grupo de ablación versus 15 [71.4%] en el grupo de tratamiento médico sin ablación, p=0.06) ni en lo referente a muerte de causa de origen cardiovascular (5 [38.5%] versus 9 [61.9%], p=0.1); específicamente durante el ingreso hospitalario por dicha TA en 3 pacientes se realizó un trasplante cardiaco y 2 fallecieron.
Finalmente, en al análisis univariado únicamente el nitrógeno ureico, la duración del QRS, la hipertensión, los antialdosterónicos y antiagregantes se comportaron como predictores, persistiendo únicamente los antialdosterónicos en el análisis multivariable (HR 3.31, IC 95% 1.41-7.76; p=0.006) (tabla 3 y fig. 1C).
Resultado del análisis univariante y multivariante para tormenta arrítmica
| Univar valor p | IC 95% | HR | Multivar | IC 95% | HR | |
|---|---|---|---|---|---|---|
| Edad (años) | 0.40 | 0.98-1.04 | 1.01 | |||
| Mujeres (n, %) | 0.11 | 0.076-1.33 | 0.3 | |||
| Hemoglobina (g/dl) | 0,36 | 0.88-1.41 | 1.11 | |||
| Sodio (mEq/L) | 0.73 | 0.85-1.11 | 0.97 | |||
| BUN (mg/dl) | 0.082 | 0.99-1.04 | 1.01 | 0.53 | 0.98-1.04 | 1.009 |
| Creatinina (mg/dl) | 0.3 | 0.70-2.31 | 1.3 | |||
| MDRD | 0.12 | 0.97-1.003 | 0.98 | |||
| IMC | 0.41 | 0.95-1.12 | 1.03 | |||
| Frecuencia cardiaca (lpm) | 0.14 | 0.99-1.04 | 1.02 | |||
| Duración QRS (ms) | 0.10 | 0.99-1.02 | 1.01 | 0.1 | 0.80-4.63 | 1.9 |
| NYHA III-IV | 0.13 | 0.88-3.3 | 1.7 | |||
| FEVI (%) | 0.12 | 0.9-1 | 0.9 | |||
| Historia previa de FA (n, %) | 0.70 | 0.55-2.19 | 1.09 | |||
| Hipertensión (n, %) | 0.06 | 0.95-4.66 | 2.1 | 0.15 | 0.78-4.94 | 1.96 |
| Diabetes mellitus (n, %) | 0.6 | 0.5-2.4 | 1.17 | |||
| Tabaquismo activo (n, %) | 0.65 | 0.57-2.46 | 1.18 | |||
| EPOC (n, %) | 0.9 | 0.3-2.9 | 1.03 | |||
| Ingresos previos por IC | 0.62 | 0.52-2.90 | 1.23 | |||
| Dislipidemia (n, %) | 0.50 | 0.63-2.51 | 1.26 | |||
| Arteriopatía periférica (n, %) | 0.3 | 0.51-2.7 | 0.3 | |||
| Betabloqueantes (n, %) | 0.93 | 0.39-2.73 | 1.04 | |||
| IECA/ARAII (n, %) | 0.60 | 0.32-1.94 | 0.78 | |||
| Antagonistas del calcio (n, %) | 0.74 | 0.01-5.27 | 0.72 | |||
| Sotalol (n,%) | 0.59 | 0.93-51.12 | 6.89 | |||
| Antiarrítmicos IC | 0.93 | 0-1.27 | 0.5 | |||
| Digoxina (n,%) | 0.53 | 0.52-3.50 | 1.35 | |||
| Amiodarona (n,%) | 0.94 | 0.36-2.69 | 1.04 | |||
| Antialdosterónicos (n,%) | 0.001 | 1.69-7.36 | 3.53 | 0.006 | 1.41-7.76 | 3.31 |
| Antiagregantes (n,%) | 0.032 | 0.23-0.94 | 0.47 | 0.5 | 0.34-1.70 | 0.75 |
| Anticoagulantes orales (n,%) | 0.13 | 0.85-3.36 | 1.70 | |||
| Estatinas (n,%) | 0.36 | 0.67-2.90 | 1.4 | |||
| Puntuación MADIT | 0.09 | 0.95-1.63 | 1.25 |
ARA: antagonistas de los receptores de la angiotensina. BUN: nitrógeno ureico en sangre; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; FEVI: fracción de eyección ventricular izquierda; HR: hazard ratio; IC: insuficiencia cardiaca; IC 95%: intervalo de confianza del 95%; IECA: inhibidores de la enzima convertidora de la angiotensina; IMC: índice de masa corporal; MDRD: Modificación de la dieta en enfermedad renal (para cálculo del filtrado glomerular); NYHA: New York Heart Association.
En el presente estudio tratamos de describir en una muestra homogénea y contemporánea la evolución de los pacientes portadores de DAI por prevención primaria tras al menos un evento de TA. Se pueden extraer varias conclusiones: en primer lugar se describe la tasa de TA en una población con indicación de prevención primaria de muerte súbita, en concreto del 2.9%, y se detalla en cuántos casos se pudo identificar la presencia de un desencadenante (47%). En segundo lugar se describe la evolución de dichos pacientes comparándolos frente a aquellos pacientes sin TA, apreciando una mayor tasa de muerte de cualquier causa y de causa cardiovascular a pesar de no presentar un perfil cardiovascular más adverso en el momento del implante. Finalmente, se detalla esta evolución en función del tratamiento asignado por su centro de referencia (tratamiento médico y/o ablación).
Lo primero que destaca de la presente cohorte es la incidencia más baja de TA que lo hasta ahora publicado, de hasta el 10-20%1,8 en algunas series. Esta diferencia radica principalmente en el hecho de que nuestra población es únicamente de prevención primaria, mientras que en el resto fue mayoritariamente de prevención secundaria. También podría ser debido a la alta tasa de tratamiento betabloqueante de nuestra cohorte (del 86% frente al 43% en la serie de ensayo AVID3 por ejemplo), ya que como es sabido, el bloqueo simpático ha demostrado ser efectivo como tratamiento agudo de las TA, además de reducir la mortalidad por isquemia e IC9. La proporción de pacientes en los que no se identificó un factor desencadenante claro fue similar a lo previamente publicado en pacientes remitidos para implante de DAI por prevención secundaria (superior al 50% en la mayoría de las series). Sin embargo solamente en la serie de Roque et al.15 se describió la tasa de TA precipitada por la estimulación VI en pacientes tras implante de TRC (incluyendo prevención primaria y secundaria), que fue del 12.5%, valor similar al observado en nuestra cohorte de prevención primaria (11.76%). Probablemente la escasa evidencia a este respecto en la series disponibles sea porque se tratan en su mayoría de series más antiguas, momento en el que la relación causal con la estimulación VI no estaba tan clara y la proporción de pacientes con TRC era menor. En la presente cohorte 4 pacientes presentaron relación con la misma, de tal forma que en 3 de ellos la TA cesó al interrumpir la estimulación VI y en otro paciente al realizar ablación epicárdica cercana a la localización de polo distal del electrodo VI. Dicho abordaje ha sido propuesto recientemente15 como posible solución para este tipo de pacientes, en los que desactivar la activación VI puede conllevar un deterioro significativo en su grado funcional.
En segundo lugar es preciso mencionar la ausencia de diferencias basales entre los pacientes que presentaron TA y los que no. Este hecho, aunque llamativo, es congruente con la literatura previa, de tal forma que incluso uno de los mayores predictores de mortalidad en población con IC como es la FEVI, no ha demostrado ser un claro predictor de TA en algunas de las grandes cohortes dónde ha sido evaluado1,4. Asimismo, la diabetes mellitus, importante marcador de riesgo cardiovascular, se ha postulado como factor protector de TA probablemente debido a las alteraciones neuroautonómicas que conlleva16 (en nuestra cohorte no hubo diferencias entre los 2 grupos). Sí resultó predictor para TA la toma crónica de antialdosterónicos. Si bien es cierto que este grupo de fármacos poseen efecto antifibrótico que se ha relacionado con disminución de arritmias ventriculares17, por otra parte, como contrapartida generan importante alteraciones hidroelectrolíticas que pueden aumentarlas18 y que podrían ser la justificación para este hallazgo. Por lo tanto, en la actualidad hay cierta heterogeneidad a este respecto en las diferentes series3 y será preciso aclararlo en futuros estudios específicamente dirigidos a analizar dicho objetivo.
Nosotros hemos recurrido a las puntuaciones de mortalidad para asignar el perfil de riesgo de las poblaciones, en concreto a la puntuación MADIT12, SHOCKED13 y FADES14, sin detectar tampoco diferencias basales significativas. Por lo tanto, a modo de hipótesis puede ser razonable concluir que, al igual que en prevención secundaria, en prevención primaria tampoco parece posible predecir con certeza qué pacientes van a presentar TA en el seguimiento.
Sin embargo, a pesar de esta ausencia de diferencias basales, nuestra población, en consonancia también con las series previas, presentó un pronóstico más adverso. La duda radica en saber si esto es «causa» (presentan choques debido a un empeoramiento cardiológico con la consecuente merma pronóstica) o «consecuencia» (los choques aumentan la mortalidad per se). Por una parte, Bansch et al.19 muestran que el incremento en la mortalidad podría ser debido a episodios recurrentes de TV, lo cual provocaría empeoramiento de la FEVI con la consiguiente evolución a una fase más avanzada del proceso de la IC, shock cardiogénico y muerte. Sin embargo, también es cierto que otra posible contribución al incremento de riesgo de muerte podría venir derivado de los choques en sí mismos. Sweeney et al.20 mostraron que los pacientes de prevención secundaria en los que el episodio de TV o fibrilación ventricular hizo que terminaran con choque tuvieron mayor mortalidad (con un incremente del 20% por cada choque) cuando se compararon con aquellos pacientes en los que no hubo terapias o estas fueron únicamente ATP. Esta hipótesis se sustenta asimismo en subestudios del MADIT-II21 en los que el riesgo de muerte después de un episodio de TA alcanzó su pico a los 3 días del evento agudo. En nuestra población en concreto (además de en la de Hohnloser et al.4) esto no se cumplió y no hubo un pico de mortalidad tan precoz, a pesar de una mayor mortalidad en el seguimiento. Independientemente del origen causal, sí parece claro que la TA representa un marcador de pronóstico desfavorable. En concreto, en un reciente metaanálisis la presencia de TA se asociaba con un riesgo relativo de 2.51; IC 95% 1.38-4.58 en aquellos pacientes con TA sin episodios de VT/VF previos10. Sin embargo, en dicho metaanálisis se incluían poblaciones y definiciones de TA heterogéneas como los autores apuntan en las limitaciones, siendo la serie de Verma et al.7 (la que más contribuye con 54 pacientes) la que definió TA como 2 o más mientras que en otras series se definió como 3 o más. Asimismo, en dicho metaanálisis se incluyeron pacientes con prevención primaria y secundaria y no se concreta la presencia de triggers identificables, la proporción de pacientes con TRC ni la evolución en aquellos pacientes remitidos a ablación de TV. Además se trata de poblaciones no mediterráneas donde la tasa de eventos cardiovascular puede ser diferente a la población mediterránea22,23, por lo que consideramos pertinente realizar este análisis en el momento actual.
Finalmente la duda radica en saber si la ablación de TV puede prolongar la supervivencia de este subgrupo de pacientes. Sí se ha comunicado que en TA refractaria a tratamiento médico la ablación de TV en centros con gran experiencia logra unas tasas de supervivencia de entre el 88%24 y el 91%25 a los 36 meses del evento agudo, tasas superiores a lo observado en pacientes con TA tratados únicamente con tratamiento médico. Sin embargo es importante puntualizar que la ausencia de eventos de TA a largo plazo solo se consiguió en aquellos paciente en los que al término de la ablación no se inducía ni la taquicardia clínica ni otras, en cuyo caso la ablación no previno el futuro desarrollo de TA en el seguimiento. En nuestra población, aunque hubo una clara tendencia a mayor mortalidad en aquellos pacientes en los que no se realizó ablación de TV, no alcanzó diferencias estadísticamente significativas. Sin embargo, creemos que sería precipitado extraer conclusiones en este sentido dado el limitado número de pacientes y periodo de seguimiento. Asimismo se trata de pacientes con diferentes factores precipitantes, alguno de ellos corregibles. También parece razonable pensar que la ablación se reserve para pacientes refractarios al tratamiento antiarrítmico. Por lo tanto, creemos que este punto deberá ser evaluado específicamente en futuros estudios.
LimitacionesEste estudio ha de ser interpretado con las limitaciones que confiere el análisis retrospectivo y no aleatorizado, lo cual aumenta la presencia de sesgos y factores de confusión. Además se trata de una muestra pequeña con baja tasa de eventos por lo que es difícil extraer conclusiones referentes a predictores de TA. También presenta la limitación inherente al periodo de seguimiento, por lo que es posible que un periodo mayor hubiese podido detectar diferencias en mortalidad en los 2 subgrupos de pacientes con TA (ablación o tratamiento médico únicamente). Finalmente es preciso mencionar que no se recogió la programación específica de los pacientes, por lo que no podemos analizar el impacto de la misma en la tasa de TA ni su influencia en la morbimortalidad.
ConclusionesEn la presente muestra de pacientes con antecedente de implante de DAI por prevención primaria se registró una tasa de TA del 2.9%, pudiéndose identificarse un desencadenante corregible en únicamente un 47% de los mismos. Además, no se objetivaron diferencias basales significativas entre pacientes con historia de TA durante el seguimiento frente a aquellos sin TA, y únicamente la toma de antialdosterónicos se comportó como factor predictor de TA. Sin embargo, sí hubo diferencias en la tasa de mortalidad de cualquier causa y de origen cardiovascular en pacientes con historia de TA versus ausencia de TA durante el periodo de estudio.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónNinguna.
Conflicto de interesesNinguno.
Anexo 1 Colaboradores
Emad Abu Assi (Servicio de Cardiología. Hospital Universitario Santiago de Compostela), Jesús Jiménez-López (Servicio de Cardiología. Hospitalario Virgen de la Salud, Toledo), Vicente Bertomeu-González (Servicio de Cardiología. Hospital Universitario San Juan, Alicante), Agustín Fernández-Cisnal (Servicio de Cardiología. Hospital Universitario Virgen del Rocío, Sevilla), Juan Benezet-Mazuecos (Servicio de Cardiología. Hospital Fundación Jiménez Díaz, Madrid), Ignacio García-Bolao (Servicio de Cardiología. Clínica Universidad de Navarra. Pamplona), Pilar Cabanas-Grandio (Servicio de Cardiología. Hospital Universitario de Vigo), Rafael Peinado (Servicio de Cardiología Hospital Universitario La Paz, Madrid), Ernesto Díaz-Infante (Servicio de Cardiología. Hospital Universitario Virgen Macarena, Sevilla), Juan José Olalla Antolín (Servicio de Cardiología. Hospital Universitario Marqués de Valdecilla. Santander), Ricardo Ruiz-Granell (Servicio de Cardiología. Hospital Clínico Universitario de Valencia), Jose Ormaetxe (Servicio de Cardiología. Hospital de Basurto, Bilbao), Enrique García Grandio (Servicio de Cardiología. Hospital Universitario de Vigo), Jose Olague de Ros (Servicio de Cardiología. Hospital Universitario La Fe, Valencia), Luis Tecedor-Sánchez (Servicio de Cardiología. Hospital Universitario La Fe, Valencia), Alonso Pedrote-Martínez (Servicio de Cardiología. Hospital Universitario Virgen del Rocío, Sevilla), Jose Ramón González-Juanatey (Servicio de Cardiología. Hospital Universitario Santiago de Compostela).