El uso de stents coronarios en la angioplastia coronaria ha evolucionado vertiginosamente en su diseño, tipo de materiales, polímeros y fármacos muy diversos. El uso de stents coronarios cubiertos de óxido nítrico han mostrado resultados satisfactorios en la práctica intervencionista; sin embargo, en comparación con los resultados reportados con stents liberadores de fármacos, se dispone de poca información.
ObjetivoComparar los resultados clínicos en la práctica clínica diaria de un stent bioactivo de acero inoxidable cubierto con titanio y óxido nítrico (BAS) y un stent liberador de fármaco (SLF) con zotarolimus.
MétodosEstudio retrospectivo, analítico, descriptivo y comparativo, cuyo objetivo fue evaluar la seguridad y la eficacia de dos dispositivos de diferentes características en nuestra población. Los puntos finales primarios a analizar fueron: muerte, infarto agudo de miocardio (IAM), y re intervención de la lesión tratada (RLT).
ResultadosEl estudio incluyó a 759 pacientes, a los cuales se les realizó angioplastia de un solo vaso. Estos se dividieron en dos brazos, 382 pacientes con SLF y 377 con BAS. Se realizó un seguimiento a un año en el 95%. Después de este periodo de seguimiento los puntos primarios (muerte cardiovascular, infarto de miocárdico, RLT y trombosis del stent) fueron similares para el brazo SLF vs. BAS; 9.5% vs. 8.5% p=NS pero con periodos más cortos de terapia dual anti plaquetaria para el brazo BAS 6.9±4.1 vs. SLF 11.1±2.5 meses p=0001. Los resultados fueron independientes del síndrome clínico de presentación.
ConclusionesDespués de un año de seguimiento no hubo diferencias estadísticamente significativas en cuanto a eventos clínicos mayores, y se presentó una tendencia a favor de BAS vs. SLF con respecto a la revascularización de la lesión tratada sin alcanzar significancia estadística.
The use of coronary stents in coronary angioplasty has evolved dramatically in its design, type materials, polymers, and a variety of drugs, the use of coronary stents covered nitric oxide have shown satisfactory results in practice, however compared to the results reported drug-eluting stents, there is little information.
ObjectivesThe aim of this study was to compare clinical outcomes of a stainless steel stent Bioactive nitric oxide coated titanium (BAS) and a drug-eluting stent zotarolimus (DES) in daily clinical practice.
MethodsA retrospective, analytical, descriptive and comparative study aimed at evaluating the safety and efficacy of two devices with different characteristics in our population. The primary endpoints were: death, acute infarction (AMI), and re intervention injury Treated (RLT).
ResultsA total of 759 patients were included in the study which was performed angioplasty to a single vessel. Were divided into two arms 382 with DES and 377 patients with BAS, the one year follow up was carried in 95%. After this follow-up period, primary points (cardiovascular death, myocardial infarction, TLR and stent thrombosis) for arm DES vs BAS; 9.5% vs 8.5% P=NS but with shorter periods of dual antiplatelet therapy for arm BAS 6.9±4.1 vs 11.1±2.5 months DES P=.0001. The results were independent of the clinical syndrome of presentation.
ConclusionsAfter one year of follow no statistically significant difference in major clinical events, there was a trend in favour of BAS vs SM with respect to revascularization of the target lesion without reaching statistical significance.
Las principales etapas en la evolución de la cardiología intervencionista han sido el desarrollo de la angioplastia con balón, la introducción del stent desnudo coronario, posteriormente el desarrollo del stent liberador de fármaco (SLF) y más recientemente los stents liberadores de fármacos de segunda generación1. La implantación de stents ha mejorado claramente la seguridad y los resultados de la intervención coronaria percutánea (ICP) comparados con los de la angioplastia con balón2; sin embargo, la restenosis ha sido el tendón de Aquiles de estos dispositivos, lo que ha llevado a la repetición del procedimiento, con el consecuente incremento en los costos de salud3, de ahí la necesidad de disminuir la tasa de restenosis.
La mayoría de las modificaciones han sido en su composición, combinación de materiales, geometría, arquitectura, grosor del struts y porcentaje de contacto del metal con la pared, y más recientemente como reservorio de fármacos antiproliferativos4.
El amplio uso de SLF, incluyendo paclitaxel, ha demostrado mejorar los resultados a corto y largo plazo comparado con los stents no medicados (SNM), sobre todo en cuanto a la reducción de la reintervención de la lesión tratada (RLT) acorde a los estudios clínicos aleatorizados en población selecta, con una reducción de un 50-70% en la tasa de reestenosis5,6.
El uso de recubrimiento pasivo de stent de metal desnudo con nitruro de titanio-óxido supone un enfoque diferente, y tiene el objetivo de incrementar la resistencia de corrosión, aumentar la biocompatibilidad y mejorar la cicatrización vascular7,8.
Ante estos hechos se realizó el presente estudio, con el objetivo de comparar la seguridad del stent con aleación de titanio y óxido nítrico (BAS) (Titan-2, Hexacath; París, Francia) vs. SLF (Endeavor Resolut con Zotarolimus; Medtronic, Indianapolis, Indiana, EUA) en una población de pacientes con cardiopatía isquémica.
Material y métodosEstudio retrospectivo, observacional analítico, comparativo, llevado a cabo en el periodo comprendido entre marzo de 2011 y mayo de 2012 y cuyo objetivo fue evaluar la seguridad del BAS vs. SLF.
Los datos fueron obtenidos de la base de datos del Departamento de Hemodinámica, realizándose el seguimiento por el expediente clínico de la consulta externa.
Los criterios de inclusión fueron: todos los pacientes mayores de 18 años de edad que acudieron a nuestro servicio con el diagnóstico de cardiopatía isquémica en los diferentes tipos (angina crónica estable [ACE], infarto de miocardio con elevación del segmento ST [IAMCEST] y síndrome coronario sin elevación del segmento ST [SICASEST], en sus dos variedades, como angina inestable [AI] e infarto de miocardio sin elevación del segmento ST [IAMSEST]), y que además de ser portadores de estas entidades hubiesen sido sometidos a intervencionismo coronario de un solo vaso, y que a su vez se les hubiese implantado un SLF del tipo zotarolimus o bien BAS.
Se excluyó a todos los pacientes que rehusaran someterse a intervención coronaria percutánea; que fueran alérgicos al ácido acetilsalicílico o al clopidogrel, o bien con contraindicación para el uso de estos fármacos por una alta posibilidad de sangrado. Se excluyó, además, a todos los pacientes con un stent diferente al de los brazos de estudio, así como aquellos en quienes se colocaron dos stents de diferente tipo.
El objetivo primario fue determinar la seguridad del BAS vs. SLF de segunda generación (Resolut), según la presencia de muerte cardiovascular, reinfarto del miocardio, trombosis intra-stent, y revascularización de la lesión tratada y del vaso tratado.
Se definió como muerte por causa cardiovascular toda aquella desarrollada en el contexto de un problema cardiaco durante su estancia en hospitalización o posterior a ella. Se consideró reinfarto la presencia de cualquier signo o síntoma clínico compatible con isquemia miocárdica, alteraciones dinámicas en el segmento ST y elevación de enzimas cardiacas por arriba de tres veces el valor normal.
La trombosis del stent (TS) se definió según la clasificación de la Academic Research Consortium (ARC) como probable, posible y definitiva. Desde el punto de vista angiográfico se definió como la observación de una oclusión o suboclusión con material de aspecto trombótico precedida de cuadro clínico agudo que puede cursar con elevación del segmento ST.
La RLT se definió como nueva angioplastia a la lesión tratada previamente o bien cirugía de revascularización por reestenosis de la lesión.
La revascularización del vaso tratado (RVT) se definió como cualquier intervención coronaria percutánea o quirúrgica en cualquier segmento del vaso tratado previamente.
No se incluyó en nuestro estudio el seguimiento angiográfico de rutina apoyándonos en prueba no invasiva para isquemia.
Análisis estadísticoSe trata de una cohorte retrospectiva, analítica observacional, comparativa. Para la medición de variables expresadas en porcentaje se utilizó la prueba de la ji al cuadrado (X2) o prueba exacta de Fisher, con base en la cantidad de pacientes. La frecuencia de eventos cardiovasculares mayores como TLR, TVR, trombosis, muerte cardiovascular e infarto se presentó en forma de porcentaje. Se consideró significativo un valor de p<0.05. Para el análisis estadístico se utilizó el sistema SPSS 20.
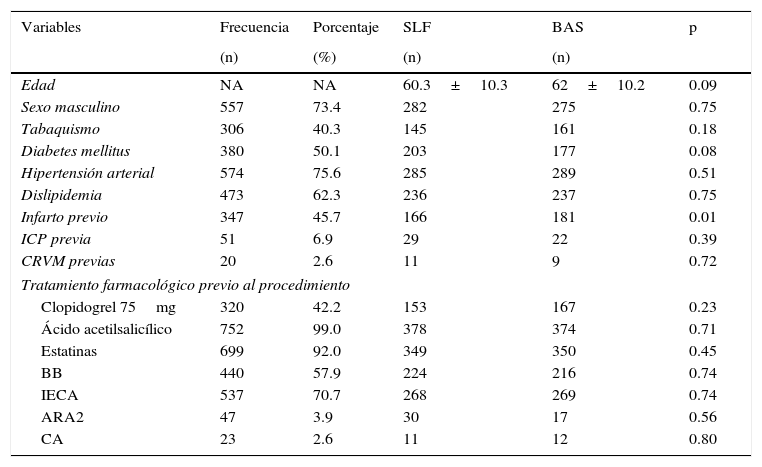
ResultadosEl estudio se realizó en el periodo comprendido entre marzo de 2011 y mayo de 2012. Durante este tiempo se realizaron 759 angioplastias al mismo número de pacientes con colocación de stent a un solo vaso. El total de pacientes se dividió en 2 brazos: 382 (50.3%) se incluyeron en el brazo de SLF y 377 (49.7%) en el de BAS. La edad promedio fue de 60±10 y 62±10 años, respectivamente, con una edad máxima de 87 años y mínima de 31. El 73.4% de los pacientes fue de sexo masculino. Un total de 380 pacientes (50.1%) fueron portadores de diabetes mellitus, de los cuales 203 estaban en el brazo de SLF y 177 en el de BAS, sin alcanzar significancia estadística. Al momento del estudio 574 pacientes (75.6%) presentaron hipertensión arterial, de los cuales 285 pertenecían al brazo de SLF y 289 al de BAS (tabla 1).
Características demográficas
| Variables | Frecuencia | Porcentaje | SLF | BAS | p |
|---|---|---|---|---|---|
| (n) | (%) | (n) | (n) | ||
| Edad | NA | NA | 60.3±10.3 | 62±10.2 | 0.09 |
| Sexo masculino | 557 | 73.4 | 282 | 275 | 0.75 |
| Tabaquismo | 306 | 40.3 | 145 | 161 | 0.18 |
| Diabetes mellitus | 380 | 50.1 | 203 | 177 | 0.08 |
| Hipertensión arterial | 574 | 75.6 | 285 | 289 | 0.51 |
| Dislipidemia | 473 | 62.3 | 236 | 237 | 0.75 |
| Infarto previo | 347 | 45.7 | 166 | 181 | 0.01 |
| ICP previa | 51 | 6.9 | 29 | 22 | 0.39 |
| CRVM previas | 20 | 2.6 | 11 | 9 | 0.72 |
| Tratamiento farmacológico previo al procedimiento | |||||
| Clopidogrel 75mg | 320 | 42.2 | 153 | 167 | 0.23 |
| Ácido acetilsalicílico | 752 | 99.0 | 378 | 374 | 0.71 |
| Estatinas | 699 | 92.0 | 349 | 350 | 0.45 |
| BB | 440 | 57.9 | 224 | 216 | 0.74 |
| IECA | 537 | 70.7 | 268 | 269 | 0.74 |
| ARA2 | 47 | 3.9 | 30 | 17 | 0.56 |
| CA | 23 | 2.6 | 11 | 12 | 0.80 |
ARA2: antagonistas de los receptores AT1 de la angiotensia II; BAS: stent bioactivo; CA: calcio-antagonista; CRVM: cirugía de revascularización miocardica BB: betabloqueantes; IECA: inhibidores de la enzima convertidora de angiotensina; ICP: intervención coronaria percutánea; SLF: stent liberador de fármaco.
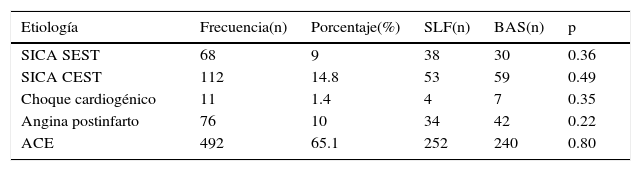
Dentro de las principales causas por las cuales los pacientes ingresaron al estudio se encontró que el 492 (65%) presentaban angina crónica estable, de los cuales 252 se encontraban en el brazo de SLF y 240 en el de BAS. En un 9% se detectó SICASEST, lo que significa que 38 pacientes pertenecieron a SLF y 30 al brazo BAS. Asimismo se encontró que 112 pacientes (14.8%) ingresaron al estudio por IAM, de los cuales 53 se incluyeron en el brazo de SLF y 59 en el de BAS; en todos los casos sin diferencia estadísticamente significativa (tabla 2).
Indicación del procedimiento
| Etiología | Frecuencia(n) | Porcentaje(%) | SLF(n) | BAS(n) | p |
|---|---|---|---|---|---|
| SICA SEST | 68 | 9 | 38 | 30 | 0.36 |
| SICA CEST | 112 | 14.8 | 53 | 59 | 0.49 |
| Choque cardiogénico | 11 | 1.4 | 4 | 7 | 0.35 |
| Angina postinfarto | 76 | 10 | 34 | 42 | 0.22 |
| ACE | 492 | 65.1 | 252 | 240 | 0.80 |
ACE: angina crónica estable; BAS: stent bioactivo; SICACEST: síndrome isquémico agudo con elevación del ST; SICASEST: síndrome isquémico agudo sin elevación del ST; SLF: stent liberador de fármaco.
Encontramos, además, dos grupos de pacientes que ingresaron al estudio con complicación por IAM establecido previamente: el primero, con choque cardiogénico, y el segundo con angina postinfarto. En el primer grupo había 11 pacientes, de los cuales 4 pertenecían al brazo de SLF y 7 al de BAS; en el segundo grupo fueron 76 pacientes, 34 del brazo de SLF y 42 del de BAS; en ambos brazos sin diferencia estadísticamente significativa.
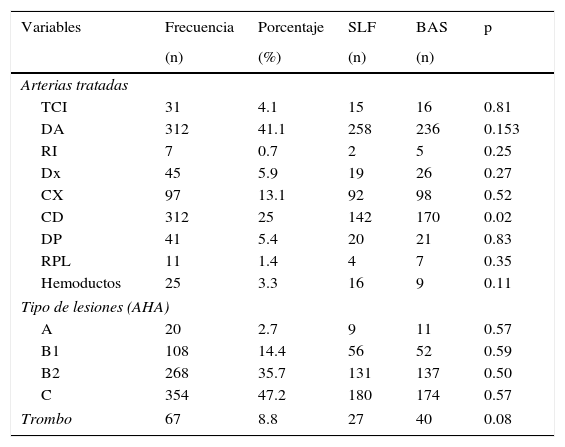
Variables angiográficasEntre las variables observadas en el procedimiento y encontradas en las angiografías (tabla 3) se logró documentar que la arteria predominante tratada fue la descendente anterior, lo que corresponde al 41.1% del total, con 258 pacientes en el brazo de SLF y 236 en el de BAS, sin diferencias estadísticamente significativas. No ocurrió lo mismo en la arteria coronaria derecha que fue la segunda arteria tratada con más frecuencia: 190 pacientes, 142 en el brazo de SLF y 170 en el de BAS, con diferencias estadísticamente significativas (p=0.02).
Características angiográficas
| Variables | Frecuencia | Porcentaje | SLF | BAS | p |
|---|---|---|---|---|---|
| (n) | (%) | (n) | (n) | ||
| Arterias tratadas | |||||
| TCI | 31 | 4.1 | 15 | 16 | 0.81 |
| DA | 312 | 41.1 | 258 | 236 | 0.153 |
| RI | 7 | 0.7 | 2 | 5 | 0.25 |
| Dx | 45 | 5.9 | 19 | 26 | 0.27 |
| CX | 97 | 13.1 | 92 | 98 | 0.52 |
| CD | 312 | 25 | 142 | 170 | 0.02 |
| DP | 41 | 5.4 | 20 | 21 | 0.83 |
| RPL | 11 | 1.4 | 4 | 7 | 0.35 |
| Hemoductos | 25 | 3.3 | 16 | 9 | 0.11 |
| Tipo de lesiones (AHA) | |||||
| A | 20 | 2.7 | 9 | 11 | 0.57 |
| B1 | 108 | 14.4 | 56 | 52 | 0.59 |
| B2 | 268 | 35.7 | 131 | 137 | 0.50 |
| C | 354 | 47.2 | 180 | 174 | 0.57 |
| Trombo | 67 | 8.8 | 27 | 40 | 0.08 |
AHA: American Heart Association; BAS: stent bioactivo; CD: coronaria derecha; CX: circunfleja; DA: descendente anterior; DP: descendente postereior; Dx: diagonal; RI: ramo intermedio; RPL: ramo posterolateral; SLF: stent liberador de fármaco; TCI: tronco de la coronaria izquierda.
En el resto de las arterias tratadas las características fueron muy similares, correspondiendo a un 33.8%, sin diferencias estadísticamente significativas. Destaca el tratamiento de tronco de la coronaria izquierda en 31 pacientes, de los cuales 15 pacientes pertenecían al brazo de SLF y 16 al de BAS; asimismo, 25 casos fueron tratados por lesión de hemoductos, sin encontrarse diferencias estadísticamente significativas entre ambos brazos.
Al hacer la comparación basándose en las características angiográficas según la clasificación de la American Heart Association (AHA) observamos que el mayor número de lesiones tratadas fue en las lesiones más complejas, como las de tipo C (354 pacientes, que corresponde al 47.2% del total de las lesiones tratadas; 180 en el brazo de SLF y 174 en el de BAS, sin diferencias estadísticamente significativas), y en segundo lugar se encontró la lesión tipo B2 en un 35.7%, sin diferencias estadísticamente significativas.
Además, en la angiografía de 67 pacientes del grupo que acudió a nuestro servicio por IAM, se observó la presencia de trombo, 27 de los cuales pertenecían al brazo de SLF y 40 al de BAS, con una tendencia a ser mayor en el brazo de BAS, pero sin lograr obtener significancia estadística (p=0.08). El uso de inhibidor de la glucoproteína IIb/IIIa fue a discreción del operador; a este respecto, el total de lesiones en que se utilizó fue de 52, 18 del brazo SLF y 34 del de BAS (p=0.02).
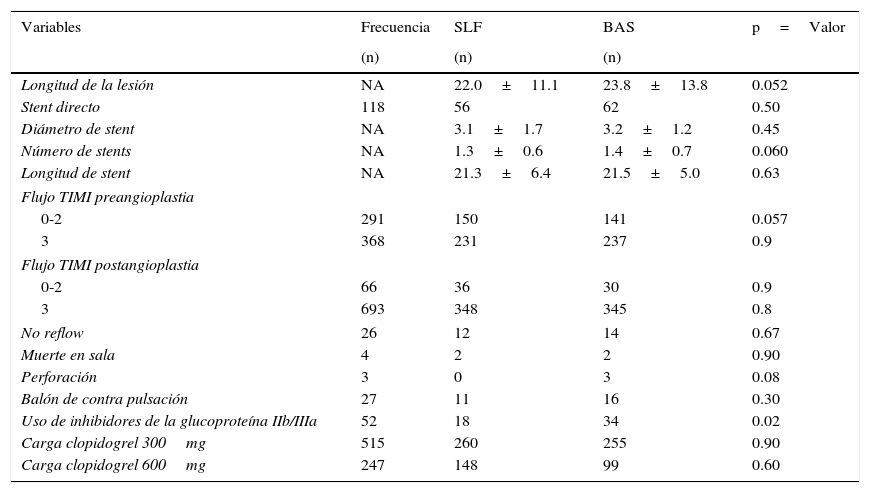
Variables de angioplastiaLa longitud de la lesión en promedio fue mayor en el brazo BAS, 23.8mm (±13.8) vs. 22.0mm (±11) en el de SLF, con una tendencia a ser significativa (p=0.052). De manera muy similar sucedió con el número de stents, donde el promedio para el brazo de BAS fue de 1.4 (±0.7) vs. 1.3 (±0.6) en el de SLF, con una p=0.060.
Las variables de diámetro del stent, longitud del stent y colocación del stent directo fueron muy similares, sin significancia estadística (tabla 4).
Resultados angioplastia
| Variables | Frecuencia | SLF | BAS | p=Valor |
|---|---|---|---|---|
| (n) | (n) | (n) | ||
| Longitud de la lesión | NA | 22.0±11.1 | 23.8±13.8 | 0.052 |
| Stent directo | 118 | 56 | 62 | 0.50 |
| Diámetro de stent | NA | 3.1±1.7 | 3.2±1.2 | 0.45 |
| Número de stents | NA | 1.3±0.6 | 1.4±0.7 | 0.060 |
| Longitud de stent | NA | 21.3±6.4 | 21.5±5.0 | 0.63 |
| Flujo TIMI preangioplastia | ||||
| 0-2 | 291 | 150 | 141 | 0.057 |
| 3 | 368 | 231 | 237 | 0.9 |
| Flujo TIMI postangioplastia | ||||
| 0-2 | 66 | 36 | 30 | 0.9 |
| 3 | 693 | 348 | 345 | 0.8 |
| No reflow | 26 | 12 | 14 | 0.67 |
| Muerte en sala | 4 | 2 | 2 | 0.90 |
| Perforación | 3 | 0 | 3 | 0.08 |
| Balón de contra pulsación | 27 | 11 | 16 | 0.30 |
| Uso de inhibidores de la glucoproteína IIb/IIIa | 52 | 18 | 34 | 0.02 |
| Carga clopidogrel 300mg | 515 | 260 | 255 | 0.90 |
| Carga clopidogrel 600mg | 247 | 148 | 99 | 0.60 |
BAS: stent bioactivo; SLF: stent liberador de fármaco.
Se consiguió el éxito angiográfico (catalogado como una estenosis residual inferior al 20% postangioplastia) en la mayoría de los pacientes, alcanzando el 95% en el brazo de SLF vs. 94% en el de BAS (p=NS). Se consiguió el flujo TIMI 3 post-ICP en el 90% en el brazo de SLF y en el 92% en el de BAS, también sin significancia estadística.
La dosis de carga de clopidogrel fue administrada en el 100% de los pacientes. La dosis más utilizada fue de 300mg en el 67.8% del total de pacientes, sin diferencias significativas en ambos brazos.
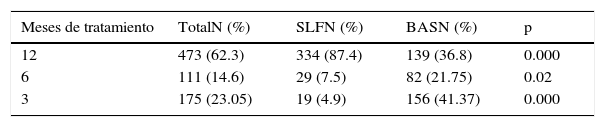
En el seguimiento con terapia dual antiplaquetaria (TDAP) se llevaron periodos más cortos de tratamiento en el grupo BAS vs. SLF a 3 meses 41.37% vs. 4.9% p=0.000 y a 12 meses solo 36.8% del brazo BAS estaba con TDAP comparado con el 87.4% del brazo SLF p=0.000 (tabla 5).
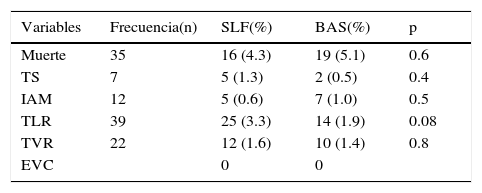
Se analizó de forma sistemática cada brazo y dentro del rubro de muerte cardiovascular se encontró que 35 pacientes fallecieron durante el seguimiento, 16 (4.3%) de los cuales pertenecían al brazo de SLF y 19 al de BAS (5.1%) (p=NS). Dos pacientes en cada brazo fallecieron en la sala por complicaciones del IAM.
La presencia de trombosis intra-stent fue más frecuente en el brazo de SLF, con un 1.3% del total de pacientes vs. 0.5% en el brazo de BAS, sin alcanzar significancia estadística; la mayoría de los casos eran pacientes que siguieron la terapia dual a los 12 meses. Por otro lado, 5 pacientes del brazo SLF (0.6%) y 7 pacientes del de BAS (1.0%) presentaron IAM, diferencia que no alcanzó significancia estadística.
Al analizar la presencia de revascularización de la lesión tratada encontramos que hubo una tendencia a ser mayor en el brazo de SLF, sin que la diferencia alcanzara significancia estadística, con 25 (3.3%) vs. 14 pacientes en el brazo de BAS (1.9%), y al hacer la asociación encontramos que no hubo relación con las variables de diámetro del stent, longitud del stent y longitud de la lesión, pues estas variables tendieron a ser mayores en el brazo de BAS.
Finalmente, la TVR se presentó en 22 casos, con cifras muy similares en los 2 brazos: 12 pacientes (1.6%) en el de SLF y 10 (1.4%) en el de BAS, sin diferencias estadísticamente significativas.
El uso de la terapia dual antiplaquetaria fue de una duración menor en el brazo de BAS 6.9±4.1 vs. SLF 11.1±2.5 meses (p=0001), y durante el seguimiento no parece haber influido en los resultados.
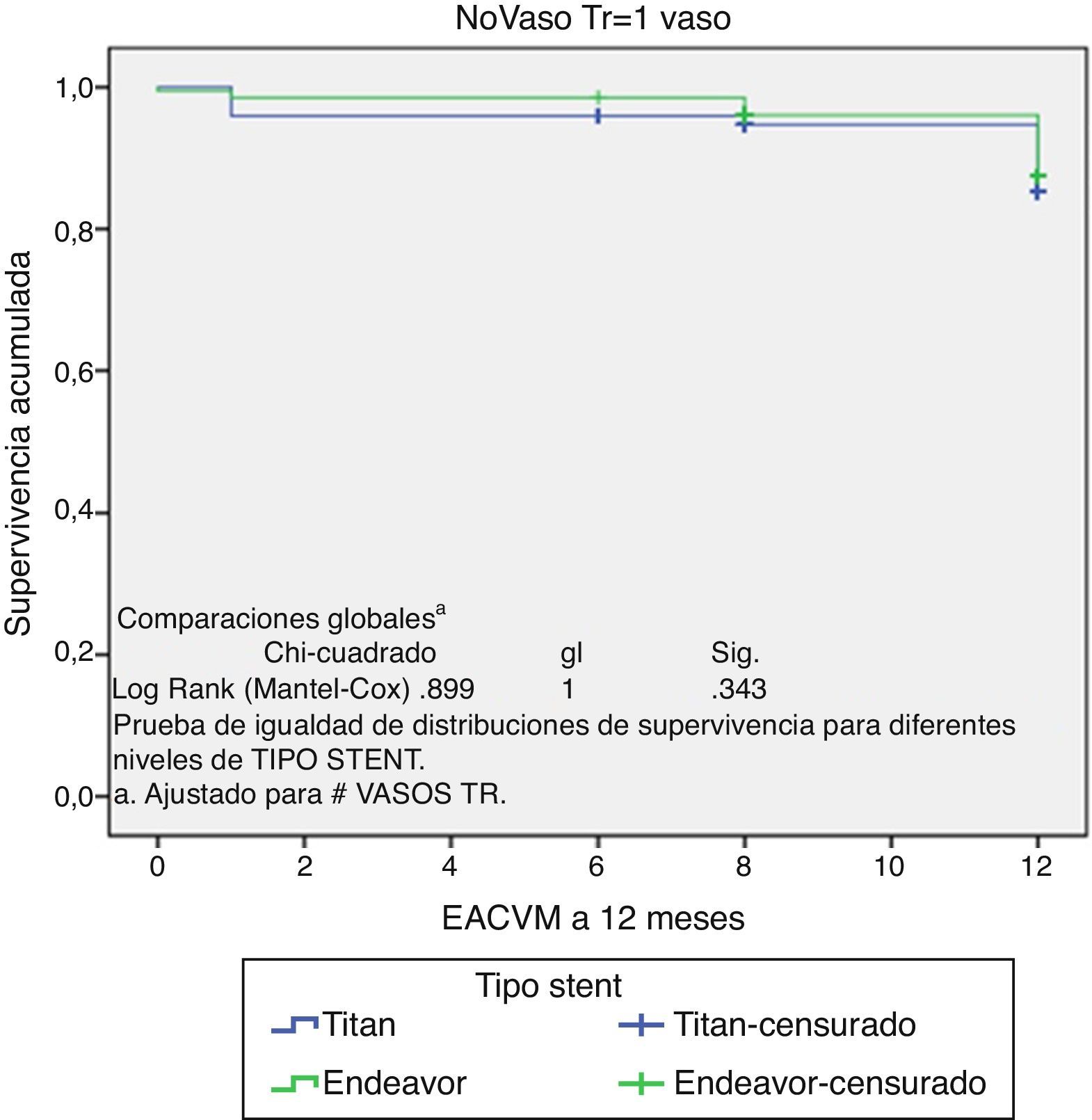
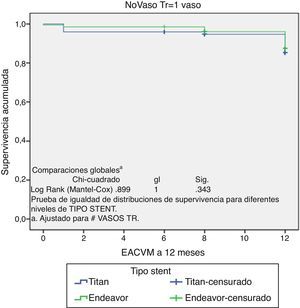
Es importante mencionar que durante el seguimiento no se encontró ningún paciente con enfermedad cerebrovascular (tabla 6). En la figura 1 se muestra la libertad de eventos adversos cardiovasculares mayores (EACVM) a 12 meses, mediante la curva de Kaplan-Meier.
Resultados clínicos a 12 meses
| Variables | Frecuencia(n) | SLF(%) | BAS(%) | p |
|---|---|---|---|---|
| Muerte | 35 | 16 (4.3) | 19 (5.1) | 0.6 |
| TS | 7 | 5 (1.3) | 2 (0.5) | 0.4 |
| IAM | 12 | 5 (0.6) | 7 (1.0) | 0.5 |
| TLR | 39 | 25 (3.3) | 14 (1.9) | 0.08 |
| TVR | 22 | 12 (1.6) | 10 (1.4) | 0.8 |
| EVC | 0 | 0 |
EVC: evento vascular cerebral; IAM: infarto agudo de miocardio; TLR:r evascularización de la lesión tratada; TS: trombosis del stent; TVR: revascularización del vaso tratado.
En la actualidad el uso de SLF es el método empleado para la reducción de la restenosis intra-stent en estudios clínicos aleatorizados que incluyen una población seleccionada6,9,10. Varios estudios clínicos aleatorizados han comparado el uso de stent no medicado con SLF, aprobado por la FDA, y han demostrado una reducción significativa de la reestenosis que se refleja en una RLT y una RVT más bajas11.
Sin embargo, después de años de experiencia en la vida real con el uso de SLF, la mejoría en la tasa de reestenosis no se ha visto reflejada en una reducción de los puntos finales duros, como muerte e IAM; en 2011 Galván et al.12 reportaron su experiencia con el uso de SLF vs. SNM y encontraron resultados interesantes, como una menor revascularización de la lesión tratada y una revascularización del vaso tratado en el SLF, pero sin diferencias en la tasa de muerte o infarto, lo que corrobora lo anteriormente mencionado a este respecto.
Según los resultados obtenidos se han realizado mejorías a los diseños de stent, y han llegado al mercado los stents metálicos cubiertos con titanio-óxido nítrico (TITAN2), con una mejor biocompatibilidad comparado con el acero inoxidable y otros materiales de revestimiento13, los cuales han demostrado una mayor endotelización. Esto sugiere que el uso de estos stents quizá se acompañe de una endotelización completa en un menor tiempo14.
La seguridad de estos dispositivos ha sido validada en varios estudios clínicos en población no selecta y en escenarios más complejos, como en pacientes diabéticos e IAM15–17. En 2011, Sánchez et al.18 compararon el uso de BAS vs. stent liberador de paclitaxel y sirolimus y hallaron que la tasa de EACVM (infarto, muerte o necesidad de nueva revascularización) a 30 días fue muy similar en ambos brazos, la trombosis intra-stent fue del 0% en el brazo de BAS vs. 1.3% en el de SLF, sin significancia estadística; asimismo, la reestenosis binaria fue del 7% vs. 6.6%, respectivamente, también sin significancia estadística.
En nuestro estudio se compararon los resultados a un año y se demostró que el BAS no es inferior al SLF con zotarolimus. La tasa de reestenosis intra-stent fue menor; sin embargo, no se alcanzó significancia estadística. Al analizar las variables que podrían influir a este respecto encontramos que las lesiones más complejas fueron muy similares en ambos brazos, las lesiones tendieron a ser de mayor longitud en el brazo de BAS y se encontró un mayor número de stents, y aun ante este hecho encontramos que la tendencia fue favorable al BAS, de nuevo sin alcanzar la significancia estadística. Es importante mencionar que en nuestro estudio no se incluyó el seguimiento angiográfico de rutina, apoyándonos en la prueba no invasiva, para isquemia para justificar con esto el envío a la realización de angiografía y tratamiento resolutivo.
Por otro lado, al evaluar la presencia de trombosis encontramos que la tasa también fue muy baja en ambos brazos; cifras similares a las encontradas en el estudio de Sánchez et al.18 en 2011, y en el registro PORI, donde a 5 años no se documentó ningún evento; no sucedió así en cuanto al stent liberador de paclitaxel donde se presentaron 10 casos, con significancia estadística2, y en el estudio TINOX, tanto a 6 meses como a 5 años, donde tampoco se documentó ningún caso8,19. Esto corrobora la seguridad de poder suspender la terapia dual antiplaquetaria incluso en un tiempo menor.
La presencia de eventos cardiovasculares adversos, como muerte o infarto del miocardio, prácticamente fue mínima en ambos brazos, sin diferencia estadísticamente significativa, cifras también muy parecidas a las de los estudios previos, como el realizado por Mendes et al.20 y el registro EXTREME, en los que la tasa de estos eventos fue muy baja, así como la presencia de trombosis y reestenosis intra-stent3.
La seguridad del stent bioactivoEn la actualidad, el uso del BAS en el tratamiento de las lesiones coronarias es una forma eficaz para reducir la tasa de EACVM, con una tasa baja de TS, utilizando un esquema corto de terapia de antiagregación plaquetaria (TDAP) como los demuestran 3 estudios prospectivos controlados en grupos de pacientes no seleccionados y 2 registros. Los estudios son el TiNOX trial19, que utilizó la TDAP por 1 mes como mínimo; el TITAX AMI trial22, que comparó el resultado de una TDAP a 7.6 meses con BAS vs. 10.1 meses con PES (p<0.001), con una tasa de trombosis con BAS vs. stent con paclitaxel (PES) de 0.5 vs. 6.6%, respectivamente (p<0.001), y el BASE ACS21, que comparó el BAS vs. EES (everolimus stent) en SCA (1:1) a 8.7 vs. 10.8 meses con clopidogrel, con un seguimiento de 18 meses, con una trombosis del stent (TS) definida de 0.7 vs. 2.4%, respectivamente (p<0.047). Los registros son el Registro PORI15, que evaluó específicamente la eficacia y la seguridad de BAS con una TDAP durante 3 meses, sin ningún caso de trombosis durante el seguimiento a 5 años, y el Registro EXTREME, que fue realizado en vasos pequeños con una TDAP de como mínimo 1 mes con un 0% de TS a 12 meses3. Ha habido algunas preocupaciones de que algunos pacientes podrían desarrollar TS, una complicación potencialmente mortal, inusualmente tardía después de la implantación de SLF. Se ha sugerido que la TS ha surgido como una entidad clínica asociada con SLF secundario a una mayor demora en la cicatrización arterial, según lo manifestado por la mala endotelización y deposición de fibrina. La trombosis tardía de stent es potencialmente debido a un desajuste entre el stent y el vaso y puede estar relacionado con una mala aposición del stent y una interrupción prematura del tratamiento antiplaquetario, lo que se ha reconocido recientemente como el factor predisponente más importante23. En el presente estudio, solo 2 pacientes (0.5%) del brazo BAS presentaron episodio de TS a los 30 días después del procedimiento no asociado al uso de clopidogrel, y durante el seguimiento no se presentaron casos adicionales de trombosis.
Tres pacientes en el brazo BAS (0.79%) presentaron perforación coronaria tipo II, que se trataron de forma conservadora (inflado prolongado a baja presión del balón en el sitio de perforación) con buenos resultados24.
En el seguimiento con la terapia dual antiplaquetaria no hubo ninguna diferencia en los 2 brazos en cuanto a la tasa de eventos adversos.
En cuanto a la TDAP, hay cuestiones fundamentales que rodean su uso óptimo en pacientes en quienes se realiza un procedimiento de intervención coronaria percutánea (ICP), cuestiones fundamentales tales como la sincronización, la dosis y la duración de esta terapia.
Las guías de práctica clínica25 apoyan el uso de clopidogrel a una dosis de carga de 600mg, y en cuanto a la duración del tratamiento en el contexto de la ICP, el clopidogrel a una dosis de 75mg diarios se debe dar por lo menos durante los siguientes 12 meses después de la implantación de un SLF; con el uso de BMS, el tratamiento se debe prolongar un mínimo de 1 mes y lo ideal es hasta 12 meses. Las directrices recomiendan la continuidad del tratamiento más allá de los 12 meses en pacientes tratados con SLF en función del riesgo del paciente (lesión bifurcada, tronco de la coronaria izquierda, stent múltiple, lesiones ostiales, etc.), y se debe considerar de forma individualizada; por ejemplo, pueden considerarse duraciones más cortas si los pacientes tienen un mayor riesgo de sangrado.
Limitaciones del estudioLas principales limitaciones de nuestro estudio son: el número de pacientes de nuestro estudio es relativamente pequeño, especialmente para eventos clínicos como TS, etc., pero, a pesar de ello, refleja claramente los principales objetivos. Fue un estudio no aleatorizado y que durante el seguimiento no incluyó el seguimiento angiográfico de rutina apoyándose en la prueba no invasiva para isquemia y, por lo tanto, es probable que se subestimase la incidencia de reestenosis.
ConclusionesA pesar de ciertas limitaciones en nuestro estudio concluimos que la implantación de BAS es segura comparada con la de SLF con zotarolimus (Resolut). Después de un año de seguimiento no hubo diferencia estadísticamente significativa en eventos clínicos mayores, con una tendencia favorable al BAS vs. SLF con respecto a la revascularización de la lesión tratada (1.9% vs. 3.3%, respectivamente), sin alcanzar significancia estadística.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.