El glucocáliz endotelial es una capa constituida por glucosaminoglicanos, proteoglicanos y glucoproteínas que cubre al endotelio vascular en su cara luminal. Tiene múltiples funciones: transducción de las fuerzas mecánicas de tensión, regulación de la permeabilidad vascular de líquidos y moléculas y de la activación de la coagulación y de la fibrinólisis, protege de la adhesión de leucocitos y plaquetas al endotelio. En general, el glucocáliz protege a la pared vascular de ataques patogénicos. La lesión del glucocáliz puede ocurrir por fuerzas de tensión anormales, especies reactivas de oxígeno, hipernatremia, hiperglucemia, hipercolesterolemia y moléculas inflamatorias, lo que causa disfunción endotelial, incremento en la permeabilidad, filtración de lipoproteínas al subendotelio, activación de la coagulación e incremento de la adherencia de leucocitos y plaquetas al endotelio vascular. La participación del deterioro del glucocáliz endotelial puede ser importante en la fisiopatología de diversas enfermedades vasculares.
Endothelial glycocalyx is a layer composed by glycosaminoglycans, proteoglycans and glycoproteins attached to the vascular endothelial luminal surface. It has several physiological roles: shear stress mechanotransduction to the endothelial cells, regulation of fluids and macromolecules vascular permeability, of coagulation cascade activation and fibrinolysis, and protects the endothelium from platelets and leukocytes adhesion. In general, glycocalyx protects vascular wall against pathogenic insults. The glycocalyx may be damaged by abnormal shear stress, reactive oxygen species, hypernatremia, hyperglycemia, hypercholesterolemia and inflammatory molecules, resulting in endothelial dysfunction, enhanced vascular permeability, lipoproteins leakage to subendothelial space, activation of plasma coagulation, and increased adherence of platelets and leukocytes to the endothelial cells. Shredding of glycocalyx appears as an important initial step in the pathophysiology of vascular diseases.
Desde hace algunos siglos, con el microscopio de luz y posteriormente con el electrónico se ha observado que las células están limitadas externamente por la membrana celular. En las últimas décadas, en algunas células animales y en bacterias se ha observado que este límite externo está cubierto por una tenue capa formada principalmente por mucopolisacáridos, y que se ha denominado glucocáliz o glucocálix.
La razón por la que no se había observado antes es que tanto la preparación para la microscopia de luz, como la fijación habitual del tejido para su observación con microscopio electrónico, a base de glutaraldehido y tetraóxido de osmio permiten preservar las proteínas y los lípidos, mientras que los hidratos de carbono desaparecen. En cambio, con otros métodos de fijación, por ejemplo con rojo de rutenio que estabiliza los grupos aniónicos, también se preservan los hidratos de carbono y se pone de manifiesto el glucocáliz1.
Se ha demostrado la existencia del glucocáliz en bacterias1, en plaquetas2,3 y en diversas células, entre otras en la mucosa intestinal4, en células linfoblastoides5, leucocitos6 y endotelio vascular.
El endotelio vascularEl endotelio vascular es una capa unicelular que recubre en su cara luminal a todas las venas, arterias y capilares, donde por si solo forma su pared. Actualmente sabemos que el endotelio, además de ser una barrera física entre la sangre y la capa media de los vasos o los tejidos en el caso de los capilares, tiene un papel fundamental en el mantenimiento de la homeostasis vascular. Las células endoteliales producen óxido nítrico (NO) el cual mantiene el tono basal de vasodilatación de arterias y venas, y la prostaciclina (PGI2) que también es vasodilatadora; el equilibrio se mantiene con la producción de sustancias vasoconstrictoras como la endotelina, el tromboxano A2 y el anión superóxido. Estas células producen sustancias antitrombóticas que se encuentran en la superficie (en el glucocáliz) como el heparán sulfato y el proteoglicano trombomodulina, que regulan la fibrinólisis ya que producen activador tisular del plasminógeno y su inhibidor (PAI-1), regulan la proliferación celular a través de la producción de sustancias estimulantes del crecimiento (factor de crecimiento derivado de plaquetas, factor de crecimiento básico derivado de fibroblastos y endotelina-1) y de inhibidores del crecimiento (factor de crecimiento transformador ß, NO y PGI2)7,8. El NO es un radical libre oxidante (especie reactiva de oxígeno [ROS]) pero también regula a la alza o a la baja la producción de ROS mitocondrial en las células endoteliales9.
Aunque existen diversos métodos para valorar la función endotelial, la mayoría se basan en la medición de la respuesta vasodilatadora mediada por endotelio (básicamente mediada por NO), ya sea por la aplicación de acetilcolina o más comúnmente por el estímulo en la secreción de NO debido a un incremento de las fuerzas de tensión. Esta es la prueba de vasodilatación mediada por flujo de la arteria braquial, en la que se aplica una presión ligeramente superior a la sistólica con el manguillo de esfigmomanómetro y se mide la dilatación arterial que ocurre al liberar la presión del manguillo. Esta prueba es reproducible y se ha demostrado que un resultado anormal se relaciona con incremento en el riesgo de eventos cardiovasculares agudos y se asocia claramente con la presencia de los distintos factores de riesgo cardiovascular10–12.
La pérdida de las propiedades fisiológicas del endotelio o disfunción endotelial, como la producida por aumento o distorsión de la presión tangencial de la sangre sobre las paredes vasculares (fuerzas de tensión o shear stress), reduce la capacidad vasodilatadora dependiente del endotelio y también afecta otras funciones endoteliales como las que regulan la coagulación y la capacidad antioxidante13. Se observa disfunción endotelial sistémica en: tabaquismo, dislipidemia (elevación de colesterol-LDL, lipoproteínas de baja densidad oxidadas [LDL0x]), hiperglucemia, prediabetes y síndrome metabólico, diabetes mellitus, hipertensión arterial, hiperhomocisteinemia, así como en sujetos con enfermedad coronaria, enfermedad vascular cerebral, insuficiencia cardíaca y disfunción eréctil14–16. También se ha demostrado disfunción endotelial en enfermedades inflamatorias sistémicas como el lupus eritematoso y la enfermedad indiferenciada del tejido conectivo17.
La relación de la disfunción endotelial con la enfermedad coronaria ha sido ampliamente estudiada. Se ha demostrado que el grado de disfunción guarda una relación significativa con la extensión del daño aterosclerótico, tanto con el número de arterias coronarias afectadas como con el grado de obstrucción arterial18. El incremento del estrés oxidativo parece ser importante en la génesis de la disfunción endotelial que ocurre en la diabetes mellitus19 y en las enfermedades cardiovasculares20. La opinión generalizada es que los distintos factores de riesgo cardiovascular causan disfunción endotelial y que esta precede a la aterosclerosis y es importante en su patogénesis21.
La disfunción endotelial también aparece como un mecanismo potencial en las complicaciones microvasculares de la diabetes mellitus, especialmente en la nefropatía diabética19,22.
Además, el endotelio vascular desempeña un papel importante en la enfermedad venosa crónica. Por ejemplo, se ha demostrado en individuos normales y en pacientes con enfermedad venosa crónica que el incremento en la presión venosa causa un aumento significativo de diversas moléculas de origen endotelial mediadoras de la inflamación como: molécula de adhesión leucocito-endotelio-1, molécula de adhesión intercelular-1 y molécula de adhesión de células vasculares-1 entre otras. La magnitud del incremento en la concentración de estas moléculas, y del factor de von Willebrand, es mayor en pacientes con várices y alteraciones cutáneas que en aquellos con un padecimiento más leve (várices sin alteraciones cutáneas)23. Diversas evidencias llevan a la hipótesis de que las células endoteliales por medio de las moléculas de adhesión modulan la respuesta inflamatoria por medio del reclutamiento de leucocitos24.
Muchas de las alteraciones endoteliales inician con cambios en el glucocáliz.
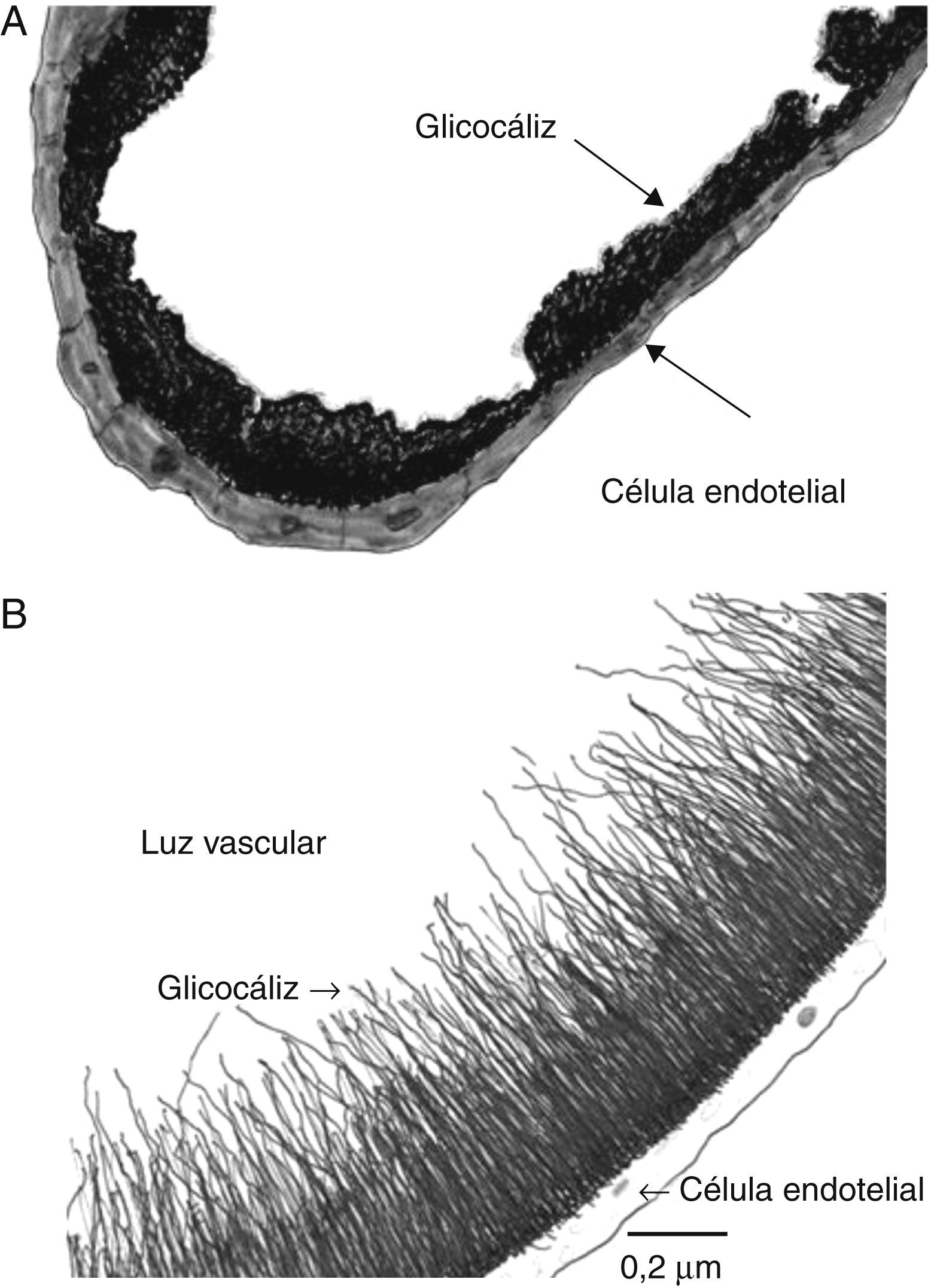
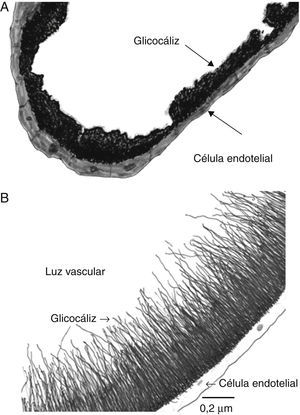
El glucocáliz endotelialEstructuraEl glucocáliz endotelial es una capa que recubre la cara luminal del endotelio de arterias, venas y capilares. Al microscopio electrónico puede observarse como un material amorfo o grumoso si se usa rojo de rutenio, o formando una malla de finos filamentos si se usa azul alciano (fig. 1A y B). Su espesor es variable dependiendo del método y del vaso estudiado, mide de 20 a 500nm, o aun mayor25–28. En las células endoteliales en cultivo el glucocáliz aparece desde la primera semana y mide 0.3-1μm29.
El espesor del glucocáliz también puede estimarse in vivo. En virtud de que in vivo el glucocáliz no se puede ver, la medición es indirecta y se basa en el hecho de que esta capa limita la proximidad de los eritrocitos y de macromoléculas a las células endoteliales. La observación del espacio que está entre el endotelio y la columna de eritrocitos equivale a la amplitud del glucocáliz. Con este principio, en humanos se ha medido en los vasos sublinguales y retinianos30. Con el mismo fundamento, se ha estimado in vivo el volumen sistémico del glucocáliz, substrayendo del volumen intravascular total calculado con infusión de dextrano 40 que penetra el glucocáliz, el volumen circulante calculado con eritrocitos marcados o con infusión de dextrano 70 que no penetra el glucocáliz30.
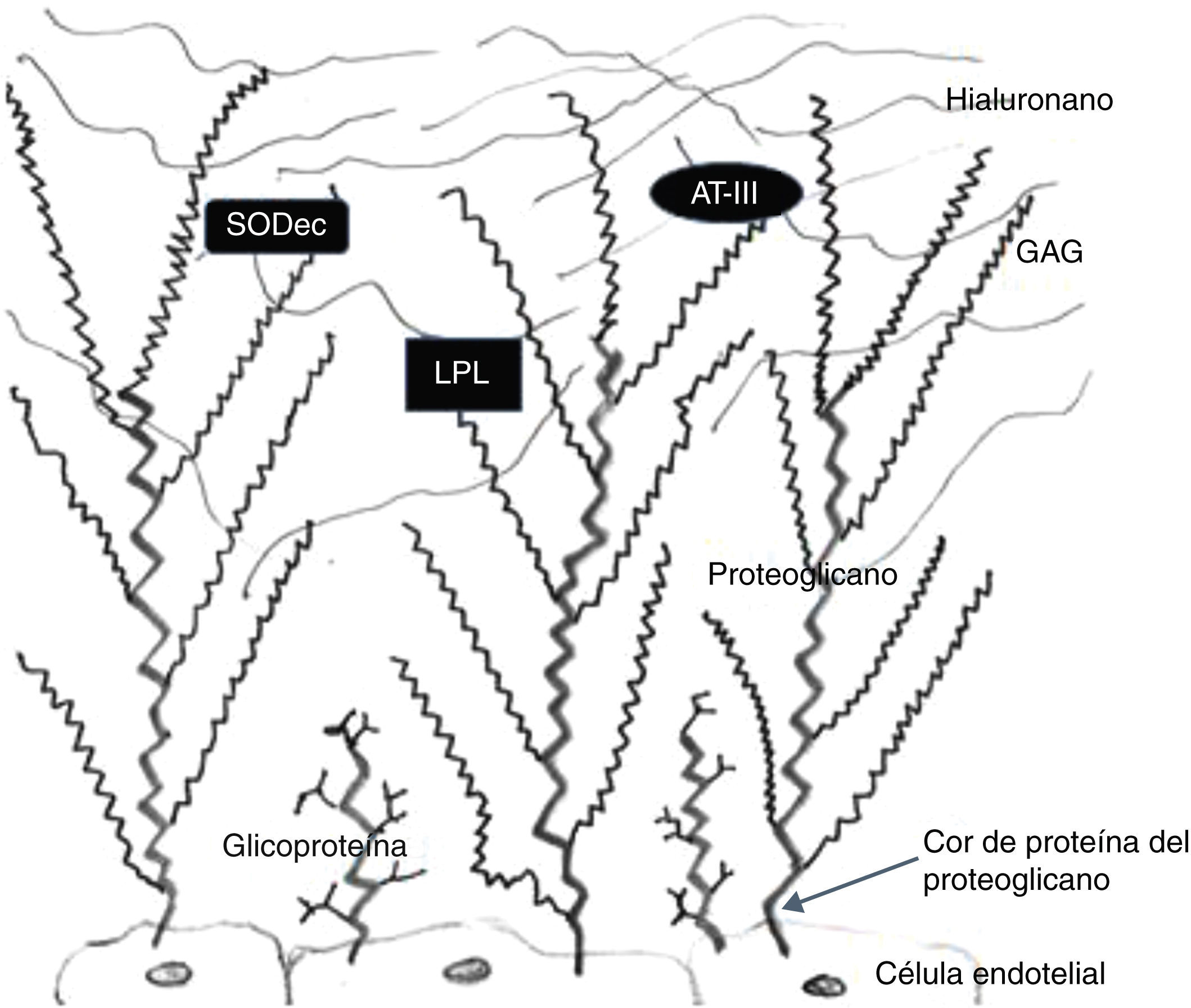
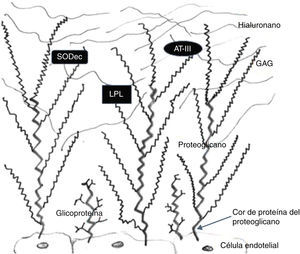
El glucocáliz está formado por 3 tipos de componentes: proteoglicanos, glucosaminoglicanos (GAG) y glucoproteínas (fig. 2).
Esquema de la composición del glucocáliz. Del interior de las células endoteliales sale el cor proteínico de los proteoglicanos, a manera de columna vertebral a la que están unidos glucosaminoglicanos (GAG) sulfatados; el hialuronano es un GAG no sulfatado que no forma parte de proteoglicanos; nótese que las glucoproteínas son mucho más cortas que los proteoglicanos y que poseen azúcares ramificados (los GAG no son ramificados). Existen moléculas adheridas a los GAG como la superóxido-dismutasa extracelular (SODec), la lipoproteinlipasa (LPL) y la antitrombina iii (AT-III). Modificada de Reitsma et al.27.
Los proteoglicanos están formados por una cadena proteínica a la que están unidas múltiples moléculas de GAG. Los proteoglicanos más abundantes en el glucocáliz son sindecanos-1,-2 y -4, glipicano-1 y perlecano, se producen en las células endoteliales y uno de sus extremos se encuentra en el citoplasma de estas células, para anclar y sostener el glucocáliz. Los GAG que forman parte de los proteoglicanos son principalmente heparán sulfato, condroitín sulfato, dermatán sulfato y escasa proporción de queratán sulfato. El hialuronano (ácido hialurónico) es un GAG no sulfatado que no forma parte de proteoglicanos y que se encuentra de manera abundante en la porción más superficial del glucocáliz. Los GAG se producen en las células endoteliales y tal vez también provengan del plasma circulante. Las glucoproteínas del glucocáliz están formadas por una proteína corta y cadenas laterales de azúcares ramificados. También se anclan en el citoplasma de las células endoteliales que las producen. Estas glucoproteínas pueden ser: a) moléculas de adhesión endotelial que reclutan células circulantes y son importantes en la señalización celular, como la familia de las selectinas (selectina-E, selectina-P), integrinas diversas, moléculas de adhesión intercelular-1 y -2, moléculas de adhesión de célula vascular-1, moléculas de adhesión de célula endotelial/plaquetas-1; b) complejos funcionales que participan en la regulación de la coagulación, fibrinólisis y hemostasia, como el complejo de glucoproteína ib-ix-v que se une al factor de von Willebrand27.
Además, en la porción más luminal el glucocáliz está incrustado en proteínas, como la albúmina, y probablemente GAG y proteoglicanos provenientes del plasma que en conjunto con el glucocáliz forman la «capa de superficie endotelial». Múltiples evidencias sugieren que esta capa es una estructura dinámica cuyas propiedades dependen no solamente de los constituyentes del glucocáliz, sino también de sus interacciones con el microambiente local31–33.
Funciones y sus alteracionesSe han identificado varias funciones del glucocáliz endotelial (tabla 1).
Funciones del glucocáliz endotelial
| Protector, sensor y transductor de las fuerzas mecánicas del torrente sanguíneoRegulación de la permeabilidad de agua y solutosRegulación de la filtración glomerularRegulación de la permeabilidad de macromoléculas (proteínas)Regulación del hematocrito capilar y del flujo sanguíneo capilarBarrera a la filtración de lipoproteínasPrevención de adhesión de plaquetas al endotelioPrevención de adhesión de leucocitos al endotelioRegulación local de la coagulación (prevención de trombosis, activación de fibrinólisis) |
Múltiples evidencias señalan que el glucocáliz es un mediador entre las fuerzas mecánicas tangenciales del torrente sanguíneo (fuerzas de tensión) y las células endoteliales. La aplicación de fuerza de tensión, estática o pulsátil, a las células endoteliales en cultivo produce un aumento en la concentración de NO que se previene con el tratamiento previo con enzimas que degradan el glucocáliz (heparinasa, hialuronidasa)34,35. Diversos modelos teóricos predicen que cuando la capa de superficie endotelial está intacta, la fuerza de tensión de los fluidos que actúan en la superficie se disipa en esta capa, de modo que la membrana plasmática de las células endoteliales no la recibe en forma directa. La fuerza de tensión probablemente cause una torsión o desplazamiento del cor proteínico relativamente rígido de los proteoglicanos que se transmite al citoesqueleto cortical de actina de las células endoteliales, lo que iniciaría la señalización para la síntesis de NO y el tráfico de moléculas. Parte de estos cambios intracelulares se han demostrado con microscopia confocal32,36.
La fuerza de tensión normal es útil para mantener sano el glucocáliz. En cultivo de células endoteliales se ha observado que la exposición a una fuerza de tensión normal incrementa el contenido de hialuronano y GAG sulfatados del glucocáliz, orienta la alineación de las células en dirección al flujo y suprime la proliferación37–39.
En la regulación de la permeabilidadCon la aplicación de enzimas que degradan el glucocáliz y con dextranos de distintos pesos moleculares se ha observado que esta estructura es mediadora de los cambios de permeabilidad del agua inducidos por fuerza de tensión, protege del edema (fig. 3) y regula la filtración de proteínas40–43. La carga electronegativa de los GAG influye en estas propiedades44.
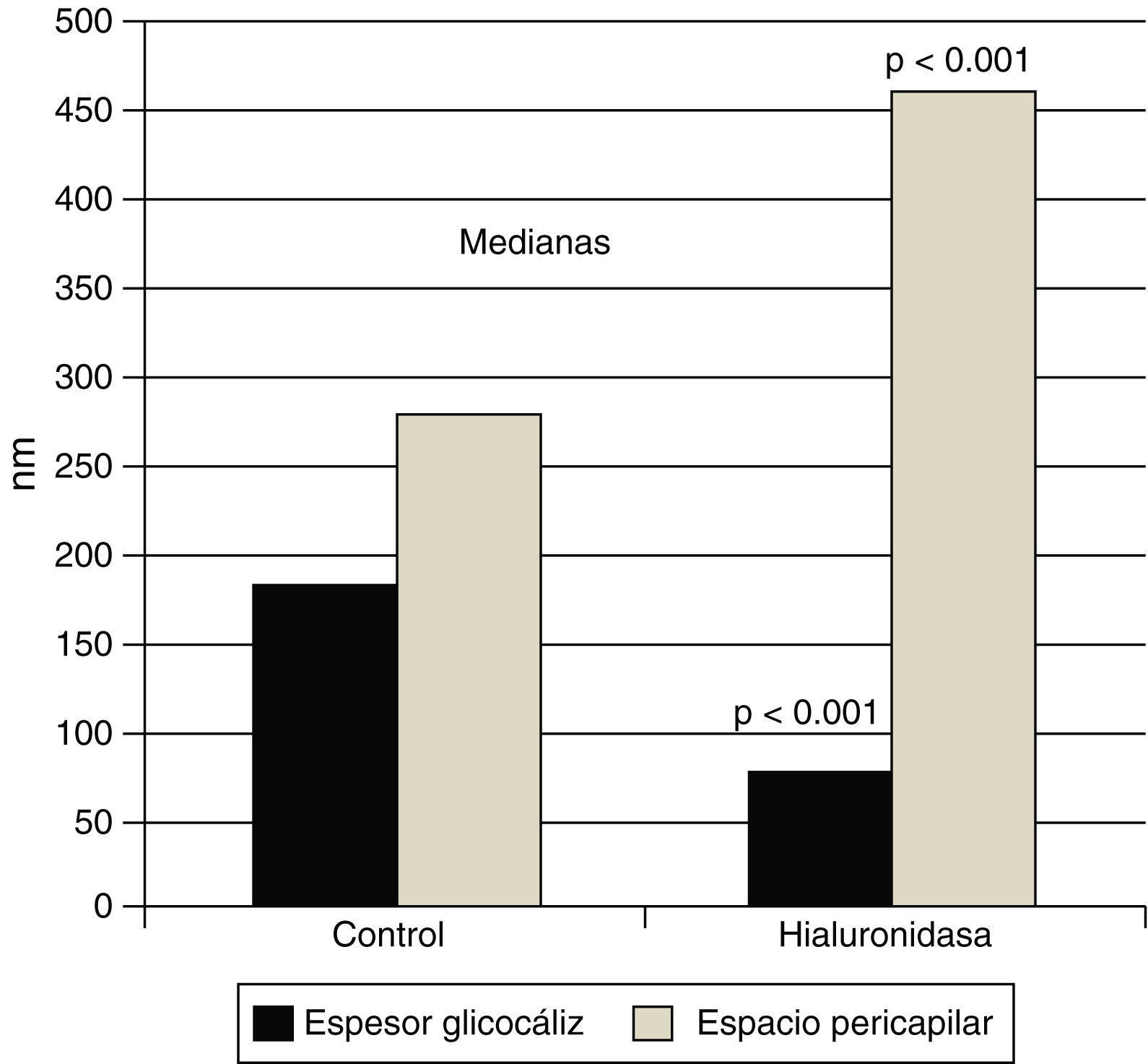
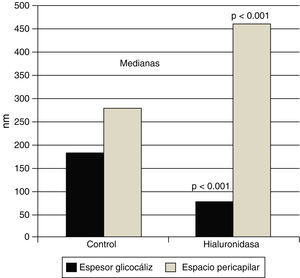
El glucocáliz endotelial protege del edema miocárdico. La infusión de hialuronidasa reduce significativamente el grosor del glucocáliz endotelial de los capilares miocárdicos de la rata, mientras que aumenta el grosor del espacio pericapilar por el edema. Se muestran los valores de las medianas (p<0.001 vs. el control sin tratamiento). Con datos de van den Bergh et al.26.
Recientemente se demostró que la sobrecarga de sodio reduce el grosor del glucocáliz, permitiendo que este penetre a las células endoteliales, lo que resultaría en incremento de la rigidez vascular y en la disminución de la liberación de NO45. Se ha postulado que, a través de este mecanismo, el glucocáliz dañado y la sobrecarga frecuente de sal podrían participar en la génesis de la hipertensión arterial46.
En los capilares fenestrados del intestino delgado, estómago y riñones de la rata no solo se demostró la presencia del glucocáliz, sino también la existencia en los poros de tapones filamentosos, que fueron denominados fascinae fenestrae47. Los mismos autores sugirieron que estos tapones en las fenestras son el sitio primario de la barrera de filtración glomerular48. El glucocáliz es la primera de las 4 capas (glucocáliz, endotelio fenestrado, membrana basal glomerular, membrana hendida de podocitos) que intervienen en la selectividad de la filtración glomerular49.
En la regulación del flujo sanguíneo capilarEl glucocáliz interviene en la regulación de la concentración de los eritrocitos en la red capilar, como se demostró in vivo con la infusión de heparinasa que fue seguida por elevación sostenida del hematocrito capilar y una disociación de la típica relación entre la respuesta vasomotora y la distribución de eritrocitos en los capilares50. Experimentos en ratones mostraron que la hiperglucemia aguda, además de incrementar la permeabilidad del glucocáliz endotelial, también causa una rápida disminución de la densidad de capilares con flujo de glóbulos rojos51.
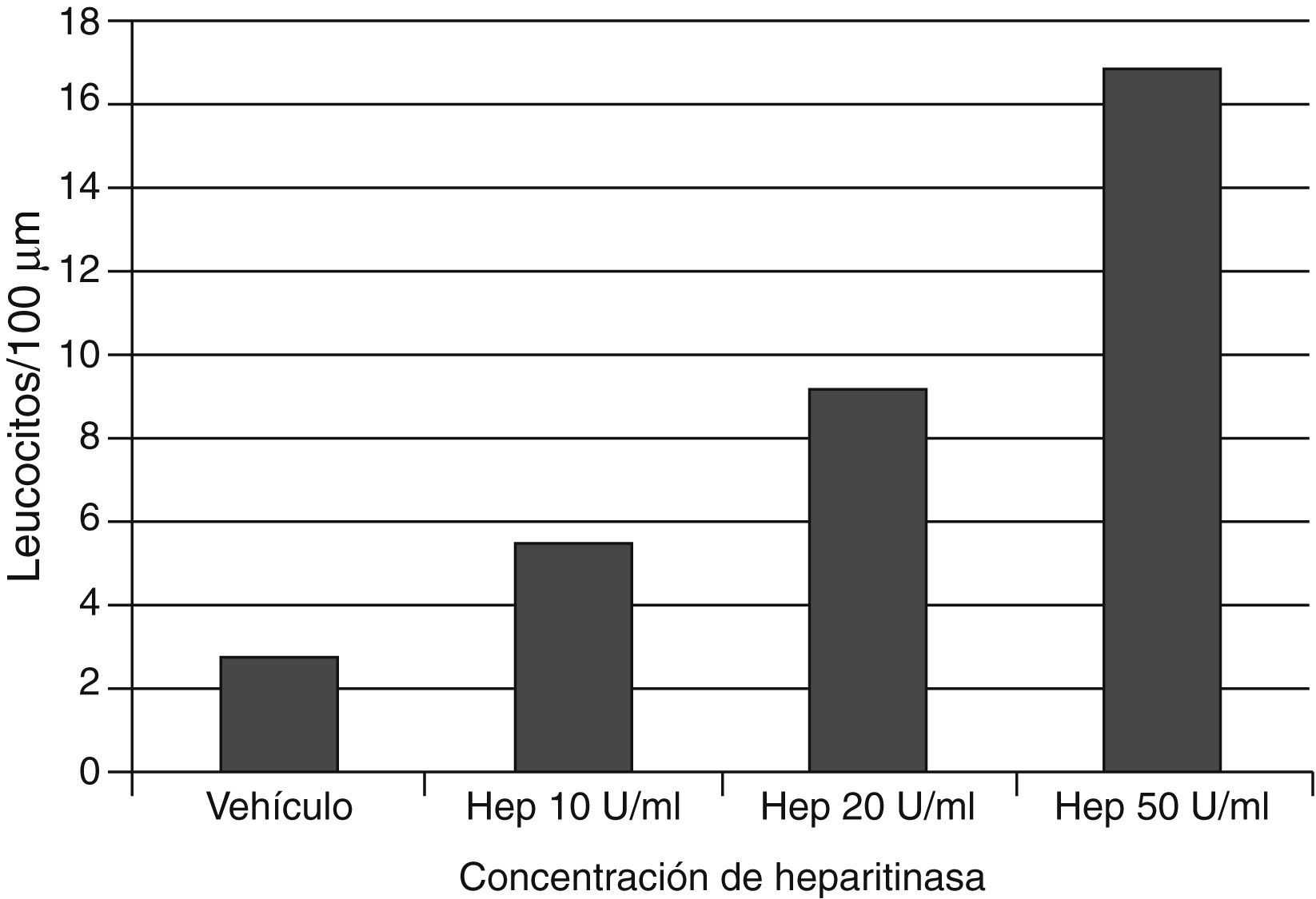
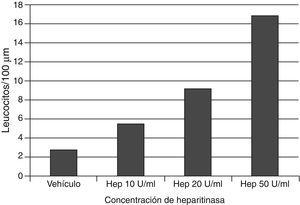
En la adhesión de los leucocitos e inflamaciónEl glucocáliz también sirve para prevenir la adhesión de leucocitos al endotelio. La degradación del glucocáliz con heparitinasa incrementa la adhesión leucocitaria, como dependiente de dosis (fig. 4)52,53. Por otra parte, el hialuronano del glucocáliz es importante en la activación de los neutrófilos, interactuando con el contrarreceptor CD44 de los neutrófilos en la adhesión estimulada por el factor de necrosis tumoral–α54.
La aplicación de heparitinasa, que degrada el heparán sulfato del glucocáliz, causa un incremento dependiente de dosis de la adhesión leucocitaria a las paredes venulares cremasterianas del ratón. Se señalan los datos a los 60min de la aplicación de la enzima. Con datos de Constantinescu et al.53.
Las citosinas proinflamatorias pueden lesionar el glucocáliz e incrementar la permeabilidad endotelial a las macromoléculas. En este campo, Henry y Duling55 en el músculo cremasteriano del hámster demostraron que la infusión de factor de necrosis tumoral-α reduce el espesor de la capa de superficie endotelial de capilares, arteriolas y vénulas y aumenta la penetración de dextrano 70, dextrano 580, albúmina e inmunoglobulina G e incrementa la adhesión de leucocitos al endotelio. Se ha postulado que el adelgazamiento del glucocáliz expone moléculas de adhesión en la superficie de las células endoteliales (o en las glucoproteínas de la profundidad del glucocáliz) y que el efector de esta degradación es la activación de proteasas, una de las cuales podría ser una metaloproteinasa de la matriz (MMP), ya que las MMP se almacenan en vesículas en las células endoteliales, tienen alta afinidad por heparán sulfato y dividen el sindecano-1. Además, podrían participar otras proteasas y liasas en la degradación de los GAG del glucocáliz. Esta propuesta se apoya en la activación de proenzimas de MMP en la superficie de las células endoteliales, concomitante con la caída del glucocáliz y con el incremento de la adhesión de leucocitos al endotelio56. Este aspecto es muy importante, ya que es el paso inicial para la diapédesis y la inflamación vascular.
Una serie de investigaciones acerca de la influencia de la inflamación en el glucocáliz, con la aplicación del potente agente quimiotàctico N-formilmetionil-leucil-fenilalanina, demuestran que este agente causa: a) una notable pérdida de elementos del glucocáliz con disminución importante del espesor de la capa de superficie endotelial en las arteriolas, capilares y vénulas; b) incremento de la adhesión leucocitaria en las vénulas poscapilares; c) disminución del flujo sanguíneo en arteriolas, capilares y vénulas debido a obstrucción de las vénulas por leucocitos adheridos a las células endoteliales; d) incremento de la resistencia al flujo en los capilares por disminución de la deformabilidad de los leucocitos activados que es parcialmente compensada cuando la dimensión del glucocáliz ha disminuido lo suficiente para ampliar el diámetro capilar. Estos cambios están mediados por proteína G y por MMP; la administración de doxiciclina estabiliza el glucocáliz por inhibición de la activación de las MMP. La reperfusión postisquemia también disminuye la dimensión del glucocáliz e incrementa la adhesión leucocitaria57–59.
En la isquemiaEn la isquemia–reperfusión aparece un rápido aumento de la penetración de dextrano-70 al glucocáliz que depende de ROS, ya que mejora con la adición de superóxido-dismutasa/catalasa exógenas60. El efecto del estrés oxidativo parece ocurrir directamente en los constituyentes del glucocáliz, ya que la exposición in vitro de los GAG a ROS derivadas de leucocitos, como el anión superóxido y los radicales hidroxilo, resulta en fragmentación de los GAG con pérdida de algunos de sus componentes61.
En cobayos y humanos se demostró que la isquemia causa desgaste del glucocáliz, en los primeros a través de disminución de su grosor observado con microscopio electrónico y en los segundos por un incremento considerable de las concentraciones de sindecano-1 y heparán sulfato en la sangre arterial de pacientes bajo bypass cardiopulmonar durante cirugía de aorta, durante el paro cardíaco, en la reperfusión y en la isquemia regional cardiopulmonar e infrarrenal62. En el infarto miocárdico por isquemia–reperfusión experimental participa la proteína C reactiva y la activación del complemento (complejo de ataque a la membrana [MAC]). Se sabe que la proteína C reactiva se une a las células apoptóticas, favoreciendo su fagocitosis y activa al complemento aunque atenúa la formación de MAC protegiendo a las células sanas63. La administración intravenosa de sulodexida (compuesta de GAG), que restaura el glucocáliz, reduce la isquemia, el área de infarto, el depósito de proteína C reactiva y de MAC en el miocardio afectado. Es interesante que la elevación de los niveles plasmáticos de sC5b-9 (MAC) en diabéticos con infarto del miocardio parece tener implicaciones pronósticas64–66.
En la coagulaciónAdemás del incremento en la adherencia de la plaquetas al endotelio al adelgazar el glucocáliz, el heparán sulfato del glucocáliz (y también de la matriz extracelular) activa la antitrombina e inhibe el factor Xa ejerciendo una acción anticoagulante local. Desde hace años se conoce que el dermatán sulfato ejerce una actividad antitrombótica, ya que interactúa con el cofactor ii (HC II) de la heparina, llevando a la inactivación enzimática de la trombina sin una modificación importante del tiempo de sangrado67–69. Los estudios en animales y humanos sugieren que en respuesta a la lesión endotelial el HC II se une específicamente al dermatán sulfato de la pared vascular inhibiendo la trombosis70,71.
En los lípidos y la aterosclerosisLa lipoproteinlipasa (LPL) es la enzima limitante en la hidrólisis de los triglicéridos en las VLDL y en los quilomicrones y, por lo tanto, controla la liberación de ácidos grasos a los tejidos. El sitio primario de la acción de la LPL es la cara luminal de la célula endotelial (glucocáliz) en donde está anclada en su forma dimérica al heparán sulfato, probablemente del sindecano-1. La forma dimérica es más activa que la monomérica, que es la forma circulante. La LPL se sintetiza en miocitos y adipocitos y llega al glucocáliz a través de las células endoteliales72.
Un elegante experimento en ratones mostró que la degradación del glucocáliz del endotelio capilar por heparitinasa o por hiperlipidemia inducida por dieta va seguida de filtración de lipoproteínas al espacio subendotelial73. La infusión intravenosa de LDL0x en el hámster produce una disminución aguda del 60% del espesor del glucocáliz y un aumento simultáneo de las plaquetas adheridas al endotelio. Ambos cambios se bloquean con la administración concomitante de superóxido-dismutasa y de catalasa74. La infusión de LDLox también incrementa la adhesión de leucocitos al endotelio vascular, lo que puede inhibirse parcialmente con la administración de GAG (heparán sulfato y heparina). Los pacientes con hipercolesterolemia heterocigota tienen disminución del volumen sistémico del glucocáliz75.
Se ha investigado la relación entre el glucocáliz y la aterosclerosis en ratones. Al respecto se ha observado que: a) las regiones más susceptibles de aterosclerosis, como la bifurcación de la carótida, tienen un glucocáliz más delgado que las regiones menos atacadas por aterosclerosis, como la carótida común; b) estas regiones también tienen una mayor relación íntima/media a expensas de engrosamiento de la íntima (de la matriz subendotelial); y c) la dieta aterogénica en ratones Apo E3 resultó en hipercolesterolemia, así como en menor grosor del glucocáliz y mayor engrosamiento de la íntima que en los ratones controles76. Este estudio apoya la influencia de las turbulencias de las fuerzas de tensión y la hipercolesterolemia en el glucocáliz y en el grosor de la íntima, y sugiere el papel protector del glucocáliz en la aterosclerosis.
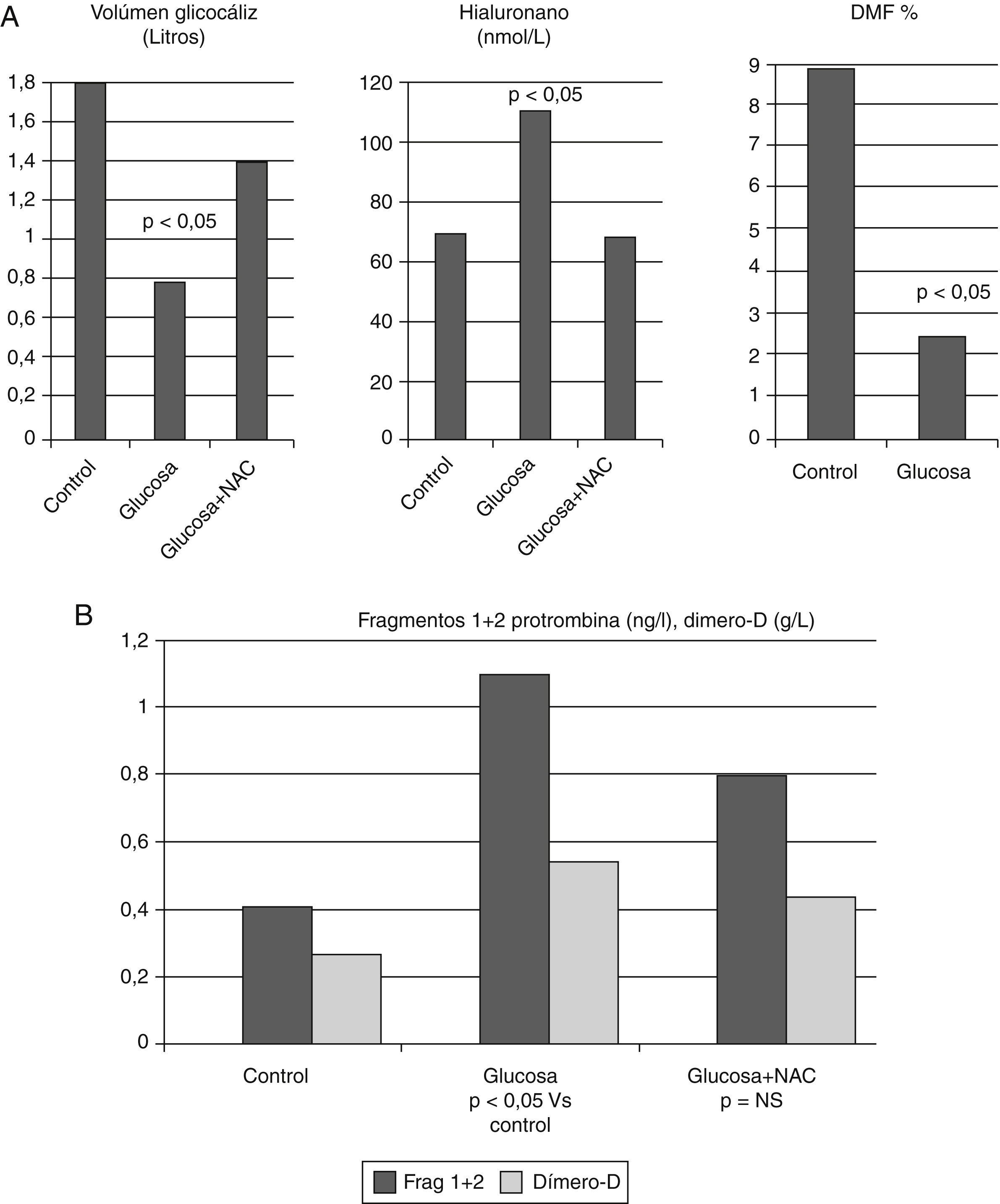
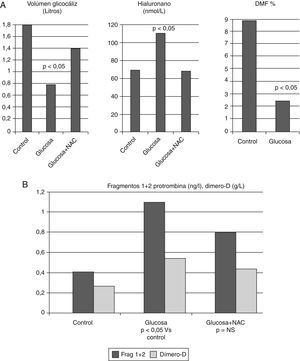
En la hiperglucemia y la diabetes mellitusEn cerdos se demostró que la hiperglucemia inducida por una infusión de glucosa atenúa la vasodilatación arterial reactiva, respuesta similar a la obtenida con hialuronidasal77. La hiperglucemia aguda y la hiperglucemia crónica incrementan la permeabilidad del glucocáliz endotelial78. Además, en voluntarios sanos se demostró que la hiperglucemia aguda obtenida con una pinza hiperglucémica normoinsulinémica fue capaz de reducir el volumen sistémico del glucocáliz, de causar disfunción endotelial y activar la coagulación sanguínea (fig. 5A y B). Estos cambios pudieron prevenirse con la infusión de un potente antioxidante, la N-acetilcisteína, apoyando el papel del estrés oxidativo en el deterioro del glucocáliz y de la disfunción endotelial79. La presencia de marcadores de un estado protrombótico, como elevación de fibrinógeno, dímero-D y PAI-1 se encuentra incluso en personas con intolerancia a la glucosa80.
A) La hiperglucemia aguda en individuos sanos degrada el glucocáliz endotelial, ya que reduce su volumen sistémico e incrementa la concentración de hialuronano circulante, y causa disfunción endotelial medida por dilatación mediada por flujo. B) En el mismo experimento se demostró activación de la coagulación, ya que incrementaron los niveles circulantes de fragmentos 1+2 de protrombina y de dímero D. La degradación del glucocáliz se previno con el antioxidante N-acetilcisteína (NAC). Con datos de Nieuwdorp et al.79.
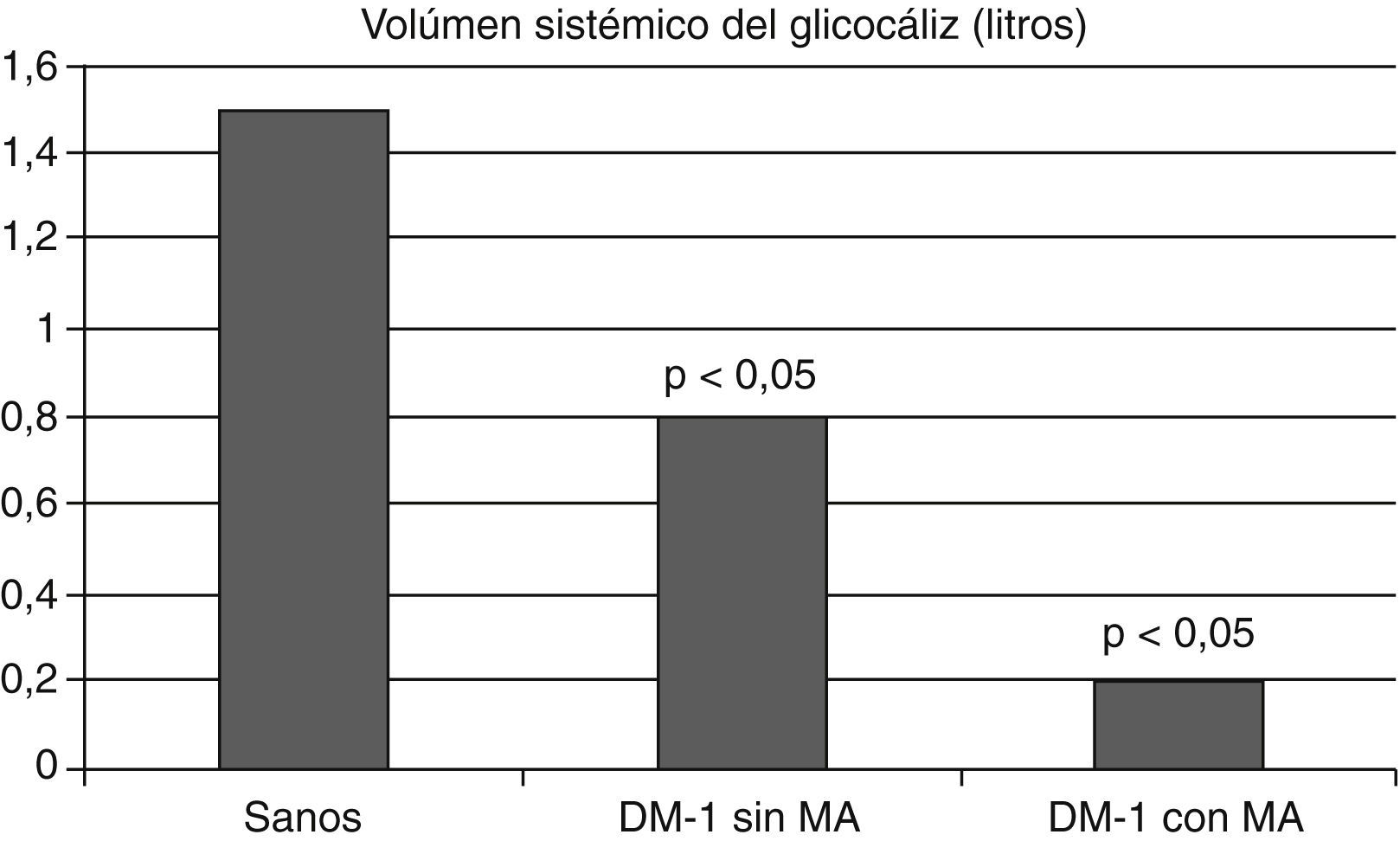
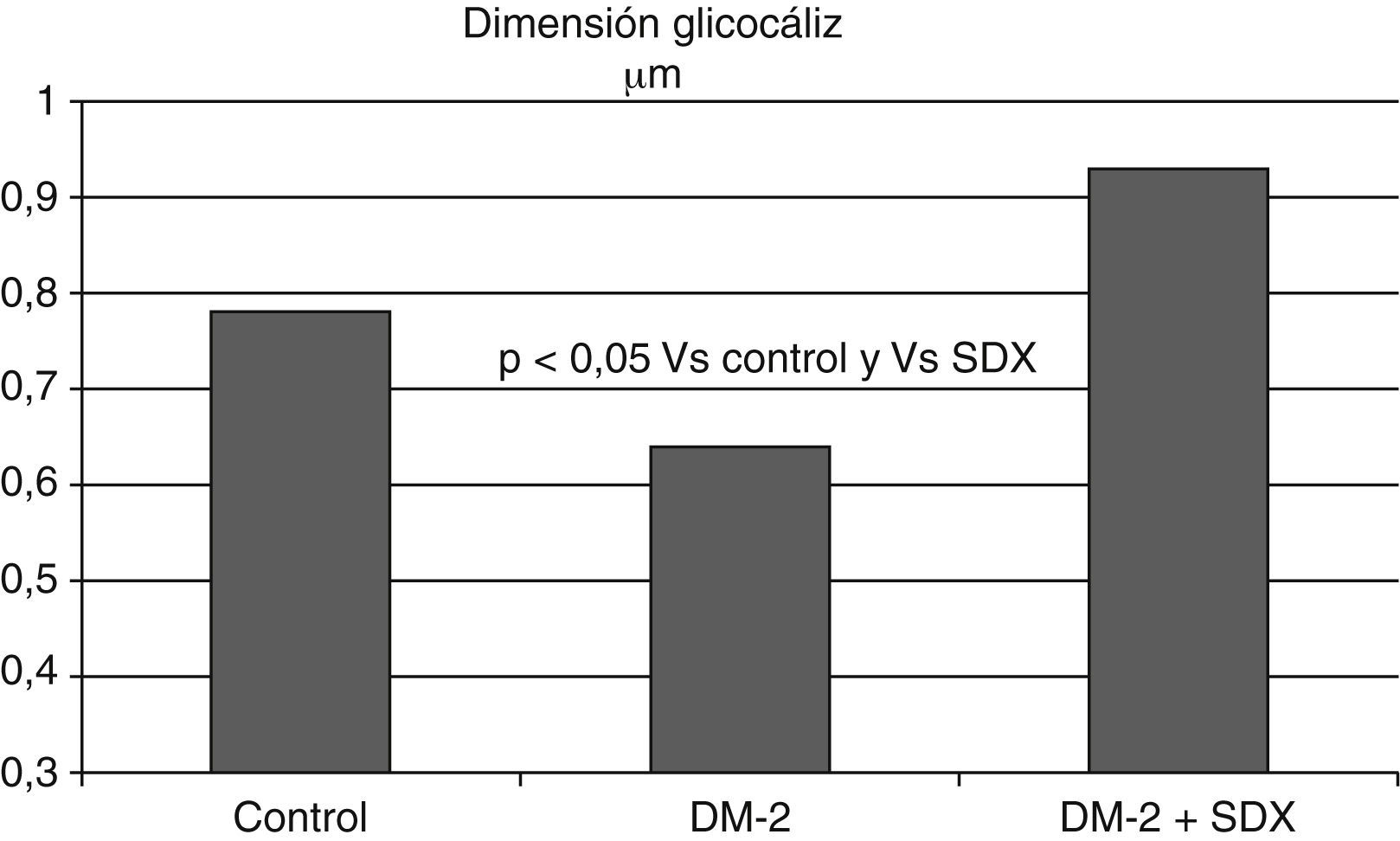
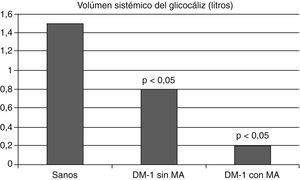
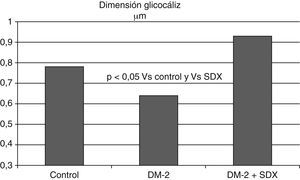
Además, en pacientes con diabetes mellitus tipo 1 se observó un menor volumen sistémico del glucocáliz con relación a los individuos sanos; este volumen fue aun menor en los diabéticos con microalbuminuria, apoyando la relación entre la diabetes y el deterioro del glucocáliz y entre este y la presencia de microalbuminuria (fig. 6)81. Las dimensiones del glucocáliz también están significativamente disminuidas en individuos con diabetes tipo 2 (fig. 7)82.
El volumen sistémico del glucocáliz está disminuido en los diabéticos tipo 1 y lo está aun más en los diabéticos con microalbuminuria. Se ilustran los valores medios. Con datos de Nieuwdorp et al.81.
La dimensión del glucocáliz observada en los vasos sublinguales de individuos con diabetes mellitus tipo 2 es menor que en los controles sanos. Después de 2 meses de tratamiento con sulodexida (SDX) por vía oral las dimensiones del glucocáliz se incrementaron hasta alcanzar valores normales. Se ilustran los valores medios. Con datos de Broekhuizen et al.82.
En las tablas 2 y 3 se resumen las causas de deterioro del glucocáliz y las consecuencias de este daño.
Factores que dañan el glucocáliz endotelial
| Trastornos de las fuerzas mecánicas de tensiónEnzimas: heparinasa, hialuronidasa, neuraminidasa, metaloproteinasas de la matriz y otras proteasasEspecies reactivas de oxígenoHipernatremiaDieta aterogénica (hipercolesterolemia)Lipoproteínas de baja densidad oxidadasHiperglucemia aguda, hiperglucemia crónica, diabetes mellitus tipo 1 y tipo 2Factor de necrosis tumoral-α |
Consecuencias del deterioro del glucocáliz endotelial
| Edema pericapilarIncremento de la permeabilidad a macromoléculasIncremento del hematocrito capilarDisfunción endotelialDisminución de la liberación de óxido nítrico en respuesta a las fuerzas de tensiónFiltración de lipoproteínas (LDL) al espacio subendotelialAdhesión de leucocitos al endotelioAdhesión de plaquetas al endotelioActivación de la coagulación plasmática |
La tenue estructura del endotelio que lo cubre en su cara luminal, el glucocáliz, tiene un importante papel en la fisiología vascular, ya que regula la permeabilidad de líquidos y moléculas y la distribución del flujo sanguíneo en la microcirculación. Además, participa con las células endoteliales en la coordinación de la vasomoción, previene la formación local de coágulos a través de acciones anticoagulantes y profibrinolíticas locales, evita la adhesión de las plaquetas y leucocitos a la pared vascular y en general defiende a la pared vascular en contra de diversas condiciones nocivas.
La degradación del glucocáliz endotelial puede darse por estímulos físicos como la presión sobre la pared vascular (shear stress) o químicos, como la hiperglucemia, la hipernatremia, la hipercolesterolemia, el estrés oxidativo y ciertas moléculas inflamatorias. El daño del glucocáliz origina una alteración de sus funciones, incluyendo incremento de la permeabilidad a líquidos, solutos y lipoproteínas, así como aumento de la adherencia leucocitaria a la pared vascular y disfunción endotelial. Los factores que deterioran el glucocáliz frecuentemente existen en enfermedades micro y macrovasculares (diabetes mellitus, aterosclerosis), lo que lleva a pensar que esta estructura podría ser importante en la fisiopatología de estos padecimientos. Así, aparece la posibilidad de terapéuticas dirigidas a proteger o restaurar el glucocáliz endotelial como un tratamiento diferente en estas enfermedades.