Introducción
La taquicardia ventricular (TV) idiopática corresponde al grupo de TV en las que no se demuestra enfermedad cardiaca estructural.1,2 Representa el 10% de todas las TV.1 Existen dos grandes subgrupos: la TV del tracto de salida (TS), que constituye el 88-90% y la TV fascicular, el 10-12% restante. Dentro de las del TS, el 80-90% se originan en el ventrículo derecho (TSVD) (más frecuentemente en su región septal posterosuperior) y el 10-20% en el ventrículo izquierdo (TSVI). Esta última se origina en el endocardio basal en un 60% de los casos (siendo el sitio más común la continuidad mitroaórtica) y en las zonas epicárdicas en un 40%. La TV de las cúspides aórticas representan el 0.7% de todas las TV.2
Se ha demostrado que las TV idiopáticas comparten un mecanismo electrofisiológico focal: Actividad disparada por postpotenciales tardíos dependientes de AMPc-Calcio y menos frecuentemente automatismo incrementado.3,4 De allí que sean sensibles a adenosina y verapamilo, se favorezca su aparición con el ejercicio o la influencia adrenérgica, y no sean inducibles ni presenten encarrilamiento transitorio durante la estimulación eléctrica programada. Los síntomas más frecuentes son las palpitaciones con o sin disnea y mareos; es raro el síncope. Desde el punto de vista electrocardiográfico pueden presentarse como extrasístoles ventriculares (EV) frecuentes, TV no sostenida repetitiva y TV sostenida inducida por el ejercicio.5,6 Particular atención merecen, las TVI con origen en los senos de Valsalva de la válvula aórtica y la región septal superior del TSVD, ya que ambas presentan durante la taquicardia, morfología de bloqueo de rama izquierda (BRI), transición precordial temprana (V2-V3) y eje inferior. El pronóstico es generalmente benigno y la incidencia de muerte súbita es rara.
Resumen del caso
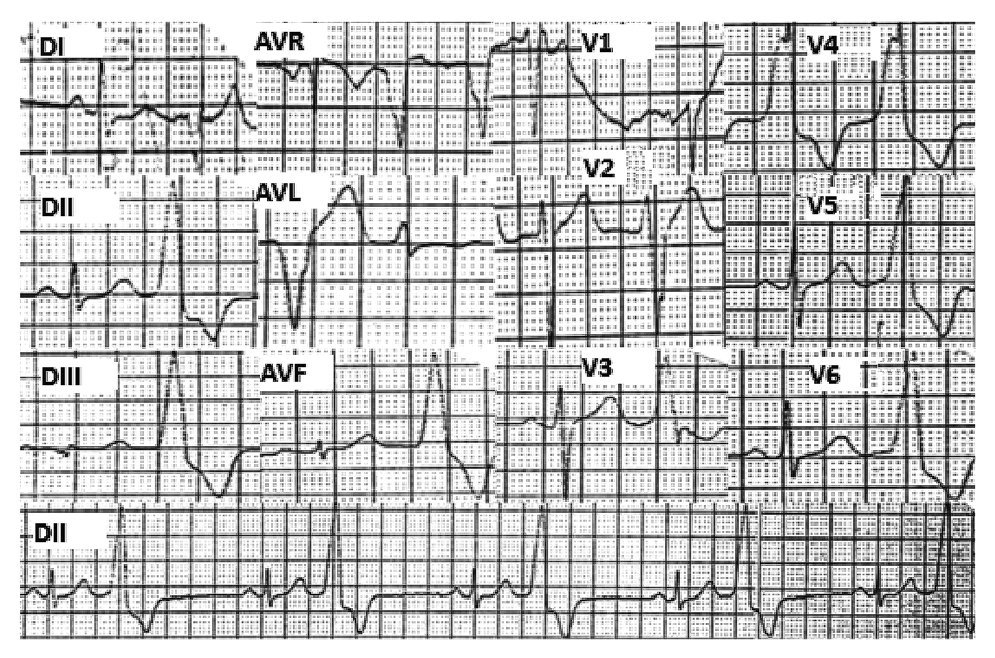
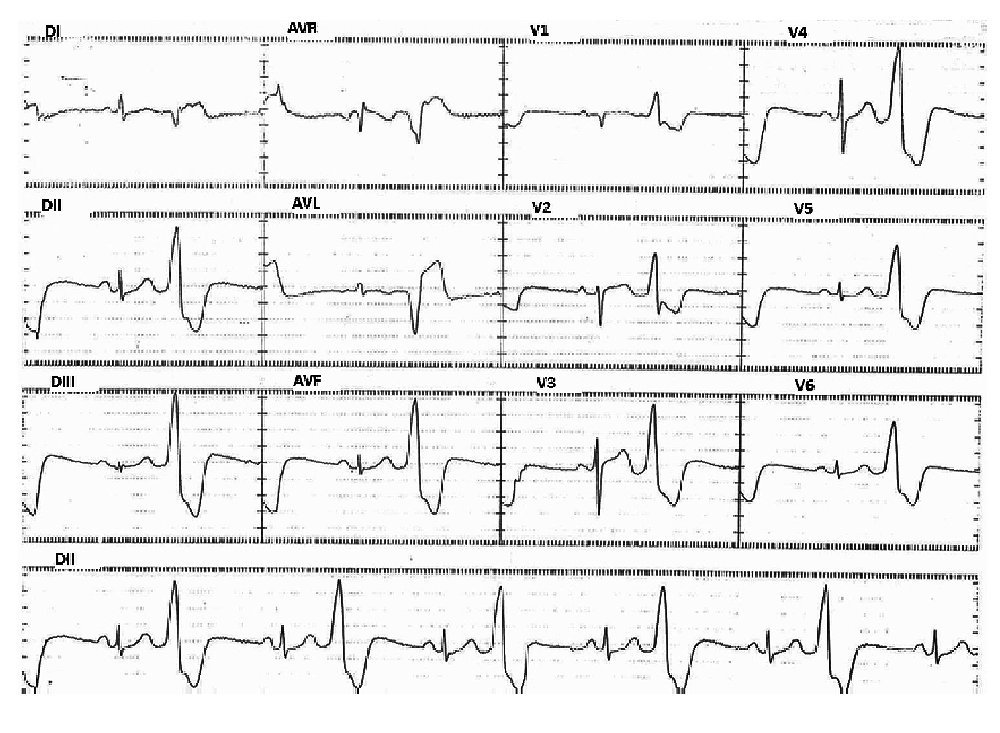
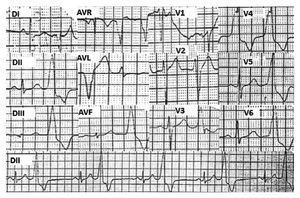
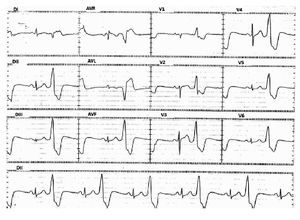
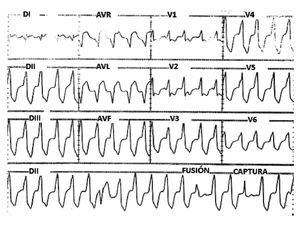
Hombre de 58 años de edad, hipertenso, con historia de 2 años de palpitaciones rápidas y regulares asociadas a disnea y mareos, últimamente incesantes a pesar del tratamiento antiarrítmico con propafenona. El examen físico fue normal. El ECG de 12 derivaciones, tomado a su ingreso, mostró EVs frecuentes con morfología de BRI, transición precordial en V3 y eje inferior (Figura 1), sin embargo, el ECG tomado al inicio del EEF mostró desplazamiento hacia la izquierda de la zona de transición precordial de la onda R, lo cual atribuimos a variaciones en el nivel en que fueron colocados los electrodos (Figura 2).
Figura 1. ECG de 12 derivadas tomado al ingreso que muestra: EVs frecuentes con morfología de BRI, transición precordial en V3 y eje en el plano frontal inferior derecho.
Figura 2. ECG de 12 derivadas tomado al inicio del EEF que muestra: EVs frecuentes con ondas R positivas de V1 a V6, pero con el mismo eje en el plano frontal que en la Figura 1.
El ecocardiograma no mostró alteraciones, la fracción de expulsión del VI fue del 65%; el monitoreo Holter de 24 horas documentó EV monomorfas frecuentes que representaron el 30% de los latidos totales, en formas sencilla, bigeminada, dupletas y múltiples episodios de TV no sostenida, siendo el mayor de 7 latidos a una frecuencia de 120 lpm. La prueba de esfuerzo reportó EVs que se hacen más frecuentes con el ejercicio máximo. La coronariografía demostró arterias coronarias epicárdicas sin lesiones angiográficas.
Estudio electrofisiológico
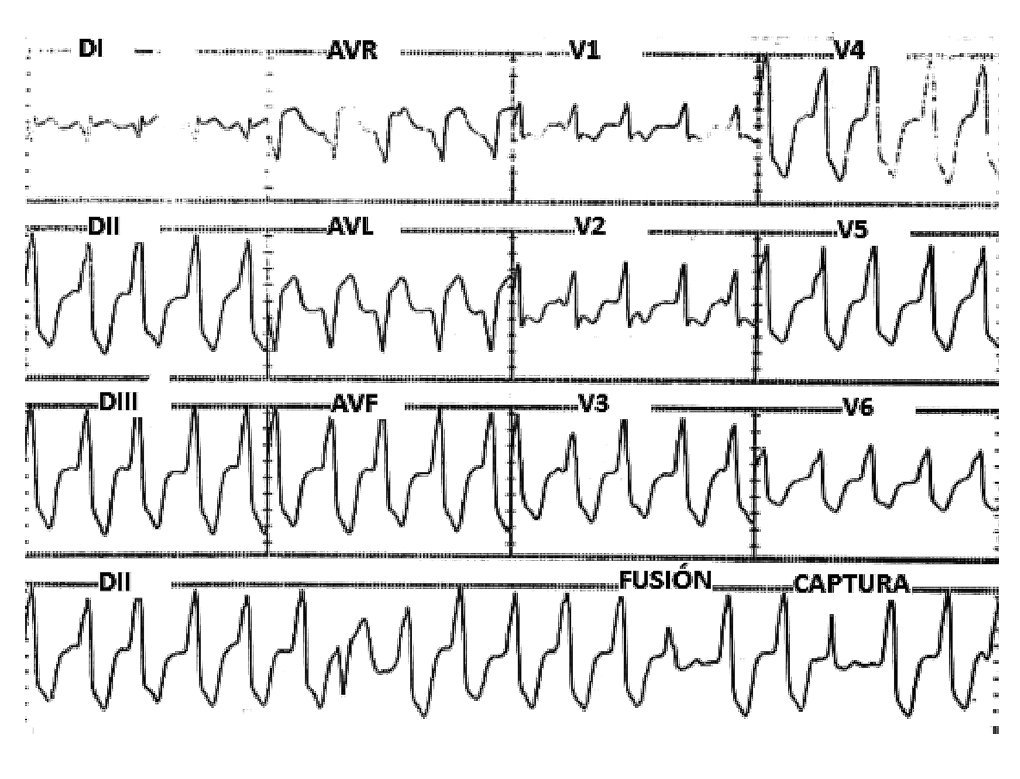
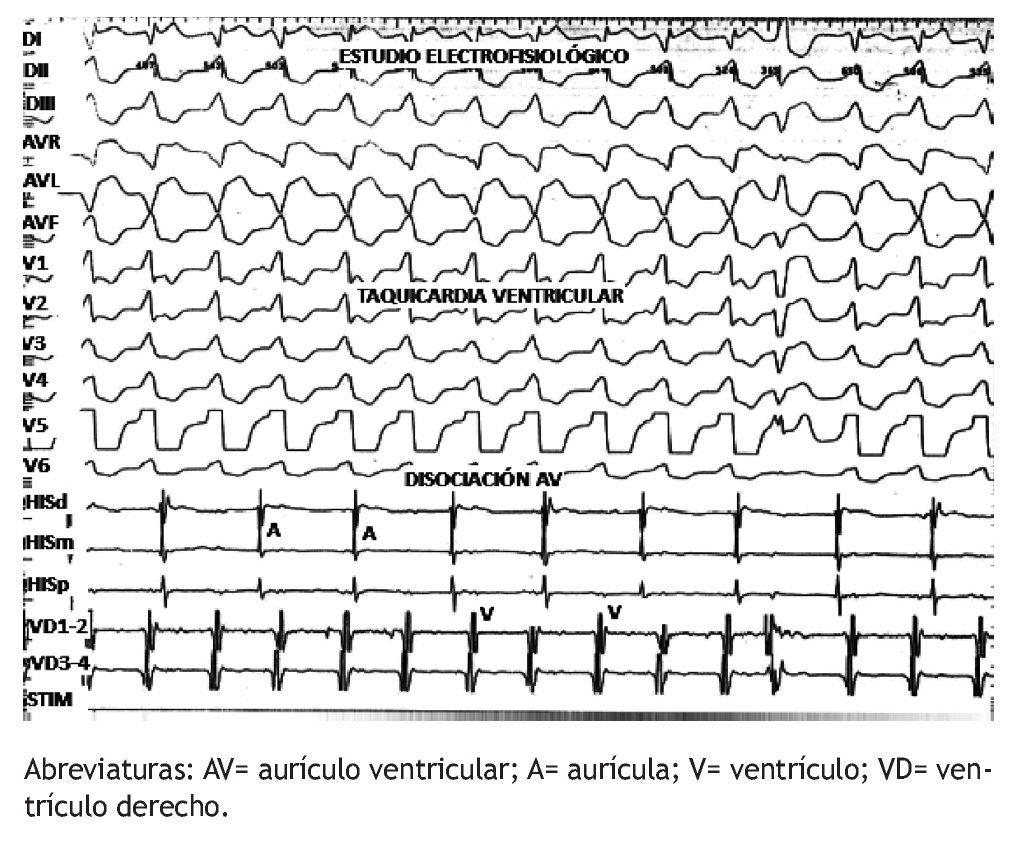
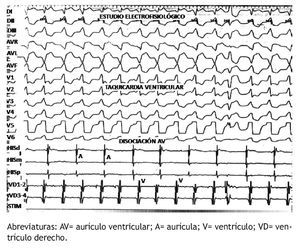
Por técnica de Seldinger modificada, se puncionó en 2 ocasiones la vena femoral y en 1 ocasión la arteria femoral derechas, para pasar bajo guía fluoroscópica 2 catéteres tetrapolares Josephson al ventrículo y aurícula derechas, y catéter deflectable de mapeo-ablación Navistar, con electrodo distal de 3.5mm para llevarlo vía retrógrada al VI. Luego de la punción arterial, se administraron 2500 UI de heparina IV. Durante todo el estudio se contó con el ECG de 12 derivaciones, así como con los registros de los electrogramas bipolares y unipolares, los cuales se filtraron entre 30-500 Hz y 0.05-500 Hz, respectivamente. Inicialmente, se realizó protocolo de inducción de TV con LC de 600 ms y 400 ms, con hasta 3 extraestímulos en ápex y tracto de salida del VD, logrando desencadenar TV no sostenida con la misma morfología que las EVs (Figuras 3 y 4). No se utilizó Isoproterenol por falta de disponibilidad al momento del estudio. Debido a esto, se decidió realizar mapa de activación de las EVs frecuentes en el tracto de salida del VI y luego en las cúspides aórticas, guiado con el sistema electroanatómico (CARTO, Biosense-Webster), demostrándose el sitio de activación más precoz (intervalo electrograma en el catéter de ablación-inicio del QRS durante la EV de al menos 20ms) en el seno de Valsalva izquierdo.
Figura 3. ECG de la TV inducida durante el EEF. Misma morfología y eje de las EVs; además con fusiones y capturas.
Figura 4. Registro de los electrogramas intracavitarios que demuestra disociación AV. El catéter de His registra la actividad eléctrica de la aurícula derecha.
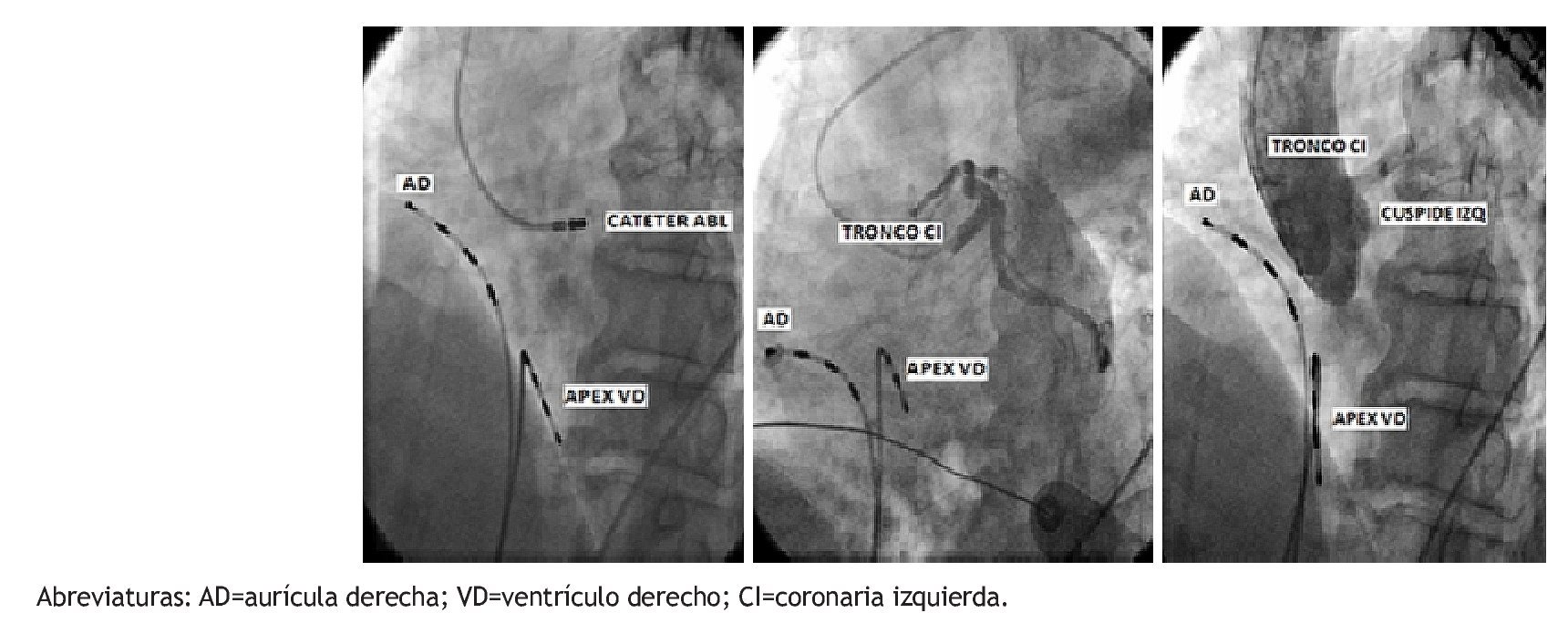
Posteriormente se efectuó coronariografía izquierda y aortograma en proyecciones comparativas OAD y AOI estándares para conocer la distancia del ostium de la arteria coronaria izquierda con la punta del catéter en el sitio de ablación (Figuras 5, 6 y 7). Se aplicó radiofrecuencia controlada con aumento escalonado de poder de 20 a 35 Watts (generador de radiofrecuencia Stocker, Biosense-Webster) e irrigación continua a 30 ml/min de solución fisiológica. Observándose interrupción de las EV a los 8 segundos de iniciada la última aplicación, la cual se completó hasta un minuto de radiofrecuencia en dicho sitio (Figura 8). No hubo recurrencia de las EVs, a pesar de repetir protocolo de estimulación.
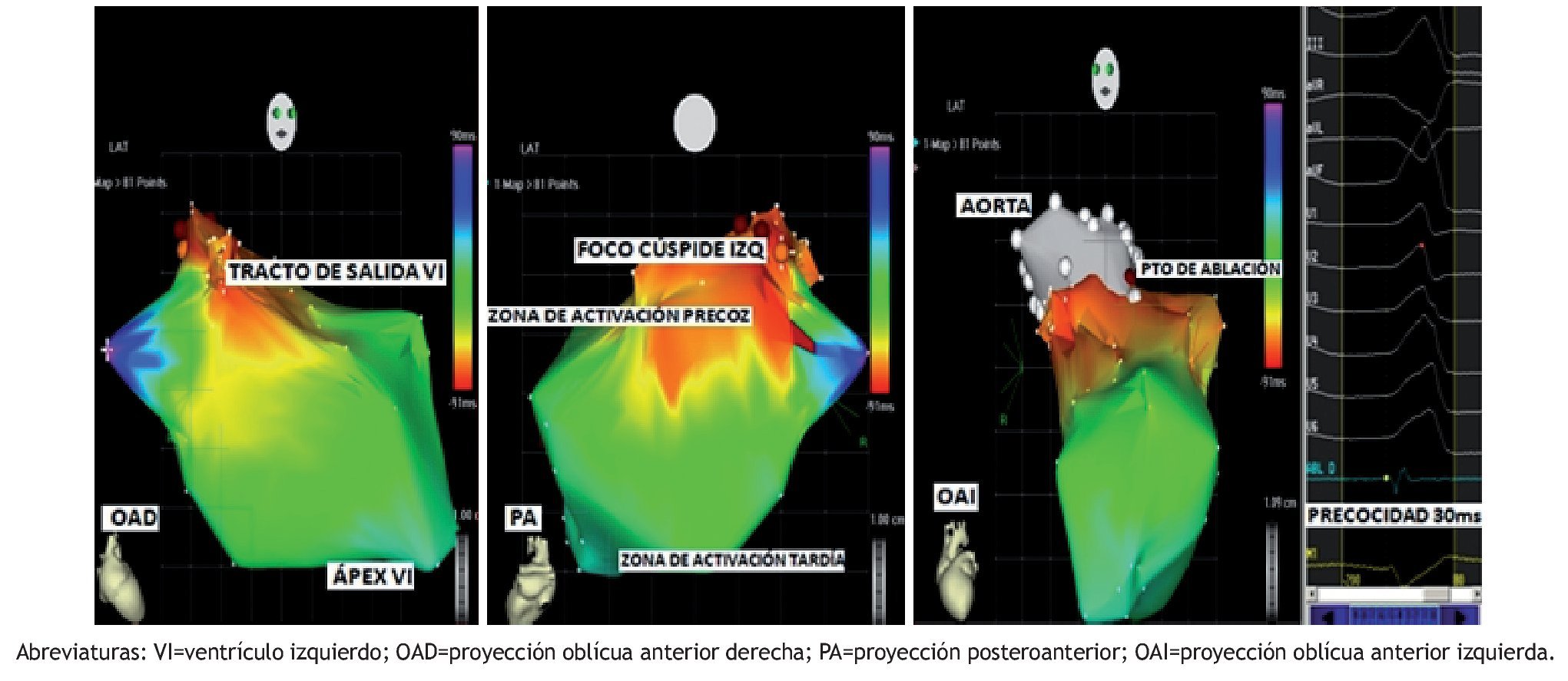
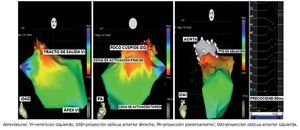
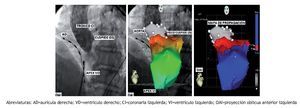
Figura 5. A. Cartografía del VI (proyección OAD) que demuestra la zona de activación más precoz inmediatamente por encima del TSVI en la cúspide aórtica izquierda. B. Cartografía del VI proyección PA. C. Cartografía del VI en proyección OAI con la aorta sobrepuesta para demostrar el punto de ablación en la cúspide aórtica izquierda, que se correspondió con el electrograma más precoz (30 ms) en el catéter de RF (electrogramas de la derecha).
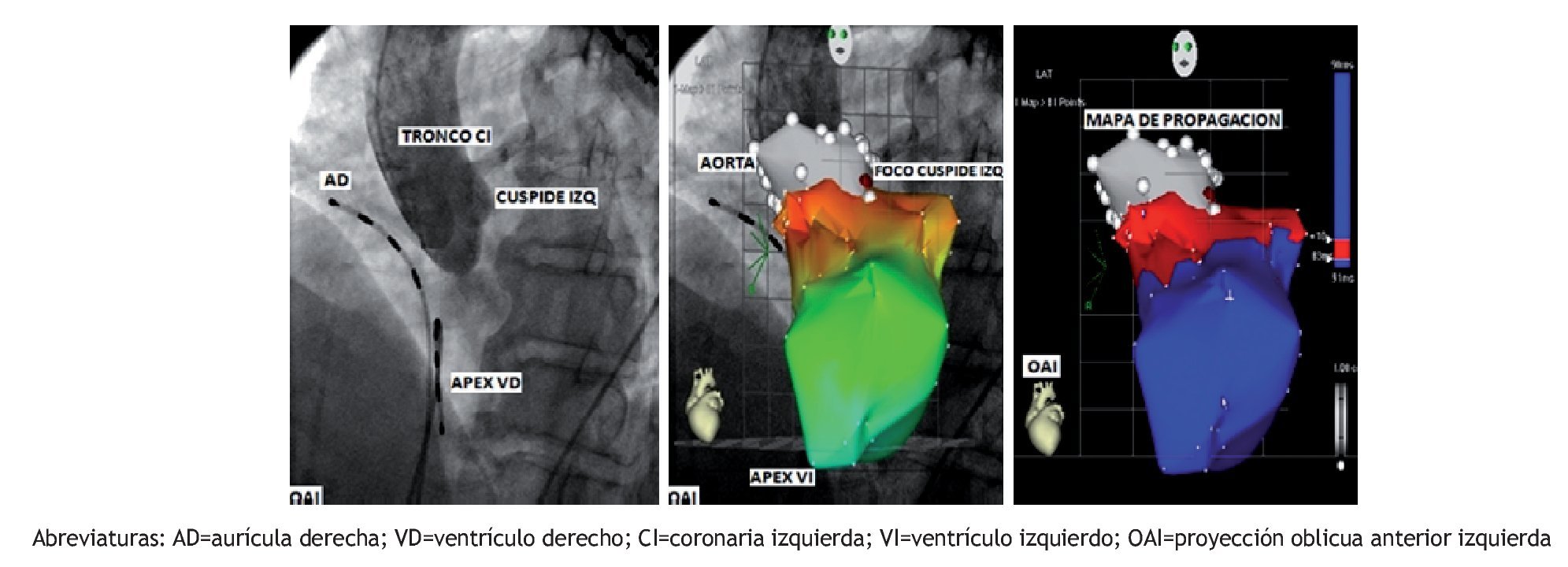
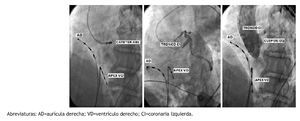
Figura 6. A. Proyección en OAI 45º para mostrar la ubicación radioscópica de la punta del catéter de ablación en el sitio de aplicación de la RF. B. Angiografía selectiva en la misma proyección que en A para mostrar la relación anatómica del tronco de la coronaria izquierdo y el catéter de ablación. C. Aortografía en OAI 45º para demostrar la orientación espacial del catéter de ablación en la cúspide aórtica izquierda.
Figura 7. A. Aortografía en OAI que muestra la raíz de la Aorta, sus cúspides y el tronco de la coronaria izquierda. B. Cartografía de la Aorta y el VI sobremontada a la Aortografía que demuestra el foco de origen de la TV en la cúspide aórtica izquierda. C. Mapa de propagación de la activación con una dirección del foco de origen de la TV (rojo) al ápex del VI (azul).
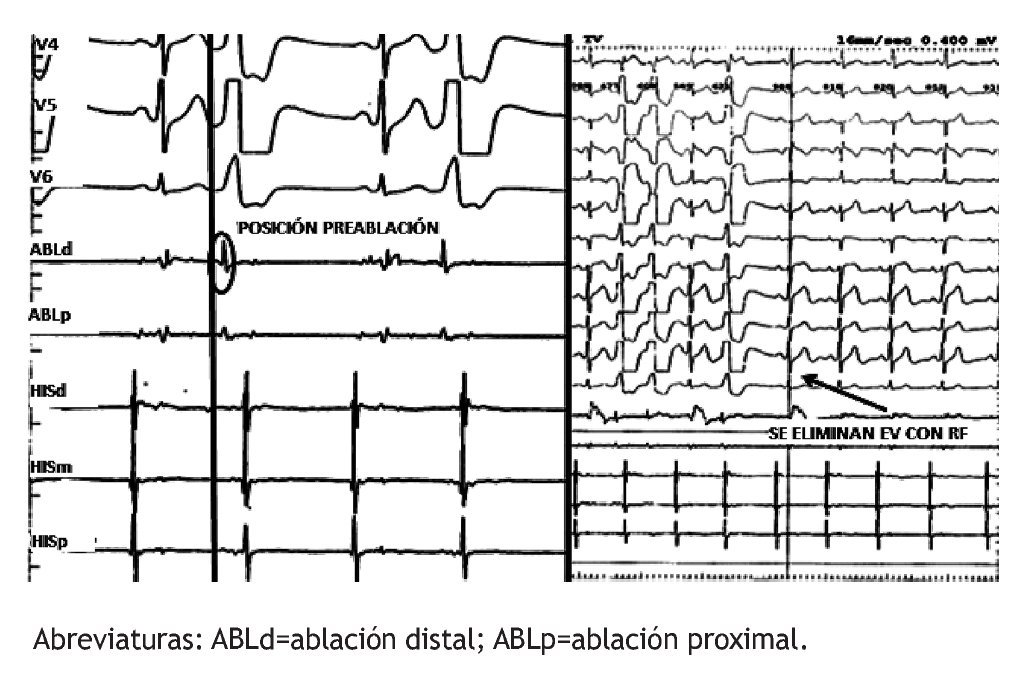
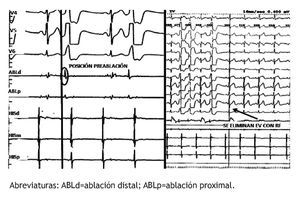
Figura 8. A. Electrograma magnificado en el catéter de ablación para mostrar la precocidad del mismo con respecto al “QRS” del ECG en la posición preablación. B. Trazo del ECG y electrogramas que permite observar el momento de desaparición de las EVs durante la aplicación de RF. El catéter de His está registrando la actividad eléctrica de la aurícula derecha.
Resultados
El paciente fue monitorizado por 24 horas luego de la ablación exitosa y fue dado de alta sin complicaciones. Luego de 18 meses de seguimiento se mantiene asintomático, sin evidencia de arritmias ventriculares y sin tratamiento antiarrítmico.
Discusión
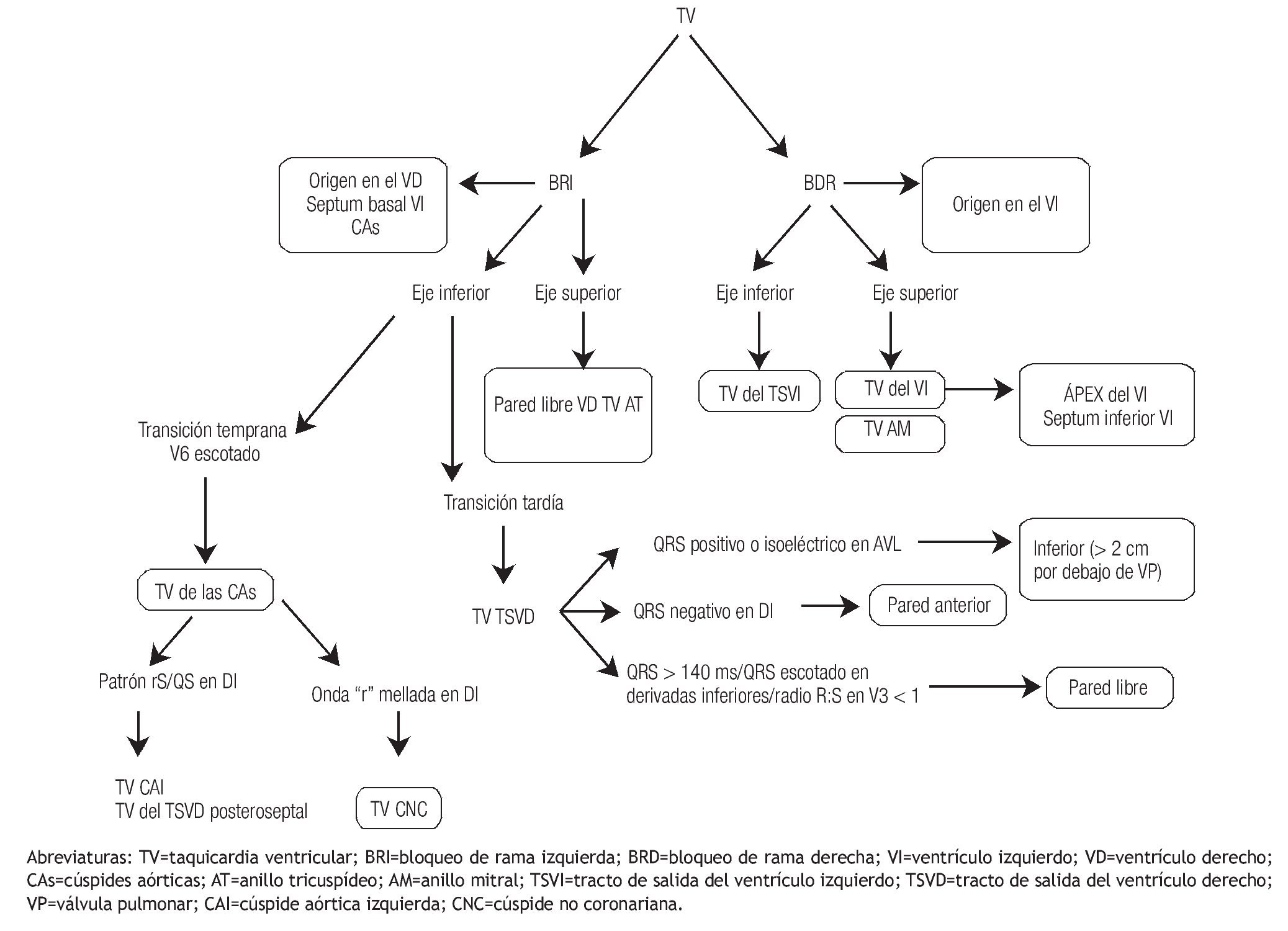
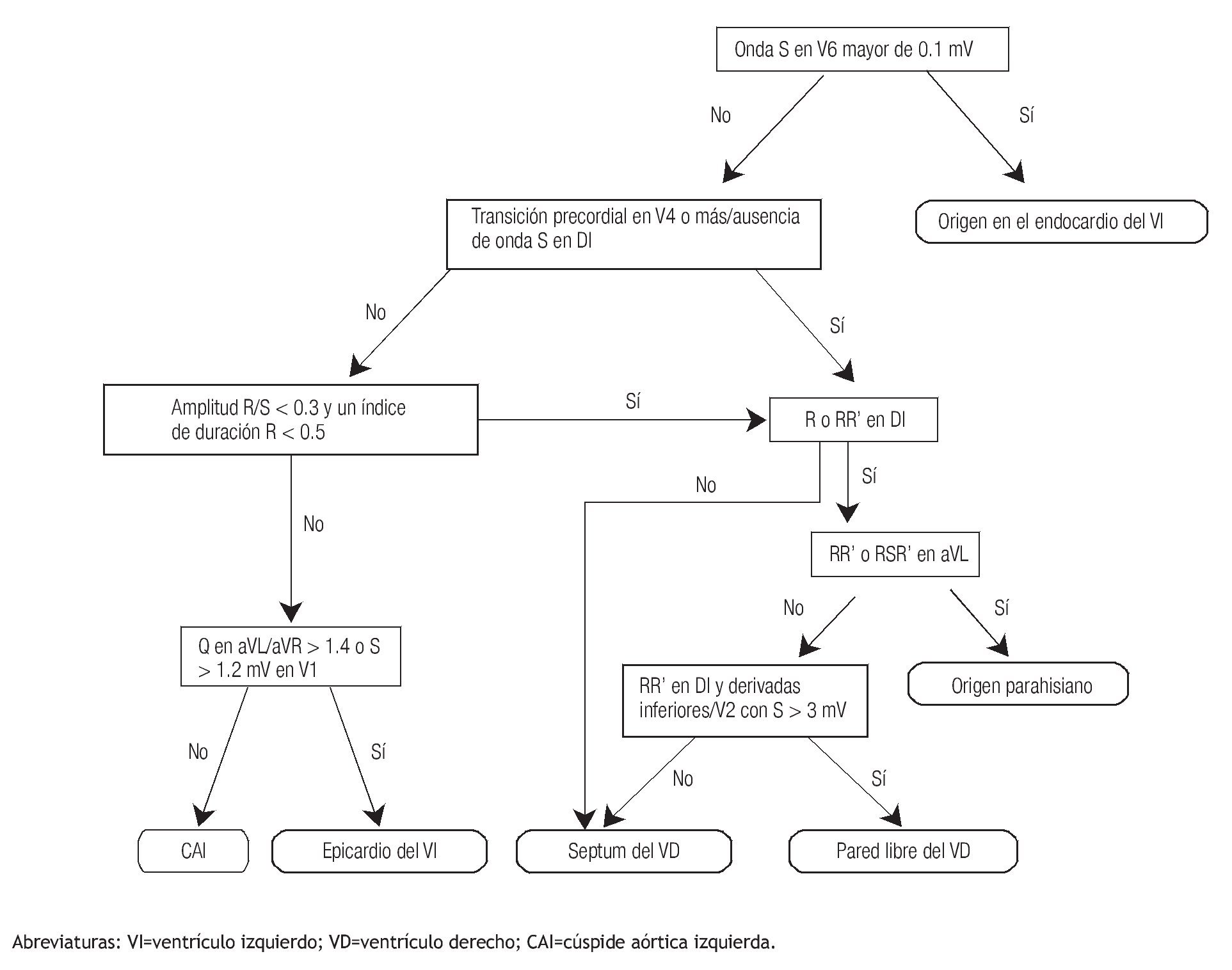
El patrón morfológico de bloqueo de rama derecha (BRD) orienta a un origen de la TV en el ventrículo izquierdo. Sin embargo, la morfología de bloqueo de rama izquierda puede verse en las TVs del ventrículo derecho, septum basal y superior del VI, CAs y otras localizaciones epicárdicas.6 Adicionalmente, la estrecha relación anatómica entre la región septal del TSVD (incluyendo la zona parahisiana) y las cúspides aórticas, especialmente la cúspide aórtica derecha (CAD) y la cúspide no coronaria (CNC), explica la morfología similar (bloqueo de rama izquierda, transición precordial temprana en V2 o V3 y eje inferior) encontrada en las EVs o TVs que se originan en estos sitios, tal como lo demostraron Yamada y colaboradores.7 A pesar de esto, existen algunas características electrocardiográficas que localizan el lugar de origen con bastante precisión.8,9,10 De tal manera que se han hecho intentos de unificar criterios proponiéndose diferentes algoritmos electrocardiográficos para localizar las TVI en general y otros más específicos para las TVs del TS (Figuras 9 y 10). Así Ito y colaboradores desarrollaron uno que validaron en 80 pacientes encontrando una sensibilidad 88%, especificidad 95%, valor predictivo positivo (VPP) 88% y un valor predictivo negativo (VPN) 96% para identificar el sitio óptimo de ablación exitosa en este tipo de taquicardias.11
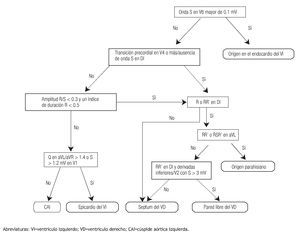
Figura 9. Algoritmo para el diagnóstico diferencial de la TVI.
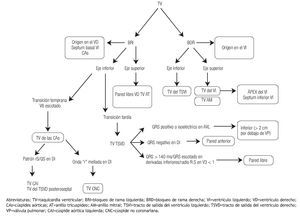
Figura 10. Algoritmo para localizar el origen de las TV del TS.
En general entonces, se toma en cuenta la morfología del ECG y la zona de transición precordial para decidir el abordaje terapéutico. De tal manera que si la transición precordial es en V1 o V2 (transición temprana) se recomienda iniciar el mapeo en el VI, y si la transición es en V4 en adelante entonces se aconseja iniciar el mapeo en el VD.12 Sin embargo, si la transición precordial es en V3 lo más recomendable es hacer un abordaje anatómico escalonado iniciando en el VD (explorando el TSVD primero por su mayor prevalencia, y luego la arteria pulmonar, pared libre del VD, anillo tricuspideo, seno coronario); si no se consiguen electrogramas precoces con ablación fallida en estos sitios, se recomienda mapear el VI (endocardio basal, septum interventricular, cúspides aórticas); y finalmente, el abordaje epicárdico percutáneo. Dicho manejo se fundamenta en varios estudios como el de Tanner y colaboradores, los cuales evaluaron 33 pacientes con TVI con transición precordial en V3 en los que encontraron un 58% de prevalencia de TV en el TSVD con una sensibilidad 55%, especificidad 38%, VPP 58% y un VPN 36% para predecir ablación exitosa en este sitio. De la misma manera, una transición precordial en V4 en adelante tuvo una especificidad y un VPP del 100% para ablación exitosa en el TSVD; y recíprocamente cuando la transición precordial estuvo en V2 o antes para las TVs que provienen de las CAs y regiones epicárdicas.13
En nuestro paciente en particular se decidió mapear directamente el VI, a pesar de una transición precordial en V3 en el ECG de ingreso por los siguientes hallazgos: una relación “R/S” mayor de 1 en V3, la presencia de ondas “R” altas en derivadas inferiores, la ausencia de onda “S” en V5 y V6, y un patrón “rS” o “QS” en D1. También para dicho abordaje se tomaron en cuenta ciertos datos del ECG obtenido durante el EEF, tales como: la concordancia precordial positiva de V1 a V6, y el hallazgo de un índice de duración de la onda “R”/duración del “QRS” mayor del 50% y una relación amplitud de la onda “R”/”S” mayor del 30% en V1 ó V2.14,15,16
En cuanto a la ablación con catéter de radiofrecuencia (RF) guiada con el sistema electroanatómico (CARTO) y la técnica de “pace-mapping” podemos comentar que se constituye en el tratamiento de elección en pacientes con síntomas persistentes como el nuestro, ya que la mayoría presentan mala respuesta al tratamiento antiarrítmico a largo plazo (calcioantagonistas, betabloqueadores, antiarrítmicos Ia, Ic y III). La tasa de éxito global oscila entre un 90%-95% con una incidencia de complicaciones mayores menor al 1% (oclusión o estenosis de las arterias coronarias y daño valvular para las TV de las cúspides aórticas). Para minimizar estos riesgos se recomienda aplicar RF, manteniendo una distancia de al menos 10mm entre la punta del catéter y el origen de las arterias coronarias, con una temperatura máxima de 55-60º y un poder escalonado hasta de 35 W con un máximo de 4 aplicaciones no mayores de 60 segundos cada una, y se recomienda interrumpir la RF si en 10 segundos no se han eliminado las EVs. Por otro lado, un electrograma ventricular en el catéter de ablación con una precocidad mayor o igual a 30ms con respecto al QRS predice éxito en la aplicación de RF. Algunos de los inconvenientes para la ablación son: la no inducción de TV sostenida en el estudio electrofisiológico (EEF) y la búsqueda del sitio de origen basada en la morfología de la extrasístole en el electrocardiograma (ECG). En el caso de no inducirse la TV por estimulación eléctrica programada se recomienda el uso de Isoproterenol (Isuprel) en dosis de 0.5-2ug/min junto con estimulación rápida en forma de ráfagas.
Por esto, en nuestro enfermo optamos por guiarnos con el sistema CARTO, mediante el cual reconstruimos la raíz de la aorta y cúspides coronarianas, ya que en este tipo de casos nos permite identificar con gran exactitud el sitio de origen de la TV a través del código de colores (rojo-precoz y violeta-tardío), de tal manera que podemos dirigir con más seguridad la ablación al punto ideal. Escogimos un catéter de ablación con irrigación externa, ya que éste tiene la menor incidencia de formación de trombos y permite una aplicación progresiva del poder manteniendo una temperatura baja en la interfase electrodo-tejido.
Conclusiones
La TV con origen en los senos de Valsalva de la válvula aórtica, aunque rara, debe considerarse en el diagnóstico diferencial de las TVIs con morfología de BRI, transición precordial temprana y eje inferior.
Aunque el electrocardiograma puede predecir con bastante exactitud el sitio cercano de origen, éste puede no ser adecuado en un paciente en particular, tomando en cuenta que la morfología y polaridad pueden variar dependiendo de la orientación del corazón en la cavidad torácica y de la posición en que son colocados los electrodos precordiales.
La ablación con catéter de este tipo de TVs, se constituye en el tratamiento de elección en pacientes sintomáticos, a pesar del tratamiento antiarrítmico.
Autor para correspondencia:
Dr. Luis Carlos Tejera Jurado.
Departamento de Electrocardiología del Instituto Nacional de Cardiología “Ignacio Chávez”, Juan Badiano No 1, Col. Sección XVI, Tlalpan 14080, México D.F.
Teléfono 5513-3740.
Correo electrónico: luiscarlos3008@hotmail.com
Recibido el 5 de septiembre de 2008;
aceptado el 19 de febrero de 2009.