El propósito de esta revisión es analizar la progresión bioquímica de la placa aterosclerótica y la relación que presenta con la diabetes y la alimentación. Se exponen las evidencias científicas de pacientes con diabetes, que a diferencia de pacientes no diabéticos presentan niveles más elevados de algunos ácidos grasos en la placa de ateroma (como el palmítico, linoleico y oleico), elevada incidencia de trombosis coronaria relacionada con el incremento en el tamaño de la base necrótica y la disminución del tamaño de la capa fibrosa de los ateromas. Entre ambos grupos de pacientes se expone la diferencia en el perfil de lípidos de la placa aterosclerótica, así como los cambios celulares involucrados en la formación de la misma y la influencia de la alimentación sobre su desarrollo.
The purpose of this review is to analyze the biochemical progression of atherosclerotic plaque and its association with diet and diabetes. This study shows the scientific evidence of demonstrating that diabetic patients present high levels of fatty acids like palmitic acid and linoleic acid in their atheroma plaques in comparison with non-diabetic patients. This study also establishes how patients with diabetes mellitus have a higher prevalence of atherosclerotic heart diseases in the form of Coronary Thrombosis and have different anatomopathological appearance like higher necrotic core and thin fibrotic layer than the general population. Furthermore this review describes the different anatomopathological appearance and cellular changes involved in the formation of these plaques and how diet can affect the development of these plaques.
La diabetes mellitus (DM) es la condición metabólica asociada con la pérdida de la regulación normal de glucosa que se manifiesta por una hiperglucemia1, se clasifica en tipo 1 y 2. La diabetes tipo 1 (DT1) es consecuencia de la destrucción de las células beta del páncreas, y por lo general conduce a una deficiencia absoluta de insulina2, mientras que la diabetes tipo 2 (DT2) se caracteriza por combinaciones de disminución, tanto de secreción como de sensibilidad a la insulina (resistencia a la insulina)3, que representa alrededor del 85% al 95% del total de casos de diabetes en países desarrollados, y podría representar un porcentaje mayor en países subdesarrollados4. La diabetes mellitus constituye un problema de salud pública actual, debido a que su prevalencia global está aumentando rápidamente, como resultado del envejecimiento de la población, la urbanización, los cambios asociados al estilo de vida, que permanece como una causa importante de morbimortalidad prematura en todo el mundo5–7, con más de 347 millones de personas con esta enfermedad. De acuerdo a las proyecciones de la Organización Mundial de la Salud (OMS) será la séptima causa de mortalidad en 20308.
Aterosclerosis y diabetesLa DM es un factor de riesgo para desarrollar aterosclerosis9, enfermedad que viene desde la época de la sexta dinastía egipcia (2625-2475 a.C.) hace 4,500 años10, y representa la principal causa de morbimortalidad del mundo occidental11, además de ser la razón principal de una calidad de vida deteriorada en pacientes con diabetes12, que presentan tasas de mortalidad de 2 a 4 veces mayor por problemas cardiacos comparado con individuos sin diabetes13. Las muertes por enfermedad cardiovascular (ECV) afectan a ambos sexos, y se calcula que para el año 2030 morirán cerca de 23,3 millones de personas14. La enfermedad coronaria isquémica es un tipo de ECV caracterizado por el suministro disminuido de sangre al músculo cardiaco, consecuencia de la formación de placas dentro de las arterias coronarias, conocida como aterosclerosis15, que afecta las arterias musculares elásticas y grandes, en las que la formación de placa de ateroma es la lesión característica, que da lugar a la rigidez de los vasos y causa engrosamiento de la pared arterial16,17. Actualmente se sabe que este proceso patológico es una forma específica de proceso inflamatorio de carácter crónico, resultado de la interacción de las lipoproteínas plasmáticas (partículas con domino apo B), componentes celulares (monocitos/macrófagos, linfocitos T, células endoteliales, células musculares lisas) y la matriz extracelular de la pared arterial18. Para explicar la influencia de la diabetes en la formación de la placa se describe el proceso de la misma en pacientes sin/con diabetes.
Formación de la placa ateroscleróticaLa primera etapa es la estría de grasa; su origen es atribuido a la disfunción endotelial inducida por diversos factores, entre los que se encuentran las especies reactivas del oxígeno (ROS) y elevados niveles de lipoproteína de baja densidad (LDL)19. Las LDL transportan colesterol y ésteres de colesterol a la pared arterial. A nivel de la íntima arterial las LDL son retenidas por proteoglicanos (PG), que favorecen su modificación principalmente por oxidación, cambio que puede generarse por efecto de la fosfolipasa A2, que transporta las partículas de LDL o que es secretada por células inflamatorias en la lesión aterosclerótica20,21.
La modificación de las LDL por agregación se produce por acción del versicano, un tipo de PG producido por las células del músculo liso (VSMC), las cuales a su vez también producen el PG heparán sulfato (HS-PG), que actúa como receptor potencial para las lipoproteínas aterogénicas; finalmente, las VSMC producen colágeno y elastina. La elastina extraída de la íntima aterosclerótica tiene una mayor capacidad para unirse a LDL que la extraída de la íntima arterial sana22.
El LDL modificado estimula la producción de proteína quemotáctica de monocitos (MCP1, citoquina estimuladora del reclutamiento de monocitos) y activa los monocitos para entrar al espacio subendotelial, donde se convierten en macrófagos que producen citoquinas: como el factor de necrosis tumoral alfa e interleucina 1 beta (ILI-β), que junto con la interleucina 6 (IL6) inducen la activación de células T23. Por su lado, el factor de necrosis tumoral alfa estimula la expresión de moléculas de adhesión leucocitarias, como la molécula de adhesión vascular, VCAM-1 (que se une a un receptor del tipo de las integrinas, receptor VLA-4, expresado por monocitos y linfocitos), la selectina E24 y la intercelular-1 (ICAM-1). Una vez que los leucocitos se han adherido al endotelio reciben señales para penetrar hacia la pared arterial mediante un proceso denominado «migración directa de leucocitos» por la acción de citosinas o quimiocinas25.
Los macrófagos por fagocitosis y las VSMC por endocitosis captan las LDL modificadas y se convierten en células espumosas, que cuando fracasan en su trabajo de retirar todo el colesterol de la pared vascular se produce la apoptosis de los macrófagos y la liberación de colesterol hacia la pared vascular, y sobre todo de sustancias inflamatorias, como el factor tisular y las metaloproteasas, que vuelven vulnerables las lesiones ateroscleróticas26 con riesgo de rotura y oclusión arterial. Cabe señalar que a medida que la placa experimenta inflamación continua, degradación de matriz, hipoxemia, angiogénesis y muerte celular su capa fibrosa se adelgaza y su núcleo lipídico se necrosa. La delgada capa fibrosa y la gran base lipídica incrementan la tensión sobre la placa y la conducen al punto de transición de riesgo de ruptura27, en la que puede observarse depósito de calcio o el desarrollo de hemorragia intracelular28.
Cambios en la formación de la placa aterosclerótica en presencia de diabetesExiste relación directa entre los años de duración de la DM, sea insulinodependiente o no, y el riesgo de cardiopatía isquémica29,30, asociada a mayor infiltrado inflamatorio (macrófagos y linfocitos T), una base necrótica más grande y aterosclerosis más difusa en las arterias coronarias31. Rubio et al., en su estudio de 2008, evaluaron los niveles circulantes de moléculas de adhesión en pacientes con DT2, encontrando un aumento significativo en VCAM-1, ICAM-1 y selectina E en comparación con los pacientes no diabéticos32.
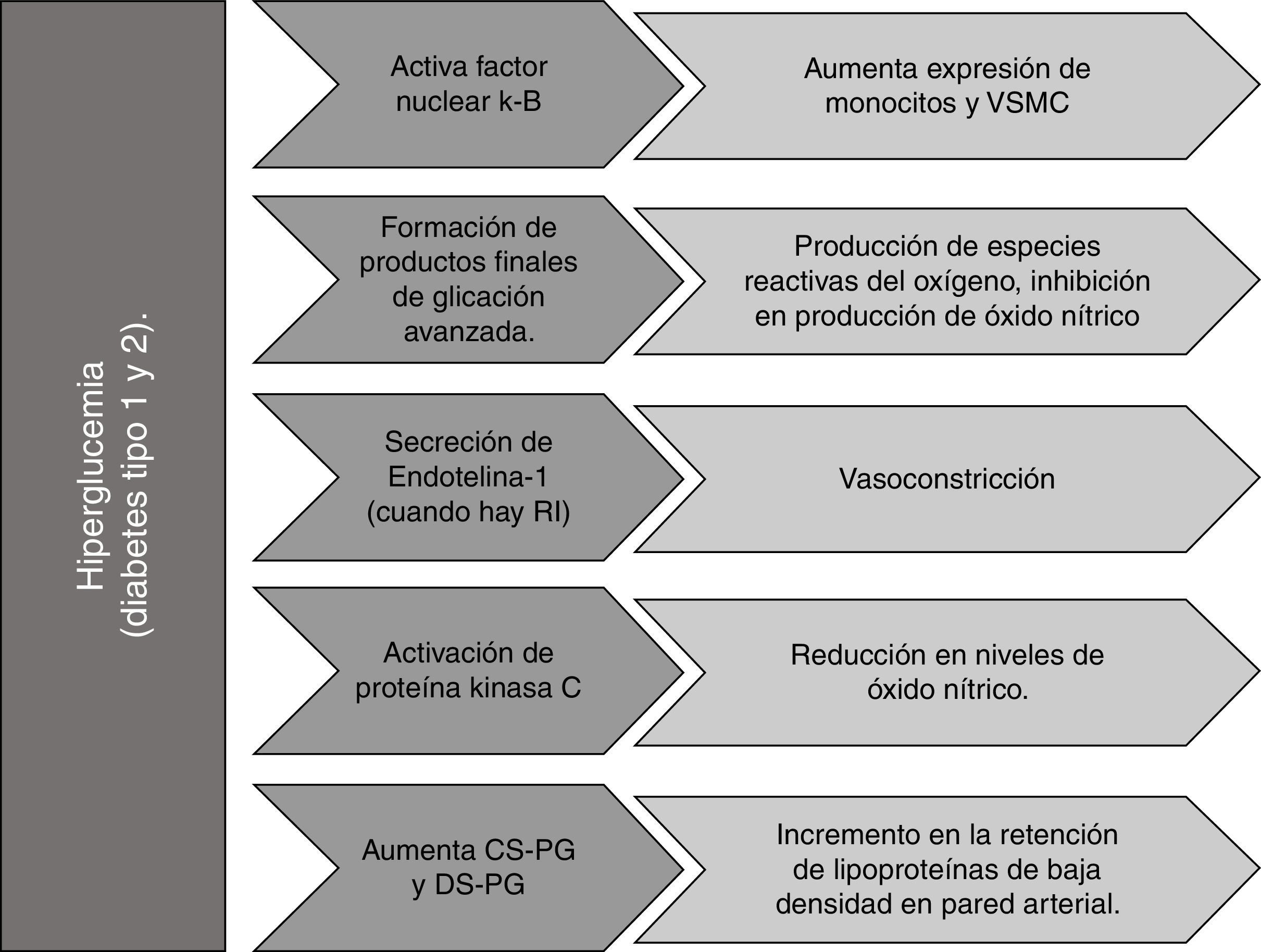
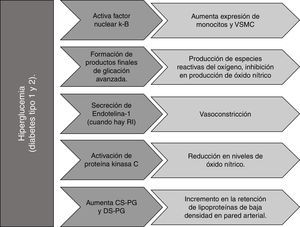
El paciente diabético desarrolla aterosclerosis de forma acelerada comparado con el no diabético, debido a un trastorno metabólico generalizado que incluye hiperglucemia (fig. 1), resistencia a la insulina (fig. 2), dislipidemia (fig. 3), pérdida de la función reguladora del endotelio, tendencia a la vasoconstricción y a un estado protrombótico33. La hiperglucemia por sí misma puede activar el factor nuclear κ-B (NFkB), capaz de incrementar la expresión de monocitos-macrófagos y VSMC; puede promover la generación de ROS que facilitan la oxidación de LDL, por acción de los productos finales de glicación avanzada (AGE) que se forman como resultado de una exposición prolongada de proteínas y lípidos a concentraciones elevadas de glucosa34. Así mismo, los receptores para los AGE desempeñan un rol central en el proceso de rotura de la placa35, y su sobreexpresión se asocia con aumento de reacción inflamatoria en macrófagos de placa de pacientes diabéticos36. Incluso, los picos posprandiales de glucosa (aun con niveles en ayuno controlados) aumentan tanto la aterogénesis como los eventos cardiovasculares37.
Las concentraciones elevadas de glucosa realzan la secreción endotelial de endotelina 1 (ET-1), que altera el balance entre óxido nítrico (NO) y ET-1, favoreciendo la vasoconstricción y la disfunción endotelial en condiciones de resistencia a la insulina (RI)38. Esta última se refiere a un impedimento en la acción de la insulina en diversos tejidos39, causado por la disminución de la sensibilidad tisular que provoca un incremento compensatorio de la secreción de la hormona denominado hiperinsulinemia40.
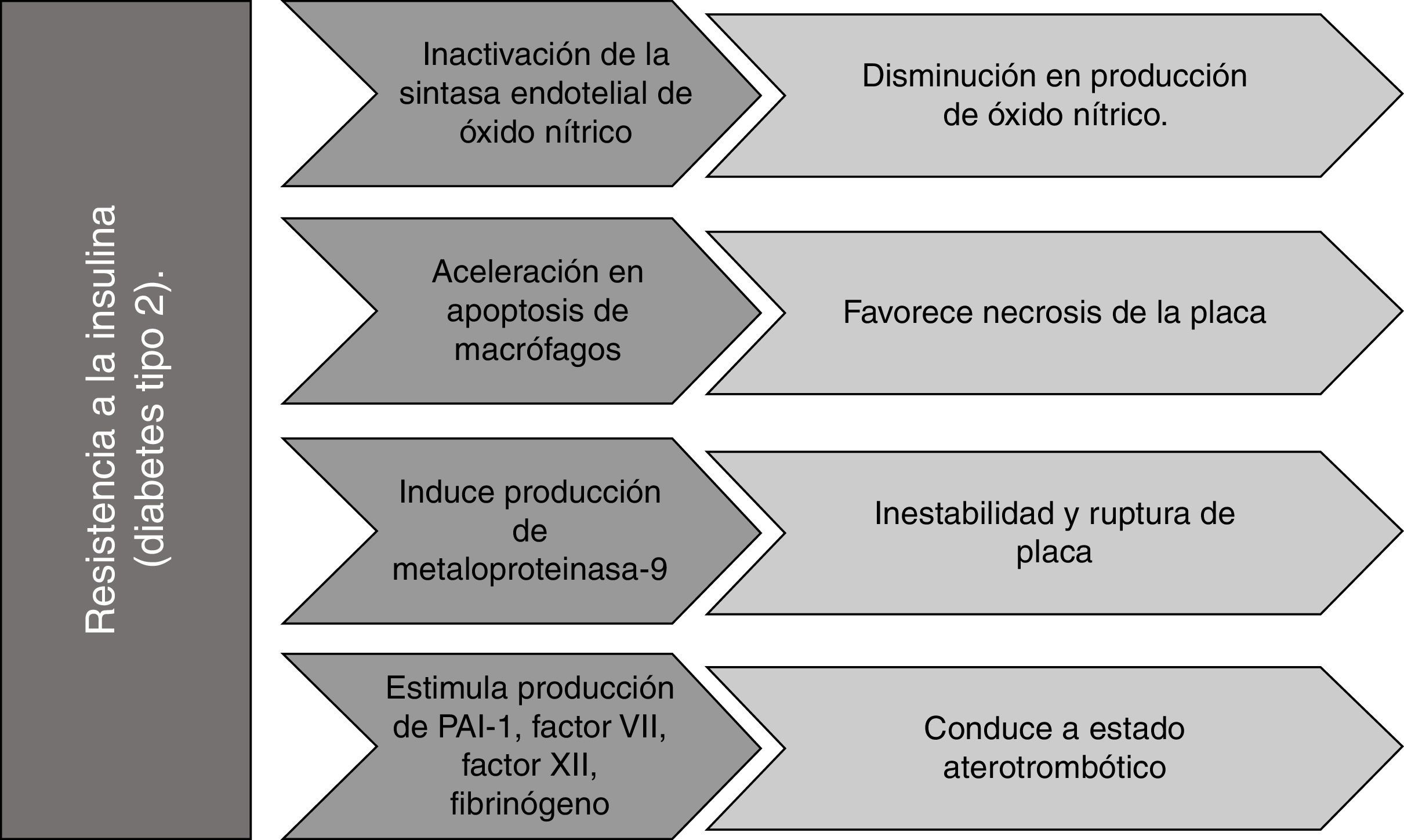
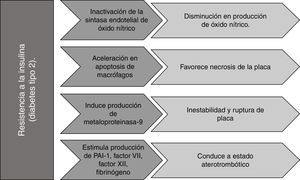
La hiperinsulinemia incrementa la actividad inflamatoria de leucocitos y podría favorecer la necrosis de la placa al acelerar la muerte de macrófagos (apoptosis), debido a la activación de estrés del retículo endoplásmico (RE)41, induciendo la producción de metaloproteinasa-9 (MMP-9), que es responsable de la inestabilidad y rotura de la placa. Así mismo podría desencadenar un estado aterotrombótico al incrementar la resistencia de plaquetas a agentes anti-agregantes, y al estimular la producción de factores pro-coagulantes, como el inhibidor del activador del plasminógeno-1 (PAI-1), factor vii, factor xii, fibrinógeno y activador tisular del plasminógeno41,42.
Por otro lado, la resistencia a la insulina puede causar inactivación de la sintasa endotelial de óxido nítrico (eNOS), disminuyendo la producción de NO cuya función es reducir la activación de integrinas de plaquetas y leucocitos, previniendo trombosis y adhesión leucocitaria, así como reducir la expresión de genes proinflamatorios dependientes de NFκB. La producción de NO también puede inhibirse por la acción de AGE que reducen la fosforilación serina de eNOS. Igualmente, la proteína quinasa C activada en condiciones de hiperglucemia puede reducir los niveles de NO al inducir un barrido dependiente de ROS1,43,44.
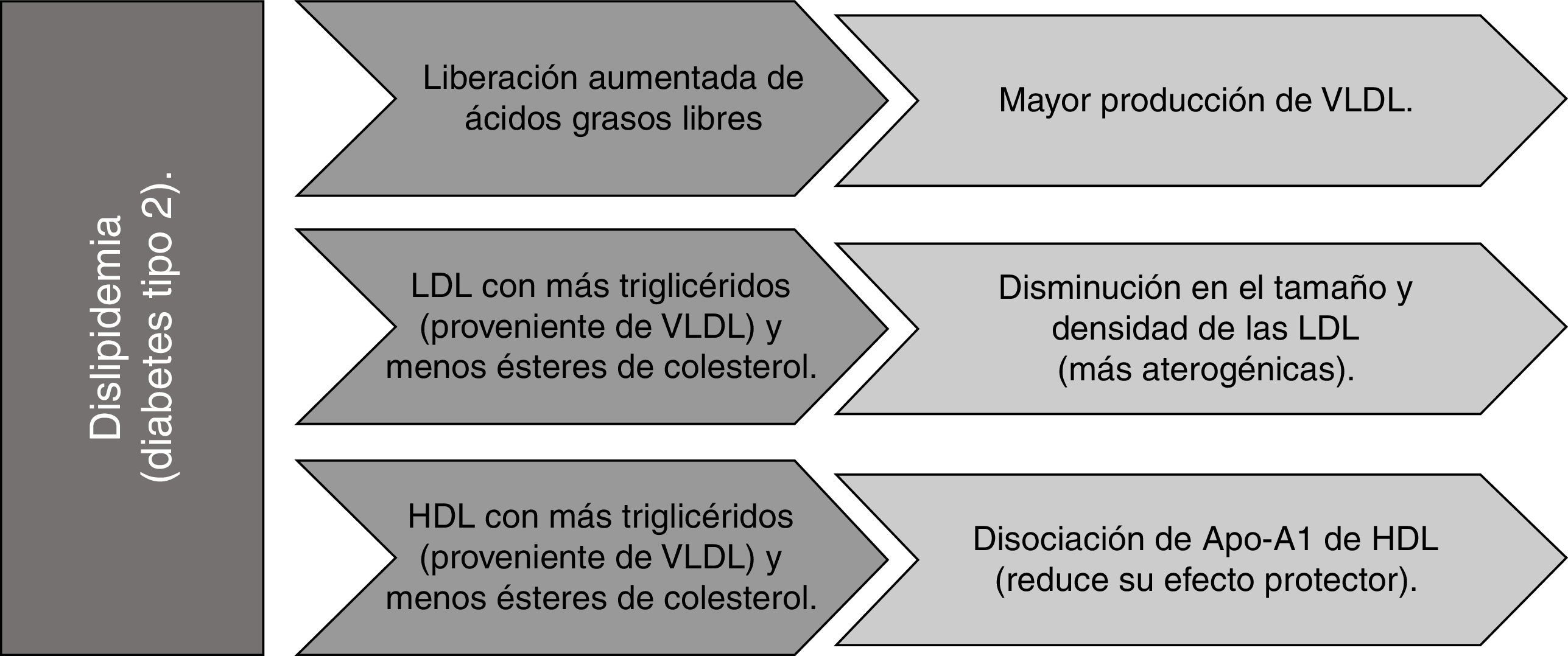
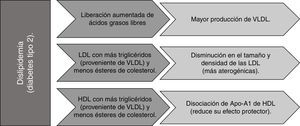
La RI en la diabetes mellitus está relacionada con la dislipidemia (observada como consecuencia del metabolismo alterado de las lipoproteínas hepáticas)45, que al nivel de los adipocitos aumenta la liberación de ácidos grasos libres (AGL) a la circulación. Este flujo incrementado de AGL al hígado estimula el ensamblaje y secreción de lipoproteínas de muy baja densidad (VLDL), produciendo una hipertrigliceridemia. Las VLDL intercambian, por acción de la proteína de transferencia de ésteres de colesterol (CETP) su contenido de triglicéridos (TG) por ésteres de colesterol (CE) de las LDL y de las lipoproteínas de alta densidad (HDL), el efecto en las primeras es una disminución de su tamaño y densidad (mayor probabilidad de oxidación y de penetración a la pared arterial), y en las segundas la disociación de la Apo-A1 reduce su habilidad para el transporte inverso de colesterol46.
Burke et al., en el año 2004, mencionan que diversos estudios muestran que el tamaño de la base necrótica en las arterias coronarias de sujetos que murieron repentinamente fue positivamente correlacionado con la presencia de diabetes, independientemente de otros factores47. El método de histología virtual basada en datos de ultrasonido intravascular reveló un incremento aproximado del 50% en la base necrótica en un grupo de diabéticos48. Estos descubrimientos plantean si los eventos celulares, particularmente la expansión de la necrosis de la placa como consecuencia de la acelerada apoptosis de macrófagos, unida a una eferocitosis defectuosa49, son situaciones potenciadas en la diabetes que conducen, en última instancia, a enfermedad vascular aterotrombótica acelerada50.
Se ha observado en lesiones ateroscleróticas de pacientes diabéticos un incremento en el contenido de los proteoglicanos condroitín sulfato (CS-PG) y dermatán sulfato (DS-PG), y una disminución del HS-PG en comparación con pacientes sin diabetes que resulta en un aumento de retención de LDL en la pared arterial34.
Composición de la base lipídica en la placa de pacientes con y sin diabetesPezeshkian y Mahtabipour, en su estudio de 2013, evaluaron el efecto de la diabetes mellitus sobre la composición de AGL en tejido adiposo epicárdico de 40 pacientes sin diabetes y 20 con diabetes. El principal ácido graso saturado (AGS) que encontraron, palmítico (16:0), mostró una reducción sustancial en pacientes con diabetes (p=0.021). Observaron en los mismos pacientes incremento del esteárico (18:0) (p = 0.003) y disminución del ácido linoleico conjugado (CLA) (p = 0.033) en comparación con los no diabéticos. El contenido de ácido araquidónico y su precursor el ácido linoleico (p=0.409 y p=0.630 respectivamente) no se afectaron por la diabetes. El ácido eicosapentaenoico (20:5n3) y el docosahexaenoico (22:6n3) mostraron una reducción del 50% en pacientes diabéticos51.
Mas et al., en 2010, caracterizaron la composición de ácidos grasos no esterificados en placas de ateroma carotídeas de pacientes con y sin DM, encontrando diferencias significativas en ácido linoleico, que fue consistentemente mayor en todas las muestras de diabéticos (p<0.05). También el ácido palmítico y ácido oleico (p<0.05) se observaron significativamente aumentados en las placas de los diabéticos52.
Stachowska et al., en su estudio de 2004, evaluaron placas de ateroma provenientes de la aorta abdominal, o la arteria iliaca o femoral en 31 pacientes varones sin diabetes con edades de 45 a 75 años, encontrando predominantemente de los AGS al palmítico, de los monoinsaturados (AGMI) oleico, poliinsaturados omega 6 (AGPI n-6) linoleico y poliinsaturado omega 3 (AGPI n-3) linolénico con un 20.64%, 29.85%, 18.56%, y 0.76% del área total de la placa, respectivamente; estos resultados coinciden con los de Mas et al. respecto al perfil de ácidos grasos encontrados en ausencia de diabetes53.
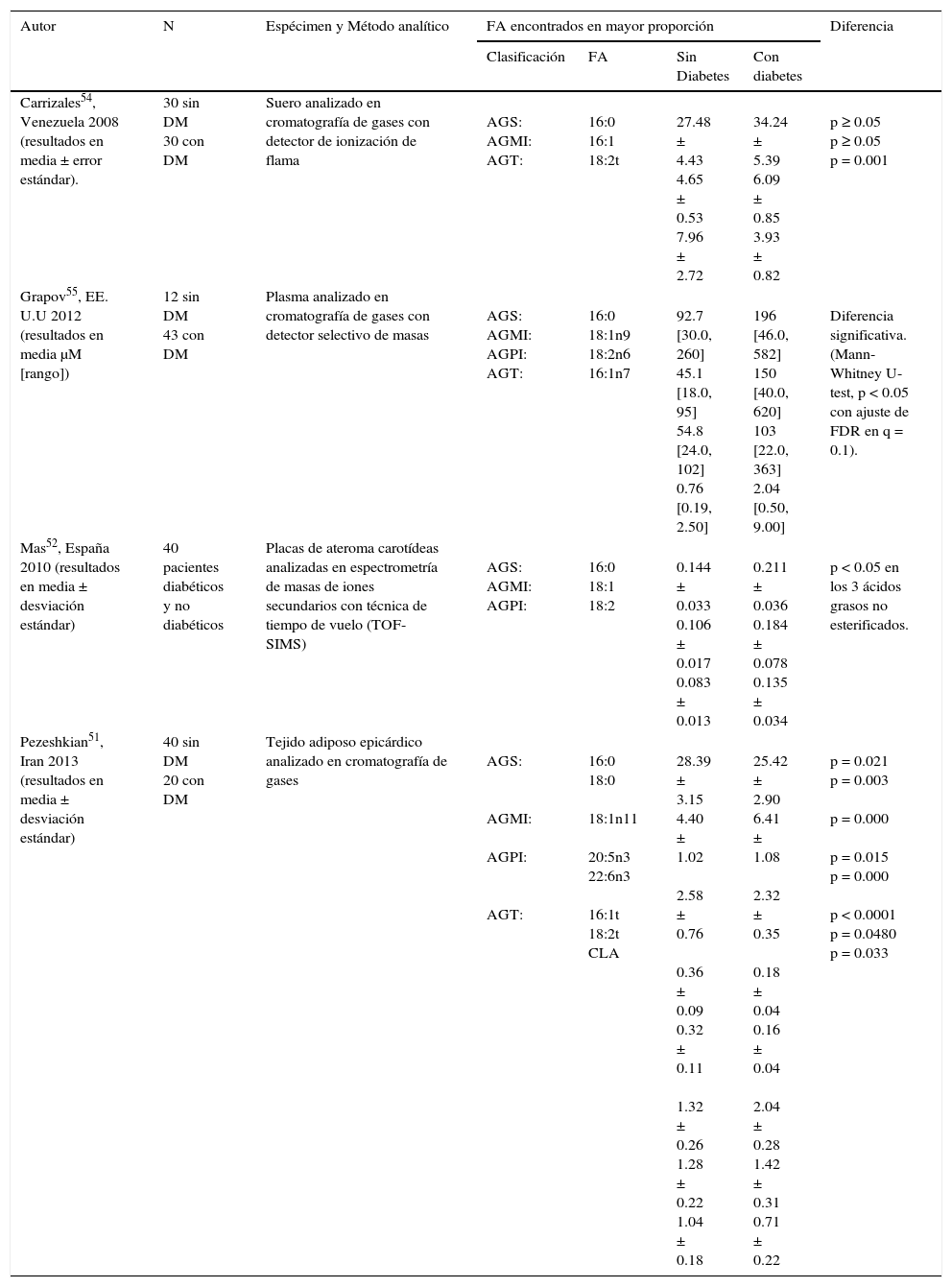
Existe incluso evidencia de contraste en el perfil de ácidos grasos en presencia o ausencia de diabetes en muestras sanguíneas, como lo expone Carrizales et al., que en 2008 evaluaron la composición sérica de ácidos grasos libres de 30 pacientes con diabetes y 30 individuos no diabéticos, observando que el porcentaje de los ácidos grasos trans (AGT) fue significativamente mayor (p=0.001) en los no diabéticos. El AGS y el AGMI que predominaron fueron el palmítico y palmitoleico respectivamente, sin diferencia significativa, concluyendo que los saturados aparecen con mayor porcentaje, seguidos por los monoinsaturados y poliinsaturados en ambos grupos de pacientes54. Por su parte, Grapov et al., en su estudio de 2012, señalan que los pacientes con DT2 (en comparación con los no diabéticos) mostraron un incremento del 114% de ácidos grasos no esterificados circulante, que fue positivamente correlacionado con los niveles de glucosa en ayuno, reportando en este grupo mayor cantidad de ácidos AGT, específicamente el palmitelaídico (tabla 1)55.
Comparación del perfil de ácidos grasos encontrados en muestras biológicas de pacientes con y sin diabetes
| Autor | N | Espécimen y Método analítico | FA encontrados en mayor proporción | Diferencia | |||
|---|---|---|---|---|---|---|---|
| Clasificación | FA | Sin Diabetes | Con diabetes | ||||
| Carrizales54, Venezuela 2008 (resultados en media ± error estándar). | 30 sin DM 30 con DM | Suero analizado en cromatografía de gases con detector de ionización de flama | AGS: AGMI: AGT: | 16:0 16:1 18:2t | 27.48 ± 4.43 4.65 ± 0.53 7.96 ± 2.72 | 34.24 ± 5.39 6.09 ± 0.85 3.93 ± 0.82 | p ≥ 0.05 p ≥ 0.05 p = 0.001 |
| Grapov55, EE. U.U 2012 (resultados en media μM [rango]) | 12 sin DM 43 con DM | Plasma analizado en cromatografía de gases con detector selectivo de masas | AGS: AGMI: AGPI: AGT: | 16:0 18:1n9 18:2n6 16:1n7 | 92.7 [30.0, 260] 45.1 [18.0, 95] 54.8 [24.0, 102] 0.76 [0.19, 2.50] | 196 [46.0, 582] 150 [40.0, 620] 103 [22.0, 363] 2.04 [0.50, 9.00] | Diferencia significativa. (Mann-Whitney U-test, p < 0.05 con ajuste de FDR en q = 0.1). |
| Mas52, España 2010 (resultados en media ± desviación estándar) | 40 pacientes diabéticos y no diabéticos | Placas de ateroma carotídeas analizadas en espectrometría de masas de iones secundarios con técnica de tiempo de vuelo (TOF-SIMS) | AGS: AGMI: AGPI: | 16:0 18:1 18:2 | 0.144 ± 0.033 0.106 ± 0.017 0.083 ± 0.013 | 0.211 ± 0.036 0.184 ± 0.078 0.135 ± 0.034 | p < 0.05 en los 3 ácidos grasos no esterificados. |
| Pezeshkian51, Iran 2013 (resultados en media ± desviación estándar) | 40 sin DM 20 con DM | Tejido adiposo epicárdico analizado en cromatografía de gases | AGS: AGMI: AGPI: AGT: | 16:0 18:0 18:1n11 20:5n3 22:6n3 16:1t 18:2t CLA | 28.39 ± 3.15 4.40 ± 1.02 2.58 ± 0.76 0.36 ± 0.09 0.32 ± 0.11 1.32 ± 0.26 1.28 ± 0.22 1.04 ± 0.18 | 25.42 ± 2.90 6.41 ± 1.08 2.32 ± 0.35 0.18 ± 0.04 0.16 ± 0.04 2.04 ± 0.28 1.42 ± 0.31 0.71 ± 0.22 | p = 0.021 p = 0.003 p = 0.000 p = 0.015 p = 0.000 p < 0.0001 p = 0.0480 p = 0.033 |
AGMI: ácidos grasos monoinsaturados; AGPI: ácidos grasos poliinsaturados; AGS: ácidos grasos saturados; AGT: ácidos grasos trans; CLA: ácido linoleico conjugado; DM: diabetes mellitus.
Fuente: propia por recopilación de investigaciones de diversos autores.
Los AGS son el componente dietético que más aumenta el colesterol LDL56; se encuentran principalmente en la carne de res, carnero y en la mantequilla, entre otros57. Además Buscemi et al. mencionan que un patrón dietético no saludable (caracterizado por un consumo elevado de refrescos, alimentos fritos, embutidos, carnes rojas y dulces) se asocia con una elevación significativa de la relación triglicérido/colesterol de alta densidad (Tg/HDL), mientras que el patrón de dieta mediterránea se asocia con una menor resistencia a la insulina58. Se ha observado que los AGS de cadena larga (como el palmitato y estearato) inducen la producción de citosinas proinflamatorias en macrófagos humanos, lo que podría contribuir a su activación en las placas ateroscleróticas, especialmente en la DT259. De igual manera, los AGT de la dieta incrementan el contenido de colesterol en macrófagos conduciendo a una marcada formación de la placa aterosclerótica60, y tienen un efecto adverso sobre el perfil lipídico, similar a las grasas saturadas que elevan las concentraciones séricas de los triglicéridos de las LDL y de la lipoproteína a61.
Existen otros tipos de ácidos grasos llamados insaturados, que a su vez se clasifican en AGMI y AGPI62: los AGPI esenciales (porque el cuerpo humano no lo sintetiza) son el linoleico precursor de la familia omega 6 (n-6) y el alfa-linolénico de la familia omega 3 (n-3). Al primero se le ha atribuido efectos proinflamatorios y protrombóticos, no obstante, también parece tener propiedades antitrombóticas y de disminuir las arritmias63, mientras que al segundo se le atribuye efecto antiaterosclerótico64,65 y protección contra enfermedad cardiovascular, especialmente infarto de miocardio y muerte súbita cardiaca. Por lo anterior, algunos autores recomiendan la ingesta de n-3 como el eicosapentaenoico (EPA) y docosahexaenoico (DHA) debido a que previenen el aumento de triglicéridos y colesterol en plasma66,67. Esta protección cardiovascular de los AGPI n-3 puede ocurrir independientemente de su efecto hipolipidemiante, ya que son antiinflamatorios y antiarrítmicos, lo que mejora la función endotelial67, además el bajo nivel en suero de DHA se ha relacionado con la progresión de aterosclerosis coronaria68.
Con respecto a los AGMI su ingesta disminuye el LDL sin afectar los niveles de colesterol HDL (que tiene efectos antioxidantes, antiapoptópicos, antiinflamatorios, antitrombóticos o antiproteolíticos56), especialmente el ácido oleico, por lo que su consumo resulta beneficioso en la disminución del riesgo aterogénico69.
La evidencia científica revisada recomienda, de manera general, disminuir el consumo de carnes rojas, principalmente procesadas, reducir el consumo de grasas saturadas y sobre todo las trans (que se encuentran en margarinas y mantecas, en aceites de uso doméstico e industrial, en productos horneados y en una gran variedad de alimentos del tipo bocadillos)70, así como estimular el consumo de cereales integrales (para aumentar el consumo de la fibra, que retrasa la absorción de grasa, colesterol y glucosa)71, frutas, vegetales, pescado y aceite de pescado (por su riqueza en EPA y DHA)72. Por otra parte, la ingesta de nutrientes, como el sodio proveniente de la dieta, se ha asociado tanto con el aumento de la acumulación de placa como con la supresión de aterogénesis (según la cantidad de su consumo) por activación o inactivación del sistema renina-angiotensina-aldosterona73. Además, el seguimiento de dichas recomendaciones aunadas a la realización de ejercicio físico serían de ayuda para prevenir la lipotoxicidad, mejorar la resistencia a la insulina y los niveles de adipoquinas en las personas con obesidad74.
ConclusionesEn esta revisión se encontraron diferencias en el perfil de ácidos grasos de muestras biológicas entre pacientes diabéticos y no diabéticos con aterosclerosis, enfermedad que afecta a ambos; en los primeros se observó mayores concentraciones de ácidos grasos del tipo omega 6 y 9, con bajo contenido de los omega 3, principalmente de EPA y DHA, en comparación con los no diabéticos, lo que sugiere que los cambios metabólicos de la DM afectan negativamente el inicio y el Rosario: que ayude a prevenir complicaciones vasculares, sobrepeso y obesidad (principales factores de riesgo modificables de la DM), sin omitir un adecuado control de glucosa en sangre en pacientes que ya han sido diagnosticados de diabetes para evitar otras complicaciones de salud graves como la ceguera, el fallo renal, la amputación de las extremidades inferiores y la muerte prematura.
FinanciaciónFinanciación interna por la Universidad Autónoma de Tamaulipas.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Se agradece el apoyo proporcionado por la Universidad Autónoma de Tamaulipas.