La fibrilación auricular (FA) es una causa frecuente de tromboembolia periférica, en especial al sistema nervioso central. Es la arritmia cardiaca más frecuente y se calcula que cada vez habrá más enfermos con este padecimiento, debido al incremento de la población de edad avanzada. Los antagonistas de la vitamina K (AVK) han mostrado ser eficaces en la prevención de las complicaciones embólicas de la FA y han estado disponibles por más de cincuenta años.1 Interfieren con la reutilización de la vitamina K en los hepatocitos y disminuyen la actividad de los factores VII, IX, X y II de la coagulación. Tienen limitantes que repercuten en la calidad de vida del enfermo: las variaciones en el contenido de vitamina K en la dieta y en su producción por la flora intestinal afectan la respuesta anticoagulante. Numerosos medicamentos interfieren y debido al estrecho margen de acción, con facilidad producen sobre-anticoagulación o anticoagulación insuficiente, que lleva riesgos en términos de seguridad y eficacia. Para lograr el control, ha sido necesario crear organizaciones de vigilancia denominadas clínicas de anticoagulantes en las que los enfermos son sometidos a punciones venosas o capilares para realizar el tiempo de protrombina y hacer ajuste en la dosis.
Los nuevos anticoagulantes orales (NAC) no tienen tales inconvenientes, ya que inhiben selectivamente a un factor de la coagulación y su farmacodinámica y farmacocinética permiten concentraciones plasmáticas estables para administrar dosis fijas que evitan las fluctuaciones individuales del grado de anticoagulación. Prácticamente carecen de interacción con otros medicamentos y con la dieta.2
Objetivos farmacológicos de los NAC
Dos han sido los objetivos terapéuticos de esta nueva generación de fármacos: los factores Xa y IIa (trombina) de la coagulación. El factor Xa lleva a cabo la generación de trombina, conjuntamente con un cofactor que acelera su acción enzimática (factor Va). Con fosfolípidos y calcio, integra un complejo enzimático (protrombinasa) que escinde a la molécula de protrombina para producir trombina, la enzima que transforma el fibrinógeno en fibrina. La inhibición del factor Xa disminuye la generación de trombina. Existe debate en torno a las ventajas farmacológicas de inhibir a cada uno de ellos. Se postula que al inhibir al factor Xa se disminuye el potencial de trombina, ya que el factor Xa es uno de los puntos cruciales que amplifican las reacciones de coagulación, debido a que es activado tanto por la vía del factor tisular, como por la vía intrínseca de la coagulación a través del factor IX.3 La teoría celular de la coagulación establece que el factor IX es también activado por el factor VIIa, con lo cual, las dos vías de activación de la coagulación conducen a la producción de factor Xa. Se postula que es más fácil inhibir la producción de trombina, que a la trombina ya producida. Además, al factor Xa no se le han encontrado funciones diferentes de la producción de trombina.
Por otra parte, la trombina tiene numerosas acciones sobre la respuesta hemostática y se le considera la gran molécula reguladora. Se sabe que existen dos etapas en su producción. La primera es una aparición temprana, en escasa concentración, que surge mediante la activación de los factores VIIa y Xa. Su función es asegurar su propia producción en cantidades mayores. Ésta se logra activando, sobre la superficie de las plaquetas, a dos cofactores de la coagulación: los factores VIII y V, que tienen una función aceleradora para amplificar la respuesta enzimática de los factores IXa (diez-asa) y Xa (protrombinasa), respectivamente. La trombina activa más plaquetas y crea una superficie de fosfolípidos más extensa para optimizar la actividad pro-coagulante de los complejos enzimáticos ya mencionados. También escinde las cadenas α y β del fibrinógeno para iniciar la polimerización de la fibrina y activa al factor XIII, con lo que el coágulo se hace insoluble y adquiere resistencia. La trombina tiene numerosas funciones más allá de la coagulación: estimula la respuesta inflamatoria y la quimiotaxis de linfocitos, monocitos y neutrófilos; produce contracción de los vasos sanguíneos y activa al inhibidor de la fibrinólisis activable por trombina (TAFI, por sus siglas en inglés), molécula que evita la disolución temprana del coágulo, además de activar a la proteína C de la coagulación, que detiene la acción de los factores VIIIa y Va. La trombina es una molécula versátil, con propiedades pro-coagulantes y anticoagulantes, inflamatorias y anti-inflamatorias, fibrinolíticas y antifibrinolíticas.4,5 Los inhibidores directos de la trombina son compuestos que antagonizan la región catalítica de la trombina o el exositio por el que se une a sustratos. Los hay de origen endógeno, así como naturales, análogos de los sustratos naturales y de origen sintético o recombinante. Después del ximelagatrán, que fue descontinuado por sus efectos hepatotóxicos, han aparecido el dabigatrán y el efegatrán. Los efectos antifibrinolíticos de estos compuestos tienen importancia desde el punto de vista clínico, ya que a pesar de su potente efecto anticoagulante, la disminución de la función fibrinolítica podría asociarse a fenómenos trombóticos.6
Nuevos anticoagulantes orales
Etexilato de dabigatrán: es un inhibidor potente, selectivo y reversible de la trombina, que en varios países ha sido aprobado para la prevención de enfermedad tromboembólica venosa en cirugía de cadera y rodilla así como en la FA. Después de su absorción intestinal es convertido por una esterasa sérica a dabigatrán. Es eliminado en 80% por vía renal y tiene una vida media plasmática de 12 a 17 horas. La inhibición de la trombina es dependiente de la dosis y, en forma secundaria, también disminuye la agregación plaquetaria inducida por trombina, mas no así la dependiente de ácido araquidónico, colágena y ADP. Alcanza una rápida concentración en el plasma (75 a 90 minutos) y no se ha observado acumulación en la administración repetida, pues la eliminación renal se logra en siete o nueve horas. No tiene interacción con medicamentos como atorvastatina, diclofenaco o digoxina, aunque su biodisponibilidad puede aumentar con la administración simultánea de amiordarona, en cuyo caso se recomienda disminuir la dosis entre 50% y 60%. El pH gástrico elevado disminuye la biodisponibilidad de 20% a 30%, como se ha observado en caso de administrarlo con pantoprazol. La dieta no afecta la biodisponibilidad. Su eficacia en la prevención de embolia en la FA ha sido demostrada en el estudio RE-LY (The Randomizad Evaluation of Long Term Anticoagulation Therapy),7 que comparó dos dosis fijas de dabigatrán: 110 mg y 150 mg dos veces al día (2/d) vs. warfarina en 1811 enfermos que tenían riesgo de eventos embólicos por FA. La tasa de eventos fue de 1.71% en el grupo de warfarina, 1.54% en el grupo de dabigatrán a 110 mg y 1.11% con la dosis de 150 mg, lo que significa que la dosis de 110 mg/2/d no es inferior a warfarina y la dosis de 150 mg/2/d es superior. Los eventos hemorrágicos cerebrales fueron significativamente menos frecuentes en los grupos con dabigatrán (150 o 110 mg/2/d) que en el grupo de warfarina (0.10%, 0.12% y 0.38% respectivamente) y la frecuencia de hemorragia mayor, fue de 3.57% en el grupo de warfarina vs. 2.87% y 3.22% entre los que recibieron 110 mg o 150 mg de dabigatrán. La FDA aprobó la dosis de 150 mg/2/d como una alternativa a warfarina en los enfermos con FA y factores de alto riesgo tromboembólico, con reducción de la dosis a 75 mg/2/d en caso de insuficiencia renal.
Rivaroxabán: es un inhibidor potente y selectivo del factor Xa, con una vida media en el plasma de cinco a nueve horas. La intensidad de inhibición y, por lo tanto, la generación de trombina, es dependiente de la dosis, lo cual significa que dosis elevadas podrían comprometer la coagulación. Se elimina por vía renal y no se ha observado interacción con medicamentos como el ácido salicílico, hidróxido de aluminio y magnesio, ranitidina o naproxeno. Su biodisponibilidad se incrementa con los inhibidores del citocromo CYP3A4/p-gp -como el ketoconazol y el ritonavir- y disminuye con la rifampicina. La biodisponibilidad sólo aumenta marginalmente con los alimentos.8 En el estudio ROCKET-AF se compara rivaroxabán a dosis de 20 mg/d vs. warfarina a dosis ajustadas en enfermos con alto riesgo de tromboembolia por FA, con un riesgo promedio en la escala CHADS de 3.47. Se presentaron eventos de embolia al SNC o sistémica en 1.7% por año en el grupo de rivaroxabán vs. 2.2% en el grupo de warfarina, con lo que se ha cumplido el criterio de no inferioridad. La frecuencia de hemorragia cerebral fue menor con rivaroxabán.9,10
Una revisión reciente ha mostrado que, por lo menos en el caso de prevención de enfermedad tromboembólica venosa, el rivaroxabán tiene mayor tendencia a producir hemorragia.11
Apixabán: Es un inhibidor reversible y selectivo del factor Xa, cuya potencia depende de la concentración plasmática. Tiene mayor afinidad por el factor Xa unido al coágulo que al que se encuentra libre. Inhibe y retrasa la generación de trombina sin afectar significativamente la agregación plaquetaria.12 La concentración plasmática máxima ocurre entre 30 y 120 minutos y no afecta la farmacocinética de la digoxina administrada concomitantemente. El estudio AVERROES13 comparó apixabán 5 mg/2/d vs. aspirina en 5599 enfermos con FA con riesgo de embolia, que no podían recibir warfarina. Se observaron 1.6% de eventos embólicos cerebrales y sistémicos en el grupo de apixabán vs. 3.5% en el grupo de aspirina, con una frecuencia similar de hemorragia (1.4 vs. 1.2% por año, respectivamente). La mortalidad fue menor en el grupo de apixaban (3.5% por año) que en el de aspirina (4.4% por año), resultados que corroboran el mayor beneficio del tratamiento anticoagulante en FA. El estudio ARISTOTLE comparó apixabán 5 mgs/2/d vs. dosis ajustadas de warfarina en 18,201 enfermos con FA de alto riesgo de embolia sistémica y cerebral. Los eventos vasculares cerebrales fueron de 1.27% por año en el grupo de apixabán vs. 1.60% en el grupo de warfarina, con hemorragia de 2.13% vs. 3.09% por año, respectivamente. La mortalidad por cualquier causa fue 3.52% vs. 3.94%, lo que demuestra una superioridad del apixabán frente a warfarina en la prevención de embolia al sistema nervioso central o sistémica, menos complicaciones hemorrágicas y menor mortalidad.
Hipercoagulabilidad en fibrilación auricular
Es bien conocida la participación de la trombina en la enfermedad cardiovascular y en los fenómenos inflamatorios asociados a la aterosclerosis,14 pero se conoce menos sobre los cambios de hipercoagulabilidd en la fibrilación auricular, asociada a un elevado riesgo de eventos embólicos por una tendencia trombogénica.15,16 Los cambios del flujo sanguíneos en la FA son evidentes mediante el ecocardiograma, fenómeno que se conoce como contraste espontáneo y que se relacionan con estasis en la aurícula izquierda. También se ha descrito denudación endocárdica, alteraciones estructurales de la aurícula a medida que progresa la dilatación y cambios en el sistema hemostático, activación plaquetaria, incremento de algunos factores de coagulación e inflamación. La insuficiencia cardiaca congestiva cursa con un estado de hipercoagulabilidad, en particular cuando existe dilatación de todas las cavidades cardiacas y una disminución en la contractilidad. El fenómeno ha llamado la atención de los investigadores y aún falta mucho por conocer sobre el estado hipercoagulable en la insuficiencia cardiaca (IC), así como los resultados de los diferentes medicamentos anticoagulantes.17 Se ha estudiado el ritmo circadiano de algunos componentes del sistema hemostático en individuos sanos y en pacientes con cardiopatías: el FvW tiene una variación hasta de 10%, lo que influye en la agregabilidad plaquetaria. Las plaquetas se incrementan durante la mañana y su actividad aumenta con la actividad física, en especial después de haberse levantado. También en las primeras horas del día se han registrado las concentraciones más altas de algunos marcadores de activación de la coagulación, como el fragmento 1+2 de la protrombina, el factor VIIa y el fibrinógeno. La inhibición del sistema fibrinolítco es más intensa por la mañana debido a un incremento del PAI-1 (inhibidor del activador tisular del plasminógeno) y algunos estudios sugieren que estas variaciones circadianas del sistema hemostático son responsables del incremento en la incidencia de eventos cardiovasculares en la madrugada.18
La FA permanente se asocia a un incremento significativo de los niveles plasmáticos de FvW, fibrinógeno y p-selectina en comparación con individuos sanos y enfermos con FA paroxística. Los pacientes con FA persistente tienen incremento significativo del FvW y de fibrinógeno pero no de la p-selectina, en tanto que los enfermos con FA paroxística tienen niveles de p-selectina y fibrinógeno incrementados, pero no de FvW. La duración de la arritmia por más de tres meses, es un predictor independiente para encontrar anomalías en estos tres indicadores hemostáticos. Se ha encontrado mayor prevalencia de la mutación Leyden del factor V y de la mutación 20210A de la protrombina. Estas alteraciones contribuyen significativamente a un estado de hipercogulabilidad en pacientes con FA.19 En un estudio que incluyó 69 enfermos con FA crónica, 23 con FA paroxística y 23 con FA persistente, se encontró un incremento significativo del FvW, de la pselectina y del fibrinógeno, comparado con los controles sanos. Las diferencias significativas en el estado protrombótico se observaron en los enfermos con FA permanente y paroxística cuando se compararon con los pacientes con FA persistente o controles en ritmo sinusal. La cardioversión y la FA persistente no alteraron significativamente los índices de hipercoagulabilidad en los siguientes tres meses en que se mantuvieron en ritmo sinusal.20 También se ha encontrado que los enfermos con FA crónica incrementan el fibrinógeno y el FvW durante el ejercicio exhaustivo, aunque éste parece no tener una influencia significativa sobre la disfunción endotelial o la activación plaquetaria.21 En un estudio de 70 pacientes con FA que se compararon con 46 individuos con otras enfermedades y 36 individuos sanos, se encontró un incremento significativo de las micropartículas plaquetarias y en la p-selectina en los primeros dos grupos, comparados con los controles sanos. No se encontraron diferencias en los niveles de micropartículas entre los enfermos con FA permanente o paroxística ni con aquellos enfermos que recibían aspirina o warfarina. Tampoco se observó correlación entre los niveles de micropartículas y de p-selectina y las características clínicas de los enfermos que podían haber contribuido al riesgo de evento vascular cerebral asociado a FA. Las conclusiones del estudio establecen que hay evidencia objetiva de activación plaquetaria durante la FA, pero que esto se debe más a la enfermedad cardiovascular subyacente que a la propia arritmia.22
En otro estudio, que comparó 103 enfermos con FA paroxística contra 87 individuos sanos, se encontró un incremento significativo del volumen plaquetario medio, de la proteína C reactiva y de la velocidad de sedimentación globular en los pacientes con FA, lo que indica que los marcadores de inflamación se relacionan con el mayor volumen de las plaquetas circulantes en este grupo de pacientes.23 En otro estudio que incluyó un reducido número de enfermos con FA paroxística sometidos a ablación y mediante catéter de radiofrecuencia, se encontró una activación plaquetaria en los primeros minutos después de la FA, detectada por un incremento significativo de la p-selectina, generación local de trombina, así como del fragmento 1+2 de la protrombina, que demuestran tanto activación hemostática como plaquetaria.24 Los resultados de los estudios sobre el volumen plaquetario medio en la FA han sido contradictorios, debido a que no se han logrado reproducir los mismos datos. Un estudio reciente realizado en 205 pacientes no encontró relación del volumen plaquetario medio con trombos intracavitarios en la FA.25 Por otra parte, tanto en individuos con FA como con insuficiencia cardiaca crónica estable, el ejercicio exhaustivo incrementa el fibrinógeno y varios marcadores hemostáticos.26,27
Evaluación del riesgo de tromboembolia y hemorragia para decidir el tratamiento anticoagulante en la FA
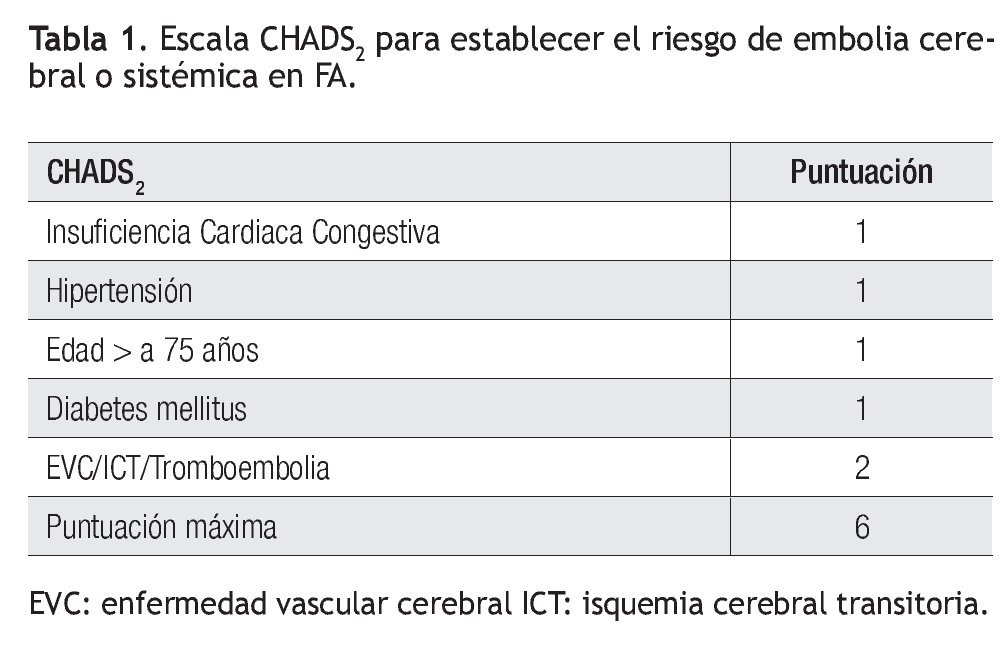
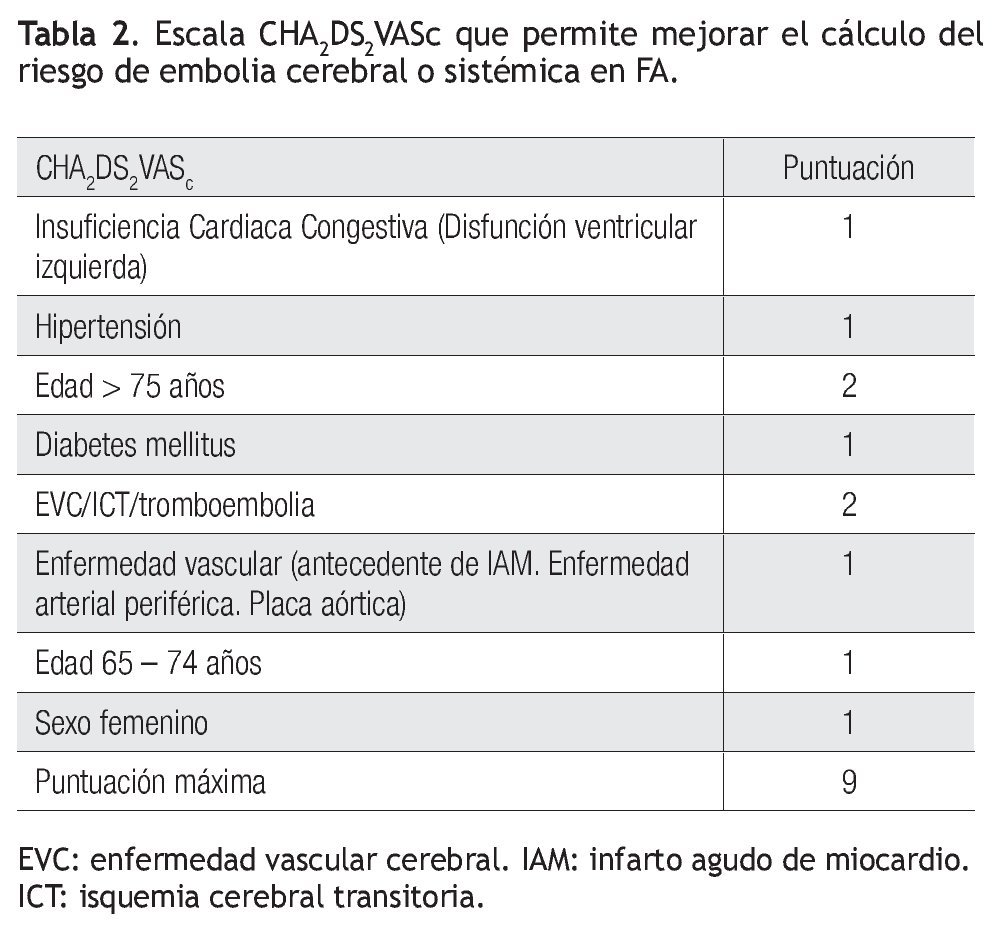
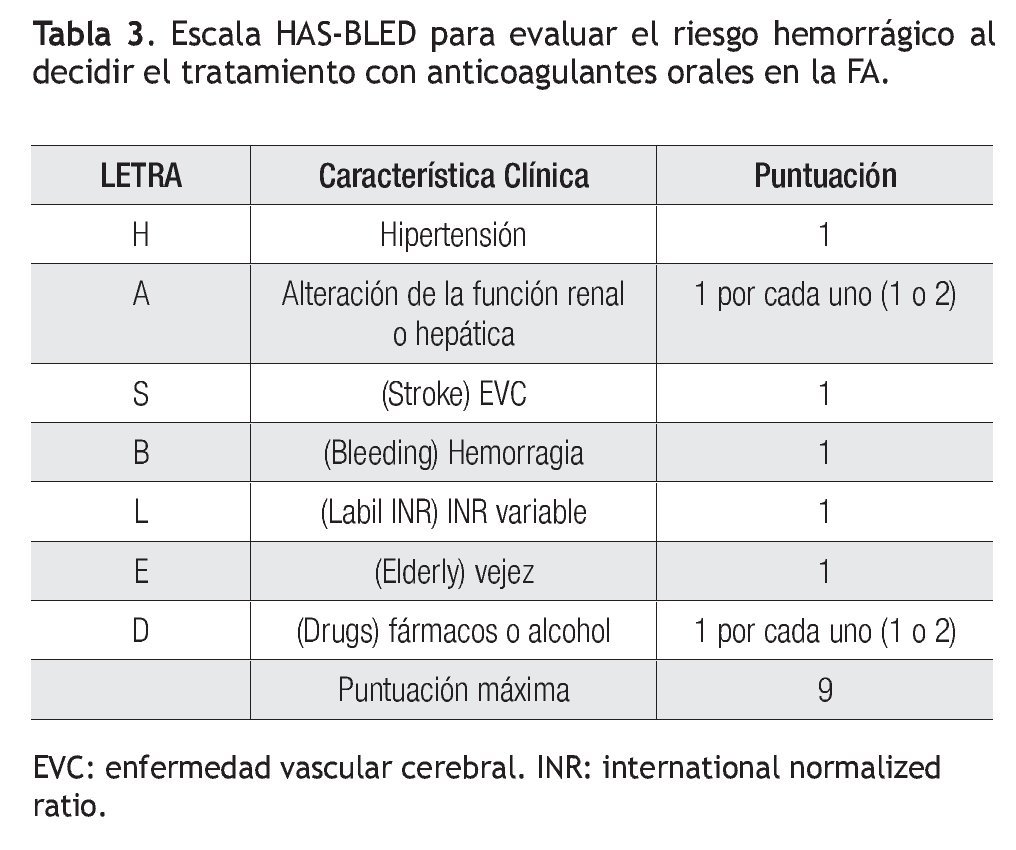
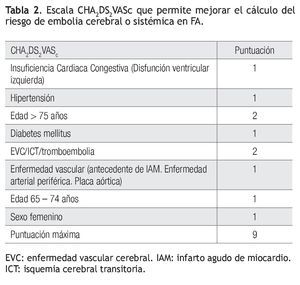
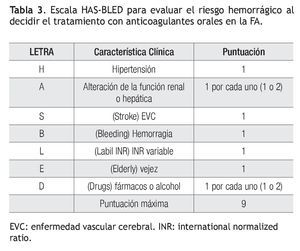
Recientemente se han propuesto escalas para valorar el riesgo de embolia y de hemorragia en los enfermos con FA. El riesgo de EVC se clasifica en bajo, moderado y alto, mediante los factores28 que se resumen en la escala CHADS2 (Tabla 1).29 Los pacientes con calificación de cero tienen bajo riesgo, los que tienen más de 2 se consideran de alto riesgo y el grupo con 1 es de riesgo intermedio. Los enfermos de alto riesgo deben recibir anticoagulantes orales y los de bajo riesgo, aspirina. Habría que considerar cualquiera de los dos tratamientos para los de riesgo intermedio. Una nueva escala, denominada CHA2DS2-VASc es más refinada al adicionar otros factores de riesgo (Tabla 2). Los enfermos con calificación de 0 son de bajo riesgo verdadero y probablemente no deberían ser tratados. Todos los demás, que corresponden a 1 o más puntos, deben ser considerados para anticoagulación oral, estableciendo el riesgo de hemorragia mediante la escala HAS-BLED (Tabla 3).30
Si un enfermo tiene calificación de menos de 2 en la escala CHADS2, se evalúa, además, con la modificación CHA2DS2-VASc, aunque ésta podría aplicarse directamente: si la puntuación es de cero, no está indicado el tratamiento antitrombótico y si tiene 1 punto, se prefiere administrar ACO en vez de aspirina. En caso de una puntuación CHADS2 igual o mayor de 2, el tratamiento también es con ACO. En caso de usar dabigatrán, la dosis es de 150 mg/2/d en los pacientes con riesgo bajo de hemorragia (escala HAS-BLED de 0 a 2) y de 110 mg/2/d en los enfermos con mayor riesgo hemorrágico (HAS-BLED ≥ 3). En pacientes con CHA2DS2-VASC = 1, posiblemente se pueda considerar también dabigatrán a dosis de 110 mg/2/d. Los pacientes con CHA2DS2-VASc = 0 tienen menor riesgo de embolia y se podrían dejar con aspirina o sin tratamiento, ya que no se ha demostrado algún beneficio en ese grupo.31
Recientemente se ha publicado una actualización para el tratamiento anticoagulante de los pacientes con FA permanente o paroxística, en el que se incluye a dabigatrán, siempre que no exista una prótesis valvular, ni enfermedad valvular con repercusión hemodinámica, ni insuficiencia renal grave (depuración de creatinina menor a 15 mL/minuto), ni hepatopatía.32 Este nuevo anti-coagulante es una alternativa a la warfarina para prevenir EVC y tromboembolia sistémica.
¿Deben vigilarse por el laboratorio los nuevos ACO?
Uno de los objetivos de los nuevos anticoagulantes orales es simplificar su empleo y no realizar pruebas de laboratorio para vigilar su acción; sin embargo, existen situaciones clínicas en que el médico desearía conocer el estado de la coagulación de algún paciente. En casos de hemorragia asociada a trauma, cirugía de urgencia o la aparición de complicaciones hemorrágicas durante el tratamiento con estos nuevos fármacos, tal vez sería necesario conocer inmediatamente el estado de la coagulación; o en los casos de cambiar de tratamiento anticoagulante o establecer si algún medicamento afecta la respuesta. Por ello, algunos autores manifiestan la necesidad del laboratorio en la vigilancia de los NAC.33 Una razón simple sería verificar el apego del paciente al tratamiento y asegurar la eficacia. Otros arguyen que la dosis terapéutica fija de estos fármacos produce una concentración plasmática tan predecible, que hacer una vigilancia por laboratorio sería de escasa utilidad clínica.34
Los inhibidores directos de la trombina alteran la relación del TP/INR, prolongan el TTPa, alteran la dosificación de factores de la coagulación basada en técnicas coagulométricas, dan un resultado falsamente disminuido de fibrinógeno y resultados no confiables en la determinación coagulométrica de las proteínas C y S. También alteran la determinación de la antitrombina y de la resistencia a la PC activada. El tiempo de trombina es muy sensible para vigilar los inhibidores directos de la trombina y generalmente lo prolongan a más de 200 segundos. No existe un criterio definido sobre el empleo de TTPa para vigilar la respuesta a los nuevos anticoagulantes orales.35 Otras pruebas que se han sugerido son: determinar la actividad anti-IIa por método cromogénico, el Tiempo de Ecarin (TE), pruebas de coagulación globales como el Tiempo de coagulación inducido por protrombinasa y la prueba de Generación de Trombina. No existe información suficiente sobre la determinación de la actividad anti-Xa para vigilar los nuevos inhibidores directos del factor Xa.36,37 Lo ideal sería contar con una prueba estandarizada y fácil de realizar, que nos diera una información inmediata sobre la intensidad de la anticoagulación con estos nuevos medicamentos. Hasta ahora, no existe.
Conclusiones
En los últimos años se han hecho notables avances para desarrollar nuevos medicamentos antitrombóticos. Los nuevos anticoagulantes ofrecen una perspectiva atractiva en la prevención de complicaciones embólicas en la fibrilación auricular, el primer padecimiento no quirúrgico en que se ha aprobado uno de ellos: el dabigatrán. Ahora parecería que, tras varias décadas de emplear antagonistas de la vitamina K, sólo vemos sus desventajas. Sin embargo, las clínicas de anticoagulación han cumplido bien su función. Se ha demostrado que los enfermos controlados en tales clínicas logran mejor calidad en el tratamiento anti-coagulante, pues permanecen más tiempo dentro de INR óptimo que los controlados en los consultorios individuales. A pesar de ello, sólo se mantienen 55% del tiempo dentro de control óptimo.38,39 Con los nuevos anticoagulantes tal vez dejaremos los viejos problemas de los AVK, aunque el tiempo que hemos vivido con ellos nos ha enseñado como enfrentarlos y su perfil de eficacia y seguridad es bien conocido a través de cientos de trabajos acumulados. La misma cantidad de información no la tenemos con los NAC. Ahora cambiaremos por nuevos problemas y aún no tenemos respuesta para las interrogantes que surgen. Los NAC generalmente son compuestos heterocíclicos que contienen nitrógeno que pudiera influir sobre la regulación del óxido nítrico y producir cambios hemodinámicos. Siendo compuestos organomiméticos, son metabolizados a diversos agentes bioactivos, cuyos efectos a largo plazo aún desconocemos y que podrían variar en las diferentes poblaciones. Tenemos enfermos que han ingerido AVK por tiempo prolongado, algunos más de 20 años. Los NAC tienen acción mono terapéutica, ya que tienen sólo un blanco de acción: anti-Xa o anti-IIa y desconocemos si tienen efectos adicionales a través de la administración prolongada. Aún no hay estudios que soporten su empleo en otras indicaciones, como la FA asociada a fiebre reumática o en las prótesis valvulares mecánicas. Parece poco probable que pronto dejemos de usar los anticoagulantes tradicionales o que desaparezcan las clínicas de anticoagulantes orales y cambiemos por completo a los NAC. Sobre la sugerencia de los fabricantes en cuanto a que no requieren control de laboratorio, ¿dejaremos de dar citas breves a los enfermos?, ¿les daremos la indicación del anticoagulante nuevo y nos olvidaremos del control periódico?, ¿es suficiente saber que los NAC tienen una farmacocinética predecible para estar tranquilos en la intensidad de anticoagulación que tiene cada enfermo?; ¿cómo verificar el apego al tratamiento? ¿Una vigilancia ocasional por laboratorio sería mejor que no vigilarlos nunca? ¿Habrían tenido menos eventos hemorrágicos los enfermos de los estudios clínicos con NAC, si se les hubieran hecho pruebas de laboratorio para vigilar la acción anticoagulante?
Por último, otras limitantes son: la edad avanzada, la insuficiencia renal, la administración de dos dosis al día (dabigatrán y apixabán), que puede favorecer la falta de apego o el olvido de la ingesta, la intolerancia gástrica, la vida media corta, que al omitir una dosis restablece el riesgo trombogénico en forma inmediata, los costos elevados y la ausencia de un antídoto en caso de hemorragia grave.
Estamos viviendo un momento crucial en el tratamiento con anticoagulantes orales. Es necesario revisar las evidencias de los nuevos y de los tradicionales. Por ahora, se ha actualizado la manera de calcular con mayor precisión los riesgos de embolia y de hemorragia en la FA y se han incorporado dabigatrán, rivaroxaban y apixabán a las opciones de tratamiento anticoagulante. Cada vez aparecerán NAC y esa diversidad nos permitirá seleccionar el más adecuado para cada situación clínica.
Correspondencia: Raúl Izaguirre Ávila.
Departamento de Hematología. Calle Juan Badiano 1. Tlalpan 14080. México, D. F.
Teléfono: (55) 55732911.
Correo electrónico: rizagui@yahoo.com.
Recibido el 1 de agosto de 2011;
aceptado el 3 de agosto de 2011.