Introducción
La mediastinitis es una complicación poco frecuente de la cirugía cardiaca y representa alrededor del 0.3% al 4.4% de las infecciones del sitio quirúrgico cardiovascular; sin embargo, reviste gran importancia por su elevada morbilidad y mortalidad. Entre los múltiples factores predisponentes reconocidos figuran obesidad, diabetes mellitus, enfermedades pulmonares, reintervenciones quirúrgicas, bajo gasto cardiaco, ventilación mecánica prolongada, tiempo quirúrgico y de derivación cardiopulmonar prolongado, entre otros.
El diagnóstico temprano de mediastinitis en el periodo posoperatorio requiere un alto grado de sospecha clínica. En general, las infecciones de la herida quirúrgica aparece entre el quinto y séptimo día posterior al procedimiento quirúrgico; no obstante, en el posoperatorio habitual de las intervenciones cardiacas se puede presentar fiebre en ausencia de algún proceso infeccioso reconocido durante el cuarto o quinto días; las reacciones farmacológicas, flebitis, atelectasias, embolia pulmonar, así como el síndrome pospericardiotomía, son las causas de la fiebre más frecuentes después del sexto día.
Se debe establecer el diagnóstico temprano para iniciar la atención médica y quirúrgica a la brevedad. La mediastinitis debe considerarse un problema quirúrgico, ya que las medidas médicas no constituyen el tratamiento definitivo, a pesar de que son necesarias.
Los protocolos terapéuticos iniciales incluían el desbridamiento sin cierre de la herida; con posterioridad se incluyeron tanto el desbridamiento como la irrigación con antibióticos mediante un sistema de catéteres y drenajes con cierre de la herida. En la actualidad se ha agregado al tratamiento el uso del epiplón y la superposición de pectorales, con lo cual se ha logrado una disminución de la mortalidad.
Definiciones y clasificación
Según las CDC (Centers for Disease Control and Prevention), la mediastinitis se define como la entidad que cumpla con los siguientes criterios:
1. Uno o más de los siguientes signos y síntomas:
• Fiebre (>38 ˚C)
• Dolor torácico
• Inestabilidad esternal
• Drenaje purulento del área mediastínica
• Germen aislado en hemocultivos o del área mediastínica
• Ensanchamiento mediastínico
2. Un cultivo bacteriano positivo del espacio mediastínico.
3. Evidencia de mediastinitis durante la operación o por histopatología.
Incidencia
La incidencia de la mediastinitis oscila entre 0.34% y 4.4% y aumenta de manera considerable en subgrupos especiales, como en quienes se practica un trasplante de corazón (2.5% al 7.5%) o poscolocación de dispositivos de asistencia ventricular.
Mortalidad
La mortalidad secundaria a la mediastinitis fluctúa entre 12% y 47% en diversas series. En 13 series de estudios que analizan la mortalidad durante los primeros 90 días posteriores a la operación de pacientes con mediastinitis, la mortalidad fue del 11.8%, en comparación con 5.5% de los pacientes sin mediastinitis. En un protocolo prospectivo de 316 casos consecutivos de mediastinitis se identificaron factores de riesgo vinculados con la mortalidad en la unidad de terapia intensiva; los factores de riesgo independientes fueron la edad > 70 años, otra intervención además de la revascularización coronaria, condiciones médicas de gravedad (APACHE II), insuficiencia orgánica, más de tres días con ventilación mecánica y hemocultivos persistentemente positivos.
Existe una disminución de la mortalidad en los sujetos tratados en los primeros siete días posteriores a la operación de mediastinitis con antibióticos específicos para el germen causal (HR, 0.4). La mayoría de los individuos con mediastinitis posquirúrgica tiene infecciones monomicrobianas. En dos revisiones con un total de 350 pacientes con mediastinitis, 290 (83%) presentaron un germen patógeno aislado en el mediastino o la sangre.
Evolución
Casi todos los pacientes con mediastinitis muestran evidencia de infección en los primeros 14 días tras el procedimiento; sin embargo, el inicio puede retrasarse por meses. En un reporte, por ejemplo, el periodo de incubación fue de tres a 417 días después de la intervención; no obstante, el tiempo medio de aparición fue de siete días y comenzó dentro de las dos semanas en dos tercios de los enfermos.
Recomendaciones
Profilaxis
Tratamiento antimicrobiano
Recomendación
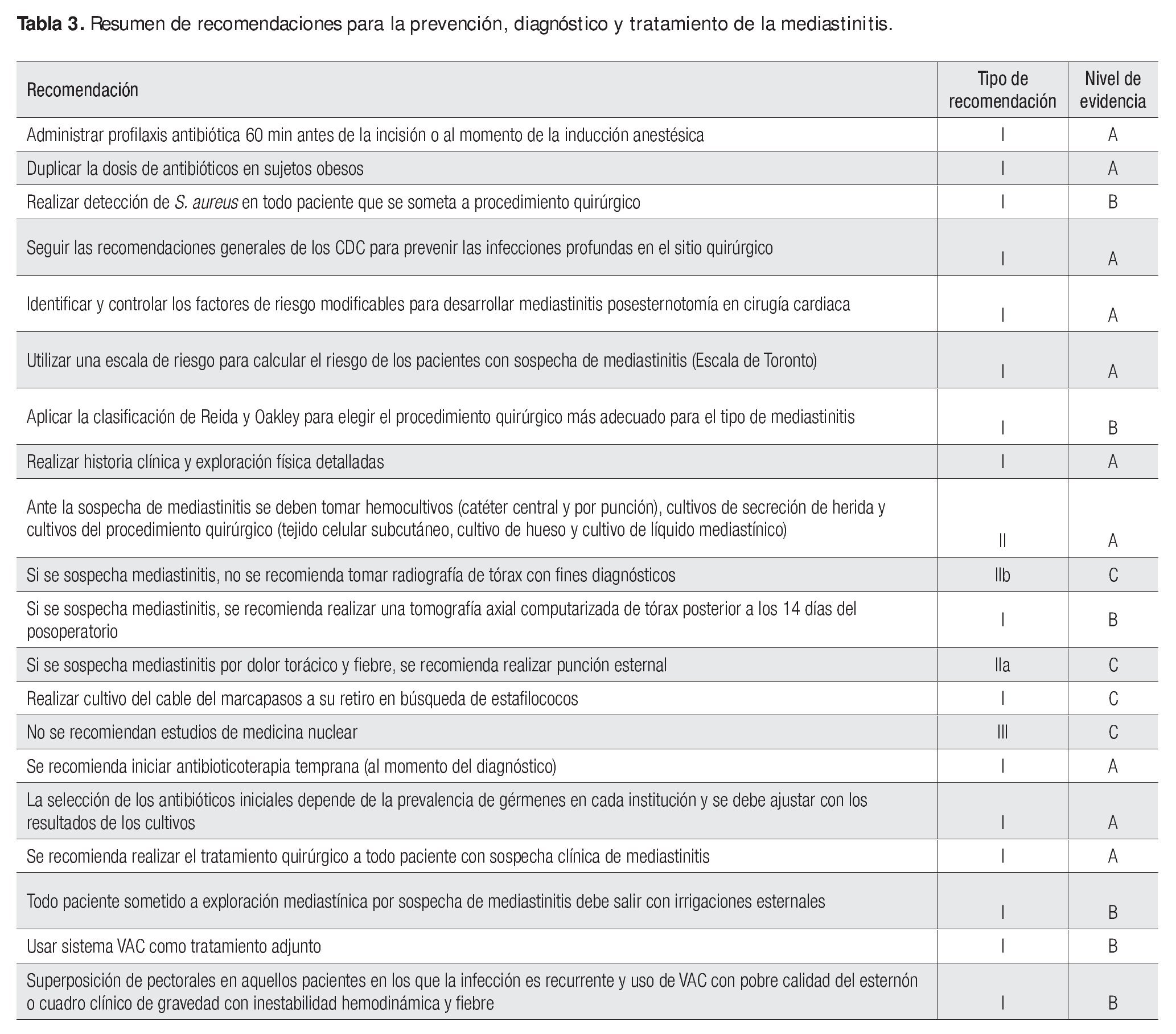
Administrar profilaxis antibiótica 60 min antes de la incisión o al momento de la inducción anestésica.
Recomendación clase I, nivel de evidencia A
Justificación. Es necesario administrar lactámicos β (cefalosporinas de primera generación). Los glucopéptidos sólo se prescriben en personas alérgicas a los lactámicos β (laringoespasmo o choque anafiláctico) o en centros hospitalarios con incidencia de infección del sitio quirúrgico por S. aureus resistente a la meticilina (SARM) mayor de 5%. El tiempo de administración de los antibióticos profilácticos es de 24 a 72 h. Los fármacos intravenosos de elección habituales son cefazolina (1 g si el peso es < 80 kg y 2 g si es > 80 kg) o cefuroxima (1.5 g). La vancomicina intravenosa (1 g [10 a 15 mg/kg]) se prefiere si el paciente se ha colonizado con SARM o si es alérgico a las penicilinas o las cefalosporinas, o bien si la operación se realiza en un hospital donde el SARM o el estafilococo negativo a la coagulasa es una causa común de infecciones posquirúrgicas. Se debe considerar duplicar la dosis de los antibióticos en individuos obesos.
Erradicación nasofaríngea preoperatoria
Recomendación
Realizar detección de S. aureus a todo paciente programado para un procedimiento quirúrgico.
Recomendación clase I, nivel de evidencia B
Justificación. Se recomienda la detección oportuna en todos los individuos antes del procedimiento cardiaco mediante un exudado nasal, ya que la detección de S. aureus sensible a la meticilina (SASM) o SARM modifica la morbimortalidad; el SARM es un factor de riesgo independiente de mortalidad en los pacientes con mediastinitis causada por este germen. La mediastinitis posquirúrgica secundaria a SARM se presenta más a menudo en el contexto de una colonización nasal por SARM, tras considerar que esta infección parece ocurrir a través de la transmisión nosocomial entre los pacientes. Esto lo ha propuesto un estudio en el cual se estudió a 1 432 sujetos sometidos a una operación cardiaca que presentaron mediastinitis (22); entre los nueve casos infectados por SARM, en siete se aislaron cultivos prequirúrgicos idénticos nasales y en el sitio quirúrgico; de los ocho casos por SARM, en ninguno se aisló el mismo cultivo, y el mismo SARM se identificó en todos estos casos, lo que demostró que la rápida detección del S. aureus y su rápida eliminación con mupirocina reduce el riesgo de infección por este agente, así como la estancia intrahospitalaria. La aplicación de mupirocina intranasal erradica a S. aureus en un 90% a 100% a un año tras la intervención y reduce la infección en un 67%. La mortalidad es más elevada en aquellos pacientes con infección por SARM respecto de aquéllos por SASM. Esto se describió en una serie de 41 pacientes con mediastinitis, 15 con SARM y 26 con SASM; la mortalidad más alta se registró en personas con SARM, en comparación con las que presentaban infección por SASM al mes posterior al diagnóstico de mediastinitis (40% vs 15%) y al año (48% vs 21%) y tres años (74% vs 21%). Ante esta evidencia, se recomienda que la erradicación por colonización nasal se realice con ungüento de gluconato de clorhexidina o mupirocina.
Prevención de infecciones profundas de la herida quirúrgica
Recomendación
Seguir las recomendaciones generales de los CDC para prevenir las infecciones profundas en el sitio quirúrgico.
Recomendación clase I, nivel de evidencia A
Justificación
• No remover el vello antes de la operación, a menos que éste se encuentre alrededor del sitio de incisión, que pueda interferir con el procedimiento quirúrgico.
Nivel de evidencia I A. Si el vello se elimina, de preferencia hay que hacerlo inmediatamente antes de la intervención con una rasuradora eléctrica.
Nivel de evidencia I A
• Los pacientes deben bañarse o asearse con un agente antiséptico, por lo menos una noche antes de la operación
Nivel de evidencia I B
• Se requieren lavado y limpieza estrictos alrededor del sitio de la incisión para remover la contaminación antes de la preparación antiséptica de la piel.
Nivel de evidencia I B
• Uso de un agente antiséptico apropiado para la preparación de la piel. Nivel de evidencia I B. Los productos que contienen alcohol de yodopovidona al 70% y el gluconato de clorhexidina son los agentes más usados. La aplicación de preparaciones antisépticas en la piel en el periodo preoperatorio exige movimientos en círculos concéntricos hacia la periferia. El área preparada debe ser lo suficientemente grande desde la incisión para crear una nueva incisión o sitio de drenaje si fuera necesario.
Nivel de evidencia II
Los lineamientos basados en la evidencia de los CDC para la prevención de la infección del sitio quirúrgico en el periodo posoperatorio, así como los cuidados del sitio de la incisión, incluyen los siguientes:
• Proteger con un apósito estéril, 24 o 48 h en el periodo posoperatorio, la incisión cerrada de primera intención.
Nivel de evidencia I B
• Lavado de manos antes y después del cambio de apósitos y de cualquier contacto con el sitio quirúrgico.
Nivel de evidencia I B
• Cuando el apósito de la incisión debe cambiarse, se debe realizar bajo una técnica estéril.
Nivel de evidencia I B
• Educar al paciente y la familia acerca del cuidado de la incisión, reconocimiento de síntomas de infección del sitio quirúrgico, así como de la necesidad de notificar dichos síntomas.
Nivel de evidencia II
• No se recomienda cubrir una incisión cerrada de primera intención más de 48 h ni tampoco durante el tiempo del baño o aseo en una incisión descubierta.
Nivel de evidencia I B
Control de los factores de riesgo modificables
Recomendación
Identificar y controlar los factores de riesgo modificables para desarrollar mediastinitis posesternotomía en la cirugía cardiaca.
Recomendación clase I, nivel de evidencia A
Justificación. Los siguientes factores de riesgo se han descrito en diferentes estudios.
• Obesidad
• Diabetes mellitus o hiperglucemia
• Tabaquismo
• Días de estancia en la terapia intensiva (>3 días)
• Reintervención
• Tiempo de uso de la bomba de circulación extracorpórea (> 100 min)
• Días de ventilación mecánica (> 2 días)
• Más de un puente de arteria mamaria
• Número de transfusiones de concentrados eritrocitarios (> 3 U).
No hay un consenso sobre cuál es el factor de riesgo más importante para el desarrollo de mediastinitis; es probable que todos o muchos de los factores de riesgo influyen en el desarrollo de la infección, en particular cuando dos o más están presentes.
La obesidad es un factor de riesgo encontrado en numerosos estudios de grandes series de pacientes. En estos estudios se reconoce la obesidad como un factor de riesgo independiente, debido a la concentración sérica inadecuada de los antibióticos por subdosificación, además de la pobre perfusión alcanzada en el tejido adiposo y las dificultades quirúrgicas añadidas, como el aumento del tiempo quirúrgico.
La diabetes mellitus tipo 2 se ha informado como un factor pronóstico para desarrollar mediastinitis en muchos estudios, casi todos observacionales. Ya se ha informado en estudios que la infusión de insulina perioperatoria reduce la incidencia de mediastinitis en pacientes diabéticos y que las concentraciones de glucosa > 200 mg/dl han demostrado ser un factor para mediastinitis.
Nivel de evidencia I A
El tabaquismo incrementa el riesgo de infecciones en las heridas de esternotomía posquirúrgica, según lo han informado numerosos estudios tanto observacionales como de casos y controles. Este factor, junto con la ventilación prolongada y la enfermedad obstructiva crónica, incrementan el riesgo de infecciones en pacientes fumadores, ya que se eleva el riesgo de complicaciones pulmonares posoperatorias, además de que existe colonización de la herida quirúrgica por flora de la nasofaringe y daño de la respuesta inmunitaria.
Nivel de evidencia I A
Tanto el antecedente de una operación como el uso prolongado de tiempo de circulación extracorpórea se han referido en numeroso estudios como factores de riesgo independientes para el desarrollo de mediastinitis, sea en el análisis multivariado como en el univariado. Repetidas esternotomías medias requieren mayor tiempo para la disección de adhesiones mediastínicas y esto incrementa la duración del tiempo quirúrgico y con ello el riesgo de contaminación en la herida.
Nivel de evidencia I A
Aunque el uso de las arterias mamarias se considera un factor de riesgo para desarrollar mediastinitis, lo cual se indica en la Tabla 1, la isquemia esternal posterior a la movilización de una o dos mamarias está bien documentada por tomografía a las semanas primera y cuarta tras la realización de esternotomía, debido a que un hemiesternón pierde más del 90% de la perfusión sanguínea con la movilización de una arteria mamaria, lo cual explica la cicatrización de la herida.
La hemorragia posoperatoria en las primeras 24 h y la reexploración por sangrado son factores de riesgo para mediastinitis, lo cual se ve reflejado en el número de transfusiones realizadas, lo que incrementa el riesgo de infección en la herida. En un estudio se encontró que el sangrado de vinculó con una mayor incidencia de mediastinitis en pacientes posoperados de cirugía de revascularización coronaria y el origen del sangrado fue el ventrículo derecho, con elevación de la mortalidad hasta un 26.7%.
Nivel de evidencia I A
Estratificación del riesgo
Recomendación
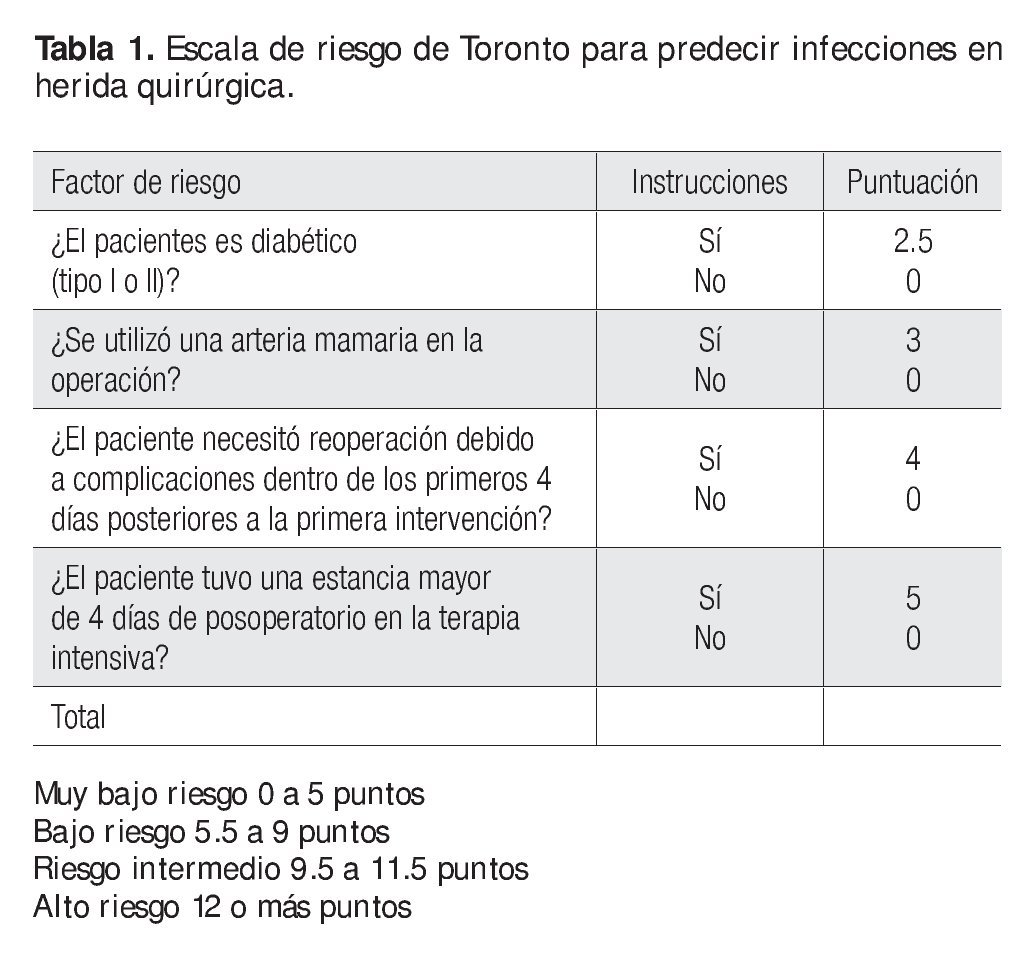
Utilizar alguna escala de riesgo (en este caso se recomienda la Escala de Toronto) para calcular el riesgo de los pacientes con sospecha de mediastinitis y estratificar su riesgo.
Recomendación clase I, nivel de evidencia A
Justificación. Es útil estratificar a los pacientes con sospecha de mediastinitis de acuerdo con la Escala del riesgo de Toronto en muy bajo riesgo (0 a 5 puntos), bajo riesgo (5.5 a 9 puntos), riesgo intermedio (9.5 a 11.5 puntos) y alto riesgo (12 o más puntos). Tabla 1.
Se han descrito varios índices del riesgo de infección en las heridas esternales secundarias a una operación cardiaca. Un sistema de puntuación preoperatorio basado en una escala máxima de tres puntos se evaluó en un estudio de cohorte de 4 987 pacientes para predecir el riesgo de mediastinitis. En este protocolo por puntaje se le asignó a la diabetes 1 punto, al IMC de 29 a 35 kg/m2 1 punto y al IMC de 35 kg/m2 o mayor 2 puntos; cada punto dobla aproximadamente el riesgo de infección en el sitio de la herida quirúrgica. La validación subsecuente de este índice de riesgo se realizó en otro estudio separado de 269 casos de infección de la herida quirúrgica, después de un procedimiento de revascularización coronaria.
Clasificación de la mediastinitis
Recomendación
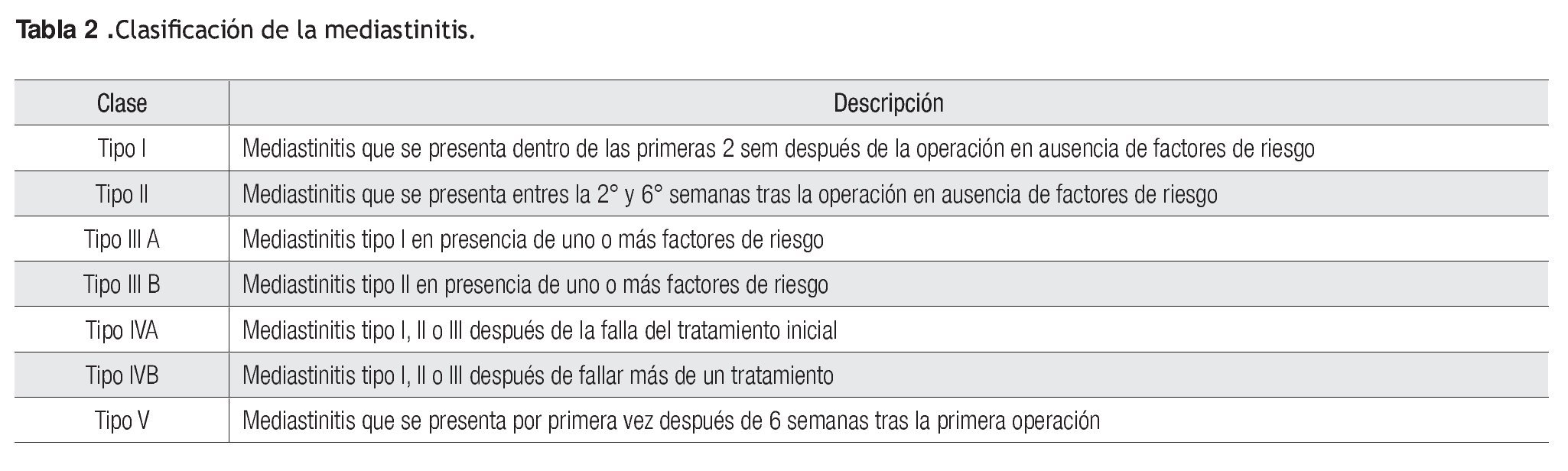
Aplicar la clasificación de Reida y Oakley para la elección del procedimiento quirúrgico más adecuado al tipo de mediastinitis (Tabla 2).
Recomendación clase I, nivel de evidencia B
Justificación. Las infecciones en la herida profundas o la mediastitinis se clasifican en cinco subtipos con base en el tiempo de aparición, la presencia o ausencia de factores de riesgo y la posible falla del tratamiento previo.
Esta clasificación se describe en diversos artículos (estudios descriptivos, prospectivos, reporte de caso, casos y controles y revisiones) para tomar decisiones acerca del tipo de tratamiento. Athanassiadi refiere el uso de transposición de epiplón como parte de la resolución de la mediastinitis en 15 pacientes con mediastinitis tipos IIIB, IVA, IVB. En otro estudio, en el que se le dio seguimiento a 125 pacientes con uso de VAC (vaccum-assited closure) se utilizó esta clasificación y se informó que 73 individuos eran de tipo IIIA y 14 de tipo IVA; el VAC redujo la incidencia de recurrencia, así como los días de terapia en comparación con aquellos pacientes no sometidos a esta terapia. En otro estudio en el que se empleó la clasificación de Reida y Oakley para el uso de la superposición de pectorales se valoró una subclasificación tras considerar cuatro grupos, según fuera que la presentación de la mediastinitis era mayor o no de seis semanas, posible existencia de inestabilidad y germen aislado. Se concluyó que la super-posición de pectorales reduce los días de estancia y la recurrencia de osteomielitis, la cual fue del 20%. Sjogren utilizó en 101 sujetos la clasificación de Reide y Oakley y comparó el VAC con el tratamiento de desbridamiento y colocación de irrigaciones. En dicho estudio, el VAC aumentó la sobrevida de los pacientes y redujo la recurrencia en comparación con el tratamiento convencional.
En un análisis retrospectivo en 68 pacientes se compararon los resultados clínicos del uso del VAC con el tratamiento de lavado e irrigaciones y se clasificaron a los pacientes de acuerdo con la clasificación de Reide y Oakley; concluyeron que el uso del VAC mejora los resultados clínicos en comparación con el tratamiento convencional.
Diagnóstico
Historia clínica y exploración física
Recomendación
Realizar la historia clínica y la exploración física detalladas.
Recomendación clase I, nivel de evidencia A
Justificación. El diagnóstico de mediastinitis es esencialmente clínico, por lo que deben efectuarse una historia clínica y una exploración física detalladas tras considerar los factores de riesgo. Hay que tener claro que el tratamiento oportuno y adecuado depende de un diagnóstico temprano.
La triada clínica más característica de la mediastinitis posoperatoria es:
• Fiebre en el 83% de los casos, con bacteriemia en alrededor del 60%.
• Secreción purulenta en el 75% de los casos.
• Dolor esternal muy intenso en el 61% de los casos. Su presencia indica osteomielitis adjunta.
La presencia de fiebre, dolor y secreción purulenta es indicativa de mediastinitis y debe tener resolución médica (antibióticos) y quirúrgica en las siguientes 24 h.
La mediastinitis posquirúrgica puede seguir un curso fulminante o subagudo. En la mayoría de los pacientes puede presentarse con fiebre, taquicardia, dolor torácico, o inestabilidad esternal, dolor y rubor local, así como salida de secreción purulenta del área mediastínica.
Por lo general, la fiebre y los síntomas sistémicos aparecen primero en casi todos los pacientes, aunque los signos de infección de la herida esternal pueden presentarse antes o después establecer el diagnóstico definitivo.
Otros hallazgos que se presentan en los sujetos con mediastinitis son los siguientes:
• Inestabilidad esternal: 46% de los casos. Se inicia con el movimiento del esternón a la palpación que puede progresar hasta la dehiscencia ósea.
• Síndrome de reacción inflamatoria sistémica.
• Flogosis de la herida esternal
• Celulitis verificada en el acto quirúrgico
• Crepitación
• Edema de la pared torácica
El signo de Hamman es la auscultación de un sonido crujiente sincronizado con la sístole del corazón por auscultación y originado por la presencia de enfisema en el mediastino. Este signo está presente en más del 50% de los individuos con neumomediastino.
La bacteriemia puede presentarse antes o después del reconocimiento de la mediastinitis. Un estudio señala que la bacteriemia es un dato común en la mediastinitis posquirúrgica y ocurre en el 57% de los pacientes. Otra serie publica que la mediastinitis fue la causa subyacente de la bacteriemia en 16 de 27 pacientes con cultivos positivos en el periodo posquirúrgico temprano. Debido a que la bacteriemia puede ser el primer signo de mediastinitis posquirúrgica, debe vigilarse de manera cuidadosa durante la evaluación de todos los sujetos sometidos a un procedimiento de cirugía cardiaca o torácica.
Cultivos
Recomendación
Ante la sospecha de mediastinitis se deben tomar hemocultivos (catéter central y por punción), cultivos de secreción de la herida y cultivos del procedimiento quirúrgico (tejido celular subcutáneo, cultivo de hueso y cultivo de líquido mediastínico). Esto está indicado cualquiera que sea la observación macroscópica que haga el cirujano.
Recomendación clase II, nivel de evidencia A
Justificación. En un estudio se examinó la utilidad de los cultivos en el diagnóstico de la mediastinitis. En esta cohorte de 5 500 pacientes, la detección de S. aureus por toma de cultivo antes de los 90 días tiene un índice de probabilidad de 25% para identificar mediastinitis (IC 95%, 14.7- 44.4); 46 de 60 sujetos (77%), quienes presentaron bacteriemia secundaria a S. aureus, desarrollaron mediastinitis por el mismo microorganismo. La bacteriemia por otros microorganismos no tuvo la misma relevancia pronóstica: sólo 15 de 126 pacientes (12%) con bacteriemia sin S. aureus desarrollaron mediastinitis, con un índice de probabilidad de 1.0 (IC 95, 0.6-1.7). Las personas con cultivos negativos presentaron menos probabilidad de presentar mediastinitis, con un índice de probabilidad de 0.45 (IC 95%, 0.35-0.58).
Radiografía de tórax
Recomendación
En personas con sospecha de mediastinitis posquirúrgica no se recomienda la radiografía de tórax para su diagnóstico debido a su baja sensibilidad y especificidad.
Recomendación clase IIb, nivel de evidencia C
Justificación. El ensanchamiento mediastínico observado en la radiografía de tórax posteroanterior puede ser un hallazgo de mediastinitis no quirúrgica y rara vez se observa en sujetos bajo operación cardiaca. Otra anormalidad poco frecuente es la observación de niveles hidroaéreos en el mediastino o el tejido subcutáneo y aire mediastínico en la radiografía de tórax lateral. Sin embargo, este último hallazgo no es valorable en pacientes posquirúrgicos.
Tomografía axial computarizada Recomendación
Se recomienda realizar una tomografía axial computarizada de tórax en pacientes con sospecha clínica de mediastinitis posterior a los 14 días del posoperatorio.
Recomendación clase I, nivel de evidencia B
Justificación. La tomografía computarizada (TC) ha demostrado dos signos que sugieren mediastinitis: líquido mediastínico localizado y neumomediastino.
Estos resultados son más significativos después de 14 días tras la práctica de la operación cardiaca. Se ha informado que la sensibilidad y especificidad de la tomografía para la detección de mediastinitis antes de los 14 días posoperatorios son de 100% y 33%, respectivamente, que se incrementan al 100% después de las dos semanas de la intervención.
Punción esternal
Recomendación
Si el paciente presenta dolor torácico y fiebre se recomienda realizar la punción esternal.
Recomendación clase IIa, nivel de evidencia C
Justificación. Benlolo y colaboradores estudiaron a pacientes con esternotomía media en la cual efectuaron una punción esternal para el diagnóstico de mediastinitis. Ellos colocaron una aguja número 21 a través de los márgenes del sitio de la esternotomía y aspiraron a una profundidad de 1 cm; si en el aspirado inicial no se obtenía secreción, el aspirado se repetía en dos o tres porciones distintas de la herida quirúrgica. De esta forma, de 1 024 sujetos posoperados de una intervención cardiaca, la punción esternal se practicó en un subgrupo de 49 pacientes con sospecha de mediastinitis; los cultivos de punción esternal fueron positivos en todos las personas con verdadera mediastinitis (n = 23), sensibilidad del 100% y negativos en 24 de 26 pacientes sin mediastinitis, especificidad del 92%; con ello el diagnóstico fue rápido y redujo los días de ventilación mecánica y los días de estancia en la terapia intensiva. Al realizar la punción, si la tinción de Gram y el cultivo son negativos (24 h) no se recomienda administrar antibióticos.
Retiro y cultivo del cable de los marcapasos
Recomendación
Los cables de los marcapasos deben retirarse en las primeras 48 h posquirúrgicas (no si existe una contraindicación).
Recomendación clase I, nivel de evidencia C
Justificación. Solicitar cultivo del cable de los marcapasos tras su retiro en búsqueda de S. aureus. Los cultivos del cable del marcapaso epicárdico pueden ser de utilidad en los pacientes con mediastinitis posquirúrgica de inicio temprano. En un reporte, cuyos cultivos presentaron una sensibilidad del 75% y una especificidad de 83%, el valor predictivo negativo del cultivo individual fue del 99% con muy bajo valor predictivo positivo. Resultados similares se obtuvieron en un estudio de 2 200 sujetos en quienes se solicitó cultivo del cable de los marcapasos en 1 607 personas; se informó que el cultivo del cable del marcapaso tiene un valor predictivo del 5.7% y un alto valor predictivo negativo del 95.9% con una exactitud diagnóstica del 70.4% por lo que aún es cuestionable. Cuando el cultivo del marcapaso epicárdico resultó positivo para S. aureus aumentó la sensibilidad del 84.6% y especificidad del 95.8% con un valor predictivo positivo del 32.3%.
Medicina nuclear con leucocitos marcados
Recomendación
No se recomienda realizar estudios de medicina nuclear con leucocitos marcados.
Recomendación clase III, nivel de evidencia C
Tratamiento
Tratamiento antimicrobiano
Recomendación
Se recomienda iniciar antibioticoterapia temprana.
Recomendación clase I, nivel de evidencia A
Justificación. El tratamiento antimicrobiano debe administrarse tan pronto como haya sospecha clínica de mediastinitis y después de tomar hemocultivos. La administración de antibióticos no debe retrasar el inicio del tratamiento quirúrgico. La selección del antibiótico debe basarse en la prevalencia de gérmenes en cada institución y debe ajustarse tan pronto se obtengan resultados de los cultivos (hemocultivo, cultivos de la secreción de la herida o del mediastino por punción).
Tratamiento quirúrgico
Recomendación
Se recomienda realizar el tratamiento quirúrgico en todo paciente con sospecha clínica de mediastinitis y apenas se establezca el diagnóstico sin espera de un resultado de laboratorio o gabinete.
Recomendación clase I, nivel de evidencia A
Justificación. Reida y Oakley informaron que un desbridamiento radical en forma adecuada y el uso de la superposición de pectorales es uno de los tratamiento efectivos en comparación con aquellos en los que no se realiza; asimismo, estos autores reiteran el tipo de tratamiento quirúrgico según sea el tiempo en que se presenta la mediastinitis, si existen o no factores de riesgo y se existe o no falla al tratamiento. Se sabe que el retraso de más de tres días para el desbridamiento de la esternotomía altera directamente la mortalidad (HR, 6.3).
Irrigaciones esternales
Recomendación
Todo paciente sometido a exploración mediastínica por sospecha de mediastinitis debe egresar con irrigaciones esternales.
Recomendación clase I, nivel de evidencia B
Justificación. Shumacker y Mandelbaum describieron este procedimiento y realizaron un lavado mediastínico y recierre, en conjunto con irrigación esternal en 1963. Las ventajas de este procedimiento son la inmediata estabilización del tórax, así como el lavado del sitio de infección por irrigación y son innecesarias las reconstrucciones con cirugía plástica, que complican aún más la operación. Sin embargo, no pueden permanecer durante periodos largos, ya que pueden presentarse fístulas, se limita la movilidad de los pacientes y se incrementa la estancia intrahospitalaria. Molina y colaboradores presentaron un estudio con 114 pacientes con infección mediastínica en la que se practicó 1) desbridamiento con resección esternal; 2) disección bilateral de la piel y tejido subcutáneo; 3) implantación del sistema de irrigación/aspiración con doble tubo, uno en la parte anterior y otro en la parte posterior del esternón; 4) reforzamiento lateral del esternón y recierre con doble alambre; 5) cierre en una sola capa de piel y tejido subcutáneo. El 95% de los enfermos tuvo una recuperación satisfactoria después del procedimiento, con un promedio de 14 días de estancia intrahospitalaria y además no se documentó ninguna muerte durante el estudio. Se concluyó que el procedimiento representa una técnica efectiva.
VAC
Recomendación
Usar el sistema VAC como tratamiento adjunto.
Recomendación clase I, nivel de evidencia B
Justificación. El uso del VAC como terapia inicial o tratamiento adjunto ha reducido en forma considerable la morbilidad y la mortalidad comparado con el uso del lavado y la colocación de irrigaciones, lo cual se ha comprobado en numerosos estudios. Se encontraron ocho estudios, tres retrospectivos y cinco prospectivos, en los que se utilizó VAC como tratamiento inicial y tratamiento adjunto al lavado e irrigación con adecuados resultados.
Superposición de pectorales
Recomendación
Se recomienda realizar la superposición de pectorales en aquellos individuos en los que la infección es recurrente y el uso del VAC con posterior superposición de pectorales en los pacientes cuya calidad del esternón sea pobre y en el paciente con un cuadro clínico de gravedad con inestabilidad hemodinámica y fiebre.
Recomendación clase I, nivel de evidencia B
Justificación. Se recomienda utilizar la superposición de pectorales en los enfermos que tienen falla de un primer procedimiento quirúrgico y debe valorarse el retiro total del esternón. La incidencia de infecciones recurrentes de la herida después del desbridamiento es menor si se utiliza la superposición de epiplón o músculos para
cerrar la herida. El beneficio de este abordaje se demostró en un estudio de 274 pacientes en el cual la incidencia de infección recurrente de la herida fue de 86% en los sujetos sometidos a drenaje abierto sin cierre de la herida, 26% en aquellos que se sometieron a desbridamiento seguido del cierre inmediato con la colocación de tubos de drenaje, y sólo el 8% en aquellos quienes experimentaron cierre inmediato mediante superposición de músculo o epiplón (Tabla 3).
Bibliografía
Abboud CS, Wey SB, Baltar VT. Risk factors for mediastinitis after cardiac surgery. Ann Thorac Surg 2004;77:676-683.
Athanassiadi K, Theakos N, Benakis G, et al. Omental transposition: the final solution for major sternal wound infection. Asian Cardiovas Thorac Ann 2007;15:200-203.
Baldwin RT, Radovancivic B, Sweeny MS. Bacterial mediastinitis after heart transplantation. J Heart Lung Transplant 1992;11:545.
Baskett R, MacDougall C, Ross D. Is mediastinitis a preventable complication? A 10 year review. Ann Thorac Surg 1999;67:462-465.
Benlolo S, Mateo J, Raskine L, et al. Sternal puncture allows an early diagnosis of poststernotomy mediastinitis. J Thorac Cardiovasc Surg 2003;125:611.
Bitkover CY, Gardlund B. Mediastinitis after cardiovascular operations: a case-control study of risk factors. Ann Thorac Surg 1988;65:36-40.
Bor DH, Rose RM, Modlin JF, et al. Mediastinitis after cardiovascular surgery. Rev Infect Dis 1983;5:885.
Braxton JH, Marrin CA, McGrath PD. Mediastinitis and long term survival after coronary artery bypass graft surgery. Northern New England Cardiovascular Disease Study Group. Ann Thorac Surg 2000;70:2004-2007.
Careaga G, Aguirre G, Medina L, et al. Factores de riesgo para mediastinitis y dehiscencia esternal después de cirugía cardiaca. Rev Esp Cardiol 2006;59:130-135.
Chen L, Anderson D, Kaye K, et al. Validating a new predictive instrument for surgical site infections following cardiac bypass surgery. Presented at the Annual IDSA Meeting. San Diego, CA. October 4-7, 2007.
Clara L, Stern L, Barcán L, et al. Mediastinitis post-quirúrgica: estudio caso- control. Rev Chil Infect 2002;19:37-48.
Cowan K, Teague L, Sue S, et al. Vacuum-assisted wound closure of deep sternal infections in high-risk patients after cardiac surgery. Ann Thorac Surg 2005;80:2205-2212.
De Feo M, Renzulli A, Ismeno G, et al. Variables predicting adverse outcome in patients with deep sternal wound infection. Ann Thorac Surg 2001;71:324- 331.
Diez C, Koch D, Kuss O, et al. Risk factors for mediastinitis after cardiac surgery-a retrospective analysis of 1700 patients. J Cardiothor Surg 2007;2:23.
Domkowski P, Smith M, Gonyon D, et al. Evaluation of vacuum-assisted closure in the treatment of poststernotomy mediastinitis. J Thorac Cardiovasc Surg 2003;126:386-390.
Eklund A, Lyytikäinen O, Klemets P, et al. Mediastinitis after more than 10 000 cardiac surgical procedures. Ann Thorac Surg 2006;82:1784-1789.
Farinas MC, Peralta G, Bernal F, et al. Suppurative mediastinitis after open-heart surgery: a case-control study covering a seven-year period in Santander, Spain. Clin Infect Dis 1995;20:272.
Fleck T, Moidl R, Giovanoli P, et al. A conclusion from the first 125 patients treated with the vacuum assisted closure system for postoperative sternal wound infection. Interact Cardio Vacs Thorac Surg 2006;5:145-148.
Fowler VGJr, Kaye KS, Simel DL, et al. Staphylococcus aureus bacteremia after median sternotomy: clinical utility of blood culture results in the identification of postoperative mediastinitis. Circulation 2003;108:73.
Friedman ND, Bull AL, Russo PL, et al. An alternative scoring system to predict risk for surgical site infection complicating coronary artery bypass graft surgery. Infect Control Hosp Epidemiol 2007;28:1162.
Fuchs U, Zittermann A, Stuettgen B, et al. Clinical outcome of patients with deep sternal wound infection managed by vacuum-assisted closure compared to conventional therapy with open packing: a retrospective analysis. Ann Thorac Surg 2005;79:526-531.
Gardlund B, Bitkover CY, Vaage S. Postoperative mediastinitis in cardiac surgery -microbiology and pathogenesis. Eur J Cardiothorac Surg 2002;21:825-830.
Gelape CL. Surgical wound infection following heart surgery. Arq Bras
Cardiol 2007:89; e3- e9.
Griffith BP, Kormos RK, Hardesty RL. The artificial heart: Infection
-related morbility and its effect on transplantation. Ann Thorac Surg 1998;45:409.
Gualis J, Flores S, Tamayo E, et al. Risk factors for mediastinitis and endocarditis after cardiac surgery. Asian Cardiovasc Thorac Ann 2009;17:612-616.
Guaragna J, Facchi L, Guerra C, et al. Predictors of mediastinitis after cardiac surgery. Rev Bras Cir Cardiovasc 2004;19(2):165-170. Gustafsson R, Sjögren J, Ingemansson R. Deep sternal wound infection: a sternal-sparing technique with vacuum-assisted closure therapy. Ann Thorac Surg 2003;76:2048-2053. Hammermesiter KE, Burchfiel C, Johnson R, et al. Identification of patient at greatgest risk for developing major complication at cardiac surgery. Circulation 1990; 82: IV 380-389. Hirata N, Hatsuoka S, Amemiya A, et al. New strategy for treatment of MRSA mediastinitis: one-stage procedure for omental transposition and closed irrigation. Ann Thorac Surg 2003;76:2104-2106.
Horan TC, Gaynes RP, Martone WJ, et al. CDC definitions of nosocomial surgical site infections, 1992: a modification of CDC definitions of surgical wound infections. Infect Control Hosp Epidemiol 1992;13:606-608.
Horan TC, Gaynes RP, Martone WJ, et al. CDC definitions of nosocomial surgical site infections, 1992: a modification of CDC definitions of surgical wound infections. Am J Infect Control 1992; 20(5): 271-274.
Immer F, Durrer M, Mühlemann K, et al. Deep sternal wound infection after cardiac surgery: modality of treatment and outcome. Ann Thorac Surg 2005;80:957-961.
Jolles H, Henry DA, Roberson JP, et al. Mediastinitis following median sternotomy: CT findings. Radiology 1996;201:463.
Karra R, Mc Dermott L, Connelly S, et al. Risk factors for 1-year mortality after postoperative mediastinitis. Gen Thor Surg 2006;132:537-543.
Kohli M, Yuan L, Escobar M, et al. A risk index for sternal surgical wound infection after cardiovascular surgery. Infect Control Hosp Epidemiol 2003; 24:17.
Kohman LJ, Coleman MJ, Parker FB. Bacteremia and sternal infection after coronary artery bypass grafting. Ann Thorac Surg 1990;49:454.
Loop FD, Lytle BW, Cosgrove DM, et al. Sternal wound complications after isolated coronary artery bypass grafting early and late mortality, morbility and cost of care. Ann Thorac Surg 1990;49:179-186.
Luckraz H, Murphy F, Bryant S, et al. Vacuum-assisted closure as a treatment modality for infections after cardiac surgery. J Thorac Cardiovasc Surg 2003;125:301-305.
Machín JC, Martínez JO, Ortiz A, et al, Nuestra experiencia en el tratamiento de la mediastinitis aguda (artículo en línea). MEDISAN 2005;9(1).
Maroto LC, Aguado JM, Carrascal Y, et al. Role of epicardial pacing wire cultures in the diagnosis of poststernotomy mediastinitis. Clin Infect Dis 1997;24:419.
Mekontso A, Honoré S, Kirsch M, et al. Usefulness of routine epicar-dial pacing wire culture for early prediction of poststernotomy mediastinitis. J Clin Microbiol 2004:5245-5248.
Mekontso-Dessap A, Kirsch M, Brun-Buisson C, et al. Postesternotomy mediastinitis due to Staphylococcus aureus: comparison of methilcillin-resistant and methicillin-susceptible cases. Clin Infect Dis 2001;32:877.
Merrill WH, Akhter SA, Wolf RK, et al. Simplified treatment of postoperative mediastinitis. Ann Thorac Surg 2004;78:608-612.
Milano CA, Kesler K, Archibald N, et al. Mediastinitis after bypass graft surgery. Risk factos and long-term survival. Circulation 1995;92:2245-2251.
Molina E, Nelson E, Robin R, et al. Treatment of postoperative eternal dehiscence with mediastinitis: twenty-four-year use of single method. J Thorac Cardiovasc Surg 2006;132:782-787.
Muñoz P, Menasalvas A, Bernaldo de Quiros JC, et al. Postsurgical mediastinitis: a case -control study. Clin Infect Dis 1997;25:1060-1064.
Nagachinta T, Stephens M, Reitz B, et al. Risk factors for surgical wound infection following cardiac surgery. J Infect Dis 1987;156:967.
Omran A, Karimi A, Ahmadi S, et al. Superficial and deep sternal wound infection after more than 9000 coronary artery bypass graft (CABG): incidence, risk factors and mortality. BMC Infec Dis 2007;7:112.
Petzina R, Ugander M, Gustafsson L, et al. Hemodynamic effects of vacuum-assisted closure therapy in cardiac surgery: assessment using magnetic resonance imaging. J Thorac Cardiovasc Surg 2007;133:1154-1162.
Poncelet A, Lengele B, Delaere B, et al. Algorithm for primary closure in sternal wound infection: a single institution 10-year experience. Eur J Cardiothorac Surg 2008;33:232-238.
Reddy SL, Grayson AD, Smith G, et al. Methicillin resistant Staphylococcus aureus infections following cardiac surgery: incidence, impact and identifying adverse outcome traits. Eur J Cardiothorac Surg 2007;32:113.
Reida M, Oakley E, Wright J. Postoperative mediastinitis: classification and management. Ann Thorac Surg 706 1996;61:1030-1036.
Roy MC, Herwaldt LA, Embrey R, et al. Does the Centers for Disease Control's NNIS system risk index stratify patients undergoing cardiothoracic operations by their risk of surgical-site infection? Infect Control Hosp Epidemiol 2000; 21:186.
Russo PL, Spelman DW. A new surgical-site infection risk index using risk factors identified by multivariate analysis for patients undergoing coronary artery bypass graft surgery. Infect Control Hosp Epidemiol 2002;23:372.
San Juan R, Chaves F, López Gude MJ, et al. Staphylococcus aureus poststernotomy mediastinitis: description of two distinct acquisition pathways with different potential preventive approaches. J Thorac Cardiovasc Surg 2007;134:670.
Schimmer C, Sommer S, Bensch M, et al. Management of poststernotomy mediastinitis: experience and results of different therapy modalities. Thorac Cardiov Surg 2008;56:200-204.
Shumacker HB, Mandelbaum I. Continuous antibiotic irrigation in the treatment of infection. Arch Surg 1963;86:384-387.
Sjögren J, Gustafsson R, Nilsson J, et al. Clinical outcome after poststernotomy mediastinitis: vacuum-assisted closure versus conventional treatment. Ann Thorac Surg 2005;79:2049-2055.
Sjogren J, Malmsjo M, Gustafsson R, et al. Poststernotomy mediastinitis: a review of conventional surgical of the Lund University Hospital mediastinitis algorithm. Eur J Cardiothorac Surg 2006;30:898-905.
Sjogren J, Nilsson J, Gustafsson R, et al. The impact of vacuum-assisted closure on long-term survival after post-sternotomy mediastinitis. Ann Thorac Surg 2005;80:1270-1275.
Trouillet JL, Vaugnat A, Combes A, et al. Acute possternotomy mediastinitis managed with debridement and closed-drainage aspiration: factors associated with death in the intensive care unit. J Thorac Cardiovasc Surg 2005;129:518.
Valla J, Corbineau H, Langanay T, et al. Mediastinitis after cardiac surgery. A 10-year evaluation (1985-1995). Ann Cardiol Angiol 1996;369-376.
Wong C, Senewiratne S, Garlick B, et al. Two-stage management of sternal wound infection using bilateral pectoralis major advancement flap. Eur J Cardiothorac Surg 2006;30:148-152.