La prevalencia de calcificación valvular aórtica (CVA) tiene influencia importante de la etnia y se desconoce en población mexicana. Nuestro objetivo fue investigar la prevalencia de CVA y sus asociaciones con factores de riesgo cardiovascular y calcificación arterial coronaria (CAC).
MétodoEn 1,267 sujetos (53% mujeres) sin enfermedad coronaria conocida y con edad de 35 a 75 años, la CVA y la CAC se evaluaron mediante tomografía computada multidetector, utilizando el método de Agatston. Los factores de riesgo cardiovascular se documentaron en todos los participantes. Las asociaciones de CVA con CAC y factores de riesgo se estimaron usando el análisis de regresión logística múltiple.
ResultadosLa prevalencia global de CVA y CAC fue del 19.89% y del 26.5%, respectivamente. Ambas condiciones aumentaron con la edad y se encontraron con mayor frecuencia en hombres (25.5 y 37.1%, respectivamente) que en mujeres (14.9 y 13%, respectivamente). La CVA se observó en únicamente el 8.5% de los sujetos sin CAC, mientras que en aquellos con CAC 1-99, 100-399 y >400 unidades Agatston, las prevalencias fueron del 36.8, 56.8 y 84%, respectivamente. El análisis de regresión logística múltiple ajustado por edad, género, obesidad, inactividad física, hipertensión, dislipidemia y valores altos de insulina, mostró que la presencia de CAC (RM [IC95%]: 3.23 [2.26-4.60]), obesidad (1.94 [1.35-2.79]), género masculino (1.44 [1.01-2.05]) y edad (1.08 [1.03-1.10]), fueron predictores independientes y significativos de la CVA.
ConclusionesLa prevalencia de CVA es alta y se asocia significativamente con factores de riesgo aterosclerótico y CAC en población mexicana.
The prevalence of aortic valve calcification (AVC), strongly influenced by ethnicity, is unknown in Mexican population. The aim of this study was to investigate the prevalence of AVC and its associations with cardiovascular risk factors and coronary artery calcification (CAC), in Mexican subjects.
MethodsIn 1,267 subjects (53% women) without known coronary heart disease, aged 35 to 75 years, AVC and CAC were assessed by multidetector-computed tomography using the Agatston score. Cardiovascular risk factors were documented in all participants. The associations of AVC with CAC and risk factors were assessed by multivariable logistic regression analyses.
ResultsThe overall prevalence of AVC and CAC was 19.89% and 26.5%, respectively. AVC and CAC increased with age and were found more frequently in men (25.5% and 37.1%, respectively) than in women (14.9% and 13.0%, respectively). AVC was observed in only 8.5% of subjects without CAC, while those with CAC 1-99, 100-399, and >400 Agatston units had AVC prevalences of 36.8%, 56.8%, and 84.0%, respectively. The multivariable logistic regression analyses, adjusted for age, gender, obesity, physical inactivity, hypertension, dyslipidemia and high insulin levels, showed that the presence of CAC (OR [CI95%]: 3.23 [2.26-4.60]), obesity (1.94 [1.35-2.79]), male gender (1.44 [1.01-2.05]) and age (1.08 [1.03-1.10]), were significant independent predictors of AVC.
ConclusionPrevalence of AVC is high and significantly associated with atherosclerotic risk factors and CAC in this Mexican population.
La esclerosis valvular aórtica consiste en el engrosamiento de al menos una de las 3 valvas que conforman a la válvula aórtica. Habitualmente, la apertura valvular no se encuentra disminuida y la velocidad máxima del flujo transvalvular es menor de 2-2.5m/seg, por lo que la alteración es anatómica más que funcional1,2. La calcificación valvular aórtica (CVA) es característica de la esclerosis valvular aórtica. Por mucho tiempo la esclerosis valvular aórtica fue considerada como una anomalía pasiva y degenerativa asociada a un soplo benigno; sin embargo, los estudios prospectivos longitudinales han documentado su relación con desenlaces cardiovasculares. Además, las investigaciones in vitro, en modelos animales y en tejidos humanos, han mostrado que su patogenia es similar a la de la aterosclerosis, con participación de células inflamatorias, fibroblastos, lipoproteínas y calcificación tisular3–7. Factores de riesgo coronario, tales como edad, hipercolesterolemia, género masculino, hábito de fumar8–11, síndrome metabólico12,13, proteína C-reactiva y lipoproteína(a)14, se han encontrado asociados de forma independiente con la CVA. También se ha informado relación de la CVA con enfermedad coronaria obstructiva15,16 y con la aterosclerosis subclínica, definida por la presencia de calcificación arterial coronaria (CAC)17–20. Sin embargo, algunos estudios no han encontrado asociación de la CVA con la enfermedad coronaria21 o la dislipidemia22, e incluso, las intervenciones clínicas con estatinas para tratar de modificar la progresión de la CVA han tenido resultados negativos23,24.
En años recientes, se ha reconocido que la CVA tiene 2 implicaciones clínicas de gran relevancia. Por un lado, es indicador de aterosclerosis, y se asocia con un 50% de aumento en el riesgo para infarto del miocardio y mortalidad cardiovascular3,25,26. Por otro, hasta 6% de los casos progresa a estenosis aórtica en 7 años1,27–29.
En estudios poblacionales se han reportado prevalencias de CVA del 10-37%9,10,16,25. Las causas de esta amplia variación son las diferencias en criterios de selección, en la frecuencia de los factores de riesgo y, particularmente, en la edad de las poblaciones estudiadas25,30–32. La etnia es otro factor con importante influencia en la frecuencia de esta alteración valvular. En el estudio multiétnico de aterosclerosis (MESA, por sus siglas en inglés), la prevalencia más alta se observó en los caucásicos, seguida por las de los hispanoamericanos, afroamericanos y asiaticoamericanos33. En todos los grupos étnicos se ha observado que al aumentar la edad incrementa el grado de CVA, y que en ausencia de CAC, la CVA es poco común17.
Considerando las importantes implicaciones clínicas de la CVA, las inconsistencias en su relación con los factores de riesgo cardiovascular, su frecuencia variable en las diferentes razas y que en nuestro país no existe información sobre la magnitud de este problema, el objetivo del presente estudio fue investigar la prevalencia de esta anormalidad y determinar su relación con los factores de riesgo cardiovascular y la CAC en población mestiza mexicana residente en su ambiente habitual.
MétodosPoblación de estudioEl estudio incluyó participantes del proyecto Genética de la Enfermedad Aterosclerosa (GEA), diseñado para estudiar las bases genéticas de la enfermedad arterial coronaria, y las relaciones de los factores de riesgo cardiovascular tradicionales y emergentes con la aterosclerosis subclínica en adultos mexicanos34. El proyecto fue aprobado por el Comité de Ética del Instituto Nacional de Cardiología Ignacio Chávez y realizado de acuerdo a los lineamientos de la Declaración de Helsinki. Todos los participantes firmaron consentimiento informado.
Para el presente análisis se incluyeron los sujetos de 35 a 75 años, sin historia personal o familiar de enfermedad cardiovascular prematura, seleccionados de la población que acude al banco de sangre del Instituto, o reclutados de centros de convivencia social y deportiva. Se excluyeron los individuos con historia o evidencia de enfermedad renal, hepática, tiroidea u oncológica. Los tratados con corticosteroides también fueron excluidos de la investigación. A todos los participantes se les aplicaron cuestionarios estandarizados para obtener información demográfica, historia familiar y personal de factores de riesgo cardiovascular, patrones de alimentación, actividad física, uso de medicamentos, consumo de tabaco y de alcohol35,36. La presión arterial se midió en posición sedente después de un periodo de reposo de 10min, con un esfigmomanómetro digital Welch Allyn Series 5200 (Shaneateies Fails, N.Y., EE. UU.) y el promedio de las 2 últimas de 3 mediciones consecutivas fue utilizado para el análisis. Se midieron el peso y la talla utilizando una báscula calibrada y un estadímetro de pared SECA 222 (Hamburgo, Alemania), y se calculó el índice de masa corporal dividiendo el peso en kilogramos entre el cuadrado de la talla en metros. Se consideró la presencia de sobrepeso cuando el índice de masa corporal fue de 25-29.9kg/m2, y de obesidad cuando fue≥30kg/m2. La circunferencia de cintura se midió con una cinta métrica de fibra de vidrio, en el punto medio de la distancia entre el borde inferior de la última costilla y la cresta iliaca. El síndrome metabólico fue definido de acuerdo al consenso de la Asociación Americana del Corazón y los Institutos Nacionales del Corazón, Pulmón y Sangre de Estados Unidos37, a excepción de la obesidad central, que fue considerada como cintura>90cm en hombres y >80cm en mujeres38. La diabetes mellitus fue definida de acuerdo a los criterios de la Asociación Americana de Diabetes39, cuando los participantes manifestaron utilizar medicamentos para el control de la glucosa y en aquellos con diagnóstico previo de diabetes realizado por un médico. La hipertensión arterial se definió con cifras de presión arterial sistólica y diastólica≥140/90mmHg y/o uso de medicamentos antihipertensivos. La hiperinsulinemia se definió como un valor≥16.97μU/mL en mujeres y≥15.20μU en hombres. La resistencia a la insulina fue estimada por medio del modelo homeostático de resistencia a la insulina (HOMA-RI), y se consideró presente cuando los valores se encontraron por arriba del percentil 75 (3.66 en mujeres y 3.38 en hombres). Estos valores fueron obtenidos de una submuestra del estudio GEA en la que se incluyó a 131 hombres y 185 mujeres sin obesidad, y con valores normales de presión arterial, glucosa y lípidos. Las dislipidemias se definieron de acuerdo a los siguientes puntos de corte; hipercolesterolemia: colesterol total>200mg/dL o colesterol de lipoproteínas de baja densidad >130mg/dL; hipertrigliceridemia: triglicéridos>150mg/dL; colesterol de lipoproteínas de alta densidad (C-HDL) bajo:<40mg/dL en hombres y <50mg/dL en mujeres.
Mediciones bioquímicasSe obtuvieron muestras de sangre venosa después de un periodo de 12h de ayuno. La glucosa plasmática, colesterol total, triglicéridos, C-HDL y apolipoproteína B, se cuantificaron utilizando procedimientos enzimáticos-colorimétricos (Roche/Hitachi, Alemania) en un autoanalizador Hitachi 902 (Hitachi LTD, Tokio, Japón). La precisión y reproducibilidad de las mediciones de lípidos en el Laboratorio de Endocrinología del Instituto Nacional de Cardiología son evaluadas de forma periódica por el Centro de Control y Prevención de Enfermedades de Atlanta, GA, EE. UU. El colesterol de lipoproteínas de baja densidad fue estimado de acuerdo a la ecuación de DeLong et al.40. La proteína C-reactiva de alta sensibilidad se determinó por medio de inmunonefelometría (BN ProSpec Nefelometer, Dade Behring, Marburg, Alemania). El coeficiente de variación fue<6% para todos estos ensayos. La insulina se midió por radioinmunoanálisis (Millipore RIA Kit ST, Charles, Missouri, EE. UU.), con coeficientes de variación intra- e interensayo del 2.1 y 6.8%, respectivamente.
Mediciones tomográficasEn todos los participantes se evaluaron la CAC y la CVA. Las mediciones se realizaron utilizando un tomógrafo helicoidal de 64 multidetectores (Somaton Sensation, Siemens, Malvern, PA, EE. UU.) con sincronización cardiaca mediante protocolo prospectivo con los siguientes parámetros: 120kV, 120mA y grosor de corte de 3mm. Las imágenes fueron interpretadas por radiólogos expertos. En las imágenes tomográficas se cuantificaron la CAC y la CVA de acuerdo al método de Agatston41,42. La comparación del grado de CVA con el peso del calcio medido directamente después de la autopsia ha mostrado una elevada correlación29. El calcio de la pared aórtica que se encontró conectado de manera inmediata al calcio valvular fue incluido para el puntaje de CVA. La variabilidad intraobservador para CVA fue excelente; en 20 casos tomados al azar se encontró un coeficiente de correlación de 0.99 con p<0.001.
Análisis estadísticoLos datos se expresan como medias y desviación estándar, medianas y rango intercuartílico, o como frecuencias para las variables categóricas. Las comparaciones para variables numéricas se realizaron con la prueba t-Student o U-Mann-Whitney, según correspondiera, y por medio de X2 para las comparaciones entre variables categóricas. La CVA fue analizada como variable dicotómica (CVA>0 o=0) o como variable continua (puntaje de Agatston). Se hicieron análisis univariados y bivariados, incluyendo análisis de correlación de Spearman. La independencia de las asociaciones fue evaluada mediante análisis de regresión logística multivariado, ajustado por otros factores de riesgo. El valor de p<0.05 fue considerado como significativo. Los cálculos se realizaron con el paquete estadístico Stata v11.11 (StataCorp LP).
ResultadosSe estudiaron1,267 sujetos (53% mujeres), con edad media de 54±9 años. La prevalencia de CVA en el total de la población fue del 19.89%, con frecuencia significativamente más elevada en los hombres que en la mujeres (25.5 vs. 14.9%, p<0.005). La mediana del puntaje de Agatston en la válvula aórtica fue de 40±113. La prevalencia de CAC en la población total fue del 26.51% y esta anormalidad también se observó en mayor proporción de hombres en comparación con las participantes del género femenino (37.08 vs. 13.05%, p<0.0001). El puntaje de Agatston en la red vascular coronaria fue de 2.3 (0-74.7unidades Agatston).
La probabilidad de presentar CVA>0 aumentó con la gravedad creciente de CAC. En los sujetos sin CAC solo el 8.45% presentó CVA, mientras que en los sujetos con puntajes de CAC de 1-99, 100-399, y >400unidades Agatston, el 36.8, 56.8 y 84% tuvieron CVA, respectivamente (p<0.001).
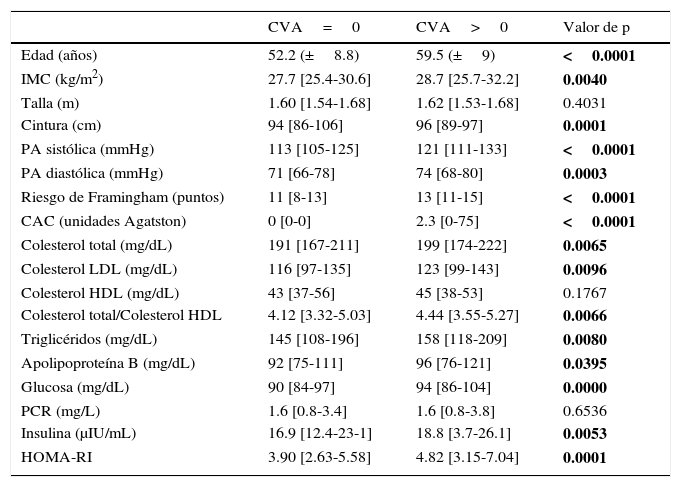
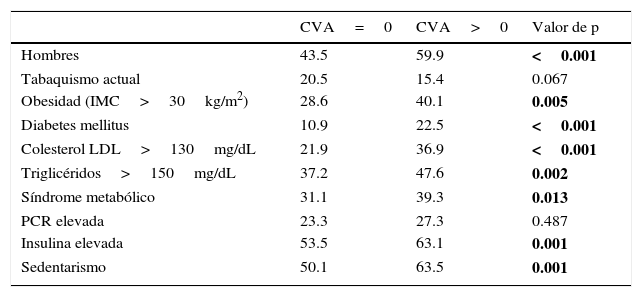
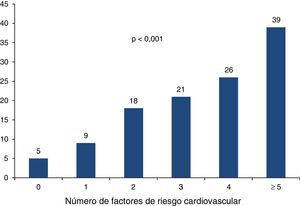
Las características clínicas, antropométricas y bioquímicas de la población estudiada, estratificadas por la presencia o ausencia de CVA, se muestran en la tabla 1. La edad, las medidas antropométricas de índice de masa corporal y circunferencia de cintura, la presión arterial, así como el riesgo de Framingham y el puntaje de CAC, fueron significativamente más altas en el grupo de CVA. Con excepción del C-HDL, las variables lipídicas, incluyendo la apolipoproteína B, mostraron valores medios significativamente más altos en los participantes con CVA. Con relación al metabolismo de los hidratos de carbono, este último grupo también mostró asociación con las concentraciones mayores de glucosa e insulina, y valores más altos del índice de resistencia a la insulina. La proteína C-reactiva de alta sensibilidad fue muy similar en ambos grupos. En general, el grupo de participantes con CVA mostró un perfil de riesgo cardiovascular más adverso, caracterizado por prevalencias más altas de obesidad, diabetes, dislipidemias, síndrome metabólico, hiperinsulinemia y estilo de vida sedentario (tabla 2). En la figura 1 se muestra el aumento gradual y progresivo de la prevalencia de la CVA conforme se incrementa el número de factores de riesgo cardiovascular.
Características generales de la población estratificada por ausencia o presencia de calcificación valvular aórtica
| CVA=0 | CVA>0 | Valor de p | |
|---|---|---|---|
| Edad (años) | 52.2 (±8.8) | 59.5 (±9) | <0.0001 |
| IMC (kg/m2) | 27.7 [25.4-30.6] | 28.7 [25.7-32.2] | 0.0040 |
| Talla (m) | 1.60 [1.54-1.68] | 1.62 [1.53-1.68] | 0.4031 |
| Cintura (cm) | 94 [86-106] | 96 [89-97] | 0.0001 |
| PA sistólica (mmHg) | 113 [105-125] | 121 [111-133] | <0.0001 |
| PA diastólica (mmHg) | 71 [66-78] | 74 [68-80] | 0.0003 |
| Riesgo de Framingham (puntos) | 11 [8-13] | 13 [11-15] | <0.0001 |
| CAC (unidades Agatston) | 0 [0-0] | 2.3 [0-75] | <0.0001 |
| Colesterol total (mg/dL) | 191 [167-211] | 199 [174-222] | 0.0065 |
| Colesterol LDL (mg/dL) | 116 [97-135] | 123 [99-143] | 0.0096 |
| Colesterol HDL (mg/dL) | 43 [37-56] | 45 [38-53] | 0.1767 |
| Colesterol total/Colesterol HDL | 4.12 [3.32-5.03] | 4.44 [3.55-5.27] | 0.0066 |
| Triglicéridos (mg/dL) | 145 [108-196] | 158 [118-209] | 0.0080 |
| Apolipoproteína B (mg/dL) | 92 [75-111] | 96 [76-121] | 0.0395 |
| Glucosa (mg/dL) | 90 [84-97] | 94 [86-104] | 0.0000 |
| PCR (mg/L) | 1.6 [0.8-3.4] | 1.6 [0.8-3.8] | 0.6536 |
| Insulina (μIU/mL) | 16.9 [12.4-23-1] | 18.8 [3.7-26.1] | 0.0053 |
| HOMA-RI | 3.90 [2.63-5.58] | 4.82 [3.15-7.04] | 0.0001 |
CAC: calcificación arterial coronaria; CVA: calcificación valvular aórtica; HDL: lipoproteínas de alta densidad; HOMA-RI: índice de resistencia a la insulina; IMC: índice de masa corporal; LDL: lipoproteínas de baja densidad; PA: presión arterial; PCR: proteína C-reactiva. Los datos expresan media±desviación estándar o mediana [rango intercuartílico].
Las negritas indican los valores de p con significado estadístico.
Prevalencia de factores de riesgo cardiovascular tradicionales y emergentes en los 2 grupos de participantes
| CVA=0 | CVA>0 | Valor de p | |
|---|---|---|---|
| Hombres | 43.5 | 59.9 | <0.001 |
| Tabaquismo actual | 20.5 | 15.4 | 0.067 |
| Obesidad (IMC>30kg/m2) | 28.6 | 40.1 | 0.005 |
| Diabetes mellitus | 10.9 | 22.5 | <0.001 |
| Colesterol LDL>130mg/dL | 21.9 | 36.9 | <0.001 |
| Triglicéridos>150mg/dL | 37.2 | 47.6 | 0.002 |
| Síndrome metabólico | 31.1 | 39.3 | 0.013 |
| PCR elevada | 23.3 | 27.3 | 0.487 |
| Insulina elevada | 53.5 | 63.1 | 0.001 |
| Sedentarismo | 50.1 | 63.5 | 0.001 |
CVA: calcio valvular aórtico; IMC: índice de masa corporal; LDL: lipoproteínas de baja densidad; PCR: proteína C-reactiva.
Las negritas indican los valores de p con significado estadístico.
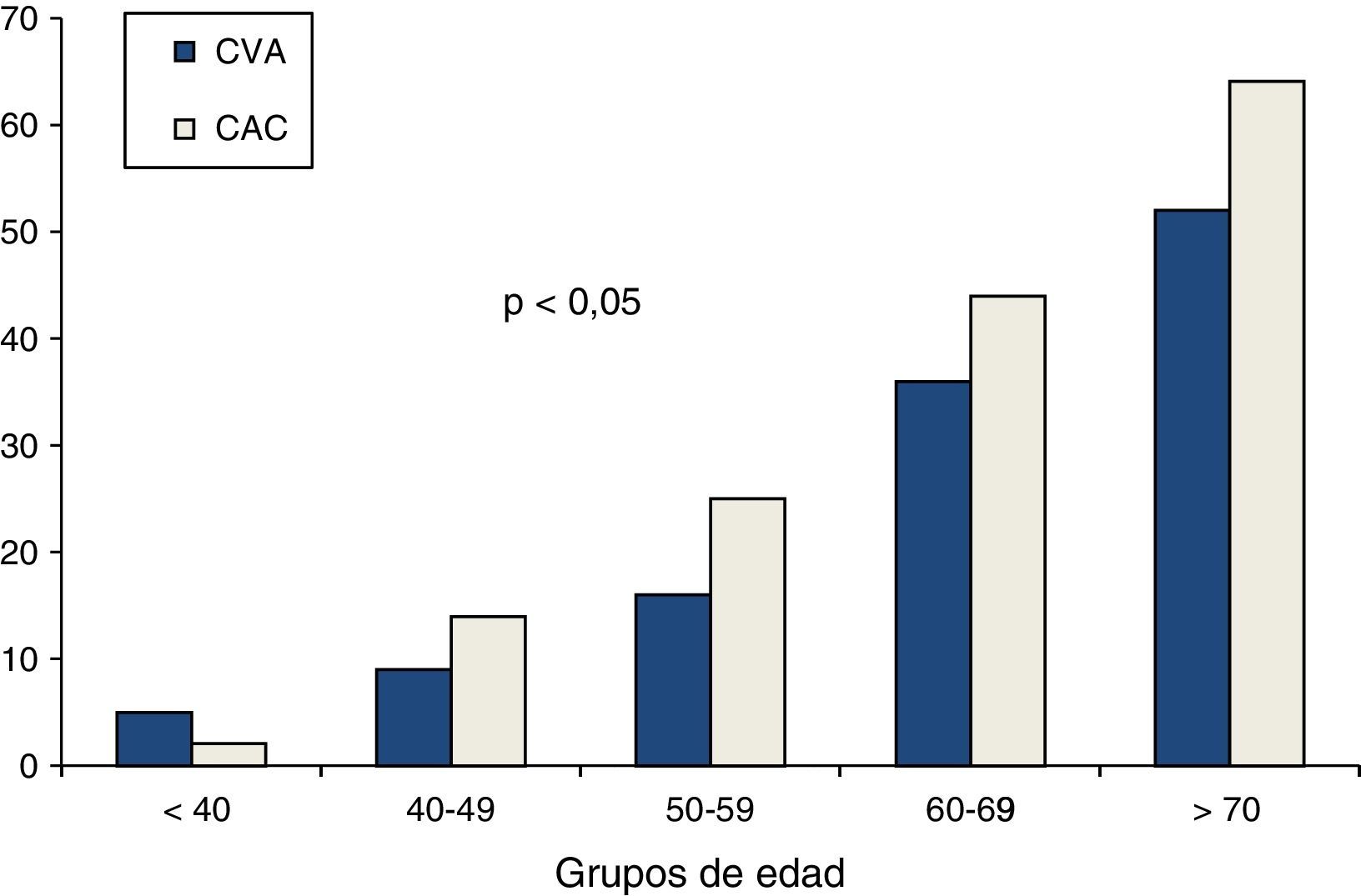
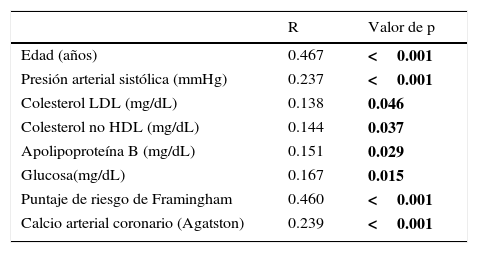
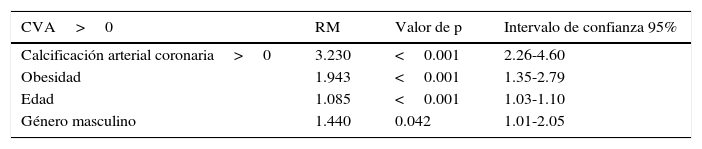
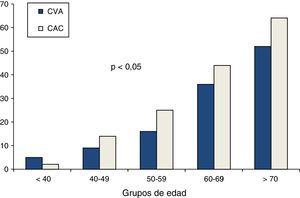
Las asociaciones univariadas de la CVA con las variables clínicas se evaluaron utilizando el análisis de correlación de Spearman. La edad y el puntaje de riesgo cardiovascular de Framingham fueron las variables que mostraron mayor correlación con la CVA, seguidas por el calcio coronario y la presión arterial sistólica. De menor magnitud fueron las asociaciones con la glucosa de ayuno y las variables lipídicas (tabla 3). La edad mostró una relación fuertemente positiva con la presencia tanto de CVA como de CAC (fig. 2). En los mayores de 70 años, la prevalencia de CVA fue del 52% y la de CAC del 64%, mientras que en los menores de 40 años las prevalencias de ambas anormalidades no alcanzaron el 5%. El análisis de regresión logística multivariado ajustado por edad, género, obesidad, hipertensión arterial, inactividad física, insulina elevada y dislipidemia (tabla 4) identificó la presencia de CAC, obesidad, género masculino y edad, como los predictores independientes de la presencia de CVA en la población estudiada.
Correlaciones de la calcificación valvular aórtica con las variables clínicas, bioquímicas y tomográficas
| R | Valor de p | |
|---|---|---|
| Edad (años) | 0.467 | <0.001 |
| Presión arterial sistólica (mmHg) | 0.237 | <0.001 |
| Colesterol LDL (mg/dL) | 0.138 | 0.046 |
| Colesterol no HDL (mg/dL) | 0.144 | 0.037 |
| Apolipoproteína B (mg/dL) | 0.151 | 0.029 |
| Glucosa(mg/dL) | 0.167 | 0.015 |
| Puntaje de riesgo de Framingham | 0.460 | <0.001 |
| Calcio arterial coronario (Agatston) | 0.239 | <0.001 |
HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad.
Las negritas indican los valores de p con significado estadístico.
Factores de riesgo para la presencia de calcificación valvular aórtica en análisis de regresión logística multivariada
| CVA>0 | RM | Valor de p | Intervalo de confianza 95% |
|---|---|---|---|
| Calcificación arterial coronaria>0 | 3.230 | <0.001 | 2.26-4.60 |
| Obesidad | 1.943 | <0.001 | 1.35-2.79 |
| Edad | 1.085 | <0.001 | 1.03-1.10 |
| Género masculino | 1.440 | 0.042 | 1.01-2.05 |
CVA: calcificación valvular aórtica; RM: razón de momios.
El modelo fue ajustado por: edad, género, obesidad, hipertensión arterial, hipercolesterolemia, hipertrigliceridemia, apolipoproteína B elevada, diabetes, sedentarismo e insulina elevada.
Los resultados del presente estudio mostraron que la prevalencia de CVA en el total de los 1,267 participantes fue del 20%, y significativamente más alta en el sexo masculino (25%) que en el femenino (15%). El análisis de regresión logística multivariado ajustado por varios factores confusores, permitió identificar el puntaje de CAC>0, y la obesidad como los predictores independientes más importantes de la presencia de CVA, seguidos por el género masculino y la edad.
Estudios previos realizados en individuos caucásicos han reportado prevalencias de CVA del 10-18%9,16, con aumentos a 25-35% en los sujetos mayores de 65 años10,25. En general las prevalencias más altas se han observado después de los 60 años de edad, en hombres10,17, en individuos con sospecha de enfermedad cardiovascular y en aquellos con presencia de CAC18,33. El estudio MESA fue el primero en demostrar la clara influencia de la etnia en la prevalencia de CVA17. En ese estudio, que incluyó a sujetos sin historia personal de enfermedad cardiovascular, las prevalencias fueron del 20% en hombres blancos, del 19% en hispanoamericanos, del 15% en afroamericanos y del 10% en chinos; en mujeres, las prevalencias fueron del 12, 8, 11 y 7%, respectivamente. Es importante hacer notar que a pesar de ser una población más joven (54±9 vs. 63±10 años de edad), los participantes del estudio GEA mostraron prevalencias de CVA más altas tanto en hombres (25 vs. 19%) como en mujeres (15 vs. 8%), comparados con los individuos hispanoamericanos del estudio MESA. Este hallazgo señala la necesidad de desarrollar nomogramas específicos de población para identificar en forma más precisa la carga de aterosclerosis en población mexicana.
Al igual que en reportes previos33, se observó que, en comparación con individuos sin anormalidad valvular, aquellos con CVA presentan un perfil de riesgo cardiovascular más adverso, caracterizado por mayor exceso de peso, valores más altos de presión arterial y prevalencias mayores de dislipidemias. Sin embargo, las asociaciones independientes de la CVA identificadas mediante análisis multivariados, con edad, sexo, dislipidemias, tabaquismo, índice de masa corporal, diabetes, síndrome metabólico, hígado graso, proteína C-reactiva, lipoproteína(a) y adiponectina, han sido variables y diferentes en los distintos estudios previos8–14,43,44. En el presente estudio, la CVA se encontró asociada en forma independiente y significativa con obesidad, edad, género masculino y la presencia de CAC.
Aunque algunos estudios no han mostrado asociación entre la CVA y la enfermedad arterial coronaria21, la mayoría de las investigaciones han reportado relación independiente entre estas 2 condiciones. Conte et al.15 encontraron mayor gravedad de lesiones ateromatosas y enfermedad coronaria obstructiva significativamente más alta (71%) en pacientes con esclerosis aórtica que en aquellos sin la lesión valvular (24%). En otro estudio, se observó asociación de la CVA con la presencia y mayor extensión de la enfermedad coronaria, y un aumento de más de 3 veces en el riesgo de presentar cualquier tipo de placa16. También se ha informado asociación de la CVA con la presencia y gravedad de la forma subclínica de la enfermedad coronaria, definida por la identificación de CAC. En una muestra de 2,740 personas de 20-79 años de edad, sin historia personal de enfermedad coronaria, Wong et al.18 reportaron la prevalencia de CVA en 27% de hombres en el cuartil más alto de CAC y de solo 2% en aquellos sin CAC. Más recientemente, un reporte del estudio MESA en 6,809 sujetos con edad promedio de 62 años y sin enfermedad cardiovascular33, mostró presencia de CVA únicamente en el 5% de los sujetos sin CAC y un aumento gradual y progresivo al 14, 25 y 38% en los individuos con puntajes de CAC de 1-99, 100-399 y >400 unidades Agatston. Esta asociación fue independiente de edad, sexo y factores de riesgo convencionales en cada una de las etnias incluidas en MESA. En consistencia con esos estudios, nuestros resultados mostraron correlación muy estrecha de la CVA con la CAC. Esta asociación permaneció significativa después de ajustar por edad, género, obesidad, hipertensión, hipercolesterolemia, diabetes, inactividad física y concentraciones elevadas de triglicéridos, apolipoproteína B e insulina. Además, observamos que la CVA aumentó en paralelo con la gravedad creciente de CAC. Los hallazgos de este y otros estudios18,33 señalan que la presencia de CVA es un indicador de la carga de aterosclerosis más que un cambio degenerativo, lo que explica, al menos parcialmente, el mayor riesgo de infarto del miocardio y de muerte cardiovascular asociado con CVA26.
Durante muchos años, la CVA fue considerada como un proceso pasivo y degenerativo relacionado con el envejecimiento, pero estudios realizados en las últimas 2 décadas han proporcionado evidencias sobre procesos moleculares participantes en el desarrollo y progresión de esta anormalidad valvular. Investigaciones in vitro han mostrado que productos de oxidación de los lípidos tienen propiedades procalcificantes, mientras que estudios en animales han demostrado que la hipercolesterolemia induce la calcificación de la válvula aórtica y su estenosis45,46. Además, se ha reportado que las válvulas con estenosis calcificada contienen mayor cantidad de LDL oxidadas, y la expresión de metaloproteinasas se encuentra aumentada en comparación con válvulas sanas47,48. Estos hallazgos son similares a lo observado en las placas ateroscleróticas coronarias49. Investigaciones de los últimos años han revelado que la infiltración lipídica, la inflamación y la osteogénesis son mecanismos patogénicos con importante participación en la CVA50,51. En un modelo murino de estenosis aórtica, se encontró correlación del desarrollo temprano de la alteración valvular con colesterol, inflamación y expresión aumentada de genes osteogénicos52. Más recientemente, Bouchareb et al.53 demostraron que las concentraciones altas de autotaxina, enzima transportada por la lipoproteína(a) y producida por múltiples tipos celulares incluyendo las células valvulares intersticiales, es un factor con importante participación en la inflamación y mineralización de la válvula aórtica. En conjunto los resultados de estas investigaciones apoyan el concepto de que la enfermedad valvular aórtica se desarrolla mediante un proceso similar al de la aterosclerosis coronaria54.
Este estudio tiene varias limitaciones. Primero, por ser de tipo transversal, no permite establecer relaciones de causalidad, sino solamente hacer inferencias. Segundo, como la muestra se formó con sujetos voluntarios, los participantes pueden o no ser representativos de la población general. Sin embargo, se esperaría que la relación de riesgo fuera similar a la de una muestra aleatoria, debido a lo improbable de que los participantes en el estudio tuvieran conocimiento previo de la calcificación de sus arterias coronarias y válvula aórtica. Además, las prevalencias de los factores de riesgo observadas, fueron similares a las reportadas por las encuestas nacionales en adultos mexicanos. Tercero, en este estudio no se realizaron mediciones hemodinámicas, por tanto no podemos estimar la posible presencia de estenosis aórtica en algunos de los participantes, sin embargo, esta alteración es poco probable considerando los puntajes de Agatston encontrados en la población estudiada.
ConclusionesEn conclusión, la prevalencia de la CVA en la población adulta mestiza mexicana es alta y similar a la reportada en otros estudios poblacionales. Los resultados mostraron asociación significativa de la CVA con los factores de riesgo cardiovascular convencionales y con la calcificación de arterias coronarias. La fuerza de asociación entre la CVA y la CAC sugiere mecanismos fisiopatológicos similares a los de la enfermedad aterosclerosa.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEl proyecto GEA fue parcialmente apoyado por el Consejo Nacional de Ciencia y Tecnología (Número de proyecto: SALUD-2010-2-150537).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen al personal que labora en los Departamentos de Endocrinología y Tomografía e Imagen, del Instituto Nacional de Cardiología Ignacio Chávez, así como a los participantes en el estudio.