Entre los nuevos biomarcadores del riesgo de eventos cardiovasculares (ECV), la proteína C reactiva detectada mediante técnicas de alta sensibilidad (PCRus) ha sido uno de los más evaluados.
En esta revisión se exploró la evidencia existente sobre la utilidad de la PCRus como factor independiente del riesgo de eventos en sujetos sin antecedentes cardiovasculares, y como marcador pronóstico en sujetos con enfermedad cardiovascular crónica o aguda.
Se realizó un overview (revisión de revisiones) con búsqueda en las principales bases bibliográficas suplementada por buscadores genéricos de Internet. En una primera etapa se detectaron revisiones sistemáticas, guías de práctica clínica, evaluaciones de tecnologías sanitarias y políticas de cobertura, y en una segunda etapa se identificaron estudios primarios publicados posteriormente a las fechas de búsqueda de las revisiones sistemáticas. Fueron recuperadas 774 citas, de las cuales se incluyeron 36 publicaciones que evaluaron el papel de la PCRus en poblaciones sanas o con antecedentes coronarios.
Se encontró evidencia de alta calidad señalando a la PCRus, tanto como factor de riesgo en población general, como pronóstico en aquellos con ECV en todas las poblaciones evaluadas. Su mayor utilidad residió en sujetos sin historia de ECV y riesgo intermedio de eventos a 10 años, en donde la adición de la PCRus a modelos clásicos de estimación del riesgo de eventos mejora la estratificación del riesgo. No se identificó, en cambio, consenso sobre su utilidad clínica como marcador pronóstico en sujetos con enfermedad coronaria crónica o aguda.
Among the new cardiovascular event (CVE) risk biomarkers, C-reactive protein detected using high sensitive techniques (hs-CRP) has been one of the most commonly evaluated.
In this review, the available evidence on the usefulness of hs-CRP was explored as an independent risk event factor in subjects with no cardiovascular history and as prognosis in case of chronic or acute cardiovascular condition.
An overview (revision of revisions) was carried out searching in the main bibliographic databases and in other general Internet search engines. During the first stage, systematic reviews, clinical practice guidelines, health technology assessments and coverage policies were found and, during the second stage primary studies published after the systematic review search dates were added. Seven hundred and seventy four quotes were found, including 36 papers assessing the role of hs-CRP in healthy populations or with cardiovascular history.
High quality evidence was found pointing out hs-CRP, both as risk factor in the general population and as prognostic factor in those with CVE, in all the populations assessed. It was most useful in subjects with a history of CVE and intermediate risk of events at 10 years; where adding hs-CRP to the classical models for event risk estimation improves risk staging. There was no consensus on its clinical usefulness as a prognostic marker in subjects with chronic or acute disease.
La enfermedad cardiovascular (EC) representa una de las principales causas de mortalidad a nivel mundial, sumando 269 muertes por cada 100,000 habitantes al año; esto afecta tanto a países desarrollados como a aquellos en vías de desarrollo1,2.
Desde la década de los setenta evidencia experimental y clínica creciente ha atribuido tanto a los procesos inmunológicos como inflamatorios una participación significativa en la generación y en el desarrollo de complicaciones a nivel de la placa aterosclerótica, lo cual se halla estrechamente vinculado al desarrollo de ECV3–5. Durante la última década han sido estudiados nuevos marcadores no invasivos de inflamación, entre los que se encuentra la proteína C reactiva (PCR)3,4,6. Se postula que niveles elevados de PCR podrían asociarse a un riesgo incrementado de ECV en individuos aparentemente sanos, así como constituir un marcador pronóstico en sujetos cursando con un síndrome coronario agudo (SCA) o en aquellos con antecedentes de EC7–9.
La PCR es una globulina de síntesis hepática que se halla presente como un pequeño componente en el suero o plasma en niveles inferiores a 1mg/dl. En general, la PCR se eleva en procesos infecciosos y en condiciones inflamatorias como artritis reumatoidea, EC y enfermedad vascular periférica. Cuando hay inflamación aguda los niveles séricos pueden elevarse hasta 100 veces dentro de las primeras 24 a 48h, y mantenerse elevados por varios días, antes de regresar a niveles normales3,10,11. Las técnicas que históricamente han medido los niveles de PCR plasmáticos fueron desarrolladas para su uso en pacientes con alteraciones infecciosas e inflamatorias, y han tenido un límite inferior de detección en el rango de 3 a 5mg/l. Estos valores se encuentran por encima de la concentración observada en la mayoría de los individuos aparentemente sanos y de las pequeñas elevaciones crónicas que parecerían encontrarse en sujetos con riesgo cardiovascular aumentado. En vista de esta limitación, se han desarrollado técnicas inmunoquímicas modificadas de alta sensibilidad incrementando el poder de detección, como la nefelometría láser y la inmunoturbidimetría, denominándose entonces PCRus (ultrasensible). Las determinaciones de PCRus identifican concentraciones en niveles desde 0.15mg/dl; sin embargo, aún no se encuentra claramente definido el valor límite sobre el cual debe interpretarse como patológica una elevación sérica de la PCRus, así como tampoco el impacto que comorbilidades inflamatorias o hepáticas pueden tener sobre el papel de la PCRus en la estratificación del riesgo de EC3,10,11.
ObjetivoEvaluar la evidencia disponible acerca de la utilidad de la PCRus como factor independiente de riesgo en población sin antecedentes de afección cardiovascular y, como marcador pronóstico en población con enfermedad cardiovascular aguda o crónica.
MétodosSe realizó un overview (revisión de revisiones) que consiste en un diseño de estudio enfocado en identificar todas las revisiones sistemáticas publicadas en relación con un tema complejo, para el que se cuenta con abundante información de buena calidad metodológica. Permite incorporar diferentes intervenciones, condiciones clínicas, poblaciones y puntos finales de interés a medir en un mismo estudio. Las mismas comparan y contrastan los hallazgos de las distintas revisiones incluidas, brindando a los tomadores de decisión un resumen de la evidencia disponible5.
El overview de revisiones sistemáticas fue complementado con la búsqueda de estudios primarios adicionales a las revisiones sistemáticas publicados con posterioridad, así como por otros tipos de diseños de estudios como guías de práctica clínica, evaluaciones de tecnología sanitaria y políticas de cobertura de financiadores de salud12.
Método de búsqueda para la identificación de estudiosSe efectúo una búsqueda de estudios publicados hasta febrero de 2013 en las principales bases de datos bibliográficas (MEDLINE, Cochrane, DARE, NHS EED), en buscadores genéricos de Internet, agencias de evaluación de tecnologías sanitarias y financiadores de salud. La estrategia de búsqueda empleada fue:
«C-Reactive Protein[Mesh] OR C Reactive[tiab] OR Protein C[tiab] OR C-reactive protein receptor, human [Supplementary Concept] OR CRP[tiab]) AND (Coronary Disease[Mesh] OR “Myocardial Infarction”[Mesh] OR “Acute Coronary Syndrome”[Mesh] OR “Angina, Unstable”[Mesh] OR “Angina, Stable”[Mesh] OR Coronar*[tiab] OR angina[tiab] OR Infarct*[tiab])».
Tipos y selección de estudiosLa identificación de estudios fue realizada en 2 etapas, la primera se limitó a la búsqueda de revisiones sistemáticas (RS), guías de práctica clínica (GPC), evaluaciones de tecnología sanitaria (ETS) y políticas de cobertura (PC) de financiadores y sistemas de salud sobre el valor de la determinación de la PCRus como predictor y marcador pronóstico de ECV. La misma fue realizada con la participación de 2 revisores independientes, quienes valoraron la relevancia de las publicaciones y resolvieron las divergencias mediante consenso. En la segunda etapa un equipo de 8 investigadores empleando el Programa Organizador Temprano de Revisiones (Early Review Organizing Software [EROS]) extendió la búsqueda a estudios observacionales y ensayos clínicos aleatorizados (ECA) publicados con posterioridad a la fecha de búsqueda de literatura de la RS más recientemente identificada. Las divergencias fueron resueltas entre los integrantes del equipo por consenso.
Extracción y manejo de los datosDos revisores independientemente extrajeron a partir de los estudios incluidos datos sobre las características de los participantes y los puntos finales explorados en cada uno de ellos. La calidad de los estudios se evaluó según los criterios de la graduación de las recomendaciones sobre evaluaciones (Grading of Recommendations Assessment [GRADE])13, clasificándose en de alta, moderada, baja y muy baja calidad. De persistir las discrepancias, todas las diferencias fueron resueltas por consenso o consulta con un tercer revisor.
Criterios para la inclusión de estudiosSe incluyeron RS basadas en estudios de cohortes, casos-controles y ECA, donde la PCRus fuese evaluada como factor predictor del riesgo de ECV en población sana, o como marcador pronóstico en sujetos con enfermedad coronaria aguda o crónica estable. La búsqueda de dichos estudios secundarios fue complementada con estudios primarios publicados con posterioridad a las RS. Para ello se consideraron los estudios de cohorte, casos-controles prospectivos y ECA que tuvieran una población igual o superior a 1,000 participantes, considerando el tamaño poblacional observado entre los estudios más relevantes de las RS incluidas. Todos los estudios debían tener información detallada sobre el potencial incremento del riesgo para ECV, tanto fatales como no fatales, asociados a niveles de PCRus en población asintomática sana, con enfermedad coronaria estable (ECE) o cursando un SCA. Se consideró que el tiempo de seguimiento para poblaciones con SCA no debía ser inferior a un mes, y de al menos 6 meses para ECE. Se realizó además un análisis descriptivo de los estudios, para lo cual los mismos se agruparon en función de si la PCRus era evaluada en forma aislada como factor de riesgo o pronóstico independiente, o si se evaluaba la utilidad de su adición a modelos convencionales de estimación del riesgo cardiovascular como la puntuación de Framingham, entre otros.
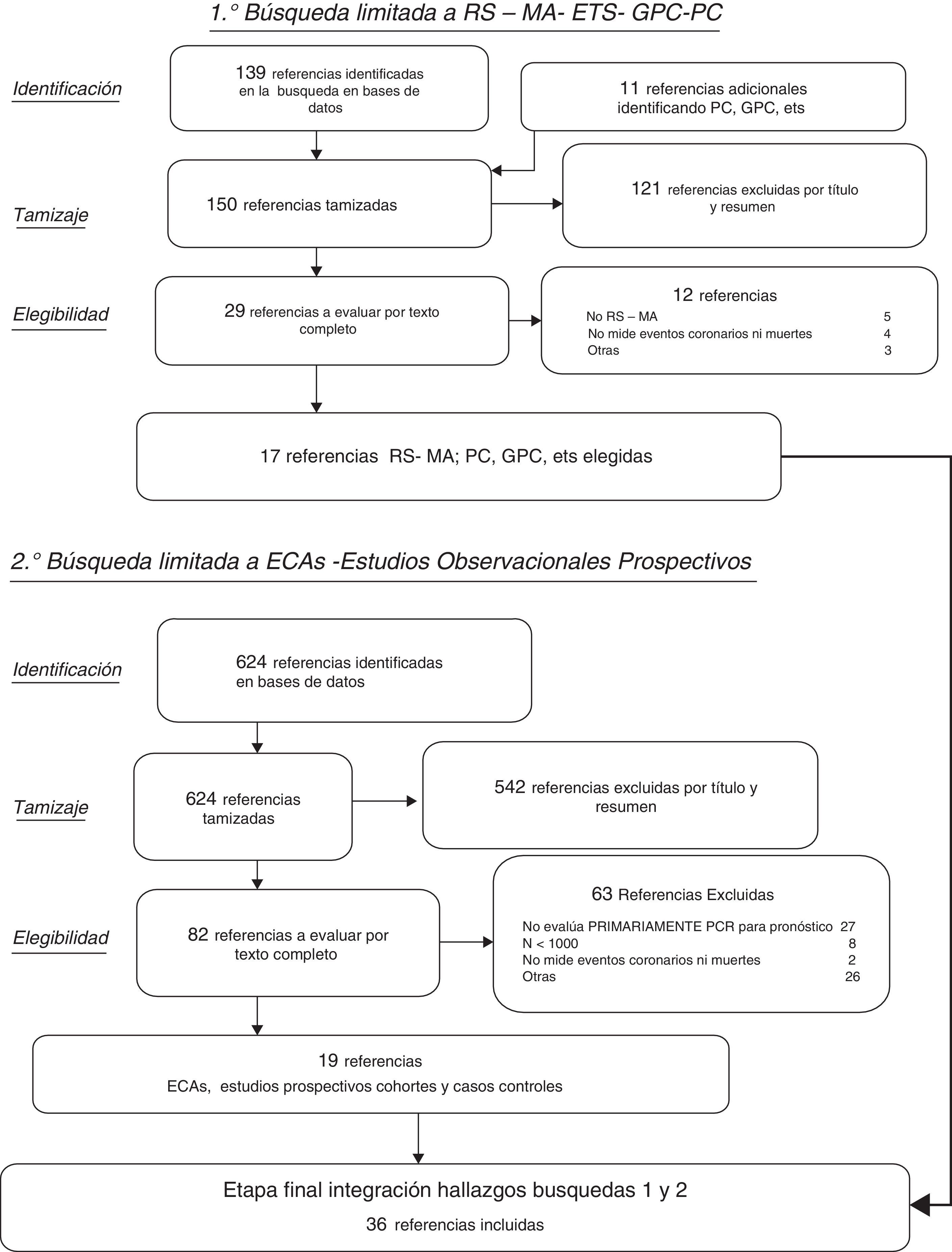
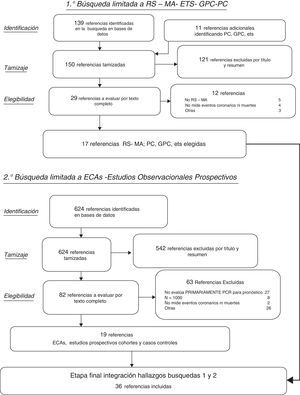
ResultadosSe identificaron 150 resúmenes de estudios potencialmente relevantes entre las RS, GPC y ETS, de los cuales 17 cumplieron criterios de inclusión. Entre los 624 resúmenes resultantes de la búsqueda limitada a estudios primarios adicionales (ECA, estudios observacionales prospectivos de cohorte y casos-controles) según los criterios previamente especificados, fueron finalmente 19 los estudios que se seleccionaron (fig. 1). En la tabla 1 se describe brevemente, para cada una de las 3 subpoblaciones de interés, toda la evidencia incluida remarcando las asociaciones entre la PCRus con los desenlaces principales relevados en cada uno de los estudios en los que la PCRus se evaluó como factor independiente de riesgo o marcador pronóstico del desarrollo de ECV. En la tabla 2 se describen con mayor detalle los resultados sumarios de aquellos estudios que evaluaban la utilidad de agregar la proteína biomarcadora a modelos predictores clásicos del riesgo de ECV. En las siguientes secciones se describen los resultados con mayor detalle para cada uno de los subgrupos de interés.
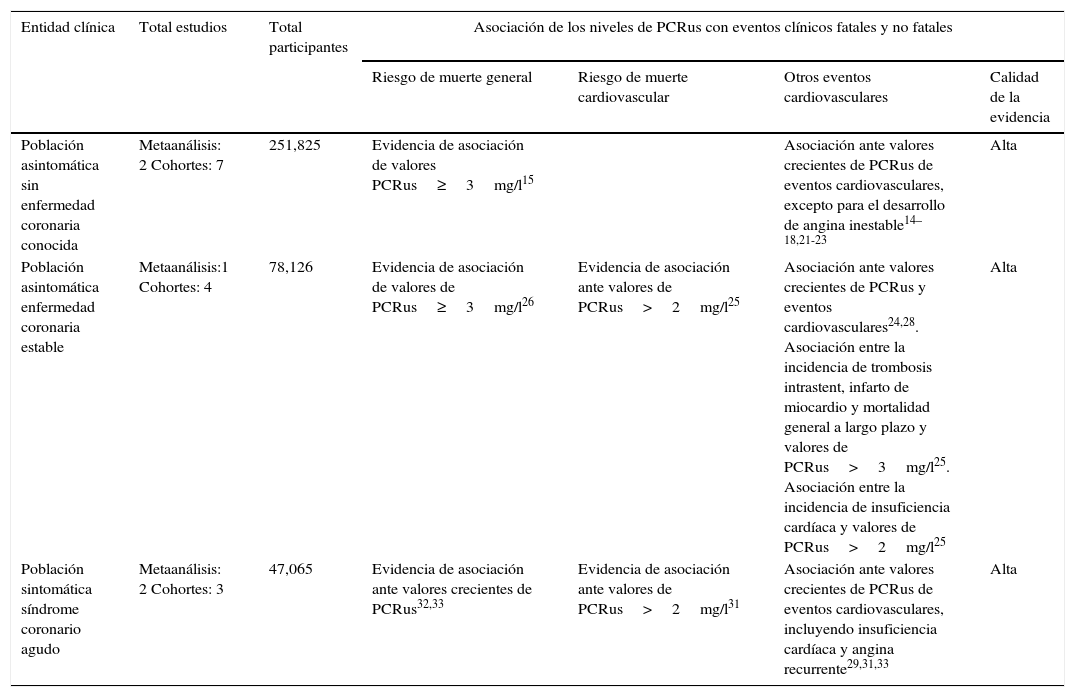
Resultados agrupados de los estudios que evalúan la asociación de PCRus con eventos clínicos cardiovasculares
| Entidad clínica | Total estudios | Total participantes | Asociación de los niveles de PCRus con eventos clínicos fatales y no fatales | |||
|---|---|---|---|---|---|---|
| Riesgo de muerte general | Riesgo de muerte cardiovascular | Otros eventos cardiovasculares | Calidad de la evidencia | |||
| Población asintomática sin enfermedad coronaria conocida | Metaanálisis: 2 Cohortes: 7 | 251,825 | Evidencia de asociación de valores PCRus≥3mg/l15 | Asociación ante valores crecientes de PCRus de eventos cardiovasculares, excepto para el desarrollo de angina inestable14–18,21-23 | Alta | |
| Población asintomática enfermedad coronaria estable | Metaanálisis:1 Cohortes: 4 | 78,126 | Evidencia de asociación de valores de PCRus≥3mg/l26 | Evidencia de asociación ante valores de PCRus>2mg/l25 | Asociación ante valores crecientes de PCRus y eventos cardiovasculares24,28. Asociación entre la incidencia de trombosis intrastent, infarto de miocardio y mortalidad general a largo plazo y valores de PCRus>3mg/l25. Asociación entre la incidencia de insuficiencia cardíaca y valores de PCRus>2mg/l25 | Alta |
| Población sintomática síndrome coronario agudo | Metaanálisis: 2 Cohortes: 3 | 47,065 | Evidencia de asociación ante valores crecientes de PCRus32,33 | Evidencia de asociación ante valores de PCRus>2mg/l31 | Asociación ante valores crecientes de PCRus de eventos cardiovasculares, incluyendo insuficiencia cardíaca y angina recurrente29,31,33 | Alta |
Para cada evento de interés el n.° poblacional corresponde al del estudio original en el cual ese evento fue medido; no se realizaron en esta revisión análisis cuantitativos y/o sumarios.
En el grupo de población asintomática sin historia de EC varios estudios prospectivos señalaron una asociación positiva entre la presencia de PCRus elevada y comorbilidad cardiovascular. Dos RS y 8 estudios de cohorte publicados de forma posterior a las fechas de búsqueda de las revisiones fueron identificados, cuyas características y hallazgos principales se detallan en las tablas 2 y 3.
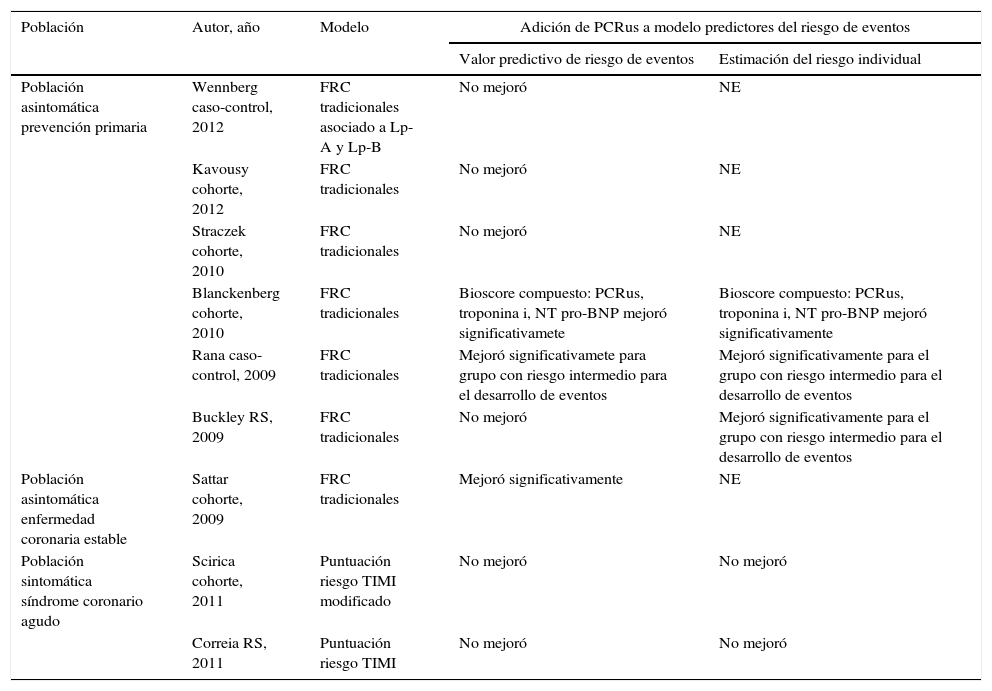
Valor de la adición de la PCRus a modelos predictores de riesgo de eventos cardiovasculares
| Población | Autor, año | Modelo | Adición de PCRus a modelo predictores del riesgo de eventos | |
|---|---|---|---|---|
| Valor predictivo de riesgo de eventos | Estimación del riesgo individual | |||
| Población asintomática prevención primaria | Wennberg caso-control, 2012 | FRC tradicionales asociado a Lp-A y Lp-B | No mejoró | NE |
| Kavousy cohorte, 2012 | FRC tradicionales | No mejoró | NE | |
| Straczek cohorte, 2010 | FRC tradicionales | No mejoró | NE | |
| Blanckenberg cohorte, 2010 | FRC tradicionales | Bioscore compuesto: PCRus, troponina i, NT pro-BNP mejoró significativamete | Bioscore compuesto: PCRus, troponina i, NT pro-BNP mejoró significativamente | |
| Rana caso-control, 2009 | FRC tradicionales | Mejoró significativamete para grupo con riesgo intermedio para el desarrollo de eventos | Mejoró significativamente para el grupo con riesgo intermedio para el desarrollo de eventos | |
| Buckley RS, 2009 | FRC tradicionales | No mejoró | Mejoró significativamente para el grupo con riesgo intermedio para el desarrollo de eventos | |
| Población asintomática enfermedad coronaria estable | Sattar cohorte, 2009 | FRC tradicionales | Mejoró significativamente | NE |
| Población sintomática síndrome coronario agudo | Scirica cohorte, 2011 | Puntuación riesgo TIMI modificado | No mejoró | No mejoró |
| Correia RS, 2011 | Puntuación riesgo TIMI | No mejoró | No mejoró | |
LP-A: lipoproteína A; LP-B: lipoproteína B; NE: no evaluado; FRC: factores de riesgo convencionales.
Puntuación de riesgo TIMI modificado: consideró las siguientes variables clínicas: edad 65 años, más de 3 factores de riesgo coronario, enfermedad coronaria documentada, angina severa reciente, desviación del ST de 0.5mm, aspirina previa, a las que asoció un aclaramiento de creatinina de 60ml/min e historia de insuficiencia cardíaca no considerando troponina.
Scirica et al.33.
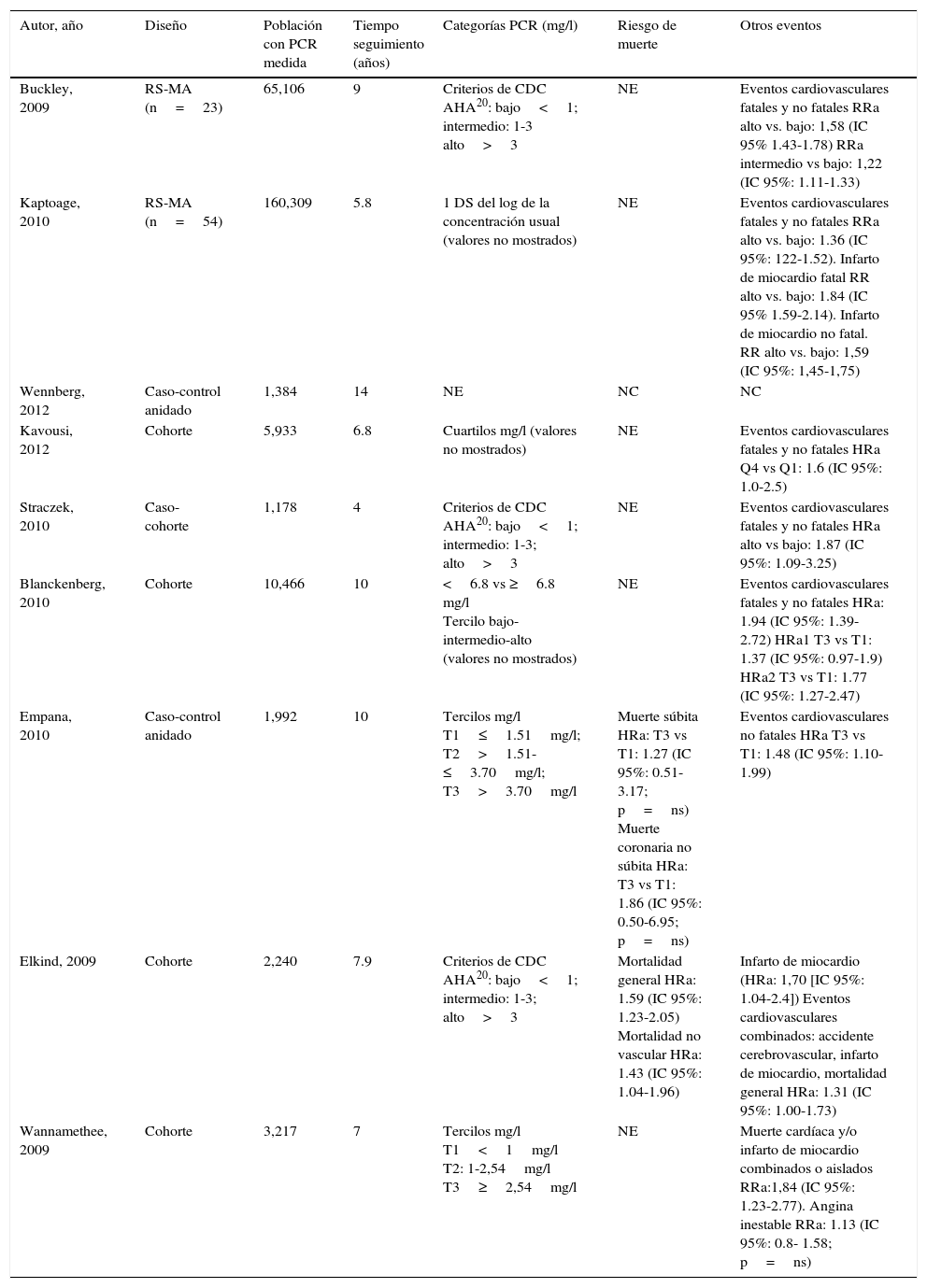
PCRus en población asintomática sin enfermedad coronaria conocida
| Autor, año | Diseño | Población con PCR medida | Tiempo seguimiento (años) | Categorías PCR (mg/l) | Riesgo de muerte | Otros eventos |
|---|---|---|---|---|---|---|
| Buckley, 2009 | RS-MA (n=23) | 65,106 | 9 | Criterios de CDC AHA20: bajo<1; intermedio: 1-3 alto>3 | NE | Eventos cardiovasculares fatales y no fatales RRa alto vs. bajo: 1,58 (IC 95% 1.43-1.78) RRa intermedio vs bajo: 1,22 (IC 95%: 1.11-1.33) |
| Kaptoage, 2010 | RS-MA (n=54) | 160,309 | 5.8 | 1 DS del log de la concentración usual (valores no mostrados) | NE | Eventos cardiovasculares fatales y no fatales RRa alto vs. bajo: 1.36 (IC 95%: 122-1.52). Infarto de miocardio fatal RR alto vs. bajo: 1.84 (IC 95% 1.59-2.14). Infarto de miocardio no fatal. RR alto vs. bajo: 1,59 (IC 95%: 1,45-1,75) |
| Wennberg, 2012 | Caso-control anidado | 1,384 | 14 | NE | NC | NC |
| Kavousi, 2012 | Cohorte | 5,933 | 6.8 | Cuartilos mg/l (valores no mostrados) | NE | Eventos cardiovasculares fatales y no fatales HRa Q4 vs Q1: 1.6 (IC 95%: 1.0-2.5) |
| Straczek, 2010 | Caso-cohorte | 1,178 | 4 | Criterios de CDC AHA20: bajo<1; intermedio: 1-3; alto>3 | NE | Eventos cardiovasculares fatales y no fatales HRa alto vs bajo: 1.87 (IC 95%: 1.09-3.25) |
| Blanckenberg, 2010 | Cohorte | 10,466 | 10 | <6.8 vs ≥6.8 mg/l Tercilo bajo-intermedio-alto (valores no mostrados) | NE | Eventos cardiovasculares fatales y no fatales HRa: 1.94 (IC 95%: 1.39-2.72) HRa1 T3 vs T1: 1.37 (IC 95%: 0.97-1.9) HRa2 T3 vs T1: 1.77 (IC 95%: 1.27-2.47) |
| Empana, 2010 | Caso-control anidado | 1,992 | 10 | Tercilos mg/l T1≤1.51mg/l; T2>1.51-≤3.70mg/l; T3>3.70mg/l | Muerte súbita HRa: T3 vs T1: 1.27 (IC 95%: 0.51-3.17; p=ns) Muerte coronaria no súbita HRa: T3 vs T1: 1.86 (IC 95%: 0.50-6.95; p=ns) | Eventos cardiovasculares no fatales HRa T3 vs T1: 1.48 (IC 95%: 1.10-1.99) |
| Elkind, 2009 | Cohorte | 2,240 | 7.9 | Criterios de CDC AHA20: bajo<1; intermedio: 1-3; alto>3 | Mortalidad general HRa: 1.59 (IC 95%: 1.23-2.05) Mortalidad no vascular HRa: 1.43 (IC 95%: 1.04-1.96) | Infarto de miocardio (HRa: 1,70 [IC 95%: 1.04-2.4]) Eventos cardiovasculares combinados: accidente cerebrovascular, infarto de miocardio, mortalidad general HRa: 1.31 (IC 95%: 1.00-1.73) |
| Wannamethee, 2009 | Cohorte | 3,217 | 7 | Tercilos mg/l T1<1mg/l T2: 1-2,54mg/l T3≥2,54mg/l | NE | Muerte cardíaca y/o infarto de miocardio combinados o aislados RRa:1,84 (IC 95%: 1.23-2.77). Angina inestable RRa: 1.13 (IC 95%: 0.8- 1.58; p=ns) |
NC: no corresponde; NE: no evaluado; ns: no significativo; RRa-HRa: riesgo relativo ajustado y hazard ratio ajustado respectivamente; para ver detalle de variables incluidas dirigirse al texto.
Hazard ratio cohorte hombres del estudio PRIME HRa1: ajustado por área de residencia, edad y factores de riesgo tradicionales; p=0.06.
Hazard ratio cohorte hombres del estudio FINRISK97HRa2: ajustado por área de residencia, edad y factores de riesgo tradicionales; p=0.001.
Blankenberg et al.21.
En el año 2009 Buckley realizó una RS evaluando la incorporación de la PCRus en la estimación del riesgo de ECV en prevención primaria, identificándose en la misma un incremento del riesgo de enfermedad coronaria ante niveles de PCRus≥1mg/l14. Elkind, en el año 2009, explorando la asociación entre PCRus y accidente cerebrovascular (ACV) isquémico, encontró un aumento del riesgo combinado de eventos tales como ACV, infarto de miocardio y mortalidad global en presencia de niveles de PCRus≥3mg/l15. Por su parte, el estudio de Empana en el año 2010, basado en el seguimiento a 7 años de los participantes del Estudio prospectivo del infarto de miocardio (Etude Prospective de l’Infarctus du Myocarde [PRIME study]) no encontró asociación entre el desarrollo de muerte súbita y PCRus. Sin embargo, se observó un aumento en el desarrollo de ECV no fatal en presencia de niveles de PCRus≥3.72mg/l aun tras ajustar por FRC tradicionales16. Los puntos de corte identificados en los estudios fueron muy variables.
Al considerar específicamente la asociación entre los niveles de PCRus y el riesgo de infarto de miocardio, también se observó gran variabilidad. Por un lado, la RS basada en metaanálisis de sujetos individuales de Kaptoge, publicada en el año 2010, señaló un incremento del riesgo de dichos eventos en presencia de niveles de PCR≥1.72mg/l17. El estudio de Wannamethe en el año 2009, con seguimiento a 7 años de los sobrevivientes del British Regional Heart Study libres de enfermedad coronaria a 20 años, identificó un aumento de la mortalidad de causa cardiaca y desarrollo de infarto de miocardio —aunque no de angina inestable— ante niveles de PCRus≥2.54mg/l, más elevados que los del estudio anterior18. En cambio, Wennberg en el año 2011, evaluando el valor predictivo de marcadores inflamatorios para el desarrollo de infarto de miocardio fatal y no fatal, señaló la pérdida de asociación entre la PCRus y el desarrollo de dichos eventos al ajustar por biomarcadores como la IL-619.
En cuanto a los estudios que evaluaron el impacto de la adición de la PCRus a modelos predictores de eventos basados en FRC tradicionales, señalaron en su mayoría una mejor estimación del riesgo individual, especialmente en el subgrupo poblacional con riesgo de 10 a 20% para eventos coronarios duros, como infarto de miocardio no fatal o muerte a 10 años14,15,17,20. En forma similar, la adición de un bioscore compuesto por el precursor del péptido natriurético (NT-pro BNP), la troponina i y la PCRus a la puntuación de riesgo Framingham mejoró la estimación del riesgo individual y el poder de discriminación del riesgo de nuevos eventos comparado al modelo clásico21. Sin embargo, estudios como el Straczek y Kavousi han mostrado discordancia con estos hallazgos, pero no han encontrado un incremento en la capacidad de discriminación del riesgo de eventos ni mejora en la reclasificación del riesgo individual tras la incorporación de la PCRus al modelo predictivo basado en FRC tradicionales22,23.
Enfermedad coronaria estableEn sujetos con ECE se ha evaluado consistentemente el rol predictor de eventos adversos de la PCRus. Una revisión sistemática y 4 estudios observacionales prospectivos posteriores a la fecha de búsqueda de la RS fueron identificados; las principales características y hallazgos de los mismos se detallan en las tablas 2 y 4.
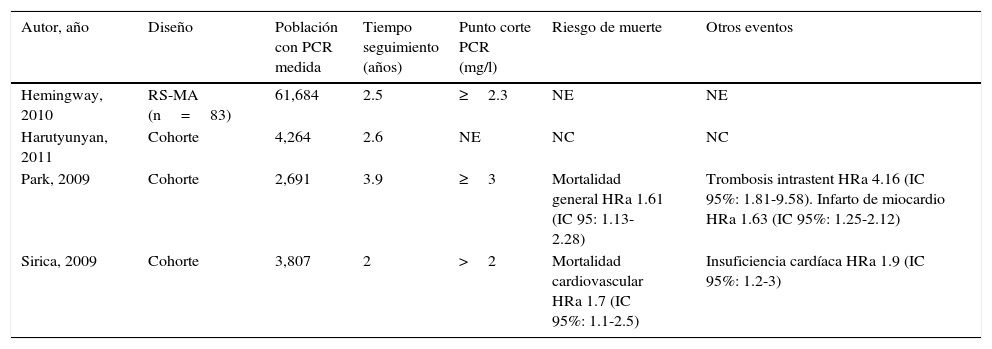
PCRus en población asintomática con enfermedad coronaria estable
| Autor, año | Diseño | Población con PCR medida | Tiempo seguimiento (años) | Punto corte PCR (mg/l) | Riesgo de muerte | Otros eventos |
|---|---|---|---|---|---|---|
| Hemingway, 2010 | RS-MA (n=83) | 61,684 | 2.5 | ≥2.3 | NE | NE |
| Harutyunyan, 2011 | Cohorte | 4,264 | 2.6 | NE | NC | NC |
| Park, 2009 | Cohorte | 2,691 | 3.9 | ≥3 | Mortalidad general HRa 1.61 (IC 95: 1.13-2.28) | Trombosis intrastent HRa 4.16 (IC 95%: 1.81-9.58). Infarto de miocardio HRa 1.63 (IC 95%: 1.25-2.12) |
| Sirica, 2009 | Cohorte | 3,807 | 2 | >2 | Mortalidad cardiovascular HRa 1.7 (IC 95%: 1.1-2.5) | Insuficiencia cardíaca HRa 1.9 (IC 95%: 1.2-3) |
Mortalidad coronaria: muerte súbita cardíaca, infarto de miocardio no fatal, angioplastia, angina inestable, insuficiencia cardíaca, enfermedad vascular periférica, accidente cerebrovascular.
Eventos cardiovasculares: infarto de miocardio, mortalidad cardiovascular.
NE: no evaluado; NC: no corresponde; RRa-HRa: riesgo relativo ajustado y hazard ratio ajustado respectivamente; para ver detalle de variables incluidas dirigirse al texto.
En el año 2010 Hemingway publicó una RS evaluando la asociación entre el nivel de PCRus y el riesgo de eventos cardiovasculares y mortalidad global en sujetos con ECE, evidenciando un riesgo significativamente mayor entre aquellos sujetos con valores de PCRus≥2.3mg/l correspondientes al tercilo superior24. El estudio de Sirica, publicado en 2009, valorando la capacidad predictiva de la PCRus sobre el desarrollo de eventos clínicos fatales y no fatales a largo plazo tras un SCA, permitió observar un aumento del desarrollo de insuficiencia cardiaca en forma aislada o combinada a otros eventos cardiovasculares en aquellos sujetos con concentraciones de PCRus superiores a 2mg/l a 30 días del evento inicial25. En sujetos sometidos a angioplastia primaria con stent liberador de fármacos, niveles de PCR≥3mg/l medidos dentro de las 72h de la intervención se asociaron a un incremento del riesgo de trombosis intrastent, infarto de miocardio y de mortalidad general26.
El estudio de Sattar al explorar la asociación entre PCRus y el desarrollo de ECV en sujetos con antecedentes o aumento del riesgo para los mismos, identificó que la adición de la PCRus a un modelo conformado por los factores de riesgo tradicionales incrementó la capacidad de discriminación del mismo para eventos tanto fatales como no fatales27. Sin embargo, el estudio de Harutyunyan en el año 2011 evaluando el rol de la PCRus en sujetos con ECE participantes del estudio CLARICOR, evidenció que el valor predictivo de los niveles de PCRus elevados para ECV tanto fatales como no fatales perdió significación tras ajustar por el biomarcador NT pro-BNP28.
Síndrome coronario agudoEn el grupo de sujetos cursando un SCA la evaluación de la capacidad predictiva de la PCRus sobre el riesgo de nuevos eventos ha sido un tema de investigación e intenso debate en los últimos años. Dos RS y 3 estudios observacionales prospectivos posteriores a la fecha de búsqueda de las RS fueron identificados; las características y hallazgos principales de los mismos se detallan en las tablas 2 y 5.
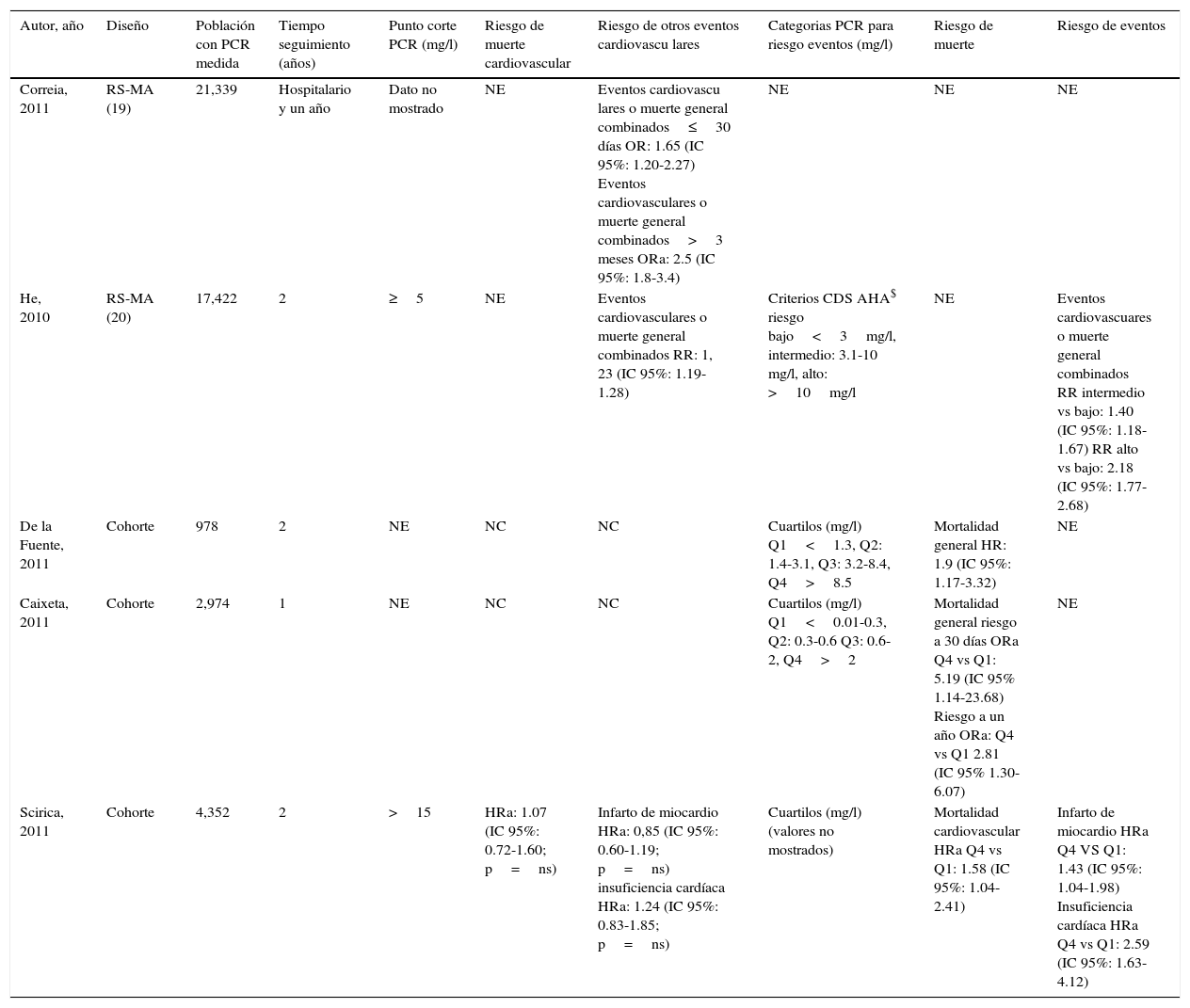
PCRus en población sintomática con síndrome coronario agudo
| Autor, año | Diseño | Población con PCR medida | Tiempo seguimiento (años) | Punto corte PCR (mg/l) | Riesgo de muerte cardiovascular | Riesgo de otros eventos cardiovascu lares | Categorias PCR para riesgo eventos (mg/l) | Riesgo de muerte | Riesgo de eventos |
|---|---|---|---|---|---|---|---|---|---|
| Correia, 2011 | RS-MA (19) | 21,339 | Hospitalario y un año | Dato no mostrado | NE | Eventos cardiovascu lares o muerte general combinados≤30 días OR: 1.65 (IC 95%: 1.20-2.27) Eventos cardiovasculares o muerte general combinados>3 meses ORa: 2.5 (IC 95%: 1.8-3.4) | NE | NE | NE |
| He, 2010 | RS-MA (20) | 17,422 | 2 | ≥5 | NE | Eventos cardiovasculares o muerte general combinados RR: 1, 23 (IC 95%: 1.19-1.28) | Criterios CDS AHA$ riesgo bajo<3mg/l, intermedio: 3.1-10 mg/l, alto: >10mg/l | NE | Eventos cardiovascuares o muerte general combinados RR intermedio vs bajo: 1.40 (IC 95%: 1.18-1.67) RR alto vs bajo: 2.18 (IC 95%: 1.77-2.68) |
| De la Fuente, 2011 | Cohorte | 978 | 2 | NE | NC | NC | Cuartilos (mg/l) Q1<1.3, Q2: 1.4-3.1, Q3: 3.2-8.4, Q4>8.5 | Mortalidad general HR: 1.9 (IC 95%: 1.17-3.32) | NE |
| Caixeta, 2011 | Cohorte | 2,974 | 1 | NE | NC | NC | Cuartilos (mg/l) Q1<0.01-0.3, Q2: 0.3-0.6 Q3: 0.6-2, Q4>2 | Mortalidad general riesgo a 30 días ORa Q4 vs Q1: 5.19 (IC 95% 1.14-23.68) Riesgo a un año ORa: Q4 vs Q1 2.81 (IC 95% 1.30-6.07) | NE |
| Scirica, 2011 | Cohorte | 4,352 | 2 | >15 | HRa: 1.07 (IC 95%: 0.72-1.60; p=ns) | Infarto de miocardio HRa: 0,85 (IC 95%: 0.60-1.19; p=ns) insuficiencia cardíaca HRa: 1.24 (IC 95%: 0.83-1.85; p=ns) | Cuartilos (mg/l) (valores no mostrados) | Mortalidad cardiovascular HRa Q4 vs Q1: 1.58 (IC 95%: 1.04-2.41) | Infarto de miocardio HRa Q4 VS Q1: 1.43 (IC 95%: 1.04-1.98) Insuficiencia cardíaca HRa Q4 vs Q1: 2.59 (IC 95%: 1.63-4.12) |
Eventos cardiovasculares: insuficiencia cardíaca, mortalidad general, infarto miocardio, angina post-infarto, revascularización miocárdica; HRa-ORa: hazard ratio ajustado y odds ratio ajustados respectivamente (para ver detalle de las variables incluidas dirigirse al texto); NE: no evaluado; NC: no corresponde; ns: no significativo; Q: cuartilos.
En el año 2011 Correia y Esteves publicaron una RS analizando el rol de la PCRus como predictor independiente de nuevos eventos intrahospitalarios y a 3 meses tras un SCA sin elevación del segmento ST, observando el mismo un aumento del riesgo de ECV fatales y no fatales en presencia de niveles de PCRus≥5mg/l29. Se reportaron hallazgos similares en el año 2010 por He en su RS, en la cual niveles de PCRus≥5mg/l determinados dentro de las 72h de un SCA se relacionaron con un mayor riesgo de ECV fatales y no fatales a largo plazo30.
El rol del nivel de la PCRus al ingreso hospitalario en la predicción de mortalidad en sujetos con SCA con troponina positiva y tratamiento invasivo temprano fue evaluado por Caixeta en 2011, identificando el mismo una mortalidad general a 30 días y al año incrementada ante niveles de PCRus>2mg/l31. En forma similar, niveles significativamente más altos de PCRus se observaron entre los individuos ingresados por un SCA que fallecieron en el seguimiento a 2 años en el estudio de De La Fuente en 2011, siendo del 66% la capacidad del biomarcador para la discriminación de los sujetos de mayor riesgo32.
El estudio de Scirica en el año 2011 evalúo el rol de la PCRus en la estratificación del riesgo de eventos a 24 meses después de un SCA sin elevación del segmento ST, evidenciando que la mayor capacidad predictiva observada mediante la adición de la PCRus a la puntuación de riesgo TIMI pierde significación al ajustarse en función de la fracción de eyección y niveles de troponina i33.
Guías de práctica clínicaLas guías de práctica clínica en prevención cardiovascular recientemente publicadas, tanto en Europa como en América del Norte, reconocen a la PCRus como un predictor independiente del riesgo de enfermedad coronaria (ECO) en pacientes asintomáticos, permitiendo la reclasificación en hasta el 11% como alto riesgo y en hasta el 12% como de bajo riesgo de los individuos inicialmente clasificados como de riesgo intermedio con base en la puntuación de Framingham34–37. Las mismas consideran, en su mayoría, de utilidad la medición de PCRus con el fin de identificar aquellos sujetos que se beneficiarían del tratamiento con estatinas entre los grupos de hombres entre 50 a 60 años, y mujeres mayores de 60 años quienes tengan niveles de colesterol LDL menores de 130mg/dl y que no reciban tratamiento hipolipidemiante, terapia de reemplazo hormonal o inmunosupresora, o tengan historia de diabetes o insuficiencia renal crónica en el momento de definir dicho tratamiento34–37. De forma similar, la guía de práctica clínica publicada por el Ministerio de Salud de Singapur en el año 2011, al evaluar el rol de distintos biomarcadores en el tamizaje del riesgo de ECO, reconoce la PCRus como un marcador biológico de utilidad en los sujetos con un riesgo intermedio de eventos a 10 años al contribuir en la toma de decisiones terapéuticas mediante la adecuada recategorización de los mismos en alto o bajo riesgo38. En sujetos con enfermedad coronaria estable los niveles elevados de PCRus se han asociado a un incremento del riesgo de ECV; sin embargo, las guías de práctica clínica de las sociedades de cardiología, tanto en Europa como en Estados Unidos, señalan que la magnitud e impacto clínico de tal asociación no se hallan suficientemente esclarecidas como para que la medición rutinaria de este marcador sea recomendada39,40. De forma similar, los niveles elevados de PCRus se han vinculado a un incremento del riesgo de ECV a corto y largo plazo, especialmente en los síndromes coronarios agudos sin elevación del segmento ST e independientemente de los niveles de troponina; sin embargo, las guías de práctica clínica, de reciente publicación por las sociedades de Cardiología tanto en Europa como en Estados Unidos, mencionan la ausencia de rol alguno de la determinación del biomarcador durante el curso de los mismos41,42.
Evaluaciones de tecnologías sanitarias y políticas de coberturaEl Servicio de Información Tecnológica Sanitaria (Health Technology Inquiry [HTI]) de Australia, en el año 2009, publicó una evaluación tecnológica explorando el rol de la PCRus en el tamizaje de ECO comparado con los FRC clásicos; dada la evidencia existente los autores sugirieron limitar su aplicación a la clarificación del riesgo en sujetos con probabilidad intermedia de eventos43. En forma similar, el Foro de Asesoramiento Tecnológico de California (California Technology Assessment Forum [CTAF]) publicó en el año 2009 una ETS analizando el papel de la PCRus en la predicción de ECO, concluyendo los autores que si bien el desarrollo de puntuaciones como la de Reynolds permiten reclasificar el riesgo individual de ECV mediante la adición de los antecedentes familiares y niveles de PCRus a la calculadora de riesgo Framingham, el valor agregado de las mismas comparado con la estimación basada solo en FRC clásicos es controvertido44. Las políticas de cobertura de 3 agentes financiadores en Estados Unidos de Norteamérica consideran médicamente necesaria la determinación de PCRus en sujetos con 2 o más FRC mayores, niveles de colesterol LDL entre 110 y 130mg/dl, y riesgo intermedio de sufrir un ECO según modelos basados en los hallazgos del estudio Framingham45–47. Mientras que en otros casos la determinación del biomarcador se considera de carácter investigacional, haciéndose referencia en tales casos a la falta de evidencia directa que asocie las determinaciones del mismo con la estimación del riesgo de ECO o la inducción de cambios en las estrategias terapéuticas que se traduzcan en mejoría de la salud48.
DiscusiónExiste abundante evidencia de alta calidad explorando el valor de la determinación de la PCRus como factor de riesgo independiente del desarrollo de ECV en población sana, así como marcador pronóstico de nuevos eventos en poblaciones con enfermedad cardiovascular crónica estable o aguda. La participación activa de la PCRus en el proceso inflamatorio aterosclerótico, así como su rol predictivo independiente del riesgo de ECV resultan indiscutibles. Sin embargo, la controversia de su necesidad de incorporación a la práctica diaria persiste, dado que nuestros hallazgos, en consonancia con otras publicaciones, reflejan un valor adicional limitado del empleo de la PCRus como factor de riesgo o marcador pronóstico de eventos al ser adicionado a los factores de riesgo o marcadores clásicos en población sana o con antecedentes cardiovasculares, respectivamente49,50. A pesar de las limitaciones mencionadas, existe hasta la fecha consenso sobre la utilidad de la determinación de la PCRus en el grupo de población sin enfermedad coronaria conocida y riesgo intermedio de eventos a 10 años. No existe, en cambio, consenso sobre la utilidad de la determinación del nivel de PCRus en el momento de estimar el riesgo de nuevos eventos en pacientes con ECE o asociado a un SCA.
Se estima que la mejor recategorización del riesgo de ECV, mediante la adición de la PCRus a los factores de riesgo convencionales en sujetos sin enfermedad coronaria y riesgo intermedio de eventos, podría dar lugar a conductas terapéuticas que finalmente se traduzcan en beneficios clínicos. Sin embargo, existe aún la necesidad de estudios aleatorizados evaluando el impacto clínico de medir el nivel de PCRus en el momento de definir estrategias preventivas o terapéuticas orientadas a la reducción del riesgo de ECV. Estudios clínicos en marcha evaluando el papel de la PCRus, en prevención primaria y secundaria, como predictor de eventos futuros tras la administración de estatinas, posiblemente permitirán esclarecer el impacto clínico de la determinación de esta proteína biomarcadora.
Las principales fortalezas de nuestro estudio fueron la evaluación de las principales fuentes de evidencia científica, enfocándose en estudios secundarios de síntesis como RS, haber contemplado el valor de la PCR tanto como factor de riesgo como marcador pronóstico en las distintas formas de presentación clínica de la enfermedad coronaria, teniendo un foco en la búsqueda de respuestas trasladables a la práctica clínica. Adicionalmente, la inclusión de aquellos estudios primarios desarrollados posteriormente a la fecha de búsqueda de las principales revisiones sistemáticas identificadas se orientó a encontrar evidencia reciente que pudiese modificar los criterios considerados apropiados en la determinación de la PCRus en la valoración del riesgo de ECV. Una de las principales finalidades de nuestro trabajo fue obtener un resumen integral de todos los actores que participan en la toma de decisiones en salud. Se logró así una versión condensada de la información relevante, incluyendo estudios primarios, revisiones sistemáticas, guías de práctica clínica, evaluaciones de tecnologías sanitarias y la perspectiva de los financiadores sobre la política de cobertura de la PCRus en la estimación del riesgo cardiovascular.
La ausencia de un análisis sumario cuantitativo para los distintos eventos cardiovasculares evaluados escapa al alcance del diseño de investigaciones secundarias como el overview adoptado51,52.
ConclusionesExiste abundante evidencia de alta calidad acerca del valor de la PCRus como factor independiente de riesgo de ECV.
A día de hoy la utilidad de la medición de la PCRus reside en una adecuada identificación y clasificación de los sujetos asintomáticos con riesgo intermedio de eventos a 10 años, lo cual permite reconocer aquellos individuos que se podrían beneficiar con la introducción de estrategias terapéuticas destinadas a reducir la incidencia de dichos eventos.
La PCR resultó también un marcador pronóstico en pacientes con enfermedad coronaria estable; sin embargo, queda por esclarecer aún si la implementación de estrategias terapéuticas basadas en los niveles de la PCRus se traducen en un beneficio clínico. De forma similar, los niveles elevados de PCRus durante el curso de un SCA se han vinculado a un incremento del riesgo de ECV, pero no está justificado hasta la fecha su uso rutinario durante el curso de los mismos.
FinanciaciónEste documento fue realizado a través de un convenio del Instituto de Efectividad Clínica y Sanitaria (IECS) con la Cámara de Diagnóstico Médico (CADIME) de Argentina.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.