Introducción
En 1977, Goldman señalaba que no debía practicarse una operación electiva en pacientes con signos de insuficiencia cardiaca. En los más de 30 años transcurridos desde la publicación de su célebre índice, las cosas han cambiado de forma notoria, hasta el punto de que la insuficiencia cardiaca no contraindica ya de forma absoluta ningún procedimiento quirúrgico, aunque debe valorarse cuidadosamente como un claro factor de riesgo de complicaciones, dado que el riesgo relativo de complicaciones cardiacas perioperatorias oscila entre 0.4% y 11%.
El periodo posoperatorio de una intervención cardiaca es uno de los más críticos desde el punto de vista de las complicaciones, diagnóstico y tratamiento de éstas, ya que a diferencia de otros órganos y sistemas que pueden colocarse en "reposo" después del procedimiento, el corazón debe reasumir sus funciones en el propio quirófano, al margen de cuán "extenso" sea el daño que inflija el trauma quirúrgico.
El desarrollo de mejores técnicas quirúrgicas y anestésicas, junto aunado a diagnósticos más precisos, ha transformado a muchos pacientes considerados previamente no recuperables en individuos más aptos para el tratamiento quirúrgico, lo cual ha incrementado el número de enfermos con pobre función ventricular que se someten a diversos procedimientos quirúrgicos. La mortalidad con la circulación extracorpórea se aproxima a 6% y las causas son diversas; en muchas de ellas interviene directamente el síndrome de bajo gasto cardiaco poscardiotomía (SBGP).
El SBGP es una variedad diferente de la insuficiencia cardiaca común descrita. Aun cuando los cardiólogos e intensivistas han tratado este síndrome desde que nació la cirugía cardiaca, existen en la actualidad pocos estudios multicéntricos que suministren conocimientos con un nivel de evidencia elevado. Esto ha llevado a algunos centros a extrapolar el conocimiento de la insuficiencia cardiaca aguda y la crónica agudizada; no obstante, el SBGP tiene rasgos muy particulares en cuanto a etiología, pronóstico y tratamiento. El SBGP prolonga el tiempo de monitorización invasiva y ventilación mecánica, un factor que eleva de forma considerable la tasa de infecciones y propicia en buena medida el deterioro de la función renal y de otros órganos, lo cual se refleja en el aumento de la mortalidad, además de que es una causa directa de nuevas complicaciones.
Incidencia
La incidencia del SBGP es variable en las distintas series publicadas, desde 4% hasta 15%, con una mortalidad que se aproxima al 20%, si bien en enfermos mayores de 70 años el síndrome puede estar presente hasta en un 63%. A pesar del desarrollo de mejores técnicas de cardioprotección y cuidados transoperatorios, la incidencia de este síndrome en poblaciones de alto riesgo no se ha modificado en una proporción significativa.
Definición
Está claro que tanto en la insuficiencia cardiaca aguda como en el SBGP hay una disfunción miocárdica; sin embargo, el término de insuficiencia cardiaca aguda es demasiado amplio y general; en las áreas quirúrgicas, el término preferido es síndrome de bajo gasto, que define con enorme precisión la situación clínica del enfermo.
El SBGP se distingue por la incapacidad del corazón para mantener un volumen por minuto adecuado para satisfacer las necesidades tisulares de oxígeno y nutrientes en el posoperatorio de una intervención cardiaca, concepto que implica dos factores: el gasto cardiaco y la influencia de los vasos periféricos sobre la resistencia al flujo sanguíneo y la perfusión tisular. Aunque existen varias definiciones, el SBGP se considera cuando existe la necesidad de un apoyo inotrópico o un balón de contrapulsación intraaórtica por más de 30 min después del ingreso del paciente a la unidad de cuidados intensivos para mantener un índice cardiaco > 2.2 L/min/m2, con una presión capilar pulmonar >15 mmHg durante las primeras 6 h posoperatorias (Tabla 1). Cuando el SBGP persiste y se presenta hipotensión sistémica grave y sostenida (presión arterial sistólica < 90 mmHg) se enfrenta una complicación mayor, el choque cardiogénico poscardiotomía, que supone una mayor morbimortalidad.
Etiología
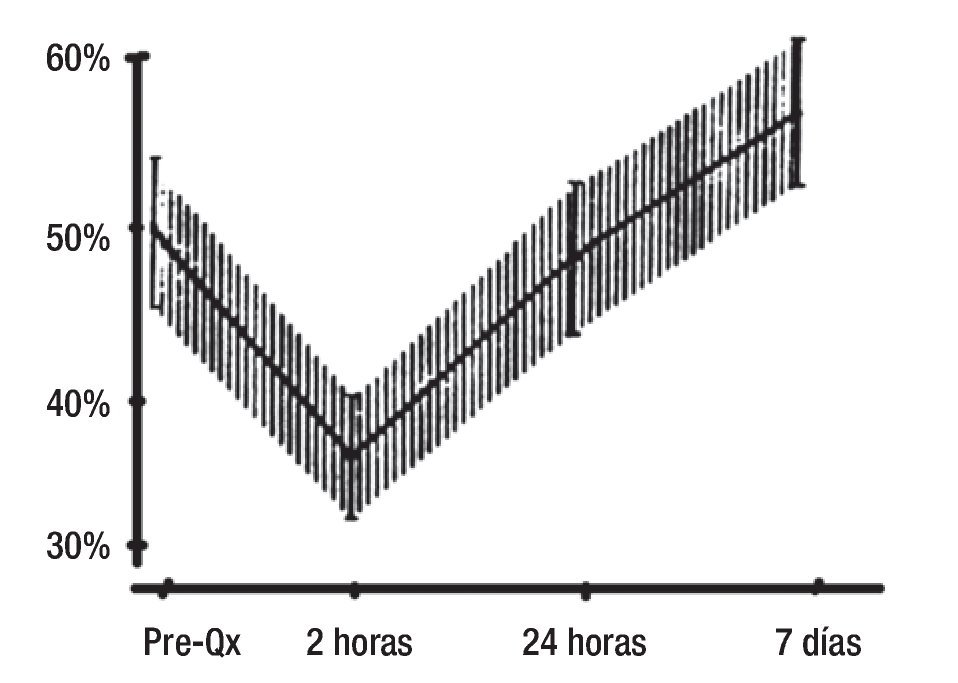
Por lo regular, cuando el paciente se somete a una cirugía cardiaca en la que se utiliza la bomba de circulación extracorpórea existe una disminución de la función ventricular posoperatoria que tiene su pico máximo entre las 8 y 12 h posteriores al procedimiento; la función ventricular se recupera de modo gradual a partir de las 24 h y se normaliza hasta el séptimo día (Figura 1).
Figura 1. Curva de disfunción ventricular posoperatoria con cirugía de revascularización coronaria y fracción de expulsión normal. Crit Care Med 2005;33(9):2082-2092.
Existen diversos mecanismos que pueden afectar la función ventricular luego de una intervención cardiovascular (Tabla 2), entre ellos la mala protección miocárdica, el daño por reperfusión, el miocardio aturdido y la isquemia miocárdica. El mantenimiento del metabolismo depende de la provisión a los tejidos corporales de sangre oxigenada, a velocidad fisiológica y a temperatura adecuada. La falta de cualquiera de estos requerimientos se advierte por la aparición de varios reflejos fisiológicos y con posterioridad por un profundo deterioro metabólico.
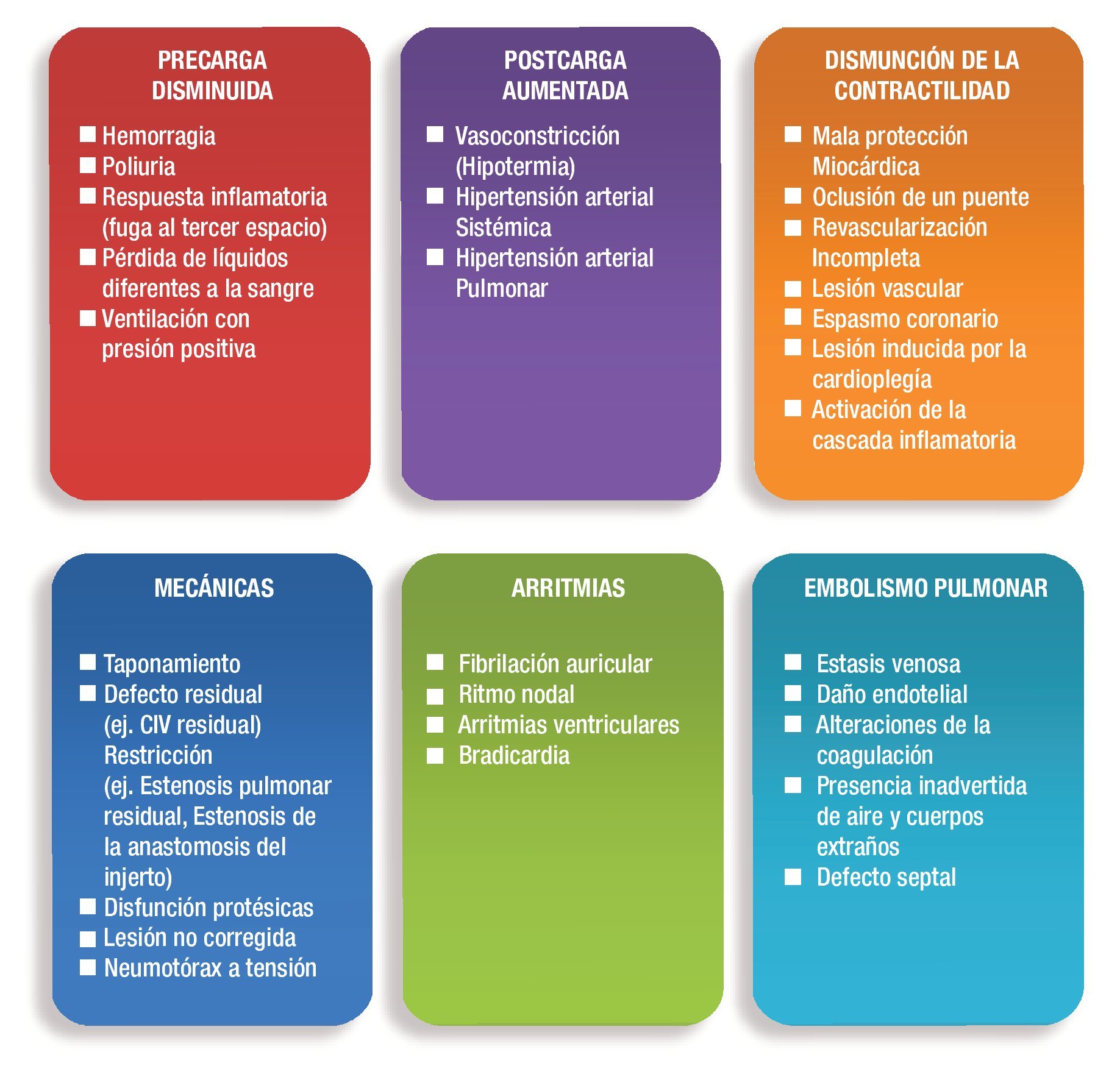
Una vez establecido el daño, las principales causas que conducen a un síndrome de bajo gasto cardiaco en el posoperatorio se señalan en la Figura 2.
Figura 2. Etiología del SBGP.
Predictores preoperatorios
Existen factores de riesgo independientes para el desarrollo del SBGP, como el tiempo de derivación cardiopulmonar (DCP), tiempo de pinzamiento aórtico, tiempo de estancia en la UCI, tiempo de estancia hospitalaria, tiempo de apoyo ventilatorio y el nivel de CPK/troponinas en el posoperatorio. Los estudios dirigidos de manera específica a la búsqueda de predictores preoperatorios de SBGP han identificado en orden de importancia los siguientes factores:
• Fracción de expulsión del ventrículo izquierdo menor de 30%
• Reintervención
• Operación de urgencia
• Sexo femenino
• Diabetes mellitus
• Edad > 70 años
• Enfermedad del tronco coronario izquierdo.
• Infarto del miocardio reciente
• Enfermedad de tres vasos
De todos ellos, el más importante es la disfunción ventricular grave preoperatoria, debido a que el margen para la protección miocárdica es limitado, aunque en ciertos casos el daño puede ser reversible en presencia de un miocardio "aturdido" o "hibernante". Los pacientes sometidos a una reintervención tienen mayor enfermedad difusa,
adherencias y casi siempre corazones dilatados, así como un alto riesgo de embolismo desde los injertos coronarios previos. En la operación urgente, un particular del sujeto con angina inestable o insuficiencia cardiaca, los pacientes llegan al quirófano con las reservas metabólicas agotadas y con pobre respuesta metabólica compensatoria. El género femenino se ha vinculado con mayor morbilidad y mortalidad; en realidad, se han postulado algunas teorías sobre vasos coronarios de pequeño calibre susceptibles de trombosis en el perioperatorio. Los individuos con diabetes mellitus, dado que acusan mayor enfermedad aterosclerosa difusa, pueden limitar la revascularización completa y mostrar además isquemia silente. (O VXMHWR ! 70 años también es susceptible, no sólo por los efectos obvios de la edad sino por la mayor prevalencia de comorbilidades. Se incluye también a las personas con infarto agudo del miocardio en los primeros 30 días posteriores al evento agudo y la enfermedad arterial coronaria trivascular, sin dejar de lado la enfermedad del tronco de la arteria coronaria izquierda.
Predictores posoperatorios
Diversos grupos han documentado que la hiperlactatemia sérica es un predictor posoperatorio temprano de disfunción ventricular y aducen que la recuperación tardía del metabolismo miocárdico aeróbico normal puede afectar de modo adverso los resultados del procedimiento cardiaco. La hiperlactatemia se ha reconocido como marcador de falla circulatoria y su gravedad se ha vinculado con incremento de la mortalidad luego de una operación cardiaca. En 2006 Ranucci y colaboradores refirieron que durante la derivación cardiopulmonar (DCP) el incremento del lactato ocurre en procedimientos que requieren prolongada exposición a la DCP, lo cual parece vincularse de manera independiente con una disponibilidad de oxígeno baja y casi invariablemente con hiperglucemia; por lo tanto, se considera un marcador de malos resultados posoperatorios en términos de morbilidad.
Con anterioridad, Maillet y colaboradores demostraron que el incremento del lactato desde el ingreso a la unidad de cuidados intensivos tiene factores de riesgo relacionados. De igual manera que Ranucci, refiere la duración prolongada de DCP, además del uso de vasopresores intraoperatorios. En el posoperatorio, los requerimientos de aminas vasoactivas y el descontrol metabólico grave son factores de riesgo independientes para el desarrollo de hiperlactatemia.
Los factores mencionados tienen un fundamento metabólico bajo condiciones normales e isquémicas, como lo demostraron Stanley y colaboradores, quienes mencionan que el metabolismo de los carbohidratos es complejo y está ligado al sustrato arterial y niveles de hormonas, flujo coronario, estado inotrópico y estado nutricional de los tejidos. La función cardiaca óptima bajo condiciones normales y patológicas es dependiente de la glucólisis y la oxidación del piruvato. El ciclo del ácido tricarboxílico y la oxidación del piruvato y los ácidos grasos están estrechamente relacionados con el trabajo contráctil e, inversamente, el trabajo contráctil está acoplado con el aporte de oxígeno y la velocidad de la fosforilación oxidativa. En consecuencia, la presencia de hiperlactatemia traduce la alteración de estas vías metabólicas condicionada por isquemia, baja disponibilidad de O2, hipoperfusión sistémica y, en el plano cardiaco, se relaciona con un deterioro de la función contráctil y por ende manifestaciones de bajo gasto cardiaco.
Manifestaciones clínicas
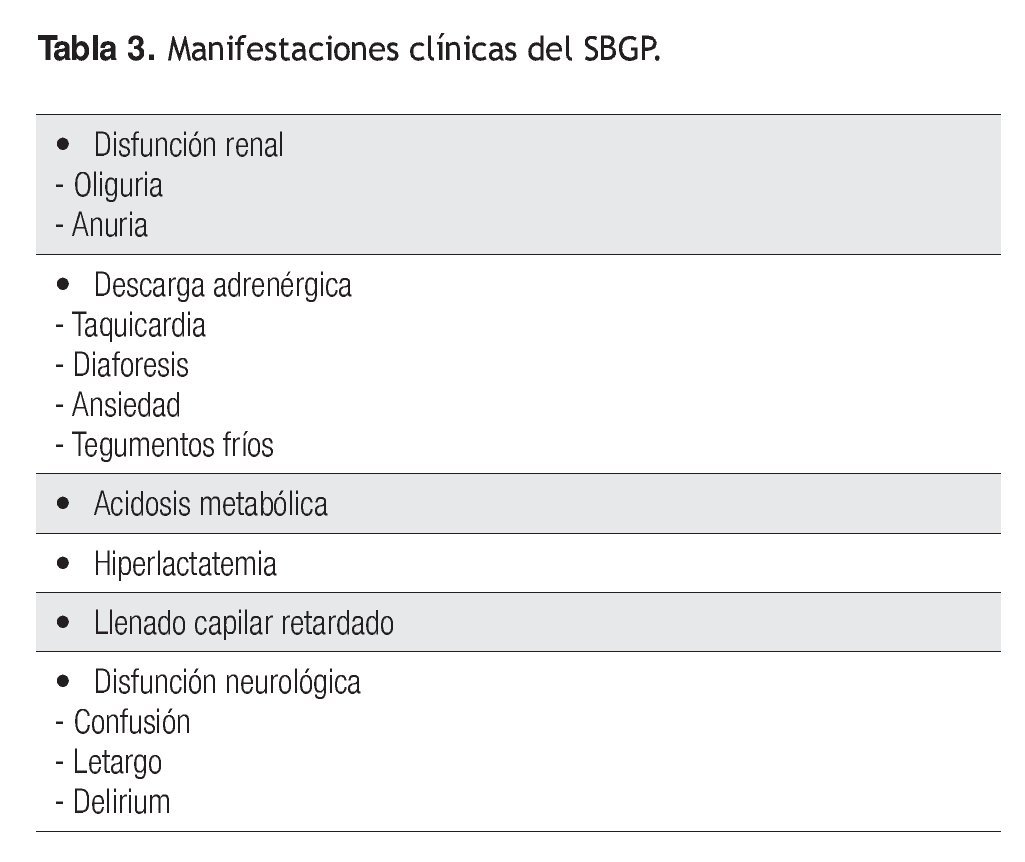
Las manifestaciones clínicas dependen en esencia de los signos de hipoperfusión sistémica (Tabla 3). Por lo regular, cuando se presentan en las primeras horas del posoperatorio, el paciente muestra datos de diaforesis, palidez de tegumentos, llenado capilar retardado, acidosis metabólica y datos de hipoperfusión renal con oliguria o incluso anuria, que en muchos casos precede al incremento de la creatinina. Cuando este síndrome se presenta en los días siguientes a la extubación, a los datos renales y acidobásicos se suman signos claros de disfunción neurológica (desorientación, bradipsiquia, delirio, etcétera.) y estimulación adrenérgica (taquicardia, diaforesis, ansiedad).
Diagnóstico
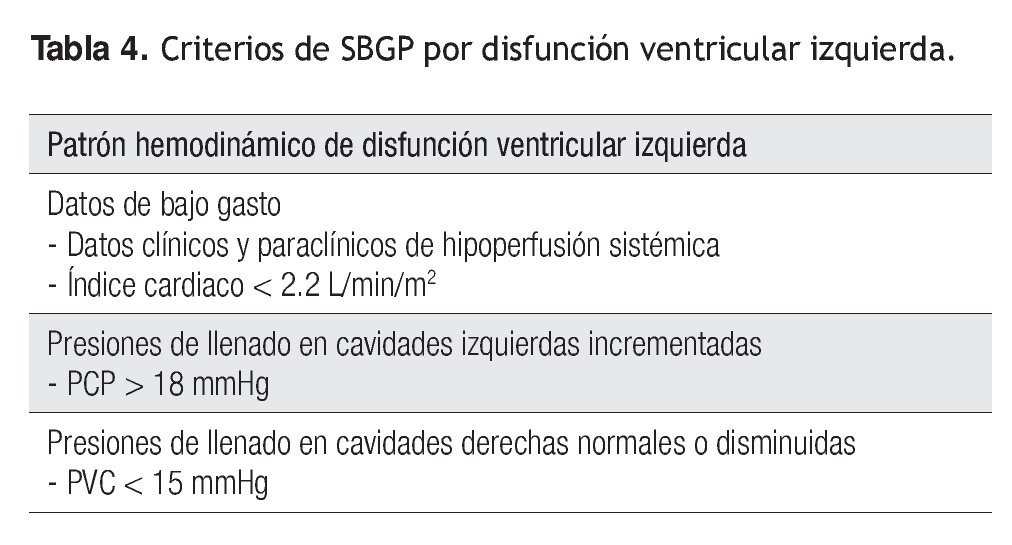
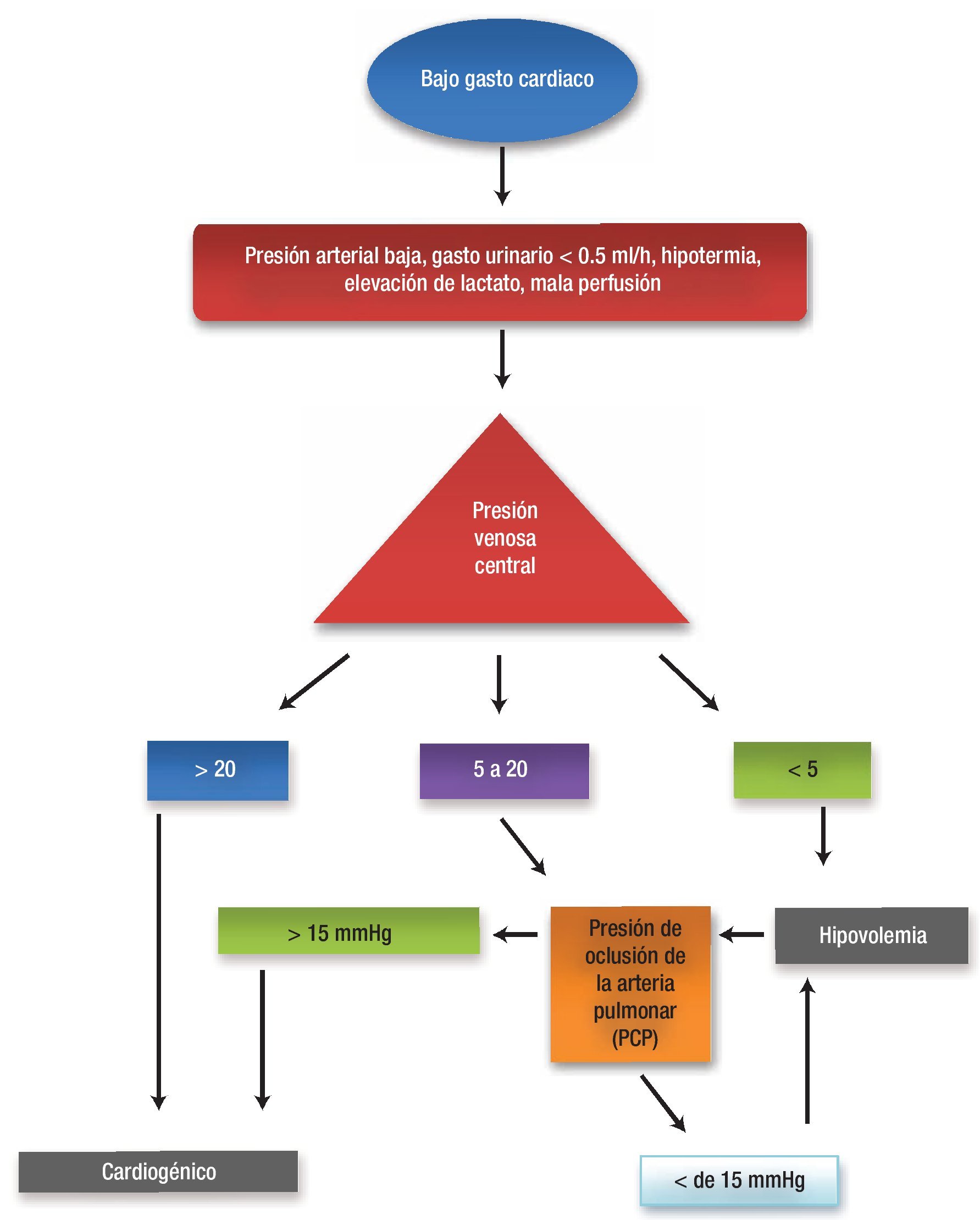
Una vez que se sospecha el diagnóstico por las manifestaciones clínicas y resultados de laboratorio, el abordaje diagnóstico debe encaminarse a confirmarlo mediante un monitoreo hemodinámico invasivo y determinar así el tipo de disfunción ventricular que presenta el paciente, ya que el tratamiento debe siempre tener un carácter etiológico. En la Figura 3 se muestra un algoritmo diagnóstico que se establece con base en mediciones de las presiones de llenado de las cavidades derechas (PVC) e izquierdas (PCP) y en la medición directa del gasto cardiaco por termodilución mediante un catéter de flotación pulmonar. Con esta información es posible determinar a partir de criterios hemodinámicos si el SBGP es efecto de la disfunción ventricular izquierda (Tabla 4), falla derecha (Tabla 5) o falla biventricular (Tabla 6) y establecer un manejo adecuada.
Figura 3. Algoritmo diagnóstico del SBGP.
En la actualidad se dispone de una herramienta de gran utilidad para complementar la información de la vigilancia invasiva: la evaluación ecocardiográfica temprana. Con ella es posible visualizar la función cardiaca desde el quirófano (ecocardiografía transoperatorio) hasta la cabecera del paciente en la unidad de cuidados intensivos cardiovasculares. El ecocardiograma puede identificar la causa de la falla cardiovascular, incluida la disfunción valvular, descartar embolismo pulmonar, obstrucción del tracto de salida del ventrículo izquierdo y taponamiento cardiaco. De ese modo puede diferenciarse entre la falla derecha, la izquierda o la global. En muchos centros de cirugía cardiaca se ha establecido una terapia guiada por ecocardiografía con excelentes resultados.
Tratamiento
El tratamiento del SBGP sigue los principios generales del tratamiento de la insuficiencia cardiaca aguda, aunque existen evidentes diferencias. El SBGP es casi siempre un estado transitorio que tiende a mostrar mejoría después de 48 a 72 h de la operación si no existe daño permanente y si se trata de forma adecuada.
El tratamiento racional del SBGP y la selección de los fármacos requieren un profundo conocimiento de los procesos fisiopatológicos que llevan al paciente al bajo gasto, de los mecanismos compensadores para una determinada cardiopatía y de los efectos cardiovasculares de cada fármaco disponible. De manera arbitraria es posible establecer diferentes medidas de manejo del SBGP:
1. Tratamiento del entorno metabólico posoperatorio.
Recomendación clase I, nivel de evidencia B
2. Optimización de los determinantes del gasto cardiaco.
Recomendación clase I, nivel de evidencia C
3. Apoyo inotrópico.
Recomendación clase IIa, nivel de evidencia B
4. Dispositivos de asistencia ventricular.
Recomendación clase I, nivel de evidencia B
El trauma quirúrgico en la cirugía cardiaca es considerable, ya que no sólo se expone al paciente a la reacción inflamatoria posterior el uso de la bomba de circulación extracorpórea sino también a estados de hipotermia-normotermia, condiciones transitorias de hipoperfusión sistémica (mesentérica, renal, cerebral, etcétera) y trastornos de coagulación que causan con frecuencia sangrados profusos, con la consiguiente necesidad de transfusión masiva, sin contar con el traumatismo cardiaco directo de la cardiotomía. Este complejo escenario ocasiona en el enfermo profundos estados de desequilibrio hidroelectrolítico y acidobásico que afectan directamente la función ventricular; tan sólo la hipotermia misma pone al miocardio en gran riesgo de sufrir arritmias y alteración de la vasorregulación periférica. Por todas estas circunstancias, el primer esfuerzo debe enfocarse en estabilizar este entorno metabólico relacionado con el procedimiento quirúrgico.
El siguiente paso en el tratamiento es la optimización de las variables de gasto cardiaco del paciente en cuestión; no obstante, aun cuando se han descrito de manera general los determinantes del gasto cardiaco, cada uno de ellos tiene un peso específico diferente en cada cardiopatía y su influencia sobre la función ventricular global puede ser variable. Comparemos por ejemplo la influencia que ejerce la frecuencia cardiaca como determinante del gasto en dos escenarios diferentes: por un lado un paciente con disfunción sistólica (p. ej., un individuo con cambio valvular mitral por insuficiencia grave y disfunción ventricular avanzada) y otro con disfunción diastólica predominante (p. ej., un sujeto con cambio valvular aórtico por estenosis aórtica crítica y FEVI normal), ambos con bajo gasto poscardiotomía, la frecuencia cardiaca es un determinante básico del gasto cardiaco (GC = VL x FC), pero en ciertas circunstancias puede tener un efecto opuesto sobre la función ventricular global. En el caso del paciente con disfunción sistólica, que las más de las veces se encuentra en fibrilación auricular, el gasto cardiaco depende en gran medida de la frecuencia cardiaca, razón por la cual es frecuente ver al individuo taquicárdico en un intento por compensar la insuficiencia cardiaca, aunque en el caso del sujeto con disfunción diastólica la taquicardia (y aún más la fibrilación auricular rápida) agrava la insuficiencia cardiaca porque la función ventricular depende en gran proporción del tiempo que dispone el ventrículo izquierdo en llenarse (precarga) y a mayor frecuencia cardiaca menor tiempo de llenado diastólico. Es probable que la dobutamina sea el fármaco de elección para el primer caso, ya que incrementaría la contractilidad y la frecuencia cardiaca por su efecto β mimético al mejorar de manera global el gasto cardiaco; empero, en el segundo caso la dobutamina sólo empeoraría el escenario: al aumentar la contractilidad miocárdica incrementaría el consumo miocárdico de oxígeno; al aumentar la frecuencia cardiaca disminuiría el tiempo de llenado diastólico; y, por último, con el incremento de la contractilidad un porcentaje considerable de los pacientes desarrollaría gradientes intraventriculares, de tal modo que se incrementaría la poscarga, efectos todos que empeorarían la disfunción diastólica del paciente.
El establecimiento de objetivos bien definidos sobre el aporte de líquidos, así como el apoyo con inotrópicos o sustancias vasoactivas, deben ser suficientes para mantener una perfusión tisular óptima para el restablecimiento del metabolismo oxidativo normal. El gasto cardiaco (GC) y un adecuado aporte de oxígeno dependen en gran medida de un apropiado volumen intravascular, por lo que en primera instancia deben formularse las siguientes consideraciones:
• A los individuos hipovolémicos con taquicardia e inadecuadas presiones de llenado, la terapéutica inicial debe ser la optimización del volumen. Con pequeñas deficiencias de volumen y presiones de oclusión de la arteria pulmonar (PCP) < 10 mmHg, se debe suministrar volumen con precaución; la elevación marcada de las presiones debe llevar a suspender la administración de líquidos. La utilización de sistemas de gasto cardiaco continuo o la vigilancia de presiones de pulso, y su respuesta a la diferencia de presiones ante una carga de volumen, permite identificar fácilmente a los "respondedores" a éste y los que requerirán apoyo inotrópico. La terapia debe enfocarse en el mantenimiento de una presión arterial media (PAM) > 65 mmHg.
• Se recomienda infundir dobutamina cuando el sujeto continúa en SBGP con una PAM < 60 mmHg a pesar de optimizar la precarga.
Recomendación clase IIb, nivel de evidencia C
• Cuando el enfermo tiene una PAM > 65 mmHg se recomienda utilizar un sensibilizador del calcio, como el levosimendán.
Recomendación clase IIa, nivel de evidencia B, o algún inhibidor de la fosfodiesterasa III (PDE III).
Recomendación clase IIb, nivel de evidencia C
• La administración de vasopresores, como la norepinefrina o epinefrina, está indicada cuando este abordaje terapéutico no mejora la hipotensión.
• En SBGP con hipotensión sostenida nunca debe utilizarse un vasopresor sin el apoyo del efecto inotrópico, ya que esto sólo aumentaría la poscarga y agravaría la insuficiencia cardiaca.
• Individuos con adecuada precarga, incremento de la POAP >15 mmHg, oliguria y aumento del lactato: pueden usarse dobutamina (IIC) o un inhibidor de PDE III (IIC). Sin embargo, hay que considerar el uso inicial de la norepinefrina como tratamiento en la hipotensión intensa.
• En personas sometidas a la operación con insuficiencia cardiaca crónica debe presuponerse que existe un fenómeno de regulación a la baja de los adrenorreceptores β, por lo que es prudente considerar la administración de un sensibilizador del calcio por el efecto sistémico limitado de los inotrópicos β miméticos.
Recomendación clase IIa, nivel de evidencia B
• La ausencia de respuesta debe llevar a considerar el uso del balón de contrapulsación intraaórtico.
• Pacientes hipervolémicos con claro incremento de la precarga (POAP > 20 mmHg), pero con GC bajo, oliguria, etcétera: la eliminación de volumen debe ser el objetivo primario mediante apoyo farmacológico o terapias de sustitución renal. La terapia farmacológica inotrópica utilizada puede ser levosimendán Recomendación clase IIa, nivel de evidencia B, dobutamina Recomendación clase IIb, nivel de evidencia C, o un inhibidor de PDE III Recomendación clase IIb, nivel de evidencia C.
La información publicada relacionada con el uso de inotrópicos en el SBGP es escasa y muchas veces contradictoria. Los inotrópicos optimizan el gasto cardiaco por medio de sus efectos sobre la contractilidad miocárdica o resistencias vasculares.
Por lo regular, el grupo de inotrópicos más utilizados es el de los β miméticos, con influencia principal sobre la contractilidad y la frecuencia más que sobre la vasomoción periférica. De ellos, el fármaco más empleado es la dobutamina, que si bien en presencia de disfunción sistólica es el fármaco de elección por su disponibilidad y costo, tiene el inconveniente de que en todas la series notificadas su uso se relaciona con un incremento de la mortalidad y su capacidad arritmogénica podría ser causa de problemas en el control del SBGP. En la actualidad está disponible un grupo de fármacos con efecto inotrópico positivo, que además tiene influencia sobre las resistencias periféricas y por tanto sobre la poscarga al ser vasodilatadores, lo que les confiere propiedades especiales porque tienen diferentes mecanismos que mejoran la función ventricular; no obstante, por este mismo efecto muestran grandes limitantes en estado de hipotensión sostenida. En este grupo de fármacos se destacan los sensibilizadores del calcio, como el levosimendán (LV) y los inhibidores de la fosfodiesterasa III, como la milrinona. De este grupo de fármacos, el LV posee mayor nivel de evidencia, según las guías de la Sociedad Europea de Cardiología en el tratamiento de la insuficiencia cardiaca aguda (ICA) y bajo los criterios del Colegio Americano de Cardiología con recomendación clase IIa, nivel de evidencia B. En la cirugía cardiaca, diversos autores señalan su uso con una recomendación clase A y nivel de evidencia Ib. No obstante, las consideraciones sobre el empleo del LV en el SBGP posoperatorio son limitadas y pocas de ellas proceden de estudios aleatorizados. Se publicaron tres series clínicas con bajo número de pacientes: Plochl (12 pacientes), Labriola (11 pacientes) y Tokuda (nueve pacientes). Las tres coinciden en demostrar una mejoría significativa de los parámetros hemodinámicos con LV. Álvarez y colaboradores evaluaron en forma aleatorizada a 41 pacientes con SBGP posoperatorio en un estudio que, como los anteriores, valoró los datos hemodinámicos y comparó la LV con dobutamina; estos investigadores concluyeron que ambos fármacos produjeron mejoría hemodinámica, si bien el LV redujo en grado significativo la resistencia vascular sistémica y pulmonar con mayor descenso de la presión arterial sistémica, pulmonar, venosa central y capilar pulmonar. Tasouli y colaboradores compararon en forma aleatorizada dos momentos diferentes del empleo de LV en 45 pacientes con SBGP, quienes ya se hallaban bajo tratamiento con inotrópicos o balón de contrapulsación. El estudio refiere resultados superiores entre los tratados en fase temprana, con menor tiempo de apoyo inotrópico, menor incidencia de sepsis y menor tiempo de estancia en cuidados intensivos y estancia general.
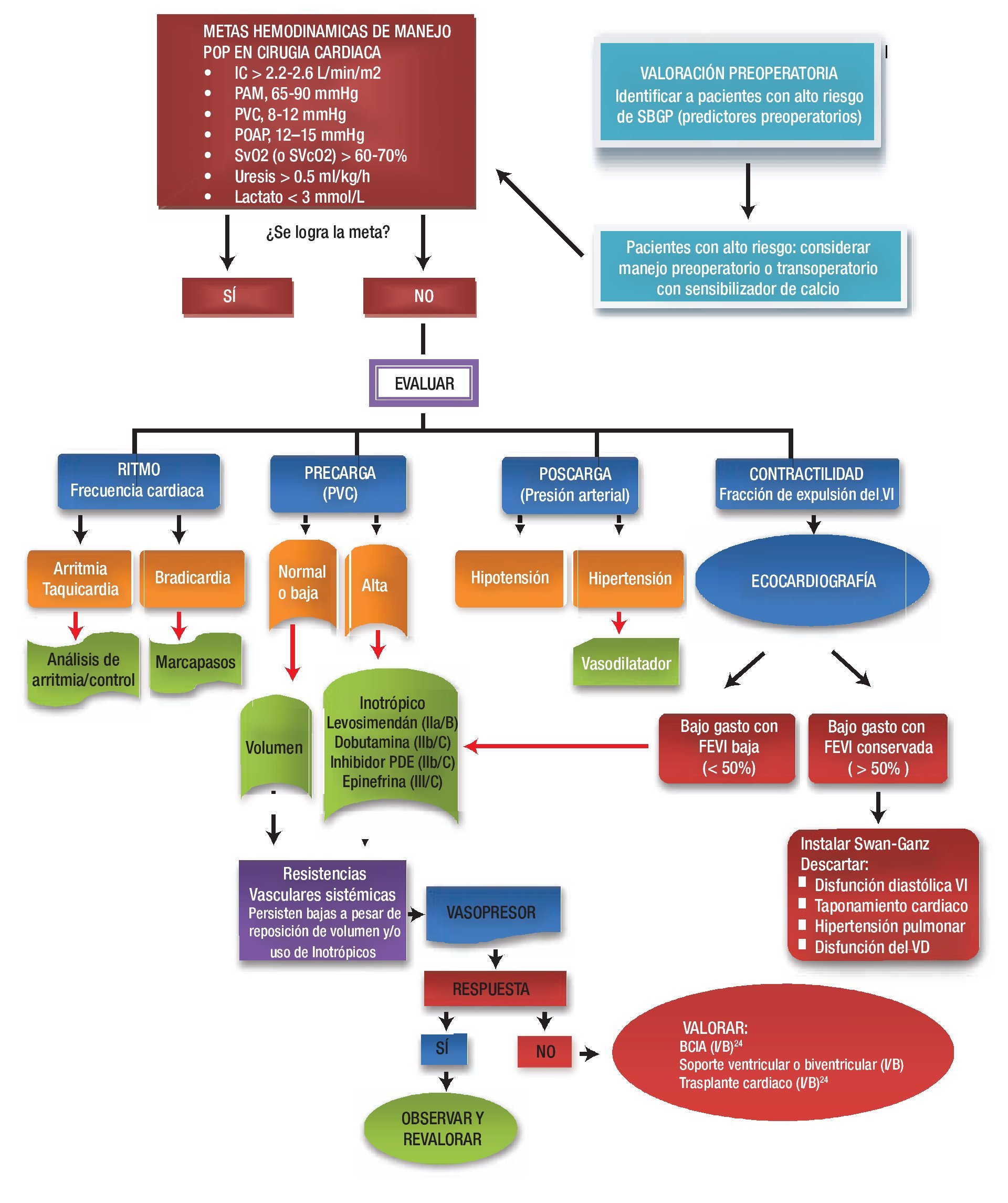
Existen contextos posoperatorios especiales, como las correcciones quirúrgicas de las cardiopatías congénitas complejas u operaciones valvulares con insuficiencia derecha por incremento de las resistencias pulmonares, que se tratan en otro capítulo pero en los que los inhibidores de la fosfodiesterasa III juegan un papel preponderante. En la Figura 4 se sugiere un algoritmo de tratamiento del SBGP.
Figura 4. Algoritmo del tratamiento del SBGP.
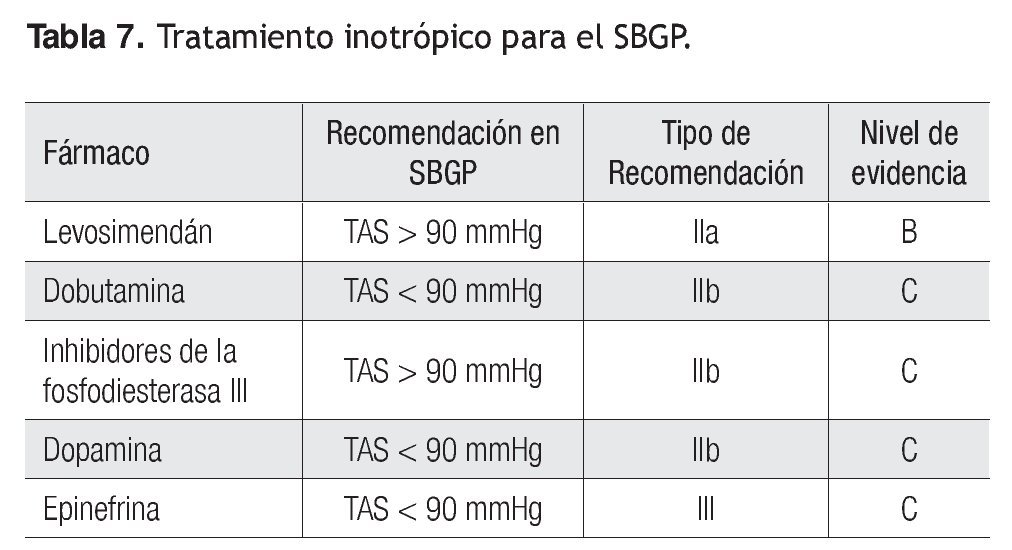
En la Tabla 7 se señalan las recomendaciones de acuerdo con el grado de recomendación y nivel de evidencia para cada uno de los inotrópicos.
Choque cardiogénico poscardiotomía
Cuando existe un daño miocárdico extenso, el SBGP puede complicarse con el choque cardiogénico, situación que ocurre entre 2% y 6% de todos los procedimientos quirúrgicos cardiovasculares, de acuerdo con las publicaciones anglosajonas; no obstante, tanto en México como en América Latina esta cifra es probablemente tres veces mayor por la elevada incidencia de la cirugía valvular de etiología reumática y por el tratamiento quirúrgico tardío de la cardiopatía. En este escenario catastrófico, la utilización de dispositivos de asistencia ventricular avanzada (DVA) es una notable opción terapéutica cuando el choque cardiogénico es refractario al manejo convencional (inotrópicos/BIAC). La tasa de éxito en la utilización de la DVA ha cambiado de forma significativa en la última década. En 1992, Pae y colaboradores analizaron la tasa de sobrevida de los pacientes que desarrollaron esta complicación y se les colocó un DAV: en un registro de casi 1 000 pacientes se encontró una sobrevida de tan sólo 25%. Con el desarrollo tecnológico, y sobre todo con la adquisición de experiencia en el manejo de la asistencia ventricular en centros de referencia, estos resultados han mejorado de manera notoria. En el año 2007, Hernández y colaboradores analizaron los resultados de 10 años del registro de la Sociedad Nacional de Cirujanos de Tórax, en donde se incluyó a 5 735 pacientes en quienes se implantaron DAV en 601 centros de cirugía cardiaca; se compararon cuatro periodos comprendidos entre enero de 1995 y diciembre del 2004, con los siguientes resultados.
Se demostró una reducción significativa de la mortalidad, 75% a 40% durante el periodo más reciente; esta mejoría ocurre a pesar de que la población quirúrgica es más longeva y con mayor comorbilidad. Existen varias posibles explicaciones para la mejoría de los resultados posterior al implante de la AVC:
Mejorías tecnológicas de los DAV. Muchos centros han cambiado a dispositivos de fácil implantación que requieren menos mantenimiento. Estos avances tecnológicos incluyen el uso de bombas pulsátiles más durables en lugar de bombas centrífugas. Las bombas pulsátiles son más fáciles de implantar debido a los avances en las técnicas de canulación y son menos propensas a sustituirse. Gracias a estos avances existen menos problemas de sangrado, infecciones, hemólisis y episodios embólicos.
Mejores protocolos de atención posquirúrgica. Muchos centros han estandarizado protocolos terapéuticos para la anticoagulación y la profilaxis de infección con el uso temprano de antibióticos. Un adecuado control de la anticoagulación reduce la necesidad de reoperación por sangrado y previene los episodios embólicos en el caso de una anticoagulación subterapéutica. Otros procedimientos en la atención posterior al implante, como la introducción de sustitución dialítica continua de flujos lentos y fármacos especiales como el óxido nítrico y el factor VII, han contribuido a estas mejorías.
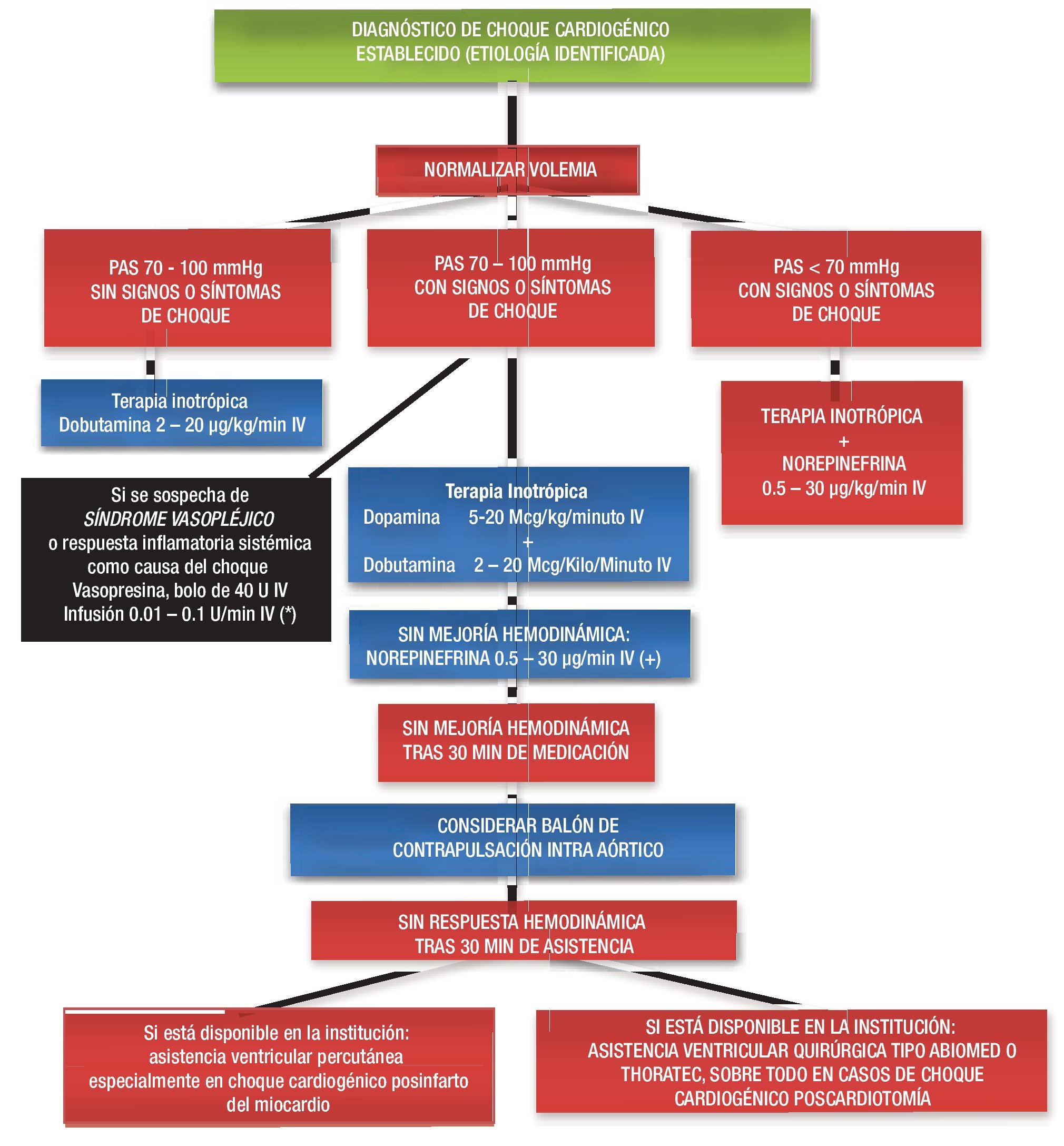
Implante temprano de DAV. Por último, estos avances de la tecnología, la fácil implantación y las medidas de atención posoperatoria han llevado a los cirujanos a la utilización temprana de los DAV antes del inicio de la insuficiencia orgánica, como la insuficiencia renal aguda, el síndrome de dificultad respiratoria del adulto o la translocación bacteriana, que suelen ensombrecer el pronóstico final de los pacientes (Figura 5). En la Tabla 8 se señalan las indicaciones de DAV en presencia de SBGP resistente al tratamiento.
Figura 5. Algoritmo del tratamiento del choque cardiogénico.
Bibliografía
Álvarez J, Bouzada M, Fernández AL, et al. Comparación de los efectos hemodinámicos del levosimendán con la dobutamina en pacientes con bajo gasto después de cirugía cardíaca. Rev Esp Cardiol 2006;59:338-345.
Álvarez J. Levosimendán en el síndrome de bajo gasto cardiaco. ¿Disminuye realmente la mortalidad? Rev Esp Cardiol 2008;61:454-457.
Antman EM, Anbe DT, Armstrong PW, et al. Modification de ACC/AHA Guidelines for the Management of Patients with ST Elevation Myocardial Infarction: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee to Revise the 1999 Guidelines for the Management of Patients With Acute Myocardial Infarction). Circulation 2004;110;e82-e293.
Brule J, Hoedemaekers C, Pickkers P. Clinical outcome benefits of pretreatment with levosimendan. Br J Anaesth 2009;102:883-884.
Christakis GT, Birnbaum PL, Weisel RD, et al. The changing pattern of coronary bypass surgery. Circulation 1989;80:(Suppl I):151-61.
Christakis GT, Weisel RD, Fremes SE, et al. Coronary artery bypass surgery in patients with poor ventricular function. J Thorac Cardiovasc Surg 1992;103:1083-1092.
De Backer D, Biston P, Devriendt J, et al. Comparison of dopamine and norepinephrine in the treatment of shock. N Engl J Med 2010;362(9):779-789.
Dickstein K, Cohen Solal A, Filippatos G, et al. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2008. Eur Heart J 2008;29:2388-2442.
Dietzman RH. Low output syndrome. J Thorac Cardiovasc Surg 1967:138-150.
Fisher LD, Kennedy JW, Davis KB, et al. Association of sex, physical size, and operative mortality after coronary artery bypass in the Coronary Artery Surgery Study (CASS). J Thorac Cardiovasc Surg 1982;84:334-341.
Follath F, Cleland JGF, Just H, et al. Efficacy and safety of intravenous levosimendan compared with dobutamine in severe low-output heart failure (the LIDO study): a randomized double blind trial. Lancet 2000;360:196-202.
George R, Winter R. The clinical value of measuring cardiac output. Brit J Hosp Med 1985;34:89.
Gheorghiade M, Zannad F, Sopko G, et al. Acute heart failure syndromes: current state and framework for future research. Circulation 2005;112: 3958-3968.
Gillies M, Bellomo R, Doolan L, Buxton B. Bench-to-bedside review: inotropic drug therapy after adult cardiac surgery- a systematic literature review. Critical Care 2005;9:266-279.
Goldman L, Caldera DL, Nussbaum SR, et al. Multifactorial index of cardiac risk in noncardiac surgical procedures. N Engl J Med 1977;297:845-850.
Goldstein R, Byrnes T, Geraci S. Pharmacologic therapy of low output syndromes after cardiac surgery. Arch Intern Physiol Biochem 1984;92s:21.
González-Chon O, García L, Chacon M, et al. Levosimendan: nueva estrategia en el manejo de la falla cardiaca. Arch Cardiol Méx 2005;75:130-139.
Hayashida N, Ikonomidis JS, Weisel RD, et al. Antegrade distribution of warm cardioplegic solution. J Thorac Cardiovasc Surg 1995;110:800-812.
Howell S. Epidemiology of perioperative cardiac complications. In: Howell S, Pepper C, Pahn DR, editors. Heart disease and the surgical patient. New York: Informa Healthcare 2007; 1-14.1.
Labriola C, Siro-Brigiani M, Carrata F, et al. Hemodynamic effects of levosimendan in patients with lowoutput heart failure after cardiac surgery. Int J Clin Pharmacol Ther 2004;42:204-211.
Large S. Surgery for heart failure. Heart 2007; 93:392-402.
Lazar HL, Buckberg GD, Manganaro AJ, et al. Myocardial energy replenishment and reversal of ischemic damage by substrate enhancement of secondary blood cardioplegia with amino acids during reperfusion. J Thorac Cardiovasc Surg 1980;80:350-359.
Levin RL, Degrange MA, Porcile R, et al. Superioridad del sensibilizante al calcio levosimendán comparado con dobutamina en el síndrome de bajo gasto cardiaco postoperatorio. Rev Esp Cardiol 2008;61:471-479.
Malliotakis P, Xenikakis T, Linardakis M. et al. Haemodynamic effects of levosimendan for low cardiac output after cardiac surgery: a case series. Hellenic J Cardiol 2007;48:80-88.
Mebazaa A, Nieminen MS, Packer M, et al. Levosimendan vs dobuta-mine for patients with acute decompesated heart failure. The SURVIVE Randomized Trial. JAMA 2007;297:1883-1891.
Mebazza A. Clinical review: practical recommendations on the management of perioperative heart failure in cardiac sugery. Critical Care 2010;14:201.
Miceli A, Fiorani B, Hinna Danesi T, et al. Prophylactic intra-aortic balloon pump in high-risk patients undergoing coronary artery bypass grafting: a propensity score analysis. Interact CardioVasc Thorac Surg 2009;9:291-294.
Misare BD, Krukenkamp IB, Levitsky S. Age-dependent sensitivity to unprotected cardiac ischemia: the senescent myocardium. J Thorac Cardiovasc Surg 1992;103:60-65.
Moiseyev VS, Poder P, Andrejevs N, et al. Safety and efficacy of a novel calcium sensitizer, levosimendan in patients with left ventricular failure due to an acute myocardial infarction (RUSSLAN study). Eur Heart J 2002;23:1422-1432.
Nieminen MS, Harjola VP. Definition and epidemiology of acute heart failure syndromes. Am J Cardiol 2005;96(6A):5G-10G.
Overgaard CB, Dzavík V. Inotropes and vasopressors. Review of physiology and clinical use in cardiovascular disease. Circulation 2008;118:1047-1056.
Pagel PS. Levosimendan in cardiac surgery: a unique drug for the treatment of perioperative left ventricular dysfunction or just another inodilator searching for a clinical application? Anesth Analg 2007;104:759-761.
Plochl W, Rajek A. The use of the novel calcium sensitizer levosimendan in critically ill patients. Anaesth Intensive Care 2004;32:471-475.
Polonen P, Ruokonen E, Hippelainen M, et al. A prospective, randomised study of goal-oriented haemodynamic therapy in cardiac surgical patients. Anesth Analg 2000;90:1052-1059.
Raja SG, Rayen BS. Levosimendan in cardiac surgery: current best available evidence. Ann Thorac Surg 2006;81:1536-1546.
Ranucci M, Toffol B. Hyperlactatemia during cardiopulmonary bypass: determinants and impact on postoperative outcome. Crit Care 2006;6.
Rao V, Ivanov J. Lactate release during reperfusion predicts low cardiac output syndrome after coronary bypass surgery. Ann Thorac Surg 2001;71:1925-1930.
Rashkin MC, Bosken C, Baughman RP. Oxygen delivery in critically ill patients. Relationship to blood lactate and surviv. Chest 1985;87:580-584.
Rousou JA, Engelman RM, Anisimowicz L, et al. Metabolic enhancement of myocardial preservation during cardioplegic arrest. J Thorac Cardiovasc Surg 1986;91:270-276.
Ruffenach A, Lessana A, Brodaty D, Maillet JM, LeBesnerais P, Cantoni M, Nataf P. Chest 2003;123:1361-1366.
Sociedad Española de Cirugía Cardiovascular. Actividad 2006. Disponible en: http://www.sectcv.es
St. Andre A, Del Rossi A. Hemodynamic management of patients in the first 24 hours after cardiac surgery. Crit Care Med 2005;33(9):2082-2092.
Stanley WC, Lopaschuk GD, Hall J, et al. Regulation of myocardial carbohydrate metabolism under normal and ischaemic conditions: potential for pharmacological interventions. Cardiovasc Res 1997:33:243-257.
Tasouli A, Papadopoulos K, Antoniou T, et al. Efficacy and safety of perioperative infusion of levosimendan in patients with compromised cardiac function undergoing open-heart surgery: importance of early use. Eur J Cardiothorac Surg 2007;32:629-633.
Tokuda Y, Grant PW, Wolfenden HD, et al. Levosimendan for patients with impaired left ventricular function undergoing cardiac surgery. Interact CardioVasc Thorac Surg 2006;5:322-326.
Tritapepe L, De Santis V, Vitale D, et al. Levosimendan pre-treatment improves outcomes in patients undergoing coronary artery bypass graft surgery. Br J Anaesth 2009;102:198-204.
Tritapepe L, De Santis V, Vitale D, Nofroni I, et al. Preconditioning effects of Levosimendan in coronary artery bypass grafting-a pilot study. Br J Anaesth 2006;96:694-700.
Weil MH, Afifi AA. Experimental and clinical studies on lactate and pyruvate as indicators of the severity of acute circulatory failure (shock). Circulation 1970;41:989-1001.