Evaluar la incidencia de síndrome cardiorrenal tipo 1 (SCR1) en una unidad de cuidados intensivos coronarios y su asociación a mortalidad intrahospitalaria a 30 días, así como a otras características epidemiológicas.
MétodosSe revisaron las historias clínicas de todos los pacientes hospitalizados con diagnóstico de falla cardíaca aguda en un periodo de 4 años. Se definió como SCR1 la presencia de falla cardíaca aguda más una creatinina al ingreso≥0.3mg/dL con respecto a la creatinina basal calculada por la fórmula MDRD75, y/o una elevación≥50% de la creatinina al ingreso en un periodo de 48h.
ResultadosLa incidencia de SCR1 fue del 27.87%, IC95%: 20.13-36.71 (34 de 122). Hubo una mayor frecuencia de SCR1 en los pacientes que ingresaron con diagnóstico de shock cardiogénico (RR: 2.02; IC95%: 1.20-3.93; p=0.0378) y en los que tenían niveles más altos de hemoglobina (p=0.0412). El SCR1 se asoció a una mayor mortalidad intrahospitalaria a 30 días (HR: 4.11; IC95%: 1.20-14.09; p=0.0244).
ConclusionesLa incidencia de SCR1 en la unidad de cuidados intensivos coronarios encontrada en nuestro estudio es similar a la descrita en estudios extranjeros. La presencia de shock cardiogénico como causa de falla cardíaca y valores más altos de hemoglobina se asociaron a una mayor incidencia de SCR1. Los pacientes con SCR1 tuvieron mayor mortalidad intrahospitalaria a 30 días.
This study sought to evaluate the incidence of cardiorenal syndrome (CRS) type 1 in a coronary care unit and its association with hospital mortality within 30 days of admission, as well as other epidemiological characteristics.
MethodsThe medical records of all the patients who were hospitalized with the diagnosis of acute heart failure in a 4-year period were reviewed. CRS type 1 was characterized by the presence of acute heart failure and an elevation of serum creatinine≥0.3mg/dL in comparison to the baseline creatinine calculated by the MDRD75 equation and/or the elevation of≥50% of the admission serum creatinine within a 48h period.
ResultsThe incidence of CRS type 1 was 27.87%, 95% CI: 20.13-36.71 (34 of 122). There was a higher frequency of CRS type 1 in those patients who were admitted with the diagnosis of cardiogenic shock (adjusted RR 2.02, 95% CI: 1.20-3.93, p=0.0378) and in those with higher hemoglobin levels (p=0.0412). The CRS type 1 was associated with an increase of 30-day mortality (HR: 4.11, 95% CI: 1.20-14.09, p=0.0244).
ConclusionsThe incidence of CRS type 1 in the coronary care unit found in our study is similar to those found in foreign studies. The history of stroke and the higher values of hemoglobin were associated with a higher incidence of cardiorenal syndrome type 1. Patients with CRS type 1 had a higher hospital mortality within 30 days of admission.
La falla cardíaca o insuficiencia cardíaca (IC) es uno de los principales problemas de salud pública tanto en países desarrollados como en países en vías de desarrollo y una de las enfermedades mundiales más prevalentes y de mayor mortalidad1–5. Esta es definida como un síndrome clínico producido por cualquier disfunción cardíaca, funcional o estructural, que altere la capacidad del ventrículo para el llenado o la eyección sanguínea6.
La prevalencia de la IC se sitúa en el 2-3% y aumenta drásticamente alrededor de los 75 años de edad, hasta llegar a un 10-20% en el grupo de pacientes de 70-80 años7.
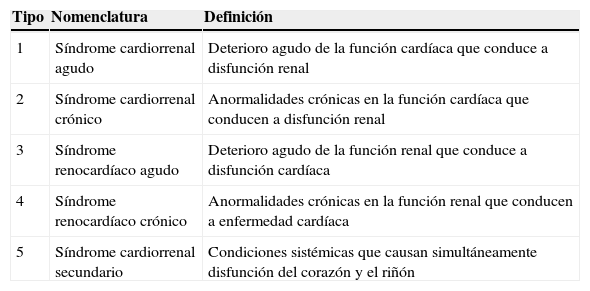
En nuestro país se han hecho estudios analizando las características epidemiológicas de los pacientes hospitalizados por falla cardíaca y su mortalidad intrahospitalaria puede llegar incluso al 17%8. Aproximadamente el 25-33% de los pacientes que se hospitalizan por falla cardíaca aguda desarrollan enfermedad renal aguda9. A esta secuencia de falla cardíaca aguda seguida de falla renal aguda se le conoce en la actualidad como síndrome cardiorrenal agudo o síndrome cardiorrenal tipo 1 (SCR1), el cual es uno de los 5 subtipos de síndrome cardiorrenal según la clasificación propuesta en el 7.o consenso de la «Acute Dialysis Quality Initiative» (ADQI)10 (tabla 1). Sin embargo, no existen estudios en nuestro país sobre la incidencia de este síndrome ni sus características epidemiológicas asociadas.
Clasificación del síndrome cardiorrenal
| Tipo | Nomenclatura | Definición |
|---|---|---|
| 1 | Síndrome cardiorrenal agudo | Deterioro agudo de la función cardíaca que conduce a disfunción renal |
| 2 | Síndrome cardiorrenal crónico | Anormalidades crónicas en la función cardíaca que conducen a disfunción renal |
| 3 | Síndrome renocardíaco agudo | Deterioro agudo de la función renal que conduce a disfunción cardíaca |
| 4 | Síndrome renocardíaco crónico | Anormalidades crónicas en la función renal que conducen a enfermedad cardíaca |
| 5 | Síndrome cardiorrenal secundario | Condiciones sistémicas que causan simultáneamente disfunción del corazón y el riñón |
Fuente: Ronco C, McCullough P, Anker SD, et al. Cardio-renal syndromes: Report from the consensus conference of the Acute Dialysis Quality Initiative. Eur Heart J. 2010;31:703–711.
El objetivo de este estudio fue evaluar la incidencia de SCR1 en los pacientes que ingresaron por falla cardíaca aguda a una unidad de cuidados intensivos coronarios (UCICOR) y su asociación a mortalidad intrahospitalaria a 30 días. También se evaluó si existía mayor incidencia de SCR1 asociado a antecedentes (por ejemplo, infarto, accidente cerebrovascular [ACV], insuficiencia cardíaca crónica, etc.), tratamiento previo, tipo de falla cardíaca aguda y asociación con ciertos parámetros de laboratorio. Por último se evaluó si la presencia de SCR1 determinaba cambios en la terapéutica, tiempo de hospitalización o necesidad de diálisis.
MétodosSe trata de un estudio observacional, analítico, de cohortes retrospectivas. Se analizaron todas las historias clínicas de los pacientes que ingresaron con diagnóstico de falla cardíaca aguda a la UCICOR del Hospital Nacional Arzobispo Loayza en Lima-Perú, entre las fechas de abril del 2009 y marzo del 2013 según el cuaderno de registro de pacientes de esta unidad.
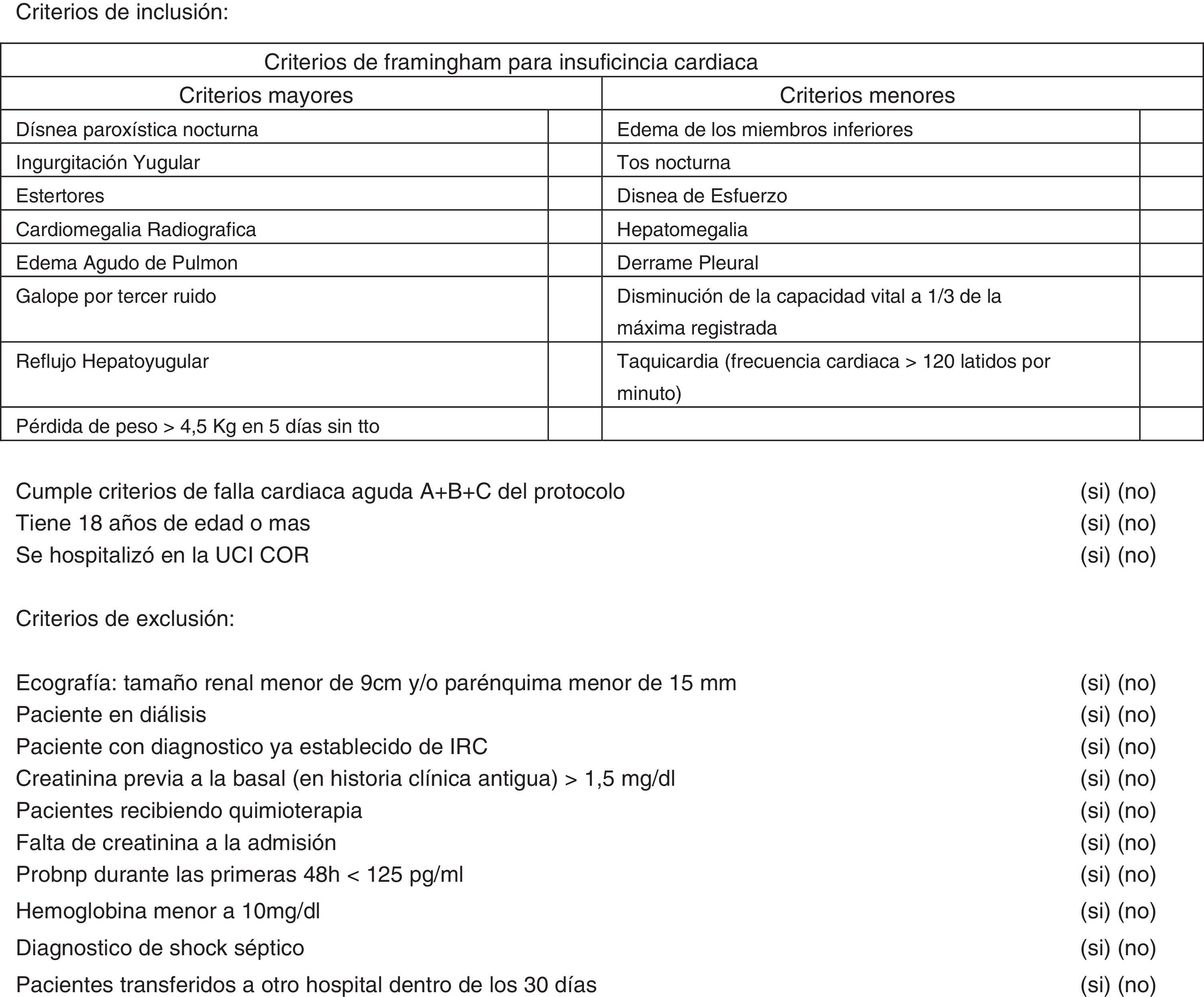
Los criterios de inclusión para este estudio fueron: diagnóstico de falla cardíaca aguda según criterios A+B+C mencionados más adelante, edad mayor o igual a 18 años y pacientes hospitalizados en la UCICOR del Hospital Nacional Arzobispo Loayza durante el periodo de estudio. Los criterios de exclusión fueron: tamaño longitudinal renal<9cm y/o parénquima<15mm por ecografía, paciente en diálisis, paciente con diagnóstico establecido de insuficiencia renal crónica por historia clínica, hemoglobina<10mg/dL al ingreso, diagnóstico de shock séptico, creatinina previa a la basal (en historia clínica antigua)>1,5mg/dL, pacientes recibiendo quimioterapia, falta de creatinina a la admisión, prohormona del péptido natriurético cerebral <125pg/mL durante las primeras 48h y pacientes transferidos a otro hospital dentro de los primeros 30 días desde su ingreso.
Para confirmar el diagnóstico de falla cardíaca aguda todo paciente debía cumplir con los ítems A+B+C que se muestran a continuación:
- A)
Presencia de por lo menos 2 criterios mayores o uno mayor y 2 menores según los criterios de Framingham para falla cardíaca (fig. 1)11,12,
- B)
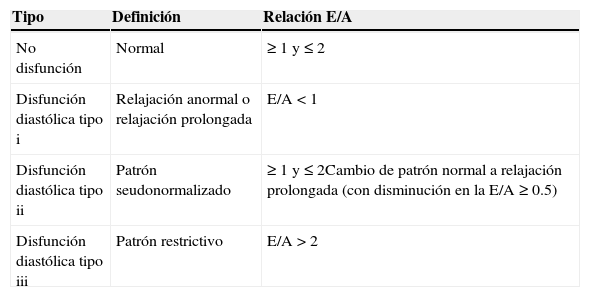
Criterios ecocardiográficos de falla cardíaca definidos como la presencia de por lo menos una de las siguientes características13–18:
- -
Disfunción sistólica: fracción de eyección≤50%
- -
Disfunción diastólica tipo i, ii o iii (tabla 2)
Tabla 2.Grados de disfunción diastólica y su definición por ecocardiografía transtorácica
Tipo Definición Relación E/A No disfunción Normal ≥1 y ≤2 Disfunción diastólica tipo i Relajación anormal o relajación prolongada E/A<1 Disfunción diastólica tipo ii Patrón seudonormalizado ≥1 y ≤2Cambio de patrón normal a relajación prolongada (con disminución en la E/A≥0.5) Disfunción diastólica tipo iii Patrón restrictivo E/A>2 E/A: cociente de los valores de las ondas E y A del flujo transmitral medidos por doppler pulsado.
Extraída de McMurray et al.3.
- -
Si el patrón de llenado es monofásico por ecocardiografía: presencia de e’≤8cm/seg y/o E/e’>15
- -
Si el paciente no cuenta con ecocardiografía o si E/e’ está entre 8 y 15: ausencia de alguna otra enfermedad que explique mejor los signos y síntomas que sugieren falla cardíaca3,19. (Por ejemplo, paciente disneico por crisis asmática, con miembros inferiores aumentados de volumen por trombosis venosa o celulitis, etc.)
- -
- C)
Inicio o empeoramiento de disnea, palpitaciones o edemas que motive la hospitalización o que haga plantear el diagnóstico de falla cardíaca aguda20,21.
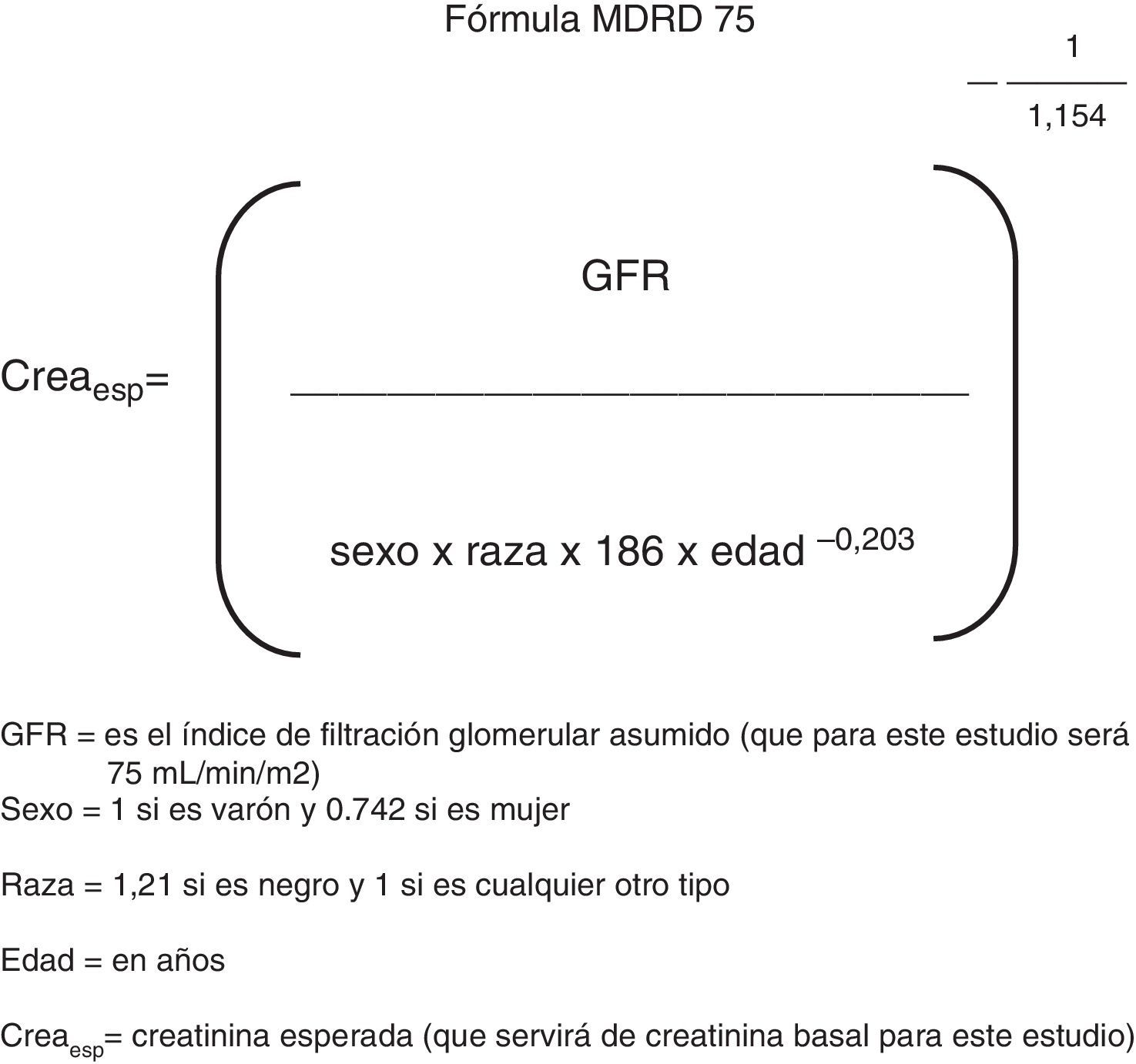
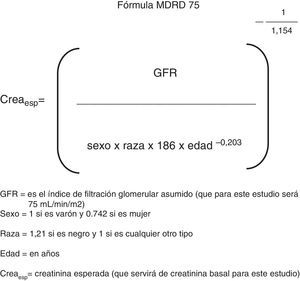
Entre los pacientes con falla cardíaca aguda se definió como SCR1 a una elevación de la creatinina≥0.3mg/dL (≥0.3mg/dL) con respecto a la creatinina basal calculada y/o una elevación≥50% en un periodo de 48h (1.5 veces el basal medido en el primer examen de laboratorio al ingreso)22,23. Se tomó como creatinina basal calculada un valor derivado de la fórmula MDRD (Modification of Diet in Renal Disease) a partir de un índice de filtración glomerular esperado de 75mL/min/m2 (fig. 2). Se eligió este método para calcular la creatinina basal debido a que la mayoría de los pacientes que llegan al hospital no cuentan con una creatinina previa y en múltiples estudios este problema fue enfrentado calculando una creatinina basal a partir de la fórmula de depuración de creatinina (en este caso la fórmula MDRD) tomando como constante una presunta función basal de 75mL/min/m2 (MDRD75), tal como lo recomienda la ADQI Working Group24–26. Este valor de filtración glomerular representa la peor función renal basal posible en una persona sin falla renal, en lugar de una presunta función renal basal entre 80 y 120 (que son sus valores normales). De esta forma se disminuye el número de diagnósticos falsos positivos.
Para la recolección de datos se utilizó un formulario (fig. 3) supervisado por los coinvestigadores nefrólogos y cardiólogos y aprobado por el Comité Institucional de Ética de la Universidad Peruana Cayetano Heredia. Las variables independientes utilizadas fueron: sexo; edad; antecedentes de insuficiencia cardíaca crónica, hipertensión arterial, diabetes mellitus, accidente cerebrovascular (ACV), valvulopatía severa, infarto de miocardio, angiografía coronaria y arritmia; tipo de arritmia que puede incluir fibrilación auricular, flutter, taquicardia paroxística supraventricular, bloqueo auriculoventricular y otras; medicación previa considerada en la historia clínica de ingreso de la UCICOR: inhibidores de la enzima convertidora de la angiotensia, antagonistas de los receptores de la angiotensina ii, diuréticos, betabloqueadores, espironolactona, calcioantagonistas, ácido acetilsalicílico, nitratos, antiinflamatorios no esteroideos y digitálicos; tipo de IC aguda: insuficiencia cardíaca crónica descompensada, edema agudo de pulmón, insuficiencia cardíaca hipertensiva, shock cardiogénico, IC derecha aislada e IC asociada a síndrome isquémico coronario agudo; valores de algunos exámenes auxiliares al ingreso como: sodio, potasio, bicarbonato, hemoglobina, lactato, diuresis durante las primeras 24h y diuresis entre las 24 y 48h; fracción de eyección por ecocardiografía; función diastólica por ecocardiografía; síndrome cardiorrenal. Las variables dependientes usadas fueron: síndrome cardiorrenal; uso de fármacos durante las primeras 48h como: inhibidores de la enzima convertidora de angiotensia, antagonistas de los receptores de la angiotensina ii, furosemida, betabloqueadores, espironolactona, antiinflamatorios no esteroideos, calcioantagonistas, ácido acetilsalicílico, nitratos, inotrópicos, vasopresores, digitálicos, fibrinolíticos, ranitidina, hidroclorotiazida, enoxaparina, warfarina y clopidogrel; tiempo de hospitalización; diálisis; mortalidad intrahospitalaria a 30 días (tabla 3).
Tipos de variables y sus posibles valores
| Nombre | Tipo | Valores |
|---|---|---|
| Sexo | Dico | M/F |
| Edad en años | Cuant | 18 a más |
| Antecedente de ICC | Dico | Sí/No |
| Antecedente de HTA | Dico | Sí/No |
| Antecedente de DM | Dico | Sí/No |
| Antecedente de ACV | Dico | Sí/No |
| Antecedente de valvulopatía severa | Dico | Sí/No |
| Antecedente de IM | Dico | Sí/No |
| Cateterismo cardíaco (angiografía coronaria reciente) | Dico | Sí/No |
| Arritmia | Cual | FA, flutter, TPSV, BAV, otras |
| Medicación previa | ||
| IECA | Dico | Sí/No |
| ARAII | Dico | Sí/No |
| Diuréticos | Dico | Sí/No |
| Betabloqueadores | Dico | Sí/No |
| Espironolactona | Dico | Sí/No |
| Calcioantagonistas | Dico | Sí/No |
| AAS | Dico | Sí/No |
| Nitratos | Dico | Sí/No |
| AINE | Dico | Sí/No |
| Digitálicos | Dico | Sí/No |
| Tiempo de enfermedad en días | Cuant | 0 a más |
| Tipo de falla cardíaca aguda | ||
| IC crónica descompensada | Dico | Sí/No |
| Edema agudo de pulmón | Dico | Sí/No |
| IC hipertensiva | Dico | Sí/No |
| Shock cardiogénico | Dico | Sí/No |
| IC derecha aislada | Dico | Sí/No |
| IC asociada a SICA | Dico | Sí/No |
| Na en mEq/L | Cuanti | 0 a más |
| K en mEq/L | Cuanti | 0 a más |
| HCO3en mEq/L | Cuanti | 0 a más |
| Hb en mg/dL | Cuanti | 0 a más |
| Lactato en mEq/L | Cuanti | 0 a más |
| Diuresis(primeras 24h) en mL | Cuanti | 0 a más |
| Diuresis(24 a 48h) en mL | Cuanti | 0 a más |
| FE en % | Cuanti | 0 a 100 |
| Función diastólica | Cuali | Disfunción tipo I, II, III y patrón monofásico |
| Fármacos usados en las primeras 48h | ||
| IECA | Dico | Sí/No |
| ARAII | Dico | Sí/No |
| Furosemida | Dico | Sí/No |
| Betabloqueadores | Dico | Sí/No |
| Espironolactona | Dico | Sí/No |
| AINE | Dico | Sí/No |
| Calcioantagonistas | Dico | Sí/No |
| AAS | Dico | Sí/No |
| Nitratos | Dico | Sí/No |
| Inotrópicos | Dico | Sí/No |
| Vasopresores | Dico | Sí/No |
| Digitálicos | Dico | Sí/No |
| Fibrinolíticos | Dico | Sí/No |
| Ranitidina | Dico | Sí/No |
| Hidroclorotiazida | Dico | Sí/No |
| Enoxaparina | Dico | Sí/No |
| Warfarina | Dico | Sí/No |
| Clopidogrel | Dico | Sí/No |
| Tiempo de hospitalización en días | Cuanti | 0 a más |
| Diálisis | Dico | Sí/No |
| Mortalidad a 30 días | Dico | Sí/No |
AAS: ácido acetilsalicílico; ACV: accidente cerebrovascular; AINE: antiinflamatorios no esteroideos; ARAII: antagonista de los receptores de la angiotensina ii; BAV: bloqueo auriculoventricular de alto grado; Cual: cualitativa; Cuanti: cuantitativa; Dico: dicotómica; DM: diabetes mellitus; F: femenino; FA: fibrilación auricular; FE: fracción de eyección; Hb: hemoglobina; HCO3: bicarbonato; HTA: hipertensión arterial; IC: insuficiencia cardíaca; ICC: insuficiencia cardíaca crónica; IECA: inhibidores de la enzima convertidora de la angiotensina; IM: infarto de miocardio; K: potasio; M: masculino; Na: sodio; SICA: síndrome isquémico coronario agudo; TPSV: taquicardia paroxística supraventricular.
Los exámenes de sangre registrados fueron tomados en el laboratorio del Hospital, el cual utiliza el analizador de gases en sangre ABL 800 FLEX para medir sodio, potasio, bicarbonato y lactato; el analizador fotométrico COBAS C501 ROCHE para medir la creatinina en sangre y el sistema hematológico ADVIA 2120 para analizar la hemoglobina.
Para todas la ecocardiografías se utilizó ecógrafos Phillips iE33.
Se utilizó T de Student para variables continuas, chi2 para variables cualitativas y análisis de regresión de Cox para calcular la supervivencia. El programa utilizado para realizar el análisis estadístico de los resultados fue Epi Info™ 7.1.2.0.
ResultadosSe analizaron un total de 167 historias clínicas, de las cuales solo 122 cumplían con criterios de inclusión y exclusión. Los motivos para excluir a los pacientes en orden de frecuencia fueron: 19 por no cumplir criterios de falla cardíaca aguda, 5 por riñones menores de 90mm por ecografía, 5 por enfermedad renal crónica (ERC) previa según criterio del médico que recibió al paciente en su ingreso a la UCICOR, 4 por shock séptico, 3 por ausencia de creatinina al ingreso, 3 por diagnóstico de ERC en hemodiálisis, 2 por otras causas que pueden explicar signos y síntomas que asemejen IC ante la ausencia de confirmación ecocardiográfica, uno por ser paciente menor de 18 años de edad, uno por ser transferido antes del alta, uno por creatinina previa>1.5 y uno por hemoglobina al ingreso<10mg/dL.
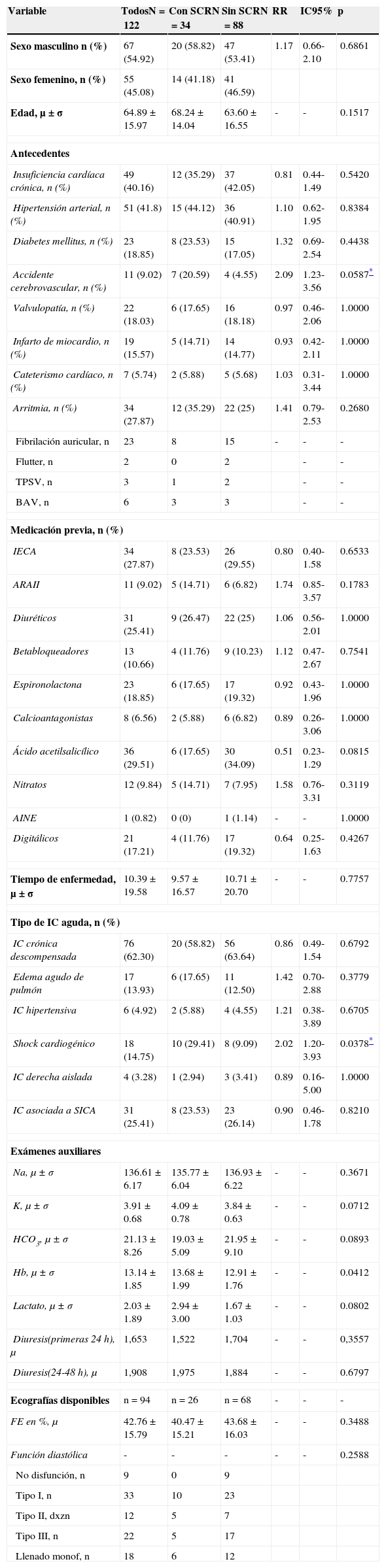
De los 122 pacientes que ingresaron al estudio, 34 (27.87%) tuvieron el diagnóstico de SCR1 con un IC95% 20.13-36.71%. Las características clínicas de los pacientes se muestran en la tabla 4. No hubo diferencias significativas en sexo, edad, medicación previa, tiempo de enfermedad (tiempo desde que comenzaron los síntomas hasta su ingreso), ni grado ecocardiográfico de disfunción sistólica o diastólica. En el análisis univariado tanto el ACV como antecedente y el shock cardiogénico como causa de falla cardíaca aguda estuvieron asociados a un mayor riesgo de desarrollar SCR1 (ACV: RR=2.62; IC95% 1.50-4.55; p=0.010) (shock cardiogénico: RR=2.41; IC95% 1.40-4.14; p=0.0087). Al hacer el análisis multivariado, el shock cardiogénico continuó siendo una variable que significativamente aumenta el riesgo de desarrollar SCR1 (ajustado: RR=2.02; IC95%: 1.20-3.93; p=0.0378). La asociación a ACV, por otro lado, disminuyó con un valor «p» ligeramente por encima de 0.05 (ajustado: RR=2.09; IC95%: 1.23-3.56; p=0.0587).
Análisis de las variables independientes y su asociación a SCR1
| Variable | TodosN=122 | Con SCRN=34 | Sin SCRN=88 | RR | IC95% | p |
|---|---|---|---|---|---|---|
| Sexo masculino n (%) | 67 (54.92) | 20 (58.82) | 47 (53.41) | 1.17 | 0.66-2.10 | 0.6861 |
| Sexo femenino, n (%) | 55 (45.08) | 14 (41.18) | 41 (46.59) | |||
| Edad, μ±σ | 64.89±15.97 | 68.24±14.04 | 63.60±16.55 | - | - | 0.1517 |
| Antecedentes | ||||||
| Insuficiencia cardíaca crónica, n (%) | 49 (40.16) | 12 (35.29) | 37 (42.05) | 0.81 | 0.44-1.49 | 0.5420 |
| Hipertensión arterial, n (%) | 51 (41.8) | 15 (44.12) | 36 (40.91) | 1.10 | 0.62-1.95 | 0.8384 |
| Diabetes mellitus, n (%) | 23 (18.85) | 8 (23.53) | 15 (17.05) | 1.32 | 0.69-2.54 | 0.4438 |
| Accidente cerebrovascular, n (%) | 11 (9.02) | 7 (20.59) | 4 (4.55) | 2.09 | 1.23-3.56 | 0.0587* |
| Valvulopatía, n (%) | 22 (18.03) | 6 (17.65) | 16 (18.18) | 0.97 | 0.46-2.06 | 1.0000 |
| Infarto de miocardio, n (%) | 19 (15.57) | 5 (14.71) | 14 (14.77) | 0.93 | 0.42-2.11 | 1.0000 |
| Cateterismo cardíaco, n (%) | 7 (5.74) | 2 (5.88) | 5 (5.68) | 1.03 | 0.31-3.44 | 1.0000 |
| Arritmia, n (%) | 34 (27.87) | 12 (35.29) | 22 (25) | 1.41 | 0.79-2.53 | 0.2680 |
| Fibrilación auricular, n | 23 | 8 | 15 | - | - | - |
| Flutter, n | 2 | 0 | 2 | - | - | |
| TPSV, n | 3 | 1 | 2 | - | - | |
| BAV, n | 6 | 3 | 3 | - | - | |
| Medicación previa, n (%) | ||||||
| IECA | 34 (27.87) | 8 (23.53) | 26 (29.55) | 0.80 | 0.40-1.58 | 0.6533 |
| ARAII | 11 (9.02) | 5 (14.71) | 6 (6.82) | 1.74 | 0.85-3.57 | 0.1783 |
| Diuréticos | 31 (25.41) | 9 (26.47) | 22 (25) | 1.06 | 0.56-2.01 | 1.0000 |
| Betabloqueadores | 13 (10.66) | 4 (11.76) | 9 (10.23) | 1.12 | 0.47-2.67 | 0.7541 |
| Espironolactona | 23 (18.85) | 6 (17.65) | 17 (19.32) | 0.92 | 0.43-1.96 | 1.0000 |
| Calcioantagonistas | 8 (6.56) | 2 (5.88) | 6 (6.82) | 0.89 | 0.26-3.06 | 1.0000 |
| Ácido acetilsalicílico | 36 (29.51) | 6 (17.65) | 30 (34.09) | 0.51 | 0.23-1.29 | 0.0815 |
| Nitratos | 12 (9.84) | 5 (14.71) | 7 (7.95) | 1.58 | 0.76-3.31 | 0.3119 |
| AINE | 1 (0.82) | 0 (0) | 1 (1.14) | - | - | 1.0000 |
| Digitálicos | 21 (17.21) | 4 (11.76) | 17 (19.32) | 0.64 | 0.25-1.63 | 0.4267 |
| Tiempo de enfermedad, μ±σ | 10.39±19.58 | 9.57±16.57 | 10.71±20.70 | - | - | 0.7757 |
| Tipo de IC aguda, n (%) | ||||||
| IC crónica descompensada | 76 (62.30) | 20 (58.82) | 56 (63.64) | 0.86 | 0.49-1.54 | 0.6792 |
| Edema agudo de pulmón | 17 (13.93) | 6 (17.65) | 11 (12.50) | 1.42 | 0.70-2.88 | 0.3779 |
| IC hipertensiva | 6 (4.92) | 2 (5.88) | 4 (4.55) | 1.21 | 0.38-3.89 | 0.6705 |
| Shock cardiogénico | 18 (14.75) | 10 (29.41) | 8 (9.09) | 2.02 | 1.20-3.93 | 0.0378* |
| IC derecha aislada | 4 (3.28) | 1 (2.94) | 3 (3.41) | 0.89 | 0.16-5.00 | 1.0000 |
| IC asociada a SICA | 31 (25.41) | 8 (23.53) | 23 (26.14) | 0.90 | 0.46-1.78 | 0.8210 |
| Exámenes auxiliares | ||||||
| Na, μ±σ | 136.61±6.17 | 135.77±6.04 | 136.93±6.22 | - | - | 0.3671 |
| K, μ±σ | 3.91±0.68 | 4.09±0.78 | 3.84±0.63 | - | - | 0.0712 |
| HCO3, μ±σ | 21.13±8.26 | 19.03±5.09 | 21.95±9.10 | - | - | 0.0893 |
| Hb, μ±σ | 13.14±1.85 | 13.68±1.99 | 12.91±1.76 | - | - | 0.0412 |
| Lactato, μ±σ | 2.03±1.89 | 2.94±3.00 | 1.67±1.03 | - | - | 0.0802 |
| Diuresis(primeras 24h), μ | 1,653 | 1,522 | 1,704 | - | - | 0,3557 |
| Diuresis(24-48h), μ | 1,908 | 1,975 | 1,884 | - | - | 0.6797 |
| Ecografías disponibles | n=94 | n=26 | n=68 | - | - | - |
| FE en %, μ | 42.76±15.79 | 40.47±15.21 | 43.68±16.03 | - | - | 0.3488 |
| Función diastólica | - | - | - | - | - | 0.2588 |
| No disfunción, n | 9 | 0 | 9 | |||
| Tipo I, n | 33 | 10 | 23 | |||
| Tipo II, dxzn | 12 | 5 | 7 | |||
| Tipo III, n | 22 | 5 | 17 | |||
| Llenado monof, n | 18 | 6 | 12 | |||
AINE: antiinflamatorios no esteroideos; ARAII: antagonista de los receptores de la angiotensina ii; BAV: bloqueo auriculoventricular de alto grado; FE: fracción de eyección; Hb: hemoglobina; HCO3: bicarbonato; IC: insuficiencia cardíaca; IC95%: intervalo de confianza del 95%; IECA: inhibidores de la enzima convertidora de la angiotensina; K: potasio; n: frecuencia; Na: sodio; RR: riesgo relativo; SCR: síndrome cardiorrenal; SICA: síndrome isquémico coronario agudo; TPSV: taquicardia paroxística supraventricular; μ: media; σ: desviación estándar; %: porcentaje.
Niveles más altos de hemoglobina también estuvieron asociados a una mayor incidencia de SCR1 (p=0.0412) en este estudio.
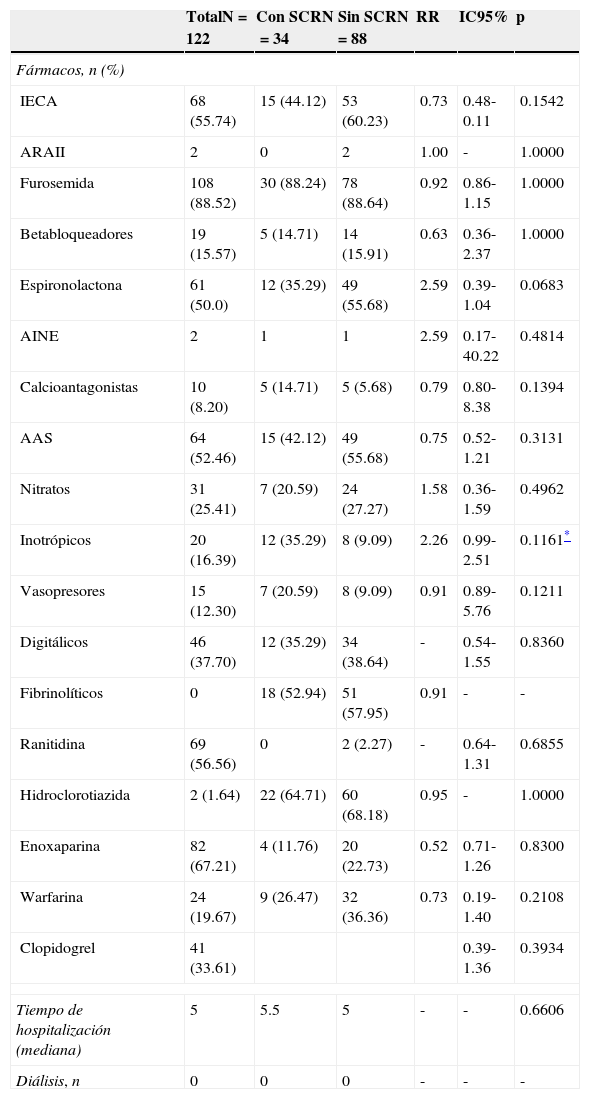
Luego del análisis univariado se encontró que entre los pacientes con SCR1 hubo una mayor utilización de inotrópicos (RR=3.88; IC95%: 1.74-8.66; p=0.0017), pero después de hacer el análisis multivariado, corregido por la presencia de shock cardiogénico, esta diferencia no fue estadísticamente significativa (ajustado: RR=1.58; IC95%: 0.99-2.51; p=0.1161) (tabla 5). Por lo tanto, no hubo diferencia estadísticamente significativa para el uso de ninguno de los fármacos evaluados. No se encontró tampoco asociación entre la presencia de SCR1 y el tiempo de hospitalización (media de 5.5 días en pacientes con SCR1 y de 5 días en pacientes sin SCR1; p=0.6358). Ninguno de los pacientes estudiados fue sometido a diálisis durante su hospitalización.
Análisis de la presencia de SCR1 y su asociación a cambios en la terapéutica en las primeras 48h, tiempo de hospitalización y necesidad de diálisis
| TotalN=122 | Con SCRN=34 | Sin SCRN=88 | RR | IC95% | p | |
|---|---|---|---|---|---|---|
| Fármacos, n (%) | ||||||
| IECA | 68 (55.74) | 15 (44.12) | 53 (60.23) | 0.73 | 0.48-0.11 | 0.1542 |
| ARAII | 2 | 0 | 2 | 1.00 | - | 1.0000 |
| Furosemida | 108 (88.52) | 30 (88.24) | 78 (88.64) | 0.92 | 0.86-1.15 | 1.0000 |
| Betabloqueadores | 19 (15.57) | 5 (14.71) | 14 (15.91) | 0.63 | 0.36-2.37 | 1.0000 |
| Espironolactona | 61 (50.0) | 12 (35.29) | 49 (55.68) | 2.59 | 0.39-1.04 | 0.0683 |
| AINE | 2 | 1 | 1 | 2.59 | 0.17-40.22 | 0.4814 |
| Calcioantagonistas | 10 (8.20) | 5 (14.71) | 5 (5.68) | 0.79 | 0.80-8.38 | 0.1394 |
| AAS | 64 (52.46) | 15 (42.12) | 49 (55.68) | 0.75 | 0.52-1.21 | 0.3131 |
| Nitratos | 31 (25.41) | 7 (20.59) | 24 (27.27) | 1.58 | 0.36-1.59 | 0.4962 |
| Inotrópicos | 20 (16.39) | 12 (35.29) | 8 (9.09) | 2.26 | 0.99-2.51 | 0.1161* |
| Vasopresores | 15 (12.30) | 7 (20.59) | 8 (9.09) | 0.91 | 0.89-5.76 | 0.1211 |
| Digitálicos | 46 (37.70) | 12 (35.29) | 34 (38.64) | - | 0.54-1.55 | 0.8360 |
| Fibrinolíticos | 0 | 18 (52.94) | 51 (57.95) | 0.91 | - | - |
| Ranitidina | 69 (56.56) | 0 | 2 (2.27) | - | 0.64-1.31 | 0.6855 |
| Hidroclorotiazida | 2 (1.64) | 22 (64.71) | 60 (68.18) | 0.95 | - | 1.0000 |
| Enoxaparina | 82 (67.21) | 4 (11.76) | 20 (22.73) | 0.52 | 0.71-1.26 | 0.8300 |
| Warfarina | 24 (19.67) | 9 (26.47) | 32 (36.36) | 0.73 | 0.19-1.40 | 0.2108 |
| Clopidogrel | 41 (33.61) | 0.39-1.36 | 0.3934 | |||
| Tiempo de hospitalización (mediana) | 5 | 5.5 | 5 | - | - | 0.6606 |
| Diálisis, n | 0 | 0 | 0 | - | - | - |
AAS: ácido acetilsalicílico; AINE: antiinflamatorios no esteroideos; ARAII: antagonista de los receptores de la angiotensina ii; IC95%: intervalo de confianza del 95%; IECA: inhibidores de la enzima convertidora de la angiotensina; n: frecuencia; RR: riesgo relativo; SCR: síndrome cardiorrenal; %: porcentaje.
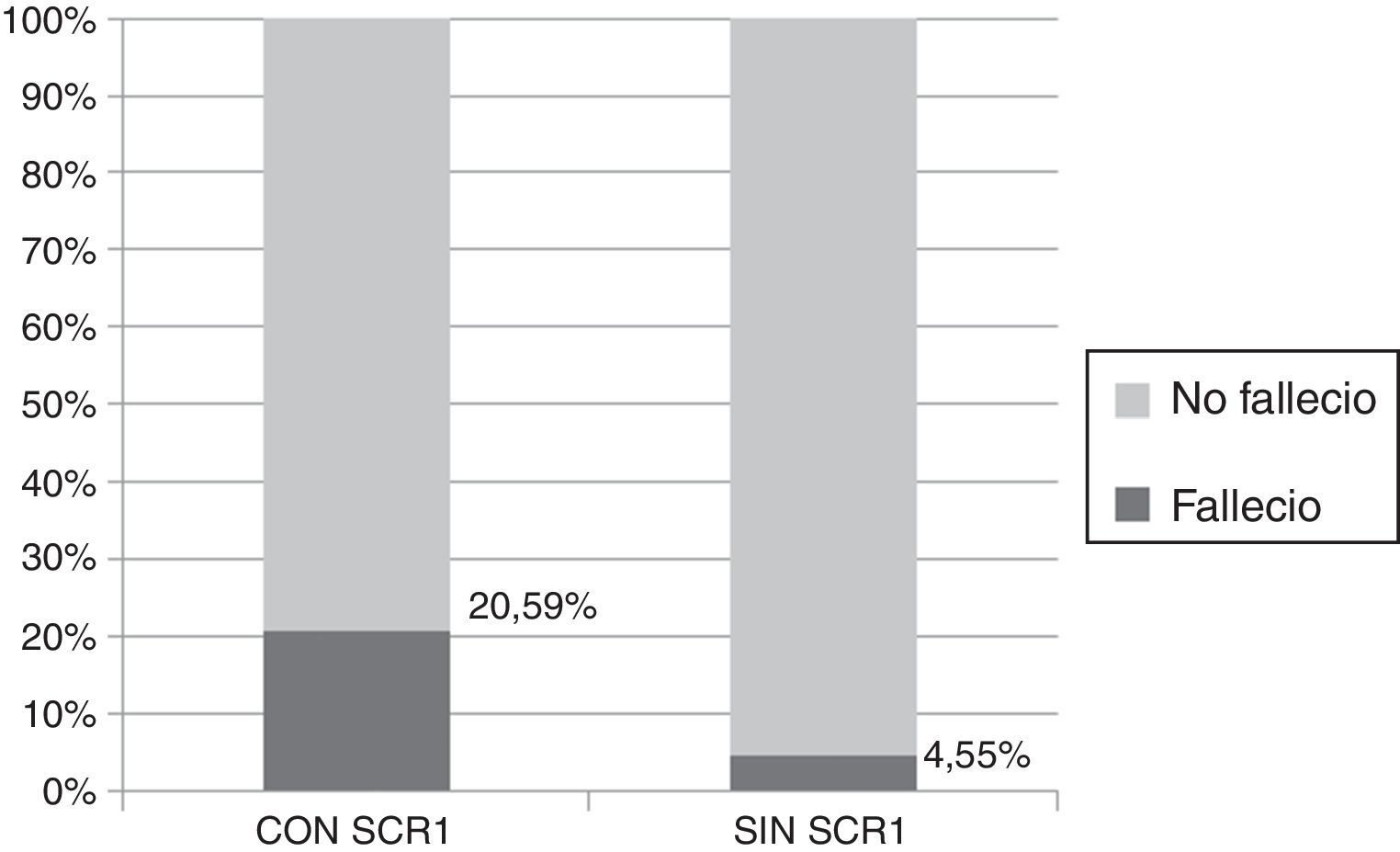
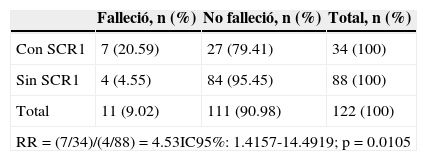
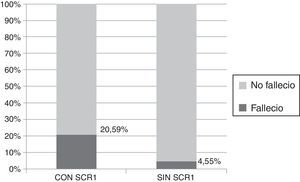
Los pacientes con SCR1 tuvieron una mayor mortalidad intrahospitalaria a 30 días (RR=4.53; IC95%: 1.4157-14.4919; p=0.0105) (tabla 6). De los 34 pacientes que desarrollaron SCR1 fallecieron 7 (20.59%) y de los 88 pacientes sin SCR1 fallecieron solo 4 pacientes (4.55%) (fig. 4). La presencia de shock cardiogénico también estuvo asociada a mayor mortalidad intrahospitalaria a 30 días y debido a que existe una relación causal entre la presencia de shock cardiogénico y el desarrollo de SCR1, pero no en sentido contrario, no se realizó un análisis multivariado corregido por la presencia de shock cardiogénico.
SCR1 y mortalidad intrahospitalaria a 30 días
| Falleció, n (%) | No falleció, n (%) | Total, n (%) | |
|---|---|---|---|
| Con SCR1 | 7 (20.59) | 27 (79.41) | 34 (100) |
| Sin SCR1 | 4 (4.55) | 84 (95.45) | 88 (100) |
| Total | 11 (9.02) | 111 (90.98) | 122 (100) |
| RR=(7/34)/(4/88)=4.53IC95%: 1.4157-14.4919; p=0.0105 | |||
IC95%: intervalo de confianza del 95%; RR: riesgo relativo; SCR1: síndrome cardiorrenal tipo 1.
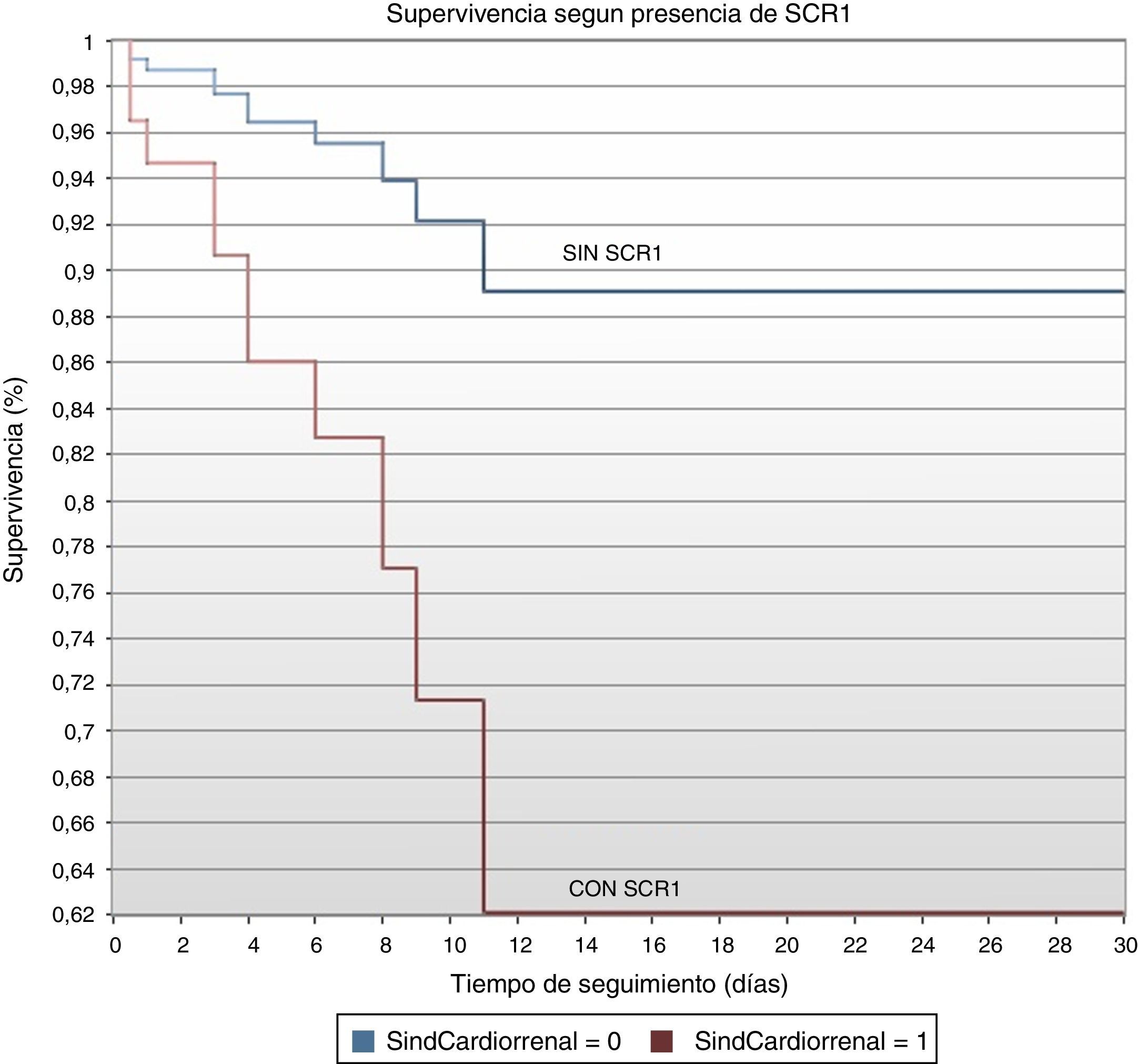
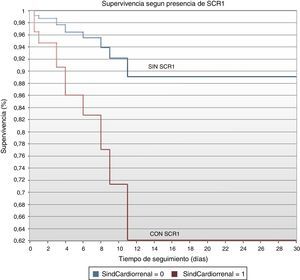
El análisis de regresión de Cox mostró que la mortalidad a 30 días fue mayor entre los pacientes que desarrollaron SCR1 (HR: 4.11; IC95%: 1.20-14.09; p=0.0244) (fig. 5).
DiscusiónEste estudio evidencia que la incidencia de SCR1 en los pacientes hospitalizados por falla cardíaca aguda en una UCICOR de nuestra ciudad (Lima-Perú) es del 27.87%; cifra semejante a las obtenidas en estudios extranjeros9,27. El shock cardiogénico fue el factor de riesgo más fuertemente asociado al desarrollo de SCR1. El antecedente de ACV fue otro factor de riesgo asociado a desarrollo de SCR1 en el análisis univariado pero que pierde su significación estadística al hacer el análisis multivariado ajustado por la presencia de shock cardiogénico. Sin embargo, estudios previos han demostrado que el antecedente de ACV es un factor de riesgo para desarrollar una caída de la función renal en pacientes que se hospitalizan por falla cardíaca aguda28. Por lo tanto no es coincidencia encontrar una mayor incidencia de SCR1 en los pacientes con antecedente de ACV y es posible que su asociación estadística sea más fuerte si tuviéramos una población más numerosa.
Los factores de riesgo que han demostrado mayor incidencia de SCR1 en otros estudios son: insuficiencia cardíaca crónica, diabetes mellitus y presión arterial elevada9,28. Si analizamos en este contexto, la insuficiencia cardíaca crónica y el ACV isquémico, no es difícil de reconocer un factor etiológico común entre ellos: «la aterosclerosis». La diabetes mellitus y la hipertensión arterial son también factores de riesgo asociados al desarrollo de aterosclerosis. Por lo tanto es posible deducir que los pacientes con mayor riesgo de desarrollar SCR1 son aquellos que de alguna forma ya tienen daño endotelial29. Por otro lado, el estado de hipoperfusión generado por la falla cardíaca aguda es uno de los factores que precipitan el desarrollo de SCR1 y este estado de hipoperfusión es mucho más notorio en los pacientes que desarrollan shock cardiogénico, entidad que ya ha demostrado también en otros estudios ser una factor importante asociado a SCR130.
En este estudio se evidenció que la presencia de niveles más altos de hemoglobina estuvo asociada a SCR1. Esta asociación pudo deberse a que nuestros criterios de inclusión y exclusión estuvieron diseñados para excluir a pacientes con ERC y en este intento se excluyeron 5 historias clínicas de pacientes con creatininas altas y hemoglobinas bajas consideradas en su diagnóstico de ingreso como ERC por el médico que redactó la historia clínica. Sin embargo, en estos casos no se tenían confirmaciones de tamaño renal por ecografía o algún otro dato que confirme que el paciente padecía previamente ERC. Es posible entonces que se hayan excluido pacientes con falla renal aguda que al coexistir con anemia y tener creatininas elevadas fueron consideradas por el médico que recibió al paciente como ERC.
La falta de asociación a cambios en la terapéutica en los pacientes con SCR1 es probablemente debida a que solo se registró la utilización o no utilización de algunos fármacos y no se compararon las dosis utilizadas. Otros estudios han demostrado que la presencia de SCR1 genera en los médicos tratantes cambios en las terapéuticas, como mayor uso de diuréticos31 o menor uso de inhibidores de la enzima convertidora de angiotensia32. Es posible también que la ausencia de diferencia en el tratamiento se deba a que la enfermedad renal aguda no fue reconocida como tal, ya que el cálculo de la filtración glomerular no se realizó de rutina en el momento en que los pacientes que ingresaron a la UCICOR. No hubo diferencias entre el tiempo de hospitalización y tampoco se dializó a ninguno de los pacientes evaluados.
En cuanto a la gráfica de supervivencia, puede observarse que las curvas se separan rápidamente desde el primer día y alcanzan su mayor variación a los 11 días donde la supervivencia de los pacientes sin SCR1 es del 89% y la de los pacientes con SCR1 es del 62%. Luego de los 11 días y hasta los 30 días, la supervivencia se mantiene constante en ambos grupos, reafirmando el hecho de que los pacientes con SCR1 tienen una mayor mortalidad sobre todo en los primeros días de hospitalización33,34.
En cuanto a las limitaciones de este estudio, tenemos que hubo pacientes con diagnóstico de IC aguda que no fueron hospitalizados en la UCICOR, sino que pasaron a pabellones de medicina interna, ya sea porque no fueron considerados graves, ya sea por falta de disponibilidad de camas en esta unidad, y se desconoce si en este tipo de pacientes la evolución es más o menos favorable o si tienen una mayor o menor incidencia de SCR1 que en la UCICOR.
Otra limitación fue que, si bien se agregaron muchos criterios de exclusión para evitar que pacientes con ERC previa ingresaran al estudio, es posible que algunos pacientes hayan sido excluidos innecesariamente, como podría ser el caso de los pacientes considerados como ERC previa por el médico que realizó la historia clínica al ingreso del paciente a la UCICOR.
Los pacientes con hemoglobina<10mg/dL fueron excluidos de este estudio para evitar que pacientes con ERC no diagnosticada (que usualmente tienen hemoglobinas bajas) fueran incluidos en el mismo y también para evitar que la presencia de una baja hemoglobina sea otro factor confusor ya que al haber menos hemoglobina hay menor transporte de oxígeno y por lo tanto todos los tejidos incluidos el riñón sufren de una menor oxigenación. Sin embargo, este estudio mostró una asociación entre una mayor hemoglobina y la presencia de SCR1, que si bien no concuerda con la fisiopatología propuesta para el desarrollo de síndrome cardiorrenal en general, nos indica que en la fisiopatología del SCR1 la anemia no es una variable asociada de forma inversa (a menor hemoglobina, mayor frecuencia de síndrome cardiorrenal) como sí lo es en el síndrome cardiorrenal crónico o tipo 235. Esta asociación inversa ha sido ya observada en un estudio donde se demostró que la hemoconcentración durante la primera semana de los pacientes que ingresan con falla cardíaca agudamente descompensada se asoció a una peor función renal36. Otro estudio demostró también que niveles de hemoglobina más altos estuvieron asociados a disminuciones sutiles de la función renal en estadios tempranos de ERC37. Incluso en pacientes con ERC hay estudios que han demostrado que corregir la hemoglobina puede producir exacerbación de la falla cardíaca, mayor tasa de eventos cardiovasculares y muerte38, lo que nos hace dudar de que la relación directa entre los valores de hemoglobina y el síndrome cardiorrenal agudo esté totalmente definida.
Otras limitaciones de este estudio son su carácter observacional retrospectivo y el tamaño de la población.
En cuanto a la calidad del registro, la UCICOR del Hospital Nacional Arzobispo Loayza cuenta desde hace muchos años con un formato de historia clínica que permitió una recolección de datos homogénea para todos los pacientes. Sin embargo, lo ideal sería tener datos más detallados y si es posible guardados en formato digital para el futuro.
ConclusionesLa incidencia de SCR1 en la UCICOR encontrada en nuestro estudio es similar a la descrita en estudios extranjeros. La presencia de shock cardiogénico como causa de falla cardíaca y valores más altos de hemoglobina se asociaron a una mayor incidencia de SCR1. Aunque la asociación estadística entre el antecedente de ACV y la presencia de SCR1 no fue significativa al hacer el análisis multivariado, estudios previos demostraron que sí hubo asociación, por lo que en nuestro medio deberían realizarse estudios prospectivos con una población más numerosa para lograr confirmar esta relación. Los pacientes con SCR1 tuvieron mayor mortalidad intrahospitalaria a 30 días.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónNinguna.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
A la Dra. Elisa Juárez por su apoyo en las traducciones del español al inglés y a la Dra. Paola Óliver por su apoyo en la formulación del proyecto.