La reducción en la perfusión pulmonar se ha descrito tras el cierre percutáneo del conducto arterioso permeable con varios dispositivos. Evaluamos la perfusión pulmonar posterior al cierre percutáneo del conducto arterioso con el dispositivo Amplatzer Duct Occluder utilizando la gammagrafía pulmonar de perfusión.
MétodosTreinta pacientes con oclusión transcatéter exitosa del conducto arterioso permeable utilizando el dispositivo Amplatzer Duct Occluder fueron incluidos en este estudio. La gammagrafía pulmonar de perfusión se realizó 6meses después del procedimiento. Las velocidades de flujo máximo y la protrusión del dispositivo fueron analizadas por ecocardiografía Doppler. Una perfusión pulmonar izquierda<40% se consideró anormal.
ResultadosEl implante del dispositivo fue exitoso en todos. La media de perfusión hacia el pulmón izquierdo fue de 44.7±4.9% (37.8-61.4). Cinco pacientes (16.6%) mostraron disminución en la perfusión pulmonar izquierda. Tanto la edad y el peso bajo, así como la longitud del conducto arterioso y la relación diámetro mínimo y máximo con la longitud del conducto arterioso fueron estadísticamente significativos en los pacientes con anomalías de la perfusión pulmonar. Se observó protrusión del dispositivo en 6 pacientes con una velocidad de flujo máximo mayor en la arteria pulmonar izquierda.
ConclusiónLa perfusión pulmonar izquierda puede comprometerse tras el cierre percutáneo del conducto arterioso con el Amplatzer Duct Occluder. El aumento en la velocidad de flujo en el origen de la arteria pulmonar izquierda puede ser un pobre indicador de la reducción en la perfusión pulmonar y puede ocurrir en ausencia de protrusión del dispositivo.
The closure of patent ductus arteriosus with multiple devices has been associated with a reduction in lung perfusion. We evaluated the pulmonary perfusion after percutaneous closure of patent ductus arteriosus with the Amplatzer Duct Occluder device using perfusion lung scan.
MethodsThirty patients underwent successful percutaneous patent ductus arteriosus occlusions using the Amplatzer Duct Occluder device were included in this study. Lung perfusion scans were preformed 6months after the procedure. Peak flow velocities and protrusion of the device were analyzed by Doppler echocardiography. A left lung perfusion<40% was considered abnormal.
ResultsThe device implantation was successful in all patients. Average perfusion of left lung was 44.7±4.9% (37.8-61.4). Five patients (16.6%) showed decreased perfusion of the left lung. Age, low weight, the length of the ductus arteriosus and the minimum and maximum diameter/length of the ductus arteriosus ratio were statistically significant in patients with abnormalities of lung perfusion. It was observed protrusion the device in 6 patients with a higher maximum flow rate in the left pulmonary artery.
ConclusionThe left lung perfusion may be compromised after percutaneous closure of patent ductus arteriosus with the Amplatzer Duct Occluder. The increased flow velocity in the origin of the left pulmonary artery can be a poor indicator of reduction in pulmonary perfusion and can occur in the absence of protrusion of the device.
El cierre percutáneo del conducto arterioso permeable (CAP) es un procedimiento bien establecido y sus resultados inmediatos son bien conocidos1,2. Para el cierre de diferentes tipos y tamaños angiográficos del CAP se utiliza una amplia variedad de dispositivos3–5. A pesar de que los resultados del procedimiento intervencionista son generalmente satisfactorios, algunas complicaciones han sido informadas6. Distorsiones mecánicas de los vasos adyacentes, particularmente de la arteria pulmonar izquierda (API) ocurren con algunos dispositivos6–8. La protrusión del dispositivo hacía el origen de la API puede condicionar una reducción del flujo sanguíneo hacía el pulmón izquierdo9,10. Dessy et al.11 describen que el 14% de los pacientes sometidos a cierre percutáneo del CAP y evaluados por estudios de gammagrafía pulmonar muestran reducción en el flujo pulmonar izquierdo. El efecto de diferentes dispositivos sobre el flujo pulmonar, utilizando la gammagrafía pulmonar de perfusión ha sido descrito por otros autores12–15. Aunque el Amplatzer Duct Occluder I (ADO I; AGA Medical Corporation, EE. UU.) es el oclusor más utilizado en los CAP de un tamaño moderado a grande, su protrusión hacía la API y su impacto en la obstrucción y distribución del flujo sanguíneo no han sido completamente evaluados3–5,9,15.
Describimos el efecto del dispositivo Amplatzer Duct Occluder (ADO) en la obstrucción del origen de la API y la perfusión pulmonar izquierda, utilizando la gammagrafía pulmonar de perfusión.
MétodosPacientesSe incluyeron 30 pacientes (20 niñas) en quienes se realizó cierre percutáneo del CAP utilizando el dispositivo ADO. Los pacientes seleccionados cumplían criterios clínicos y ecocardiográficos de un CAP de tamaño moderado y un peso mayor de 4kg8,9. La edad al momento del cierre del CAP fue de 23.8±13.7meses (intervalo: 7-67meses) y el peso de 11.1±4.5kg (intervalo: 4.1-25.5kg). Quince pacientes (50%) evidenciaron un peso≤10kg. Ocho pacientes (26.6%) tenían otras malformaciones cardiacas asociadas: comunicación interventricular perimembranosa pequeña en 2; foramen oval permeable en 3; coartación aórtica leve, estenosis de rama pulmonar izquierda y otra, uno en cada uno. Los datos demográficos y los resultados del cateterismo se muestran en la tabla 1. Previo al procedimiento intervencionista, se realizó un ecocardiograma Doppler-color para evaluar el gradiente de presión entre el tronco pulmonar y las arterias pulmonares, en la proyección del eje corto16.
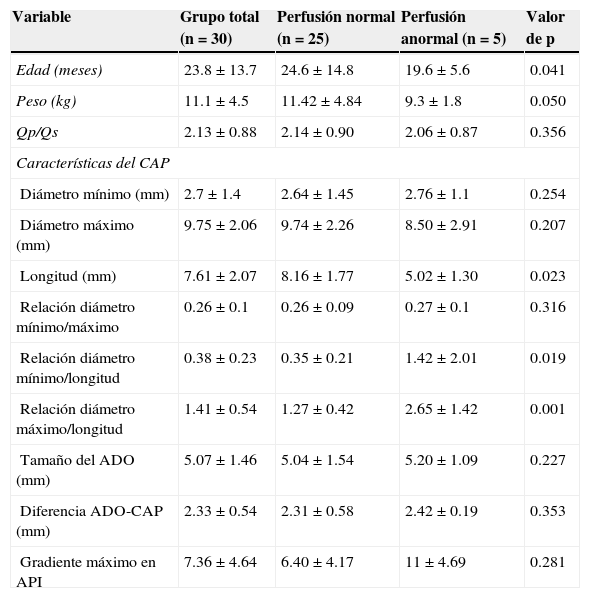
Datos demográficos y resultados del cateterismo en la población total, y comparación entre aquellos con perfusión normal y anormal
| Variable | Grupo total (n=30) | Perfusión normal (n=25) | Perfusión anormal (n=5) | Valor de p |
|---|---|---|---|---|
| Edad (meses) | 23.8±13.7 | 24.6±14.8 | 19.6±5.6 | 0.041 |
| Peso (kg) | 11.1±4.5 | 11.42±4.84 | 9.3±1.8 | 0.050 |
| Qp/Qs | 2.13±0.88 | 2.14±0.90 | 2.06±0.87 | 0.356 |
| Características del CAP | ||||
| Diámetro mínimo (mm) | 2.7±1.4 | 2.64±1.45 | 2.76±1.1 | 0.254 |
| Diámetro máximo (mm) | 9.75±2.06 | 9.74±2.26 | 8.50±2.91 | 0.207 |
| Longitud (mm) | 7.61±2.07 | 8.16±1.77 | 5.02±1.30 | 0.023 |
| Relación diámetro mínimo/máximo | 0.26±0.1 | 0.26±0.09 | 0.27±0.1 | 0.316 |
| Relación diámetro mínimo/longitud | 0.38±0.23 | 0.35±0.21 | 1.42±2.01 | 0.019 |
| Relación diámetro máximo/longitud | 1.41±0.54 | 1.27±0.42 | 2.65±1.42 | 0.001 |
| Tamaño del ADO (mm) | 5.07±1.46 | 5.04±1.54 | 5.20±1.09 | 0.227 |
| Diferencia ADO-CAP (mm) | 2.33±0.54 | 2.31±0.58 | 2.42±0.19 | 0.353 |
| Gradiente máximo en API | 7.36±4.64 | 6.40±4.17 | 11±4.69 | 0.281 |
ADO: Amplatzer Duct Occluder; API: arteria pulmonar izquierda; CAP: conducto arterioso permeable; Diferencia ADO-CAP: diferencia tamaño del ADO y diámetro mínimo del CAP; Qp/Qs: relación gasto pulmonar/sistémico.
La técnica del cierre percutáneo del CAP ha sido descrita previamente por los autores8–10. El dispositivo se seleccionó en función del tamaño y morfología del CAP, de acuerdo con Krichenko et al.17 y de un diámetro de 2mm mayor al diámetro mínimo del CAP.
SeguimientoLa evaluación ecocardiográfica transtóracica se realizó en todo paciente previo a su alta (24h), 3 y 6meses posteriores al procedimiento, enfatizando en la presencia de fuga residual, protrusión del dispositivo, y mediante evaluación Doppler se determinó la velocidad máxima (Vmáx) entre el tronco pulmonar y la API. Se consideró una Vmáx>1.6m/s (gradiente>10mmHg) como indicativa de posible estenosis en el origen de la API.
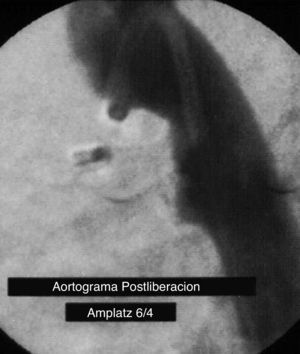
Estudio de la perfusión pulmonarLa gammagrafía pulmonar de perfusión se realizó 6 meses después del procedimiento utilizando una inyección intravenosa de macroagregados de albúmina marcada con 99mTc a una dosis de 74MBq/2mCi a través de una vena periférica en posición supina. El procedimiento se realizó en una cámara gamma (E-cam Siemens), con adquisición de imagen estática en proyección anterior y posterior durante 10min, para evaluar la distribución del flujo sanguíneo entre los pulmones. El porcentaje de perfusión en ambos pulmones se calculó al dividir la radiactividad media obtenida en ambas posiciones. Se consideró un flujo<40% hacía el pulmón izquierdo como anormal11–15. El protocolo de estudio fue aprobado por el comité de investigación local (R-2014-3603-7).
Análisis estadísticoSe realizó análisis estadístico descriptivo, con cálculos de medidas de tendencia central (media, mediana) y dispersión (desviación estándar, mínimo y máximo) para las variables cuantitativas de acuerdo con el tipo de distribución. Para las variables cualitativas, frecuencias y porcentajes. Los resultados se expresan como media±desviación estándar o mediana e intervalos. En el análisis de los datos se emplearon la prueba exacta de Fisher y la prueba de χ2 de Pearson. Para contrastar las variables cuantitativas, se utilizó la prueba de U de Mann-Whitney. Todos los análisis se hicieron con el paquete estadístico SPSS versión 20, considerando un valor de p<0.05 con significación estadística.
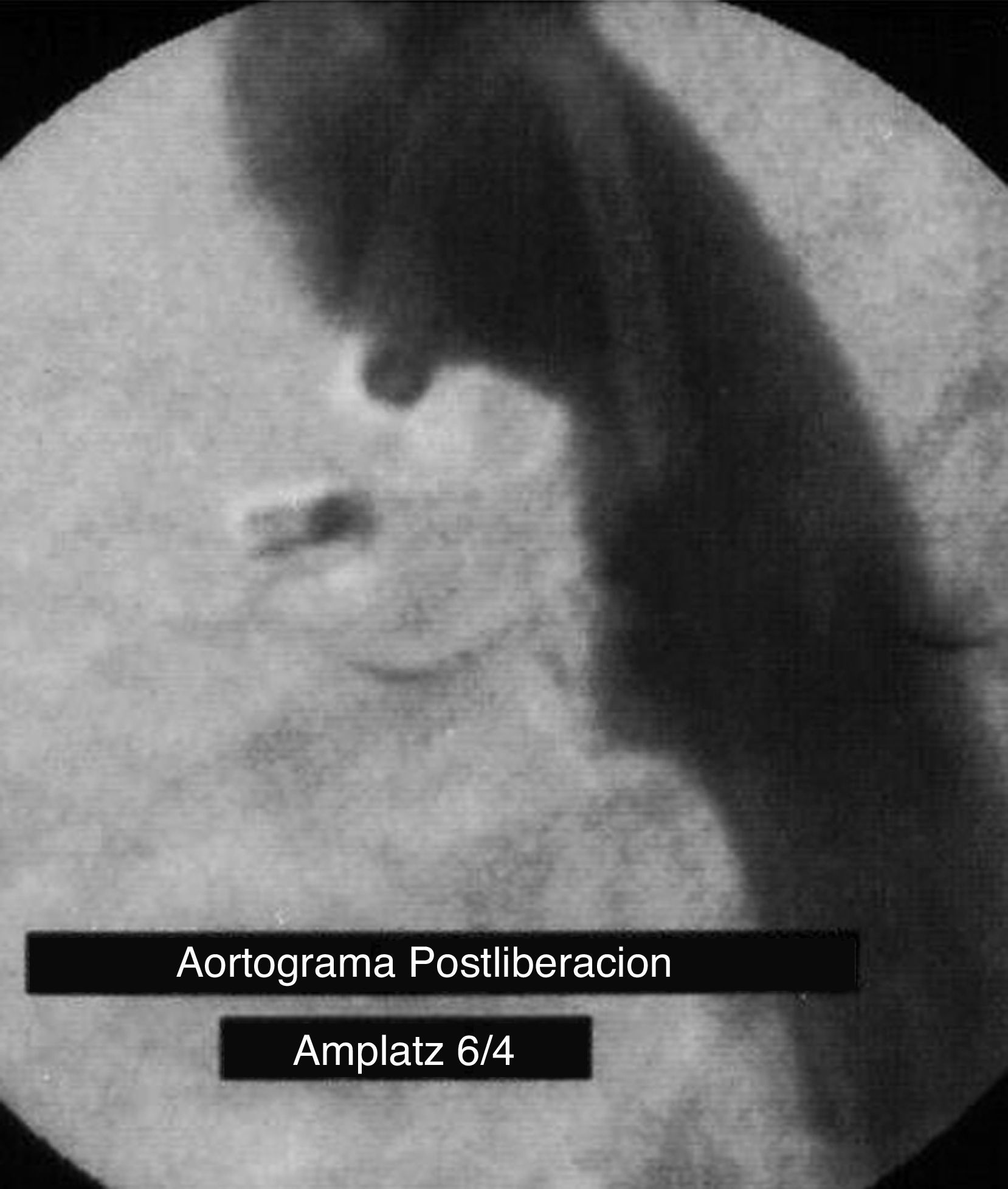
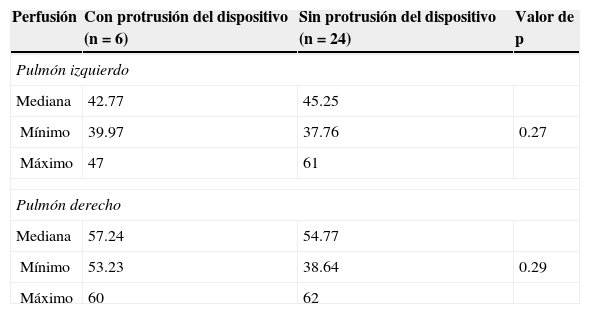
ResultadosEl implante del dispositivo fue exitoso en todos los pacientes (fig. 1) y la prevalencia de fuga residual posterior al implante del dispositivo fue del 30% y del 6.7% a las 24h. Ninguno de los pacientes mostró fuga residual 3meses después del procedimiento. Por ecocardiografía Doppler, un paciente mostró una Vmáx>2m/s (23mmHg) en la API antes del implante del dispositivo. Hemodinámicamente, observamos hipertensión arterial pulmonar (PMP≥25mmHg) en 12 pacientes (mediana 30mmHg), siendo>35mmHg en 3 de ellos. La relación gasto pulmonar/gasto sistémico mostró una mediana de 2.04/1Lt/min (intervalo: 1.2-4.7). Doce pacientes (40.1%) evidenciaron un diámetro mínimo angiográfico del CAP≤2mm y 3 pacientes (10%) mostraron una longitud del CAP<5.8mm. El tipo de CAP encontrado fue: cónico (tipo A) en 21 casos (70%), tubular (tipo C) en 5 casos (16.7%) y tipo E (cónico elongado) en 4 casos (13.3%).
En la sala de hemodinamia, un paciente mostró un gradiente de retiro de presión entre la API y el tronco pulmonar de 12mmHg previo al procedimiento y que persistió tras el implante del dispositivo. El tamaño del dispositivo fue 5/4 en 12 casos (40%), 6/4 en 5 casos (16.7%), 8/6 en 11 casos (36.7%), 10/8 en un paciente (3.3%) y 12/10 en otro (3.3%). El tamaño del dispositivo más utilizado fue el 5/4 y el 8/6 (5.07±1.46mm) para una relación ADO/CAP para el grupo total de 2.1±0.7. En 21 pacientes (70%) se utilizó un dispositivo con un diámetro>2mm al diámetro mínimo del CAP con una media de 2.3±0.5 en milímetros en la relación ADO/CAP.
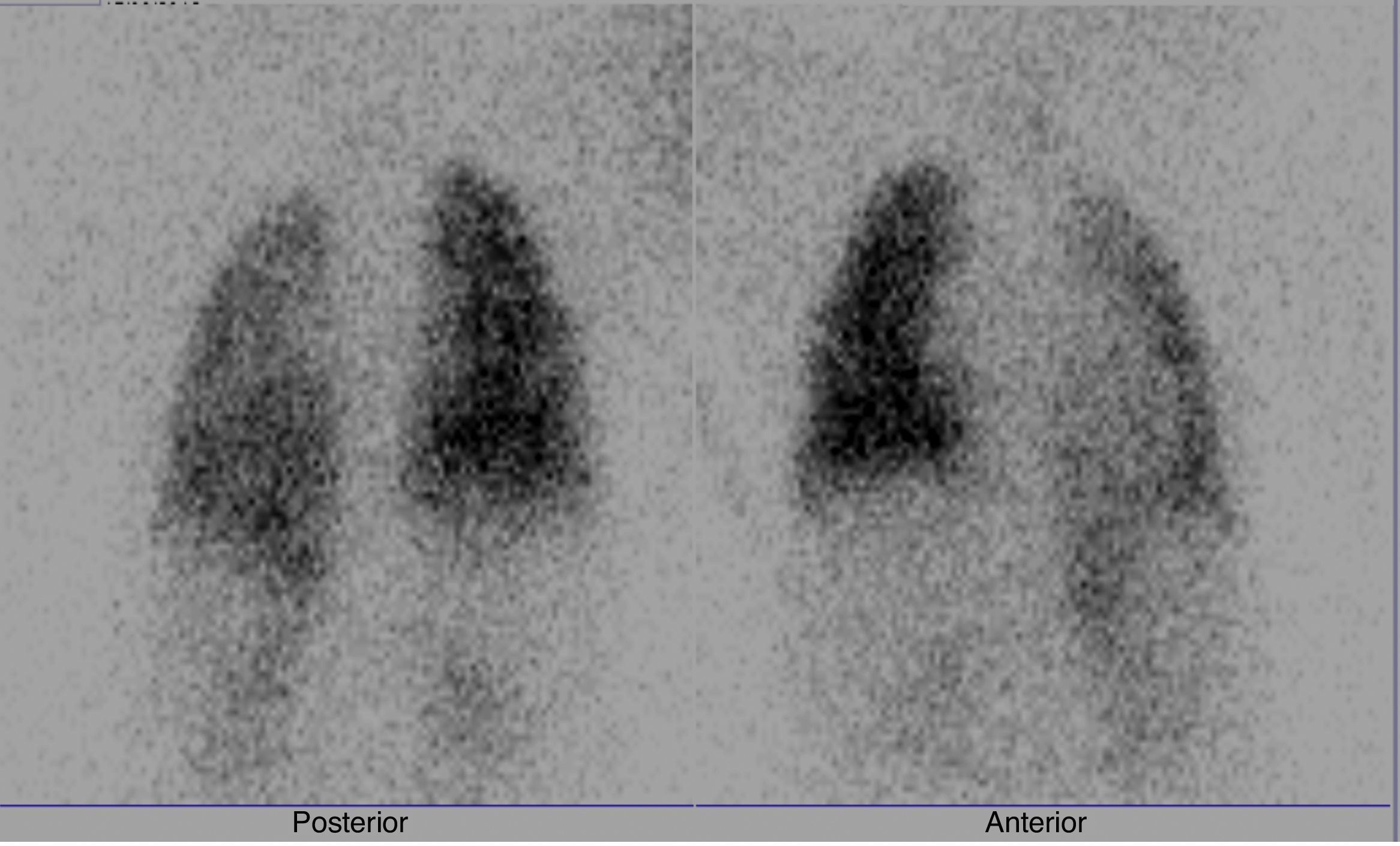
Al analizar los resultados de la gammagrafía pulmonar, encontramos una mediana de porcentaje de perfusión para el pulmón derecho del 55.3% (intervalo: 40.6-62.24) y para el pulmón izquierdo del 44.7% (intervalo: 37.7-61.36). En 5 pacientes (16.6%) se evidenció disminución en la perfusión del pulmón izquierdo, definida como<40% del flujo pulmonar total (fig. 2). Se compararon las variables entre los pacientes con perfusión pulmonar normal y disminuida (tabla 1).
Los valores medios de edad y peso fueron significativamente menores en los pacientes con disminución en la perfusión pulmonar izquierda (p=0.04, 0.05, respectivamente). Aunque los diámetros mínimo y máximo del CAP fueron similares en los pacientes con y sin alteración en la perfusión pulmonar (p=0.25, 0.20, respectivamente), la longitud del CAP fue significativamente menor en los pacientes con disminución en la perfusión pulmonar izquierda (p=0.04). La relación diámetro mínimo y máximo del CAP con su longitud, también fueron significativamente menores en aquellos pacientes con flujo pulmonar disminuido (p=0.019 y 0.001, respectivamente).
La ecocardiografía Doppler postimplante del ADO evidenció 5 pacientes (16.6%) con incremento en la Vmáx en la API (excluyendo al paciente con estenosis preimplante) con valores entre 1.7-2.2m/s (gradiente 11-19mmHg) y con una disminución leve del flujo pulmonar (37-39%) en 3 de ellos (p=0.09). Seis pacientes (20%) evidenciaron protrusión del dispositivo hacia la API, con un gradiente>10mmHg en 5 de ellos. Al comparar el resultado de la perfusión pulmonar entre los pacientes con y sin protrusión del dispositivo, no hubo diferencia estadísticamente significativa (tabla 2).
Relación entre la perfusión pulmonar y la presencia o ausencia de protrusión del dispositivo
| Perfusión | Con protrusión del dispositivo (n=6) | Sin protrusión del dispositivo (n=24) | Valor de p |
|---|---|---|---|
| Pulmón izquierdo | |||
| Mediana | 42.77 | 45.25 | |
| Mínimo | 39.97 | 37.76 | 0.27 |
| Máximo | 47 | 61 | |
| Pulmón derecho | |||
| Mediana | 57.24 | 54.77 | |
| Mínimo | 53.23 | 38.64 | 0.29 |
| Máximo | 60 | 62 | |
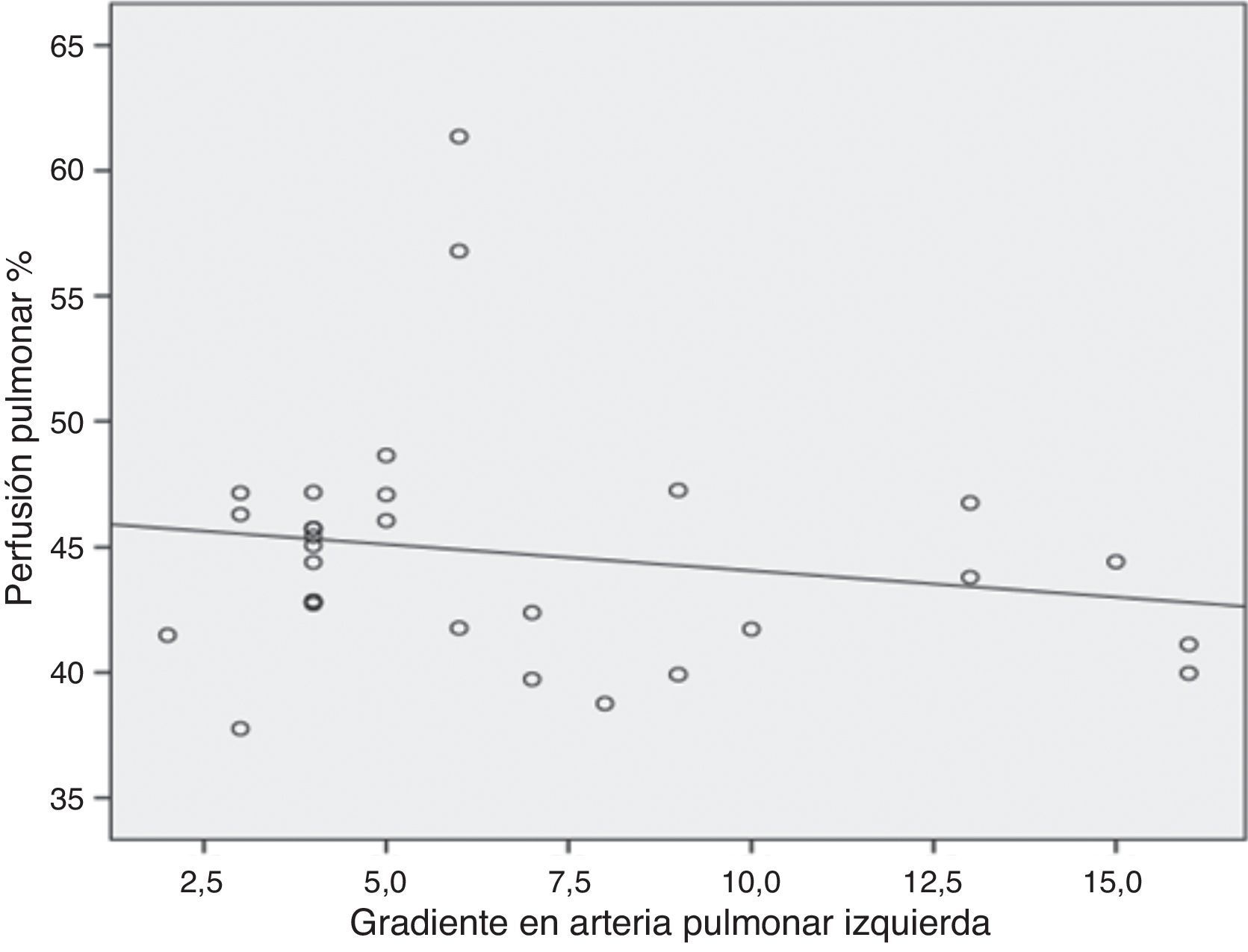
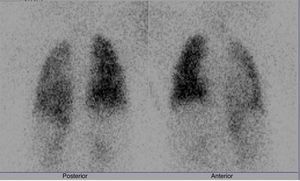
Se realizó correlación de Spearman entre el gradiente de la API y la perfusión pulmonar izquierda (fig. 3), observando que la menor perfusión pulmonar se relacionó con un mayor gradiente en la API (rho −0.530), sin embargo, no resultó estadísticamente significativa (p=0.28). El tamaño del ADO y un incremento>2mm al diámetro mínimo del CAP no fueron estadísticamente significativos (p=0.22 y 0.35, respectivamente) en aquellos pacientes con disminución en la perfusión pulmonar izquierda. En 3 de los 5 pacientes con conducto arterioso tipo tubular, se observó reducción del flujo pulmonar izquierdo.
DiscusiónDesde la primera descripción del cierre percutáneo del conducto arterioso, 3 décadas de experiencia y seguimiento han establecido la seguridad y eficacia de este procedimiento como una alternativa al cierre quirúrgico18–20. Habitualmente, los CAP pequeños (<2mm) son ocluidos con coils de Gianturco o coils de liberación controlada1–3. El ADO es empleado con éxito en el cierre de virtualmente todos los tipos morfológicos del CAP y ofrece muchas ventajas en comparación con otros oclusores4–6,10. Sin embargo, en niños pequeños se han reportado la embolización del oclusor, la obstrucción de la luz aórtica o de la rama pulmonar izquierda y otras complicaciones3,7–10. Los efectos adversos asociados con el ADO son ligeramente mayores en niños con peso<10kg4,6,10. Varios estudios muestran que los gradientes en la API no difieren tras la oclusión del CAP con el ADO, al compararlos con los gradientes preoclusión1,3–5,16.
Algunos estudios analizaron la correlación entre la imágenes ecocardiográficas de protrusión del dispositivo hacia estructuras vasculares adyacentes y el gradiente medido por Doppler y la distribución del flujo sanguíneo pulmonar posterior al cierre percutáneo del CAP11–13, concluyendo que no hay correlación entre las imágenes ecocardiográficas bidimensionales de protrusión del dispositivo y el gradiente de presión por velocidad de flujo Doppler través de la API16. Soares et al. mencionan que el índice de velocidad Doppler es altamente predictivo de asimetría en la perfusión pulmonar13.
Estudios sistemáticos que incluyen la gammagrafía pulmonar de perfusión en la evaluación rutinaria de pacientes sometidos a cierre percutáneo del CAP con diferentes dispositivos encuentran un riesgo potencial de alteraciones en la perfusión pulmonar izquierda11–14,21,22. Estudios en pacientes sin anomalías cardiacas muestran una distribución normal del flujo sanguíneo pulmonar del 52.5% y del 47.5% (±2.1%) para el pulmón derecho e izquierdo23, considerando un valor de corte>45% para una perfusión pulmonar izquierda normal. No existen suficientes datos de una distribución normal del flujo sanguíneo pulmonar en las diferentes edades pediátricas24. En este estudio consideramos una disminución del 10% en la perfusión pulmonar izquierda como anormal (perfusión pulmonar izquierda<40% del flujo sanguíneo total). La alta incidencia de alteraciones en la perfusión pulmonar posterior al cierre del CAP referida por diversos autores podría deberse a la falta de una definición adecuada de perfusión pulmonar anormal o por tratarse de serie de casos no consecutivos21,22,25.
En este estudio detectamos una disminución en la perfusión pulmonar izquierda mediante la gammagrafía pulmonar de perfusión en 5/30 (16.6%) pacientes, utilizando un valor de corte<40% según lo sugerido por otros estudios14,15,22. La media de edad, el peso y la longitud del CAP fueron estadísticamente significativos en los pacientes con perfusión pulmonar disminuida21,25, y el porcentaje de pacientes con disminución en la perfusión pulmonar izquierda no se correlacionó con la Vmáx en la API, medida por ecocardiografía Doppler.
Las alteraciones en la perfusión pulmonar utilizando el ADO varían en una proporción del 17-33%14,21,22. Polat et al. consideran que una longitud del conducto<5.8mm y una relación diámetro ampolla ductal/longitud ampolla ductal≥1.9 son los mejores valores de corte obtenidos por curvas ROC, para discriminar una perfusión pulmonar disminuida21. Aunque la edad y el peso de los pacientes y la longitud del CAP pueden ser factores de riesgo para una inadecuada perfusión pulmonar izquierda, se considera que el determinante primario podría ser la anatomía ductal14,15,22. Se identifican factores de riesgo asociados con gammagrafías anormales, y se confirma la mejoría espontánea de la perfusión pulmonar izquierda en una proporción significativa de pacientes durante su seguimiento (65.7%)25,26.
ConclusionesEste estudio demuestra que el cierre del CAP con el ADO está asociado con un riesgo potencial de alteraciones en la perfusión pulmonar izquierda en 5/30 (16.6%) de los pacientes, utilizando la gammagrafía pulmonar de perfusión. Esto ocurre más a menudo en niños pequeños y con bajo peso, y está muy relacionado con la anatomía ductal. Conductos cortos y tubulares son más propensos a desarrollar esta complicación. No existe una estrecha correlación entre la gammagrafía pulmonar y la ecocardiografía Doppler para establecer alteraciones en la perfusión pulmonar.
LimitacionesEs importante mencionar las limitaciones de este estudio, incluyendo su naturaleza retrospectiva y un tamaño de muestra pequeño. Es también importante darse cuenta de que esto no prueba una relación causa-efecto entre una perfusión izquierda anormal y el cierre del CAP con el dispositivo, considerando la ausencia de estudios de perfusión preintervención y la falta de correlación con otros modos de valoración. El significado clínico de nuestros datos requiere de una validación con nuevos estudios prospectivos y un seguimiento a largo plazo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este estudio.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.