Introducción
El presente consenso presenta algunos lineamientos para la atención del receptor de un trasplante cardiaco, desde su etapa previa hasta los primeros días posteriores a la intervención, mientras el individuo se encuentra en el área de terapia intensiva. Para la redacción de estas recomendaciones clínicas acerca del tratamiento intensivo del paciente sometido a trasplante de corazón en México se consultó en meses recientes la publicación de las guías para el manejo de los receptores de trasplante cardiaco de la Sociedad Internacional de Trasplante de Corazón y Pulmón.
Debido al escaso número de trasplantes de corazón practicados a nivel mundial, existe una escasa productividad de estudios multicéntricos y el número de pacientes que sustente un nivel de evidencia A para cualquier recomendación es insuficiente; por ello, el lector advertirá que la mayoría de las indicaciones tiene un nivel de evidencia C basado en la experiencia de expertos en la materia.
Antes del trasplante
Equipo de trasplantes
La Ley General de Salud Mexicana (artículo 335), al igual que las legislaciones de otros países, exige con claridad que el personal encargado de realizar trasplantes cardiacos debe contar con la especialidad y entrenamiento específico en la materia. Todo hospital que disponga de programas de procuración y trasplante de órganos y tejidos debe contar con un Comité de Trasplantes, cuya función es vigilar de forma estrecha las decisiones tomadas para evaluar, tratar y aceptar la inclusión en el Registro de Pacientes en Espera de un Órgano (antes lista de espera), para la realización de un trasplante cardiaco, tratamiento médico, etcétera.
El equipo que valora al receptor y efectúa el trasplante tiene una naturaleza multidisciplinaria y sólo el personal adiestrado en trasplantes está autorizado para tomar decisiones que directamente modifiquen la atención del paciente.
Nivel de evidencia B
Selección del donador
Este texto va dirigido a médicos relacionados con la terapia intensiva; es importante disponer de la información vinculada con el entorno de la donación de órganos, ante la posibilidad de entrar en contacto con éstos, y que la sala de terapia sea el origen del proceso de donación multiorgánica. Diversos factores relacionados con el donador pueden determinar el resultado final del trasplante; por lo tanto, es imprescindible considerar las condiciones en las que se encuentra el receptor al momento de establecerse la oferta de un órgano, ya que aún el corazón de un donador no ideal debe aceptarse si se considera muy elevado el riesgo de muerte por la gravedad del receptor.
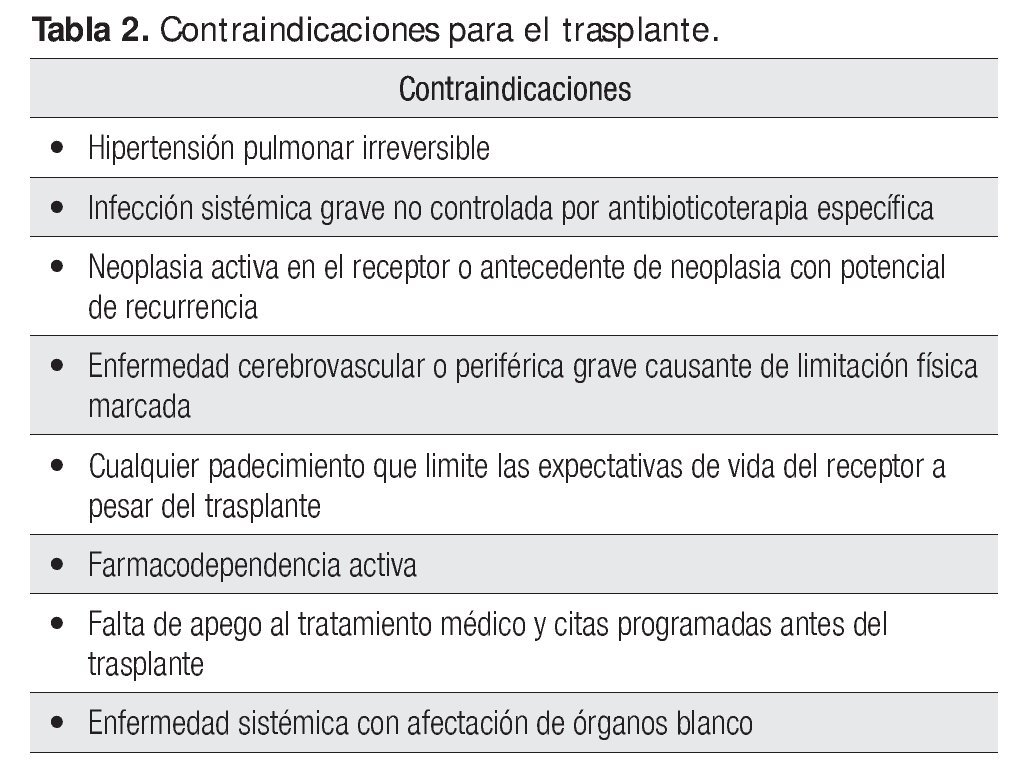
Cuando las circunstancias lo permiten, la selección de un buen órgano suministra sin duda mejores posibilidades de éxito. En la Tabla 1 se señalan las indicaciones universales aceptadas para el trasplante cardiaco; por su parte, en la Tabla 2 se mencionan sus contraindicaciones.
Recomendaciones para la función cardiaca en el donador
Clase I
1. El injerto cardiaco considerado como ideal es aquel que registra una función ventricular completamente normal en el ecocardiograma y en el cual, en el peor de los casos, el apoyo inotrópico es leve a moderado (niveles de apoyo con dopamina o dobutamina < 20 μg/kg/min o equivalentes en otras sustancias adrenérgicas) y sin arritmias ventriculares graves.
Nivel de evidencia C
2. Si las condiciones del receptor hacen posible elegir un órgano en buenas condiciones, es preciso descartar un injerto cardiaco en el que se demuestren arritmias ventriculares graves, paro cardiorrespiratorio 24 h antes de la procuración y apoyo inotrópico elevado (dopamina o dobutamina > 20 μg/kg/min o su equivalente en otros fármacos adrenérgicos), a pesar de la optimización de la precarga y la poscarga. La presencia de anormalidades regionales de la contractilidad ventricular o una fracción de expulsión del ventrículo izquierdo < 40%, no obstante la optimización de la terapia inotrópica, es razón suficiente para no aceptar el órgano.
Nivel de evidencia B
3. Si la diferencia de peso entre el donador femenino y el receptor masculino es < 20%, se puede considerar segura su utilización. Diferencias mayores deben tomarse en cuenta antes de decidir la aceptación del injerto. En el caso de un donador de sexo masculino, se considera segura la donación si su peso es > 70 kg, cualquiera que sea el peso del receptor.
Nivel de evidencia C
4. El tiempo de isquemia ideal para contar con mayores posibilidades de éxito tras el trasplante es < 4 h.
En situaciones en las que el tiempo de isquemia es > 4 h, el injerto puede aceptarse si otros factores propios de un donador ideal están presentes, como edad temprana, función cardiaca normal y ausencia de apoyo inotrópico.
Nivel de evidencia C
Clase IIa
1. Para seleccionar a un donador de corazón, la edad ideal es menor de 35 años; sin embargo, se ha considerado que incluso los injertos de donadores menores de 45 años son capaces de superar las adversidades propias del acto quirúrgico, o las impuestas por fenómenos propios del receptor. En consecuencia, al disponer de un injerto proveniente de un donador de 45 a 55 años en quienes se ha excluido enfermedad arterial coronaria, se debe asignar a un receptor en el cual no existan factores comórbidos o posibles problemas quirúrgicos para el trasplante (operaciones cardiacas previas, riesgo esperado de sangrado profuso en la intervención quirúrgica, receptor en malas condiciones generales). Si se dispone de un donador mayor de 55 años, se aconseja rechazarlo, a menos de que el riesgo de muerte calculado a corto plazo para el receptor sea muy elevado y se considere que el beneficio de trasplantar mediante un injerto con reservas miocárdicas limitadas supere el porcentaje reducido de éxito conocido. En otros países con mayor demanda de trasplantes cardiacos que México, los injertos de donadores de mayores 55 años se emplean en receptores de edad avanzada.
Nivel de evidencia B
2. La presencia de infección en el donador se considera un factor no óptimo, si bien podría aceptarse el injerto si los hemocultivos son negativos, si se establece un tratamiento antimicrobiano específico y la función cardiaca es normal antes de la donación. Tras el trasplante, el receptor debe recibir los mismos antibióticos que se utilizaban en el donador antes de la procuración, y es necesario mantener una vigilancia con hemocultivos de manera estrecha. Una excepción para aceptar el corazón de un donador infectado es la presencia de una endocarditis bacteriana en el injerto.
Nivel de evidencia C
3. El antecedente de consumo de cocaína en el potencial donador no excluye la donación en todos los casos, siempre y cuando no se haya utilizado la vía intravenosa, la función ventricular sea normal y no exista hipertrofia ventricular izquierda.
Nivel de evidencia C
4. El alcoholismo tampoco debe asumirse como una contraindicación para la procuración del corazón.
Nivel de evidencia C
5. La presencia de enfermedad coronaria focal en el injerto cardiaco debe ser una razón suficiente para desechar el injerto; sólo en caso de que la práctica del trasplante sea una urgencia real está justificada la procuración, a condición de que antes del trasplante se coloque un puente aortocoronario en el vaso enfermo.
Nivel de evidencia C
6. El objetivo siempre debe ser la obtención de un injerto con anatomía y función ventricular normales. En caso de detectarse hipertrofia ventricular izquierda, puede aceptarse para procuración y trasplante si el grosor de la pared ventricular izquierda es < 14 mm.
Nivel de evidencia C
Durante el trasplante Clase I
1. Al momento del trasplante, el paciente debe contar con determinaciones del tiempo de protrombina, tiempo de tromboplastina parcial activado y cuenta de plaquetas. El tiempo de coagulación activado debe obtenerse en varias ocasiones durante el acto quirúrgico para vigilar la actividad de la heparina.
Nivel de evidencia C
2. La relación normalizada internacional (INR) debe descender, en la medida de lo posible, por debajo de 1.5 antes del trasplante.
Nivel de evidencia C
3. Para corregir las alteraciones del INR en el paciente sometido a tratamiento anticoagulante crónico y programado para trasplante, debe recibir dosis bajas de vitamina K (2.5 a 5 mg IV para evitar la anafilaxia con dosis mayores); pueden agregarse plasma fresco congelado (10 cm3/kg) o factor VII recombinante si es necesario.
Nivel de evidencia C
4. Si los niveles de productos relacionados con la coagulación son bajos y existe sangrado operatorio, se pueden transfundir (además de sangre en paquete globular) plaquetas, plasma fresco congelado o fibrinógeno, según sean las deficiencias.
Nivel de evidencia C
Clase IIa
1. La tromboelastografía es útil antes, durante y después de la intervención para vigilar el estado hemostásico del paciente.
Nivel de evidencia C
Clase IIb
1. El factor recombinante VIIa puede suministrarse en caso de hemorragia excesiva intratable en la cirugía de trasplantes.
Nivel de evidencia C
Clase III
1. A pesar de la eficacia de la aprotinina para reducir el sangrado durante el trasplante, su uso sistemático no está recomendado por el riesgo de precipitar episodios clínicos adversos.
Nivel de evidencia B
2. No está indicada la administración sistemática de la desmopresina por su efecto leve en la reducción del sangrado posoperatorio y su incidencia elevada de episodios clínicos adversos.
Nivel de evidencia A
Después del trasplante
Recomendaciones para la atención posoperatoria temprana
Clase I
1. En condiciones ideales, la vigilancia perioperatoria del paciente receptor del trasplante cardiaco debe incluir trazo electrocardiográfico continuo, ecocardiografía transesofágica, acceso arterial, catéter venoso central, catéter de Swan-Ganz para medición de la presión en cuña de la arteria pulmonar y gasto cardiaco, oximetría de pulso, medición del gasto urinario y electrocardiograma de 12 derivaciones en el posoperatorio.
Nivel de evidencia C
2. La insuficiencia tricuspídea posoperatoria debe vigilarse y evaluarse en los primeros días después del trasplante mediante ecocardiografía; si no se corrige o es grave, puede considerarse una anuloplastia de la válvula tricúspide en el injerto.
Nivel de evidencia C
3. El derrame pericárdico ocurre con frecuencia después del trasplante, especialmente en pacientes con grandes cardiomegalias anteriores al procedimiento, en las que un injerto cardiaco de tamaño normal ocupa sólo una porción de la cavidad pericárdica. En caso de demostrarse compromiso hemodinámico por taponamiento cardiaco o sospecharse un proceso infeccioso subyacente en el pericardio, es indispensable su drenaje percutáneo o quirúrgico, con solicitud de cultivos y estudios fisicoquímicos y citoquímicos del líquido pericárdico.
Nivel de evidencia C
4. Puede requerirse apoyo inotrópico a las menores dosis posibles en las primeras horas posteriores al trasplante cardiaco.
Nivel de evidencia C
5. Si es necesario mantener una presión arterial media adecuada, se sugieren infusiones continuas de adrenérgicos α, como fenilefrina, norepinefrina o epinefrina.
Nivel de evidencia C
6. Si se intenta corregir un estado de choque vasodilatador debe estar disponible la vasopresina (0.03 a 0.1 U/min).
Nivel de evidencia B
7. En el caso de disfunción del ventrículo derecho con presión arterial preservada, las alternativas son: nitroglicerina o nitroprusiato de sodio como vasodilatadores sistémicos y pulmonares, dobutamina o isoproterenol como inotrópicos y milrinona o levosimendán como inotrópicos con efecto vasodilatador pulmonar.
Nivel de evidencia C
8. Ante la disfunción del ventrículo derecho es factible la utilización de vasodilatadores pulmonares selectivos, como óxido nítrico inhalado, alprostadilo, prostaciclina o sildenafilo.
Nivel de evidencia C
9. Si no es posible retirar al paciente de la bomba de circulación extracorpórea, a pesar de la optimización de la precarga y poscarga, el apoyo inotrópico y los vasopresores, la siguiente alternativa es el uso del balón de contrapulsación intraaórtico; si éste falla, no debe demorarse la decisión de utilizar un dispositivo de apoyo ventricular, capaz de proporcionar uno a cinco días de asistencia mientras se resuelve la insuficiencia ventricular o se coloca al paciente en lista para un retrasplante. En algunos centros del país se puede tener acceso a dispositivos de asistencia ventricular percutánea (como Impella) o de colocación quirúrgica (p. ej., Abiomed BVS 5000 o AB 5000 y Thoratec).
Nivel de evidencia B
10. En el posoperatorio inmediato y en las primeras 48 h posteriores al trasplante cardiaco es inevitable observar los efectos de la desnervación cardiaca; se ha calculado que hasta un 30% de estos pacientes desarrolla disfunción del nodo sinusal, que puede ser temporal y requerir el apoyo con isoproterenol o teofilina, con lo cual se incrementa la frecuencia cardiaca.
Nivel de evidencia B
11. Ante una dificultad temprana del injerto cardiaco de incrementar el gasto cardiaco, la frecuencia cardiaca se torna un factor útil para este propósito. Se sugiere la utilización en el perioperatorio y posoperatorio inmediato del isoproterenol para lograr una frecuencia cardiaca superior a los 100 latidos por minuto.
Nivel de evidencia C
12. Luego del trasplante, el paciente debe egresar del quirófano con marcapasos epicárdicos auricular y ventricular, independientemente de que se obtenga un ritmo sinusal desde la estancia en el quirófano.
Nivel de evidencia B
13. En caso de incompetencia cronotrópica en el injerto a las tres semanas del trasplante cardiaco, se sugiere la colocación de un marcapaso definitivo, de preferencia uno con programación bicameral con modulación de frecuencia (DDDR).
Nivel de evidencia C
14. El tratamiento de las taquiarritmias posterior al trasplante debe controlar la frecuencia cardiaca.
Nivel de evidencia B
15. La presencia de taquiarritmias persistentes justifica la realización de una biopsia intramiocárdica para identificar un rechazo celular; más aún, si ésta es normal o descarta un rechazo celular de consideración, está indicado el estudio electrofisiológico. Si la arritmia es una taquicardia ventricular sostenida, se solicita una angiografía coronaria.
Nivel de evidencia B
16. Debido a la desnervación, el injerto cardiaco se adapta con dificultad a los estados de hipovolemia y por tanto es necesario mantener una precarga y poscarga adecuadas y es recomendable conservar la presión venosa central en un nivel suficiente para optimizar el gasto cardiaco (tan baja como 5 mmHg o tan elevada como 20 mmHg, a condición de que no exista evidencia de insuficiencia del ventrículo derecho).
Nivel de evidencia C
17. Para la adecuación de la volemia se administran como fármacos de primera elección los productos sanguíneos compatibles con el receptor, en caso necesario; de lo contrario, pueden requerirse otros coloides en las primeras 24 a 48 h luego del trasplante.
Nivel de evidencia C
18. En caso de sobrevenir trastornos de la función renal en el posoperatorio, puede necesitarse apoyo diurético para evitar la sobrecarga volumétrica; se sugiere como primera elección prescribir los diuréticos de asa, pero puede administrarse una combinación con tiazidas o antagonistas de la aldosterona para establecer un bloqueo secuencial de la nefrona.
Nivel de evidencia C
19. Si se desarrolla una elevación notoria de la creatinina sérica en el posoperatorio temprano, o el paciente se encuentra anúrico a pesar de una precarga y poscarga óptimas, puede ser necesaria la hemodiálisis temprana en el receptor.
Nivel de evidencia B
20. En el banco de sangre deben sustraerse los leucocitos de los productos sanguíneos; cuando no es seguro que la sangre carezca por completo de leucocitos deben usarse filtros leucorreductores, ya que los leucocitos constituyen una forma de transmisión de citomegalovirus. Si el receptor es negativo a estos últimos, debe recibir de preferencia un injerto cardiaco y productos sanguíneos negativos a citomegalovirus.
Nivel de evidencia B
21. Los productos sanguíneos, con excepción de las células madre, deben radiarse de acuerdo con las recomendaciones internacionales para reducir el riesgo de la enfermedad de injerto contra huésped transmitida por transfusión, dado que es una alteración de elevada mortalidad; algunos centros sugieren no radiar el plasma, pero esto es controversial .
Nivel de evidencia B
22. Es necesaria la administración de antibióticos profilácticos en el quirófano antes de efectuar la incisión en la piel para el trasplante; dicho esquema se selecciona de acuerdo con la sensibilidad a los antibióticos demostrada en el hospital y debe cubrir la flora de la piel, en particular estafilococos.
Nivel de evidencia B
23. Si el receptor del trasplante es portador de un dispositivo de apoyo ventricular o un marcapaso infectados de manera crónica, debe recibir en el perioperatorio antibióticos seleccionados ajustados a la sensibilidad microbiológica demostrada por cultivos y antibiogramas.
Nivel de evidencia B
24. La profilaxis contra citomegalovirus debe iniciarse en las primeras 24 a 48 h tras la práctica del trasplante.
Nivel de evidencia A
25. Se considera que un paciente tiene alto riesgo de sufrir infección por citomegalovirus cuando muestra una serología negativa y recibe un injerto o transfusión de donador con serología positiva. En esta circunstancia, se administra ganciclovir intravenoso en el receptor a dosis de 5 a 10 mg/kg/día (la dosis debe ajustarse de acuerdo con la función renal); algunos centros suministran de forma conjunta inmunoglobulina hiperinmunitaria para citomegalovirus y se continúa en el alta hospitalaria con valganciclovir, 900 mg cada 12 h durante los primeros seis meses tras el trasplante.
Nivel de evidencia A
26. En el receptor positivo a citomegalovirus debe iniciarse una terapia anticipada con ganciclovir intravenoso (a las mismas dosis recomendadas en el punto 24), seguida en el egreso hospitalario de valganciclovir oral por seis meses.
Nivel de evidencia A
27. Una alternativa al tratamiento constante contra citomegalovirus es la vigilancia ambulatoria de la antigenemia contra citomegalovirus; en caso de una exacerbación de la antigenemia, se indica el valganciclovir a dosis de 900 mg cada 12 h.
Nivel de evidencia C
28. La profilaxis contra Aspergillus debe iniciarse una vez que se demuestre la estabilidad en el paciente, al principio por la vía oral; se recomienda el itraconazol (200 mg diarios por esta vía) y la profilaxis se mantendrá por un mínimo de seis meses. No debe perderse de vista que el metabolismo del itraconazol tiene lugar a través de la CYP3A4, y la administración concomitante de fármacos metabolizables por esta vía, o que tengan un efecto estimulador o inhibidor de ella, altera las concentraciones y efectos del itraconazol, o bien éste modifica la acción de los otros fármacos.
Nivel de evidencia B
29. Siempre debe establecerse en el periodo postrasplante la profilaxis contra Pneumocistys jiroveci (antes carinii); la primera elección es la combinación de trimetoprim y sulfametoxazol a dosis de 360/800 mg, respectivamente, cada tercer día por un mínimo por seis meses. En caso de alergia a la fórmula mencionada, la segunda alternativa es la dapsona (100 mg diarios), sin olvidar que ésta se metaboliza por la misma vía que el itraconazol y deben observarse las mismas precauciones .
Nivel de evidencia B
30. La vigilancia del rechazo celular del injerto cardiaco se establece mediante biopsias endomiocárdicas (obtenidas con frecuencia los primeros seis a 12 meses; puede ser factible, si las circunstancias lo permiten, efectuarlas anualmente, o ante la sospecha clínica de rechazo, con o sin compromiso hemodinámico).
Nivel de evidencia C
Clase IIa
1. Cuando en las primeras horas o días después del trasplante el paciente muestra signos clínicos o hemodinámicos de una clara disfunción ventricular progresiva, es indispensable descartar el rechazo hiperagudo mediado por anticuerpos, rechazo celular o taponamiento cardiaco. Si a pesar de descartar esto e instituir un tratamiento adecuado el deterioro hemodinámico persiste, es preciso considerar la colocación de un dispositivo de apoyo ventricular percutáneo o quirúrgico, cualquiera que esté disponible en el hospital donde sobrevenga el episodio.
Nivel de evidencia C
2. Siempre que el paciente se encuentre bajo apoyo con un dispositivo de asistencia ventricular y demuestre una mejoría clínica y funcional del injerto, corroborada mediante estudios de gabinete cardiológico (ecocardiografía, mejoría del gasto cardiaco, presiones pulmonares, etc.), se debe considerar el retiro del dispositivo de asistencia. Si en caso contrario, tras cuatro a cinco días de asistencia ventricular no se reconoce mejoría o recuperación funcional del injerto, es necesario considerar la colocación de ese paciente otra vez en lista para someterlo a un retrasplante.
Nivel de evidencia C
3. Los bloqueadores de los receptores β y los bloqueadores de los canales de calcio no dihidropiridínicos pueden administrarse en receptores de trasplante para controlar la frecuencia en las taquiarritmias.
Nivel de evidencia B
4. Los antiarrítmicos de clase III como la amiodarona o el sotalol pueden indicarse con seguridad, en caso de requerirse debido a su escasa interacción con los inmunosupresores.
Nivel de evidencia C
5. La ultrafiltración se recomienda en caso de sobrecarga volumétrica y se alcanzan presiones venosas centrales superiores a los 20 mmHg, a pesar de las maniobras farmacológicas para estimular la diuresis.
Nivel de evidencia B
6. Debido al acto quirúrgico y a la administración de esteroides, no es rara la aparición de hiperglucemia; en tal caso, se requiere una infusión de insulina intravenosa para mantener una glucemia por debajo de 200 mg/dl, en el control intraoperatorio y posoperatorio inmediato de la terapia intensiva, o durante todo el internamiento si es necesario.
Nivel de evidencia B
Inmunosupresión temprana
Clase I
1. El Comité de Trasplantes de cada centro debe definir el esquema de inmunosupresión a seguir en su programa.
Nivel de evidencia B
2. Se recomienda iniciar estatinas a dosis bajas en las primeras dos semanas después del trasplante, al margen de las cifras de colesterol del paciente, para aprovechar sus efectos pleiotrópicos que pueden generar una reducción de los episodios de rechazo celular.
Nivel de evidencia A
Clase IIa
1. El tratamiento con inhibidores de la calcineurina todavía se considera la piedra angular en los esquemas de inmunosupresión tras el trasplante cardiaco; no obstante, en virtud de su conocido efecto nefrotóxico, se han adoptado esquemas de suspensión temprana de ellos o esquemas combinados que incluyen dosis muy bajas de ciclosporina o tacrolimus.
Nivel de evidencia B
2. Los esquemas que incluyen sirolimus, mofetilo de micofenolato o everolimus han mostrado un efecto benéfico en la reducción del inicio y progresión de la enfermedad coronaria del injerto, demostrado por ultrasonido intravascular, razón por la cual deben considerarse en los esquemas convencionales de inmunosupresión.
Nivel de evidencia B
3. En casos de deterioro grave de la función renal desde el inicio de la recuperación del trasplante, es posible utilizar un esquema de inmunosupresión libre de inhibidores de calcineurina, al combinar sirolimus, ácido micofenólico, mofetilo de micofenolato o everolimus con los esteroides.
Nivel de evidencia B
4. Es posible considerar la inducción de la inmunosupresión con preparados de anticuerpos policlonales con la intención de retardar la necesidad de iniciar los inhibidores de calcineurina si el riesgo de la aparición de insuficiencia renal temprana es muy elevado.
Nivel de evidencia B
Clase IIb
1. Los resultados de ensayos clínicos sugieren que los esquemas que utilizan tacrolimus se vinculan con menores tasas de rechazo que la ciclosporina, aunque no con mejor sobrevida.
Nivel de evidencia B
2. La utilización sistemática de la terapia inductora de inmunosupresión para todos los pacientes sometidos a trasplante cardiaco no ha demostrado ser superior a los esquemas convencionales de inmunosupresión.
Nivel de evidencia B
Clase III
1. El análisis regular de los parámetros electrocardiográficos, ecocardiográficos o de resonancia magnética nuclear cardiaca no están recomendados como medidas de vigilancia ni como sustitutos de la biopsia endomiocárdica en el seguimiento del rechazo del injerto cardiaco.
Nivel de evidencia C
2. No están recomendadas las determinaciones del péptido natriurético cerebral, troponina I o C, proteína C reactiva o marcadores inflamatorios sistémicos como forma de vigilar el rechazo del injerto cardiaco.
Nivel de evidencia C
Tratamiento del rechazo celular agudo acompañado de síntomas
Clase I
1. El receptor de trasplante cardiaco con rechazo celular agudo sintomático debe tratarse en un medio hospitalario. Si existe compromiso hemodinámico a consecuencia del rechazo celular (hipotensión, bajo gasto cardiaco, reducción de la fracción de expulsión de ventrículo izquierdo, etc.) el paciente debe recibir atención en una unidad de terapia intensiva.
Nivel de evidencia C
2. Los bloqueadores de los receptores de interleucina 2 no deben administrarse para revertir un episodio de rechazo celular agudo.
Nivel de evidencia C
3. La primera medida terapéutica para prevenir el rechazo celular agudo sintomático son los esteroides intravenosos a dosis altas (cualquiera que sea la gravedad del rechazo celular) acompañados de optimización de la terapia inmunosupresora coexistente (ciclosporina, tacrolimus, sirolimus, ácido micofenólico, etc.).
Nivel de evidencia C
4. Si tras 24 h de la administración de los esteroides intravenosos a dosis elevadas para atender un rechazo celular sintomático no hay signos de mejoría clínica, se recomienda el tratamiento inmunosupresor citolítico con anticuerpos antitimocito o anticuerpos monoclonales.
Nivel de evidencia C
5. Al incrementar la inmunosupresión con dosis elevadas de esteroides o terapia citolítica para atender un episodio de rechazo celular es necesario garantizar una profilaxis antimicrobiana contra gérmenes oportunistas.
Nivel evidencia C
6. Dos semanas después de iniciar el tratamiento de un episodio de rechazo celular se debe realizar una biopsia endomiocárdica para vigilar la respuesta celular al tratamiento; se recomienda la vigilancia de la recuperación de la función del injerto cardiaco con ecocardiogramas seriados.
Nivel de evidencia C
Tratamiento del rechazo celular agudo asintomático Clase I
1. El rechazo celular grave diagnosticado por biopsia endomiocárdica debe tratarse incluso en ausencia de síntomas o disfunción ventricular en el injerto cardiaco.
Nivel de evidencia C
2. El rechazo celular grave asintomático debe tratarse con dosis elevadas de esteroides intravenosos.
Nivel de evidencia C
3. El rechazo celular moderado asintomático puede tratarse con esteroides orales o intravenosos.
Nivel de evidencia C
Clase IIa
1. La biopsia endomiocárdica de seguimiento se lleva a cabo dos a cuatro semanas tras el ajuste de la inmunosupresión en casos de rechazo celular moderado o grave asintomáticos.
Nivel de evidencia C
2. Si en la biopsia endomiocárdica de seguimiento no se determina una resolución del grado de rechazo celular, se recomienda el tratamiento inmunosupresor citolítico.
Nivel de evidencia C
Bibliografía
Agarwal P, Ray VL, Choudhury N, et al. Effect of pre-storage gamma irradiation on red blood cells. Indian J Med Res 2005;122:385-387.
Ardehali A, Huges K, Sadeghi A, et al. Inhaled nitric oxide for pulmonary hypertension after heart transplantation. Transplantation 2001;72:638-641.
Arora S, Gullestad L, Wergeland R, et al. Probrain natriuretic peptide and C reactive protein as markers of acute rejection, allograft vasculopathy and mortality in heart transplantation. Transplantation 2007;83:1308-1315.
Boyle JM, Moualla S, Arrigain S, et al. Risk and outcomes of acute kidney injury requiring dyalisis after cardiac transplantation. Am J Kidney Dis 2006;48:787-796.
Brieke A, Krishnamani R, Rocha MJ, et al. Influence of donor cocaine use on outcome after cardiac transplantation: analysis of the United Network for Organ Sharing Thoracic Registry. J Heart Lung Transplant 2008;27:1350-1352.
Carrier M, Leblanc MH, Perrault LP, et al. Basiliximab and rabbit anti-thymocyte globulin for prophylaxis of acute rejection after heart transplantation: a non inferiority trial. J Heart Lung Transplant 2007;26:258-263.
Chee YL, Crawford JC, McCrindle BW, et al. Guidelines on the assessment of bleeding risk prior to surgery or invasive procedures. British Committee for Standards in Haematology. Br J Haematol 2008;140:496-504.
Chin C, Pittson S, Luikart H, et al. Induction therapy for pediatric and adult heart transplantation: comparison between OKT3 and daclizumab. Transplantation 2005;80:477-481.
Constanzo MR, Guglin ME, Saltzberg MT, et al. Ultrafiltration versus intravenous diuretics for patients hospitalized for acute decompensated heart failure. J Am Coll Cardiol 2007;49:675-683.
Constanzo MR, Taylor D, Burch M, et al. The International Society of Heart and Lung Transplantation Guidelines for the care of heart transplant recipients. J Heart Lung Transplant 2010;29:914-956.
Coons JC, Shullo M, Schonder K, et al. Terbutaline for cChrono-tropic support in heart transplantation. Ann Pharmacother 2004;38:586-589.
Cooper LT, Baughman KL, Feldman AM, et al. The role of endomyocardial biopsy in the management of cardiovascular disease: a scientific statement from the American Heart Association, the American College of Cardiology and the European Society of Cardiology. Endorsed by the Heart Failure Society of America and the Heart Failure Association of the European Society of Cardiology. J Am Coll Cardiol 2007;50:1914-1931.
De la Zerda DJ, Cohen O, Beygui RE, et al. Alcohol use in donors is a protective factor in a recipients´ outcome after heart transplantation. Transplantation 2007;83:1214-1218.
De Santo LS, Mastroianni C, Romano G, et al. Role of sildenafil in acute posttransplant right ventricular dysfunction: successful experience in 13 consecutive patients. Transplant Proc 2008;40:2015-2018.
Delgado DH, Miriuka SG, Cusimano RJ, et al. Use of basiliximab and cyclosporine in heart transplant patients with preoperative renal dysfunction. J Heart Lung Transplant 2005;24:166-169.
Dengler TJ, Gleissner CA, Klingenberg R, et al. Biomarkers after heart transplantation: nongenomic. Heart Fail Clin 2007;3:69-81.
Dvorak L, Pirk J, Cerny S, et al. The role of leukocyte depleting filters in heart transplantation: early outcomes in prospective, randomized clinical trial. Eur J Cardiothorac Surg 2006;30:621-627.
Eisen HJ, Tuzcu EM, Dorent R, et al. Everolimus for the prevention of allograft rejection and vasculopathy in cardiac transplant recipients. N Engl J Med 2003;349:847-858.
Francis GS, Greenberg BH, Hsu DT, et al. ACCF/AHA/ACP/HFSA/ISHLT 2010 clinical competence statement on management of patients with advanced heart failure and cardiac transplant: a report of the ACCF/AHA/ACP Task Force on Clinical Competence and Training. J Am Coll Cardiol 2010;56:424-453.
Goland S, Czer LS, Coleman B, et al. Induction therapy with thymoglobulin after heart transplantation: impact of therapy duration on lymphocyte depletion and recovery, rejection and cytomegalovirus infection rates. J Heart Lung Transplant 2008;27:1115-1121.
Goldsmith KA, Demiris N, Gooi JH, et al. Life years gained by reducing donor heart ischemic times. Transplantation 2009;87:243-248.
Green H, Paul M, Vidal L, et al. Prophylaxis of Pneumocystis pneumonia in immunocompromised non HIV infected patients: Systematic review and meta-analysis of randomized controlled trials. Mayo Clin Proc 2007;82(9):1052-1059.
Grimm M, Rinaldi M, Yonan NA, et al. Superior prevention of acute rejection by tacrolimus vs cyclosporine in heart transplant recipients—a large European trial. Am J Transplant 2006;6:1387-1397.
Groentzner J, Meiser B, Landwehr P, et al. Replacement of calcineurin-inhibitors with sirolimus as primary immunosuppression for late cardiac transplant recipients with chronic renal failure. Transplantation 2004;77:568-574.
Groetzner J, Meiser B, Landwehr P, et al. Mycophenolate mofetil and sirolimus as calcineurin inhibitor-free immunosuppression for late cardiac transplant recipients with chronic renal failure. Transplantation 2004;77:568-574.
Hanley JP. Warfarin reversal. J Clin Pathol 2004;57:1132-1139. Hauer D, Beiras-Fernandez A, Kur F, et al. The management of severe primary graft failure after cardiac transplantation. J Cardiothorac Vasc Anesth 2009;23:203-205.
Hershberger RE, Starling RC, Eisen HJ, et al. Daclizumab to prevent rejection after cardiac transplantation. N Engl J Med 2005;352:2705-2713.
Holt ND, Mc Comb JM. Cardiac transplantation and pacemakers: when and what to implant. Card Electrophysiol Rev 2002;6:140-151.
Hussey JC, Bonser RS, Rudge CJ. Ischaemia time in cardiac transplantation: A UK national study. J Heart Lung Transplant 2006;25:115.
Ibrahim M, Hendry P, Masters R, et al. Management of acute severe perioperative failure of cardiac allografts: a single-centre experience with a review of the literature. Can J Cardiol 2007;23(5):363-367.
Keogh A, Richardson M, Ruygrok P, et al. Sirolimus in de novo heart transplant recipients reduces acute rejection and prevents coronary artery disease at 2 years: a randomized clinical trial. Circulation 2004;110:2694-2700.
Kobashigawa JA, Miller LW, Russell SD, et al. Tacrolimus with mycophenolate mofetil (MMF) or sirolimus vs cyclosporine with MMF in cardiac transplant patients: 1 year report. Am J Transplant 2006;6:1377-1386.
Kobashigawa JA, Moriguchi JD Laks H, et al. Ten year follow up of a randomized trial of pravastatin in heart transplant patients. J Heart Lung Transplant 2005;24:1736-1740.
Kobashigawa JA, Tobis JM, Mentzer RM, et al. Mycophenolate mofetil reduces intimal thickness by intravascular ultrasound after heart transplant: reanalysis of the multicenter trial. Am J Transplant 2006;6:993-997.
Kubak BM, Gregson AL, Pegues DA, et al. Use of hearts transplanted from donors with severe sepsis and infectious deaths. J Heart Lung Transplant 2009;28:260-265.
Kuppahally S, Valantine H, Weishaar D, et al. Outcome in cardiac recipients of donor hearts with increased left ventricular wall thickness. American Journal of Transplantation 2007;7(10):2388-2395.
Liu MZ, Wang JH, Du J, et al. Impact of pulmonary hypertension on early hemodynamics after orthotopic heart transplantation. Zhoghua Yi Xue Za Zhi 2007;87:2618-2622.
Mattei MF, Redonnet M, Gandjbakhch I, et al. Lower risk of infectious deaths in cardiac transplant patients receiving basiliximab versus anti-thymocyte globulin as induction therapy. J Heart Lung Transplant 2007;26:693-699.
McIlroy DR, Silvers AJ. Recombinant factor VIIa for life-threatening bleeding in high-risk cardiac surgery despite full-dose aprotinin. Anesthesia & Analgesia 2004;99:27-30.
Mehra MR, Zucker MJ, Wagoner L, et al. A multicenter prospective, randomized double blind trial of basiliximab in heart transplantation. J Heart Lung Transplant 2005;24:1297-1304.
Meiser B, Reichart B, Adamidis B, et al. First experience with de novo calcineurin-inhibitor-free immunosuppression following cardiac transplantation. Am J Transplant 2005;5:827-831.
Morales DL, Garrido MJ, Madigan JD, et al. A double-blind randomizedt rial: prophylactic vasopressin reduces hypotension after cardiopulmonary bypass. Ann Thorac Surg 2003;75:926-930.
Park MH, Starling RC, Ratliff NB, et al. Oral steroid pulse without taper for the treatment of asymptomatic moderate cardiac allo-graft rejection. J Heart Lung Transplant 1999;18:1224-1227.
Patel ND, Weiss ES, Nwakanma LU, et al. Impact of donor to recipient weight ratio on survival after heart transplantation. Circulation 2008;118:S83-S88.
Pedotti P, Matucci DA, Gabbrielli F, et al. Analysis of the complex effect of donor´s age on survival of subjects who underwent heart transplantation. Transplantation 2005;80:1026-1032.
Perrottet N, Decosterd L, Meylan P, et al. Valganciclovir in adult solid organ transplant recipients: pharmacokinetic and pharmacodynamic characteristics and clinical interpretation of plasma concentration measurements. Clinical Pharmacokinetics 2009;48:399-418.
Quin JA, Tauriainen MP, Huber LM, et al. Predictors of pericardial effusion after orthotopic heart transplantation. J Thorac Cardiovasc Surg 2002;124:979-983.
Raichlin E, Khalpey Z, Kremers W, et al. Replacement of calcineurin inhibitors with sirolimus as primary immunosppression in stable cardiac transplant recipients. Transplantation 2007;84:467-474.
Rajagopal V, Steahr G, Wilmer CI, et al. A novel percutaneous mechanical biventricular bridge to recovery in severe cardiac allograft rejection. J Heart Lung Transplant 2010;29:93-95.
Segovia J, Rodriguez-Lambert JL, Crespo-Leiro MG, et al. A randomized multicenter comparison of basiliximab and muronomab (OKT3) in heart transplantation: SIMCOR study. Transplantation 2006;81:1542-1548.
Shanahan A, Malani P, Kaul D. Relapsing cytomegalovirus infection in solid organ transplant recipients. Transplant Infectious Disease 2009;11:513-518.
Shulman S, Bijsterveld NR. Anticoagulants end their reversal. Transfus Med Rev 2007;21:37-48.
Stehlik J, Starling RC, Movsesian MA, et al. Utility of long term surveillance endomyocardial biopsy: a multi-institutional analysis. J Heart Lung Transplant 2006;25:1402-1409.
Theodoraki K, Tsiapras D, Tsourelis L, et al. Inhaled iloprost in eight heart transplant recipients presenting with post-bypass acute right ventricular dysfunction. Acta Anaesthesiol Scand 2006;50:1213-1217.
Tigen E, Tigen K, Karaahmet T, et al. Concomitant Aspergillus and Citomegalovirus infection in heart transplant: early diagnosis is the key to successful treatment. Exp Clin Transplant 2009;7:168-172.
Vaseghi M, Boyle NG, Kedia R, et al. Supraventricular tachycardia after orthotopic cardiac transplantation. J Am Coll Cardiol 2008;51:2241-2249.
Weis F, Beiras-Fernandez A, Kacsmarek I, et al. Levosimendan: a new therapeutic option in the treatment of primary graft dys-function after heart transplantation. J Heart Lung Transplant 2009;28:501-504.
Wilmot I, Kanter KR, Vincent RN. OKT3 treatment in refractory pediatric heart transplant rejection. J Heart Lung Transplant 2005;24:1793-1797.
Wilson M, Weinreb J, Hoo GW. Intensive insulin therapy in critical Care: a review of 12 protocols. Diabetes Ccare 2007;30:1005-1011.
Zakliczynski M, Nozynnski J, Zakliczynska H, et al. Diagnosis and treatment of steroid resistant cellular rejction in heart transplant recipients—single center experience. Ann Transplant 2003;8:25-36.
Zieroth S, Ross H, Rao V, et al. Permanent pacing after cardiac transplantation in the era of extended donors. J Heart Lung Transplant 2006;25:1142-1147.