El iloprost inhalado es un fármaco del grupo de las prostaciclinas utilizado en el tratamiento de la hipertensión arterial pulmonar. La eficacia y seguridad de su administración han permitido su uso como monoterapia y en terapia combinada. En esta revisión se describen las características del medicamento, los grupos susceptibles de tratamiento y la evidencia clínica actualizada del uso del fármaco.
Inhaled iloprost is a drug from the group of prostacyclins used in the treatment of pulmonary arterial hypertension. Its efficacy and safety have allowed its use as monotherapy and combination therapy. This review describes the product characteristics, amenable to treatment groups, and updated clinical evidence of drug use.
La hipertensión arterial pulmonar (HAP) engloba un grupo heterogéneo de enfermedades que se caracterizan por el incremento progresivo de la presión arterial pulmonar (PAP) que conduce a disfunción del ventrículo derecho (VD) y eventualmente a la muerte.
El grupo de hipertensión pulmonar (HP) se compone de 5 estratos de condiciones clínicas de acuerdo a la clasificación de Niza, Francia 20131.
Grupo 1. HAP;
Grupo 2. HP debida a enfermedades de corazón izquierdo;
Grupo 3. HP debida a enfermedades pulmonares e hipoxia;
Grupo 4. HP tromboembólica crónica;
Grupo 5. HP por mecanismos multifactoriales desconocidos.
Al primer grupo se le ha denominado como portadores de HAP, el resto (grupos 2 al 5) se considera que cursan con HP.
El diagnóstico de certeza requiere realizar cateterismo cardiaco derecho2. La definición general de HP incluye el incremento en la presión pulmonar media (PAP-m)≥25mmHg en reposo, y para la HAP se ha sugerido incluir la resistencia vascular pulmonar (RVP)>3 unidades Wood2.
Se ha clasificado en función de sus parámetros hemodinámicos3–5:
HP precapilar: Se caracteriza por PAP-m≥25mmHg, presión capilar pulmonar≤15mmHg y gasto cardiaco (GC) normal o reducido; este perfil es similar en los grupos 1, 3, 4 y 5.
HP poscapilar: Se define por PAP-m≥25mmHg, presión capilar pulmonar≥15mmHg y GC normal o reducido; típico del grupo 2.
En los informes de los Institutos Nacionales de Salud de los EE. UU. en 19916 el diagnóstico de la enfermedad fue establecido en promedio 1.9 a 2.8 años a partir del inicio de la sospecha clínica, tiempo que ha permanecido>2años en la actualidad (2010)7 a pesar de los esfuerzos de la organización mundial de la salud (OMS/WHO) para difundir su conocimiento. En nuestro medio (República Mexicana) se desconoce cuál es el tiempo estimado para la detección de la enfermedad. El retraso diagnóstico impacta en el pronóstico de la enfermedad.
El tratamiento se basa en el conocimiento de las alteraciones endoteliales asociadas a la HP8. El mantenimiento del tono vascular, la coordinación del crecimiento celular vascular, el control de procesos inflamatorios e inmunológicos y el mantenimiento del balance entre la actividad trombótica y fibrinolítica están regulados a través de mediadores; la prostaciclina (PGI2) es uno de ellos y tiene un papel importante7,8.
Se cuenta con algoritmos y recomendaciones de tratamiento internacionales3–5,9. Las medidas adicionales engloban viajes, actividad física, rehabilitación supervisada, control del embarazo, prevención de la infección, apoyo psicosocial y tratamiento de soporte como anticoagulación, oxigenoterapia y diuréticos.
Las líneas de tratamiento específico3–5,9 incluyen 3 clases de medicamentos: prostanoides (epoprostenol, beraprost, treprostinil e iloprost), antagonistas de los receptores de endotelina (bosentán, ambrisentán) y los inhibidores de la fosfodiesterasa 5 (sildenafil, tadalafil, vardenafil), además de los bloqueadores de los canales del calcio (nifedipina, amlodipina y diltiacem), limitados a pacientes denominados respondedores a maniobras de reto farmacológico en el cateterismo cardiaco derecho.
Estos fármacos se han utilizado para las entidades del grupo 1 (HAP) de manera primordial en clase funcional (CF) II a IV de la OMS/WHO, con diferentes dosis y vías de administración, intravenosa (iv), oral, subcutánea (sc) e inhalada (inh)3–5,9,10. Con este conocimiento, la indicación de estos medicamentos se ha extrapolado a otras formas de HP. Pueden ser administrados como monoterapia, tratamiento combinado de acuerdo al mecanismo de acción o incluso utilizando combinaciones con 3 fármacos, práctica aún no sustentada en guías de tratamiento. Ante el deterioro clínico y como puente a trasplante pulmonar se ha utilizado la septostomía auricular9,11,12, que consiste en la apertura de una comunicación entre ambas aurículas. El objetivo es descomprimir el VD; la última opción terapéutica en estos pacientes es el trasplante pulmonar9,13 o de corazón-pulmón.
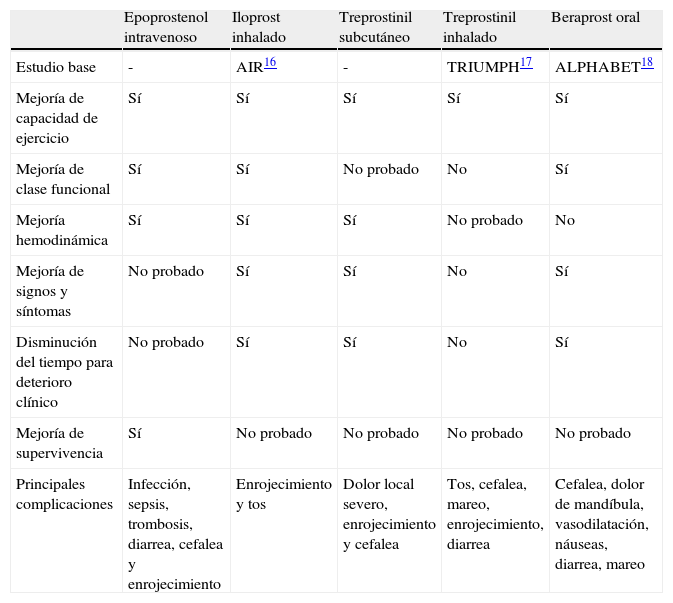
De los fármacos clasificados como prostanoides, la prostaciclina (epoprostenol) fue el primer vasodilatador pulmonar específico para el tratamiento de la HAP14,15. Se administra en infusión continua debido a su corto tiempo de acción, 1-2min. Su efecto hemodinámico fue la disminución de la PAP y la RVP, sin embargo, se le relacionó con complicaciones debidas a la permanencia del catéter central, como la sepsis, trombosis y rebote de la presión pulmonar con el retiro del medicamento. El cambio de vía de administración con el treprostinil subcutáneo14,15 mantuvo los efectos benéficos previamente observados con el epoprostenol iv, anuló las complicaciones severas de la administración del epoprostenol, pero el dolor en el sitio de aplicación, infección local y sangrado fueron sus inconvenientes. Con la finalidad de disminuir estas complicaciones se estudió la ruta inhalada, además con el concepto de que el medicamento tendría su acción de manera más específica al actuar en el órgano blanco. Las diferencias clínicas entre los prostanoides se muestran en la tabla 116–18.
Principales diferencias entre prostanoides
| Epoprostenol intravenoso | Iloprost inhalado | Treprostinil subcutáneo | Treprostinil inhalado | Beraprost oral | |
| Estudio base | - | AIR16 | - | TRIUMPH17 | ALPHABET18 |
| Mejoría de capacidad de ejercicio | Sí | Sí | Sí | Sí | Sí |
| Mejoría de clase funcional | Sí | Sí | No probado | No | Sí |
| Mejoría hemodinámica | Sí | Sí | Sí | No probado | No |
| Mejoría de signos y síntomas | No probado | Sí | Sí | No | Sí |
| Disminución del tiempo para deterioro clínico | No probado | Sí | Sí | No | Sí |
| Mejoría de supervivencia | Sí | No probado | No probado | No probado | No probado |
| Principales complicaciones | Infección, sepsis, trombosis, diarrea, cefalea y enrojecimiento | Enrojecimiento y tos | Dolor local severo, enrojecimiento y cefalea | Tos, cefalea, mareo, enrojecimiento, diarrea | Cefalea, dolor de mandíbula, vasodilatación, náuseas, diarrea, mareo |
En esta revisión se comentan las características farmacológicas y clínicas del iloprost-inh, sus indicaciones clínicas, complicaciones, la monoterapia y el tratamiento combinado secuencial; y finalmente, la repercusión en la supervivencia de estos pacientes con el uso de prostanoides.
Generalidades del iloprost inhaladoEl iloprost es el análogo sintético más estable de la prostaciclina endógena PGI2, pertenece al grupo de los prostanoides y es clasificado como eicosanoide. Tiene efecto similar a las hormonas y se forma por peroxidación regulada enzimáticamente de diversos ácidos grasos no saturados C20, tal como el ácido araquidónico y el ácido dihomo-γ-linolénico. El grupo de eicosanoides incluye otros compuestos generados por la ciclooxigenasa (prostaglandinas, tromboxano A2 y prostaciclina) y lipoxigenasa (leucotrieno)10,19–21.
Tiene gran afinidad por el receptor de la prostaciclina y una alta estabilidad molecular. La mayor vida media del iloprost resulta del hecho de que el grupo enol en el anillo superior de la PGI2 ha sido remplazado por un grupo metileno22.
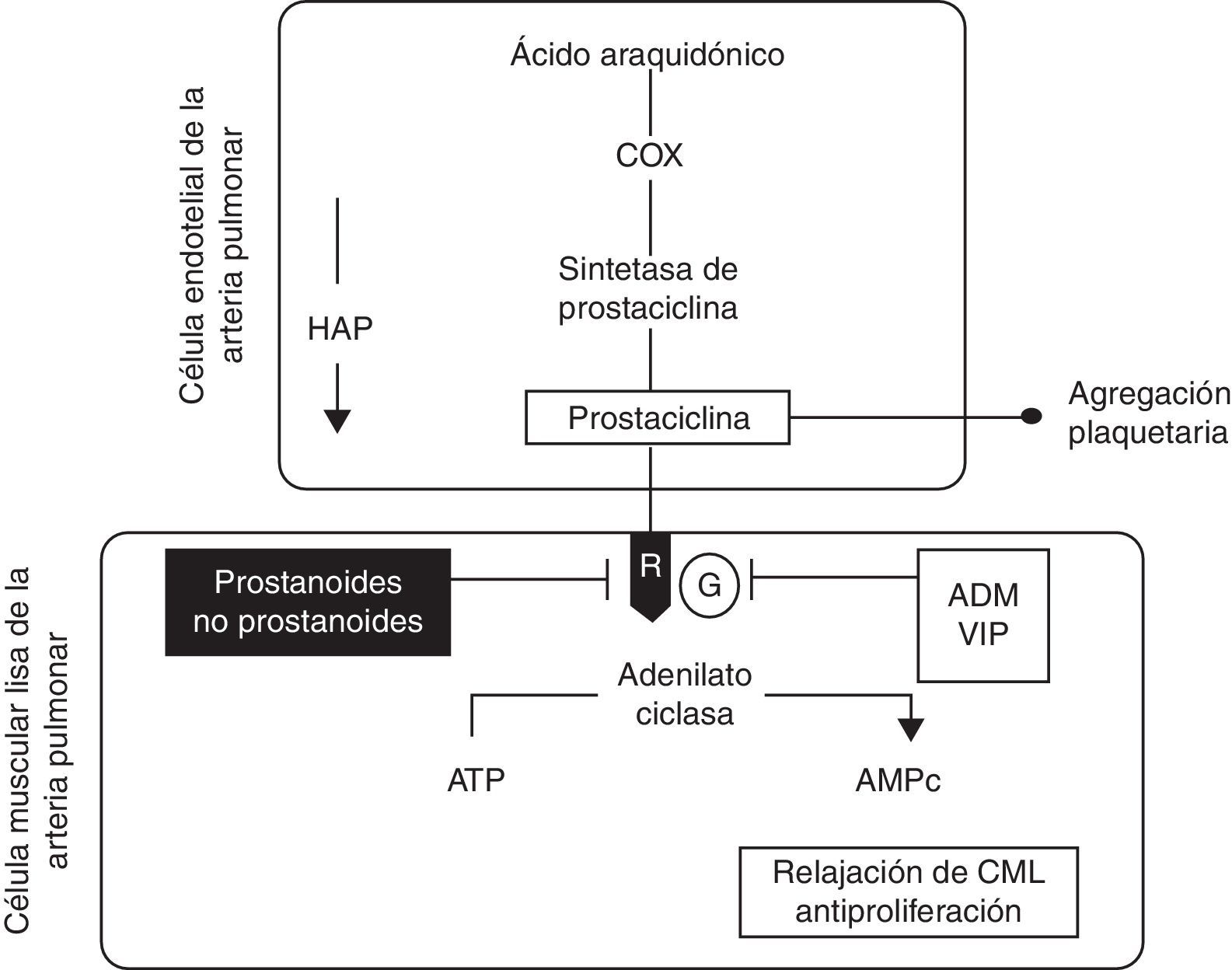
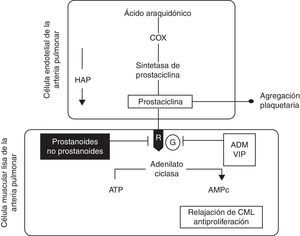
El iloprost estimula la enzima adenilato-ciclasa al unirse a receptores específicos como la prostaglandina i y otros receptores que están localizados en la superficie celular o el núcleo (receptor de la prostaglandina E o receptor PPAR). El resultado es el incremento en el nivel de adenosin-monofosfato-cíclico (AMPc) y a través de este la inhibición de la agregación plaquetaria y de las acciones relacionadas con la actividad trombótica. Este incremento en el nivel de AMPc en las células musculares activa las bombas de calcio, lo que lleva a este fuera de la célula; en adición, se abren los canales de potasio con lo que se provoca hiperpolarización. El AMPc activa las miosincinasas lo que produce vasodilatación, con reducción de la resistencia vascular e incremento del flujo sanguíneo19–23. En la figura 1 se muestra la vía de la prostaciclina en la HAP24.
Esquema de la vía de la prostaciclina en la hipertensión arterial pulmonar. El ácido araquidónico es transformado por la Cox a un substrato de la prostaciclina sintetasa para formar prostaciclina en la célula endotelial. En la CML la prostaciclina liga a un receptor de membrana (R) que estimula a la adenilato ciclasa para producir AMPc y a través de esta, en la CML, promover relajación, además de tener efectos antiproliferadores. La prostaciclina inhibe la agregación plaquetaria. En la HAP los niveles de prostaciclina y de la sintetasa de prostaciclina están disminuidos. Fármacos prostanoides y no prostanoides pueden restaurar estos niveles parcialmente si actúan a nivel del receptor. Otras sustancias pueden activar a la adenilato ciclasa si ligan a la proteína G, como sucede con la ADM y el VIP. ADM: adrenomodulina; AMPc: adenosín-monofosfato-cíclico; ATP: trifosfato de adenosina; CML: célula de músculo liso; Cox: ciclooxigenasa; G: proteína G; HAP: hipertensión arterial pulmonar; R: receptor de prostaciclina; VIP: péptido intestinal vasoactivo. Figura modificada de Vachiéry24.
Inhibe la activación de las plaquetas en todos los estadios, independientemente del tipo o variedad del estímulo, y el efecto inhibitorio del iloprost es 10 veces más potente que el de la PGI2. La inhibición de la agregación plaquetaria es reversible y retorna a sus niveles originales aproximadamente una hora después de la infusión20,21.
En años recientes se han demostrado otros efectos del iloprost, que incluyen a los macrófagos, los monocitos y las células T (actuando como mediador)21. El iloprost tiene una influencia protectora en la integridad del endotelio; inhibe el proceso inflamatorio e influye en el remodelado vascular in vitro. Adicionalmente tiene efectos inmunomoduladores19–21.
La hipoxia y mediadores específicos como la trombina, tromboxano, angiotensina ii y endotelina pueden inducir vasoconstricción mediada por receptores de membrana y cascadas de señalización intracelular.
La endotelina es secretada por células endoteliales hacia el músculo liso donde se liga a receptores específicos ETA y ETB. Estos receptores pueden ser encontrados en cerebro, riñón y pulmón de fetos humanos adultos y puede haber interacción entre ellos. Los receptores ETA promueven la vasoconstricción y la proliferación celular en diversos tejidos. Los receptores ETB estimulan la liberación de óxido nítrico y prostaciclina e inhiben la expresión de enzimas convertidoras de endotelina y la apoptosis; además, otra importante función que exhiben es la disminución de la endotelina circulante.
En el contexto de la HP, en el lecho vascular pulmonar existe un desequilibrio entre el efecto de estos receptores, por un lado la vasoconstricción y proliferación celular, y por otro la vasodilatación y la apoptosis. Se ha descrito la disminución de la sintetasa de prostaciclina así como de la expresión de receptores de la prostaciclina endotelial22–24. En modelos realizados con ratones knockout, se demostró la influencia inhibitoria de la prostaciclina sobre la proliferación de las células del músculo liso25; este potente efecto se ha demostrado también en modelos de HP por hipoxia en conejos26. La disminución de la endotelina intrapulmonar ha sido demostrada con el uso del iloprost-inh en 15 sujetos con HP de diferente etiología27.
Farmacocinética y metabolismoDespués de la aplicación iv del iloprost, los niveles plasmáticos caen en 2 fases. La primera fase depende de la distribución del agente en el organismo y corresponde a 2.8±1.6min, la segunda fase muestra el metabolismo del iloprost por β-oxidación y su vida media es de 26±7.2min. Aproximadamente el 70% de los metabolitos principales son eliminados a través del riñón como ácido glucurónico y/o conjugados de ácido sulfúrico10,21.
La biodisponibilidad del fármaco es del 100% por vía intravenosa; en modelos experimentales en conejo se han estudiado 2 dosis inhaladas (75 y 900ng) su biodisponibilidad fue de 63% y 14% respectivamente28; la mayor dosis no llevó a mayor perfusión del medicamento, mecanismo aún no definido.
Se han estudiado cálculos farmacocinéticos concernientes a la aplicación inhalada del iloprost en humanos comparando 3 tipos de nebulizadores29. La efectividad (el reservorio o la dosis nebulizada insertada en la boca) varió entre un 13 y 25%; para propósitos de investigación fue hecho un ajuste para los 5μg en la boquilla. Los tiempos de inhalación se mantuvieron entre 10 y 12min; solo se requirieron algunos minutos para detectar niveles en el suero. La concentración máxima después de la inhalación mostró tener un rango de 65 a 300pg/ml. Este valor fue alcanzado hacia el final de la inhalación y cayó de forma rápida, con una vida media que fluctuó de 6.5 a 9.4min.
Los nebulizadores adecuados para la inhalación de iloprost deben administrar 2.5 o 5μg a través de la boquilla en un tiempo aproximado de 4 a 10min. La mediana del diámetro aerodinámico de masa del aerosol debe estar entre 1 y 5μm30.
Indicaciones del iloprost inhalado en la hipertensión arterial pulmonarGuías internaciones3–5 lo recomiendan como monoterapia o en terapia secuencial combinada en pacientes con CF-III y CF-IV de la OMS/WHO con respuesta subóptima. El iloprost-inh ha sido aprobado para su uso en la HAP por diferentes agencias encargadas de regular su uso: Europa (EMEA) 2003, EE. UU. (Food and Drug Administration [FDA]) 2004 y Australia (Administración Australiana de Buenas Terapéuticas) 2004. En México se ha aprobado por la Comisión Federal para la Protección contra Riesgos Sanitarios, México (COFEPRIS) para el tratamiento de:
- 1.
HAP idiopática e HAP familiar;
- 2.
HAP asociada a enfermedad del tejido conectivo e HAP asociada a fármacos o toxinas;
- 3.
HP debida a enfermedad embólica y/o trombótica crónica donde la cirugía no es una opción viable de tratamiento.
Guías de referencia nacionales31 lo mencionan como uno de los fármacos para realizar el reto farmacológico32 durante el cateterismo cardiaco derecho y determinar si existe o no un componente reversible del lecho vascular pulmonar en pacientes con HAP idiopática. Es similar a la adenosina iv pero mejor tolerado, además con su uso se ha identificado a pacientes que pueden ser respondedores a medicamentos bloqueadores de los canales del calcio a largo plazo.
En lo que respecta la indicación en términos de su aplicación, el iloprost-inh se distribuye en ampolletas de 2ml a razón de 10μg/ml, y la prescripción será de 6 a 9inhalaciones/día mediante un nebulizador. La duración en cada nebulización es de 10 a 12min. La dosis puede ser individualizada. En algunos casos como en el estudio Aerosolized Iloprost Randomized Study Group (AIR)16 la dosis se individualizó durante los primeros 8días de tratamiento.
Efectos benéficosLos efectos benéficos de la vasodilatación de la circulación pulmonar relacionados con el uso del iloprost-inh reportados han sido disminución de la PAP-m, RVP y mejoría del GC, como fue mostrado en el estudio con 35 pacientes con HAP idiopática donde se demostró mayor efectividad al inhalar iloprost (14-17μg) que óxido nítrico (40ppm)33. Este efecto hemodinámico en condición aguda se mantuvo durante 45min a diferencia de lo ocurrido con el óxido nítrico. Estos fármacos se consideran vasodilatadores pulmonares selectivos34. Al comparar el epoprostenol iv con el iloprost-inh se observó que ambos tuvieron efectos hemodinámicos similares, sin embargo, la diferencia estuvo en el tiempo, 30min vs. 120min, respectivamente; asimismo se evidenció una baja incidencia de efectos secundarios con el iloprost debido a su acción directa órgano-específica30,34.
Otros efectos benéficos se han expresado en la capacidad de ejercicio, CF e intercambio gaseoso: saturación arterial de oxígeno y saturación venosa central de oxígeno (SvcO2)3–5.
Con dosis bajas de iloprost-inh35 (2.5μg) 6 veces al día, después de 24 semanas de tratamiento se observó mejoría de la caminata de 6min (de 356±98m a 414±99m, p<0.001) y de la CF (p=0.006); el GC, índice cardiaco y la SvcO2 mejoraron en la CF-II pero no en la CF-III ni en la CF-IV. Con ello se reafirma la importancia del diagnóstico oportuno con el objetivo de un tratamiento temprano.
Seguridad y eficaciaSu forma de administración a diferencia de otras prostaciclinas análogas (epoprostenol iv, treprostinil subcutáneo) es diferente (por inhalación) lo que conlleva menor frecuencia de eventos secundarios (hipotensión arterial sistémica, taquifilaxia y rebote de la PAP con el retiro) relacionados con la administración sistémica de otros fármacos análogos de la prostaciclina como el epoprostenol, como fue demostrado cuando se comparó el iloprost-inh vs. epoprostenol iv en pacientes con HAP36. Debido a estas características de administración se hace posible su empleo como monoterapia en pacientes graves en CF-IV y falla del VD37, en terapia largo plazo16,38 e incluso en terapia combinada3–5,19–21.
Los datos de seguridad del iloprost-inh fueron obtenidos de 215 pacientes con HAP en un estudio de 12 semanas y 2 brazos de extensión a largo plazo16. Los pacientes inhalaron iloprost una vez al día durante más de 3 años. La mediana de semanas de exposición fue de 15 semanas; 40 pacientes completaron 12 meses de la fase abierta del protocolo tratados con iloprost. La frecuencia de eventos adversos (EA) serios reportados incluyeron falla del VD, 4 (4%) y síncope, 5 (5%). EA: tos, 39 (38.6%); cefalea (29.7%); rubor facial, 27 (26.7%); síndrome gripal, 14 (13.9%); edema periférico, 13 (12.9%); dolor de mandíbula, 12 (11.9%); hipotensión arterial, 11 (10.9%); diarrea, 9(8.9%); vértigo, 7 (6.9%); y otros como taquicardia, disnea, edema periférico, falla renal e insuficiencia cardiaca26.
En el estudio Safety and pilot efficacy Trial in combination with bosentan for Evaluation in Pulmonary arterial hypertension (STEP)39 de terapia combinada a largo plazo donde los pacientes que ya tomaban un antagonista de los receptores de las endotelinas (bosentán) recibieron iloprost-inh, la seguridad fue consistentemente similar al estudio previo de fase 3 en el que los pacientes recibieron Iloprost-inh como monoterapia16. Los EA39 más frecuentes fueron cefalea, vasodilatación facial y dolor de mandíbula. Hubo síncope sin secuelas y no requirieron tratamiento, uno en el grupo con iloprost-inh y 2 en el grupo placebo. Pacientes 5/35 (14%) en el grupo de Iloprost-inh vs. 7/32 (22%) del grupo placebo experimentaron 12 EA serios que incluyeron deterioro de la HP que requirieron hospitalización en 4, falla del VD uno del grupo placebo y uno con anemia por lo cual se les retiró del estudio; en el grupo iloprost-inh hubo cefalea en 2 pacientes, uno requirió salir del estudio, y sangrado rectal en 2.
Del estudio con bajas dosis de iloprost (2.5μg)35 62 pacientes entraron al estudio; fueron retirados del estudio 14 (22.6%) de estos: 8 por deterioro clínico, 4 por cambio de protocolo y 2 se perdieron durante el seguimiento. Trece pacientes tuvieron 29 EA durante el período del estudio. Ocho tuvieron uno o más EA: 10 vasodilatación facial, tos 6, hipotensión arterial sistémica 4, cefalea 4, anorexia 3, distensión abdominal uno y sensación de tensión en el tórax otro. La mayoría de estos EA serios fueron de leves a moderados y generalmente desaparecieron pocos días después del inicio de la inhalación. Sin embargo la anorexia, la distensión abdominal y la sensación de tensión torácica fueron relativamente importantes durante meses y limitados a la inhalación diaria. Ninguno de estos eventos causó el término del estudio. Entre 8 pacientes con deterioro clínico, 4 murieron por falla del VD, 3 tuvieron síntomas de falla del VD por lo que se incrementó la dosis de iloprost o se inició tratamiento combinado, y un paciente requirió trasplante pulmonar.
DesventajaSu desventaja frente a otros medicamentos de la misma clase (análogos de la prostaciclina) como el epoprostenol iv o el treprostinil subcutáneo, es que requiere ser inhalado de manera frecuente para mantener el efecto (6 a 9 veces al día)3–5,10,19–21. Esta desventaja parece disminuida por la menor frecuencia de eventos secundarios18,36.
Iloprost inhalado a largo plazoEn el estudio multicéntrico, doble ciego, aleatorizado, placebo-controlado (AIR)16 fueron aceptados 203 pacientes, clasificados como HAP idiopática, HAP asociada a enfermedades de la colágena e HP tromboembólica crónica. Se les trató con 6-9 inhalaciones diarias de 2.5-5μg/iloprost vs. placebo. Hubo mejoría en la CF y en la caminata de 6min a los 3 meses de tratamiento. En el punto final combinado de deterioro clínico y muerte, el brazo de iloprost tuvo mejores resultados que el grupo placebo. El grupo con HAP idiopática fue el más beneficiado en la caminata de 6min, además no hubo diferencias entre los tipos de HAP para llegar al punto final combinado de acuerdo al modelo de regresión logística.
En el estudio a largo plazo con iloprost39, se incluyeron 63 pacientes diferentes a los del estudio AIR, el tipo de HAP fue diversa, 52 entraron a la fase de largo plazo, y de estos, 36 (69%) completaron los 2 años del estudio. Se encontró beneficio hemodinámico, CF, ejercicio, estabilización de la escala de disnea de Mahler y mejoría de la calidad de vida evaluada a través de la escala visual análoga EuroQoL-VAS. Un 50% del grupo total tuvo EA serios balanceados en ambos brazos, estos fueron tos, vasodilatación, edema periférico, dolor de tórax, cefalea y falla cardiaca derecha. Durante los primeros 3 meses la frecuencia de EA serios fue similar en ambos brazos: 23% iloprost-inh vs. placebo (21%); a los 2 años la frecuencia de EA serios fue de un 57%; los más frecuentes fueron la falla cardiaca derecha, la muerte y la cirugía.
La tasa de supervivencia38 estimada a los 2 años fue del 91.4% (81-100%, IC 95%) para los pacientes con HAP idiopática; para los otros grupos de HAP fue del 61.9% (41-83%, IC 95%).
Con estos 2 trabajos se demostró la eficacia y seguridad del iloprost-inh a corto y largo plazo en pacientes con HAP. Otros estudios han reportado resultados similares. En el estudio monocéntrico40 con 24 pacientes con HAP idiopática, quienes recibieron tratamiento durante 12 meses con iloprost-inh a razón de 100 a 150μg/día, se apreció mejoría hemodinámica y en la caminata de 6min. Estos datos son diferentes a los de otro estudio en el que no se apreció la mejoría hemodinámica en 15/18 pacientes con HAP idiopática41. En el trabajo multicéntrico de Berlín42 que incluyó a 81 pacientes, 64 fueron de HAP idiopática, 59 recibieron tratamiento con iloprost-inh durante más de 24 meses y el principal efecto obtenido fue el mantenimiento de la estabilidad clínica.
En el estudio alemán33 con 19 pacientes con HAP, 12/19 de ellos con HAP idiopática y falla del VD, hubo mejoría inicial, se continuó el tratamiento de 100 a 200μg/día; a los 3 meses hubo mejoría hemodinámica y de la caminata de 6min, 4 pacientes fallecieron (21%). En otro trabajo43 se incluyó a 12 pacientes con HAP, 7/12 de ellos con HP tromboembólica crónica, se les administró iloprost 100-150μg/día y fueron tratados durante 10±5 meses; no se observó mejoría clínica, y la mayoría de los pacientes terminaron tratamiento por deterioro hemodinámico y clínico. De manera retrospectiva44 se estudiaron 37 pacientes con HAP en 11 centros. Se cambiaron de epoprostenol iv o treprostinil subcutáneo a iloprost-inh. Al año, 78.4% permanecían con terapia inhalada y el 81.1% estuvieron libres de deterioro clínico.
Iloprost inhalado en terapia combinadaLa respuesta insuficiente a la monoterapia en HAP es habitualmente la indicación para iniciar la administración de un segundo medicamento. Otra posibilidad tal vez menos utilizada es la de usar 2 fármacos de manera simultánea. No hay una recomendación específica en la literatura de cuándo usar una combinación específica y cuál sería la más idónea. Debido a esto las guías3–5 de tratamiento son cautas en esta recomendación. Por lo tanto, la combinación a utilizar depende del criterio médico y de la disponibilidad de fármacos.
El estudio STEP39 fue el segundo ensayo clínico controlado de tratamiento combinado con prostanoides y el primero que añadió iloprost-inh a tratamiento previo con bosentán en pacientes con HAP. La dosis del iloprost inhalado fue de 5μg/inhalación o placebo. Se incluyeron 67 pacientes, el 55% con HAP idiopática, el 45% con enfermedad sistémica o cardiopatía congénita corregida, el 97% en CF-III; y se les administraron 6 inhalaciones al día durante 12 semanas. El tiempo mínimo en tratamiento con bosentán fue de 4 meses. Al final del estudio los pacientes del grupo iloprost caminaron más, tuvieron mejor CF y parámetros hemodinámicos, y mayor tiempo hasta empeoramiento clínico que los del grupo placebo. Los efectos secundarios atribuibles al iloprost-inh, como el enrojecimiento facial, cefalea y las artralgias, fueron más frecuentes en los pacientes que recibieron iloprost-inh. Sin embargo, no hubo diferencias en cuanto a efectos secundarios y anomalías graves de laboratorio entre ambos grupos. Debido a este estudio, la FDA de los EE. UU. reconoció en el año 2005 esta combinación para el tratamiento de la HAP.
Esta asociación de un prostanoide (iloprost o beraprost) y un antagonista de los receptores de endotelina (bosentán) en otro estudio45 evidenció mejoría en la caminata de 6min a los 3 meses de haberse iniciado el tratamiento combinado. La combinación fue bien tolerada por todos los pacientes. El tratamiento con bosentán añadido a los prostanoides de base proporcionó un incremento en el consumo pico de oxígeno, así como mejoría en el umbral anaeróbico, pulso pico de oxígeno y de la presión arterial sistólica sistémica durante la prueba de ejercicio cardiopulmonar. No se observaron episodios de hipotensión o síncope. Sin embargo, en un ensayo realizado en Alemania46, similar al estudio STEP, en donde se planeó incluir una muestra de 72 pacientes, se finalizó pronto dado que en un análisis intermedio con 40 pacientes no se observaron diferencias entre los 2 grupos.
La combinación de un inhibidor de la fosfodiesterasa 5 (sildenafil oral) y un prostanoide (iloprost-inh) es otra de la que se dispone de información. Para comparar los efectos del iloprost-inh, sildenafil oral o la combinación de ambos47 en los parámetros hemodinámicos pulmonares y sistémicos en pacientes con HP primaria se estudiaron 5 pacientes con HAP idiopática en CF-III o CF-IV; 4 pacientes recibían previamente iloprost-inh durante 2 a 4 años. Los resultados demostraron que: 1. iloprost-inh redujo la PAP-m (p<0.0001), con un descenso posterior a la primera inhalación de 9.6±1.3mmHg, alcanzando un efecto máximo a los 15-30min (−17.1%, p<0.025) y volviendo a los valores basales a los 120min. Iloprost redujo en un 43.8% la RVP (p<0.001) con un consecuente aumento en el GC del 43.6% (p<0.05) y un incremento de la SvcO2. No hubo retorno completo al valor basal de la RVP transcurridos 120min desde su administración. 2. Sildenafil redujo la PAP-m (p<0.01) en 6.4±1.1mmHg (−12.6%, p<0.005) con un efecto máximo tras la primera dosis. Las dosis de sildenafil administradas posteriormente no produjeron una reducción acumulativa en la PAP-m durante el período de observación de 90min. La RVP se redujo en un −21.8% (p<0.03) tras la primera dosis. Tampoco hubo un descenso adicional de la RVP después de las administraciones consecutivas de sildenafil. 3. La combinación de iloprost y sildenafil redujo la PAP-m a 14±1.4mmHg (−24.7%, p=0.02) respecto al valor basal. Los valores de PAP-m continuaron por debajo de los valores basales en 4 pacientes después de 120min de observación (−1,3%). La RVP se redujo en −43% (p<0.02), sin volver a los valores basales a los 120min. El GC aumentó independientemente de la frecuencia cardiaca en un 22.5% (p<0.03) y la SvcO2 aumentó.
El sildenafil redujo de forma constante los valores medios de PAP y RVP, con una mejora adicional después de la inhalación de iloprost. Estos datos sugieren que el iloprost-inh puede ser un adyuvante de un inhibidor de la fosfodiesterasa 5 en el tratamiento de la HP.
Para evaluar la eficacia y la seguridad de sildenafil oral en monoterapia o en combinación con iloprost-inh en el tratamiento de la HP se diseñó un ensayo clínico prospectivo, abierto, comparativo, aleatorizado48, en el que se compararon diversas dosis de sildenafil oral en monoterapia o asociado con iloprost-inh y un grupo control con óxido nítrico. Se estudiaron 30 pacientes, 10/30 con HAP idiopática, 13/30 con HP tromboembólica crónica, y otras diversas, todos ellos en CF-III o CF-IV. Los resultados mostraron que el tratamiento más eficaz con respecto a la potencia vasodilatadora pulmonar fue el de sildenafil 50mg+iloprost 2.8μg, seguido de sildenafil 12.5mg+iloprost 2.8μg, por encima de iloprost o sildenafil 50mg en monoterapia y finalmente sildenafil 12.5mg y óxido nítrico. En comparación con la monoterapia, la combinación de sildenafil e iloprost aumentó la vasodilatación pulmonar, redujo la RVP (p<0.001) y aumentó el índice cardiaco (p<0.001). La reducción máxima de la RVP fue del 44.2% con la dosis de 50mg de sildenafil+iloprost. Los efectos de óxido nítrico desaparecieron en 15min; los de iloprost en monoterapia se mantuvieron durante 60-90min, mientras que con sildenafil oral el efecto alcanzó una meseta a los 45-60min pero persistió a los 120min. El resultado del tratamiento combinado se mantuvo hasta más allá de los 180min. No hubo EA durante el tratamiento combinado. En conclusión, en combinación con iloprost-inh, el sildenafil tiene un efecto hemodinámico sinérgico. Esta combinación consigue una importante vasodilatación pulmonar en pacientes con HAP o tromboembólica crónica.
Estos mismos investigadores49 publicaron posteriormente los resultados clínicos de 14 pacientes en tratamiento con iloprost-inh, en quienes se había comprobado deterioro de la capacidad de ejercicio. Se añadió sildenafil oral al tratamiento, con lo cual mejoró de forma significativa su CF, y esta mejoría se mantuvo al menos por un año. Durante este período hubo 2 muertes por neumonía que no fueron atribuidas al tratamiento.
Se estudiaron 8 pacientes50 con HAP en CF-IV y en falla cardiaca, 4 de ellos candidatos a trasplante pulmonar. Como una alternativa al epoprostenol iv se utilizó la combinación de iloprost-inh y sildenafil. A los 3 meses de tratamiento hubo mejoría en la CF y la caminata de 6min mejoró, de no poder caminar a andar 322±90m. La supervivencia a uno y 5 años fue del 100 y 75% respectivamente. De los candidatos a trasplante pulmonar, a uno se le realizó 6.8 años después y uno murió 1.2 años después de iniciado el tratamiento.
Supervivencia con monoterapia y tratamiento combinadoEn el metaanálisis publicado en 200951 se evaluaron en 18 años (1990-2008) 23 ensayos clínicos aleatorizados, 8 incluyeron fármacos prostanoides y uno iloprost-inh16. La HAP idiopática fue la entidad que más se estudió y predominó la CF-III. El total de pacientes incluidos en este metaanálisis fue de 3,140; la mortalidad global en el grupo con tratamiento fue del 1.54 vs. 3.80% placebo en 14.3 semanas promedio. El riesgo relativo acumulado estimó una reducción del 43% de muerte para el grupo con tratamiento, (p<0.023). Con todo esto se puede concluir que el tratamiento específico con monoterapia con fármacos prostanoides de manera global disminuyó la mortalidad en este grupo de pacientes.
En 201052 se publicó otro metaanálisis donde se identificaron 1,541 trabajos y resúmenes, se aceptaron para análisis 24 artículos con 3,758 pacientes, de los cuales 11 correspondieron a prostanoides (análogos de las prostaciclinas) con 1,404 pacientes. Los datos se agruparon en 3 clases de medicamentos: prostanoides, antagonistas de los receptores de endotelina e inhibidores de la fosfodiesterasa 5. La mortalidad en el brazo control fue del 4.2%, con un tiempo de estudio de 14.9 semanas promedio. Hubo beneficio en cuanto a mortalidad en el grupo de prostanoides (RR 0.49 [IC 0.29 a 0.82]) beneficio que no fue observado con las otras líneas de tratamiento. La reducción de la mortalidad fue del 51% (RR 0.49, IC 0.29 a 0.82). Los 3 tipos de medicamentos tuvieron mejoría clínica y hemodinámica y los EA con prostanoides incluyeron dolor de mandíbula, diarrea, edema periférico, cefalea y náuseas. En conclusión, los prostanoides disminuyeron la mortalidad y mejoraron múltiples eventos clínicos y hemodinámicos.
En 2011 en otro metaanálisis53 se valoró si el tratamiento combinado podría ser al menos igual que el tratamiento con monoterapia. Se incluyeron 6 ensayos clínicos aleatorizados con 729 pacientes con un seguimiento de 12 a 16 semanas. Al comparar el tratamiento de monoterapia con el combinado, este último (no obstante evidenciar un modesto incremento en la caminata de 6min al final del seguimiento) no demostró disminución de la mortalidad, admisiones hospitalarias por deterioro de la HAP, escalar el tratamiento o de la clase funcional. Se menciona la necesidad de más estudios y mejor calidad en los datos.
ConclusionesEl iloprost-inh es un medicamento análogo de la prostaciclina con efecto específico vasodilatador pulmonar de alrededor de 120min posterior a su aplicación.
Además de su uso aceptado para el tratamiento de pacientes con HAP en CF-III y IV, se ha aceptado para el reto farmacológico en el cateterismo cardiaco derecho.
Como monoterapia ha demostrado mejorar la hemodinámica pulmonar, la capacidad de ejercicio y la calidad de vida a corto y largo plazo; junto a otros prostanoides ha impactado con mayor tiempo de supervivencia.
Es posible su uso en combinación con otros fármacos vasodilatadores específicos pulmonares; aunque ha mejorado la evolución clínica del paciente con HAP, no se ha demostrado aún un efecto definido en la supervivencia.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este estudio.
Conflicto de interesesEl Dr. Santos Martínez ha sido invitado por Bayer de México como profesor para iloprost inhalado (Ventavis®) y ribaroxavan (Xarelto®). El Dr. Bojorquez-Guerrero es Gerente Médico del área cardiovascular, de Bayer de México S. A de C.V. DF. México.
El resto de los autores declaran no tener ningún conflicto de intereses.