El sistema cardiovascular es un sistema dinámico cuya función es asegurar un adecuado suministro de oxígeno, nutrientes y hormonas a los tejidos, necesarios para el metabolismo celular, además sintetiza y modifican los componentes vasoactivos los cuales regulan el tono vascular y la función miocárdica. Estos componentes vasoactivos son fundamentales en el manejo del paciente pediátrico en estado crítico con falla cardiaca y choque en los cuales se ha comprobado sus efectos benéficos, sin embargo, su uso y abuso trae consigo efectos nocivos, tales como mayor riesgo de arritmias, aumento el consumo miocárdico de oxígeno lo cual podría favorecer la presencia de isquemia. Por lo tanto, es preciso conocer el mecanismo de acción de los distintos tipos de agentes vasoactivos, así como las indicaciones de dichos fármacos para minimizar dichos efectos. El propósito de esta revisión es describir la farmacología y las aplicaciones clínicas de los agentes inotrópicos y Vasopresores en el paciente pediátrico en estado crítico.
The cardiovascular system is a dynamic system, which is required to ensure adequate delivery of oxygen, nutrients, and hormones to the tissues that are necessary for cell metabolism. It also synthesises and modifies the vasoactive components that regulate vascular tone and myocardial function. These vasoactive components have demonstrated their beneficial effects in the management of paediatric patients in a critical condition with heart failure and shock. However, their use and abuse brings harmful effects, increases mortality, and is associated with arrhythmias. An increase in myocardial oxygen consumption favours the presence of ischaemia, therefore it is necessary to know the mechanism of action and indications of these drugs to minimise their harmful effects. The purpose of this review is to describe the pharmacology and clinical applications of inotropic and vasopressor agents in the paediatric patient in acritical condition.
El estado de choque es la expresión clínica de insuficiencia circulatoria que da como resultado una inadecuada entrega de oxígeno celular, es una condición común en las unidades de cuidados críticos, afectando alrededor de un tercio de los pacientes ingresados. El diagnóstico de choque se basa en datos clínicos, hemodinámicos y bioquímicos. Una mnemotecnia útil para describir los componentes importantes de la reanimación es la regla VIP, por sus siglas en inglés (ventilate, infusion and pump administration); ventile (administración de oxígeno), infundir (reposición de líquidos), y pump (bomba) administración de agentes vasoactivos1.
En el manejo del paciente con choque tratamos de manipular el gasto cardiaco (GC) y las resistencias vasculares sistémicas (RVS). Cuando existe un predominio de hipoperfusión secundario a elevación de RVS hablamos de choque frío, cuando la clínica es de vasodilatación por disminución de las RVS hablamos de choque caliente, ambos pueden tener o no alteraciones en el GC1.
Las respuestas compensatorias del niño a los estados de precarga ventricular disminuida, alteración de la contractilidad miocárdica y alteraciones en el tono vascular difieren de las del adulto. En el paciente pediátrico, el GC es expresado con el término de índice cardiaco (IC) que se expresa como GC por metro cuadrado de superficie corporal. En el niño, el IC es principalmente dependiente de frecuencia cardiaca y no de volumen sistólico, esto es debido a la menor masa muscular del ventrículo izquierdo en el niño. La taquicardia es la principal respuesta compensadora para mantener un adecuado IC en condiciones de disminución de la precarga. Por lo tanto, en los pacientes pediátricos, la presión arterial (PA) no es un buen indicador de la homeostasis cardiovascular y solo nos orienta para clasificar al choque en compensado y descompensado. Por ello, la evaluación de la frecuencia cardiaca y de la perfusión de los órganos diana, incluyendo el llenado capilar, la calidad de los pulsos periféricos, el gasto urinario y el estado ácido-base, es más confiables que la PA para determinar el estado circulatorio de un niño2. De igual forma la hiperlactatemia es un indicador objetivo de la situación funcional del sistema circulatorio.
Existen criterios diversos sobre ¿Qué medicamentos vasoactivos utilizar?, ¿En qué paciente?, ¿Cuándo? y ¿Con qué dosis iniciar? así como la forma de determinar la graduación del fármaco y los parámetros a monitorizar. La mayoría de las veces se manejan en base al razonamiento basado en la experiencia más que en la evidencia 1–6.
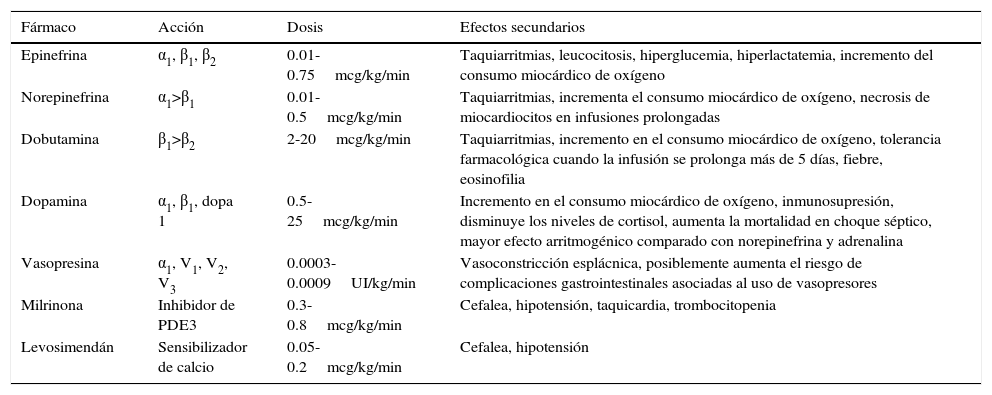
Los vasopresores inducen vasoconstricción periférica, aumentando las RVS y por consiguiente incrementan la PA media (PAM). Los inotrópicos aumentan la contractilidad cardiaca, incrementando el IC y la PAM. Algunos agentes se caracterizan por producir solo una de estas acciones, mientras que otros tienen múltiples efectos4–6 (tabla 1).
Vasopresores e inotrópicos
| Fármaco | Acción | Dosis | Efectos secundarios |
|---|---|---|---|
| Epinefrina | α1, β1, β2 | 0.01-0.75mcg/kg/min | Taquiarritmias, leucocitosis, hiperglucemia, hiperlactatemia, incremento del consumo miocárdico de oxígeno |
| Norepinefrina | α1>β1 | 0.01-0.5mcg/kg/min | Taquiarritmias, incrementa el consumo miocárdico de oxígeno, necrosis de miocardiocitos en infusiones prolongadas |
| Dobutamina | β1>β2 | 2-20mcg/kg/min | Taquiarritmias, incremento en el consumo miocárdico de oxígeno, tolerancia farmacológica cuando la infusión se prolonga más de 5 días, fiebre, eosinofilia |
| Dopamina | α1, β1, dopa 1 | 0.5-25mcg/kg/min | Incremento en el consumo miocárdico de oxígeno, inmunosupresión, disminuye los niveles de cortisol, aumenta la mortalidad en choque séptico, mayor efecto arritmogénico comparado con norepinefrina y adrenalina |
| Vasopresina | α1, V1, V2, V3 | 0.0003-0.0009UI/kg/min | Vasoconstricción esplácnica, posiblemente aumenta el riesgo de complicaciones gastrointestinales asociadas al uso de vasopresores |
| Milrinona | Inhibidor de PDE3 | 0.3-0.8mcg/kg/min | Cefalea, hipotensión, taquicardia, trombocitopenia |
| Levosimendán | Sensibilizador de calcio | 0.05-0.2mcg/kg/min | Cefalea, hipotensión |
El uso de fármacos inotrópicos positivos ha estado plagado de serias preocupaciones con respecto a una mayor morbimortalidad. Los problemas incluyen el aumento en el riesgo de arritmias, isquemia miocárdica y en algunos casos hipotensión2–6. El uso a corto plazo de los fármacos inotrópicos positivos intravenosos tiene un papel terapéutico claro en pacientes hospitalizados con insuficiencia cardiaca sistólica aguda, donde la hipoperfusión de órganos vitales es evidente y la necesidad de mejorar la perfusión es inmediata. El uso adicional de agentes inotrópicos no debe basarse en parámetros hemodinámicos por sí solos, sino en la condición clínica del paciente3–6.
Cuando la hipoperfusión se manifiesta por una disminución de la saturación de oxígeno en sangre venosa mixta (SVO2), esta medida puede ser utilizada como una guía para la adecuación del tratamiento inotrópico, excepto en pacientes con cardiopatía congénita con cortocircuito de izquierda a derecha en los cuales la SVO2 es considerablemente mayor. Del mismo modo, una caída en la concentración de lactato sérico concomitante con la mejoría en la perfusión periférica es un signo de buen pronóstico e indica mejoría del IC7.
La comprensión de la fisiopatología del choque así como de las acciones y limitaciones de los agentes vasoactivos puede ayudar al médico para adaptar el tratamiento a las condiciones específicas de cada paciente8.
No existe un régimen de dosificación estándar para agentes inotrópicos y hay una considerable variabilidad en la práctica clínica. la adrenalina, la noradrenalina y la dobutamina son probablemente los agentes más comúnmente usados1–8. Varios ensayos clínicos han explorado el uso de objetivos hemodinámicos específicos, tales como el IC, disponibilidad de oxígeno y SVO2 también llamada reserva venosa central7–9. El uso de tales objetivos puede ser eficaz en las primeras etapas de la reanimación de pacientes con choque10; sin embargo, una vez lograda la estabilidad del paciente se debe ser muy juicioso respecto a dichos objetivos de acuerdo a la condición clínica del paciente, ya que la búsqueda agresiva de estos objetivos en los pacientes que no responden de manera adecuada ha demostrado ser deletérea y aumenta el riesgo de efectos secundarios asociados a catecolaminas6,11,12.
Uno de los inconvenientes principales del uso de fármacos inotrópicos y vasopresores son los errores en la dosificación; los pacientes pediátricos tienen un mayor riesgo de errores de medicación, especialmente con infusiones continuas utilizadas en áreas críticas. La determinación del tiempo, el tipo y la cantidad de vasopresores o inotrópicos debe ajustarse y valorarse según la necesidad individual del paciente10,13.
Es importante destacar que los objetivos de la PAM siempre deben ser individualizados y basados en marcadores de perfusión clínicamente relevantes, tales como el gasto urinario, el estado mental, la perfusión de la piel y el aclaramiento de lactato sérico14.
Receptores adrenérgicosReceptores alfaLa estimulación del receptor α1 ejerce su efecto primario sobre el músculo liso, ocasionando constricción. La actividad α1 se ha relacionado con aumento en la contractilidad cardiaca, aunque los mecanismos exactos de estas actividades no están claros15,16. La estimulación de los receptores α2 presinápticos produce retroalimentación negativa, mientras que la estimulación de los receptores postsinápticos α2 provoca vasodilatación por la producción de óxido nítrico endotelial12,17. Se ha entendido que esta actividad mixta de los receptores alfa ayuda a mantener el balance de la perfusión, particularmente en la circulación coronaria18 (tabla 1).
Receptores betaEl agonismo β1 es casi exclusivo en corazón y produce aumento de la frecuencia cardiaca y la contractilidad, originando un mejor rendimiento cardiaco. Por tanto desencadena un efecto inotrópico, cronotrópico, batmotrópico y un aumento en el automatismo, este último muy relacionado con el efecto arritmogénico de las catecolaminas 19. El principal objetivo que perseguimos al estimular este receptor es aumentar el volumen sistólico como resultado de un incremento en la contractilidad del músculo cardiaco (efecto inotrópico). La estimulación del receptor β2 causa relajación de músculo liso. Por lo tanto, en arterias coronarias, arterias de los órganos viscerales y arterias del músculo esquelético la activación β2 produce vasodilatación. Adicionalmente, la estimulación β2 produce un efecto cronotrópico ligero y mejora el inotropismo8,12.
Receptores dopaminérgicosSe han identificado más de 7 subtipos de receptores de dopamina20. Aproximadamente el 50% del efecto inotrópico de la dopamina se debe a la estimulación de los receptores D2; asimismo estos receptores producen liberación de norepinefrina (NE) de las terminales nerviosas simpáticas21. En el riñón, la dopamina estimula los receptores D1 para estimular la diuresis y natriuresis, dichos efectos son bastante controvertidos y cuestionados. En la arteria pulmonar los subtipos D1, D2, D4, D5 producen vasodilatación20,21.
Receptores de vasopresinaEstán comúnmente clasificados en V1 vascular, V2 renal, V3 hipofisario, oxitócicos y P2 purinérgicos. Los receptores purinérgicos P2 están localizados en el endotelio cardiaco y pulmonar, y podrían tener una acción en la contractilidad cardiaca y en la vasodilatación coronaria, pulmonar y cerebral 8,22 (tabla 1).
EpinefrinaLa epinefrina ejerce sus efectos cardiovasculares mediante la estimulación de los receptores alfa y betaadrenérgicos dependiente de la dosis. Los efectos hemodinámicos de la estimulación de los receptores α2 son menos prominentes. Los efectos hemodinámicos netos de la administración de epinefrina son el aumento significativo en la PA y el flujo sanguíneo sistémico causado por el aumento de las RVS y el IC mediado por agonismo β17.
Puede ser administrada inicialmente a una dosis de 0.02μg/kg/min hasta 1μg/kg/min, idealmente por vía venosa central, su indicación es principalmente en choque hipodinámico es decir bajo GC con RVS altas1,16. Dependiendo de la dosis administrada puede producir efectos variables, a bajas dosis (generalmente<0,3μg/kg/min), estimula principalmente los receptores adrenérgicos β1 y β2, resultando en aumento en la frecuencia cardiaca e induciendo vasodilatación en músculo esquelético y lechos vasculares cutáneos7; de igual forma ha mostrado un incremento en el IC que va del 24% al 54% con aumento consecuentemente en el consumo miocárdico de oxígeno8,23. En dosis altas idealmente>0.3μg/kg/min activa receptores adrenérgicos α1 ocasionando aumento de RVS. Como se mencionó anteriormente en pacientes con RVS elevadas, la epinefrina puede ser administrada por su efecto vasodilatador13,24,25. Los efectos metabólicos incluyen elevación de las concentraciones de glucosa en plasma principalmente por agonismo β2 en hígado y de lactato, probablemente es debido al aumento del metabolismo celular3,7. El aumento de lactato en suero es de importancia clínica ya que este se utiliza en el paciente crítico como un marcador de hipoperfusión tisular. Sin embargo, el incremento del lactato en suero inducido por las catecolaminas exógenas no parece tener ningún efecto nocivo. No obstante, se recomienda su estrecha monitorización ya que de manera inicial este se elevará si se infunde epinefrina12,13. Las principales limitaciones de la epinefrina son su potencial arritmogénico7, el riesgo de desarrollar isquemia miocárdica y una profunda vasoconstricción esplácnica que puede causar isquemia de órganos abdominales7,8. La epinefrina puede aumentar la PA en pacientes que no responden a los agentes tradicionales. Se ha considerado un agente de segunda línea cuyo uso debe ser considerado en pacientes que no responden a terapia vasopresora inicial1,7. De igual forma se ha referido que aumenta la resistencia vascular pulmonar y, por lo tanto, la poscarga del ventrículo derecho12. La epinefrina es aproximadamente 100 veces más potente como inotrópico que la dobutamina o la dopamina, Después de la cirugía cardiaca, la adrenalina en dosis bajas (0.03-0.1μg/kg/min) incrementa de manera efectiva la SVO2, el IC y la PAM con menos efecto taquicardizante que la dobutamina (5μg/kg/min)26. Además es más útil como inotrópico en pacientes hipotensos y libres de isquemia miocárdica, especialmente después de cirugía cardiovascular. Las dosis más altas de epinefrina (>0.3μg/kg/min) producen vasoconstricción por agonismo α1. El potente efecto vasopresor e inotrópico de la epinefrina es similar a la combinación de NE más dobutamina27. En choque séptico la epinefrina es un vasopresor altamente eficaz considerado generalmente de segunda línea debido a sus efectos metabólicos.Para dosis refractaria de epinefrina, dosis>0.3-0.5μg/kg/min se consideran altas, pero no hay una dosis máxima definida para choque refractario16,28.
NorepinefrinaLa NE es el principal neurotransmisor simpático posganglionar. Los potentes efectos vasoconstrictores actúan aumentando el retorno venoso y mejorando la precarga ventricular derecha, sin embargo al aumentar las RVS se incrementa la poscarga ventricular izquierda comprometiendo la función cardiaca en pacientes con disfunción miocárdica. La vasoconstricción inicial de la NE es vista principalmente como un aumento desproporcionado de la PA sistólica sobre la presión diastólica que puede conducir a una bradicardia refleja1,29.
En dosis bajas (0.01μg/kg/min), la NE estimula los receptores betaadrenérgicos. En las dosis clínicas habituales (0.1μg/kg/min), la NE estimula los receptores alfa que promueven vasoconstricción. Se ha observado en modelos animales que la NE tiene un impacto negativo en los lechos vasculares pulmonares, produciendo vasoconstricción, y por lo tanto, puede potenciar los cuadros de hipertensión pulmonar particularmente importante en el postoperatorio de cirugía cardiovascular; sin embargo estos efectos son similares a los observados con la adrenalina6,8. La NE aumenta la demanda miocárdica de oxígeno y ha demostrado ser más eficaz para mejorar la PA en pacientes con choque séptico; de igual forma se ha demostrado beneficios en la mortalidad con respecto a otros agentes como la dopamina1,30. En gran medida se ha adoptado como el agente de primera elección para el soporte hemodinámico en todos los tipos de choque hipotensivo1,16. En un servicio de urgencias, la NE debe ser el agente de elección para el tratamiento de la hipotensión asociada a la sepsis8. Los efectos vasoconstrictores de la NE pueden tener efectos perjudiciales sobre la hemodinamia renal en pacientes con hipotensión e hipovolemia, con el riesgo potencial de isquemia renal. De igual manera a dosis altas>1μg/kg/min puede ocasionar necrosis distal7.
Debido a la escasez relativa de los adrenoceptores vasculares cerebrales, altas dosis de NE pueden utilizarse con seguridad para mantener la presión de perfusión cerebral sin comprometer significativamente el flujo de la circulación cerebral. Sin embargo se ha relacionado la NE con una disminución del flujo pulmonar, cutáneo, renal y esplácnico. La NE no causa aumento de lactato en suero12,13. Como se mencionó anteriormente, la NE puede reducir el IC por su efecto vasoconstrictor y aumento de la poscarga que puede ser deletéreo en pacientes con disfunción cardiaca. Para criterios de refractariedad, dosis>0.5μg/kg/min se considera alta, pero no hay una dosis de NE máxima para definir choque refractario. Las guías actuales recomiendan la combinación de NE y dobutamina para el choque cardiogénico en lugar de dopamina16,31.
MilrinonaEs un inhibidor selectivo de la fosfodiesterasa 3 (PDE3); la PDE3 es una enzima intracelular asociada con el retículo sarcoplásmico en los miocitos y células del músculo liso donde convierte el AMPc en AMP. Los inhibidores de la PDE3 aumentan el nivel de AMPc al inhibir esta conversión celular, con el incremento de la contractilidad. En comparación con otros inotrópicos como la dopamina, la dobutamina y la adrenalina, la milrinona no se asocia con incremento en el consumo miocárdico de oxígeno32. Estos agentes son potentes inotrópicos y vasodilatadores, además mejoran la relajación diastólica (lusitropismo), por lo que mejora la precarga y poscarga del ventrículo derecho así como reduce las RVS por su efecto vasodilatador33. Un lusitrópico es una sustancia que incrementa el tiempo de la relajación miocárdica. Las propiedades lusitrópicas se producen al reducir las concentraciones de calcio intracelular en el retículo sarcoplásmico al promover la disociación de calcio de la troponina C durante la diástole3.
La milrinona fue introducida en la edad pediátrica con indicación en posquirúrgicos de cirugía cardiaca para tratar el síndrome de bajo GC (SBGC) posbomba de circulación extracorpórea. Por lo tanto, su uso en pediatría es relativamente reciente; en los pacientes neonatos los datos son limitados, sin embargo existen estudios donde se evalúan los efectos de esta, para prevenir el SBGC en recién nacidos pretérmino, como el estudio realizado por Paradisis et al., donde valoraron dicho efecto en prematuros extremos sin observar que la milrinona pudiera prevenir el SBGC en las primeras 24h de vida, pero tampoco se observaron efectos adversos34. El-Khuffash et al.35 estudiaron el uso de la milrinona en las primeras horas después de la ligadura del conducto arterioso para mejorar la disfunción miocárdica posterior al procedimiento, encontrando que las propiedades lusitrópicas e inotrópicas de milrinona benefician a este tipo de pacientes. Recientemente, la milrinona se ha empezado a utilizar en unidades de cuidados intensivos neonatales como manejo de la hipertensión pulmonar persistente, esto gracias a las propiedades de vasodilatación pulmonar que presenta, ya que al actuar sobre el AMPc puede reducir la presión pulmonar por mecanismos de vasodilatación y, además, mejorar la función ventricular derecha6,36. En cuanto a la seguridad el fármaco en este grupo de edad, se ha encontrado que la hipotensión y la trombocitopenia son los efectos adversos más frecuentemente reportados, sin embargo solo se presentaron en el 0.2% de los pacientes. Por lo que se concluye que la milrinona es segura en este grupo de edad36,37.
En choque séptico, el uso de inhibidores de la fosfodiesterasa, al incrementar el AMPc presentan un efecto inotrópico independiente de los receptores betaadrenérgicos, por lo en estudios recientes se indica que tiene propiedades benéficas al disminuir la sensibilidad adrenérgica miocárdica en choque séptico36,37, ya que se ha observado que el acúmulo intracelular de AMPc afecta una cadena similar de eventos en tejido vascular y cardiaco que se observan en la estimulación adrenérgica8. Existen estudios donde se refiere que la milrinona en pacientes con choque séptico debe utilizarse con precaución por el riesgo de exacerbar la hipotensión7. Los pacientes que presentan bajo gasto y RVS elevadas pueden mantener una presión media adecuada posterior al uso de milrinona, sin embargo, otros pacientes con RVS bajas o hipovolemia pueden presentar hipotensión, siendo la milrinona subóptima para muchos pacientes con choque y por lo tanto debe individualizarse su uso38–40. Como se mencionó previamente, el inicio de la utilización de milrinona en paciente pediátricos fue en choque cardiogénico, principalmente en pacientes posquirúrgicos de cirugía cardiovascular, ya que se ha observado que disminuye el riesgo de SBGC41,42. Smith et al. refieren que el uso de milrinona ayuda a mejorar la disfunción diastólica y ocasiona vasodilatación sin afectar el consumo de oxígeno en pacientes posquirúrgicos de corazón42. Hoffman et al. encontraron que el SBGC en posquirúrgicos de cirugía cardiaca afecta aproximadamente al 25% de los pacientes, y evaluaron el uso de milrinona profiláctica para pacientes posquirúrgicos de cirugía cardiaca, donde se encuentra que se puede reducir hasta el 64% del riesgo en el desarrollo de SBGC con el uso profiláctico de la milrinona43. Sin embargo, Burkhard et al. en su revisión de Cochrane donde valoran el uso profiláctico de la milrinona para prevención del SBGC en cirugía de cardiopatías congénitas concluyeron que la evidencia actual es insuficiente para valorar el efecto de la milrinona como prevención en mortalidad y SBGC; solo se ha observado que disminuye la aparición de este síndrome en el periodo posoperatorio inmediato comparado con el placebo44,45. En cuanto a los efectos adversos se encontró que la hipotensión, la trombocitopenia y las arritmias que se han reportado en pacientes adultos ocurren infrecuentemente en pediatría43. Smith et al. estudiaron la correlación entre la milrinona y taquiarritmias posquirúrgicas y encontraron una incidencia de arritmias hasta en un 50% más; comúnmente taquicardia ventricular monomórfica en un 12%, seguida de taquicardia ectópica de la unión (Juntional Ectopic Tachycardia o JET por sus siglas en ingles) en un 10%, concluyendo que la milrinona es un factor de riesgo independiente para taquiarritmias clínicamente significativas en el periodo postoperatorio temprano de cirugía cardiaca46. Lee et al. encontraron una frecuencia de arritmias en el 0.4% de los pacientes posquirúrgicos de cirugía cardiovascular y hasta un 10% en pacientes con algún tipo de miocardiopatía; dichas arritmias fueron principalmente ventriculares. El desarrollo de trombocitopenia se presentó en el 0.5% de los casos y la mayoría de los casos fueron pacientes con un tiempo de bomba incrementado. Se concluye que la milrinona es eficaz y segura en pacientes pediátricos; sin embargo se debe monitorizar la aparición de arritmias principalmente en pacientes que tienen algún factor de riesgo para la aparición de las mismas45. La milrinona puede utilizarse en dosis de carga de 50-75μg/kg por vía intravenosa para 15-60min; pudiendo disminuir la dosis de carga hasta 25μg/kg en pacientes con alto riesgo de hipotensión. Inmediatamente después de la dosis de carga se recomienda iniciar infusión continua a 0.375-0.75μg/kg/minuto47,48. No se recomienda realizar infusión de milrinona con furosemida ya que resulta en formación de precipitados47. El aclaramiento de la creatinina es mayor en pacientes pediátricos que en adultos (2ml/kg). Sin embargo el aclaramiento en los neonatos está disminuido en comparación con los niños mayores en aproximadamente un 25% por lo que el volumen de milrinona es mayor en los pacientes neonatos que en los adultos (0.3ml/kg)49. Como resultado de esta disminución del aclaramiento en los pacientes pequeños, la infusión debe ser menor para mantener la concentración plasmática, por lo que se recomienda que la infusión en neonatos sea de 0.2μg/kg/min49.
LevosimendanEs un fármaco de uso relativamente reciente y su aplicación es principalmente en falla cardiaca. Tiene 2 efectos en el cardiomiocito: es un sensibilizador de calcio y abre los canales dependientes de K+ con lo cual tiene un efecto inotrópico positivo, lusitrópico, vasodilatador (sistémico, pulmonar y coronario), además de un efecto cardioprotector50. Actúa uniéndose a la troponina C, resultando en un incremento en la afinidad por el calcio y la subsecuente sensibilización, lo que origina un incremento en el inotropismo; al igual que otros fármacos inotrópicos, con dosis terapéuticas, el levosimendán mejora la contractilidad miocárdica sin incrementar el consumo de oxígeno o aumento en las concentraciones de calcio o AMPc intracelular51.
El levosimendán origina metabolitos que se eliminan lentamente; el OR-1896 se ha descrito como su principal metabolito activo, es el principal determinante de los efectos cardiovasculares que se presentan tras suspender la infusión del fármaco49. Principalmente muestra efectos de vasodilatación sobre arterias y venas, gracias a la apertura de canales de ATP sensibles a K+ y otros canales de K+, resultando en hiperpolarización y relajación del músculo liso vascular. Clínicamente, el levosimendán y el OR-1896 produce vasodilatación (sistémica, pulmonar y coronaria) así como vasodilatación venosa (portal y safena)52. Además del efecto inotrópico y vasodilatador, el levosimendán demuestra efecto lusitrópico positivo, con disminución de la presión de llenado ventricular y mejora en la función diastólica en el ventrículo derecho e izquierdo49. Además, varios estudios, han demostrado que el levosimendán puede inducir un incremento moderado del calcio intracelular por vía de la inhibición de la fosfodiesterasa pero no en concentraciones terapéuticas53. El efecto inotrópico del levosimendán es resultado de un fortalecimiento de la contracción miocárdica sin incrementar la demanda de oxígeno, el AMPc intracelular o las concentraciones de calcio intracelular en dosis clínicamente relevantes53. La contracción del músculo cardiaco es facilitada por interacciones dependientes de calcio entre la troponina i y la troponina C, además de la hidrólisis de ATP a ADP. La troponina C tiene 4 sitios de unión al Ca++, 2 N-terminal y 2 C-terminal, sin embargo, el dominio N-terminal es el sitio donde se permite el acortamiento de los miofilamentos54. El levosimendán liga el dominio regulador de Ca++ con troponina C, en una forma dependiente de calcio, el cual se produce significativamente más débil durante la diástole cuando los niveles de calcio intracelular son bajos y por lo tanto conduce a un efecto inotrópico positivo. Por sus propiedades de relajación, mejora la función diastólica del ventrículo izquierdo resultando en un aumento en su contractilidad55. Cabe mencionar que este efecto inotrópico positivo es obtenido sin afectar la relajación ventricular o incrementar el consumo de oxígeno miocárdico. El metabolito OR-1896 muestra efectos hemodinámicos similares por la vía de sensibilización de calcio, pero las interacciones con la troponina C no se han demostrado aún56. También se reporta un efecto cardioprotector al inducir vasodilatación coronaria y por lo tanto mejorando la perfusión miocárdica49. El levosimendán induce un incremento del flujo de potasio y por lo tanto previene la sobrecarga de calcio mitocondrial. De esta forma, el fármaco estabiliza el potencial de membrana mitocondrial y preserva los fosfatos de alta energía, además de la función mitocondrial por la vía de regulación del volumen matriz57. Estudios experimentales indican que el levosimendán, a través de la apertura de los canales de K+ (ATP), ejerce efectos cardioprotectores ya que esto trae consigo propiedades antiapoptóticas58,59. Esto se ha propuesto como mecanismo biológico para disminuir el daño citotóxico y las consecuencias hemodinámicas de la respuesta oxidativa anormal como respuesta en la falla cardiaca aguda58. Los efectos protectores del levosimendán no solo se restringen al corazón, las propiedades específicas del levosimendán asociadas a la modificación en la presión sanguínea regional y el GC inducidos por este quizá sean producidas por la modulación de funciones de otros órganos. Uno de los efectos que se ha estudiado actualmente son las propiedades neuroprotectoras del levosimendán en pacientes con daño cerebral traumático60. Rohel et al. estudiaron el hipocampo de ratones con trauma mecánico; encontraron que el levosimendán representa una nueva promesa farmacológica como neuroprotector después de un daño cerebral, observando una reducción significativa, dosis-dependiente, tanto de la lesión primaria como de la secundaria en células tratadas con dicho fármaco a dosis de 0.01-0.1μg/kg/min. Sin embargo, estos hallazgos no han sido estudiados en humanos60. En cuanto al uso de levosimendán en pacientes pediátricos, al ser un fármaco relativamente nuevo sus usos en este grupo son limitados. Los primeros usos del levosimendán los observamos en los pacientes posquirúrgicos de cirugía cardiaca.
El uso del levosimendán en pacientes neonatos ha sido valorado en cirugía cardiaca y se concluye que el levosimendán es bien tolerado y seguro en neonatos críticamente enfermos, pudiendo tener mayores ventajas que la milrinona61. Ricci et al. observan una disminución significativa de los valores de lactato, además de una disminución en la incidencia del SBGC en neonatos operados de cirugía cardiaca con buena tolerancia al fármaco62. En población pediátrica el levosimendán es eficaz y seguro con mayor estabilidad hemodinámica en pacientes tratados con dicho fármaco comparados con la dobutamina o la milrinona63. En falla cardiaca crónica, las opciones de tratamiento son limitadas. Se ha estudiado el uso del levosimendán en este grupo de pacientes y se ha observado que es seguro en niños con falla cardiaca en estadio final o agudo, produciendo mejoría en el trabajo miocárdico64,65. En cuanto al choque séptico, el levosimendán, según las guías internacionales es un agente de segunda línea. Por lo tanto, los estudios en este grupo son sumamente limitados. Papoff et al. describen la mejoría de la contractilidad miocárdica, la perfusión tisular, la reducción de niveles de lactato y el incremento del gasto urinario en pacientes pediátricos con choque séptico66. Como se mencionó previamente, la evidencia que apoya el uso de levosimendán en pacientes pediátricos es limitada, sin embargo, sabemos cada vez más que existen, durante la sepsis, cambios morfológicos miocárdicos resultando en dilatación biventricular y reducción de la fracción de eyección. Además la disfunción del ventrículo izquierdo puede ocurrir aproximadamente en el 50% de los pacientes con choque séptico en las primeras 48h y se asocia con alta mortalidad67–70. El levosimendán no incrementa el consumo de oxígeno, mejorando la respuesta inflamatoria, y puede inhibir la apoptosis en pacientes con choque67,71. La dosis del levosimendán usualmente utilizada en pacientes pediátricos es por vía intravenosa a dosis de 6-12μg/kg/min como dosis de carga para 10min seguidos de una dosis de 0.05-0.2μg/kg/min como infusión continua. La respuesta hemodinámica generalmente se observa a los 5min de empezar la infusión de la dosis de carga. El pico de acción se observa entre los 10-30min de la infusión; la duración de acción es alrededor de 75h a una semana y sus metabolitos pueden prolongar sus efectos por un tiempo relativamente más largo. En caso de falla renal o hepática no se requiere ajustar la dosis72.
DobutaminaLa dobutamina fue introducida aproximadamente en los 70 como una nueva catecolamina sintética y con administración intravenosa, la cual presenta un efecto directo sobre los receptores adrenérgicos β1 y β2 sin propiedades vasoconstrictoras y con menos efecto taquicardizante73. Está compuesta por un átomo de carbono asimétrico, por lo tanto dicho fármaco presenta 2 isómeros con distinta afinidad para receptores adrenérgicos73. El isómero negativo es primariamente un receptor α1 agonista, incrementando la contractilidad miocárdica y las RVS. El isómero positivo es un receptor agonista β1 y β2 causando incremento de la contractilidad miocárdica, frecuencia cardiaca y la velocidad de conducción, además de que disminuye las RVS. Adicionalmente, el efecto de la dobutamina es un 50% del isómero positivo y del negativo, los efectos totales de su administración terminan en un incremento de la contractilidad miocárdica y, en menor grado, frecuencia cardiaca y ningún efecto o disminución sobre las RVS. El efecto mixto en los receptores betaadrenérgicos presenta un efecto de unión con un rango 3:1 en los receptores β1:β2 respectivamente12. La dobutamina es ampliamente utilizada en el paciente pediátrico, incluso en el periodo neonatal. Durante el desarrollo cardiovascular temprano, la expresión de los receptores alfaadrenérgicos se encuentra suprarregulada hasta la maduración completa de los receptores betaadrenérgicos12,74; es por ello que en los neonatos pretérminos es más probable que la respuesta a la dobutamina sea con ligera disminución en las RVS y con ello un mayor incremento en la presión sanguínea comparado con los neonatos a término. Sin embargo, no existen estudios sistemáticos dosis-respuesta comparando el efecto de la dobutamina en los recién nacidos pretérmino y los recién nacidos a término12. Los efectos cardiovasculares de la dobutamina son dosis-dependientes; a muy bajas dosis (2.5μg/kg/min) no tiene efectos hemodinámicos significativos en neonatos con compromiso cardiovascular75. Sin embargo, las dosis moderadas (5-7.5μg/kg/min) conducen a incrementos del IC, mientras que las dosis altas (7.5-20μg/kg/min) incrementan el IC y la PA en pacientes neonatos hipotensos76. En general, la dobutamina es más efectiva que la dopamina en incrementar el IC en neonatos con disfunción miocárdica; cabe destacar que altas dosis de dobutamina pueden conducir a una disminución en la distensibilidad miocárdica pudiendo afectar el llenado ventricular especialmente en pacientes con miocardiopatía hipertrófica12. Una de las principales causas de disfunción miocárdica en neonatos es ocasionada por asfixia perinatal; en los neonatos muy prematuros se ocasiona por disminución en el flujo sistémico y vasoconstricción durante el periodo transicional; la dobutamina ocasiona incremento en el flujo sanguíneo de órganos así como un aumento en la PA mediada por incremento del IC.
En los pacientes neonatos que presentan disminución de las RVS (vasodilatación) como causa dominante de la afectación hemodinámica, la dobutamina no es el fármaco de primera elección pues podría agravar la vasodilatación77. La dobutamina puede producir hipotensión por vasodilatación, pero la severidad e importancia de estos efectos varían extensamente entre los pacientes. Además, puede causar efectos adversos incluyendo eosinofilia y fiebre6,78,79. El uso de dobutamina en pacientes pediátricos con choque séptico se encuentra ampliamente descrito en la literatura, reportándose un incremento en el IC izquierdo del 23-58% con dosis de dobutamina que van de 5 a 12μg/kg/min. Además, se han observado incrementos similares del IC derecho80–82. En las guías de la campaña Sobreviviendo a la sepsis, desde el 201283,84 se recomienda la dobutamina como inotrópico de primera línea con o sin vasopresor. Los pacientes con choque séptico pueden permanecer con hipotensión a pesar de la resucitación con líquidos, pudiendo el IC estar bajo, normal o incrementado. Es por ello que la dobutamina está indicada en estos pacientes la mayoría en combinación con un agente vasoconstrictor12,85. En lo que respecta al uso de la dobutamina en pacientes con falla cardiaca, existen múltiples estudios donde se reporta sus efectos benéficos, gracias a las propiedades como inotrópico, sin embargo los efectos a largo plazo sobre la mortalidad se han cuestionado en este grupo de pacientes19.
DopaminaLa dopamina es un neurotransmisor central y precursor inmediato de NE en la vía de síntesis de catecolaminas endógenas14, además con múltiples efectos clínicos importantes.
La introducción de la dopamina en la práctica médica inicia en los 70 como parte del manejo de choque séptico6. Existen 7 subtipos de receptores dopaminérgicos20,86. Clásicamente se dividen en 2 grupos: D1 (subtipos DR1 y DR5) y D2 (subtipos DR2, DR3 y DR4). Todos estos subtipos se han identificado en el riñón donde son mediadores de natriuresis y diuresis. Los receptores dopaminérgicos DR1 y DR4 muestran sobre todo efecto inotrópico, sin embargo es menor en comparación con los betaadrenorreceptores6. También se han identificado en la médula adrenal, ganglio autonómico, endotelio y vasculatura renal y esplácnica, donde se localizan tanto pre- (D2) y postsinápticos (D1 y D2). Los receptores D1 se localizan en la vasculatura media ocasionando vasodilatación. Los receptores D2 pueden causar vasodilatación o vasoconstricción dependiendo de si se encuentran sobre la media o adventicia87. La dopamina actúa tanto en los receptores dopaminérgicos como en los adrenorreceptores, dando una respuesta cardiovascular compleja. A bajas dosis, 5μg/kg/min, se activan los receptores dopaminérgicos D1 causando una disminución en las resistencias vasculares e incrementan levemente el GC6. Mucho se habla de los beneficios de la dopamina como «dosis renal» sin embargo esto es controversial. Hay estudios que han demostrado que la filtración glomerular no mejora con el uso de la dopamina a dosis baja, es decir no presenta un aparente efecto reno protector6.
Además, estudios en pacientes críticos han observado incremento de la filtración glomerular y que no confiere protección para los incrementos de creatinina, progresión de oliguria y necesidad de hemodiálisis. Como el estudio realizado por Bellomo et al.88 en donde valoraron a 328 pacientes en la unidad de cuidados intensivos, donde se estudió los efectos de protección renal versus placebo; sin embargo, no se observaron diferencias en cuanto a los niveles de creatinina, requerimiento de hemodiálisis, estancia hospitalaria o supervivencia. Similares estudios no han demostrado el supuesto incremento en el flujo esplácnico y es cuestionable su acción en la perfusión mesentérica89. En neonatos se ha reportado que presenta incremento del flujo renal, sin embargo, se explica este efecto por la mejora del IC. La dopamina no tiene efecto en el flujo sanguíneo renal en estudios experimentales en cerdos neonatos y de hecho produce incremento en la resistencia vascular renal y reducción de la producción de orina, a dosis bajas. Estudios similares han sido reportados en otros modelos animales neonatales. Se cree que es debido a la inmadurez de los receptores dopaminérgicos en neonatos; la respuesta observada ocurre debido a la activación de los receptores α periféricos resultando en vasoconstricción. Además se ha encontrado que la dopamina puede afectar la microhemodinamia renal, epitelio tubular y las funciones endocrinas y renales las cuales desempeñan un importante rol en la regulación y modulación en la función renal3,12. A dosis intermedia de 5-10 g/kg/min se activan los betaadrenorreceptores ocasionando incremento del GC y frecuencia cardiaca6; además inhiben la recaptación de NE en las terminaciones nerviosas presinápticas. A dosis altas de 10-20μg/kg/min, la dopamina actúa principalmente en los receptores alfaadrenérgicos, ocasionando vasoconstricción periférica6. El uso de la dopamina actualmente se reporta solo en el periodo neonatal, sin embargo hay estudios que indican que, en forma general, la dobutamina es más efectiva que la dopamina para incrementar el GC en neonatos con disfunción miocárdica89. Además, se ha encontrado que la dobutamina a dosis de 10 o 20μg/k/min es más efectiva que la dopamina para incrementar el flujo en vena cava superior en los recién nacidos pretérminos durante el primer día de vida3,90. Una de las principales causas de hipotensión en la etapa neonatal es la que ocurre en los primeros 5 días de vida y es secundaria a la apertura del conducto arterioso, y es por ello que se han realizado estudios para conocer los efectos de la dopamina a nivel de la vasculatura pulmonar; se ha observado que al incrementar las RVS aumentará el cortocircuito de izquierda a derecha, estos estudios fueron demostrados por Liet et al.91. En un estudio realizado por Filippi et al.92, donde compararon los efectos endocrinos de la dopamina versus dobutamina en prematuros de muy bajo peso al nacer con hipotensión, encontraron que ambos fármacos incrementan la PA, sin embargo la dopamina disminuye los niveles de TSH, T4 y prolactina, las cuales son rápidamente reversibles al retirar el fármaco, requiriendo futuras investigaciones para valorar si existe una supresión pituitaria iatrogénica con consecuencias a largo plazo.
En pacientes con choque séptico se reporta que la dopamina puede incrementar la PA hasta un 24% en pacientes con choque séptico refractario a líquidos7. Sin embargo su uso se ha asociado a incremento de la mortalidad, como lo describen varios estudios observacionales realizados en la unión europea, donde se observó incremento de la mortalidad en el grupo manejado con dopamina. Por lo tanto la dopamina no está actualmente recomendada como soporte vasopresor en pacientes con choque séptico, excepto en pacientes con relativa bradicardia quienes tienen bajo riesgo de taquiarritmias39,93. El uso de dopamina también representa un incremento en el consumo de oxígeno, como se mencionó previamente; uno de sus principales efectos adversos es la taquicardia y su efecto arritmogénico, ambos son más frecuentemente observados en comparación con otros agentes vasopresores93. En un estudio reciente no se observó ventajas de la dopamina versus NE como agente vasopresor de primera línea, sin embargo se evidenció mayor incidencia de arritmias y fue asociado un incremento de la mortalidad a los 28 días en pacientes con choque séptico 94. Algunos estudios indican, como se mencionó en párrafos anteriores, que la dopamina disminuye la liberación de prolactina y favorece la apoptosis de linfocitosis con la consecuente inmunosupresión93; de igual forma en postoperados de cirugía de corazón con alto riesgo de arritmias, la dopamina puede resultar deletérea en el manejo de este grupo de pacientes94. Los pacientes con choque neurogénico frecuentemente presentan hipotensión y bradicardia resultado del daño espinal por lo que, en estos casos, se recomienda el uso de la dopamina y la NE ya que incrementan la actividad de los receptores α1 y β1 en el tejido afectado1.
VasopresinaLa vasopresina se sintetiza en el hipotálamo, y es liberada en 3 fragmentos: vasopresina, neurofisina-ii y copeptina. Tiene una vida media de aproximadamente 15min4, y sus funciones fisiológicas principales son la constricción del músculo liso vascular y la osmorregulación. Actúa por medio de receptores V1 vascular, V2 renal, V3 hipofisario, oxitócicos y P2 purinérgicos22. Los receptores purinérgicos P2 están localizados en el endotelio cardiaco y podrían tener una acción en la contractilidad cardiaca y en la vasodilatación coronaria selectiva. El estímulo más importante para la liberación de vasopresina es el incremento en la osmolaridad plasmática, hipotensión e hipovolemia6. Endotoxinas y citocinas proinflamatorias también estimulan su liberación95 La utilidad de la vasopresina en el choque séptico vasodilatado y vasoplejía posbomba de circulación extracorpórea está en que su efecto en receptores V1 estimula contracción del músculo liso vascular. La infusión de vasopresina comúnmente causa vasodilatación en las circulaciones cerebral, pulmonar y coronaria por vía de la estimulación del receptor de oxitocina y liberación de ON endotelial. Paradójicamente la vasopresina (hormona antidiurética) aumenta el gasto urinario y el aclaramiento de creatinina en pacientes con choque séptico. La vasopresina es un potente estimulador de la liberación de la hormona adrenocorticotropina y cortisol20 así como también estimula la liberación de prolactina y endotelina 1.
El uso de la vasopresina como tratamiento vasopresor de segunda línea propicia una disminución del requerimiento de catecolaminas por lo que se recomienda su uso cuando el requerimiento de estas es elevado, con el objetivo de potenciar el efecto vasopresor y en estas condiciones disminuir la dosis de aminas y así limitar sus efectos secundarios96. La dosis de vasopresina varia de 0.0003 a 0.002UI/kg/min. En pediatría no existen estudios concluyentes para recomendar su uso en paro cardiaco. Los efectos adversos relacionados con la vasopresina exógena reportados incluyen isquemia coronaria, aumento en la poscarga miocárdica, lesiones cutáneas isquémicas, complicación de heridas, taquiarritmias de nuevo inicio e hipoperfusión esplácnica97.
Score inotrópicoPor último cabe mencionar que el manejo aminérgico en el paciente crítico está plagado de un sinfín de efectos adversos, algunos con poco efecto sobre la morbilidad de los pacientes y algunos otros con efectos nocivos que resultan en mayor mortalidad5–9; es por eso que todo paciente que requiera infusión de aminas vasoactivas debe tener una vigilancia estrecha y estas deben titularse de acuerdo a la dosis mínima necesaria para mantener la homeostasis orgánica y así reducir el riesgo de efectos adversos asociados a su uso. Wernovsky et al.98, en 1995, describen una formula en la cual se le da un valor numérico a la dosis de aminas vasoactivas e inotrópicos; se incluyen la adrenalina, la NE, la dobutamina, la milrinona y la vasopresina en dicha fórmula a la cual se la llamó «Score inotrópico», y fue descrita inicialmente para medir el soporte hemodinámico en niños intervenidos de cirugía cardiovascular98; actualmente dicho score tiene un uso diferente para el cual fue propuesto inicialmente. En la actualidad dicho score se ha utilizado como predictor de mortalidad y se ha intentado validar en varios estudios99–101. Existen pocos estudios publicados en pacientes con choque séptico y estos concluyen que un Score inotrópico mayor de 20 se considera alto y se asocia con mayores complicaciones asociadas al uso de vasopresores e inotrópicos100,101 (tabla 2).
Score inotrópico y vasopresor
| Score inotrópico (SI)=dosis de dopamina (mcg/kg/min)+dosis de dobutamina (mcg/kg/min)+100xdosis de epinefrina (mcg/kg/min) |
| Score vasopresor-inotrópico (SVI)=SI+10xdosis de milrinona (mcg/kg/min)+10,000xdosis de vasopresina (UI/kg/min)+100xdosis norepinefrina (mcg/kg/min) |
Modificada de de Wernovsky G et al.98.
El manejo aminérgico en el paciente pediátrico en estado crítico requiere de la comprensión de la hemodinamia del paciente y debe ajustarse a las condiciones clínicas según sea el caso, con el objetivo de disminuir sus efectos adversos. Un inotrópico ideal sería el que tenga las propiedades de incrementar la función sistólica y diastólica, disminuir la vasoconstricción sistémica y pulmonar, sin aumentar el consumo miocárdico de oxígeno, tener pocos efectos secundarios y mejorar la calidad de vida y la supervivencia, sin embargo dicho fármaco aún no existe, por lo cual el manejo debe ser encaminado a obtener objetivos clínicos tales como mejoría en la perfusión, evidenciados por un adecuado llenado capilar, mejoría del equilibrio acido-base, gasto urinario óptimo y en ausencia de cortocircuitos intracardiacos una saturación venosa central>70%. Conocer el mecanismo de acción, indicaciones y contraindicaciones de los fármacos vasopresores e inotrópicos es crucial para encaminar una terapéutica guiada en objetivos y no solo en cifras de PA. La respuesta a los inotrópicos en la población pediátrica es distinta a la de los adultos, y en la población neonatal es única y muy variada. La fisiopatología del compromiso hemodinámico en esta edad es compleja y muchos de los fármacos usados en adultos y población pediátrica pueden ser usados en la población neonatal, sin embargo, debido a las características únicas de la fisiología neonatal, incluyendo diferencias en la arquitectura miocárdica, receptores celulares, presencia de cortocircuitos intracardiacos y diferencias en las enfermedades presentes a esta edad, realizar una directa extrapolación es inexacto. Se necesitan más estudios para determinar el manejo aminérgico óptimo en el neonato.
El score inotrópico puede ser una herramienta útil para predecir la morbimortalidad en el paciente en estado crítico y por lo tanto debería conocerse y aplicarse; no solo en el área de cirugía cardiovascular sino en todo paciente con choque que amerite manejo aminérgico.
Cada día se están investigando nuevos fármacos para soporte aminérgico en pacientes adultos, los cuales posteriormente se extrapolan a la población pediátrica. Nos corresponde tratar de promover y superar obstáculos para realizar un mayor número de ensayos clínicos controlados para orientar apropiadamente la terapéutica en el paciente pediátrico crítico.
FinanciaciónNinguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.