El objetivo de este estudio es conocer las características de la COVID-19 en pacientes con uveítis asociada a enfermedades autoinmunes sistémicas (EAS) mediante una encuesta telemática.
Material y métodosLa Sociedad Española de Medicina Interna por medio del Grupo de Trabajo de Enfermedades Autoinmunes realizó una encuesta telemática a pacientes con EAS para conocer las características de la COVID-19 en esta población.
ResultadosUn total de 2.789 pacientes contestaron la encuesta, de los que 28 tenían un diagnóstico de uveítis asociada a una EAS. La mayoría (82%) eran mujeres y caucásicas (82%), con una media de 48 años. Las EAS más frecuentes fueron la enfermedad de Behçet seguida de la sarcoidosis y del lupus eritematoso sistémico. El 46% de los pacientes estaban recibiendo tratamiento con corticoides a una dosis media de prednisona de 11mg/día. Respecto a la infección, 14 (50%) pacientes referían síntomas compatibles con infección por SARS-CoV-2. Se realizó RT-PCR en el frotis nasofaríngeo en dos pacientes y en uno de ellos (4%) fue positivo.
ConclusionesLos pacientes con UNI asociada a EAS tanto los asintomáticos como los sintomáticos de COVID-19 habían recibido de forma similar tratamiento inmunosupresor.
The objetive of these study is to know the characteristics of COVID-19 in patients with uveitis associated with Systemic Autoimmune Disease (SAD) through telematic survey.
Material and methodsInternal Medicine Society and Group of Systemic Autoimmune disease conducted a telematic survey of patients with SAD to learn about the characteristics of COVID-19 in this population.
ResultsA total of 2,789 patients answered the survey, of which 28 had a diagnosis of uveitis associated with SAE. The majority (82%) were female and caucasian (82%), with a mean age of 48 years. The most frequent SAEs were Behçet's disease followed by sarcoidosis and systemic lupus erythematosus. 46% of the patients were receiving corticosteroid treatment at a mean prednisone dose of 11mg/day. Regarding infection, 14 (50%) patients reported symptoms compatible with SARS-CoV-2 infection. RT-PCR was performed on the nasopharyngeal smear in two patients and in one of them (4%) it was positive.
ConclusionsBoth asymptomatic and symptomatic COVID-19 patients with ASD-associated UNI had received similar immunosuppressive treatment.
La enfermedad por el coronavirus 2019 o COronaVIrus Disease 2019 (COVID-19) está causada por el coronavirus 2 del síndrome de distrés respiratorio del adulto (SDRA) o Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2). Se originó en la ciudad de Wuhan (provincia de Hubei, China), en diciembre de 2019 y ha provocado el mayor brote por coronavirus descrito hasta la fecha después del SARS en 2002 y el MERS en 2012.
Tras una fase variable de incubación, que oscila entre 3 y 10 días, inicialmente se manifiesta con síntomas respiratorios. Alrededor de un 80% de los pacientes desarrolla un cuadro paucisintomático, o incluso asintomático. El 20% restante desarrolla un cuadro clínico caracterizado por una neumonía intersticial bilateral que en ocasiones se complica con un SDRA que comporta un fallo respiratorio y un aumento de la respuesta inflamatoria sistémica con marcadores inflamatorios elevados1. La mortalidad de los pacientes que desarrollan este cuadro inflamatorio oscila entre un 10% y un 20%2. La COVID-19 se asocia a otras manifestaciones clínicas menos frecuentes y algo más tardías, como fenómenos trombóticos (arteriales o venosos), inflamación cutánea, vasculitis y el desarrollo de fibrosis pulmonar.
Datos de estudios observacionales y casos clínicos publicados en China3,4 y en Europa5,6 que han incluido tanto pacientes trasplantados como pacientes con enfermedades autoinmunes sistémicas (EAS) que se encuentran bajo tratamiento inmunosupresor no han demostrado hasta la fecha que los pacientes inmunodeprimidos tengan mayor riesgo de infección por SARS-COV-2 que la población general, ni que la presentación clínica, el curso de la enfermedad, los hallazgos de laboratorio, ni de imagen sean diferentes o más graves que los de los pacientes no inmunodeprimidos.
Algunas sociedades científicas como la International Uveitis Study Group, la International Ocular Inflammation Society y la Foster Ocular Inflammation Society han publicado un consenso con las recomendaciones a seguir en los pacientes con uveítis en tiempos de la infección por COVID-197. De forma similar a otras sociedades científicas8, se ha recomendado que no se suspenda el tratamiento inmunosupresor en pacientes sin síntomas de COVID-19 y un seguimiento estricto de las medidas de aislamiento social y la realización de las consultas de seguimiento por medio de la telemedicina en la medida de lo posible. Además, se recomienda el uso de las dosis más bajas posibles de corticoides (idealmente por debajo de 20mg al día de prednisona oral o su equivalente)9.
No existen datos hasta este momento sobre el impacto de la COVID-19 en pacientes con uveítis asociadas a EAS. Algunos de estos enfermos reciben tratamiento con corticoides y fármacos modificadores de la enfermedad como los antimetabolitos, inhibidores de la calcineurina, agentes alquilantes o biológicos7 que pueden aumentar el riesgo de contraer infecciones.
El objetivo de este estudio es conocer el número de pacientes con uveítis asociada a EAS que se podían haber contagiado del virus SARS-COV-2 durante la primera ola de la pandemia, las características de la COVID-19 en estos pacientes, el grado de inmunosupresión y la realización de test diagnósticos así como la necesidad de hospitalización, mediante una encuesta telemática dirigida a diferentes asociaciones de pacientes con enfermedades autoinmunes sistémicas y uveítis.
Material y métodosLa Sociedad Española de Medicina Interna (SEMI) por medio del Grupo de Trabajo de Enfermedades Autoinmunes (GEAS) realizó una encuesta telemática a pacientes con EAS para conocer las características de la COVID-19 en esta población. En este estudio, realizado en colaboración con la Sociedad Española de Inflamación Ocular, se presentan los resultados correspondientes a los pacientes con uveítis asociada a EAS.
Se trata de un estudio descriptivo, observacional y transversal con recogida de información obtenida a través de una encuesta estructurada. La encuesta fue elaborada por 3 médicos internistas (PF, LSC y BGT), con amplia experiencia en el campo del manejo multidisciplinar de las EAS. La encuesta se realizó mediante la plataforma para encuestas on line Survey Monkey (Survey Monkey Inc. San Mateo, California, Estados Unidos). Se adjuntó el consentimiento informado junto con el link de la encuesta. Cuando el paciente accedía a la encuesta, el primer punto que se rellenaba era si el paciente estaba de acuerdo con la realización de la encuesta, si se respondía afirmativamente, se daba por aceptado el consentimiento informado.
En la encuesta se recogieron las siguientes variables, enfermedad autoinmune sistémica de base y si el paciente había sido diagnosticado previamente de uveítis, fecha de nacimiento, sexo, etnia, tratamiento con hidroxicloroquina u otros antimaláricos en los últimos 3 meses y dosis diaria, tratamiento con corticoides orales en el último mes y dosis medias de corticoides en el último mes, tratamiento inmunosupresor o biológico recibido en los últimos 6 meses, síntomas de sospecha de COVID-19 en los últimos 14 días, contacto previo en los últimos 14 días con un paciente con síntomas y realización de reacción en cadena de la polimerasa en tiempo real (RT-PCR) para SARS-COV-2 en frotis nasofaríngeo en los últimos 14 días (Anexo).
El Departamento de Medicamentos de Uso Humano de la Agencia Española de Medicamentos y Productos Sanitarios clasificó el estudio como «estudio observacional no postautorización» (no-EPA). Posteriormente la encuesta sobre infección por COVID-19 y EAS tuvo la aprobación del Comité de ética de investigación clínica) de Aragón.
La encuesta se remitió a través de las asociaciones de pacientes y se difundió entre sus socios desde el 15 de abril hasta el 15 de mayo de 2020. La asociaciones de pacientes que difundieron la encuesta entre sus socios y que participaron fueron las siguientes: Asociación de Pacientes de Uveítis (AUVEA), Asociación de Retina de Navarra, Federación Española de Lupus, Asociación Gallega de Lupus, Asociación de Lúpicos de Asturias, Asociación Lupus de Cantabria, Asociación de Ayuda a los Enfermos de Lupus de Vizcaya, Asociación Leonesa de Lupus y Síndrome Antifosfolípido, Asociación Salmantina de Lupus, Asociación de Lupus de Aragón, Asociación Madrileña de Enfermos de Lupus y Antifosfolípidos, Asociación de Lupus de Badajoz, Asociación de Lupus de Castilla-La Mancha, Asociación Catalana de Lupus Eritematoso Generalizado, Asociación Valenciana de Afectados de Lupus, Asociación de Lupus de Islas Baleares, Asociación de Lupus de Almería, Asociación de Enfermos de Lupus de la Provincia de Cádiz, Asociación Granadina de Lupus, Huelva Lúpicos Asociados, Asociación de Lupus de Jaén, Asociación Malagueña de Lupus, Asociación de Lúpicos de Sevilla, Asociación Española del Síndrome de Sjögren, Asociación Española de Esclerodermia, Asociación de Esclerodermia de Castellón, Asociación Española de Vasculitis Sistémicas, Asociación Española de la Enfermedad de Behçet, y la Asociación Nacional de Enfermos de Sarcoidosis.
Análisis estadístico. Los datos se recogieron y analizaron mediante una base de datos del programa Excel (Microsoft office, Redmond, WA 98052, Estados Unidos). Las variables cuantitativas se expresaron como media y las variables cualitativas se resumen en su distribución de frecuencia.
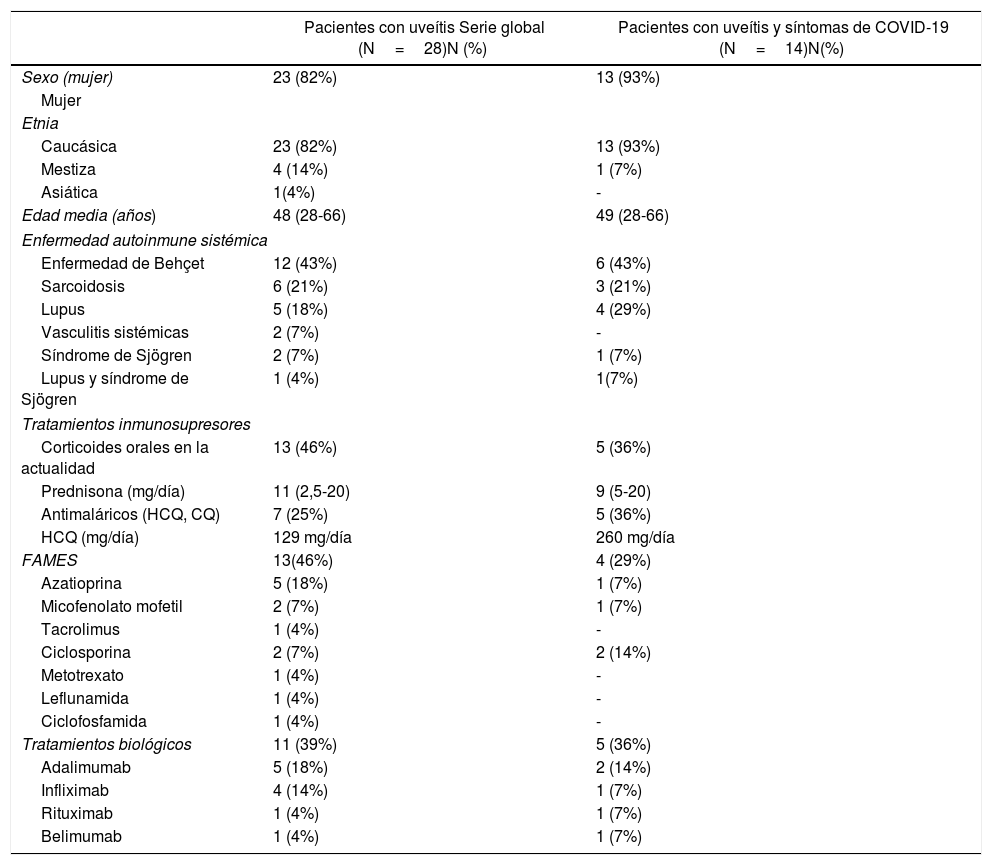
ResultadosUn total de 2.789 pacientes contestaron la encuesta, de los que 28 tenían un diagnóstico de uveítis asociada a una EAS (tabla 1). No hubo respuesta a la encuesta de ningún paciente con diagnóstico de uveítis aislada, sin enfermedad autoinmune sistémica asociada a pesar de que se remitió a la Asociación de Retina de Navarra y a AUVEA.
Características demográficas y clínicas de los pacientes con uveítis
| Pacientes con uveítis Serie global (N=28)N (%) | Pacientes con uveítis y síntomas de COVID-19 (N=14)N(%) | |
|---|---|---|
| Sexo (mujer) | 23 (82%) | 13 (93%) |
| Mujer | ||
| Etnia | ||
| Caucásica | 23 (82%) | 13 (93%) |
| Mestiza | 4 (14%) | 1 (7%) |
| Asiática | 1(4%) | - |
| Edad media (años) | 48 (28-66) | 49 (28-66) |
| Enfermedad autoinmune sistémica | ||
| Enfermedad de Behçet | 12 (43%) | 6 (43%) |
| Sarcoidosis | 6 (21%) | 3 (21%) |
| Lupus | 5 (18%) | 4 (29%) |
| Vasculitis sistémicas | 2 (7%) | - |
| Síndrome de Sjögren | 2 (7%) | 1 (7%) |
| Lupus y síndrome de Sjögren | 1 (4%) | 1(7%) |
| Tratamientos inmunosupresores | ||
| Corticoides orales en la actualidad | 13 (46%) | 5 (36%) |
| Prednisona (mg/día) | 11 (2,5-20) | 9 (5-20) |
| Antimaláricos (HCQ, CQ) | 7 (25%) | 5 (36%) |
| HCQ (mg/día) | 129 mg/día | 260 mg/día |
| FAMES | 13(46%) | 4 (29%) |
| Azatioprina | 5 (18%) | 1 (7%) |
| Micofenolato mofetil | 2 (7%) | 1 (7%) |
| Tacrolimus | 1 (4%) | - |
| Ciclosporina | 2 (7%) | 2 (14%) |
| Metotrexato | 1 (4%) | - |
| Leflunamida | 1 (4%) | - |
| Ciclofosfamida | 1 (4%) | - |
| Tratamientos biológicos | 11 (39%) | 5 (36%) |
| Adalimumab | 5 (18%) | 2 (14%) |
| Infliximab | 4 (14%) | 1 (7%) |
| Rituximab | 1 (4%) | 1 (7%) |
| Belimumab | 1 (4%) | 1 (7%) |
La mayoría eran mujeres (82%) y de etnia caucásica (82%), con una media de 48 años. Las EAS más frecuentes fueron la enfermedad de Behçet seguida de la sarcoidosis y del lupus eritematoso sistémico.
El 46% de los pacientes estaban recibiendo tratamiento con corticoides a una dosis media de prednisona de 11mg/día. El 25% de los pacientes habían recibido hidroxicloroquina o algún otro antimalárico en los últimos 3 meses y la dosis media fue de 129mg/día. Respecto a los inmunosupresores, el 18% había recibido azatioprina seguido del 7% de micofenolato mofetilo, 7% ciclosporina, 4% tacrolimus, 4% metotrexato, 4% leflunomida y 4% ciclofosfamida. Once (39%) pacientes habían recibido tratamiento biológico en los últimos 6 meses (tabla 1).
Respecto a la infección, 14 (50%) pacientes referían síntomas compatibles con infección por SARS-CoV-2. Entre los síntomas más frecuentes que los pacientes referían se encontraban tos (9 pacientes), diarrea (7 pacientes), disgeusia (4 pacientes), fiebre o febrícula (3 pacientes), disnea (3 pacientes) y anosmia (3 pacientes).
Catorce (50%) pacientes desconocían si habían tenido contacto previo con pacientes con síntomas en los 14 días previos, 12 (43%) pacientes no habían tenido contacto previo y 2 (7%) pacientes sí habían tenido contacto previo. Se realizó RT-PCR en el frotis nasofaríngeo en dos pacientes y en uno de ellos (4%) fue positivo. Se trataba de una mujer de 50 años de origen caucásico con un cuadro de uveítis asociada a sarcoidosis en tratamiento con hidroxicloroquina 100mg/día, prednisona 20mg/día y micofenolato mofetilo. La paciente no refería contacto previo en los 14 días anteriores y presentó un cuadro de fiebre de>38°C, tos, disnea, disgeusia, anosmia, diarrea y astenia que precisó ingreso hospitalario.
DiscusiónEn este estudio se muestra que tras realizar una encuesta a diferentes asociaciones de pacientes con EAS, 28 de 2.789 (1%) pacientes presentaban un diagnóstico de uveítis asociada a una EAS. Los casos posibles de COVID-19 (con clínica compatible sin confirmación diagnóstica) fueron la mitad y solo en un paciente se confirmó la infección por SARS-COV-2 (mediante la prueba oro del RT-PCR en frotis nasofaríngeo) y requirió ingreso hospitalario.
Este es el primer estudio en el que se publican resultados de posible infección por SARS-COV-2 en un grupo de pacientes con uveítis asociadas a EAS en tratamiento inmunosupresor.
En un estudio llevado a cabo en Hubei se objetivó que hasta un 1/3 de los pacientes con COVID-19 sufrían alteraciones oculares y que estas se encontraban más frecuentemente en pacientes con síntomas más graves de COVID-1910. Hasta la actualidad, existen casos publicados de conjuntivitis, queratitis, uveítis anterior, retinitis y neuritis óptica como parte del síndrome inflamatorio producido por la COVID-1911. Algunos de estos pacientes respondieron al tratamiento esteroideo tópico y se ha postulado que la inflamación ocular podría formar parte del síndrome de liberación de citoquinas12.
Pero puede ser que paradójicamente la inmunosupresión sea considerada como un factor de protección o incluso como parte del tratamiento de una uveítis secundaria al cuadro de infección de COVID-19. Wu et al. estudiaron 201 pacientes con SDRA y demostraron que los que habían recibido tratamiento con corticoides se asociaban a un menor riesgo de mortalidad (46% tasa de mortalidad con corticoides vs. 62% sin tratamiento con corticoides)13. Más recientemente en base a los hallazgos publicados en el ensayo Randomised Evaluation of COVID-19 therapy por Horby et al., de un total de 2104 que recibieron tratamiento con dexametasona 6mg al día durante 10 días comparados con 4321 que no recibieron esteroides, se observó que la dexametasona reducía la mortalidad en un 35% de los pacientes que precisaban de ventilación mecánica y en un 20% de los pacientes que precisaban de oxígenterapia14. En España dos estudios han demostrado la utilidad de los pulsos de metilpredsinolona en el tratamiento de la neumonía secundaria al síndrome de respuesta inflamatoria sistémica generada por la COVID-1915,16.
En la actualidad numerosos ensayos clínicos y estudios se están llevando a cabo con terapias biológicas e inhibidores de pequeñas moléculas en el tratamiento de la neumonía COVID-19. En la era de la medicina de precisión estas terapias nos permiten bloquear citoquinas de la cascada inflamatoria desencadenada por el coronavirus
SARS-CoV-2 sin que por ello se vea mermada la respuesta protectora inmune del huésped.
Dado el papel clave que juega dentro de la cascada inflamatoria la IL-6, en la fase de hiperinflamación sistémica y en la fase tardía de la COVID-19, el tocilizumab, un anticuerpo monoclonal humanizado inhibidor de la IL-6, es uno de los agentes biológicos más utilizados y estudiados durante la pandemia de la COVID-1917. En un reciente estudio español publicado por Rodríguez-Baño et al., se ha comprobado la utilidad del uso del tocilizumab tanto solo como en combinación con esteroides para el tratamiento de la respuesta hiperinflamatoria18. De la misma forma, anakinra un inhibidor del receptor de la IL-1, también ha sido estudiado en varias cohortes prospectivas y retrospectivas con resultados satisfactorios19,20, demostrando mejoría clínica en el 72% de los pacientes y reduciendo la necesidad de ventilación mecánica y mortalidad con COVID-19 y SDRA.
Se ha objetivado que los pacientes con enfermedad inflamatoria intestinal en tratamiento con adalimumab o infliximab no tenían mayor riesgo de infección que la población general. En base a la hipótesis del posible efecto protector de estos tratamientos, ya que el TNF alfa es una de las citoquinas principales sobre las que pivota del síndrome de tormenta de citoquinas, en la actualidad solo existe un ensayo clínico con infliximab en COVID 19 que se encuentra en estado de reclutamiento21.
En cuanto al adalimumab, el único tratamiento biológico, autorizado para el tratamiento de la uveítis no infecciosa, no hay estudios publicados ni ensayos clínicos en marcha.
En nuestro estudio tanto los pacientes con posibles síntomas de COVID-19 como los pacientes asintomáticos se encontraban en tratamiento con esteroides, FAMES y tratamientos biológicos, siendo el adalimumab el más frecuentemente utilizado en ambos grupos.
Dentro de las limitaciones de este estudio se encuentra el hecho que se trata de una encuesta y, por tanto, su validez depende en primer lugar de la voluntad de los pacientes y del conocimiento que tengan de su EAS y de los tratamientos inmunosupresores que están recibiendo. El hecho de que la encuesta no fuera dirigida a pacientes con uveítis solamente y que dentro de las enfermedades autoinmunes sistémicas asociadas no se incluyera explícitamente al grupo de las espondiloartropatía nos hace pensar que puede existir un sesgo de selección y por dicho motivo aparezcan más pacientes de lo habitual con el diagnóstico asociado a la uveítis de lupus u otras EAS. Además, la encuesta es remitida desde la SEMI y desde el Grupo de Trabajo de Enfermedades Autoinmunes Sistémicas con lo que conlleva posiblemente también un perfil de paciente diferente al que puede ser manejado desde la consulta de Reumatología.
Además, otro de los posibles sesgos de selección que se han podido producir es el hecho de que contestaran la encuesta de forma mayoritaria, los pacientes que han presentado síntomas sugestivos de la COVID-19. Otra de las limitaciones es que desconocemos el tipo de uveítis según localización (anterior, intermedia, posterior o panuveítis) que presentaban, ni tampoco cuántos de los pacientes con uveítis se encontraban en brote en el momento de realización de la encuesta. Por otra parte, el estudio no cuenta con un grupo control de paciente sin EAS y la RT-PCR del frotis nasofaríngeo se realizó solo en dos pacientes.
Mediante esta encuesta telemática se ha identificado un caso confirmado de COVID-19 en un grupo de pacientes con uveítis asociada a EAS, cuando la mitad de los pacientes referían sintomatología sospechosa de infección por coronavirus. Este estudio pone de manifiesto la necesidad de realización de PCR y test diagnósticos en pacientes con síntomas sospechosos de infección por coronavirus y población de riesgo como son los pacientes con terapias inmunosupresoras. Unos pacientes con uveítis y enfermedades autoinmunes sistémicas que a pesar de las guías y recomendaciones de las sociedades científicas22,23 posiblemente no recibieron las atenciones asistenciales necesarias con pruebas diagnósticas adecuadas, consultas presenciales y de seguimiento que requerían durante el confinamiento. Es preciso que mientras persista la pandemia por coronavirus, estos pacientes con patología crónica y autoinmune sigan sus consultas habituales y se les realice los test diagnósticos pertinentes para el despistaje de infección por coronavirus, en caso de inicio de síntomas o contacto con un caso confirmado o sospechoso.
Son necesarios más estudios con un mayor número de enfermos y con un grupo control para conocer la incidencia real de esta infección y sus características en esta población.
ConclusionesLos pacientes con UNI asociada a EAS tanto los asintomáticos como los sintomáticos de COVID-19 habían recibido de forma similar tratamiento inmunosupresor. Es necesario que a los pacientes con UNI con síntomas sospechosos de COVID-19 se les realice las pruebas diagnósticas pertinentes para descartar infección por coronavirus.
Se precisa de más estudios en pacientes con UNI en tratamiento inmunosupresor para evaluar el riesgo de infección por la COVID-19 en esta población.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todos las asociaciones de pacientes y a sus pacientes por colaborar en la realización de la encuesta GEAS-COVID durante la pandemia de la COVID-19.