Mujer de 60 años que refería dificultad visual. Presentaba pigmentación en espículas óseas y atrofia retiniana en toda la retina periférica, así como flecks retinianos en la mácula. La multimodalidad de imagen mostró los hallazgos típicos de ambas distrofias hereditarias de la retina (DHR). El electrorretinograma confirmó disfunción de bastones. Se encontraron mutaciones bialélicas en los genes ABCA4 y CNGA1. Aunque sea poco frecuente, pueden presentarse varias DHR en un mismo paciente, al mismo tiempo. Este es el primer caso comunicado de la combinación de RP y enfermedad de Stargardt de inicio tardío. Proponemos el nombre de «Stargardt pigmentaria» para esta nueva entidad clínica.
A 60-year-old woman referring visual disability. She presented bone spicule pigmentation and retinal atrophy in all peripheral retina, as well as macular retinal flecks. Multimodal imaging showed typical findings of both inherited retinal dystrophies (IRD). Electroretinogram confirmed rod dysfunction. Biallelic mutations were found in ABCA4 and CNGA1 genes. Although not common, different IRDs may be present in a same patient at the same time. This is the first reported case of the combination of RP with late-onset Stargardt's disease. We propose the name ‘Stargardt's pigmentosa’ for this novel clinical entity.
Las distrofias hereditarias de retina (DHR) engloban un grupo muy heterogéneo de enfermedades retinianas con trasfondo genético. Existe una gran variedad de manifestaciones clínicas con decenas de DHR y cientos de genes relacionados, cada uno de ellos con un patrón de transmisión diferente. Varios individuos de una misma familia suelen estar afectados por la misma DHR, por lo que se recomienda estudiar a los parientes cercanos de los pacientes con DHR.
La DHR más frecuente es la retinosis pigmentaria (RP), cuya prevalencia mundial se sitúa en torno a 1:4.000, y que puede estar asociada a afecciones no oculares en un 20-30% de los casos, es decir, RP sindrómica1. Se han descrito más de 100 mutaciones hasta el momento2. Aunque todos los fotorreceptores pueden estar afectados, la enfermedad comienza por los bastones. Esto conduce a nictalopía, discapacidad por deslumbramiento y reducción concéntrica de la visión. Algunos signos típicos son la pigmentación periférica de las espículas óseas, la atenuación de los vasos retinianos y la palidez de la cabeza del nervio óptico.
La segunda DHR más frecuente es la enfermedad de Stargardt, con una prevalencia mundial de 1:9.0003, causada por mutaciones bialélicas en el gen ABCA4. Esta mutación bloquea la eliminación de retinoides del disco de membrana dentro del fotorreceptor y, por tanto, bloquea el ciclo visual. Finalmente, esto conduce a depósitos maculares denominados «manchas retinianas» y, con el tiempo, a daños en el epitelio pigmentado de la retina (EPR) en la mácula.
Con el paso de los años ambas DHR progresan y finalmente conducen a la ceguera debido a la atrofia coriorretiniana central. La atrofia de la RP comienza en la periferia, al contrario que la atrofia en la enfermedad de Stargardt, que comienza en la mácula. Las mutaciones de ABCA4 pueden conducir tanto a la RP como a la enfermedad de Stargardt. Sin embargo, hasta ahora no se ha descrito ningún caso afectado por ambas DHR.
CasoUna mujer de 60 años refería discapacidad visual desde hacía más de 10 años, y ya había sido examinada por diferentes oftalmólogos antes de acudir a nuestro servicio. Algunos de los diagnósticos que había recibido eran coroiditis multifocal, retinopatía externa oculta zonal aguda (AZOOR), RP y enfermedad de Stargardt. Su mejor agudeza visual corregida (MAVC) era de 40/200 en el ojo derecho (OD) y de 160/200 en el ojo izquierdo (OS). No había hallazgos anormales en el segmento anterior, había sido operada de cataratas y se le habían implantado lentes intraoculares. La presión intraocular medida con tonometría de Goldmann era de 19mmHg en ambos ojos (AO).
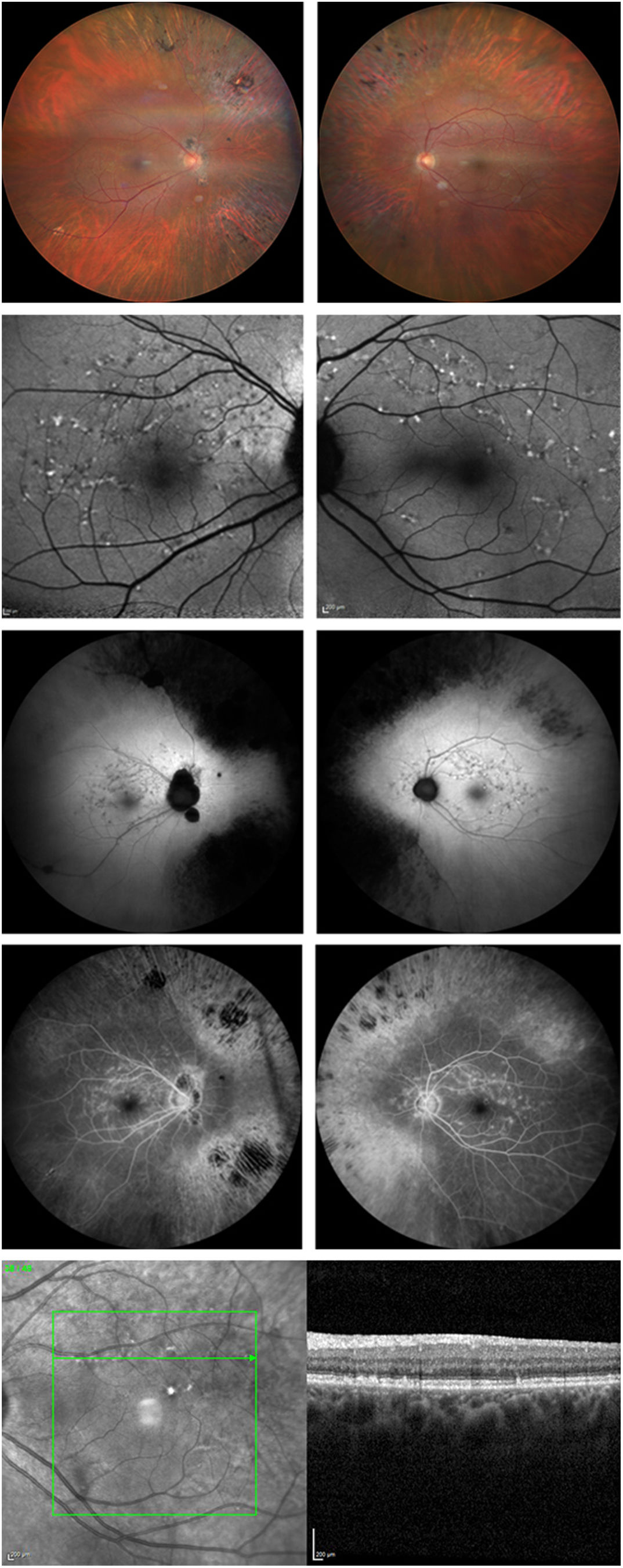
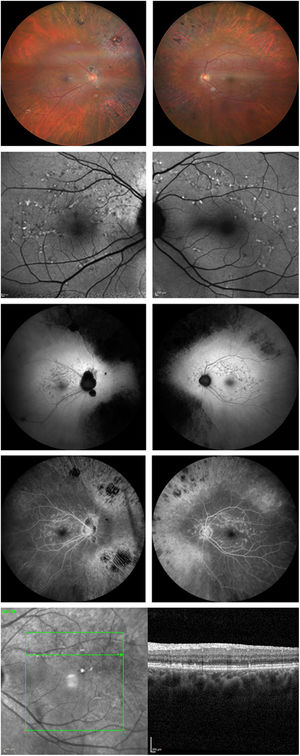
La paciente presentaba pigmentación de espículas óseas en toda la retina periférica en AO, junto con atrofia retiniana. La atrofia periférica era considerablemente mayor en el OD que en el OS. No obstante, el disco óptico y los vasos retinianos parecían normales. En AO se apreciaban sutiles motas maculares. Se consideraron como posibles diagnósticos la RP y la enfermedad de Stargardt, por lo que se realizaron más pruebas de imagen. La figura 1 muestra imágenes de fondo de ojo e imágenes multimodales de AO.
A la izquierda se muestran las imágenes del OD y a la derecha las imágenes en OS. Primera fila: fondo de ojo en AO. Segunda fila: autofluorescencia azul que muestra manchas maculares hiperautofluorescentes que no afectan a la fóvea. Tercera fila: autofluorescencia verde que muestra manchas maculares y atrofia periférica, así como una hiperautofluorescencia macular difusa elevada. Cuarta fila: angiografía fluoresceínica que muestra efecto de ventana periférica debido a la atrofia, baja señal que emerge de la coroides y motas maculares hiperfluorescentes. Quinta fila: Corte de OCT que muestra motas retinianas de tipo 1, junto con imagen infrarroja.
La autofluorescencia azul del fondo de ojo (AF) obtenida con SPECTRALIS® (Heidelberg Engineering, Heidelberg, Alemania) mostró lesiones hiperautofluorescentes maculares localizadas exactamente donde se identificaron las motas en la funduscopia. Se observó una hiperautofluorescencia difusa elevada en el polo posterior y alrededor de los vasos maculares. La hipoautofluorescencia correspondiente a la atrofia del EPR estaba presente en la periferia. También se obtuvo AF verde con ZEISS CLARUS® 700 (Carl Zeiss Meditec, Jena, Alemania).
La angiografía fluoresceínica (AGF) mostró baja señal emergente de la coroides, y las lesiones maculares eran hiperfluorescentes, sin difusión del colorante en estadios tardíos. El defecto de ventana estaba presente en la periferia, como era de esperar en presencia de atrofia. Las imágenes AGF se obtuvieron con ZEISS CLARUS® 700.
Se detectaron sutiles manchas hiperreflectantes subretinianas en la tomografía de coherencia óptica (OCT) SPECTRALIS® de dominio espectral, con preservación foveal. Estas motas se clasificaron de tipo 1 según la clasificación de Querques et al.4. Los fotorreceptores estaban conservados en la mácula. No se identificó edema macular ni membrana epirretiniana.
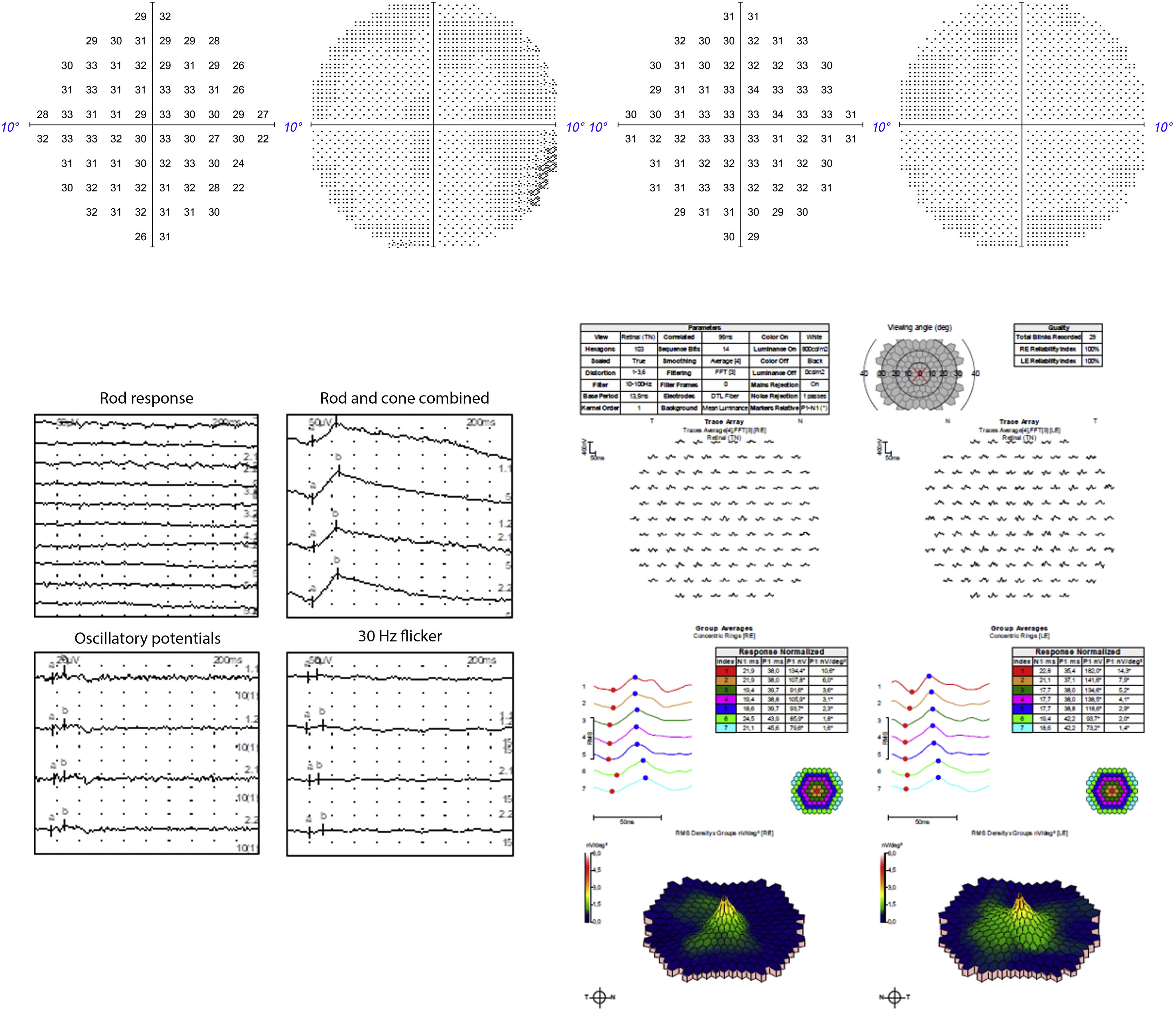
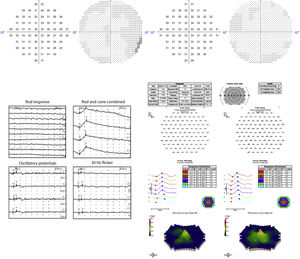
El electrorretinograma multifocal (ERGmf) detectó cierto grado de disfunción retiniana en la zona macular. El ERG de Ganzfeld detectó disfunción de fotorreceptores, siendo predominantemente afectados los bastones. Los campos visuales (CV) 10,2 con analizador de campo HUMPHREY® (Carl Zeiss Meditec, Jena, Alemania) no detectaron ningún escotoma. Las pérdidas de fijación fueron de 0/15 y 0/15, los falsos positivos del 0 y 0%, y los falsos negativos del 10 y 0%, en el OD y en el OS, respectivamente. La figura 2 muestra los resultados resumidos de CV y ERG.
Las imágenes del OD se muestran a la izquierda y las del OS a la derecha. Arriba: campo visual de 10,2 sin escotomas. Abajo a la izquierda: Resultados de ERG de Ganzfeld que muestran disfunción de fotorreceptores, especialmente bastones. Abajo a la derecha: ERG multifocal que muestra cierto grado de disfunción macular.
Se realizó el análisis genético, y se detectaron diferentes mutaciones genéticas que se muestran en la tabla 1. Ambas eran compatibles con RP y enfermedad de Stargardt. Posteriormente, sus parientes cercanos fueron examinados en el departamento de oftalmología y se ordenaron análisis genéticos. Compartían algunas de las mutaciones genéticas y hallazgos oftalmológicos, pero ninguno de ellos presentaba mutaciones o hallazgos tanto de RP como de enfermedad de Stargardt al mismo tiempo.
Mutaciones genéticas detectadas en la paciente
| Gen | Variante | Enfermedades compatibles |
|---|---|---|
| ABCA4(NM_000350.2) | c.5461-10T>Cp.(?) | RP 19 (AR)Distrofia de conos y bastones (AR)Enfermedad de Stargardt (AR)Susceptibilidad a DMAE (AD) |
| ABCA4(NM_000350.2) | c.4297G>Ap.(Val1433Ile) | RP 19 (AR)Distrofia de conos y bastones (AR)Enfermedad de Stargardt (AR)Susceptibilidad a DMAE (AD) |
| CNGA1(NM_001142564.1) | c.1166C>Tp.(Ser389Phe) | RP 49 (AR) |
| CNGA1(NM_001142564.1) | c.859C>Tp.(Arg287*) | RP 49 (AR) |
| TOPORS(NM_005802.4) | c.3055C>Gp.(Gln1019Glu) | RP 31 |
AD: autosómica dominante; AR: autosómica recesiva; DMAE: degeneración macular asociada a la edad; RP: retinosis pigmentaria.
Las DHR representan un reto diagnóstico para los oftalmólogos. En ocasiones, la gran variedad de diferentes entidades que se han descrito hasta ahora pueden suponer una dificultad para su correcto diagnóstico. La imagen multimodal es una herramienta útil ya que algunas lesiones pueden aparecer más claramente con AF o FA, como las drusas reticulares5 o las áreas de atrofia del EPR6. Las DHR tienen un trasfondo genético, pero no siempre es posible identificar la mutación responsable de la expresión clínica. Además, algunas DHR, como la RP, pueden estar causadas por más de cien mutaciones2.
Presentamos el caso de una paciente con hallazgos oftalmológicos y mutaciones genéticas compatibles tanto con RP como con enfermedad de Stargardt de inicio tardío. Los signos típicos de RP eran pigmentación periférica de la espícula ósea con atrofia retiniana periférica. La sospecha clínica de RP se confirmó con pruebas genéticas. La mutación en el gen CNGA1 está asociada a la RP autosómica recesiva. Este gen codifica la subunidad alfa del canal de nucleótidos cíclicos (CNG) de los bastones, que se encuentra en la membrana plasmática del segmento externo de los bastones7. En adición, en la ERG de Ganzfeld se observó que los bastones estaban especialmente afectados y que la mácula seguía preservada en la ERGmf.
Los signos oftalmológicos típicos de la enfermedad de Stargardt eran motas retinianas maculares, cuyas propiedades en distintos tipos de imágenes coincidían con los conocimientos previos8. El respeto foveal ocurre principalmente en pacientes con enfermedad de Stargardt de inicio tardío9. El silencio coroideo en la AGF es típico de la enfermedad de Stargardt, y no se da en pacientes con RP. La sospecha clínica de esta DHR se confirmó con pruebas genéticas, encontrándose mutadas ambas copias del gen ABCA4. Aunque las mutaciones en ABCA4 pueden causar RP10, las motas maculares no están presentes en la RP. Dependiendo de las mutaciones en el gen ABCA4, estas pueden causar RP, distrofia de conos y bastones, enfermedad de Stargardt o susceptibilidad a la degeneración macular asociada a la edad (DMAE).
Los familiares de la paciente mostraban mutaciones genéticas para RP, pero no eran compatibles con la enfermedad de Stargardt, ya que en todos ellos solo se detectó una mutación en el gen ABCA4. Además, no presentaban signos oftalmológicos de la enfermedad de Stargardt. Por lo tanto, no pudimos estimar la penetrancia ni la expresividad de esta enfermedad ni de estas mutaciones. Suponemos que esta combinación de dos DHR diferentes no es muy frecuente porque hasta ahora no se ha publicado ningún caso similar. Las mutaciones en ABCA4 detectadas en esta paciente parecían causar una enfermedad de Stargardt leve de aparición tardía, dado que aún no había atrofia macular de retina.
Así pues, concluimos que la paciente estaba afectada por la combinación de 2 DHR diferentes: RP y enfermedad de Stargardt de aparición tardía. A nuestro conocer, este es el primer caso descrito en la literatura científica. Proponemos el nombre de «Stargardt pigmentaria» para esta nueva entidad clínica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.