Programa de Actividades Preventivas y de Promoción de la Salud-PAPPS 2022
Más datosEn la actualización del PAPPS de 2022 presentamos aquellas actividades preventivas específicas para la salud de la mujer, exceptuando las relacionadas con la prevención del cáncer (que se incluye en otro documento) y los aspectos relacionados con la morbilidad diferencial de género, aspecto este transversal para todos los grupos de trabajo.
La anticoncepción es una actividad preventiva esencial, considerando básico el derecho a decidir tanto el número de hijos como el momento de tenerlos. Debemos informar sobre los posibles métodos anticonceptivos, garantizando en el seguimiento su seguridad, eficacia y efectividad (se incluyen tablas sobre cambio de un método a otro para preservar la protección anticonceptiva). Debemos informar sobre la anticoncepción de urgencia y proponerla en caso de relación sin protección. Todo ello se hará mediante cribado oportunista sin precisar cribado de trombofilia ni de dislipemia, y sí de hipertensión arterial.
El embarazo constituye una vivencia vital importante y el médico de familia no debe permanecer ajeno. Debemos ser competentes tanto en la consulta preconcepcional (recomendando la toma de ácido fólico, evitando la exposición a riesgos laborales y medioambientales, realizando cribado de determinadas patologías y valorando la toma de fármacos no indicados durante el embarazo) como en el seguimiento de la gestación. Hagamos o no seguimiento del embarazo, no debemos desentendernos de su control aprovechando este periodo para promocionar estilos de vida saludables y participando de los procesos intercurrentes que puedan acontecer.
La menopausia en general y la osteoporosis, en particular, ejemplifican la estrategia de medicalización de procesos vitales que se ha seguido desde diferentes instancias y organismos. En nuestra actualización abordamos la prevención y el tratamiento de aquellos síntomas secundarios a la deprivación estrogénica. Así mismo, planteamos la prevención de la osteoporosis, incluyendo la realización de densitometría en función del riesgo de fractura en los próximos 10 años, y por ello no se aconseja el cribado densitométrico en mujeres menores de 60 años. En la valoración del riesgo preconizamos la utilización de la herramienta frax o mejor, la calibración del riesgo de fractura de cadera con datos de prevalencia de la Comunidad de Madrid. La indicación del tratamiento la vinculamos con la Z-score (densidad mineral ósea comparada con mujeres de su misma edad), al ser una patología asociada al envejecimiento, y no en comparación con mujeres de 20 años de la T-score.
In the 2022 PAPPS update we present those specific preventive activities for women's health, except those related to cancer prevention (which are included in another document) and those aspects related to differential gender morbidity, a cross-cutting aspect for all working groups.
Contraception is an essential preventive activity, considering basic the right to decide both the number of children and the time to have them. We must inform about the possible contraceptive methods, guaranteeing the monitoring of their safety, efficacy and effectiveness (tables are included on changing from one method to another to preserve contraceptive protection). We must inform about emergency contraception and propose it in the event of unprotected intercourse. All this will be done through opportunistic screening without requiring screening for thrombophilia or dyslipidemia, but for arterial hypertension.
Pregnancy is an important life experience and the family doctor should not remain oblivious. We must be competent both in the preconception consultation (recommending the intake of folic acid, avoiding exposure to occupational and environmental risks, screening for certain pathologies and assessing the intake of drugs not indicated during pregnancy) and in the monitoring of pregnancy. Whether or not we monitor the pregnancy, we must not disregard its control, taking advantage of this period to promote healthy lifestyles and participating in the intercurrent processes that may occur.
Menopause in general and osteoporosis in particular exemplify the strategy of medicalization of vital processes that has been followed from different instances and organizations. In our update we address the prevention and treatment of symptoms secondary to estrogen deprivation. We also propose the prevention of osteoporosis, including carrying out densitometry based on the risk of fracture in the next 10 years, and therefore densitometric screening is not recommended in women under 60 years of age. In risk assessment we recommend the use of the frax tool or better, the calibration of the risk of hip fracture with prevalence data from our setting. We linked the indication for treatment with the Z-Score (bone mineral density compared with women of the same age), as it is a condition associated with aging.
En países desarrollados, las tasas de mortalidad perinatal y materna1,2 han presentado un notable descenso en las últimas décadas, expresión entre otras de la calidad de la atención durante la gestación.
El seguimiento de embarazos sin necesidad de cuidados adicionales en atención primaria supone, básicamente, la realización de actividades de promoción y prevención de la salud, que deben iniciarse al manifestar la mujer deseo de gestación1.
La consulta preconcepcional comprende una actualización de la situación clínica, detectar circunstancias subsidiarias de cuidados adicionales, recomendar ingesta de 400 μg de ácido fólico, uno a dos meses antes de la concepción para evitar defectos del tubo neural (DTN)3-5 (recomendación fuerte), identificación de posibles riesgos de exposición laboral-ambiental (Ley 39/1999 de conciliación de la vida familiar y laboral)6 y promocionar hábitos saludables en la mujer y su pareja. En caso de antecedentes familiares o personales de enfermedades hereditarias o historia de complicaciones obstétricas previas, realizar consejo reproductivo.
En caso de enfermedades previas, evaluar grado de control de las mismas y su compatibilidad con un embarazo: hay que supervisar la medicación actual suprimiendo la prescindible y sustituir si es necesario, por medicamentos seguros en el embarazo. En caso de hipertensión arterial sustituir teratógenos como IECA o ARA-II por alfametildopa o labetalol. En caso de epilepsia sustituir los de alto/moderado riesgo de malformaciones (valproato/carbamazepina, oxcarbazepina, zonisamida) por los de mínimo riesgo (lamotrigina, levetiracetam)7. Si hay hipotiroidismo, planificar el aumento del 20 al 30% de la dosis inmediatamente al inicio del embarazo8 (recomendación fuerte).
En mujeres con diabetes mellitus (1 y 2) se recomienda planear anticipadamente la gestación, ya que un buen control metabólico en meses previos y durante el embarazo, se asocia a disminución del riesgo de abortos y embriopatía9. El riesgo es mayor si ya existe vasculopatía. Se recomienda HbA1c en un rango lo más parecido al normal, si se puede lograr de manera segura: HbA1c < 6,5% sin hipoglucemias significativas y glucemia capilar al despertar 90-125 mg/dL y antes de las comidas en otros momentos del día 72-125 mg/dL9,10. Con HbA1c pregestacional > 10 se desaconseja la gestación9 (recomendación débil).
Ofertar serología para cribado de hepatitis C en visita preconcepcional mediante estrategia de alto riesgo puede evitar el embarazo en mujeres portadoras11 (recomendación débil).
En el embarazo, la primera visita será lo más precoz posible, antes de la semana 12 de gestación, se aconseja una visita/mes, ya que el seguimiento con más de 8-12 visitas no mejora los resultados, un menor número de visitas se asocia a peores resultados12 (recomendación débil). En la tabla 1 se recogen las intervenciones en el seguimiento de embarazos sin necesidad de cuidados adicionales en atención primaria13.
Seguimiento del «embarazo sin necesidad de cuidados adicionales» (ESNCA)
| Semana | Anamnesis | Exploraciones | Analíticas | Consejos | Inmunizaciones |
|---|---|---|---|---|---|
| Muy precozMF | - Antecedentes familiares, personales, gineco-obstétricos.FM, FO, FUR.Hábitos.- Aceptación, molestias, síntomas,- Valorar factores de riesgo, incluido riesgo social, laboral y maltrato.- Valorar e informar sobre diagnóstico prenatal | Peso, talla, TA, exploración general.Obstetra: Situaciones especiales. | - Hemograma,- Grupo, Rh y Coombs indirecto.- Serologías: Lúes, rubéola, VIH, HbsAg.Chagas si indicado.- Urocultivo- TSH > 30 años o riesgo- Cribado DM si riesgo.- Marcadores bioquímicos 1°T9-10 S, si acepta | GeneralesDieta equilibrada.Consejos toxoplasma-listeria.Dejar de fumar y no beber alcohol.Moderar café.Asistir a los controles.Educación maternalNo usar antisépticos yodados.Apoyo lactancia.Informar sobre analgesia y anestesia en el parto, plan de parto, entregar hoja informativa y consentimiento informadoSituaciones especialesApoyo socialDetección violencia de géneroCambio puesto de trabajo (tareas de riesgo) | Vacunacionesindicadas:Tétanos –antidiftérica de adulto (si no estaba previamente vacunada)Gripe si coincide con la temporada (en cualquier edad gestacional)(28-32 S)gammaglobulina antiD a Rh- no sensibilizadas(27-36 S)Vacuna combinada tétanos -difteria y tosferina (dTpa)Resto de vacunas: Ver capítulo sobre Inmunizaciones |
| 12Obstetra | ¿Cómo se encuentra?¿Le preocupa algo?¿Hábitos?Revisar lo relevante de historia clínica y evolución. | Peso, TA, Ecografía, con o sin diagnóstico prenatal. | Resultados diagnóstico prenatal si se realiza. | ||
| 16MF | Peso, TA, altura uterina, latidos fetales | Marcadores bioquímicos 2°T casos especiales (15-19 S) | |||
| 20Obstetra | Peso, TA, Ecografía estudio estructural. | ||||
| 24MF | Peso, TA, altura uterina, latidos fetales | (24 -28 S) Hemograma, cribado diabetes,Coombs indirecto en mujeres Rh- | |||
| 28MF | Peso, TA, altura uterina, latidos fetales | ||||
| 32-34Obstetra | Peso, TA, Ecografía, estudio crecimiento fetal | ||||
| 36MF | Peso, TA, altura uterina,latidos fetales,estática fetal | (36-37 S) Estudio de coagulación con plaquetas. Cultivo vagino-rectal EGB | |||
| 38MF | Peso, TA, altura uterina, latidos fetales,estática fetal | Evaluar y anotar todos los resultados | |||
| 39-40Obstetra | Peso, TA, ecografía |
MF: Médico de familia; FM; Fórmula menstrual; FO: Fórmula Obstétrica; FUR: Fecha última regla; S: Semana; EGB: Estreptococo grupo B; TA: Tensión arterial; DM: Diabetes mellitus.
Para prevenir la transmisión vertical de infecciones se recomienda solicitar a todas las mujeres al inicio del embarazo las siguientes serologías: lúes14,15 (recomendación débil); rubéola16(recomendación fuerte), si es negativa vacunar tras el parto; virus de la inmunodeficiencia humana (VIH)17 (recomendación fuerte); hepatitis B11 (recomendación fuerte). La serología de toxoplasmosis no está recomendada, presenta balance riesgo-beneficio negativo por la baja incidencia de enfermedad, la dificultad diagnóstica y el riesgo teratogénico del tratamiento. Se debe insistir mucho en las medidas preventivas18,19 (tabla 2) (recomendación débil). Ofertar serología para cribado de enfermedad de Chagas, a las mujeres procedentes de países latinoamericanos con endemia20,21 (recomendación fuerte), (tabla 3). En portadoras no hay indicación de cesárea. No realizar cribado de hepatitis C en gestantes22, ya que no existen estrategias efectivas para reducir el riesgo de transmisión (recomendación fuerte).
Recomendaciones frente a toxoplasma
| • Usar guantes y limpiar bien manos y uñas al manipular arena, tierra o al hacer labores de jardinería |
| • Evitar el contacto con los gatos y sus excrementos |
| • Mantener a los gatos domésticos en el interior, dar solo comida cocinada o seca |
| • Comer solo carne que esté bien cocida, a más de 70°C |
| • No tomar alimentos elaborados con carnes crudas (ahumados, embutidos o jamón se pueden tomar si previamente se congelan a −20°C/48 h) |
| • Lavado de hortalizas, frutas y verduras antes de consumir |
| • Lavado de manos y utensilios de cocina tras manipular carnes crudas |
| • La refrigeración (+4°C) no destruye el parásito y la cocción en microondas, tampoco |
Fuente: referencias bibliográficas 18,19.
Serología de Chagas
| Falsos positivosReacción cruzada con los antígenos de leishmania, plasmodio mycobacteria tuberculosa y Treponema pallidum | Falsos negativos,Cuadros de inmunodeficiencias, pacientes ya tratados de enfermedad de Chagas, y en portadores de VIH* |
Fuente: referencias bibliográficas 20,21 *VIH: Virus inmunodeficiencia humana.
Para evitar el riesgo de infección por listeria, recomendar a las gestantes que dejen de tomar alimentos envasados que no precisen un cocinado previo a su consumo23 (tabla 4)
Recomendaciones frente a infección por listeria
| Cocinar a más de 70°C durante dos minutosEvitar que la temperatura del frigorífico supere los 4°C.Alimentos contaminados más frecuentes:• Productos cárnicos envasados (embutidos, carne mechada, jamón cocido)• Pescados ahumados• Ensaladas y frutas envasadas• Patés refrigerados• Leche no pasteurizada o cruda• Quesos frescos o de pasta blanda elaborados con leche no pasteurizada (fresco, mozzarella, feta, brie, camembert, roquefort): quitar la corteza al queso |
Fuente: Listeriosis. Agencia Española de Seguridad Alimentaria y Nutrición. Actualizado a 18/10/2019- Disponible en http://www.aecosan.msssi.gob.es/AECOSAN/web/seguridad_alimentaria/subdetalle/listeria.htm.
Se debe prevenir la exposición a la hipertermia24. Son fármacos contraindicados en la gestación: dietilestilbestrol, talidomida, misoprostol, andrógenos, dosis > 5.000 U de vitamina A y retinoides. Ante dudas al prescribir un medicamento, se debe consultar siempre la ficha técnica actualizada (apartado 4.6: datos clínicos de uso en fertilidad, embarazo y lactancia) disponible online en la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS): https://www.aemps.gob.es/cima/publico/home.html. Evitar la automedicación, pero no abandonar tratamientos específicos (antiepilépticos, antiasmáticos, HTA) adecuándolos con aquellos compatibles con el embarazo. Recomendar abandono del hábito tabáquico (recomendación fuerte). No tomar alcohol, no hay dosis segura (recomendación fuerte). Aconsejar bajar el consumo de cafeína a 150 mg/día (una taza de café contiene entre 100-150 mg), cifras > 300 mg/día pueden inducir abortos, infertilidad y teratogenia25.
Para evitar los DTN se recomienda la ingesta diaria de 400 μg de ácido fólico, desde el diagnóstico de embarazo (si la mujer no lo tomó antes de la concepción) y continuar hasta cierre del tubo neural, semana 12 de gestación3,5,6 (recomendación fuerte). En mujeres de alto riesgo se recomienda una dosis diaria de 5 mg de ácido fólico (tabla 5). No se debe ofrecer suplementos de hierro sistemáticamente. El cribado de anemia se realiza mediante la determinación de hemoglobina/hematocrito en la primera visita y otra entre las semanas 24-28 (recomendación débil), siendo diagnóstico un valor de hemoglobina inferior a 11 g/dL. La confirmación de anemia ferropénica se realiza con una determinación de ferritina sérica4,14 (recomendación fuerte).
Prevención con ácido fólico de los defectos del tubo neural (DTN)
| • Mujeres de alto riesgo (antecedentes de gestación con DTN), diabéticas, obesidad con IMC > 35 y epilépticas con tratamiento anticonvulsivante, con deseo de gestación: 5 mg/día de ácido fólico tres meses antes de la concepción y en los primeros tres meses del embarazo |
| • Mujeres de bajo riesgo (sin antecedentes de gestación con DTN) con deseo de gestación: 0,4-0,8 mg/día de ácido fólico un mes antes de la concepción y en los primeros tres meses del embarazo |
| • Mujeres en edad fértil con posibilidad de embarazo no planificado: 0,4 mg de ácido fólico diario |
Fuente: referencias bibliográficas 3-6.
Durante el embarazo se produce un incremento de la función tiroidea, aumentando los requerimientos diarios de yodo, pasando de 150 a 250 μg/día. La suplementación de yodo durante el embarazo y la lactancia actualmente no está justificada en España de forma generalizada6,26,27 (recomendación débil). Se puede alcanzar una ingesta de yodo suficiente con el uso de sal yodada y la toma diaria de tres raciones de lácteos o sus derivados (recomendación débil). Otros alimentos, como las legumbres y el pescado, también tienen un elevado contenido en yodo. En caso de gestantes con ingesta insuficiente en dieta, se puede indicar el suplemento de 200 μg/día de yoduro potásico durante el embarazo y lactancia6,26,27,28 (recomendación débil).
Algunos grupos recomiendan el cribado sistemático de disfunción tiroidea en la gestación29,30. Sin embargo, esta estrategia no ha demostrado beneficio en variables maternas o infantiles31,32. Se recomienda un cribado en gestantes con riesgo elevado de enfermedad tiroidea (tabla 6), de acuerdo con guías internacionales y nacionales33-35(recomendación débil). El cribado para mayores de 30 años incluye a la mayoría de gestantes en nuestro país, se desconoce el impacto de esta medida en nuestra población.
Factores de riesgo para el cribado de enfermedad tiroidea, en gestantes, en la primera visita de embarazo
| Edad mayor de 30 añosHistoria familiar de enfermedad tiroidea autoinmune o hipotiroidismoPresencia de bocioPositividad de anticuerpos antitiroideos, principalmente anticuerpos antiperoxidasaSíntomas y signos clínicos sugestivos de hipofunción tiroideaDiagnóstico de diabetes mellitus 1 u otros trastornos tiroideosAntecedentes de infertilidadAntecedentes de aborto o parto pretérminoAntecedentes de irradiación de cabeza o cuello o cirugía tiroidea previaGestante en tratamiento sustitutivo con levotiroxinaResidente en zonas presumiblemente deficientes en yodo |
Fuente: Agencia de Evaluación Tecnologías Sanitarias Andalucía. Guía de Práctica Clínica de Atención en el Embarazo y Puerperio. Ministerio de Sanidad, Servicios Sociales e Igualdad. Agencia de Evaluación de Tecnologías Sanitarias de la Consejería de Igualdad, Salud y Políticas Sociales de Andalucía; 2014. Guías de Práctica Clínica en el SNS: AETSA 2011/10.
Existe acuerdo sobre la indicación de tratamiento en el embarazo del hipotiroidismo clínico (HipoC). Hay controversia para el manejo del hipotiroidismo subclínico (HipoSC) con T4 libre normal y niveles de TSH entre 4* y 10 mU/L (* > percentil 97,5 para valores de referencia propios) con T4L normal; sí hay consenso en tratar si los niveles de TSH > 10 mU/L independientemente de los valores de T4 libre8,33,35. Para ajustar el tratamiento con levotiroxina se deben considerar rangos de TSH y T4 trimestre-específicos propios o recomendando como límite superior de la normalidad para la TSH en el primer trimestre del embarazo 2,5 mU/ L y en el segundo y tercer trimestres 3,0 mU/ L8.
Al inicio del embarazo se debe valorar el índice de masa corporal (IMC), ya que la obesidad o la delgadez extrema se asocian con malos resultados obstétricos6,36 (recomendación fuerte).
Se debe realizar la toma de presión arterial en todas las visitas para cribado de preeclampsia4,6,37 (recomendación fuerte). Los estados hipertensivos inducidos por el embarazo (EHE) son una de las cuatro primeras causas de mortalidad materna y de morbilidad perinatal. No se recomienda el cribado mediante determinación de proteinuria38 (recomendación débil). Actualmente se está llevando a cabo la prevención de preeclampsia en mujeres con factores de alto riesgo mediante uso de ácido acetilsalicílico (AAS) 60-150 mg/día desde final del primer trimestre. Una reciente revisión sistemática muestra resultados favorables para algunas variables de morbimortalidad materno fetal39, aunque debería individualizarse el riesgo antes de tomar la decisión40,41.
A todas las gestantes se les debe solicitar grupo sanguíneo, factor Rh y test de Coombs indirecto en la primera visita4,6,14 (recomendación fuerte). El test Coombs indirecto debe repetirse en la semana 28 a las gestantes con Rh negativo4,6,14 (recomendación fuerte). La incidencia de isoinmunización ha descendido desde que se estableció la profilaxis con gammaglobulina específica anti-D: en gestantes Rh− se recomienda administrar una dosis completa (300 μg) de inmunoglobulina anti-D si el test de Coombs indirecto es negativo en el tercer trimestre4,6,14 (recomendación fuerte). El cribado de bacteriuria asintomática (BA) para la prevención de complicaciones perinatales se debe realizar mediante solicitud de urocultivo en la primera visita4,6,14 (recomendación fuerte). La BA de la gestante (> 100.000 colonias/mL), incluida la BA por estreptococo del grupo B (EGB)42 se debe tratar siempre.
No hay pruebas concluyentes de que la realización sistemática de ecografías mejore los resultados obstétricos. Se recomienda la realización de ecografía obstétrica en la semana 12 de gestación para cribado de gestaciones múltiples, malformaciones-cromosomopatías y la realización de ecografía en el segundo trimestre, una vez completada la organogénesis, para cribado de malformaciones congénitas4,6 (recomendación fuerte). Se recomienda la auscultación de latidos fetales mediante Doppler a partir de la semana 12. No está recomendado el registro ecocardiotocográfico sistemáticamente anteparto.
Actualmente en España el 8-10% de los partos son partos pretérmino (PPT). Revisiones sistemáticas muestran la reducción de la incidencia de PPT mediante cribado universal, en gestantes de 18-24 semanas, asintomáticas y con embarazo simple, a través de la medida ecográfica de la longitud cervical y tratamiento con progesterona (recomendación débil), aunque existe controversia debido a su reducido impacto en términos absolutos y en variables centradas en la paciente43,44.
La prevalencia de diabetes mellitus gestacional (DMG) en España oscila entre un 6 y un 8%; no hay pruebas suficientes para determinar si el cribado de DMG o qué tipo de cribado pueden mejorar los resultados de salud materna e infantil. En general se recomienda realizar cribado universal en semana 2414,45 (recomendación débil) o al inicio del embarazo si existen factores de riesgo que sugieran la existencia de una diabetes mellitus previa no diagnosticada46 (tabla 7). Para el cribado se utiliza el test de O'Sullivan. Con resultado ≥ 140 mg de glucemia debe realizarse un test diagnóstico de sobrecarga oral de glucosa (SOG), con 100 g de glucosa y cuatro determinaciones de glucemia: basal, a una, dos y tres horas de ingerir la glucosa. Se ha propuesto la realización alternativa del test de SOG con 75 g de glucosa y tres determinaciones de glucemia: basal, a una y dos horas de la ingesta de glucosa47-49 siendo positivo con un solo valor alterado50. Esta estrategia ha sido incorporada, entre otras, a las recomendaciones de la NICE14. La aplicación de esta estrategia aumenta el número de mujeres diagnosticadas de DMG, aunque no existe evidencia sobre los beneficios del tratamiento.
Factores de riesgo. Diabetes gestacional (DG)
| • Historia de diabetes en familiares de primer grado• Obesidad definida como un IMC > 30• Antecedentes de tolerancia alterada a la glucosa o DG• Malos antecedentes obstétricos (abortos, muerte fetal sin causa, macrosomía fetal [> 4 kg], malformaciones)• Pertenencia a grupo étnico con elevada prevalencia (afroamericana, indias Pyma, etc.) |
Fuente: referencias bibliográficas 14,45,46. IMC: índice de masa corporal.
Se recomienda realizar cultivo vaginorrectal a todas las gestantes entre las semanas 35 y 37 para prevenir la sepsis neonatal, meningitis y neumonías por Streptococcus agalactiae del grupo B (EGB)4,6,51 (recomendación débil). No hay que tratar a las portadoras; la profilaxis antibiótica se realiza cuando se inicia el parto.
Las técnicas de cribado del primer trimestre permiten valorar en la gestante, el riesgo de ser portadora de un feto con alteración cromosómica52-54. El cribado en el primer trimestre o cribado combinado se realiza en dos pasos, mediante la determinación en sangre materna de marcadores bioquímicos (proteína A plasmática asociada al embarazo [PAPP-A] y fracción β-libre de la gonadotrofina coriónica humana [β-hCG]) que se realiza entre las semanas 9-10 de gestación, y el estudio ecográfico (translucencia nucal, huesos nasales, ángulo facial, pulsatilidad ductus venoso, regurgitación tricuspídea) entre las semanas 11-13+6 (recomendación fuerte). El cribado del segundo trimestre mediante marcadores bioquímicos (alfa-fetoproteína [AFP], β-hCG, estradiol no conjugado e inhibina A), se ofrecerá entre las semanas 15-19 de gestación, solo a las gestantes que no se hayan podido hacer el cribado del primer trimestre. Las técnicas diagnósticas son la biopsia corial en el primer trimestre y la amniocentesis en el segundo. Se está incorporando a los programas de cribado un nuevo test55-57 que detecta el ADN fetal en sangre materna, es una prueba segura, la extracción sanguínea materna se puede realizar entre las semanas 10-22 de gestación y el resultado se puede tener en una semana. Al tratarse de una prueba de cribado, un resultado positivo requiere confirmación mediante biopsia corial o amniocentesis.
Durante el embarazo se consideran vacunas seguras aquellas en las que el material utilizado son virus o bacterias muertas o inactivados (gripe, hepatitis B). Cuando la gestación coincida con época de gripe estacional se recomienda vacunar a la embarazada6,58-60 (recomendación fuerte). Debido al aumento de incidencia de tosferina, se recomienda actualmente la vacunación de las embarazadas preferiblemente en la semana 28 a 32 (aunque se puede vacunar hasta la 36) con la vacuna dTPa (difteria, tétanos y Pertussis acelular de baja carga antigénica) como estrategia para disminuir la transmisión de tosferina a los niños en los primeros meses de vida61-65 (recomendación fuerte). En caso de riesgo de exposición se puede administrar vacuna meningocócica, poliomielitis parenteral, rabia y hepatitis A.
No se dispone de información sobre la seguridad en el embarazo de las vacunas tifoidea parenteral y del cólera. En caso necesario realizar balance riesgo-beneficio. Durante el embarazo está contraindicada la administración de vacunas en las que el material usado sean virus o bacterias vivos o atenuados (sarampión, rubéola parotiditis)66 (recomendación fuerte).
La guía CHEST 2012 recomienda valorar la indicación de tromboprofilaxis en embarazo y postparto de forma individualizada67 (recomendación débil). La enfermedad tromboembólica venosa es una de las principales causas de morbimortalidad materna. Sin embargo, el impacto real de las medidas puede ser reducido: la mayoría de casos son de trombosis venosa profunda y ocurren en el postparto68.
El embarazo es una situación de mayor vulnerabilidad para sufrir violencia de género. A su vez, esta se asocia a mayor morbimortalidad materno-fetal. Se recomienda la detección activa de maltrato69.
En la actual situación de pandemia, existen todavía pocos datos referentes a la infección por SARS-CoV-2 durante la gestación. No parece haber diferencias en la presentación de la enfermedad en embarazadas respecto a población general. La infección de curso grave podría asociarse a enfermedad neonatal, si bien actualmente no hay constancia de transmisión vertical de SARS-CoV-2 ni de MERS-CoV70.
AnticoncepciónIntroducción y magnitud del problemaLas actividades preventivas en anticoncepción deben estar dirigidas a ayudar a mujeres y varones a planificar y espaciar los embarazos, evitar embarazos no planificados (ENP) y reducir el número de abortos. Estas actividades anticonceptivas se deben ofrecer con unos criterios de calidad que parten de un conocimiento científico actualizado, garantizando una información centrada en el/la paciente sobre la seguridad y efectividad de los diferentes métodos, en el momento que los demanda y con un servicio eficiente, accesible y con equidad71.
La tasa de interrupciones voluntarias del embarazo (IVE) por 1.000 mujeres de entre 15 y 44 años de edad en España ha tenido una tendencia creciente hasta el año 2011, con una disminución progresiva pasando de una tasa, ese año, de 12,47 a 10,36 en el 2017. Durante 2018 y 2019 existe cierto incremento, para volver a descender hasta 10,33 en el 2020, con un total de 86.990 IVE ese año. La anticoncepción de emergencia se lleva utilizando en Europa desde hace más de 20 años, con una implantación diferente entre los países; sin embargo es la entrada de la libre dispensación lo que ha facilitado de forma significativa su utilización. Se estima que durante el 2020 un total de 38,4% de las mujeres en edad fértil han tenido que utilizarla al menos una vez72 Según la última encuesta de fertilidad del INE, realizada en el 2018 (15.000 mujeres), el 44,4% de las mujeres en edad fértil no utilizan ningún método anticonceptivo (tabla 8)73; según los datos de la encuesta realizada por la Sociedad Española de Contracepción en el 2020 (1.800 mujeres) sería del 39%. Este porcentaje es menor en la población con edad inferior a 25 años74: 25% en las de 20-25 años y 34% en las de menos de 20 años. Ante estos datos es fundamental revisar y elaborar nuevas estrategias dentro de la AP que faciliten la anticoncepción como una de las actividades preventivas.
Utilización de anticonceptivos en España (porcentaje)
| No usa anticoncepcion | Usa anticoncepcion | Anticonceptivos hormonales (oral,parche,anillo) | DIU de cobre | Preservativo | Cotius interruptus | Ligadura de trompas o vasectomia | Otros métodos | |
|---|---|---|---|---|---|---|---|---|
| Total | 44,48 | 55,52 | 21,17 | 3,13 | 23,98 | 0,8 | 5,12 | 1,33 |
| Menos de 25 años | 34,53 | 65,47 | 32,78 | 1,13 | 29,51 | 0,54 | , | 1,38 |
| De 25 a 29 años | 25 | 75 | 40,99 | 1,88 | 30,23 | 0,48 | , | 1,31 |
| De 30 a 34 años | 39,24 | 60,76 | 26,06 | 2,49 | 27,13 | 1,74 | 1,86 | 1,47 |
| De 35 a 39 años | 38,8 | 61,2 | 22,12 | 4,54 | 28,14 | 1,08 | 4,07 | 1,25 |
| De 40 a 44 años | 39,03 | 60,97 | 18,12 | 4,92 | 26,59 | 0,78 | 8,8 | 1,76 |
| De 45 a 49 años | 50,01 | 49,99 | 14,,03 | 3,94 | 20,78 | 0,81 | 8,92 | 1,51 |
| 50 y más años | 71,24 | 28,76 | 6,31 | 2,19 | 11,24 | 0,33 | 7,98 | 0,71 |
Notas
El símbolo “,” debe interpretarse como dato que no se proporciona por muestra insuficiente.
Fuente:
Instituto Nacional de Estadística. Encuesta de fecundidad 2018.
La evidencia sobre la efectividad del consejo contraceptivo estructurado en diferentes ámbitos asistenciales en general muestra resultados favorables, si bien es escasa y con limitaciones metodológicas74-77. Estudios observacionales que analizan el impacto del consejo contraceptivo facilitado en el ámbito de la AP concluyen que se asocia a un incremento de uso de los anticonceptivos hormonales y puede reducir los ENP78. Organismos como el CDC aconsejan ofrecer consejo anticonceptivo en todas las visitas con mujeres en edad reproductiva71; es más, cuando se implantan medidas organizativas que permiten en una sola visita hacer el consejo anticonceptivo y facilitar el acceso a cualquiera de ellos, se eleva el número de mujeres que utilizan anticoncepción79.
La efectividad del consejo depende de su contenido, teniendo en cuenta los intereses individuales y los grupos de edad80,81. Hay evidencia de efectividad en el posparto con la entrega de hojas informativas y la visita puerperal a domicilio82-84. Las evidencias sobre la mejora del uso de anticonceptivos basadas en teléfonos móviles y redes sociales son aún limitadas85.
Algunas intervenciones efectuadas en el medio escolar y en centros de planificación familiar parecen ayudar a prevenir los ENP86,87. En población adolescente, el consejo debería incluir la prevención de infecciones de transmisión sexual (ITS)88. Los programas más efectivos son los que no se limitan a dar información acerca de la sexualidad y la anticoncepción, sino que ofrecen acceso a los métodos y apoyo psicológico, aunque la efectividad desaparece cuando se interrumpen estas actividades.
Los médicos de familia (MF), en consulta, deben descartar la posibilidad de embarazo al prescribir fármacos con potencial teratógeno, o al solicitar estudios radiológicos89, y abordar la anticoncepción como una actividad preventiva más. Al realizar el consejo personalizado deben mantener actualizados los criterios médicos para elegir un anticonceptivo90, investigar las preferencias de la mujer y orientar cómo usarlos de manera segura y eficaz88,91 y para facilitar el consejo anticonceptivo en consulta es de utilidad la aplicación móvil iContraception, que recoge los criterios de elegibilidad de la Organización Mundial de la Salud (OMS)92.
Hay que señalar que en el caso de los abortos con aspiración/legrado, se podría utilizar el mismo acto quirúrgico para insertar un dispositivo intrauterino (DIU). Asimismo, se podría iniciar inmediatamente anticoncepción hormonal (progestágeno, combinado o implante)93.
Eficacia de los métodos anticonceptivosLa eficacia anticonceptiva se evalúa midiendo el índice de Pearl, número de fallos por cada 100 mujeres-año de exposición (tabla 9)94. Para el abordaje clínico se debe tener en cuenta, sobre todo, la eficacia real, el «uso típico», las cifras de continuidad de uso, la aceptabilidad y no tanto el «uso perfecto». Para la mayoría de los métodos hay evidencia de una eficacia alta. La mayoría de las mujeres sobrestima la eficacia de píldoras y preservativos95. Es muy importante evitar la desprotección en los cambios de método (tabla 10).
Porcentaje de mujeres que experimentan un embarazo no deseado durante el primer año de uso y porcentaje de mujeres que continúan usando el método al final del primer año (Estados Unidos)
| Método | % de mujeres que experimentan un embarazo no deseado durante el primer año de uso | % de mujeres que continúan usando el método al año | |
|---|---|---|---|
| Uso habitual | Uso perfecto | ||
| Ningún método | 85 | 85 | |
| Espermicidas | 28 | 18 | 42 |
| Coitus interruptus | 22 | 4 | 46 |
| Abstinencia periódica | 24 | 47 | |
| Calendario | 5 | ||
| Ovulación | 3 | ||
| Sintotérmico | 0,4 | ||
| Esponja vaginal | 36 | ||
| Multíparas | 24 | 20 | |
| Nulíparas | 12 | 9 | |
| Diafragma con espermicida | 12 | 6 | 57 |
| Preservativo | |||
| Femenino | 21 | 5 | 41 |
| Masculino | 18 | 2 | 43 |
| Píldora combinada y píldora de solo gestágeno | 9 | 0,3 | 67 |
| Parche homonal combinado (Evra) | 9 | 0,3 | 67 |
| Anillo hormonal combinado (Nuvaring) | 9 | 0,3 | 67 |
| Inyectable trimestral (depo-progevera) | 6 | 0,2 | 56 |
| DIU | |||
| T de Cobre (Paragard) | 0,8 | 0,6 | 78 |
| DIU-LNG (Mirena) | 0,2 | 0,2 | 80 |
| Implante subcutáneo (Implanon) | 0,05 | 0,05 | 84 |
| Ligadura tubárica | 0,5 | 0,5 | 100 |
| Vasectomía | 0,15 | 0,1 | 100 |
Fuente: Trussell J. Contraceptive failure in the United States. Contraception. 2011;83(5):397-404.
Prevención de la desprotección en los cambios de anticonceptivos
| Cambio de: | Cambio a: | ||||||
|---|---|---|---|---|---|---|---|
| Píldora | Parche | Anillo | Gestágeno inyectable | Implante de gestágeno | DIU de gestágeno | DIU de cobre | |
| Píldora | Sin hueco: tomar la primera píldora del nuevo paquete el día después de tomar cualquier píldora del antiguo envase. | Comenzar con el parche un día antes de dejar la píldora. | Sin hueco: Insertar el anillo un día después de tomar cualquier píldora del envase. | Poner la primera inyección siete días antes de dejar la píldora | Insertar el implante cuatro días antes de dejar la píldora | Insertar el DIU de gestágeno siete días antes de dejar la píldora | Puede insertarse el DIU de cobre hasta cinco días después de dejar la píldora |
| Parche | Iniciar la píldora un día antes de dejar el parche. | - | Sin hueco: Insertar el anillo y retirar el parche el mismo día. | Poner la primera inyección siete días antes de retirar el parche | Insertar el implante cuatro días antes de retirar el parche. | Insertar el DIU de gestágeno siete días antes de retirar el parche | Puede insertarse el DIU de cobre hasta cinco días después de retirar el parche. |
| Anillo | Iniciar la píldora un día antes de retirar el anillo. | Comenzar el parche dos días antes de retirar el anillo. | - | Poner la primera inyección siete días antes de retirar el anillo. | Insertar el implante cuatro días antes de retirar el anillo. | Insertar el DIU de gestágeno siete días antes de retirar el anillo. | Puede insertarse el DIU de cobre hasta cinco días después de retirar el anillo. |
| Gestágeno inyectable | Puede tomarse la primera píldora hasta 15 semanas después de la última inyección. | Puede iniciarse el parche hasta 15 semanas después de la última inyección. | Puede insertarse el anillo hasta 15 semanas después de la última inyección. | - | Puede insertarse el implante hasta 15 semanas después de la última inyección. | Puede insertarse el DIU de gestágeno hasta 15 semanas después de la última inyección. | Puede insertarse el DIU de cobre hasta dieciséis semanas después de la última inyección |
| Implante de gestágeno | Iniciar la píldora siete días antes de retirar el implante | Iniciar el parche siete días antes de retirar el implante | Iniciar el anillo siete días antes de retirar el implante | Poner la primera inyección siete días antes de retirar el implante | - | Insertar el DIU de gestágeno siete días antes de retirar el implante | Puede insertarse el DIU de cobre hasta cinco días después de retirar el implante |
| DIU de gestágeno | Iniciar la píldora siete días antes de retirar el DIU | Iniciar el parche siete días antes de retirar el DIU | Iniciar el anillo siete días antes de retirar el DIU | Poner la primera inyección siete días antes de retirar el DIU | Insertar el implante cuatro días antes de retirar el DIU | - | Puede insertarse un DIU de cobre en el mismo acto de retirada del DIU de gestágeno |
| DIU de cobre | Comenzar la píldora siete días antes de retirar el DIU | Comenzar el parche siete días antes de retirar el DIU | Comenzar el anillo siete días antes de retirar el DIU | Poner la primera inyección siete días antes de retirar el DIU | Insertar el implante cuatro días antes de retirar el DIU | Insertar el DIU de gestágeno en el mismo acto de retirada del DIU de cobre y usar método de respaldo siete días | - |
Fuente: Lesnewski R, Prine L, Ginzburg R. Preventing gaps when switching contraceptives. Am Fam Physician 2011;83(5):567-70. Disponible en: http://www.aafp.org/afp/2011/0301/p567.html. Adaptado de Reproductive Health Access Project. http://www.reproductiveaccess.org.
Los anticonceptivos reversibles de larga duración (ARLD), es decir, el DIU y los implantes subcutáneos, son métodos que no requieren cumplimiento y son los más coste-efectivos (tabla 11) en todos los grupos de edad96. Estos métodos están infrautilizados en España, donde solo 8,6% de las mujeres en edad fértil utiliza el DIU, frente a 21,4% en Francia97. Sería deseable que se implantasen estrategias para su utilización en AP98,99,100.
Queremos destacar que entre las mujeres adolescentes incluidas en el proyecto CHOICE, la gran mayoría prefería un ARLD101; además en las adolescentes, los ARLD han demostrado reducir las tasas de embarazos, partos y abortos102. Se podría doblar su uso si se retiran las barreras de acceso para la inserción103,104. Es importante señalar que los últimos datos de fallos de DIU de cobre (0,52%) y de LNG (0,06%)105 son inferiores que los de la ligadura tubárica (2%).
Al dejar un método para pasar a otro, se deben evitar las interrupciones, solapándolos cuando sea necesario hasta que el nuevo método sea ya eficaz (tabla 10)106.
Abordaje de los métodos y efectos secundariosNo hay estudios específicos sobre los requisitos previos ni sobre los controles posteriores que se deben realizar. Existe consenso entre las principales guías de práctica clínica107, y opiniones de expertos108-110.
Antes de utilizar cualquier anticonceptivo es preciso tener presente si cumple criterios de elegibilidad (tablas 11-15)
Categorías OMS de las condiciones que afectan a la elegibilidad de los anticonceptivos
| 1. Ninguna restricción para el uso del método |
| 2. Las ventajas de usar el método son mayores que los posibles riesgos |
| 3. Los posibles riesgos de usar el método son mayores que las ventajas |
| 4. El riesgo de usar el método es inaceptable |
Fuente: World Health Organization. Reproductive Health and research. Improving access to quality care in family planning. Medical eligibility criteria for contraceptive use. 5ª edición. World Health Organization; 2015. Disponible en: http://apps.who.int/iris/bitstream/10665/181468/1/9789241549158_eng.pdf
Contraindicaciones de los anticonceptivos hormonales combinados (AHC)
| Categorías OMS | |
|---|---|
| Lactancia: < 6 semanas posparto / 6 semanas-6 meses posparto | 4 / 3 |
| Posparto (sin lactancia materna): < 21 días (+ factores riesgo TEV) / >/= 21 días (+ factores riesgo TEV) | 3 (4) / 2(3) |
| Fumadora >/= 35 años: < 15 cigarrillos/día / >= 15 cigarillos/día | 3 / 4 |
| Múltiples factores de riesgo cardiovascular (edad avanzada, tabaco, diabetes, hipertensión y dislipemia conocida): previo / durante el uso | 3 / 4 |
| HTA (mmHg): historia – HTA buen control - PAS 140-159 o PAD 90-99 / PAS >/= 160 o PAD > /= 100 / enfermedad vascular | 3 / 4 / 4 |
| TVP y/o TEP: historia/en fase aguda, con o sin terapia anticoagulante | 4 / 4 |
| Cirugía mayor con inmovilización prolongada | 4 |
| Trombofilia con mutaciones conocidas (factor V Leiden; protrombina; déficit proteína S, proteína C, antitrombina) | 4 |
| Cardiopatía isquémica: actual o historia | 4 |
| Ictus: actual o historia | 4 |
| Valvulopatía cardíaca complicada (hipertensión pulmonar, FA, historia de endocarditis bacteriana subaguda) | 4 |
| LES con anticuerpos antifosfolípidos+ o no conocidos | 4 |
| Migraña: sin aura < 35 años aparece durante uso / > 35 historia-aparece durante uso / con aura | 3 / 3-4 / 4 |
| Cáncer de mama: sin recurrencia en 5 años / en curso | 3 / 4 |
| DM con: nefropatía, retinopatía, neuropatía / otra enfermedad vascular o DM > 20 años duración | 3-4* |
| Litiasis vesicular sintomática activa y/o con tratamiento médico | 3 / 2 CIC |
| Historia de colestasis relacionada con AHC | 3 / 2 CIC |
| Hepatitis viral aguda. | 3-4* I |
| Cirrosis severa (descompensada). Adenoma | 4 / 3 CIC |
| Carcinoma hepático. | 4 / 3-4* CIC |
| Interacciones: fenitoína, carbamazepina, barbitúricos, primidona, topiramato, oxcarbazepina, rifampicina, rifabutina | 3 / 2 CIC |
| Interacciones: lamotrigina | 3 |
CIC: anticonceptivo inyectable combinado; DM: diabetes mellitus; FA: fibrilación auricular; HTA: hipertensión arterial; I: inicio; LES: lupus eritematoso sistémico; PAD: presión arterial diastólica; PAS: presión arterial sistólica; TEP: tromboembolia pulmonar; TVP: tromboembolia venosa profunda.
En función de gravedad de condición médica.
Fuente: World Health Organization. Reproductive Health and Research. Improving access to quality care in family planning. Medical eligibility criteria for contraceptive use. 5th ed. Geneva: WHO; 2015. Disponible en: http://apps.who.int/iris/bitstream/10665/181468/1/9789241549158_eng.pdf
Contraindicaciones de los anticonceptivos hormonales de solo gestágeno (AHSG)
| Categoría OMS | |
|---|---|
| Lactancia < 6 semanas posparto | 3 AMP |
| Múltiples factores de riesgo cardiovascular | 3 AMP |
| HTA con sistólica >= 160 o diastólica >= 100, o con enfermedad vascular | 3 AMP |
| TVP/TEP en fase aguda sin tratamiento anticoagulante establecido | 3 todos |
| Cardiopatía isquémica: historia / durante el uso | 3 AMP / 3 todos |
| Ictus: historia / durante el uso | 3 AMP / 3 todos |
| LES: anticuerpos antifosfolípido+ o no conocidos / historia trombocitopenia severa en su inicio | 3 todos / 3 AMP |
| Migraña con aura durante el uso | 3 todos |
| Sangrado vaginal inexplicado (no evaluado) | 3AMP e ISG |
| Cáncer de mama: sin recurrencia 5 años / activo | 3 todos / 4 todos |
| DM y nefropatía, retinopatía o neuropatía | 3 AMP |
| Otra enfermedad vascular o DM de > 20 años de evolución | 3 AMP |
| Cirrosis hepática severa (descompensada). Adenoma. Cáncer hepático | 3 todos |
| Interacciones: fenitoína, carbamazepina, barbitúricos, primidona, topiramato, oxcarbazepina, rifampicina | 3 PSG |
AMP: acetato de medroxiprogesterona; DM: diabetes mellitus; HTA: hipertensión arterial; ISG: implante subcutáneo gestágeno; LES: lupus eritematoso sistémico; PSG: píldora solo gestágeno; TEP: tromboembolia pulmonar; TVP: tromboembolia venosa profunda.
Fuente: World Health Organization. Reproductive Health and Research. Improving access to quality care in family planning. Medical eligibility criteria for contraceptive use. 5th ed. Geneva: WHO; 2015. Disponible en: http://apps.who.int/iris/bitstream/10665/181468/1/9789241549158_eng.pdf
Contraindicaciones del dispositivo intrauterino (DIU) de cobre
| Categoría OMS | |
|---|---|
| Embarazo | 4 |
| Posparto de >= 48 h hasta < 4 semanas | 3 |
| Posparto con sepsis puerperal | 4 |
| Inserción inmediata postaborto séptico | 4 |
| LES con trombocitopenia grave | 3 I / 2 C |
| Sangrado vaginal inexplicado (sin evaluar) | 4 I / 2 C |
| Enfermedad trofoblástica y BHCG en descenso o indetectable | 3 |
| Enfermedad trofoblástica maligna o valores de BHCG elevados persistentemente | 4 |
| Cáncer de cérvix o endometrio (en espera de tratamiento) | 4 I / 2 C |
| Cáncer de ovario | 3 I / 2 C |
| Miomas, anomalías anatómicas que distorsionan cavidad uterina | 4 |
| Infecciones genitales activas | 4 I / 2 C |
| Alto riesgo de ITS | 2-3 I / 2 C |
| Sida con clínica y sin terapia antirretroviral | 3 I / 2 C |
| Sida sin clínica y con terapia antirretroviral | 2-3 I / 2 C |
| TBC pélvica | 4 I / 3 C |
BHCG: beta-gonadotropina coriónica humana; C: continuación; I: inicio; ITS: infección de transmisión sexual; LES: lupus eritematoso sistémico; Sida: síndrome de la inmunodeficiencia adquirida; TBC: tuberculosis.
Fuente: World Health Organization. Reproductive Health and Research. Improving access to quality care in family planning. Medical eligibility criteria for contraceptive use. 5th ed. Geneva: WHO; 2015. Disponible en: http://apps.who.int/iris/bitstream/10665/181468/1/9789241549158_eng.pdf
Contraindicaciones del dispositivo intrauterino (DIU) levonorgestrel
| Las del DIU de cobre en general* y además: | Categoría OMS |
| TVP/TEP en fase aguda sin anticoagulación establecida | 3 |
| Cardiopatía isquémica actual o historia | 2 I / 3 C |
| LES con anticuerpos antifosfolípido + o no conocidos | 3 |
| Migraña con aura a cualquier edad | 2 I / 3 C |
| Cáncer de mama actual | 4 |
| Cáncer de mama sin recidiva en cinco años | 3 |
| Cirrosis hepática descompensada. Adenoma y carcinoma hepático | 3 |
C: continuación; I: inicio; LES: lupus eritematoso sistémico; TEP: tromboembolia pulmonar; TVP; tromboembolia venosa profunda.
Excepto «LES con trombocitopenia grave».
Fuente: World Health Organization. Reproductive Health and Research. Improving access to quality care in family planning. Medical eligibility criteria for contraceptive use. 5th ed. Geneva: WHO; 2015. Disponible en: http://apps.who.int/iris/bitstream/10665/181468/1/9789241549158_eng.pdf
Para iniciar un anticonceptivo hormonal combinado (AHC) se debe realizar una historia clínica personal y familiar, especialmente orientada hacia la detección de contraindicaciones (tablas 12 y 13) y de factores de riesgo cardiovascular, medir la presión arterial, pesar e informar a la mujer94,111,112. Es fundamental explicar las diferentes formas de administración de los anticonceptivos hormonales, con sus ventajas e inconvenientes113.
No se recomienda el cribado rutinario de trombofilia ni dislipemia90. Una visita de seguimiento a los tres a seis meses parece útil para reforzar el cumplimiento. Anualmente se recomienda medir la presión arterial y actualizar la historia clínica. La evidencia científica no justifica la realización de descansos durante el uso de AHC. La seguridad de los AHC se ha estudiado ampliamente. El uso de AHC durante las etapas iniciales del embarazo no se asocia a la aparición de defectos congénitos114.
La European Medicines Agency (EMA) y una reciente revisión sistemática confirman que el riesgo de tromboembolia venosa (TEV) es pequeño, del orden de 20-40 casos por 100.000 mujeres/año de uso, y varía entre los distintos AHC estudiados. En el rango superior están los AHC de tercera y cuarta generaciones. Todos los AHC se asocian con un aumento del riesgo de TEV y confirman que este riesgo es pequeño, como norma general, y que depende del progestágeno utilizado y de la dosis de etinilestradiol. El riesgo de TEV de los AHC con 30 a 35 mg de etinilestradiol y gestodeno, desogestrel, acetato de ciproterona y drospirenona fue similar y aproximadamente un 50-80% mayor que con levonorgestrel (LNG)115. Los más seguros son los que contienen LNG o norgestimato, sin que existan diferencias en función de la vía de administración116,117. Los nuevos preparados con estradiol, frente a los clásicos con etinilestradiol (EE), buscan la reducción del riesgo de TEV, sin significación estadística hasta ahora, y se necesitan series más grandes para sacar conclusiones118.
Respecto al cáncer de mama y su relación con «todos» los anticonceptivos hormonales, se ha descrito recientemente un riesgo relativo de 1,20 en mujeres que los usan o han usado recientemente119. Un aumento muy bajo, en términos absolutos, frente al efecto anticonceptivo, beneficios adicionales sobre dismenorrea y menorragia, y la reducción global del cáncer, a expensas de una significativa disminución del riesgo de cáncer de ovario, endometrio y colon120.
Antes de insertar un DIU hay que realizar la historia clínica, una exploración pélvica con histerometría, comprobar que no está contraindicado (tabla 14) e informar e insertar en día óptimo. En una visita unoa tres meses postintervención se deben visualizar los hilos por el orificio cervical y valorar la tolerancia. Si se realiza autopalpación de los hilos, no se precisarían revisiones posteriores121. No hay evidencia para realizar más pruebas. En situaciones especiales, realizar prescripción y seguimiento adaptados122.
En las mujeres en la década de los 40, también se puede usar el DIU de cobre, siempre descartando previamente las contraindicaciones (tabla 15).
Anticoncepción de urgenciaHay sólida evidencia de la eficacia de varios métodos de anticoncepción de urgencia (AU) (tablas 16 y 17)123,124. El método más eficaz en AU es el DIU de cobre125. Cuando una mujer solicita la AU, cualquiera que sea su edad, el coito no protegido (CNP) ya ha ocurrido y el tiempo no tiene marcha atrás. Las píldoras anticonceptivas de urgencia (PAU) no tienen contraindicaciones, inhiben o retrasan la ovulación, no son abortivas y pueden evitar el embarazo y los abortos derivados de los ENP126. La PAU de ulipristal acetato (UPA) impide, significativamente, más embarazos que la PAU de LNG en las 72-120 h tras el CNP, debido a que, cuando la ovulación es inminente, el UPA es más eficaz que el LNG en retrasarla, ya que impide la rotura de folículos con mayor tamaño. Algunos estudios apuntan un posible menor efecto del LNG en las mujeres obesas127,128, en las que los niveles plasmáticos son menores, por lo que doblar la dosis en ellas puede ser razonable129. Con UPA, los niveles son iguales en obesas y no obesas. Se recomienda iniciar otro método eficaz, al día siguiente de tomar PAU de LNG, prescribiéndolo a la vez130. Con UPA, no debe iniciarse otro método hormonal hasta que pasen al menos cinco días. Sin embargo, en el momento actual en España, y tras una suspensión cautelar del ulipristal por riesgo de fallo hepático, la presentación que hay disponible es de 5 mg (no de 30 mg que es la dosis para la anticoncepción de urgencia) y la indicación es exclusivamente para el tratamiento de los miomas, siempre con una vigilancia estrecha por si aparecen datos de afectación hepática; no está autorizado como anticonceptivo de emergencia131. La OMS, sin embargo, sigue considerando el ulipristal como una opción para la anticoncepción de emergencia132.
Métodos de anticoncepción de urgencia disponibles
| Dosis | Fallos (%) | Plazo uso | Prescripción médica | |
|---|---|---|---|---|
| Píldora LNG | 1,5 mg (DU) | 1,1a | 72 y 120 horas tras CNP | No |
| 1,5b | ||||
| 2,6c | ||||
| *Píldora Ulipristal | 30 mg (DU) | 1,7c | 72 y 120 horas tras CNP | No |
| Píldoras EE+LNG (Yuzpe)* | 0,1 mg EE + 0,5 mg LNG (2 dosis, 12 h intervalo) | 3,2a | 72 horas tras CNP | Sí |
| DIU de cobre | Alta carga de cobre, > 300 mm2 | 0,09d | 5 días tras CNP5 días tras día estimado ovulación | Sí |
CNP: coito no protegido; DU: dosis única; EE: etinilestradiol; LNG: levonorgestrel.
Anticonceptivos reversibles de larga duración
| Uso típico(tasa fallos, %) | Uso perfecto(tasa fallos, %) | Continuidad al año (%) | Retorno de la fertilidad | Composición | Duración eficacia | |
|---|---|---|---|---|---|---|
| Implante subcutáneo | 0,05 | 0,05 | 84 | 1 mes | Etonogestrel | 3 años |
| DIU LNG | 0,2 | 0,2 | 80 | Inmediato | Levonorgestrel | 5 años |
| DIU cobre | 0,8 | 0,6 | 78 | Inmediato | Cobre | 5-10 años |
| Inyección trimestral | 3 | 0,3 | 56 | 6 meses | AMP | 3 meses |
AMP: acetato de medroxiprogesterona; DIU: dispositivo intrauterino; LNG: levonorgestrel.
Fuente: elaboración propia.
Los MF, dada su accesibilidad, favorecen la anticoncepción si manejan en sus consultas todos los métodos anticonceptivos reversibles133. La consulta a demanda del MF es la mejor opción para abordar la anticoncepción, respondiendo al criterio de buena práctica de aprovechar la oportunidad. Las consultas programadas, las específicas de la mujer, suelen ser menos accesibles, menos discretas, y la demora en la atención aumenta el riesgo de ENP109,134. Las mejoras en anticoncepción pasan por una mayor utilización de los ARLD133.
Es clave aumentar el uso de DIU e implantes, que pueden ser manejados por los MF. Debe garantizarse tanto la accesibilidad como la atención. La anticoncepción es un derecho y no puede negarse por objeción de conciencia, falta de competencia o por otros motivos. Hay estudios que apuntan que los profesionales de AP136 infraestiman el problema de los ENP. Es necesario garantizar una adecuada formación de los profesionales.
Recomendaciones del PAPPS sobre prevención de embarazos no planificados
- •
Hacer cribado oportunista sobre anticoncepción en todas las mujeres en edad fértil, en los varones y a sus parejas respectivas aprovechando cualquier motivo de consulta (calidad evidencia moderada, recomendación fuerte a favor), con una periodicidad anual o menor en situaciones de riesgo o vulnerabilidad (calidad evidencia muy débil, recomendación débil a favor).
- •
Ofrecer consejo contraceptivo estructurado, que incluya información sobre los distintos métodos anticonceptivos y su efectividad en la prevención de embarazos no planificados, ITS y VIH, sus beneficios y efectos adversos (calidad evidencia baja, recomendación débil a favor). Usar hojas impresas para reforzar la información (calidad evidencia moderada, recomendación fuerte a favor)
- •
Facilitar una elección informada, indicar métodos y garantizar el seguimiento y la accesibilidad para consultar las posibles dudas (calidad de la evidencia baja, recomendación fuerte a favor).
- •
Si la opción es AHC se recomienda la prescripción de etinilestradiol a la dosis más baja posible y LNG (calidad de la evidencia alta, recomendación fuerte a favor).
- •
Informar acerca de la posibilidad de anticoncepción de urgencia ante una relación sin protección o un fallo del método anticonceptivo, y prescribirla cuando haya indicación. La PAU-LNG es un método anticonceptivo seguro y eficaz (calidad de la evidencia alta, recomendación fuerte a favor).
- •
Ofrecer anticonceptivos reversibles de larga duración (DIU e implantes subcutáneos) en atención primaria para aumentar su uso (calidad de la evidencia baja, recomendación débil a favor).
- •
Si el profesional tuviera problemas para resolver la demanda de anticoncepción debe facilitar la atención por otro profesional (calidad de la evidencia baja, recomendación débil a favor)
- •
Ofrecer la mayoría de anticonceptivos reversibles por médicos de familia a través de consulta a demanda y sin demora para aumentar su uso (calidad de la evidencia baja, recomendación débil a favor).
AP: atención primaria; DIU: dispositivo intrauterino; ITS: infecciones de transmisión sexual; LNG: levonorgestrel; PAU: píldora anticonceptiva de urgencia; VIH: virus de la inmunodeficiencia humana.
Actividades preventivas en la menopausia. OsteoporosisSíntomas asociados al descenso de estrógenosEl descenso estrogénico puede originar síntomas vasomotores y sequedad vaginal para los cuales los estrógenos, con o sin progestágenos, al igual que la tibolona137 se han mostrado eficaces135,138,139. No existen datos para asociar el climaterio con las alteraciones del estado del ánimo140, estando más en relación con padecimientos depresivos previos, acontecimientos vitales estresantes141 o con actitudes negativas sobre la menopausia142,143, por lo que no se justifica el tratamiento ni la prevención de los mismos con terapia hormonal144. No se ha demostrado que el tratamiento hormonal oral o transdérmico sea eficaz para prevenir infecciones urinarias145, ni tratar la incontinencia urinaria146,147, o prevenir la enfermedad cardiovascular si se administra antes de los 60 años148-150, como sugerían algunos autores151. Se constata el incremento del riesgo cardiovascular con el tratamiento hormonal combinado (estrógenos-gestágenos) o con estrógenos solos152, en los ensayos WHI153 y WISDOM154 y en la revisión de la Cochrane155. La terapia hormonal combinada de estrógenos y gestágenos produce un incremento de la incidencia de cáncer de mama156. A pesar de que se decía que el tratamiento solo con estrógenos no aumentaba el riesgo de cáncer de mama157, sí parece que lo incrementa158. Resultados del WHI demuestran incremento del riesgo de deterioro cognitivo en mujeres mayores de 65 años tras el tratamiento con terapia hormonal159. En mujeres con útero, los estrógenos se deben asociar siempre con progesterona para evitar la aparición de cáncer de endometrio. La asociación de estrógenos con bazedoxifeno no resulta actualmente recomendable por las dudas que plantea en términos de seguridad en relación con el cáncer de endometrio y el riesgo de tromboembolismo160. Los efectos de la terapia hormonal161,162,163 se ilustran en la tabla 18. Dichos efectos desaparecen a los años de interrumpir el tratamiento164. Los estrógenos vaginales se han mostrado eficaces en el tratamiento de los síntomas secundarios a sequedad vaginal165, sin los riesgos de la terapia sistémica y sin necesidad de suplementarlos con progesterona, y posiblemente en la urgencia urinaria y en las infecciones urinarias recurrentes146,166.
Efectos de la terapia hormonal
| Número de eventos a lo largo de un año en 10.000 mujeres mayores de 50 años. | Efecto producido en 10.000 mujeres por la toma de estrógenos y progesterona, durante un año | Efecto producido en 10.000 mujeres por la toma de estrógenos solos, durante un año | |
|---|---|---|---|
| Cáncer de mama | 30 | 8 más | 3-4 más |
| Ictus | 21 | 8 más | 12 más |
| Tromboembolismo pulmonar | 8 | 8 más | 7 más |
| Demencia/Alzheimer en mujeres > 65 años | 22 | 23 más | No cambios |
| Cáncer colorectal | 16 | 6 menos | No cambios |
| Fracturas de cadera | 15 | 5 menos | 6 menos |
La tibolona aumenta el riesgo de cáncer de mama recurrente en mujeres con antecedentes de cáncer de mama (OR 1,5, 95% IC 1,21-1,85) y puede aumentar el riesgo de accidente cerebrovascular en mujeres mayores de 60 años137.
El tratamiento transdérmico, con estrógenos solos o combinados, supone menor riesgo trombótico que el tratamiento oral167,168.
- •
En mujeres con síntomas vasomotores y sequedad vaginal que, por su intensidad o frecuencia, repercutan en la calidad de vida de la mujer, se recomienda ofrecer el tratamiento hormonal con estrógenos/gestágenos a la mínima dosis eficaz y durante el menor tiempo posible (no superior a cinco años). En mujeres histerectomizadas, el tratamiento se realizará tan solo con estrógenos (recomendación fuerte).
Valores y preferencias: el grupo de trabajo ha asignado una importancia alta a la mejora en la calidad de vida y baja a los potenciales efectos adversos poco frecuentes, cuando los síntomas son suficientemente importantes.
El tabaquismo169,170 y la obesidad171 incrementan la incidencia de síntomas vasomotores en la etapa de transición menopáusica, mejorando, en el caso de la reducción de la obesidad, tras la menopausia172. Existen estudios que muestran alivio de los sofocos con intervenciones dirigidas a la pérdida de peso173 y a la práctica de ejercicio174 si bien en el caso del ejercicio sus resultados no son concluyentes175. Así mismo, se ha implicado a las agresiones sexuales previas como causa de incremento de síntomas vasomotores176.
Los antidepresivos inhibidores de la recaptación de serotonina (IRS) y los inhibidores de la recaptación de serotonina y noradrenalina (IRSN) reducen los sofocos, aunque con escasa relevancia clínica177-179, siendo paroxetina, citalopram, escitalopran, venlafaxina y desvenlafaxina sobre los que hay mejores evidencias180-182. Dado que la paroxetina por su interacción con el citocromo CYP2D6, disminuye la conversión del tamoxifeno a su metabolito activo, en caso de tratamiento con tamoxifeno, se aconseja el uso de venlafaxina y la desvenlafaxina183,184. La sertralina y fluoxetina son menos eficaces e interaccionan también con el tamoxifeno por lo que se prefiere el uso de otros IRS/IRSN. La pregabalina y la gabapentina también han mostrado cierta eficacia. Gabapentina podría valorarse en mujeres que tienen síntomas, sobre todo por la noche185. La guía NICE los aconseja como terapia de segunda línea en síntomas vasomotores186.
Las revisiones sistemáticas sobre fitoestrógenos muestran que o no mejoran los síntomas vasomotores o que el efecto es mínimo187-192 Dado que existe alguna evidencia, en estudios de baja calidad, de los extractos naturales o sintéticos de soya, trébol rojo, concentrados de genisteína o suplementos dietéticos de soya, estos podrían ser una opción de segunda línea en su tratamiento193,194. Se han constatado algunas acciones beneficiosas sobre la densidad mineral ósea195, pero desconocemos su efecto sobre fracturas196. Los fitoestrógenos no tienen importantes efectos secundarios197, pero pueden producir interacciones con otros medicamentos. No parece que incrementen el cáncer de mama198-200, aunque los resultados no son concluyentes.
Prevención de la osteoporosisPromoción de estilos de vidaDiversos metaanálisis muestran asociación entre el tabaco y la fractura vertebral201 y de cadera202,203. Existen estudios que asocian la realización de ejercicio con el aumento de masa ósea204,205 y con disminución de caídas, mejora del balance articular y del tono muscular206-209 y muchos menos con la disminución de fracturas210.
La eficacia de los suplementos de calcio y vitamina D en la reducción de fracturas es un tema controvertido. Existen ensayos clínicos y revisiones sistemáticas que muestran la eficacia de la vitamina D211-213, del calcio214, con o sin vitamina D, de la administración conjunta de calcio y vitamina D215-217 y otros que no encuentran resultados favorables218-222. La United States Preventive Services Task Force (USPSTF) se muestra en contra de la administración de suplementos en la prevención de caídas y fracturas223, acorde con los resultados de los últimos metaanálisis, en los que la vitamina D no se muestra eficaz en la prevención de fracturas ni de caídas224-226, salvo en población institucionalizada. Un reciente ensayo clínico aleatorizado australiano concluyó que la ingesta de una dieta rica en calcio y en proteínas (3,5 raciones de productos lácteos al día) en ancianos institucionalizados que tomaban suplementos de vitamina D, reduce el riesgo de caídas en un 11% (hazard ratio [HR] 0,89, IC 95% 0,78-0,98%; p = 0,04) y el de fractura de cadera en un 46% (HR 0,54, IC 95% 0,35-0,83%; p = 0,005) a los tres y cinco meses, respectivamente227. Así mismo, en su actualización de 2021, concluyen que no hay suficiente evidencia para recomendar el cribado de vitamina D en adultos no gestantes, sanos y sin factores de riesgo de hipovitaminosis D228.
- •
En población general se aconseja evitar el sedentarismo y el tabaquismo, tomar el sol al menos 10 min al día con una zona de exposición de al menos al cara y las manos, tomar una dieta rica en calcio y vitamina D y realizar ejercicio (recomendación débil).
- •
Los suplementos de calcio y vitamina D tan solo se aconsejan en mujeres institucionalizadas. Valorar su indicación en mayores de 70 años con déficit nutricionales importantes, ingesta de calcio inferior a 500 mg/día y escasa exposición solar (recomendación débil).
- •
En población general, no se aconseja cribado de determinación de niveles de 25 OH vitamina D (recomendación fuerte).
La osteoporosis se define como un trastorno caracterizado por una densidad mineral ósea (DMO) baja y un deterioro de la microarquitectura del hueso. En 1994, la OMS estableció criterios de osteoporosis en función de la DMO: menor de -2,5 desviaciones estándar (DE) respecto a la media de las mediciones de DMO en población joven (T- score); la osteopenia se define con cifras de DMO entre < -1 DE y > -2,5 DE. Dichos criterios sirven para clasificar y no para diagnosticar o tratar y contemplan tan solo un factor de riesgo de osteoporosis.
La DMO tiene un escaso valor predictivo positivo de fracturas cuando se aplica a poblaciones de bajo riesgo (tabla 19), y su baja sensibilidad (40%) la hace inapropiada para cribado229. Los estudios ponen de manifiesto que aproximadamente la mitad de las fracturas de cadera y de las fracturas no vertebrales se producen en mujeres sin osteoporosis densitométrica230, lo que arroja un porcentaje importante de falsos negativos: personas con DMO normal y susceptibles de fracturarse. El NNT (número de pacientes que hay que tratar para evitar un evento) es una medida indirecta de la especificidad y del número de falsos positivos. Su valor depende de la prevalencia de la enfermedad: en el caso del alendronato es de 72 (IC de 61-92) en mujeres de alto riesgo, y de 1790 (IC entre 1.507-2.455) si bajo riesgo231. Por todo ello, la estrategia de cribado densitométrico en mujeres debe basarse en la valoración del riesgo absoluto de fractura en los próximos 10 años. Es importante que las escalas utilizadas no exijan para su cálculo la DMO, para su utilización como criterio para la indicación de densitometría. Las escalas más utilizadas son el FRAX (OMS), GARVAN (Canadá, Australia y Nueva Zelanda) y QFracture (validada en Reino Unido [RU]). Los factores de riesgo del FRAX son: edad, sexo, índice de masa corporal, tabaquismo, ingesta de tres o más unidades de alcohol/día, antecedentes de fracturas después de los 50 años, antecedentes familiares de fractura de cadera y tratamiento con corticoides. Permite el cálculo de riesgo, con y sin DMO, considerando tan solo el T-score de cuello femoral. En la cohorte de FRIDEX el modelo FRAX predice un 41% de fracturas de cadera y 46% de fracturas mayores232. Validada en 57 países, su área bajo la curva en RU es de 0,85 en mujeres233.
Estimaciones de sensibilidad y especificidad y valor predictivo positivo (VPP) de la densitometría para predecir futuras fracturas en 10 años con una DMO <-1DE (Z-score). Con 2 DE, la sensibilidad es de 14% y la especificidad del 99% (The Swedish Council on Technology Assesment in Health Care)229
| Mujeres con bajo riesgo(mayores de 65 años con dos factores de riesgo como máximo) | Mujeres con alto riesgo(mayores de 65 años con más de cinco factores de riesgo) | |
|---|---|---|
| Sensibilidad | 40% | 40% |
| Especificidad | 85% | 94% |
| VPP | 8% | 75% |
La USPSTF en su actualización del año 2018 preconiza el cribado densitométrico en mujeres por encima de 65 años, y en más jóvenes con riesgo de fracturas análogo al de las mujeres de 65 años (grado de evidencia B), según las tablas FRAX (en torno al 8,4% en los próximos 10 años)234. En España, un riesgo igual al 8,4% se obtiene a partir de los 75 años.
Esta recomendación también es apoyada por la Sociedad Norteamericana de Menopausia (NAMS), que en su guía de 2021 recomienda el cribado densitométrico de mujeres mayores de 65 años y en mujeres mayores de 50 años con otros factores de riesgo, con una periodicidad de cada tres años. En mujeres entre 50 y 65 años que tengan una DMO superiores a -1,5 de T-score en la primera densitometría, no será necesario repetir la densitometría hasta los 65 años235. En las mujeres con bajo riesgo de fractura, la densitometría se debe repetir a los 5 años.
La guía NICE preconiza la evaluación sistemática del riesgo de fractura con la herramienta FRAX o con el Q-Fracture, a partir de los 65 años, y a partir de los 51 si factores de riesgo. La guía no contempla de manera clara los umbrales de tratamiento o de indicación de densitometría. El también británico National Osteoporosis Guideline Group (NOGG) recomienda en su guía de 2021 la evaluación del riesgo de fractura mediante la herramienta FRAX en todas las mujeres posmenopáusicas y en hombres mayores de 50 años con factores de riesgo de fractura. La guía recomienda la realización de densitometría en personas con riesgo intermedio de fractura a los 10 años e iniciar tratamiento en personas con riesgo alto o muy alto236.
La Scottish Intercollegiate Guidelines Network (SIGN) propone densitometría en mujeres con antecedentes de fractura o un riesgo mayor del 10% según escalas FRAX o QFracture237. En Canadá proponen intervención independientemente de la DMO en mujeres de alto riesgo (> 20%) y densitometría si riesgo intermedio (10-20%)238. Japón, Suecia y Suiza proponen densitometría si riesgo superior al 15%239. Alemania y Austria indican tratamiento con un riesgo >30% o el T-score <-3 DS240.
Las guías europeas establecen diferentes umbrales para tratar, no tratar o indicar densitometría, utilizando las tablas FRAX. Establecen niveles de riesgo por tramos etarios cada cinco años. Entre 50-54 años la densitometría se indica si el riesgo de fractura es superior a 6,3% en 10 años. Superior al 9,9% entre 60 y 64 años. Superior al 17,6% entre 70 y 74 años, y superior al 29,1% entre 80 y 84 años241.
Aunque ninguna sociedad científica propone el cribado poblacional, la National Osteoporosis Foundation (NOF), institución marcadamente financiada por la industria farmacéutica sí preconiza un cribado «de facto» al justificar la realización de densitometría a toda mujer mayor de 50 años con factores de riesgo de fracturas muy prevalentes (baja ingesta de calcio, baja actividad física, etc.), o preocupación por su «salud ósea» (signifique lo que signifique esa aseveración), y cribado poblacional en toda mujer mayor de 65 años y de hombres por encima de 70 años242.
Independientemente de la edad y de los factores de riesgo apuesta por el tratamiento a todo paciente con DMO ≤ 2,5 DE de T-score (considerando la disminución de la densidad mineral ósea como una enfermedad, y no como un factor de riesgo). Si hay un riesgo mayor del 20% de fracturas totales o del 3% de fracturas de cadera en los próximos 10 años, el tratamiento lo aconsejan si la DMO está en rango de osteopenia (≤ 1 DE y ≤ 2,5 DE). Considerando estos criterios, el 75% de las mujeres americanas de más de 65 años, y el 95% de las mujeres mayores de 75 años, deberían realizar tratamiento farmacológico243.
Los únicos estudios que han analizado la eficacia de un cribado poblacional son el estudio ROSE, en mujeres entre 65 y 80 años en donde tan solo hubo diferencias en el grupo de mayor riesgo de fracturas (> 15%)244; y el estudio SCOOP, en mujeres entre 70 y 85 años donde encontraron diferencias significativas en la reducción de fracturas de cadera, pero no en el número total de fracturas245.
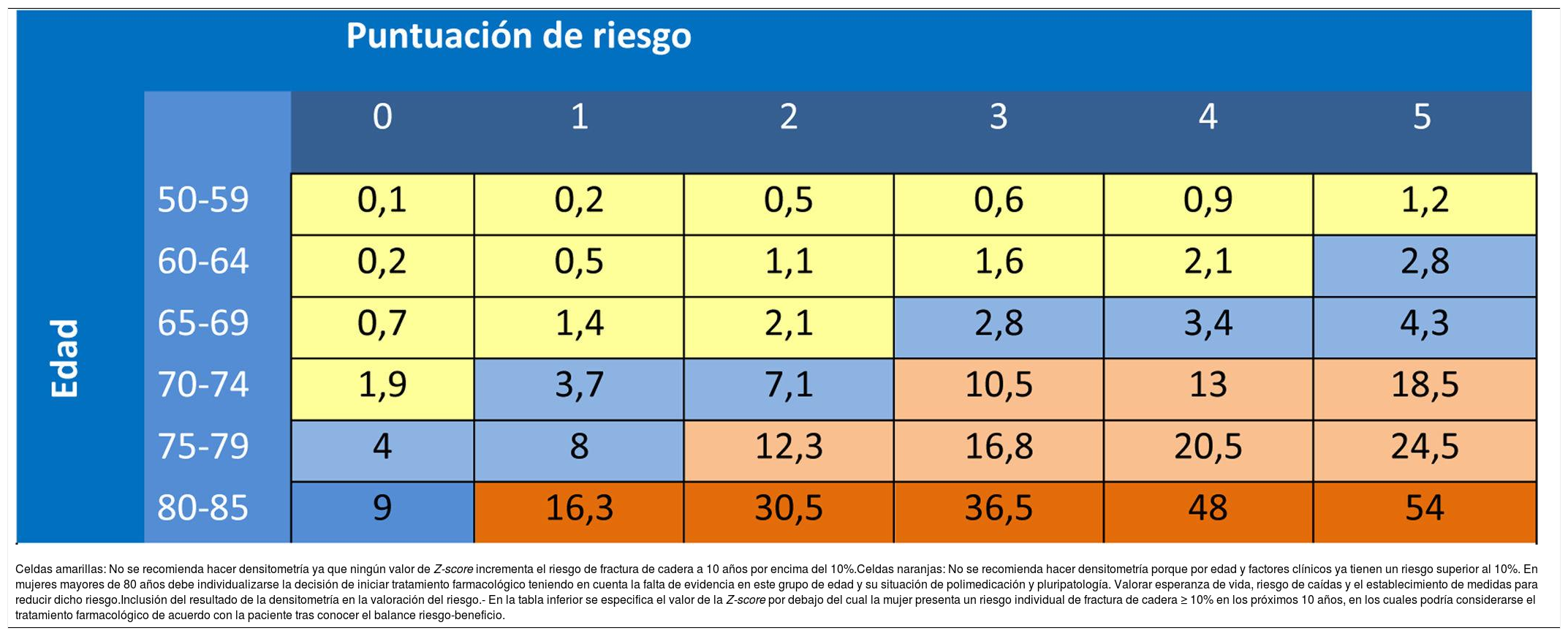
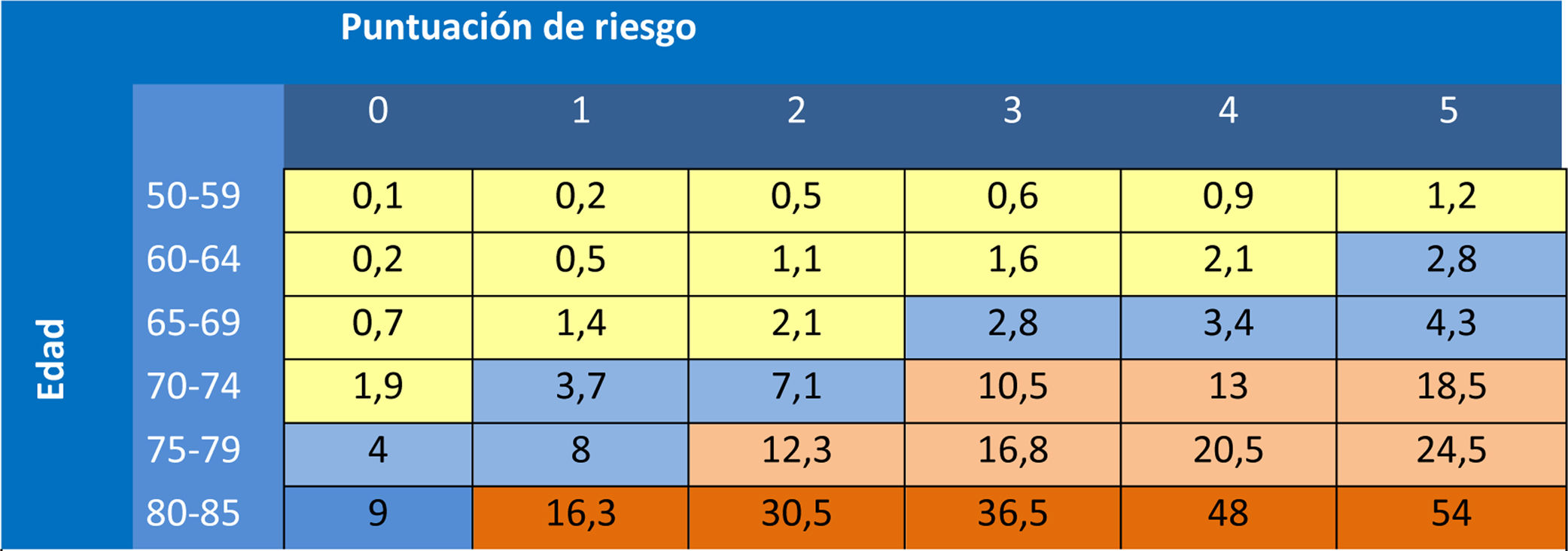
Recomendaciones del PAPPSLa indicación de cribado se hará en función del riesgo absoluto de fractura. La Dirección General de Farmacia de la Comunidad de Madrid (DGFCM), con los datos del estudio Rotterdam230,246 y aplicando un modelo matemático establecido247 propuso en el año 2007, en función de la edad y de los factores de riesgo, el cálculo del riesgo absoluto de fractura248 (dichas tablas fueron concebidas antes de las tablas FRAX de la OMS). En la tabla 20 se expone la manera de realizar el cálculo de la puntuación de riesgo en función del riesgo relativo (RR) de las diferentes variables: los factores de riesgo con un RR de dos se les asigna un punto; a los que tienen un RR de 4, se les asignan dos puntos. La puntuación obtenida aplicada a la edad de la paciente, determina un porcentaje de riesgo de fractura en los próximos 10 años. Los niveles de riesgo que justifican intervención eran los mismos que los de las guías canadienses249: con más del 20% del riesgo de cualquier fractura osteoporótica en los próximos 10 años, se justifica el tratamiento farmacológico, entre el 10 y el 20% indicación de densitometría y por debajo del 10% no intervención (esto se modificó en la actualización del 2015 al considerar tan solo las fracturas de cadera).
Factores a considerar para el cálculo de la puntuación de riesgo251
| Factores de riesgo | Puntuación |
|---|---|
| Índice de masa corporal menor de 19 | 1 |
| Fractura después de 50 años | 1 |
| Fractura de cadera en madre, padre o hermana | 1 |
| Deformidad vertebral morfométrica (disminución del 20% de la altura del cuerpo vertebral)* | 2 |
Las tablas de predicción de riesgo de fracturas de la OMS (FRAX: http://www.shef.ac.uk/FRAX/faq.htm) pueden suponer una alternativa válida para el cálculo del riesgo de fractura, si bien existen estudios que cuestionan su utilidad en la población española. Azagra et al.250 con los datos del estudio FRIDEX232 analizan la capacidad predictiva de fracturas del FRAX, y establecen el umbral de riesgo de cualquier fractura osteoporótica, según las tablas FRAX. Dicho estudio pretende ajustar el umbral de riesgo por encima del cual plantear intervenciones: menos del 5% de fracturas osteoporóticas totales supondría un riesgo bajo, y mayor o igual al 7,5% un riesgo alto. El umbral que definiría la realización de densitometría, sería de un 5%. El de tratamiento sería, una vez reclasificado el riesgo tras incluir el valor de la DMO, un valor mayor del 7,5%. Con esta adecuación se obtiene una sensibilidad del 40,8%, especificidad del 92,3%, con un VPP del 25,3%. Desde nuestro punto de vista este modelo potenciaría el sobrediagnóstico y el sobretratamiento al presentar un pobre VPP.
Por tal razón, por encima de la herramienta FRAX, con escasa representación de la cohorte española (tan solo 300 pacientes), el PAPPS propone el modelo elaborado por la DGFCM en su actualización del año 2015251, aplicando un modelo matemático concreto247, que ya fue aplicado en el estudio Rotterdam230, pero con datos de los CMBD del registro de fracturas de cadera de la Comunidad de Madrid (conjunto mínimo básico de datos, de obligado cumplimiento en los hospitales en los que se registran la totalidad de las fracturas de cadera). De esta manera disponemos de una tabla de riesgo de fractura de cadera en función de los factores de riesgo y la edad (tabla 21). La puntuación de riesgo es la referida en la tabla 20. No se recomienda el cribado radiológico: tan solo a mujeres mayores de 60 años cuando exista pérdida de estatura significativa (4 cm) y/o hipercifosis. Los factores relacionados con los estilos de vida (tabaquismo, alcohol, baja ingesta de calcio, sedentarismo) han mostrado menor consistencia. En general se consideran factores de riesgo de importancia poblacional, pero con escasa relevancia a nivel individual por presentar RR relativos inferiores a dos.
Riesgo de fractura de cadera en 10 años, en función de la edad y de la puntuación de riesgo251
| Celdas amarillas: No se recomienda hacer densitometría ya que ningún valor de Z-score incrementa el riesgo de fractura de cadera a 10 años por encima del 10%.Celdas naranjas: No se recomienda hacer densitometría porque por edad y factores clínicos ya tienen un riesgo superior al 10%. En mujeres mayores de 80 años debe individualizarse la decisión de iniciar tratamiento farmacológico teniendo en cuenta la falta de evidencia en este grupo de edad y su situación de polimedicación y pluripatología. Valorar esperanza de vida, riesgo de caídas y el establecimiento de medidas para reducir dicho riesgo.Inclusión del resultado de la densitometría en la valoración del riesgo.- En la tabla inferior se especifica el valor de la Z-score por debajo del cual la mujer presenta un riesgo individual de fractura de cadera ≥ 10% en los próximos 10 años, en los cuales podría considerarse el tratamiento farmacológico de acuerdo con la paciente tras conocer el balance riesgo-beneficio. |
La utilización de la tabla del documento de la DGFCM supone una ventaja al disponer de datos reales de fractura de cadera (que es la que ocasiona una mayor morbimortalidad) de una cohorte española. Dado que los datos de fractura vertebral son datos poco confiables, se ha establecido el criterio de intervención exclusivamente en función del riesgo de fractura de cadera, que es el evento de mayor morbimortalidad. Al igual que en el caso del riesgo cardiovascular (en donde la utilización de tablas de riesgo de muerte cardiovascular, en lugar de las de riesgo de eventos, previene infartos e ictus no mortales) su utilización previene la totalidad de fracturas osteoporóticas. En un estudio en el que analizan la predicción de fracturas atendiendo tan solo al criterio densitométrico del cuello femoral o mixto, femoral y columna lumbar, no encuentran diferencias significativas en la predicción de fracturas totales o no vertebrales, y tan solo una discreta mejor predicción con el modelo mixto, en fracturas vertebrales252.
Con el fin de evitar sobrediagnósticos y sobretratamiento cuando se indica densitometría, se utiliza el Z-score en lugar del T-score como criterio más que razonable. Se justificaría el tratamiento cuando el riesgo de fractura de cadera es mayor del 10%, en los próximos 10 años. Entre el 3 y el 10% se aconseja realización de densitometría y por debajo del 3% no se aconseja intervención. En mujeres de bajo riesgo (riesgo inferior al 3%) probablemente no sería preciso repetir la densitometría hasta pasados los cinco años253.
El criterio del umbral de intervención por encima del 10% se establece en relación con la prevalencia de fracturas de los ensayos clínicos disponibles. Con estos criterios no está indicada, como se aprecia en la tabla 21, la realización de densitometrías en mujeres menores de 60 años.
En los casos en los que esté indicada la densitometría, el Z-score por debajo del cual se justifica tratamiento sería el que incrementa el riesgo al 10% (tabla 4).
Respecto a la eficacia del tratamiento de la prevención primaria de fracturas, tan solo el raloxifeno254 y alendronato255, y con un T-score inferior a –2,5 DS, han demostrado eficacia en mujeres sin fracturas vertebrales. Otros tratamientos han demostrado disminución de fracturas vertebrales y/o de cadera en poblaciones con fracturas previas. Metaanálisis de ensayos clínicos que analizan el beneficio de la terapia de los bifosfonatos en la reducción de fracturas osteoporóticas, en mujeres con T-score menor de -2,5 DE o fracturas vertebrales establecen que para la prevención de una fractura de cadera es preciso tratar a 200 mujeres postmenopáusicas 20,3 meses. Para evitar una fractura vertebral es necesario tratar a 200 mujeres durante 12,1 meses. Para evitar una fractura no vertebral hay que tratar a 100 mujeres durante 12,4 meses256.
Los bifosfonatos pueden incrementar las fracturas de estrés atípicas y la osteonecrosis de mandíbula257, lo que ha llevado a no recomendar su uso más de cinco años. Los resultados de la discontinuación del tratamiento tras tres a cinco años de tratamiento con bifosfonatos es dispar, aunque sí parece haber un ligero incremento de las fracturas vertebrales, siendo los factores de riesgo un T-score menor de -2,5 DE en cuello femoral y la presencia de fracturas vertebrales incidentales258.
El denosumab presenta idénticos riesgos que los bifosfonatos y el riesgo añadido de que tras su supresión se puede producir un efecto rebote incrementándose el riesgo de fracturas vertebrales259. Su indicación como inicio de tratamiento es dudosa dado que su retirada presenta riesgos que no son suficientemente resueltos con el «sellado» con bifosfonatos tras su supresión. En el estudio FREEDOM, el 15% de las mujeres discontinuaron el tratamiento con denosumab con el consiguiente aumento de fracturas, siendo en dos tercios de los casos fracturas múltiples259. El efecto rebote tras la supresión del denosumab es de un incremento de fracturas vertebrales tras el primer año de interrupción, con un HR de 2,18 (1,46, 3,24) y hasta un HR 3,58 (1,74, 7,40), tras dos años de supresión. Con los bifosfonatos se aprecia el incremento a partir del segundo año, con un HR de (HR 2,02 [1,07, 3,80]), en fracturas vertebrales, sin efecto sobre las no vertebrales260.
No se recomienda el uso de teriparatida más de dos años.
- •
En mujeres con riesgo de fractura de cadera superior al 10% en los próximos 10 años, valorar el tratamiento farmacológico. En mujeres con riesgo de fractura de cadera superior al 3% y valores de Z-score que incrementen el riesgo hasta el 10% se aconseja valorar indicación de tratamiento farmacológico (tabla 21). Los bifosfonatos son los tratamientos de primera elección durante un tiempo estimado, en general, no mayor de cinco años (recomendación débil).
No existen datos de la eficacia del tratamiento en mujeres con osteopenia261, salvo con la administración IV de ácido zoledrónico cada 18 meses en un ensayo clínico en el que se demostraba reducción de fracturas en mujeres de muy alto riesgo (con un porcentaje importante de fracturas vertebrales) y con criterios de clasificación de osteopenia no muy claros262.
Los ultrasonidos presentan baja sensibilidad y dado la falta de datos sobre su eficacia diagnóstica y terapéutica no se aconseja como método de cribado263.
Consideraciones éticasEl artículo de ACTUALIZACIÓN DEL PAPPS se limita a realizar una revisión de la mejor evidencia sobre aspectos ligados a la prevención en el embarazo, anticoncepción, menopausia y osteoporosis. Por tal razón no hay pacientes incluidos por lo que no ha sido preciso el consentimiento informado de los mismos. No hay experimentación animal, por lo que no es preciso aclarar aspectos vinculados a la ética de la experimentación con animales.
Conflicto de interesesLos autores de este capítulo carecen de conflictos de interés con la industria farmacéutica. Algunos de ellos han participado en seminarios organizados por las Consejerías de Sanidad de las comunidades autónomas correspondientes.
AgradecimientoIn memorian de Lorenzo Arribas Mir. Miembro del grupo del PAPPS de la mujer que nos dejó en fechas recientes, apenas iniciada su jubilación. Este documento es deudor de su buen hacer, y todos los miembros del PAPPS lo somos de su magisterio. Descanse en paz.