Programa de Actividades Preventivas y de Promoción de la Salud-PAPPS 2024
Más datosEn la actualización del PAPPS de 2024 presentamos aquellas actividades preventivas específicas para la salud de la mujer, exceptuando las relacionadas con la prevención del cáncer (que se incluye en otro documento) y los aspectos relacionados con la morbilidad diferencial de género, aspecto este transversal para todos los grupos de trabajo.
La anticoncepción es una actividad preventiva esencial, considerando básico el derecho a decidir tanto el número de hijos como el momento de tenerlos. Debemos informar sobre los posibles métodos anticonceptivos, garantizando en el seguimiento su seguridad, eficacia y efectividad (se incluyen tablas sobre cambio de un método a otro para preservar la protección anticonceptiva). Debemos informar sobre la anticoncepción de urgencia y proponerla en caso de relación sin protección. Todo ello se hará mediante cribado oportunista, sin precisar cribado de trombofilia ni de dislipemia, y sí de hipertensión arterial.
El embarazo constituye una vivencia vital importante y el médico de familia no debe permanecer ajeno. Debemos ser competentes tanto en la consulta preconcepcional (recomendando la toma de ácido fólico, evitando la exposición a riesgos laborales y medioambientales, realizando cribado de determinadas patologías y valorando la toma de fármacos no indicados durante el embarazo) como en el seguimiento de la gestación. Hagamos o no seguimiento del embarazo, no debemos desentendernos de su control aprovechando este periodo para promocionar estilos de vida saludables y participando de los procesos intercurrentes que puedan acontecer.
La menopausia en general y la osteoporosis en particular ejemplifican la estrategia de medicalización de procesos vitales que se ha seguido desde diferentes instancias y organismos. En nuestra actualización abordamos la prevención y el tratamiento de aquellos síntomas secundarios a la deprivación estrogénica. Asimismo, planteamos la prevención de la osteoporosis, incluyendo la realización de densitometría en función del riesgo de fractura en los próximos 10 años, y por ello no se aconseja el cribado densitométrico en mujeres menores de 60 años. En la valoración del riesgo preconizamos la utilización de la herramienta FRAX, o mejor, la calibración del riesgo de fractura de cadera con datos de prevalencia de la Comunidad de Madrid. La indicación del tratamiento la vinculamos con la Z-score (densidad mineral ósea comparada con mujeres de su misma edad), al ser una patología asociada al envejecimiento, y no en comparación con mujeres de 20 años de la T-score.
In the 2024 PAPPS update, we present preventive activities specific to women's health, except those related to cancer prevention (which are included in another document) and aspects related to differential morbidity of gender, which is a cross-cutting element for all working groups.
Contraception is an essential preventive activity; the right to decide both the number of children that they will have and when to have them is considered basic. We must inform about contraceptive methods, guaranteeing in follow-up their safety, efficacy, and effectiveness (tables are included on changing from one method to another to preserve contraceptive protection). We must inform about emergency contraception and propose it in in the event of unprotected intercourse. We will use opportunistic screening to do this, without needing to screen for thrombophilia or dyslipidaemia, but we will screen for hypertension.
Pregnancy is a major life experience and general practitioners should not ignore it. We should be competent at both preconception consultation (recommend folic acid intake, avoiding exposure to occupational and environmental hazards, screen for certain pathologies, and assess the intake of medication not indicated during pregnancy) and during follow-up of pregnancy. Whether or not we follow-up the pregnancy, we should not fail to monitor it, taking advantage of this period to promote healthy lifestyles and manage potential intercurrent events.
Menopause in general and osteoporosis in particular exemplify the strategy of medicalising life events that has been followed by different bodies and organisations. In our update we address the prevention and treatment of symptoms secondary to oestrogen deprivation. We also propose osteoporosis prevention, including bone density scanning according to the fracture risk in the next 10 years, therefore, bone density screening is not recommended in women under 60 years of age. We recommend the FRAX tool for assessing risk, or better, measuring hip fracture risk with prevalence data from the Community of Madrid. The indication for treatment is linked to the Z-score (bone mineral density compared with women of the same age), since this is a condition associated with aging, and not the T-score, which is used to compare women of 20 years of age.
La Organización Mundial de la Salud (OMS) reconoce la atención preconcepcional como una forma de mejorar la salud de las mujeres, antes de quedarse embarazadas y los resultados tanto para la madre como para el feto durante el embarazo.
El asesoramiento preconcepcional puede iniciarse durante cualquier consulta preguntando a la paciente si desea quedarse embarazada en el próximo año.
Las visitas preconcepcionales deben abordar medidas preventivas, optimizar el control y evaluar el tratamiento potencialmente teratogénico de ciertas enfermedades crónicas (tabla 1). Dichos medicamentos deben evitarse o mantener la dosis más baja posible si son esenciales para el control de la enfermedad1.
Consideraciones sobre la medicación en la atención preconcepcional
| Acné | La isotretinoína es un teratógeno conocido; su uso en personas en edad fértil requiere el uso de anticoncepción |
| Ansiedad y depresión | Para las pacientes con síntomas de moderados a graves, la primera opción de tratamiento son los ISRS. Se debe evitar la paroxetina, pues está asociada a mayor riesgo de malformaciones cardiacas. Los trastornos del ánimo no tratados no están exentos de riesgo tanto para la embarazada como para el feto |
| Asma | El manejo es similar en pacientes embarazadas o no embarazadas. Los riesgos maternos y fetales asociados al asma no controlada superan con creces los pequeños riesgos asociados a la medicación |
| Diabetes mellitus | La insulina es el fármaco de primera elección porque no atraviesa la placenta. La metformina puede utilizarse durante el embarazo, pero se sabe que atraviesa la placenta, por lo que es necesario analizar la relación riesgo/beneficio de los posibles riesgos para el feto, como la restricción del crecimiento fetal y la hipoglucemia neonatal. Otros medicamentos hipoglucemiantes deben evitarse |
| Epilepsia | Es preferible la monoterapia con antiepilépticos a la dosis más baja efectiva (lamotrigina y levetiracetam). Se deben evitar valproato, carbamazepina, fenitoína y fenobarbital. Hay que considerar dosis más altas de suplementación con ácido fólico en aquellas que toman antiepilépticos e intentan concebir |
| Hipertensión arterial | Están contraindicados IECAS, ARA II y espironolactona. Labetalol, metildopa y nifedipino de liberación prolongada son los de elección |
| Hipertiroidismo | Durante el primer trimestre, se prefiere el propiltiouracilo. Sin embargo, en el segundo y tercer trimestre es preferible el metimazol |
| Hipotiroidismo | La levotiroxina es un fármaco seguro durante el embarazo. Se recomienda un aumento de la dosis en torno al 30-50% |
| Trastornos psicóticos y bipolar | La risperidona debe evitarse durante el embarazo. Otros antipsicóticos no tienen una asociación clara con malformaciones congénitas, pero se necesitan más datos de seguridad a largo plazo |
| Trombofilia y trombosis venosa | Los antagonistas de la vitamina K son fármacos teratogénicos que atraviesan la placenta. Los nuevos anticoagulantes de acción directa deben evitarse en embarazadas y en aquellas que quieren concebir debido a la falta de datos de seguridad a largo plazo. La heparina no fraccionada y la heparina de bajo peso molecular son de elección en el embarazo y en pacientes que intentan concebir porque no atraviesan la placenta. La heparina de bajo peso molecular suele preferirse por su facilidad de dosificación y su perfil de seguridad |
Fuente: elaboración propia1,3.
Debido al aumento de infecciones de transmisión sexual, especialmente clamidia, gonorrea y sífilis en España en 20222, sería recomendable realizar un cribado durante la consulta preconcepcional (tabla 2). Por otro lado, hay que actualizar las vacunaciones (tabla 3) de todas las pacientes que deseen un embarazo.
Recomendaciones para el cribado de enfermedades infecciosas en la atención preconcepcional
| Clamidia y gonorrea | Mujeres sexualmente activas con alto riesgo de infeccióna |
| Enfermedad de Chagas | Mujeres en edad reproductiva que nacieron o vivieron en países endémicos de América Central o del Sur |
| Hepatitis B | Adolescentes y adultos con alto riesgo de infecciónb |
| Hepatitis C | Adultos ≥18 años |
| Sífilis | Pacientes con alto riesgo de infecciónc |
| VHS | No realizar cribado. Si la paciente tiene historia de infección previa, se podría usar terapia antiviral supresora para evitar la transmisión vertical |
| VIH | Pacientes ≥15 años |
VHS: virus herpes simple; VIH: virus de la inmunodeficiencia humana.
Una infección de transmisión sexual (ITS) previa o coexistente, más de una pareja sexual, pareja sexual que mantiene relaciones sexuales con otras parejas al mismo tiempo, pareja sexual con una ITS, uso inconsistente del preservativo cuando no se está en una relación monógama mutua, antecedentes de prostitución o encarcelamiento.
Personas nacidas en países y regiones con una alta prevalencia de infección por VHB (Asia, África, las islas del Pacífico y partes de Sudamérica), no vacunados, pacientes con VIH, usuarios de drogas vía parenteral, parejas sexuales de personas con infección por VHB.
Personas con infección por VIH u otras ITS; consumidores de drogas y personas con antecedentes de encarcelamiento, trabajo sexual o servicio militar.Fuente: elaboración propia1,4–7.
Recomendaciones de vacunación en la atención preconcepcional
| COVID-19 | Recomendada para embarazadas, lactantes, personas que intentan quedarse embarazadas o las que podrían quedar embarazadas en el futuro |
| Gripe | Las mujeres embarazadas o que puedan quedarse embarazadas durante la temporada de gripe deben recibir la vacuna antigripal |
| Hepatitis B | Revisar calendario vacunal y recomendar a adultos sin vacunar previamente |
| Triple vírica | Mujeres en edad reproductiva que tienen 1 o 2 dosis y cuyos niveles de IgG para rubéola no son claramente positivos deben recibir una dosis adicional (máximo 3) antes o después del embarazo. Las pacientes deben evitar el embarazo un mes después de la vacuna |
| Varicela | Se debe evaluar la inmunidad. Las pacientes deben evitar el embarazo un mes después de la vacuna |
| VPH | No se recomienda la vacunación durante el embarazo, sin embargo, no se recomienda retrasar la vacunación porque una mujer quiera quedarse embarazada o está intentándolo. Si se inicia la vacunación y la paciente se queda embarazada, debe retrasarse hasta que finalice el embarazo |
Fuente: elaboración propia1.
Asimismo, se deben abordar otros temas como son: antecedentes reproductivos, abuso de sustancias (tabla 4), exposición a peligros ambientales (tabla 5), necesidad de atención psicosocial y riesgo de enfermedades genéticas.
Cribado de abuso de sustancias en la atención preconcepcional
| Alcohol | Es un conocido teratogénico y se asocia con mayor riesgo de aborto espontáneo, restricción del crecimiento intrauterino (CIR), defectos del nacimiento y déficits del desarrollo neurológico |
| Cafeína | Si se consume más de 300mg al día, puede aumentar el riesgo de complicaciones durante el embarazo |
| Cannabinoides | Afectan la fertilidad femenina y masculina. Pueden alterar el ciclo menstrual, las características del semen y provocar fluctuaciones en las hormonas reproductivas. Hay datos limitados que sugieren asociación entre exposición prenatal y alteraciones fetales como CIR y trastornos del desarrollo neurológico |
| Otras drogas ilícitas | Aumenta el riesgo de mortalidad infantil, bajo peso al nacer y síndrome de abstinencia neonatal |
| Tabaco | Se asocia con mayor riesgo de CIR, parto prematuro, malformaciones congénitas, muerte súbita del lactante y bajo peso al nacer |
Fuente: Close et al.1.
Implicación de los peligros ambientales para el embarazo
| Peligros | Implicaciones | Mitigación o evitación |
|---|---|---|
| Plomo | Se asocia con mayor riesgo de hipertensión gestacional, placenta previa, parto pretérmino, CIR, alteración del neurodesarrollo y otros defectos congénitos | Evitar trabajos de construcción o reformas de casas antiguasQuitarse los zapatos antes de entrar en casa en estas circunstancias |
| Mercurio | Es una neurotoxina. Se encuentra en altas concentraciones en pescados como caballa, tiburón, pez espada, blanquillo. Puede aumentar el riesgo de parto pretérmino y alteraciones del neurodesarrollo fetal | Comer pescado con bajo contenido en mercurio. No tomar más de 2 porciones de pescado por semana |
| Radiación | Aumenta el riesgo de aborto espontáneo, muerte fetal, linfoma no Hodgkin y cáncer infantil | Seguir las normas de salud laboral para reducir los riesgos de exposición en el entorno ocupacional |
Fuente: elaboración propia1,8.
A continuación, se detallan los temas más comunes que se deben tratar en la visita preconcepcional. Las recomendaciones son pertinentes sólo para países de rentas altas, pues la OMS establece recomendaciones diferentes para los países de rentas bajas1.
Suplementación con ácido fólicoSe recomienda que todas las personas en busca de embarazo tomen un suplemento que contenga 400μg de ácido fólico al día, comenzando al menos un mes antes de la concepción y continuando los primeros 3 meses de embarazo.
Las mujeres con alto riesgo de defectos del tubo neural (obesidad, diabetes o historia familiar de defectos del tubo neural) deben tomar 5mg de ácido fólico al día, comenzando 3 meses antes de la concepción y manteniéndolo durante el primer trimestre1.
Índice de masa corporalEl índice de masa corporal (IMC) previo al embarazo afecta a los resultados del embarazo y a la salud infantil. La obesidad durante el embarazo aumenta el riesgo de preeclampsia, feto grande para la edad gestacional, distocia de hombros, cesáreas, muerte fetal y neonatal. También, malformaciones congénitas, como defectos del tubo neural, labio leporino, reducción de extremidades e hidrocefalia, se notifican con mayor frecuencia en embarazos de pacientes obesas.
En la atención preconcepcional, a las pacientes obesas o con sobrepeso, los médicos deben recomendar un IMC entre 18,5 y 24,9kg/m2 y plantear objetivos mínimos de pérdida de peso alcanzables antes del embarazo. Algunos de los elementos más eficaces para dicha planificación son: asesoramiento individual, consejo dietético y modificación de los hábitos de vida. Tanto la farmacoterapia como la cirugía bariátrica pueden ayudar a las mujeres a obtener un peso saludable antes de la concepción. En cuanto a la medicación para perder peso, los análogos de la GLP1 se deben suspender 2 meses antes del embarazo1.
Diabetes mellitusTodas las mujeres en edad reproductiva con diabetes deben ser informadas de los riesgos durante el embarazo. Por otro lado, cuando manifiesten su deseo gestacional, si los niveles de HbA1c no están controlados, los médicos deben ofrecer anticoncepción.
Se recomiendan niveles de HbA1c ≤6,5% para reducir los riesgos de macrosomía, parto pretérmino, preeclampsia y muerte perinatal. Es necesario realizar retinografía antes de la concepción porque el embarazo puede afectar negativamente a la retinopatía diabética1.
HipertensiónSe ha demostrado que pacientes con cifras de presión arterial <140/90mmHg tuvieron menos resultados adversos durante el embarazo (preeclampsia, parto pretérmino, desprendimiento de placenta y muerte fetal). Por lo tanto, se debe asesorar a las mujeres sobre los riesgos de la hipertensión arterial no controlada antes y durante el embarazo, con el objetivo de controlar las cifras antes de la concepción1.
Enfermedad tiroideaSe ha demostrado que la enfermedad tiroidea no controlada afecta el desarrollo fetal temprano y aumenta el riesgo de pérdida fetal. A las personas con alteraciones tiroideas se les debe aconsejar que retrasen el embarazo hasta que se logre la eutimia para minimizar el riesgo para el feto1. Una paciente con hipotiroidismo estable debe aumentar su dosis de levotiroxina un 30-50% antes de la concepción.
En el hipotiroidismo subclínico, se recomienda tratar a mujeres con anticuerpos positivos, TSH>10mU/L y con otros factores de riesgo (>30 años, otras enfermedades autoinmunes, radiación en cabeza y cuello, uso de fármacos que afecten a la función tiroidea, administración de contraste yodado, bocio, residentes en zonas con deficiencia moderada-severa de yodo, embarazos múltiples anteriores, antecedentes de aborto, parto pretérmino o infertilidad, historia familiar de enfermedad tiroidea y obesidad mórbida).
Además, hay que tener en cuenta que el hipotiroidismo puede ser inducido o empeorado por la terapia de estimulación ovárica en los procedimientos de reproducción asistida3.
En cuanto al hipertiroidismo, el tratamiento se centra en lograr la eutimia y minimizar la exposición a medicamentos antitiroideos. Si se realiza una terapia con ablación con yodo radiactivo, se debe aconsejar que eviten el embarazo en los siguientes 6 meses1.
Violencia de géneroSe recomienda la detección activa de violencia de género en todas las mujeres en edad reproductiva y ofrecer servicios de apoyo.
VIHPara las mujeres en edad fértil con infección por virus de la inmunodeficiencia humana (VIH), los médicos de atención primaria (AP) deben analizar el deseo de embarazo con regularidad y brindarles un tratamiento con terapia antirretroviral eficaz, ya que así se minimiza el riesgo de transmisión vertical.
El tratamiento del VIH debe ser individualizado y centrarse en mantener una carga viral indetectable. Debe tenerse en cuenta que el dolutegravir se ha asociado a defectos del tubo neural. Por lo tanto, en el caso de las mujeres que planean concebir, puede ser adecuado un tratamiento antirretroviral alternativo, que debe comentarse con la paciente y un especialista en VIH1.
En la consulta preconcepcional se recomienda la suplementación con 400μg de ácido fólico al día para reducir el riesgo de defectos del tubo neural (recomendación fuerte, a favor)
Se recomienda el normopeso (IMC: 18,5-24,9) antes del embarazo para reducir complicaciones materno-fetales (recomendación moderada, a favor)
La atención prenatal es un componente clave de un embarazo sano. La atención prenatal organizada ayuda a identificar, tratar precozmente las complicaciones que puedan surgir y a promover comportamientos saludables. Aunque hay pocos estudios, los datos sugieren que los recién nacidos de madres que no reciben atención prenatal tienen 3 veces más probabilidades de tener bajo peso al nacer y 5 veces más probabilidades de morir, en comparación con los recién nacidos de madres que reciben una atención prenatal adecuada.
La atención prenatal abarca todo el embarazo (desde la identificación del embarazo hasta el puerperio) y tiene 3 objetivos clave:
- 1.
Atención médica: detección y tratamiento de enfermedades crónicas y complicaciones del embarazo.
- 2.
Recomendaciones preventivas: durante el embarazo, el parto, el puerperio y la crianza.
- 3.
Apoyo psicosocial: tratamiento de la salud mental e identificación de los factores sociales que afectan a la capacidad de las embarazadas para acceder a la atención médica y lograr resultados saludables.
La atención prenatal tradicional incluye una serie de entre 7 y 12 visitas; sin embargo, se discute el número de visitas necesarias para una atención adecuada. Aunque se dispone de pocos datos sobre la frecuencia, el calendario y el contenido óptimos de las visitas, el número de visitas de atención prenatal debe determinarse en función de las necesidades y el estado de riesgo de cada mujer y su feto.
Estas visitas de atención prenatal deben programarse a intervalos adecuados para garantizar la realización de pruebas y cribados urgentes, la administración de inmunoglobulina anti-D, si es necesario, y el seguimiento de las complicaciones más frecuentes.
La recomendación más aceptada sobre frecuencia de visitas sería:
- •
Cada 4 semanas durante las primeras 28 semanas.
- •
Cada 2 o 3 semanas entre las 28 y las 36 semanas.
- •
Semanalmente después de las 36 semanas.
No podemos olvidar incluir una valoración psicosocial, al menos una vez cada trimestre, ya que puede ayudar a identificar problemas que requieran una evaluación, intervención o derivación9.
En la tabla 6 se resumen las intervenciones y puntos clave en el seguimiento del embarazo en embarazos sin complicaciones.
Intervenciones y puntos clave en el seguimiento del embarazo en embarazos sin complicaciones
| Trimestre | Semanas | Pruebas | Procedimientos/ecografía |
|---|---|---|---|
| 1.o | 1.a visita | • Hemograma• Rh• Coombs• Bacteriuria• Cribado de diabetes (si riesgo)• Cribado hipotiroidismo• PAPP-A y Fracc libre β-HCG• Serologías:∘ Rubéola∘ Sífilis∘ VIH∘ Hepatitis B∘ Clamidia y gonorrea* (si factores de riesgo)∘ Chagas*∘ Citología (si no hay cribado correcto) | |
| 11-13 semanas | Biopsia corial (si sospecha cromosomopatía) | Ecografía (cribado de gestación múltiple, malformaciones) | |
| 2.o | 16-18 semanas | Alfafetoproteína | |
| 15-22 semanas | Test de ADN (si disponible)Amniocentesis (si hubiera sospecha de cromosomopatía) | ||
| 18-24 semanas | Cribado DM (test O'Sullivan) | Ecografía cribado malformaciones congénitas | |
| 3.o | 28 semanas | Inmunoglobulina anti-D si precisa | |
| 33-36 | Ofrecer preparación al parto | ||
| >36 semanas | Determinar presentación fetal | ||
| 35-37 semanas | Cultivo vagino-rectal Streptococcus agalactiae grupo B | ||
| 41 semanas | Inducción del parto |
Fuente: elaboración propia.
En el embarazo, la primera visita será lo más precoz posible, antes de la semana 12 de gestación.
Evaluaciones iniciales- •
Antecedentes familiares y personales
- •
Historial de embarazos previos
- •
Exploración física: IMC (obesidad o delgadez extrema empeora los resultados obstétricos), toma de la presión arterial en todas las visitas, valorar mujeres con riesgo de mutilación genital.
- •
Pruebas de laboratorio iniciales:
- ∘
Serologías: Para impedir la transmisión vertical de infecciones se recomienda incluir serologías de sífilis, rubéola (si fuese negativa, vacunar tras el parto), virus de inmunodeficiencia humana (VIH), hepatitis B. La serología de toxoplasmosis no está recomendada, presenta balance riesgo-beneficio negativo por la baja incidencia de enfermedad, la dificultad diagnóstica y el riesgo teratogénico del tratamiento, es importante insistir mucho en las medidas preventivas (tabla 7). En las mujeres que proceden de países iberoamericanos con endemia de enfermedad de Chagas se debe realizar cribado de esta enfermedad.
Tabla 7.Recomendaciones frente a toxoplasma
• Usar guantes y limpiar bien las manos y uñas al manipular arena, tierra, etc. • Evitar contacto con gatos y sus excrementos • Mantener gatos domésticos en el interior y dar comida cocinada o seca • Comer solo carne cocinada a >70° • No tomar alimentos elaborados con carnes crudas (pueden tomarse si se han congelado previamente -20° durante 48h) • Lavado de hortalizas, frutas y verduras antes del consumo • Lavado de manos y utensilios después de manipular carne cruda Fuente: Agencia Española de Seguridad Alimentaria y Nutrición19 y López Garcia-Franco et al.20.
- ∘
Grupo sanguíneo, factor Rh y test de Coombs indirecto.
- ∘
El cribado de bacteriuria asintomática (BA) para la prevención de pielonefritis y de complicaciones perinatales, como bajo peso al nacer (aunque los estudios que hay son de baja calidad), se debe realizar mediante solicitud de urocultivo. La BA de la gestante (>100.000 colonias/ml), incluida la BA por estreptococo del grupo B (EGB), se debe tratar10.
- ∘
Determinación de hemoglobina y hematocrito para cribado de anemia, siendo un valor de hemoglobina inferior a 11g/dl diagnóstico de esta. La confirmación de anemia ferropénica se realiza con una determinación de ferritina sérica.
- ∘
Cribado de enfermedad tiroidea (tabla 8):
Tabla 8.Factores de riesgo para cribado de enfermedad tiroidea en gestantes
• Edad >30 años • Historia familiar de enfermedad tiroidea autoinmune o hipotiroidismo • Presencia de bocio • Positividad de anticuerpos antitiroideos • Diagnóstico de diabetes mellitus tipo 1 u otras alteraciones tiroideas • Antecedentes de infertilidad • Antecedentes de aborto o parto pretérmino • Antecedentes de irradiación de cabeza o cuello o cirugía tiroidea • Gestante en tratamiento con levotiroxina • Residente de zonas deficientes de yodo
- -
Se recomienda en gestantes con riesgo elevado de acuerdo con las guías; incluye mujeres mayores de 30 años, que son un gran porcentaje de gestantes en nuestro país, aunque se desconoce el impacto de esta medida (tabla 8).
- -
Sobre la indicación de tratamiento del hipotiroidismo clínico en el embarazo, no hay duda.
- -
En el hipotiroidismo subclínico, sí hay consenso en tratar si los niveles de TSH>10mU/L independientemente de los valores de T4 libre.
- -
Sí que hay controversia para el manejo del hipotiroidismo subclínico con niveles de TSH entre 4 y 10mU/L con T4L normal.
- -
Para ajustar el tratamiento con levotiroxina se deben considerar rangos de TSH y T4 trimestre-específicos propios o recomendando como límite superior de la normalidad para la TSH en el primer trimestre del embarazo 2,5mU/L y en el segundo y tercer trimestres 3,0mU/L11,12.
- ∘
Cribado de diabetes mellitus (DM) en mujeres con factores de riesgo (tabla 9) o sospecha de padecer DM no diagnosticada, aunque el cribado universal se realizará a las 24 semanas13.
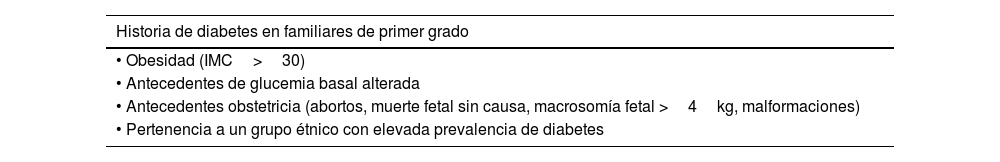
Tabla 9.Factores de riesgo para diabetes gestacional
Historia de diabetes en familiares de primer grado • Obesidad (IMC>30) • Antecedentes de glucemia basal alterada • Antecedentes obstetricia (abortos, muerte fetal sin causa, macrosomía fetal >4kg, malformaciones) • Pertenencia a un grupo étnico con elevada prevalencia de diabetes Fuente: Davidson et al.13.
- ∘
Cribado de ser portadora de un feto con alteraciones cromosómicas:
- -
En el primer trimestre o cribado combinado se realiza en dos pasos:
- –
Determinación en sangre materna de marcadores bioquímicos (proteína A plasmática asociada al embarazo [PAPP-A] fracción libre de la beta-gonadotrofina coriónica humana [β-HCG]) que se realiza entre las semanas 9-10 de gestación.
- –
Estudio ecográfico (translucencia nucal, huesos nasales, ángulo facial, pulsatilidad ductus venoso, regurgitación tricuspídea) entre las semanas 11-13+6.
- -
El cribado del segundo trimestre mediante marcadores bioquímicos (alfafetoproteína [AFP], β-HCG, estradiol no conjugado e inhibina A) se ofrecerá entre las semanas 15-19 de gestación, solo a las gestantes que no se hayan podido hacer el cribado del primer trimestre.
- -
Actualmente, se está incorporando a los programas de cribado un nuevo test que detecta el ADN fetal en sangre materna, es una prueba segura, la extracción sanguínea materna se puede realizar entre las semanas 10-22 de gestación y el resultado se puede tener en una semana.
- -
Al tratarse de pruebas de cribado, un resultado positivo requiere confirmación mediante biopsia corial en el primer trimestre o amniocentesis en el segundo.
- ∘
Revisar el cribado de cáncer de cérvix (si no fuera correcto, mejor realizarlo el primer o segundo trimestre).
- ∘
El embarazo es una situación de mayor vulnerabilidad para sufrir violencia de género. A su vez, esta se asocia a mayor morbimortalidad materno-fetal. Se recomienda la detección activa de maltrato durante todo el embarazo.
- ∘
No hay estudios concluyentes de que la realización sistemática de ecografías mejore los resultados obstétricos. Distintas recomendaciones proponen que se realice la ecografía del primer trimestre no más tarde de la semana 14 (recomendación fuerte, en contra). Las ventajas de la ecografía del primer trimestre incluyen su capacidad para ayudar a determinar la presencia de un embarazo intrauterino, la edad gestacional y evaluar la gestación múltiple.
La ecografía realizada en el segundo trimestre sirve para estudiar la anatomía fetal y la localización de la placenta. Se recomienda que la ecografía del segundo trimestre se realice entre las semanas 18 y 22 de gestación. Esta ecografía también puede confirmar la fecha del embarazo si no se hubiera realizado una ecografía antes. La sensibilidad de la ecografía para detectar anomalías fetales oscila entre el 13 y el 82%, dependiendo del tipo de anomalía, el nivel de riesgo de la población y la pericia del ecografista14.
Cribado de diabetes gestacionalEn general se recomienda realizar cribado universal en la semana 24 (recomendación débil, a favor). Para el cribado se utiliza el test de O'Sullivan (50g de glucosa). Si el resultado ≥140mg de glucemia debe realizarse un test diagnóstico de sobrecarga oral de glucosa (SOG), con 100g de glucosa y 4 determinaciones de glucemia: basal, a 1 hora, 2 horas y 3 horas de ingerir la glucosa13.
Cribado de preeclampsiaSe debe realizar la toma de presión arterial en todas las visitas para cribado de preeclampsia (recomendación fuerte, a favor). Los estados hipertensivos inducidos por el embarazo (EHE) son una de las 4 primeras causas de mortalidad materna y de morbilidad perinatal.
Actualmente se está llevando a cabo la prevención de preeclampsia en mujeres con factores de alto riesgo mediante uso de ácido acetilsalicílico (AAS) 60-150mg/día desde finales del primer trimestre. Una revisión sistemática muestra resultados favorables para algunas variables de morbimortalidad materno-fetal, aunque debería individualizarse el riesgo antes de tomar la decisión15.
Administración de inmunoglobulina anti-DEl test Coombs indirecto que se realizó en la primera visita debe repetirse en la semana 28 a las gestantes con Rh negativo (recomendación fuerte, a favor). La incidencia de isoinmunización ha descendido desde que se estableció la profilaxis con gammaglobulina específica anti-D: en gestantes Rh negativas se recomienda administrar una dosis completa (300ng) de inmunoglobulina anti-D si el test de Coombs indirecto es negativo en el tercer trimestre12.
Cribado de estreptococo BSe recomienda realizar cultivo vagino-rectal a todas las gestantes entre las semanas 35 y 37 para prevenir la sepsis neonatal, meningitis y neumonías por Streptococcus agalactiae del grupo B (EGB) (recomendación débil, a favor). No hay que tratar a las portadoras; la profilaxis antibiótica se realiza cuando se inicia el parto12,16.
Educación maternalRecomendaciones nutricionalesÁcido fólico: Para evitar los defectos del tubo neural (DTN) se recomienda la ingesta diaria de 400μg de ácido fólico, desde el diagnóstico de embarazo (si la mujer no lo tomó antes de la concepción) y continuar hasta el cierre del tubo neural, semana 12 de gestación (recomendación fuerte, a favor). En mujeres de alto riesgo se recomienda una dosis diaria de 5mg de ácido fólico17.
Yodo: Durante el embarazo se produce un incremento de la función tiroidea, aumentando los requerimientos diarios de yodo, pasando de 150 a 250μg/día. La suplementación de yodo durante el embarazo y la lactancia actualmente no está justificada en España de forma generalizada (recomendación débil, en contra). Se puede alcanzar una ingesta de yodo suficiente con el uso de sal yodada y la toma diaria de 3 raciones de lácteos o sus derivados (recomendación débil, a favor). Otros alimentos, como las legumbres y el pescado, también tienen un elevado contenido en yodo. En caso de gestantes con ingesta insuficiente en dieta, se puede indicar el suplemento de 200μg/día de yoduro potásico durante el embarazo y lactancia (recomendación débil, a favor)18.
Alcohol: abstención. No hay dosis segura (recomendación fuerte, en contra).
Cafeína: Aconsejar bajar el consumo a 150mg/día (una taza de café contiene entre 100-150mg), cifras>300mg/día pueden inducir abortos, infertilidad y teratogenia.
Prevención de infección por listeria: recomendar a las gestantes que dejen de tomar alimentos envasados que no precisen un cocinado previo a su consumo.
Evitar o limitar el consumo por su alto contenido en mercurio: pez espada o emperador, atún rojo, tiburón (cazón, marrajo, tintorera, etc.) y lucio.
Evitar: carne de caza silvestre (animales abatidos en la caza, como el jabalí, venado, etc.) y productos cárnicos loncheados y quesos loncheados o rallados industriales19.
VacunasDurante el embarazo se consideran vacunas seguras aquellas en las que el material utilizado son virus o bacterias muertas o inactivados (gripe, hepatitis B).
- •
Gripe: Cuando la gestación coincide con época de gripe estacional se recomienda vacunar a la embarazada (recomendación fuerte, a favor).
- •
Tosferina: Debido al aumento de incidencia, se recomienda actualmente la vacunación de las embarazadas preferiblemente en la semana 28 a 32 (aunque se puede vacunar hasta la 36) con la vacuna dTPa (difteria, tétanos y Pertussis acelular de baja carga antigénica) como estrategia para disminuir la transmisión de tosferina a los niños en los primeros meses de vida (recomendación fuerte, a favor).
- •
COVID-19: La vacuna puede administrarse sin riesgo a gestantes.
- •
Otras: En caso de riesgo de exposición se puede administrar vacuna meningocócica, poliomielitis parenteral, rabia y hepatitis A. No se dispone de información sobre la seguridad en el embarazo de las vacunas tifoidea parenteral y del cólera. Durante el embarazo está contraindicada la administración de vacunas en las que el material usado sean virus o bacterias vivos o atenuados (sarampión, rubéola y parotiditis) (recomendación fuerte, en contra)20.
- •
Tabaquismo: si las mujeres consumen productos del tabaco, debe fomentarse el abandono del hábito y proporcionarse apoyo.
- •
Abuso de sustancias: debe identificarse y tratarse a las mujeres que abusan regularmente de drogas, medicamentos de venta libre, medicamentos con receta hasta el punto de que la dependencia física o los daños supongan un riesgo para ellas mismas o para el feto.
- •
Trabajo: la mayoría de las mujeres con un embarazo sin complicaciones pueden seguir trabajando hasta el inicio del parto. Sin embargo, si la mujer tiene complicaciones médicas u otras complicaciones del embarazo, o la ocupación implica riesgo, debe ser necesario valorarlo.
- •
Viajes en avión: las mujeres con embarazos sin complicaciones pueden volar con seguridad hasta las 36 semanas de gestación, aunque se les debe advertir y dar recomendaciones sobre el riesgo de trombosis venosa (estado de embarazo y estasis venoso) para que tomen precauciones.
- •
Ejercicio físico: se debe animar a las gestantes a realizar ejercicio físico moderado durante el embarazo14.
Se deben abordar:
- -
Lactancia materna.
- -
Suplementación.
- -
Evaluación de la salud física y emocional.
- -
Planificación familiar posparto.
Las actividades preventivas en anticoncepción deben estar dirigidas a planificar y espaciar los embarazos, evitar embarazos no planificados y reducir el número de interrupciones voluntarias del embarazo (IVE). Estas actividades anticonceptivas se deben ofrecer con unos criterios de calidad que parten de un conocimiento científico actualizado, garantizando una información centrada en el/la paciente sobre la seguridad y efectividad de los diferentes métodos, en el momento que los demanda y con un servicio eficiente, accesible y con equidad.
El número de IVE realizadas en España durante el año 2022 (últimos datos publicados), efectuadas dentro de los supuestos regulados según la Ley Orgánica 2/2010, de 3 de marzo, de salud sexual y reproductiva y de la interrupción voluntaria del embarazo fueron 98.316, lo que supone una tasa de IVE por 1.000 mujeres de entre 15 y 44 años de edad en España de 11,68; estas cifras han supuesto un repunte volviendo a cifras similares a 201921.
La anticoncepción de urgencia se lleva utilizando desde hace más de 20 años, con una implantación diferente entre los países; la entrada de la libre dispensación en España, hace 15 años, ha facilitado de forma significativa su utilización. En la última encuesta de la Sociedad Española de Contracepción (SEC) publicada en 2022, el 31,4% de las mujeres en edad fértil encuestadas declaran haber tenido que recurrir en alguna ocasión a la toma de anticoncepción de urgencia22.
Ante estos datos es fundamental revisar y elaborar nuevas estrategias dentro de AP para facilitar la anticoncepción como una de las actividades preventivas.
Cribado oportunista, consejo contraceptivo y estrategias de intervenciónLa evidencia sobre la efectividad del consejo contraceptivo estructurado en diferentes ámbitos asistenciales en general muestra resultados favorables, si bien es escasa y con limitaciones metodológicas. Realizar un buen consejo contraceptivo en el ámbito de la AP concluye que se asocia a un incremento de uso de los anticonceptivos hormonales y puede reducir los embarazos no planificados.
No existe el método anticonceptivo ideal, cada pareja (es recomendable implicar a los hombres en esta actividad preventiva) optará por el método que le resulte más adecuado. Por lo tanto, es imprescindible que tengan toda la información necesaria para poder elegir el método que más se ajuste a sus características, necesidades y preferencias.
En el ámbito de AP se recomienda realizar una detección oportunista sobre el uso de métodos anticonceptivos en todas las mujeres en edad fértil aprovechando cualquier motivo de consulta, con una periodicidad cada 1-2 años o menor en situaciones de riesgo o vulnerabilidad.
Debe ser un consejo estructurado e incluir información sobre los distintos métodos anticonceptivos y su efectividad en la prevención de embarazos no planificados, infecciones de transmisión sexual (ITS) y VIH, sus beneficios y efectos adversos; con el objetivo de facilitar una elección informada, indicar el método elegido y garantizar el seguimiento y la accesibilidad para consultar las posibles dudas.
Los objetivos del consejo contraceptivo son:
- •
Responsabilizar sobre la salud:
- ∘
Implicar al paciente en su propio cuidado.
- ∘
Estimular la responsabilidad del paciente en la toma de sus decisiones.
- ∘
- •
Fomentar actitudes saludables:
- ∘
Ayudar a los usuarios a cambiar prácticas de riesgo.
- ∘
Facilitar decisiones para usar anticonceptivos.
- ∘
Prevenir ITS.
- ∘
- •
Explicar los posibles efectos secundarios:
- ∘
Reduce la ansiedad.
- ∘
Aumenta el éxito del método.
- ∘
Prepara por si los problemas aparecen.
- ∘
- •
Despejar mitos y rumores.
- •
Relación médica/o-paciente:
- ∘
Construir una buena relación entre el profesional y la usuaria/o.
- ∘
Asegurar y mantener la confidencialidad.
- ∘
La efectividad del consejo depende de su contenido, teniendo en cuenta los intereses individuales y los grupos de edad.
Mayor efectividad si además de información se ofrece acceso a los métodos y apoyo profesional.
Hay pocos estudios sobre la efectividad del consejo. En una revisión Cochrane, se encontraron 10 ensayos con datos de calidad moderada. Las mujeres que recibieron el asesoramiento estructurado continuaron con el uso de la anticoncepción, comparadas con las pacientes que recibieron asesoramiento habitual. Además, menos mujeres que recibieron asesoramiento estructurado dejaron de utilizar anticonceptivos por cambios en el patrón de sangrado23.
Hay situaciones de mayor vulnerabilidad donde hay evidencia de mayor efectividad del consejo contraceptivo, como son el posparto o después de una IVE donde incluso se podría utilizar el mismo acto quirúrgico para insertar un DIU o se podría iniciar inmediatamente anticoncepción hormonal.
En población adolescente el consejo debería incluir la prevención de ITS, insistiendo en el doble método. Los programas más efectivos son los que no se limitan a dar información acerca de la sexualidad y la anticoncepción, sino que ofrecen acceso a los métodos y apoyo psicológico, aunque la efectividad desaparece cuando se interrumpen estas actividades.
Los médicos de familia en consulta deben descartar la posibilidad de embarazo al prescribir fármacos con potencial teratógeno, o al solicitar estudios radiológicos, y abordar la anticoncepción como una actividad preventiva más. Al realizar el consejo personalizado deben mantenerse actualizados los criterios médicos para elegir un anticonceptivo, investigar las preferencias de la mujer y orientar cómo usarlos de manera segura y eficaz.
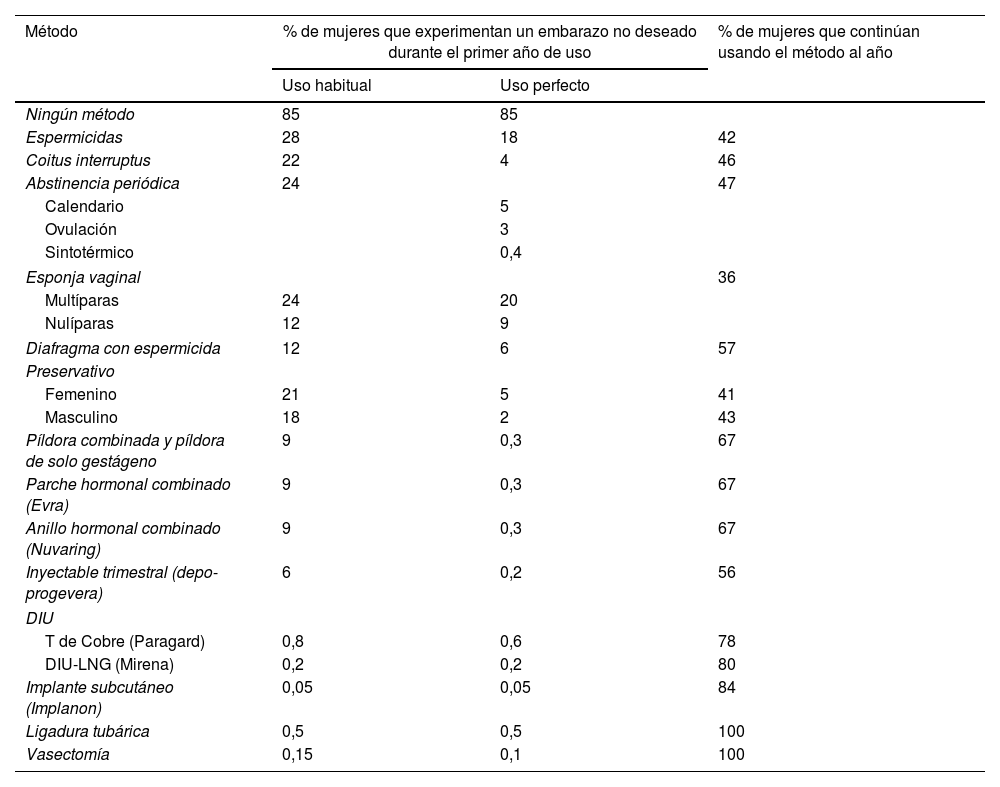
Eficacia de los métodos anticonceptivosLa eficacia anticonceptiva se evalúa midiendo el índice de Pearl, número de fallos por cada 100 mujeres-año de exposición (tabla 10)24. Sabemos que los anticonceptivos que proporcionan una mayor efectividad son aquellos que su cumplimiento no depende de la usuaria, en ellos la eficacia (uso perfecto) y efectividad (uso real) se aproximan mucho25.
Porcentaje de mujeres que experimentan un embarazo no deseado durante el primer año de uso y porcentaje de mujeres que continúan usando el método al final del primer año (Estados Unidos)
| Método | % de mujeres que experimentan un embarazo no deseado durante el primer año de uso | % de mujeres que continúan usando el método al año | |
|---|---|---|---|
| Uso habitual | Uso perfecto | ||
| Ningún método | 85 | 85 | |
| Espermicidas | 28 | 18 | 42 |
| Coitus interruptus | 22 | 4 | 46 |
| Abstinencia periódica | 24 | 47 | |
| Calendario | 5 | ||
| Ovulación | 3 | ||
| Sintotérmico | 0,4 | ||
| Esponja vaginal | 36 | ||
| Multíparas | 24 | 20 | |
| Nulíparas | 12 | 9 | |
| Diafragma con espermicida | 12 | 6 | 57 |
| Preservativo | |||
| Femenino | 21 | 5 | 41 |
| Masculino | 18 | 2 | 43 |
| Píldora combinada y píldora de solo gestágeno | 9 | 0,3 | 67 |
| Parche hormonal combinado (Evra) | 9 | 0,3 | 67 |
| Anillo hormonal combinado (Nuvaring) | 9 | 0,3 | 67 |
| Inyectable trimestral (depo-progevera) | 6 | 0,2 | 56 |
| DIU | |||
| T de Cobre (Paragard) | 0,8 | 0,6 | 78 |
| DIU-LNG (Mirena) | 0,2 | 0,2 | 80 |
| Implante subcutáneo (Implanon) | 0,05 | 0,05 | 84 |
| Ligadura tubárica | 0,5 | 0,5 | 100 |
| Vasectomía | 0,15 | 0,1 | 100 |
Fuente: Trusell45.
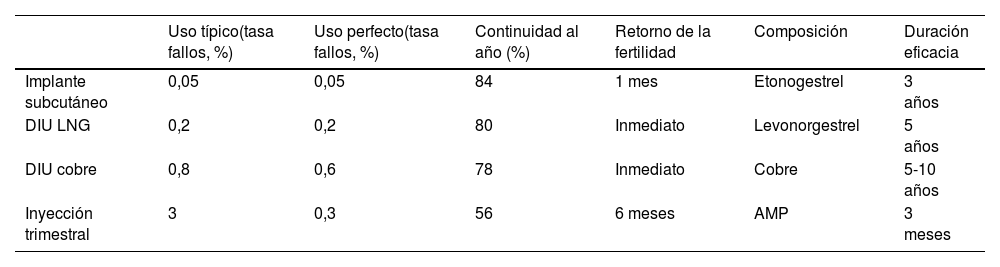
Los anticonceptivos reversibles de larga duración (LARC en terminología anglosajona), es decir, el DIU y los implantes subcutáneos, son métodos que no requieren cumplimiento y son los más coste-efectivos en todos los grupos de edad. Estos métodos están infrautilizados en España, donde un 3,8% utiliza el DIU hormonal, un 2,9% el DIU de cobre y un 1,7% implante subcutáneo, según datos de la SEC22.
Sería deseable que se implanten estrategias para su utilización en AP.
Es muy importante evitar la desprotección en los cambios de método (tablas 11 y 12).
Recomendaciones para el inicio de los diferentes métodos anticonceptivos
| Método anticonceptivo | Cuando empezar siempre que la mujer no esté embarazada | Necesidad de añadir otro método anticonceptivo | Exploraciones y analíticas previas antes de iniciar el tratamiento |
|---|---|---|---|
| DIU cobre | En cualquier momento | No es necesario | Exploración bimanual e inspección del cérvix |
| DIU levonorgestrel | En cualquier momento | Si han transcurrido >7 días tras el inicio de la menstruación, utilizar un método barrera o abstinencia durante 7 días | Exploración bimanual e inspección del cérvix |
| Implante levonorgestrel | En cualquier momento | Si han transcurrido >5 días tras el inicio de la menstruación, utilizar un método barrera o abstinencia durante 7 días | Ninguna |
| Progestágeno inyectado | En cualquier momento | Si han transcurrido >7 días tras el inicio de la menstruación, utilizar un método barrera o abstinencia durante 7 días | Ninguna |
| Anticonceptivo hormonal combinado | En cualquier momento | Si han transcurrido >5 días tras el inicio de la menstruación, utilizar un método barrera durante o abstinencia durante 7 días | Ninguna |
| Anticonceptivo oral solo gestágeno | En cualquier momento | Si han transcurrido >5 días tras el inicio de la menstruación, utilizar un método barrera durante o abstinencia durante 2 días | Ninguna |
Fuente: Holton y Paranandi46.
Prevención de la desprotección en los cambios de anticonceptivos
| Píldora | Parche | Anillo | Gestágeno inyectable | Implante de gestágeno | DIU de gestágeno | DIU de cobre | |
|---|---|---|---|---|---|---|---|
| Píldora | Sin hueco: tomar la primera píldora del nuevo paquete el día después de tomar cualquier píldora del antiguo envase | Comenzar con el parche un día antes de dejar la píldora | Sin hueco: Insertar el anillo un día después de tomar cualquier píldora del envase | Poner la primera inyección 7 días antes de dejar la píldora | Insertar el implante 4 días antes de dejar la píldora | Insertar el DIU de gestágeno 7 días antes de dejar la píldora | El DIU de cobre puede insertarse hasta 5 días después de dejar la píldora |
| Parche | Iniciar la píldora un día antes de dejar el parche | - | Sin hueco: Insertar el anillo y retirar el parche el mismo día | Poner la primera inyección 7 días antes de retirar el parche | Insertar el implante 4 días antes de retirar el parche | Insertar el DIU de gestágeno 7 días antes de retirar el parche | El DIU de cobre puede insertarse hasta 5 días después de retirar el parche |
| Anillo | Iniciar la píldora un día antes de retirar el anillo | Comenzar el parche 2 días antes de retirar el anillo | - | Poner la primera inyección 7 días antes de retirar el anillo | Insertar el implante 4 días antes de retirar el anillo | Insertar el DIU de gestágeno 7 días antes de retirar el anillo | El DIU de cobre puede insertarse hasta 5 días después de retirar el anillo |
| Gestágeno inyectable | Puede tomar la primera píldora hasta 15 semanas después de la última inyección | Puede iniciarse el parche hasta 15 semanas después de la última inyección. | Puede insertarse el anillo hasta 15 semanas después de la última inyección | - | Puede insertarse el implante hasta 15 semanas después de la última inyección | El DIU de gestágeno puede insertarse hasta 15 semanas después de la última inyección | El DIU de cobre puede insertarse hasta 16 semanas después de la última inyección |
| Implante de gestágeno | Iniciar la píldora 7 días antes de retirar el implante | Iniciar el parche 7 días antes de retirar el implante | Iniciar el anillo 7 días antes de retirar el implante | Poner la primera inyección 7 días antes de retirar el implante | - | Insertar el DIU de gestágeno 7 días antes de retirar el implante | El DIU de cobre puede insertarse hasta 5 días después de retirar el implante |
| DIU de gestágeno | Iniciar la píldora 7 días antes de retirar el DIU | Iniciar el parche 7 días antes de retirar el DIU | Iniciar el anillo 7 días antes de retirar el DIU | Poner la primera inyección 7 días antes de retirar el DIU | Insertar el implante 4 días antes de retirar el DIU | - | Puede insertarse un DIU de cobre en el mismo acto de retirada del DIU de gestágeno |
| DIU de cobre | Comenzar la píldora 7 días antes de retirar el DIU | Comenzar el parche 7 días antes de retirar el DIU | Comenzar el anillo 7 días antes de retirar el DIU | Poner la primera inyección 7 días antes de retirar el DIU | Insertar el implante 4 días antes de retirar el DIU | Insertar el DIU de gestágeno en el mismo acto de retirada del DIU de cobre y usar método de respaldo 7 días | - |
Fuente: Reproductive Health Access Project47.
Queremos destacar que entre las mujeres adolescentes incluidas en el proyecto CHOICE, la gran mayoría (72%) prefería un LARC; además, en las adolescentes, los LARC han demostrado reducir las tasas de embarazos, partos y abortos. Se podría doblar su uso si se retiraran las barreras de acceso para la inserción. Es importante señalar que los datos de fallos de DIU de cobre (0,52%) y de LNG (0,06%) son inferiores a los de la ligadura tubárica (2%)26.
Al dejar un método para pasar a otro, se deben evitar las interrupciones, solapándolos cuando sea necesario hasta que el nuevo método sea ya eficaz (tablas 11 y 12).
Abordaje de los métodos y efectos secundariosNo hay estudios específicos sobre los requisitos previos ni sobre los controles posteriores que se deben realizar. Existe consenso entre las principales guías de práctica clínica27 y opiniones de expertos28,29.
Antes de utilizar cualquier anticonceptivo es preciso tener presente si cumple criterios de elegibilidad (tablas 13-16). CDC tiene una app disponible gratuita para teléfonos móviles, denominada Contraception, que nos permite aplicar de forma automática dichos criterios de elegibilidad30.
Categorías OMS de las condiciones que afectan a la elegibilidad de los anticonceptivos
| 1. Ninguna restricción para el uso del método |
| 2. Las ventajas de usar el método son mayores que los posibles riesgos |
| 3. Los posibles riesgos de usar el método son mayores que las ventajas |
| 4. El riesgo de usar el método es inaceptable |
Fuente: OMS48.
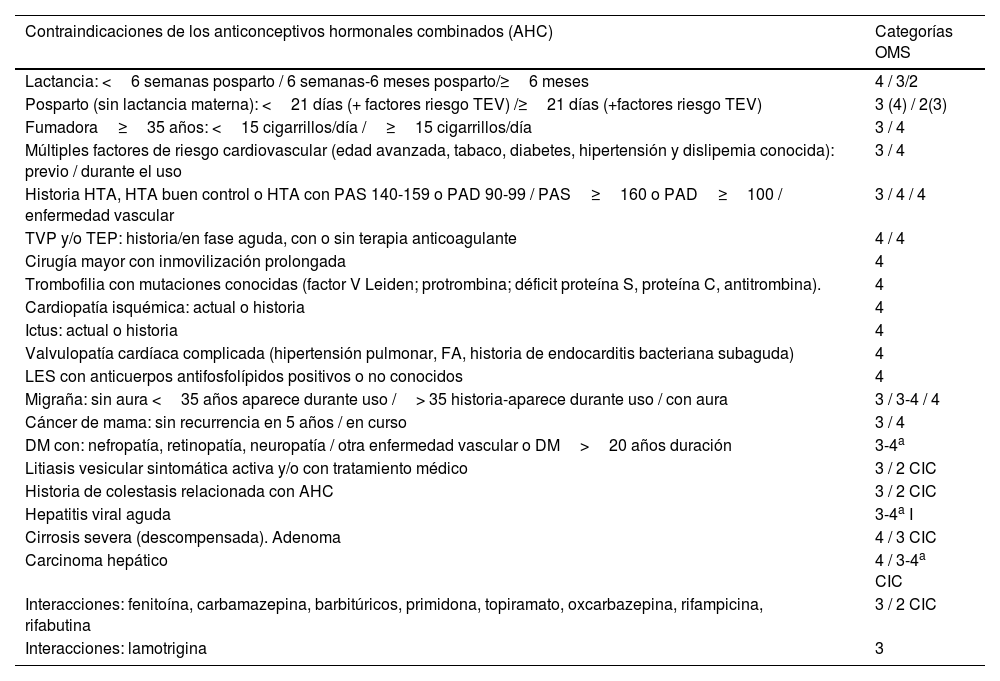
Contraindicaciones de los anticonceptivos hormonales combinados (AHC)
| Contraindicaciones de los anticonceptivos hormonales combinados (AHC) | Categorías OMS |
|---|---|
| Lactancia: <6 semanas posparto / 6 semanas-6 meses posparto/≥6 meses | 4 / 3/2 |
| Posparto (sin lactancia materna): <21 días (+ factores riesgo TEV) /≥21 días (+factores riesgo TEV) | 3 (4) / 2(3) |
| Fumadora≥35 años: <15 cigarrillos/día /≥15 cigarrillos/día | 3 / 4 |
| Múltiples factores de riesgo cardiovascular (edad avanzada, tabaco, diabetes, hipertensión y dislipemia conocida): previo / durante el uso | 3 / 4 |
| Historia HTA, HTA buen control o HTA con PAS 140-159 o PAD 90-99 / PAS≥160 o PAD≥100 / enfermedad vascular | 3 / 4 / 4 |
| TVP y/o TEP: historia/en fase aguda, con o sin terapia anticoagulante | 4 / 4 |
| Cirugía mayor con inmovilización prolongada | 4 |
| Trombofilia con mutaciones conocidas (factor V Leiden; protrombina; déficit proteína S, proteína C, antitrombina). | 4 |
| Cardiopatía isquémica: actual o historia | 4 |
| Ictus: actual o historia | 4 |
| Valvulopatía cardíaca complicada (hipertensión pulmonar, FA, historia de endocarditis bacteriana subaguda) | 4 |
| LES con anticuerpos antifosfolípidos positivos o no conocidos | 4 |
| Migraña: sin aura <35 años aparece durante uso /> 35 historia-aparece durante uso / con aura | 3 / 3-4 / 4 |
| Cáncer de mama: sin recurrencia en 5 años / en curso | 3 / 4 |
| DM con: nefropatía, retinopatía, neuropatía / otra enfermedad vascular o DM>20 años duración | 3-4a |
| Litiasis vesicular sintomática activa y/o con tratamiento médico | 3 / 2 CIC |
| Historia de colestasis relacionada con AHC | 3 / 2 CIC |
| Hepatitis viral aguda | 3-4a I |
| Cirrosis severa (descompensada). Adenoma | 4 / 3 CIC |
| Carcinoma hepático | 4 / 3-4a CIC |
| Interacciones: fenitoína, carbamazepina, barbitúricos, primidona, topiramato, oxcarbazepina, rifampicina, rifabutina | 3 / 2 CIC |
| Interacciones: lamotrigina | 3 |
CIC: anticonceptivo inyectable combinado; DM: diabetes mellitus; FA: fibrilación auricular; HTA: hipertensión arterial; I: inicio; LES: lupus eritematoso sistémico; PAD: presión arterial diastólica; PAS: presión arterial sistólica; TEV: tromboembolismo venoso; TEP: tromboembolia pulmonar; TVP: tromboembolia venosa profunda.
Contraindicaciones del dispositivo intrauterino (DIU) levonorgestrel
| Las del DIU de cobre (tabla 16) en generala y además: | Categoría OMS |
|---|---|
| TVP/TEP en fase aguda sin anticoagulación establecida | 3 |
| Cardiopatía isquémica actual o historia | 2 I / 3 C |
| LES con anticuerpos antifosfolípidos+ o no conocidos | 3 |
| Migraña con aura a cualquier edad | 2 I / 3 C |
| Cáncer de mama actual | 4 |
| Cáncer de mama sin recidiva en 5 años | 3 |
| Cirrosis hepática descompensada. Adenoma y carcinoma hepático | 3 |
C: continuación; I: inicio; LES: lupus eritematoso sistémico; TEP: tromboembolia pulmonar; TVP: tromboembolia venosa profunda.
Contraindicaciones del dispositivo intrauterino (DIU) de cobre
| Motivo de la contraindicación | Categoría OMS |
|---|---|
| Embarazo | 4 |
| Posparto de ≥48h hasta <4 semanas | 3 |
| Posparto con sepsis puerperal | 4 |
| Inserción inmediata postaborto séptico | 4 |
| LES con trombocitopenia grave | 3 I / 2 C |
| Sangrado vaginal inexplicado (sin evaluar) | 4 I / 2 C |
| Enfermedad trofoblástica y β□-HCG en descenso o indetectable | 3 |
| Enfermedad trofoblástica maligna o valores de β□-HCG elevados persistentemente | 4 |
| Cáncer de cérvix o endometrio (en espera tratamiento) | 4 I / 2 C |
| Cáncer de ovario | 3 I / 2 C |
| Miomas anomalías anatómicas que distorsionan cavidad uterina | 4 |
| Infecciones genitales activas | 4 I / 2 C |
| Alto riesgo de ITS | 2-3 I / 2 C |
| SIDA con clínica y sin terapia antirretroviral | 3 I / 2 C |
| SIDA sin clínica y con terapia antirretroviral | 2-3 I / 2 C |
| TBC pélvica | 4 I / 3 C |
β□-HCG: beta-gonadotropina coriónica humana; C: continuación; I: inicio; ITS: infección de transmisión sexual; LES: lupus eritematoso sistémico; sida: síndrome de la inmunodeficiencia adquirida; TBC: tuberculosis.
Fuente: OMS49.
Para iniciar un anticonceptivo hormonal combinado (AHC) se debe realizar una historia clínica personal y familiar, especialmente orientada hacia la detección de contraindicaciones (tablas 14-16) y de factores de riesgo cardiovascular, medir la presión arterial, pesar e informar a la mujer. Es fundamental explicar las diferentes formas de administración de los anticonceptivos hormonales, con sus ventajas e inconvenientes.
No se recomienda el screening rutinario de trombofilia ni dislipemia31. Una visita de seguimiento a los 3-6 meses parece útil para reforzar el cumplimiento. Anualmente se recomienda medir la presión arterial y actualizar la historia clínica. La evidencia científica no justifica la realización de descansos durante el uso de AHC. La seguridad de los AHC se ha estudiado ampliamente. El uso de AHC durante las etapas iniciales del embarazo no se asocia a la aparición de defectos congénitos32.
La European Medicines Agency y una reciente revisión sistemática confirman que el riesgo de tromboembolia venosa (TEV) es pequeño, del orden de 20-40 casos por 100.000 mujeres/año de uso, y varía entre los distintos AHC estudiados. En el rango superior están los AHC de tercera y cuarta generaciones. Todos los AHC se asocian con un aumento del riesgo de TEV y confirman que este riesgo es pequeño, como norma general, y que depende del progestágeno utilizado y de la dosis de etinilestradiol. El riesgo de TEV de los AHC con 30 a 35mg de etinilestradiol y gestodeno, desogestrel, acetato de ciproterona y drospirenona fue similar y aproximadamente un 50-80% mayor que con LNG33. Los más seguros son los que contienen LNG o norgestimato, sin que existan diferencias en función de la vía de administración34,35. Los nuevos preparados con estradiol, frente a los clásicos con EE, buscan la reducción del riesgo de TEV, sin significación estadística hasta ahora, y se necesitan series más grandes para sacar conclusiones36.
Respecto al cáncer de mama y su relación con «todos» los anticonceptivos hormonales, se ha descrito recientemente un riesgo relativo de 1,20 en mujeres que los usan o han usado recientemente37. Un aumento muy bajo, en términos absolutos, frente al efecto anticonceptivo, beneficios adicionales sobre dismenorrea y menorragia, y la reducción global del cáncer, a expensas de una significativa disminución del riesgo de cáncer de ovario, endometrio y colon38.
Antes de insertar un DIU hay que realizar la historia clínica, una exploración pélvica con histerometría, comprobar que no está contraindicado (tabla 15) e informar e insertar en día óptimo. En una visita 1-3 meses postintervención se deben visualizar los hilos por el orificio cervical y valorar la tolerancia. Si se realiza autopalpación de los hilos, no se precisan revisiones posteriores39. No hay evidencia para realizar más pruebas. En situaciones especiales, realizar prescripción y seguimiento adaptados.
En las mujeres en la década de los 40, también se puede usar el DIU de cobre, siempre descartando previamente las contraindicaciones (tabla 16).
Anticoncepción de urgenciaSe denomina anticoncepción de urgencia a aquella que se usa de forma esporádica para evitar un embarazo no deseado tras una relación sexual sin protección, pero nunca debe ser utilizada como un método anticonceptivo. En este sentido habría que facilitarla si ha existido una relación sexual sin protección cualquier día del ciclo menstrual, a partir de los 21 días de un parto a menos que la mujer esté lactando, a partir del día 5 tras un legrado o una intervención por un embarazo ectópico y, por último, si se ha utilizado de forma incorrecta un anticonceptivo hormonal, tanto oral como en forma de implante, o si se ha sobrepasado el tiempo aconsejado para el DIU con progestágeno40. Los métodos utilizados para la anticoncepción de urgencia son el DIU de cobre y el tratamiento oral con acetato de ulipristal (30mg dosis única) o con levonorgestrel (1,5mg dosis única). El mecanismo de acción del DIU es alterar la motilidad y viabilidad de los espermatozoides para prevenir la fertilización; también puede afectar al ovocito y al endometrio. En el caso de la anticoncepción de urgencia oral, se origina un retraso en la ovulación o en el desarrollo del folículo. En ninguno de los casos tiene un efecto abortivo.
Hay que subrayar que el más eficaz es la inserción del DIU de cobre y el único que consigue el efecto deseado si se ha producido la ovulación. Se debe colocar durante los 5 primeros días tras la relación sexual sin protección, o incluso retrasarlo si se considera que todavía no se ha producido la ovulación. En este último escenario la inserción sería dentro de los 5 primeros días tras la ovulación. Es importante advertir que no tiene un efecto abortivo: lo que impide es la implantación, pero no actúa si el embrión ya estuviese implantado. Por otro lado, su eficacia no cambia con el IMC ni con la utilización concomitante de otros tratamientos médicos.
Cuando no se puede utilizar el DIU (bien por negación por parte de la paciente, por falta de accesibilidad o por contraindicación) se puede ofrecer tratamiento oral. Hay que advertir que no tiene efecto si se utiliza pasadas 120 horas después de la relación sexual, ya que se estima que es el tiempo que puede permanecer el esperma en el tracto genital. Por otro lado, el tratamiento oral lo que hace es «retrasar» la ovulación, pero no tiene efecto si esta se ha producido. Es más, hay datos que apuntan que el tratamiento oral con levonorgestrel no es efectivo si se realiza, no ya después de 120 horas, como se ha dicho de forma general, sino pasadas 96 horas. Es importante subrayar que tras la utilización del ulipristal hay que esperar 5 días antes de iniciar el tratamiento hormonal, en tanto que con el levonorgestrel se puede realizar de forma inmediata.
Aunque como ya hemos comentado es más eficaz el ulipristal que el levonorgestrel, existen algunas circunstancias en que puede ser preferible utilizar el segundo. Así, si el riesgo de embarazo tras la relación sexual es bajo, sería preferible utilizar el levonorgestrel, ya que esto nos permitiría utilizar otro método anticonceptivo de forma inmediata. Por otro lado, si la mujer ha tomado recientemente un progestágeno (por ejemplo, porque se le haya olvidado una pastilla), es preferible utilizar el levonorgestrel porque el efecto del ulipristal disminuye claramente.
Otra situación a tener en cuenta es el caso de las mujeres con IMC>26kg/m2 o peso superior a 70kg, o cuando la mujer esté utilizando algún fármaco que origine inducción enzimática. En estos casos se aconseja duplicar la dosis de levonorgestrel (3mg), pero en el caso del ulipristal se utiliza la misma dosis.
Dicho todo esto, tenemos que aclarar que en nuestro país puede resultar muy complicado la colocación «urgente» de un DIU. En el caso de las pautas orales, actualmente están disponibles tanto el ulipristal de 30mg como el levonorgestrel de 1,5mg, no están financiadas y no necesitan receta médica. En cuanto a la necesidad del consentimiento de los padres en menores, tenemos que aclarar que la edad mínima de la mujer para adquirir el anticonceptivo sin el consentimiento de los padres es de 16 años, y desde los 13 a los 15, atendiendo a la Ley 41/2002 de Autonomía del paciente41 (BOE 2002), habría que valorar si se trata de una «menor madura», en cuyo caso tampoco se necesita el consentimiento paterno (valoración que puede hacer tanto el médico que la prescribe, como el farmacéutico).
Accesibilidad, información y atención a la anticoncepción en los centros de saludLos médicos de familia, dada su accesibilidad, favorecen la anticoncepción si manejan en sus consultas todos los métodos anticonceptivos reversibles42. La consulta a demanda del médico de familia es la mejor opción para abordar la anticoncepción, respondiendo al criterio de buena práctica de aprovechar la oportunidad. Las consultas programadas, las específicas de la mujer, suelen ser menos accesibles, menos discretas, y la demora en la atención aumenta el riesgo de embarazo no planificado43.. Un grupo especialmente vulnerable y en el que hay que asegurar este servicio es el de las mujeres inmigrantes latinas44. Las mejoras en anticoncepción pasan por una mayor utilización de los ARLD42.
Es clave aumentar el uso de DIU e implantes, que pueden ser manejados por los médicos de familia. Debe garantizarse tanto la accesibilidad como la atención. La anticoncepción es un derecho y no puede negarse por objeción de conciencia, falta de competencia o por otros motivos. Hay estudios que apuntan que los profesionales de AP infraestiman el problema de los embarazos no planificados. Es necesario garantizar una adecuada formación de los profesionales. En la tabla 17 se indican algunas de las características de estos métodos.
Anticonceptivos reversibles de larga duración
| Uso típico(tasa fallos, %) | Uso perfecto(tasa fallos, %) | Continuidad al año (%) | Retorno de la fertilidad | Composición | Duración eficacia | |
|---|---|---|---|---|---|---|
| Implante subcutáneo | 0,05 | 0,05 | 84 | 1 mes | Etonogestrel | 3 años |
| DIU LNG | 0,2 | 0,2 | 80 | Inmediato | Levonorgestrel | 5 años |
| DIU cobre | 0,8 | 0,6 | 78 | Inmediato | Cobre | 5-10 años |
| Inyección trimestral | 3 | 0,3 | 56 | 6 meses | AMP | 3 meses |
AMP: acetato de medroxiprogesterona; DIU: dispositivo intrauterino; LNG: levonorgestrel.
Fuente: elaboración propia.
Recomendaciones del PAPPS sobre prevención de embarazos no planificados
• Hacer cribado oportunista sobre anticoncepción en todas las mujeres en edad fértil, en los varones y a sus parejas respectivas aprovechando cualquier motivo de consulta (recomendación fuerte, a favor), con una periodicidad anual o menor en situaciones de riesgo o vulnerabilidad (recomendación débil, a favor)
• Ofrecer consejo contraceptivo estructurado, que incluya información sobre los distintos métodos anticonceptivos y su efectividad en la prevención de embarazos no planificados, ITS y VIH, sus beneficios y efectos adversos (recomendación débil, a favor). Usar hojas impresas para reforzar la información (recomendación fuerte, a favor)
• Facilitar una elección informada, indicar métodos y garantizar el seguimiento y la accesibilidad para consultar las posibles dudas (recomendación fuerte, a favor)
• Si la opción es AHC se recomienda la prescripción de etinilestradiol a la dosis más baja posible y LNG (recomendación fuerte, a favor)
• Informar acerca de la posibilidad de anticoncepción de urgencia ante una relación sin protección o un fallo del método anticonceptivo, y aconsejar a la hora de elegir si fuese necesario. No se precisa prescripción médica para la anticoncepción de urgencia vía oral. La PAU-LNG y la PAU-ulipristal son métodos anticonceptivos seguros y eficaces (recomendación fuerte, a favor)
• Ofrecer anticonceptivos reversibles de larga duración (DIU e implantes subcutáneos) en atención primaria para aumentar su uso (recomendación débil, a favor)
• Si el profesional tuviera problemas para resolver la demanda de anticoncepción debe facilitar la atención por parte de otro profesional (recomendación débil, a favor)
• Ofrecer la mayoría de anticonceptivos reversibles por médicos de familia a través de consulta a demanda y sin demora para aumentar su uso (recomendación débil, a favor)
DIU: dispositivo intrauterino; ITS: infecciones de transmisión sexual; LNG: levonorgestrel; PAU: píldora anticonceptiva de urgencia; VIH: virus de la inmunodeficiencia humana.
Actividades preventivas en la menopausiaLa desmedicalización del discurso sobre la menopausia y la posmenopausia es un debate de largo tiempo de recorrido. Ya en 2005, los Institutos Nacionales de Salud estadounidenses identificaron la necesidad de desarrollar y difundir información enfatizando que la menopausia es una fase normal y saludable de la vida de la mujer50. A pesar de los esfuerzos realizados por diferentes actores, este debate sigue estando vigente. El editorial monográfico sobre menopausia de The Lancet de 2024 afirma que las mujeres necesitan información imparcial de profesionales independientes, no de quienes comercializan productos para el tratamiento de la menopausia, ni de los que se benefician de su medicalización por diferentes motivos51. La experiencia de esta fase de la vida varía enormemente de una mujer a otra. Muchas la atraviesan sin problemas, mientras que otras experimentan síntomas prolongados o graves y necesitan información, apoyo o tratamiento médico51.
Síntomas asociados al descenso de estrógenosLos síntomas más comúnmente asociados a la menopausia y la posmenopausia son los vasomotores (como sofocos y sudores nocturnos) y los relacionados con la atrofia vaginal (sequedad, irritación o dispareunia)52.
El tratamiento de los síntomas vasomotores mediante terapia hormonal sustitutiva (THS) se ha mostrado eficaz, tanto con estrógenos (con o sin progestágenos)53,54 como con tibolona55. Así, los estrógenos en monoterapia o combinados son el tratamiento de primera línea de estos síntomas. En mujeres con útero, los estrógenos se deben asociar siempre con progesterona para evitar la aparición de cáncer de endometrio56. La THS se ha mostrado igualmente efectiva para la reducción de los síntomas vasomotores en su presentación oral y transdérmica57.
Recientemente, se ha comercializado un antagonista del receptor de neuroquinina 3, el fezolinetant, para el tratamiento de los síntomas vasomotores. La dosis de 45mg al día disminuye los episodios y la severidad de dichos síntomas, siendo la mejoría modesta y clínicamente irrelevante y teniendo una eficacia claramente menor que la THS58. Entre sus efectos secundarios se incluyen el fallo renal y hepático, así como el incremento de cánceres59.
En mujeres posmenopáusicas con síntomas vasomotores que, por su intensidad o frecuencia, repercutan en la calidad de vida de la mujer, se recomienda ofrecer el tratamiento hormonal con estrógenos/gestágenos a la mínima dosis eficaz y durante el menor tiempo posible (no superior a 5 años). En mujeres posmenopáusicas histerectomizadas el tratamiento se realizará tan solo con estrógenos (recomendación fuerte, a favor)
Valores y preferencias: el grupo de trabajo ha asignado una importancia alta a la mejora en la calidad de vida y baja a los potenciales efectos adversos poco frecuentes, cuando los síntomas son suficientemente importantes
Los efectos secundarios de la terapia hormonal se ilustran en la tabla 18. Dichos efectos desaparecen a los años de interrumpir el tratamiento.
Efectos de la terapia hormonal
| Número de eventos a lo largo de un año en 10.000 mujeres mayores de 50 años | Efecto producido en 10.000 mujeres por la toma de estrógenos y progesterona, durante un año | Efecto producido en 10.000 mujeres por la toma de estrógenos sólos, durante un año | |
|---|---|---|---|
| Cáncer de mama | 30 | 8 más | 3-4 más |
| Ictus | 21 | 8 más | 12 más |
| Tromboembolismo pulmonar | 8 | 8 más | 7 más |
| Demencia/Alzheimer en mujeres >65 años | 22 | 23 más | No cambios |
| Cáncer colorrectal | 16 | 6 menos | No cambios |
| Fracturas de cadera | 15 | 5 menos | 6 menos |
El efecto de la THS sobre el riesgo cardiovascular en mujeres menopáusicas es un tema que ha despertado controversias. En un análisis de subgrupos del Women's Health Initiative se concluyó que el tratamiento con THS en los 10 años posteriores a la menopausia podría disminuir el riesgo coronario60. Una revisión Cochrane del 2015 encontró diferencias en esta relación en función del momento de inicio del tratamiento, lo que se conoce como «hipótesis del tiempo». En general, la THS no mostró ningún efecto beneficioso en la prevención del riesgo cardiovascular, aumentando ligeramente el riesgo de ictus. La THS iniciada en los 10 primeros años de la menopausia produce un efecto beneficioso de pequeña magnitud en el riesgo coronario sin aumentar el riesgo de ictus, pero incrementando el riesgo de trombosis venosa profunda61. Estos resultados concuerdan con los de una revisión sistemática con metaanálisis posterior, en la que se concluyó que el efecto sobre el riesgo cardiovascular depende del momento de inicio de la THS, procediendo los resultados beneficiosos de estudios de tipo observacional62. Este grupo de trabajo considera que no se deben desestimar los efectos secundarios cardiovasculares de la THS a la hora de recomendarla, dado que sus potenciales beneficios en este ámbito son de pequeña magnitud, solo se dan en un grupo concreto de mujeres y la evidencia sobre los mismos proviene únicamente de estudios observacionales. El tratamiento transdérmico con estrógenos en monoterapia o combinados supone menor riesgo trombótico que la vía oral63.
Tradicionalmente se consideraba que el tratamiento con estrógenos en monoterapia no aumentaba el riesgo de cáncer de mama, aspecto que ha sido revisado por grandes estudios observacionales y metaanálisis. En dichos estudios se concluye que todos los tipos de terapia hormonal sustitutiva sistémica incrementan el riesgo de cáncer de mama, siendo mayor el de las presentaciones combinadas de estrógenos con progestágenos64.
En relación con la influencia de la terapia hormonal y el deterioro cognitivo, una revisión sistemática que analizó este aspecto, a partir del análisis de 34 ensayos clínicos, muestra resultados no concluyentes, con efectos dependientes del tiempo sobre ciertos aspectos de la cognición, con variaciones basadas en la formulación y el momento de inicio65.
El tabaquismo y la obesidad incrementan la incidencia de síntomas vasomotores en el climaterio66. Un ensayo clínico aleatorizado mostró alivio de los sofocos con intervenciones dirigidas a la pérdida de peso en mujeres con sobrepeso u obesidad, aunque esta asociación no era significativa en un modelo estadístico ajustado por distintos factores de confusión67. El ejercicio físico no ha mostrado efectos significativos en la reducción de estos síntomas, siendo la evidencia disponible sobre este tema de baja calidad68.
Los antidepresivos inhibidores selectivos de la recaptación de serotonina (ISRS) y los inhibidores de la recaptación de serotonina y noradrenalina (IRSN) reducen los sofocos, aunque con escasa relevancia clínica, siendo paroxetina, citalopram, escitalopram, venlafaxina y desvenlafaxina sobre los que hay mejores evidencias69. Dado que la paroxetina, por su interacción con el citocromo CYP2D6, disminuye la conversión del tamoxifeno a su metabolito activo, en caso de tratamiento con tamoxifeno, se aconseja el uso de venlafaxina y la desvenlafaxina70. La sertralina y fluoxetina son menos eficaces e interaccionan también con el tamoxifeno, por lo que se prefiere el uso de otros ISRS/IRSN. La pregabalina y la gabapentina también han mostrado cierta eficacia71. La guía NICE aconseja únicamente los ISRS/IRSN y la clonidina como terapia de segunda línea en síntomas vasomotores72.
No existe evidencia concluyente sobre si los fitoestrógenos reducen la frecuencia o severidad de los síntomas vasomotores en la menopausia o perimenopausia54. Existe alguna evidencia, en estudios de baja calidad, de que los extractos naturales o sintéticos de soja, concentrados de genisteína o suplementos dietéticos de soja, disminuyen los síntomas vasomotores frente a placebo, por lo que podrían ser una opción de segunda línea en el tratamiento de los mismos56.
En mujeres perimenopáusicas y posmenopáusicas con síntomas vasomotores que por su intensidad o frecuencia repercutan en su calidad de vida y en las que esté contraindicado el tratamiento hormonal, se sugiere valorar el tratamiento con ISRS/IRSN o fitoestrógenos (extractos o suplementos dietéticos de soja o concentrados de genisteína) (recomendación débil, a favor)
Existe evidencia de baja calidad de que los síntomas secundarios a la sequedad vaginal mejoran mediante el tratamiento con estrógenos vaginales, sin los riesgos de la terapia sistémica y sin necesidad de suplementos de progesterona73. La guía NICE sobre menopausia, actualizada en 2019, recomienda «ofrecer estrógenos vaginales a las mujeres con atrofia urogenital y continuar el tratamiento durante el tiempo necesario para aliviar los síntomas»72.
No existe evidencia concluyente sobre la relación de los síntomas urinarios con la menopausia74. Existe evidencia de que la incontinencia urinaria no mejora (o incluso puede empeorar) con la THS en monoterapia o combinada, tanto por vía oral como transdérmica75. La eficacia de la THS en la disminución de la incidencia de infecciones urinarias es un tema controvertido, aunque sí hay estudios en los que se muestra eficaz76. Un metaanálisis y una revisión sistemática recientes concluyen que el tratamiento local con estrógenos reduce la recurrencia de infecciones urinarias75,77. También hay evidencia de su eficacia para reducir síntomas como la disuria, frecuencia urinaria e incontinencia urinaria de esfuerzo y de urgencia75.
De igual modo que con los síntomas urinarios, no existen datos concluyentes para asociar la menopausia con las alteraciones del estado del ánimo78, por lo que no se recomienda el tratamiento ni la prevención de los mismos con THS79. En una reciente revisión de estudios prospectivos, no se evidencia que la menopausia sea un factor de riesgo de depresión, trastorno bipolar o psicosis, más allá de la posible repercusión en el equilibrio mental de la mujer en caso de síntomas asociados a la menopausia severos y de larga duración78. De los 12 estudios que analizan esta relación entre menopausia y depresión, solamente 2 la encuentran. En algunos estudios lo que se evidencia es la recurrencia de los síntomas de la menopausia en personas diagnosticadas previamente de depresión o ansiedad78.
Cribado de osteoporosisLa osteoporosis se define como un trastorno caracterizado por una densidad mineral ósea (DMO) baja y un deterioro de la microarquitectura del hueso. En 1994 la OMS estableció criterios de DMO para clasificarla: se considera osteoporosis una DMO menor de -2,5 desviaciones estándar (DE) respecto a la media de las mediciones de DMO en población joven entre 20 y 30 años (T-score); y osteopenia cifras de DMO entre <-1 DE y >-2,5 DE. Dichos criterios servían para clasificar y no para diagnosticar o tratar.
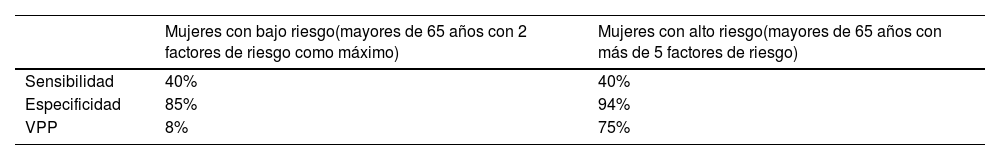
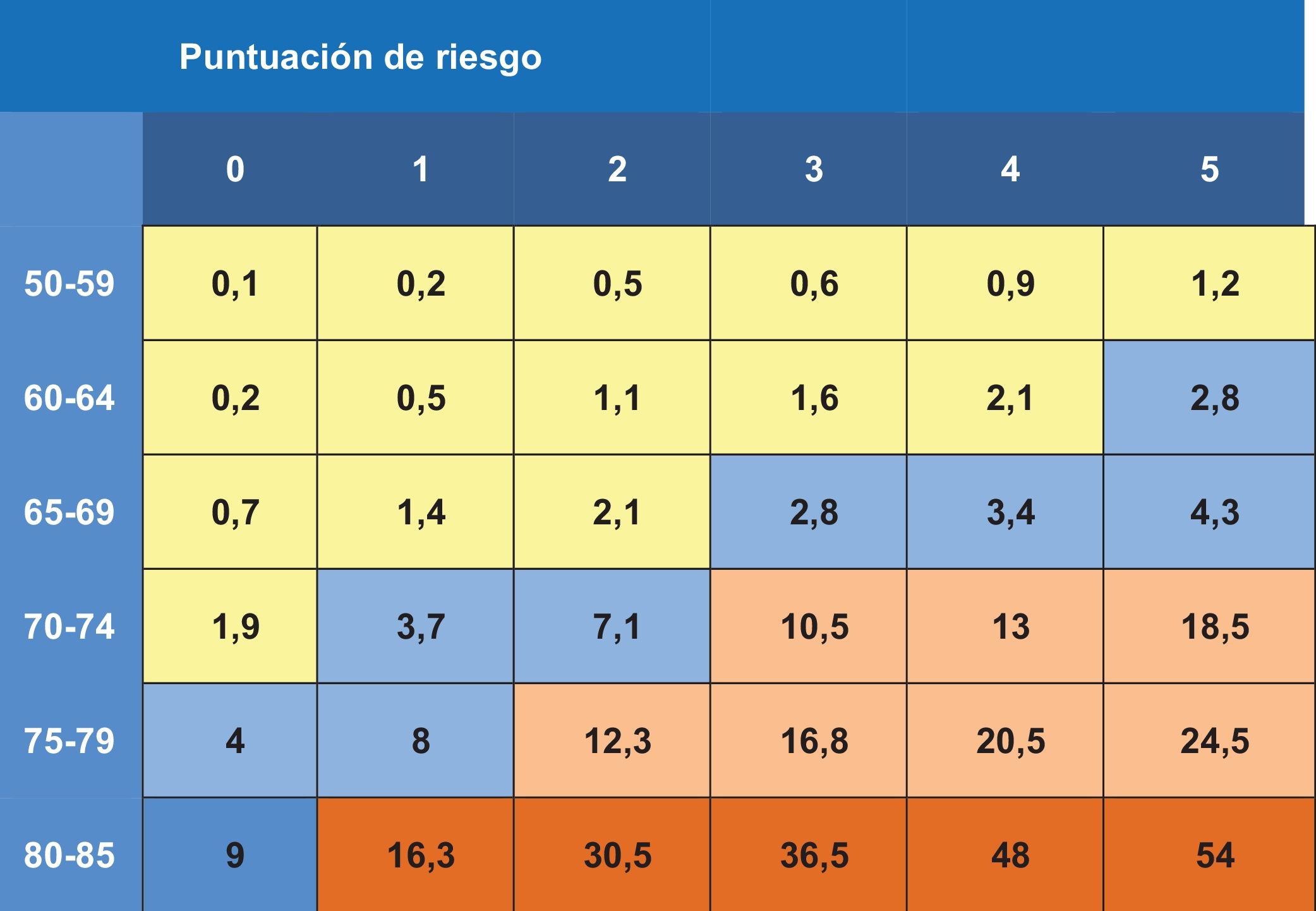
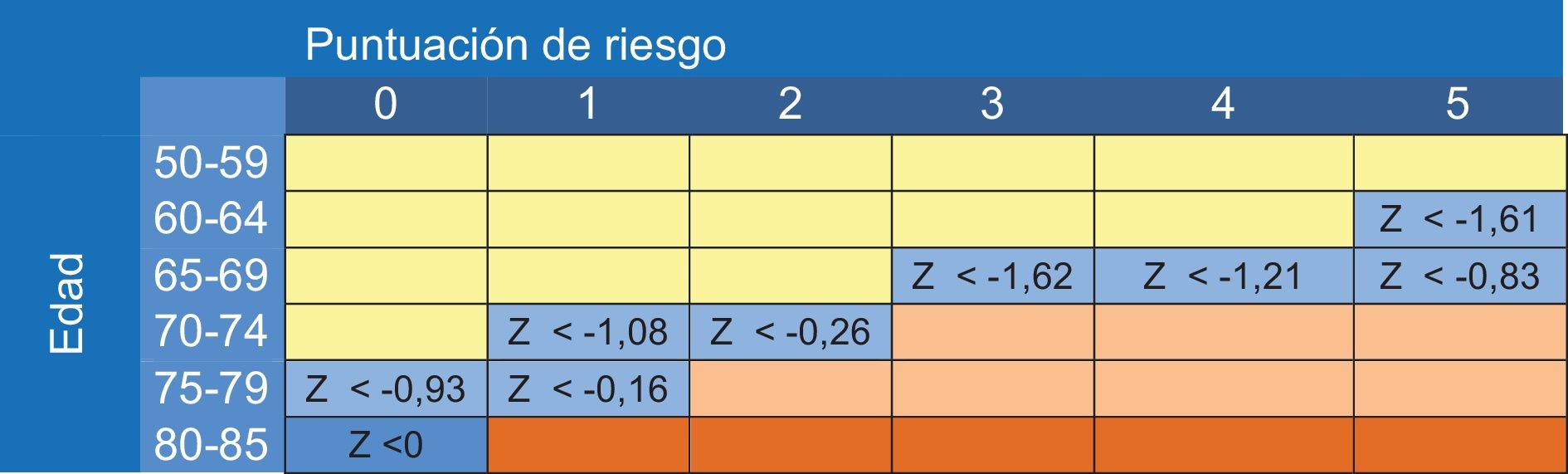
La DMO tiene un escaso valor predictivo positivo de fracturas cuando se aplica a poblaciones de bajo riesgo (tabla 19)80. Los estudios ponen de manifiesto que aproximadamente la mitad de las fracturas de cadera y de las fracturas no vertebrales se producen en mujeres sin osteoporosis densitométrica81, lo que arroja un porcentaje importante de falsos negativos: personas con DMO normal y susceptibles de fracturarse. Asimismo, la importancia de la DMO depende de la edad82: una T-score de -3 a los 50 años supone un riesgo de fractura en 10 años menor del 5%, mientras que a los 80 años supone un riesgo del 20%. El aumento de la edad es 7 veces más importante que el descenso densitométrico83. El escaso valor predictivo positivo de la DMO cuando se aplica a poblaciones de bajo riesgo, sumado a su baja sensibilidad (40%), la hace inapropiada como prueba de cribado.
Estimaciones de sensibilidad y especificidad y valor predictivo positivo (VPP) de la densitometría para predecir futuras fracturas en 10 años
| Mujeres con bajo riesgo(mayores de 65 años con 2 factores de riesgo como máximo) | Mujeres con alto riesgo(mayores de 65 años con más de 5 factores de riesgo) | |
|---|---|---|
| Sensibilidad | 40% | 40% |
| Especificidad | 85% | 94% |
| VPP | 8% | 75% |
Fuente: Bone density measurement--a systematic review80.
Por otra parte, conviene resaltar la falta de evidencia de la efectividad de los cribados. Tres estudios la valoraron: el ensayo clínico ROSE, que incluyó a 34.229 mujeres entre 65 y 80 años con un 10,6% de prevención secundaria (mujeres con fracturas previas), sin encontrar diferencias relevantes entre la población cribada y la que no, ni en la prevención de fracturas totales ni de fracturas de cadera84; el estudio SCOOP, que incluyó a 12.483 mujeres entre 70 y 85 años (22% se trataba de prevención secundaria), reduciendo el riesgo de fracturas de cadera, aunque no el de fracturas vertebrales85; y el estudio SOS, que incluyó a 11.032 mujeres entre 65 y 90 años (44% en prevención secundaria), sin presentar beneficio en número de fracturas86. Esta heterogeneidad en los resultados se suma a las limitaciones de estos estudios en términos de validez externa: todos ellos incorporan un porcentaje nada desdeñable, entre 11-44%, de participantes con antecedentes de fracturas (prevención secundaria), por lo que sus resultados tienen limitaciones para aplicarse al escenario del cribado (prevención primaria).
Un metaanálisis de los 3 estudios concluye que el cribado podría reducir el número de fracturas osteoporóticas mayores (HR=0,91; IC95%=0,84-0,98) y fracturas de cadera (HR=0,80; IC95%=0,71-0,91), pero no muestra una reducción de la mortalidad. Estos resultados son muy dependientes del estudio SCOOP. El número necesario de población cribada para evitar una fractura es de 247 para cualquier fractura mayor y 272 para fracturas de cadera87. Para valorar estos resultados, conviene tener en cuenta la heterogeneidad de los estudios en cuanto a sus poblaciones (porcentaje de mujeres con fracturas), que se traduce en una limitación de la validez externa de los mismos, como se ha expuesto con anterioridad.
Por todo ello, la estrategia de cribado densitométrico en mujeres debe basarse en la valoración del riesgo absoluto de fractura en los próximos 10 años, siendo importante que los modelos empleados no exijan para su cálculo el valor de la DMO.
Recomendaciones del PAPPSLa indicación de cribado con densitometría se hará en función del riesgo absoluto de fractura. Para este cálculo, es común recomendar la utilización de las tablas de predicción de riesgo de fracturas de la OMS (FRAX: http://www.shef.ac.uk/FRAX/faq.htm). Sin embargo, existen estudios que cuestionan su utilidad en la población española, por su escaso VPP y por haber sido diseñadas con poca representación de la cohorte de este país (tan solo 300 pacientes)88. El PAPPS considera que el uso del modelo FRAX para calcular el riesgo de fractura potenciaría el sobrediagnóstico y el sobretratamiento, por lo que no recomienda su uso en nuestro entorno. En su lugar, se propone el uso del modelo elaborado por la Dirección General de Farmacia de la Comunidad de Madrid (DGFCM) en su actualización del año 201589. Dicho modelo diseñó una tabla para la predicción del riesgo de fractura empleando datos reales de una cohorte española, lo que lo hace más aplicable a nuestro entorno. Asimismo, tiene la ventaja de proponer umbrales de intervención (o, lo que es lo mismo, niveles de riesgo de fractura a partir de los que se recomienda tratar) basados exclusivamente en el riesgo de fractura de cadera, porque los datos de este tipo de fractura son los más fiables y por tratarse del evento relacionado con la osteoporosis que causa mayor morbimortalidad89.
El modelo de la DGFCM propone tomar decisiones de intervención (diagnósticas y terapéuticas), basándonos en el riesgo de fractura a los 10 años calculado mediante una tabla de predicción que considera una puntuación individual del riesgo y la edad. Para su uso, primero se debe calcular la puntuación individual de riesgo adjudicando una calificación numérica a distintos factores (tabla 20). En resumen, se valorará con 1 punto a los factores con riesgo relativo (RR) cercanos a 2: IMC menor de 19, fractura después de 50 años y fractura de cadera en madre, padre o hermano/a; y con 2 puntos a los factores de riesgo con RR cercano a 4: deformidad vertebral morfométrica (considerando esta como una disminución del 20% de la altura del cuerpo vertebral) (tabla 20). La puntuación oscila entre 0 y 5 y debe trasladarse a la tabla de riesgo de fractura de cadera en los próximos 10 años (tabla 21), que realizará una predicción del riesgo considerando también la edad89.
Factores a considerar para el cálculo de la puntuación de riesgo
| Factores de riesgo | Puntuación |
|---|---|
| Índice de masa corporal menor de 19 | 1 |
| Fractura después de 50 años | 1 |
| Fractura de cadera en madre, padre o hermana | 1 |
| Deformidad vertebral morfométrica (disminución del 20% de la altura del cuerpo vertebral)a | 2 |
Se recomienda hacer radiografía a mujeres mayores de 60 años cuando exista pérdida de estatura significativa (4cm) y/o hipercifosis. Los factores asociados a los estilos de vida (tabaco, alcohol, baja ingesta de calcio, ejercicio) han mostrado menor consistencia.
Fuente: Revilla Abad et al.89.
Tabla de riesgo de fractura de cadera en los próximos 10 años, en función de la edad y de la puntuación individual de riesgo
Celdas amarillas: No se recomienda hacer densitometría, ya que ningún valor de Z-score incrementa el riesgo de fractura de cadera a 10 años por encima del 10%.
Celdas naranjas: No se recomienda hacer densitometría porque por edad y factores clínicos ya tienen un riesgo superior al 10%. En mujeres mayores de 80 años debe individualizarse la decisión de iniciar tratamiento farmacológico, teniendo en cuenta la falta de evidencia en este grupo de edad y su situación de polimedicación y pluripatología. Valorar esperanza de vida, riesgo de caídas y el establecimiento de medidas para reducir dicho riesgo.
Inclusión del resultado de la densitometría en la valoración del riesgo.
- En la tabla 22 se especifica el valor de la Z-score por debajo del cual la mujer presenta un riesgo individual de fractura de cadera ≥10% en los próximos 10 años, en las cuales podría considerarse el tratamiento farmacológico de acuerdo con la paciente tras conocer el balance riesgo-beneficio.
Fuente: Revilla Abad et al.89.
El tratamiento farmacológico se debe considerar con un riesgo estimado de fractura a los 10 años ≥10%, estableciéndose este umbral por ser el empleado por los ensayos clínicos disponibles. En mujeres con un riesgo de fractura <10%, pero superior al 2,8% (celdas azules de la tabla 21), se recomienda hacer cribado densitométrico. El resultado de la densitometría (aplicando la Z-score de cuello femoral) debe contrastarse con la tabla 22. En dicha tabla se especifica el valor de la Z-score por debajo del cual la mujer presenta un riesgo individual de fractura de cadera mayor de un 10% en los próximos 10 años. Consecuentemente, a lo expuesto con anterioridad, si la mujer tuviera un valor de Z-score menor que el indicado en la tabla, se debería valorar la indicación de tratamiento89. La utilización de la Z-score (comparación con las mujeres de su edad) en lugar de la T-score (mujeres entre 20 y 30 años) supone una aproximación más adecuada con un menor impacto en sobrediagnósticos y sobretratamientos.
Valor de la Z-score por debajo del cual la mujer presenta un riesgo personal de fractura de cadera mayor de un 10% en los próximos 10 años
Fuente: Revilla Abad et al.89.
En mujeres menores de 60 años, se sugiere no realizar el cribado con densitometría (recomendación débil, en contra)
En mujeres mayores de 60 años con un riesgo de fractura de cadera mayor del 3% en los próximos 10 años, se sugiere hacer el cribado con densitometría (DEXA) (recomendación débil, a favor) y se recomienda no realizarlo con ultrasonidos (recomendación fuerte, en contra)
Por su parte, la radiografía está indicada en mujeres ≥60 años cuando exista pérdida de estatura significativa (4cm) y/o hipercifosis89. El cribado radiológico tampoco se recomienda. Los ultrasonidos presentan baja sensibilidad y debido a la falta de datos sobre su eficacia diagnóstica y terapéutica no se aconseja como método de cribado90.
Respecto a la eficacia del tratamiento con bifosfonatos, una revisión sistemática en red muestra que estos reducen el riesgo de fractura de cadera, vertebrales clínicas y radiográficas, y otras fracturas clínicas en mujeres posmenopáusicas con osteoporosis91. La seguridad de los bifosfonatos es un tema de vital importancia. Es conocido que pueden incrementar las fracturas de estrés atípicas y la osteonecrosis de mandíbula91, lo que ha llevado a recomendar que su uso no se prolongue más de 5 años. Los resultados de la discontinuación del tratamiento tras 3-5 años de tratamiento con bifosfonatos es dispar, aunque sí parece haber un ligero incremento de las fracturas vertebrales, siendo los factores de riesgo una T-score menor de -2,5 DE en cuello femoral y la presencia de fracturas vertebrales incidentales92.
En el caso de los anticuerpos monoclonales, denosumab presenta idénticos riesgos en términos de seguridad que los bifosfonatos, añadiendo que tras su supresión se puede producir un efecto rebote con incremento de fracturas vertebrales, a veces múltiples. En un análisis post-hoc del estudio FREEDOM, el 15% de las mujeres descontinuaron el tratamiento con denosumab, con el consiguiente aumento de fracturas, siendo en dos tercios de los casos fracturas múltiples93. El incremento del riesgo de fracturas vertebrales tras el primer año desde la interrupción de denosumab aumenta considerablemente en el segundo año y es mucho mayor que el observado en los bifosfonatos94. Por ello, su indicación como inicio de tratamiento es dudosa (sobre todo en mujeres con esperanza de vida larga), dado que su retirada presenta riesgos que no son suficientemente resueltos con el «sellado» con bifosfonatos tras su supresión, toda vez que expone a las mujeres durante muchos años a la toma de fármacos que pueden producir efectos deletéreos incluso en el hueso (fracturas atípicas y osteonecrosis mandibular).
Otro anticuerpo monoclonal recomendado por algunas sociedades científicas en mujeres de muy alto riesgo es el romosozumab. Inicialmente, produce aumento de los marcadores de remodelado óseo, seguido a los pocos meses de inhibición de los mismos. Se utiliza solo durante un año seguido de bisfosfonato en mujeres con riesgo muy elevado de fractura. En el estudio FRAME y en el estudio ARCH, este fármaco demostró una disminución de fracturas vertebrales95,96, produciendo un aumento de eventos cardiovasculares graves (infartos de miocardio y accidente cerebrovascular graves), de acuerdo con resultados del estudio ARCH96. Así, su relación riesgo-beneficio no es favorable, lo que no hace recomendable su uso.
Otro fármaco empleado para el tratamiento de la osteoporosis es la teriparatida, que se ha estudiado en un ensayo clínico aleatorizado controlado frente a risedrónico en mujeres con fracturas vertebrales (al menos dos moderadas o una grave)97. En dicho estudio, el 65% de las participantes tenían más de una fractura vertebral (el 40% tres o más) y el 90% de las fracturas eran severas. La teriparatida mostró superioridad sobre el risedrónico en la incidencia de fracturas. Estaría indicada en fracturas vertebrales múltiples con un tiempo máximo de uso de 2 años97.
En mujeres con riesgo de fractura de cadera superior al 10% en los próximos 10 años, valorar el tratamiento farmacológico. En mujeres con riesgo de fractura de cadera superior al 3% y valores de Z-score que incrementen el riesgo hasta el 10% se aconseja valorar indicación de tratamiento farmacológico (tabla 22). Los bifosfonatos son los tratamientos de primera elección durante un tiempo estimado, en general, no mayor de 5 años (recomendación débil, a favor)
No existen datos sobre la eficacia del tratamiento farmacológico en mujeres con osteopenia98, salvo con la administración IV de ácido zoledrónico cada 18 meses en un ensayo clínico en el que se demostraba reducción de fracturas en mujeres de muy alto riesgo y con criterios de clasificación de osteopenia no muy claros99.
Recomendaciones de otras organizacionesLa United States Preventive Services Task Force (USPSTF) en su actualización del año 2018 recomienda el cribado densitométrico en mujeres por encima de 65 años, y en más jóvenes con riesgo de fracturas análogo al de las mujeres de 65 años (grado de evidencia B), según las tablas FRAX (en torno al 8,4% en los próximos 10 años). En España, en población general, este riesgo se obtiene a partir de los 75 años100. Esta recomendación también es apoyada por la Sociedad Norteamericana de Menopausia (NAMS), que en su guía de 2021 recomienda el cribado densitométrico de mujeres mayores de 65 años y en mujeres mayores de 50 años con otros factores de riesgo, con una periodicidad de cada 3 años101. La Canadian Task Force (CTF) se muestra favorable al cribado en mujeres a partir de los 65 años, no recomendando el cribado en hombres102.
La guía de NICE (National Institute of Clinical Excellence) preconiza la evaluación sistemática del riesgo de fractura con la herramienta FRAX o con el Q-Fracture, a partir de los 65 años, y a partir de los 50 si existen factores de riesgo103. La guía no contempla de manera clara los umbrales de tratamiento o de indicación de densitometría103. SIGN establece el cribado densitométrico en mujeres por encima de 65 años con una valoración de riesgo de fracturas mayor del 10% en los próximos 10 años según la escala Q-Fracture. En mujeres con ese riesgo el tratamiento farmacológico se indicaría siempre y cuando presentaran osteoporosis densitométrica. En mujeres con osteopenia se indicará el tratamiento a partir de los 65 años104. Las guías europeas establecen diferentes umbrales para tratar, no tratar o indicar densitometría, utilizando las tablas FRAX, estableciendo niveles de riesgo por tramos etarios cada 5 años. Entre los 50 y 54 años la densitometría se indica si el riesgo de fractura es superior al 6,3% en 10 años, superior al 9,9% entre 60 y 64 años, superior al 17,6% entre 70 y 74 años, y superior al 29,1% entre 80 y 84 años105.
Aunque ninguna sociedad científica propone el cribado poblacional a partir de la menopausia, la National Osteoporosis Foundation (NOF) sí preconiza un cribado de facto, al justificar la realización de densitometría a toda mujer mayor de 50 años con factores de riesgo de fracturas muy prevalentes (baja ingesta de calcio, baja actividad física, etc.), o preocupación por su «salud ósea» (signifique lo que signifique esa aseveración), y cribado poblacional en toda mujer mayor de 65 años y de hombres por encima de 70 años106. Independientemente de la edad y de los factores de riesgo, apuesta por el tratamiento a todo paciente con DMO <-2,5 DE de T-score; considerando la disminución de la DMO como una enfermedad, y no como un factor de riesgo. Si hay un riesgo mayor del 20% de fracturas totales o del 3% de fracturas de cadera en los próximos 10 años, el tratamiento lo aconsejan si la DMO está en rango de osteopenia (<-1 DE y >-2,5 DE). Aplicando las recomendaciones de la NOF, tres cuartas partes de las mujeres americanas de más de 65 años requerirían tratamiento farmacológico107.
Promoción de estilos de vidaAunque los estilos de vida repercuten en la aparición de la osteoporosis, estos suponen un RR menor de 2, como se ha indicado anteriormente, de insuficiente entidad como para considerarlo individualmente un factor de riesgo importante. Se aconseja, por tanto, promocionar la abstención tabáquica y el consumo moderado de alcohol por su importancia en la salud global de la población, amén de por su repercusión en la osteoporosis (consumir más de 3,5 unidades al día supone un RR de fracturas de 1,39 [IC 95% 1,08-1,79])108. En relación con la dieta existe cierta polémica. Los principales 4 metaanálisis sobre dieta y fracturas concluyen que una dieta rica en calcio no tiene efecto en el riesgo de fracturas109.
La eficacia de los suplementos de calcio y vitamina D en la reducción de fracturas es un tema controvertido. Existen ensayos clínicos y revisiones sistemáticas que muestran la eficacia de la vitamina D, del calcio, con o sin vitamina D, de la administración conjunta de calcio y vitamina D, aunque la mayoría no encuentran resultados favorables110–113.
La USPSTF se muestra en contra de la administración de suplementos en la prevención de caídas y fracturas114, acorde con los resultados de los últimos metaanálisis, salvo en población institucionalizada. La USPSTF se muestra en contra, no solo de la suplementación con vitamina D en población sana, sino también de su cribado115.
Acorde con estas evidencias, un reciente ensayo clínico indica que los suplementos de vitamina D no reducen el riesgo de fractura, incluso en las personas con niveles bajos de vitamina D116. Se trata de un ensayo clínico aleatorizado en el que se suministra al grupo de intervención 2000UI de vitamina D al día. El principal objetivo del estudio consistía en ver su repercusión en la incidencia de fracturas. La media de edad de los participantes era de 57 años, 51% de mujeres y 20% de raza negra. El 25% tenía niveles de vitamina D por debajo de 24ng/ml y el 1,5% tenía un valor por debajo de 12ng. La diferencia en la incidencia de fracturas no se evidenció ni en los pacientes con niveles de vitamina D por debajo de 24ng/ml (hazard ratio [HR] 1,04; IC95% 0,80-1,36) ni en los de menos de 12ng/ml (HR 1,03; 0,36-2,95)116.
En relación con las caídas, una de cada 3 personas mayores de 65 años se caen anualmente (y en mayores de 80 años lo hacen el 60% de los ancianos). El 10-15% de las caídas producen fracturas y lesiones en la cabeza y el 95% de las fracturas de cadera están producidas por caídas. El 30% de ellas mueren en el siguiente año y un 50% pierden movilidad y autonomía. Por ello es importante, en población mayor de 65 años, minimizar la prescripción de medicación psicotrópica, promover el ejercicio que desarrolle la fortaleza y el equilibrio, corrección de defectos visuales y evitar barreras en la deambulación117.
En población general se aconseja evitar el sedentarismo y el tabaquismo, tomar el sol al menos 10 minutos al día con una zona de exposición de al menos la cara y las manos, tomar una dieta rica en calcio y vitamina D y realizar ejercicio (recomendación débil, a favor)
Los suplementos de calcio y vitamina D tan solo se aconsejan en mujeres institucionalizadas. Valorar su indicación en mayores de 70 años con déficits nutricionales importantes, ingesta de calcio inferior a 500mg/día y escasa exposición solar (recomendación débil, a favor)
En población general, no se aconseja cribado de determinación de niveles de 25-OH-vitamina D (recomendación fuerte, en contra)
Las personas que han redactado este capítulo carecen de conflictos de intereses con la industria farmacéutica. Algunas de ellas han participado en seminarios organizados por Consejerías de Sanidad de las comunidades autónomas correspondientes.