Introducción
Aunque constantemente se comercializan nuevos principios activos, se considera que sólo una pequeña proporción de las novedades terapéuticas aporta ventajas significativas en relación con las opciones de tratamiento farmacológico ya disponibles1. Esto se debe a que gran parte corresponde a los fármacos denominados me-too o «yo también»2,3, que suelen ser modificaciones de principios activos ya disponibles, con diferencias farmacocinéticas o en la vía de administración2.
El concepto de innovación o avance terapéutico debe ser entendido en realidad como un nuevo tratamiento que ofrece beneficios para los pacientes al aportar ventajas sustanciales sobre los fármacos ya comercializados o llenar un espacio en la terapéutica no ocupado previamente por otros principios activos2.
En los últimos años ha quedado bastante bien establecido que los nuevos principios activos no deberían compararse con placebo, sino con las alternativas ya disponibles, y no se debería justificar su eficacia a través de resultados intermedios4. La seguridad, la experiencia de uso y el coste son, asimismo, conceptos imprescindibles hoy día al valorar un nuevo principio activo1. El caso de la cerivastatina ilustra a la perfección que no podemos dejar de lado estas reflexiones y autorizar un nuevo medicamento sólo porque disminuya de manera más o menos notoria el colesterol4. Recientemente, la retirada del mercado del rofecoxib ha ahondado en el tema de la seguridad y la experiencia de uso.
Aunque en algunos trabajos previos se ha evaluado la comercialización de nuevos principios activos5,6 en años aislados, en el momento actual no disponemos de una visión a largo plazo de este fenómeno, especialmente si lo referimos al concepto de avance terapéutico1. Tampoco conocemos con exactitud si en los últimos años se han producido cambios en la proporción de nuevos principios activos que suponen verdaderos avances terapéuticos, la distribución por grupos farmacológicos de los nuevos principios activos, si son utilizados por los hospitales, los especialistas o su uso es general, o si los nuevos fármacos comercializados difieren en el precio respecto a los ya disponibles.
El objetivo del presente trabajo es describir los nuevos principios activos comercializados en España durante el período 1992-2002 con el objetivo principal de determinar su grado de innovación terapéutica. Como objetivos secundarios se estudian sus características, su distribución por grupos farmacológicos, el medio en el que se autoriza su uso (hospitalario y general) y su precio.
Material y métodos
Se realizó un estudio descriptivo transversal de los nuevos principios activos comercializados en España durante el período 1992-2002, ambos años inclusive. Los datos se obtuvieron mediante revisión de las valoraciones de los nuevos principios activos publicadas en Información Terapéutica del Sistema Nacional de Salud en su versión impresa7-11 y en su versión electrónica a partir de 199712. Esta publicación también define como nuevos principios activos a los ya comercializados pero que se autorizan en una nueva indicación o por una nueva vía de administración. Los principios activos se clasificaron mediante la Anatomical Terapeutical Clinical (ATC) de la Organización Mundial de la Salud (OMS)13. Mediante un protocolo estandarizado se recogieron las siguientes variables:
1. Año de autorización.
2. Nombre del principio activo.
3. Grupo de la ATC13.
4. Clasificación como innovación terapéutica según7-12 la Food and Drug Administration (FDA), es decir, A*: novedad terapéutica excepcional; A: importante mejora terapéutica; B: modesta mejora terapéutica; C: nula o muy pequeña mejora terapéutica; D: sin calificación.
5. Ámbito de uso: a) uso o diagnóstico hospitalario, b) uso general, en cualquier medio sanitario.
6. Vía de administración: a) oral; b) parenteral; c) rectal; d) inhalatoria; e) intranasal; f) ocular; g) transdérmica, y h) tópica (excluidas las vías f y g).
7. Precio superior respecto a alternativas similares ya comercializadas (sólo en principios activos del grupo C) codificada como variable dicotómica (sí/no), basándose asimismo en las tablas comparativas de la bibliografía utilizada7-12.
8. Precio en euros por dosis diaria definida (DDD) según la ATC13. No se calculó si la dosis del fármaco se administraba exclusivamente por el peso o la superficie corporal (como en el caso de los antineoplásicos), si se trataba de productos sin DDD, como los contrastes y otros medios de diagnóstico, las vacunas y los productos tópicos, o si no estaba definida la DDD. En el caso de que se presentase bajo dos o más nombres comerciales, se calculó la media.
Análisis estadístico
Se realizó mediante el paquete estadístico SPSS, versión 11.0. Las medias se compararon con el test de la t de Student o la prueba no paramétrica correspondiente si no se cumplían las condiciones de aplicación. Las proporciones se analizaron mediante la prueba de la *2, la prueba de la *2 para la tendencia o el test exacto de Fisher si estaba indicado.
Resultados
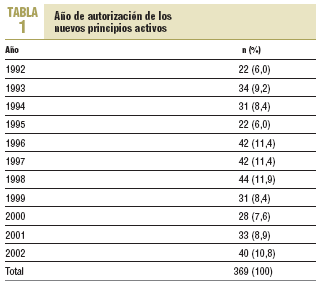
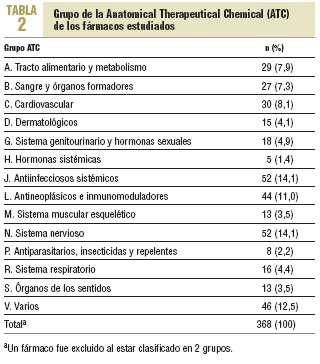
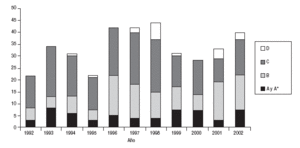
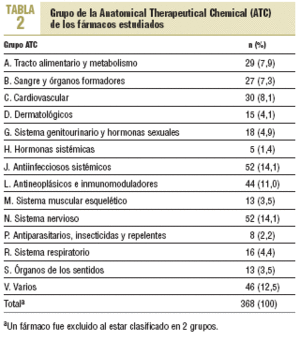
Se estudió un total de 369 nuevos principios activos. Su año de autorización aparece reflejado en la tabla 1 y en la figura 1, observándose un aumento hasta los años 1996-1998 y un descenso o estancamiento posterior. Respecto a los grupos de la ATC (tabla 2), la mayor proporción de nuevos principios activos correspondió a los grupos J (antiinfecciosos sistémicos) y N (sistema nervioso, con un 14,1%), el grupo V (varios) con un 12,5% y el grupo L (antineoplásicos e inmunomoduladores) con un 11,0%.
Figura 1. Número de nuevos principios activos comercializados en el período 1992-2002 según la innovación terapéutica.
La clasificación como innovación terapéutica con la clasificación de la FDA se detalla en la tabla 3; se observa que prácticamente la mitad de los nuevos principios activos suponía una nula o muy pequeña mejora terapéutica (49,3%) y que sólo el 15,4% incorporaba una importante o excepcional mejora.
Al estudiar la tendencia (fig. 1) en la proporción de nuevos principios activos en las categorías de la FDA estudiada en relación con el período de estudio no se observaron tendencias significativas (aumento o disminución durante el período estudiado) en los principios activos de los grupos A/A* y B. Sin embargo, se halló una tendencia significativa hacia un descenso en la proporción en el grupo C (p = 0,001) y hacia un aumento en el grupo D (p = 0,002).
Un total de 156 de los nuevos principios activos (42,3%) correspondía a fármacos de uso o diagnóstico hospitalario, frente a 213 destinados a uso general (57,7%).
Respecto a la vía de admistración (tabla 4), se observa que predominaban las vías oral (50,1%) y parenteral (35,2%).
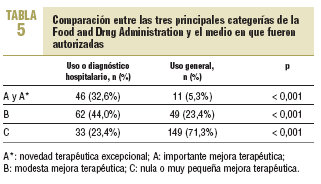
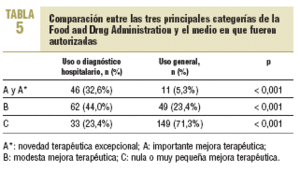
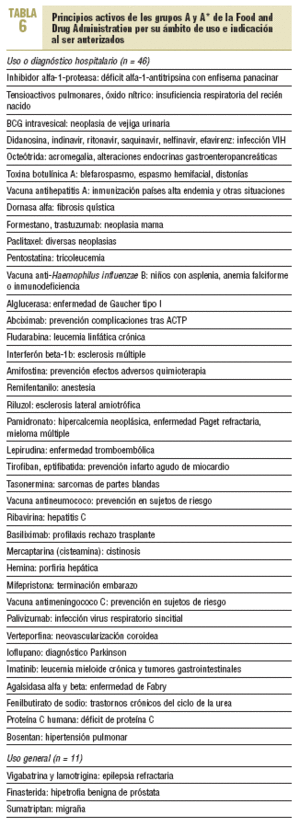
La comparación entre las tres principales categorías de la FDA (A, B y C) y el medio en que fueron autorizadas (uso hospitalario y uso general) se refleja en la tabla 5; se observan diferencias significativas (p < 0,001) en su distribución, de manera que la mayor parte de las verdaderas novedades terapéuticas corresponde a fármacos de uso y diagnóstico hospitalario. En la tabla 6 se detallan los principios activos de los grupos A/A* de la FDA por su ámbito de uso e indicación en el momento de ser autorizadas; se observa que la mayor parte de estos fármacos tiene un uso restringido a enfermedades muy específicas y al medio hospitalario.
Respecto al precio de los fármacos clasificados como con nula o muy pequeña mejora terapéutica con los criterios de la FDA (n = 182), se observó que 170 (93,4%) eran más caros que las alternativas ya disponibles.
En relación con el coste por DDD en los casos en que se pudo calcular (n = 213), el resultado fue una DDD de 17,6 e (mediana, 3,7; rango, 0,09-576,9). Estas cifras indican un coste bastante elevado y una alta variabilidad.
Al estudiar el precio en euros por DDD se observaron diferencias (p < 0,001) entre los fármacos de uso o diagnóstico hospitalario (DDD de 55,2 e) y los de uso general (DDD de 5,1 e). El coste por DDD fue de 26,1 e en los fármacos clasificados como A/A*, de 27,3 e en los clasificados como B y de 12,3 e en los clasificados como C. No se hallaron diferencias significativas al comparar las DDD de los fármacos de los grupos A/A* y B. Sin embargo, las diferencias fueron significativas (p < 0,001) al comparar el coste en DDD de los fármacos del grupo C con los de los grupos A/A* y B.
Discusión
Los resultados del presente estudio ponen de manifiesto que los verdaderos avances terapéuticos de los últimos años son sólo una pequeña parte del grueso de fármacos comercializados. De hecho, sólo el 15,4% correspondió a novedades terapéuticas excepcionales o importantes mejoras. Más de la mitad de las novedades eran fármacos con una nula o muy pequeña mejora terapéutica o sin calificación que las alternativas ya disponibles, y el 30,1% eran fármacos con una modesta mejora terapéutica. Además, la mayor parte de las verdaderas mejoras correspondió a fármacos de uso o diagnóstico hospitalario, con frecuencia restringido a enfermedades muy específicas o poco frecuentes y, por tanto, con poca repercusión en la salud general de la población. Otro aspecto relevante es que los nuevos principios activos comercializados del grupo C (nula o muy pequeña mejora terapéutica) de la FDA son prácticamente siempre más caros que sus alternativas ya comercializadas.
En cuanto a las limitaciones del presente estudio, cabe mencionar que la clasificación de la FDA empleada en las fuentes de información utilizadas7-12 ha presentado alguna pequeña modificación durante los años evaluados (1992-2002). Concretamente, a partir del año 1997 se empezó a utilizar la categoría D (sin calificación). Este hecho no afecta a los 3 grupos más importantes comparados (A, A*, B y C). Otra limitación es el hecho de que sólo se valoró como variable dicotómica si los principios activos del grupo C eran más caros que las alternativas similares ya comercializadas. En este sentido, sólo se analizaron los fármacos del grupo C (nula o muy pequeña mejora terapéutica), ya que tenía poco sentido desde un punto de vista ético analizar si una verdadera o incluso una modesta innovación terapéutica (grupos A/A* y B) era más cara que una alternativa ya disponible. Asimismo, las comparaciones del precio en DDD son a veces difíciles de interpretar debido a que se expresan en forma de medias y con frecuencia los valores están distorsionados por los valores
extremos de las variables. Por último, el estudio de las tendencias (fig. 1) de las categorías de la FDA debe interpretarse con cautela, puesto que dicha prueba estadística está muy influida por la proporción inicial que se toma como referencia (la del año 1992) y por el número de casillas (total de años estudiados, es decir 11).
Los verdaderos avances terapéuticos fueron de escasa cuantía y la mayor parte de los nuevos principios activos correspondía a fármacos me-too o «yo también»2,3. Estas cifras coinciden con las de estudios previos realizados en nuestro medio5,6 y reflejan que la mayor parte de los nuevos principios activos aporta pocas novedades terapéuticas reales. La tendencia en relación con estos grupos se ha modificado durante el período estudiado (fig. 1) en las categorías C (tendencia a la disminución) y en la categoría D (tendencia al aumento), aunque estas tendencias pueden estar sesgadas por el hecho de que en los primeros años analizados no se utilizó esta categoría y es posible que fármacos que se habrían clasificado como D se hayan incluido en la categoría C. Más importante es el hecho de que no se ha modificado la proporción en las categoría A/A*, que son los verdaderos avances terapéuticos. Llama la atención que mientras que las enfermedades cardiovasculares y las neoplasias son las principales causas de mortalidad, los nuevos principios activos destinados a estas enfermedades no son los más frecuentes. Por ejemplo, los nuevos principios activos del grupo C de la ATC (cardiovascular) ocupan el quinto lugar en número (aunque los antiagregantes están en el grupo B, el escaso número comercializado en el período de estudio no invalida esta reflexión) y los antineoplásicos ocupan el tercer lugar, pero una parte importante de estos nuevos principios activos correspondía a los fármacos inmunomoduladores, utilizados asimismo en enfermedades no neoplásicas.
Al analizar los verdaderos avances terapéuticos desde el punto de vista de la atención primaria, ámbito en el que se realiza la mayor parte de las prescripciones, el panorama es bastante más desolador, puesto que sólo el 5,3% de los nuevos principios activos correspondía a verdaderos avances (A/A*) y el 23,4% a modestas mejoras, a diferencia del medio hospitalario o especializado, en que estas proporciones fueron bastante más elevadas (32,6 y 44,0%, respectivamente). Se confirma, por tanto, que la mayor parte de los verdaderos avances corresponde a fármacos de uso hospitalario (tabla 6) y de uso en enfermedades relativamente poco frecuentes. No obstante, como aspecto positivo podemos destacar que bastantes de los verdaderos avances terapéuticos (tabla 6) corresponden a enfermedades con una baja prevalencia y, por tanto, con poco interés para la industria farmacéutica, como la enfermedad de Gaucher tipo I, las cistinosis o la enfermedad de Fabry.
En relación con el precio de los nuevos principios activos, se trata en general de fármacos de elevado coste, incluso al tener en cuenta sólo los fármacos del grupo C, mayoritariamente utilizados en atención primaria. Este fenómeno coincide con un estudio en el que se analizaban los nuevos fármacos presentados por la industria a los médicos de atención primaria14 y en el que se observó que costaban más del doble que los utilizados habitualmente por los médicos. En este sentido, el coste medio por receta se ha llegado a triplicar cada 10 años15 , como consecuencia (o al menos en parte) de que los nuevos principios activos son mucho más caros que los ya disponibles, a pesar de que con frecuencia son pequeñas modificaciones o no aportan avances relevantes.
Estas consideraciones deben realizarse en el contexto de una progresiva disminución del desarrollo de nuevos principios activos por parte de las instituciones públicas1, por lo que la preponderancia de la industria farmacéutica no ha hecho sino acentuarse los últimos años. Además, la industria farmacéutica1 crea la impresión de que es preciso un rápido desarrollo y aprobación de sus novedades para que los pacientes tengan un pronto acceso a ellas. Es frecuente que estas novedades sean presentadas antes de su comercialización a los médicos por los visitadores5 e incluso que se publiquen los resultados en la prensa no especializada o por internet antes que en las revistas médicas.
En resumen, la mayoría de los nuevos principios activos comercializados en los últimos años es escasamente innovadora y, a pesar de esto, su prescripción no cesa de aumentar5. Todo ello no hace sino contribuir al aumento del gasto sanitario de manera exponencial. La financiación selectiva y la promoción del uso de genéricos han sido poco eficaces en la contención del gasto farmacéutico, aunque es posible que la adopción de los precios de referencia haya tenido efectos positivos. No obstante, parece que el aumento del gasto depende básicamente de la implantación en el mercado de nuevos principios activos, que son mucho más caros que los ya utilizados14,16. En otros países se ha optado por limitar la financiación pública de los nuevos principios activos que no suponen auténticas innovaciones16 mediante cláusulas de economía sanitaria o estudios de coste-efectividad y, por tanto, a la eficacia y la seguridad se ha añadido el concepto de conveniencia1. Aunque en la Unión Europea se ha armonizado el mercado farmacéutico mediante el sistema de registro, todavía persisten diferencias importantes entre países en los sistemas de precios y las condiciones de financiación. Como han señalado algunos autores4, es imperiosa la necesidad de cambiar los mecanismos de autorización de la comercialización de los nuevos medicamentos. Es importante recordar que es la propia Administración la única responsable de que los fármacos del grupo C (me-too) tengan un precio que no guarda relación con lo que aportan y que, además, estén financiados con recursos públicos17. También es importante reseñar que las administraciones no han sabido hacer llegar a los profesionales y los pacientes qué principios activos suponen verdaderos avances terapéuticos, cuál es su uso correcto y su relación entre beneficio y riesgo18. El actual modelo, excepto con los precios de referencia, ha tenido grandes problemas para contener el gasto sanitario y ha tratado de paliar los progresivos aumentos pactando con la industria farmacéutica aportaciones que son una parte mínima de sus ingresos y que son muy inferiores a los descuentos que se aplican en almacenes y farmacias16.
Es preciso que el concepto de avance terapéutico1, susceptible por tanto de ser autorizado y financiado, esté avalado por la eficacia (considerada preferentemente en términos de mortalidad y morbilidad), la seguridad y la conveniencia de ser comercializado, con el objeto de no introducir en el mercado nuevos fármacos que no aportan nada o aportan ventajas de escaso interés y que sólo contribuyen a disparar el gasto farmacéutico.
Agradecimientos
A la Dra. E. Barceló y al Dr. E. Diogene por sus comentarios al manuscrito.