Sr. Director: La autorización y la comercialización de los análogos de insulina de acción rápida abrieron esperanzas de mejorar el control de la diabetes. Las cualidades de los 2 análogos comercializados actualmente (aspart y lispro) han sido ampliamente difundidas; cabe destacar las ventajas (al menos teóricas) que ofrece su farmacocinética: comienzo de acción rápido y efecto más breve. Su promoción les atribuye un mejor control metabólico (HbA1c y glucosa posprandial), una menor incidencia de episodios hipoglucémicos y, globalmente, una mayor aceptación de los pacientes. Cambio de dirección: hacia un mayor control de la glucemia capilar. Prospectos publicitario 920508-09/04 Novo Nordisk 2004.
Lamentablemente, el panorama en el mundo real no resulta tan concluyente como el que a veces intentan presentar los departamentos de marketing. En la revisión sistemática de la Cochrane Library1 publicada en el 2004 (aunque con poca repercusión), Siebenhofer et al señalan que el análisis de los ensayos clínicos efectuados hasta diciembre de 2003 que comparan los análogos con insulina humana sólo les puede atribuir beneficios clínicos menores. Los autores sugieren «tener una respuesta cautelosa ante la promoción enérgica de los análogos de insulina hasta que se disponga de los datos de eficacia y seguridad a largo plazo» y reclaman la necesidad de realizar, por motivos de seguridad, un seguimiento a largo plazo de los pacientes que las utilizan, especialmente de los que presentan complicaciones diabéticas avanzadas (en los que no están suficientemente ensayadas) y en embarazadas, para determinar el perfil de seguridad, tanto para la madre como para el neonato. Algo similar parece desprenderse de las evaluaciones realizadas con los nuevos análogos de insulina basales, glargina y detemir2.
En la actualidad, 8 años después de la aparición en el mercado del primer análogo de insulina de acción rápida, la tendencia hacia el recambio, aunque lenta, es evidente; en la Comunidad Valenciana los análogos suponen ya el 40% de los envases dispensados a través de receta por el sistema sanitario público y, por su mayor coste, han contribuido al incremento del gasto farmacéutico.
Recientemente, y éste es el motivo de la carta, como ya anunciaba el laboratorio Novo Nordisk en el Reino Unido3, se ha procedido a la retirada (por racionalización en los productos de su vademécum) de varias especialidades de insulina humana, entre otras, las que utilizan el dispositivo Novolet®.
A diferencia de lo ha ocurrido en el citado país, en España la información se comunicó de manera «oficiosa» a los profesionales sanitarios hasta que, el pasado mes de febrero se llevó a cabo, simultáneamente, la comunicación oficial y la retirada efectiva de los preparados afectados, lo que sin duda ocasionó molestias tanto a los profesionales como, sobre todo, a los pacientes.
En el caso de la insulina NPH, que por el momento se mantendría en el mercado, se propone el cambio del sistema de administración Novolet® por el Innolet® (que pese a ser muy adecuado para diabéticos con dificultades en el manejo de las plumas, resulta aparatoso para la gran mayoría) o sustituirlo por la nueva pluma Flexpen®. En cualquiera de los 2 casos se pagaría un 25% más por el mismo tratamiento (de 28,4 a 40,5 e por envase).
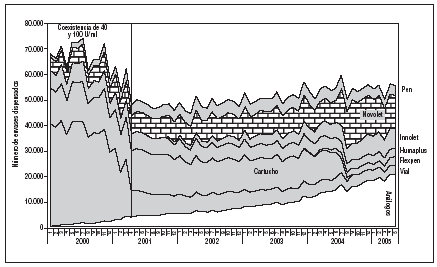
Con el eslogan: «Sistema Flexpen®: sencillez y seguridad», NovoNordisk nos propone justificar este cambio. Sin embargo, el dispositivo Novolet®, «la presentación preferida por los profesionales... y por los pacientes», como señalaba hace poco la publicidad del mismo laboratorio (en diabetes con insulinas... Novolet®. Prospecto publicitario 110094 Novo Nordisk), sigue siendo hoy la presentación más vendida en la Comunidad Valenciana (fig. 1). ¿Por qué retirar una especialidad del mercado si tiene tanta demanda?
FIGURA 1. Evolución de las presentaciones de insulina en la Comunidad Valenciana.
En el caso de la insulina rápida y bifásica, el laboratorio y la Agencia Española del Medicamento proponen cambiarlo por los análogos Novorapid® y Novomix®. Análogos en casi todo menos en su precio (79,4 frente a 28,4 e). Y esta propuesta nos sugiere otra pregunta: si el médico hubiera considerado esta opción como la más conveniente para su paciente, ¿no la habría prescrito ya?
Dejando al margen que estas 2 preguntas se contestan solas y que la medida supone pagar 2-3,5 millones de euros más al año en la Comunidad Valenciana (en el escenario más optimista), lo evidente es que la medida provoca irremediablemente la sustitución de los tratamientos con insulinas humanas por los nuevos análogos, a pesar de las limitadas mejoras que introducen en cuanto a eficacia, seguridad o tolerancia del tratamiento (excepto en algún grupo concreto de pacientes, de manera moderada)1.
Como en otras ocasiones, apreciamos que las decisiones comerciales influyen y mucho en nuestra práctica clínica. En este caso, el cese de comercialización de las especialidades afectadas, unido a una información imprecisa (p. ej., destacar que mejora la glucemia posprandial ocultando que los pacientes no mejoran sus cifras de HbA1c o pueden experimentar cambios en los síntomas usuales de aviso de hipoglucemia, haciendo necesario advertirles de esta situación) puede persuadir al médico a reemplazar, en un paciente controlado, el tratamiento con el que ambos están familiarizados por otra alternativa que no ha demostrado ser más beneficiosa a largo plazo y en la que ambos todavía no han adquirido la suficiente destreza.
Resumiendo, en este caso pensamos que la medida no persigue el beneficio del paciente. Que su tratamiento venga dictado por resultados comerciales y no por las decisiones clínicas del médico deja a ambos en una situación de indefensión.