Introducción
En los últimos años hemos asistido a la erradicación de algunas enfermedades, como la viruela, o a la reducción de su prevalencia, como la poliomielitis y el sarampión, gracias a la administración de las vacunas, que han conseguido unas mejoras sanitarias muy evidentes en la prevención de estas enfermedades.
Por otro lado, las vacunas han adquirido de nuevo un gran protagonismo mundial en los últimos meses a raíz de la utilización de lo que se denomina terrorismo biológico, después de los atentados perpetrados en los EE.UU. en septiembre de 2001. Estas armas biológicas consisten en bacterias, virus o toxinas que se distribuyen de forma masiva e indiscriminada sobre ejércitos o población civil con las consecuencias catastróficas que pueden acarrear, tanto por la mortalidad asociada como por la morbilidad, con el consiguiente colapso sanitario y social que pueden provocar. Para que esto ocurra se tendrían que dar tres condiciones de forma simultánea: una población diana vulnerable, una persona o grupo con capacidad de ataque y la intención de realizar dicho atentado. Para protegerse de esta posibilidad la inversión más costosa y difícil es conseguir la disminución de la vulnerabilidad. Muchos de los desafíos actuales, que derivan en enfermedades emergentes y reemergentes, provienen de problemas como las masificaciones, la deforestación, la aparición de gérmenes multirresistentes por el uso extendido de fármacos, la movilidad internacional, etc., por lo que en ocasiones deben confluir estrategias de salud pública y seguridad nacional. Si los países tienen que enfrentarse a la liberación intencionada de patógenos, deben, además, estar preparados para amenazas probables derivadas de la propia naturaleza (gripe aviar, tuberculosis multirresistente, etc.)1. En cualquier caso, ante este tipo de acciones de terrorismo biológico es muy importante una respuesta inmediata, coordinando los diferentes agentes implicados, tanto sanitarios (asistencia, laboratorios, etc.) como gubernamentales y militares, para proteger a la población de una forma efectiva, disminuyendo al máximo el impacto social y de salud pública que se puede derivar de tales acciones2,3.
De los numerosos agentes que se pueden utilizar como armas biológicas, existen pocos que puedan provocar suficiente número de muertes y enfermedades como para diezmar a una población o región, pero entre ellas podemos destacar el ántrax y la viruela. Ambas tienen el mayor potencial de enfermedad de masas y de alteración de la vida civil porque son altamente letales, estables en la transmisión por aerosol y por la posibilidad de su producción a gran escala.
Otros gérmenes que, en diversa medida, pueden utilizarse son los agentes productores de la peste y la tularemia, que son infectivos a bajas dosis, graves y letales sin tratamiento correcto, aunque la profilaxis y los medicamentos adecuados pueden evitar un gran daño a la población.
Otros agentes que pueden ser objeto de preocupación incluyen las toxinas botulínicas y las fiebres hemorrágicas virales. Las primeras son agentes menos efectivos por su baja estabilidad medioambiental y la posible escasa cobertura geográfica. Los segundos tienen un potencial más grave debido a la letalidad y alta infectividad mediante la transmisión por aerosol2,3. Existe una clasificación de patógenos biológicos basada en la facilidad de transmisión y diseminación, el potencial de afectación de la salud pública, la capacidad de respuesta del sistema sanitario y el impacto a escala social y el grado de pánico producido publicada por los Centers for Disease Control and Prevention, sobre la que no nos vamos a extender3,4.
La Convención para la Prohibición de la Producción, Almacenamiento y Uso de Armas Químicas y su Destrucción se firmó en París en 1993. No obstante, desde entonces se han realizado pocos progresos para su implementación definitiva. Un total de 17 países firmantes del Tratado (incluyendo Iraq, Irán, Rusia, India, Yugoslavia y EE.UU.) posee armas químicas y biológicas. Por tanto, es importante que se lleven a cabo iniciativas desde las Naciones Unidas que pongan fin a la producción, proliferación y uso de este tipo de armas.
El objetivo de este artículo es dar a conocer los gérmenes y las enfermedades causadas por ellos, de los más utilizados o temidos en la actualidad, de forma que el médico de familia tenga conocimientos para poder sospechar o reconocer enfermedades posiblemente vinculadas al bioterrorismo, a fin de seguir las pautas adecuadas.
Indicios de sospecha de liberación intencionada de agentes biológicos
La dificultad para reconocer los brotes producidos por estos agentes estriba en la semejanza con los brotes naturales, el probable desconocimiento de la exposición a tales patógenos y la separación temporal desde la exposición hasta la aparición de la enfermedad, así como la visita a diversos profesionales para su diagnóstico y tratamiento.
Por ello es fundamental mantener un alto índice de sospecha clínica y valores óptimos de declaración de las enfermedades al servicio de salud pública pertinente.
Se tendrán en cuenta los siguientes factores para sospechar un ataque bioterrorista:
Agrupación de brotes de una determinada enfermedad no habitual en su distribución geográfica o temporal.
Aparición de pacientes con signos y síntomas de brote de una enfermedad infecciosa no habitual (sospecha de ántrax).
Distribución inusual en edad de una determinada enfermedad (varicela en adultos, que podría ser confundida con viruela).
Cuadros de parálisis flácida aguda con afección bulbar, sugestivas de intoxicación por toxina botulínica4.
Carbunco (ántrax)
Etiología y epidemiología
El ántrax es una enfermedad infecciosa aguda zoonótica causada por Bacillus anthracis, bacteria grampositiva, aeróbica y formadora de esporas que pueden sobrevivir durante décadas en el ambiente. Afecta fundamentalmente a animales herbívoros, como las ovejas, las cabras, el ganado vacuno y, en menor grado, a cerdos, aunque todos los animales son susceptibles5-7. La afección humana ha desaparecido prácticamente en los países industrializados, pero por desgracia continúa siendo una enfermedad endémica en amplias zonas de Asia y África8. Esta enfermedad de prevalencia muy baja (51 casos declarados en 1996 en España9) ha vuelto a ser protagonista, ya que constituye una de las armas biológicas más estudiadas desde hace 80 años10, y de los 17 países que se cree que están trabajando en estas armas muchos de ellos lo están haciendo con el ántrax11. Desde 1997 ha dejado de ser una enfermedad de declaración obligatoria a escala nacional, aunque sigue siéndolo en diversas comunidades.
La enfermedad se desarrolla tras el contacto con animales infectados o con productos derivados de éstos. Los principales factores de virulencia de B. anthracis son el polipéptido capsular y la toxina antrácica. Habitualmente aparece en animales tras la ingestión de esporas del suelo. La vacunación masiva de animales ha reducido drásticamente su incidencia y mortalidad, aunque sigue demostrándose la existencia de esporas en todo el mundo12.
En seres humanos, la mayoría de los casos aparecen por exposición industrial o agrícola como enfermedad profesional, tras el contacto con animales o productos de animales contaminados. La infección puede producirse de tres maneras: por vía inhalatoria, cutánea y gastrointestinal6,10,12. La forma cutánea es la más frecuente (el 95% de los casos) y puede producirse después de un contacto con animales infectados; la forma gastrointestinal es muy poco frecuente (se han descrito casos en Asia y África) y aparece tras la ingestión de carne insuficientemente cocida e incluye dos síndromes: faríngeo y abdominal. La forma inhalatoria es muy infrecuente de forma natural, y se ha descrito en trabajadores de la lana y curtidores12. No se conoce ningún caso de transmisión persona-persona8.
Clínica
Forma cutánea. Aproximadamente el 95% de los casos de ántrax se presenta como forma cutánea. Tras un período que puede variar entre 10 días y 4 semanas tras el contacto con las esporas y que se ve favorecido por lesiones cutáneas previas, aparece precedida de prurito previo una mácula de pequeño tamaño, posterior pápula y vesícula, que se transforma en una escara, negra y deprimida en la piel rodeada de gran edema, que es la causa de dolor, si es que existe. Las infecciones no tratadas se expanden a la cadena ganglionar y posteriormente originan septicemia12,13.
Forma inhalatoria. Esta forma clínica ha sido hasta ahora una enfermedad de interés histórico con casos muy esporádicos. En la actualidad, constituye una amenaza de arma biológica y, por tanto, vuelve a adquirir protagonismo. Las esporas en partículas de aerosol de más de 5 µm de tamaño se depositan en las vías altas (faringe, laringe y tráquea) y son eliminadas por el sistema mucociliar respiratorio. Las esporas de tamaño entre 2 y 5 µm son capaces de alcanzar los alvéolos y los conductos alveolares8,12,14. El diagnóstico temprano de ántrax inhalado es muy difícil y debe acompañarse de un alto índice de sospecha. No existe en la actualidad ningún sistema de detección temprana de una nube de esporas de ántrax. El número mínimo de esporas inhaladas con una letalidad del 50% no está claramente determinado pero se cree que puede estar entre las 8.000 y las 10.000 esporas6.
El cuadro clínico presenta dos fases diferenciadas. Una primera, tras una incubación superior a 6 días, que se presenta como un cuadro seudogripal e insidioso de unos 4 días de duración, acompañado de malestar general, mialgias, astenia, tos seca, fiebre y sensación de presión retrosternal. La segunda fase se desarrolla de forma súbita con deterioro general, disnea, diaforesis y shock. La linfadenopatía masiva y la expansión al mediastino se acompañan en algunos casos de estridor. La radiografía de tórax evidencia un mediastino ensanchado compatible con linfadenopatías. Hasta el 50% de los pacientes desarrolla meningitis hemorrágica que se manifiesta con signos de meningismo, delirio y estupor. La muerte ocurre en pocas horas12.
Forma gastrointestinal. Se produce tras la ingestión de carne contaminada y se caracteriza por un proceso inflamatorio intestinal, con la aparición inicial de fiebre, náuseas, vómitos, seguidos de dolor abdominal, hematemesis y diarrea sanguinolenta. Es mortal en un 30-60% de los casos.
Diagnóstico
Dada la poca prevalencia de la enfermedad en condiciones normales el diagnóstico es difícil y requiere un alto grado de sospecha, muchas veces basado en la aparición de otros casos sospechosos que obliguen a una confirmación por laboratorio de que estamos ante casos de ántrax en cualquiera de sus formas y que puedan hacer suponer su utilización como arma biológica o terrorismo biológico. El uso de pruebas como ELISA o la reacción en cadena de la polimerasa (PCR) sólo se encuentra en determinados laboratorios, por lo que puede dificultar su diagnóstico12.
Prevención y control de la infección
La prevención en zonas enzoóticas se basa en medidas de control sobre el reservorio animal con la vacunación, diagnóstico, tratamiento, sacrificio, desinfección e incineración así como medidas de higiene y seguridad en el trabajo, evitando la producción de polvo ambiental y utilizando guantes ropas protectoras así como lavado cuidadoso, desinfección o esterilización de pieles, pelo, cueros, harina de huesos y otros productos de origen animal antes de su uso industrial15.
Pueden existir diferentes formas en las que utilizar B. anthracis como arma biológica, aunque puede resultar muy difícil identificar el lugar y la forma de emisión. Estos medios pueden ser la aerosolización en forma de nube de esporas (técnicamente de gran dificultad), la contaminación de vías de conducción aérea de edificios o lo que se ha podido observar hasta ahora en los diferentes atentados que se han producido: en forma de carta o paquete que contiene polvo contaminado con esporas16. Para el correcto abordaje de estas situaciones, se han elaborado diferentes recomendaciones, como las propuestas por el Ministerio de Sanidad o los Centers for Disease Control and Prevention16.
No hay datos que indiquen la transmisión de persona a persona, y por ello se han recomendado las precauciones habituales de aislamiento para los pacientes hospitalizados en cualquiera de sus formas clínicas, y no está indicada la utilización de mascarillas ni otras medidas de protección contra infecciones de transmisión aérea. Tampoco lo está la quimioprofilaxis ni la inmunización de los contactos con pacientes enfermos salvo que éstos hayan estado expuestos a los aerosoles en el momento del ataque. El hipoclorito constituye un desinfectante de uso habitual indicado para el tratamiento de superficies contaminadas con fluidos infectados. El correcto enterramiento o la incineración de personas o animales muertos es importante para prevenir la transmisión de la enfermedad8,12.
Profilaxis5,7,8,12,16,17,18
Profilaxis preexposición: vacunación. Se trata de una vacuna acelular, preparada de un filtrado de cultivo de cepa avirulenta no capsulada de la bacteria que elabora el antígeno protector durante su crecimiento. El hidróxido de aluminio es el adyuvante utilizado. Esta vacuna está producida en los EE.UU. Existe otra vacuna atenuada utilizada en la ex Unión Soviética.
Administración. La primovacunación consiste en tres dosis de 0,5 ml por vía subcutánea a las 0, 2 y 4 semanas y tres dosis de refuerzo a los 6, 12 y 18 meses. Es necesaria una dosis de recuerdo administrada anualmente.
Indicaciones: a) personal de laboratorio que trabaja con B. anthracis; b) profesionales en contacto con animales o productos de éstos que puedan estar contaminados en zonas endémicas o en países en los que no se aplican medidas sanitarias suficientes en estas industrias; personal militar, sanitario y personas en las que, por su condición, se pueda calcular el riesgo de exposición a un ataque de bioterrorismo o guerra biológica, y c) profilaxis postexposición: en España no está indicada su utilización en veterinarios.
Seguridad. Pueden aparecer reacciones locales como eritema (30%) o discreto edema (4%). Reacciones más graves como edema en la extremidad ocurren con muy poca frecuencia. Reacciones generales, como fiebre, mialgias o astenia son muy infrecuentes18.
Eficacia. Diferentes estudios en animales y un estudio en seres humanos han demostrado una eficacia de la vacuna de más del 90% tanto frente a la forma cutánea como a la inhalada. No hay datos respecto a la eficacia en personas de menos de 18 años de edad y de más de 657, y se necesitan más estudios para determinar su seguridad en embarazadas.
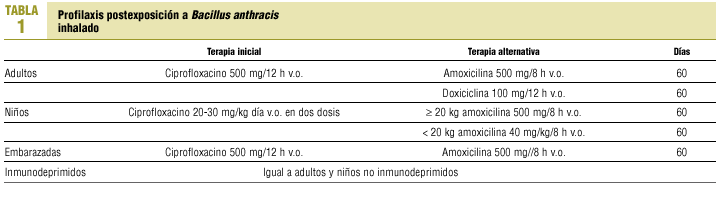
Profilaxis postexposición. Se basa en la utilización conjunta de quimioprofilaxis y vacunación5. La amoxicilina, doxiciclina, ciprofloxacino y ofloxacino son las opciones antibióticas indicadas en casos de exposición a la bacteria en las dosis que se recomiendan en la tabla 15.
Estos antibióticos son activos frente a las formas germinativas de la bacteria y no lo son frente a las esporas, ya que éstas pueden sobrevivir en los tejidos durante meses.
El ciprofloxacino es el único antibiótico aprobado por la Food and Drug Administration (FDA) para reducir la progresión de la enfermedad en la exposición a las formas aerosolizadas de B. anthracis. Este tratamiento debe prolongarse durante 42-60 días y acompañarse de la vacunación. Una vez completadas las primeras tres dosis puede detenerse el tratamiento antibiótico. Valorando el riesgobeneficio de una exposición a B. anthracis, el ciprofloxacino puede utilizarse en niños y embarazadas inicialmente como profilaxis, cambiando a penicilina cuando se disponga de la sensibilidad antibiótica de la bacteria16.
Tratamiento8,12,14
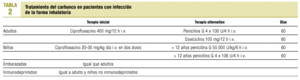
La penicilina continúa siendo el antibiótico de elección para el tratamiento de B. anthracis adquirido de forma natural, y como alternativa se recomienda la administración de ciprofloxacino o doxiciclina. Dada la posibilidad de que la bacteria utilizada en bioterrorismo pertenezca a cepas resistentes, el ciprofloxacino por vía intravenosa es el tratamiento de elección (a las dosis recomendadas según la tabla 2) en las formas inhalada y gastrointestinal hasta conocer su sensibilidad. La terapia alternativa se administrará sólo en el caso de cepas con demostrada sensibilidad a estos antibióticos. La forma cutánea puede tratarse de forma oral.
Viruela
La viruela utilizada como arma biológica puede tener consecuencias devastadoras dada la mortalidad con la que puede asociarse, de hasta el 30%, los bajos grados de inmunidad de la población actual (se dejó de vacunar contra esta enfermedad en 1971, una vez erradicada) y la ausencia de tratamiento eficaz.
Etiología y epidemiología
La viruela está producida por un virus ADN de la familia de los orthopoxvirus. Durante la época prevacunal, todo el mundo tenía contacto con el virus, y existían dos formas de presentación de la enfermedad: la viruela maior, con un 30% de mortalidad, y la viruela minor, con un 1% de mortalidad, que se diferencian virológicamente.
La viruela es una enfermedad que se disemina de persona a persona a través de aerosoles expelidos de la orofaringe, por contacto directo y a través de fómites infectados. No existe reservorio animal, y presentaba una mayor incidencia estacional en los meses de invierno y comienzo de primavera, semejante al sarampión y la varicela.
Clínica
Al final de un período de incubación de 2-17 días, el paciente presenta durante 2-3 días pródromos con fiebre alta, postración, cefalea y lumbalgia. A continuación, comienza un exantema centrífugo maculopapular en la mucosa de la boca, la faringe y la piel de la cara y los hombros, que se extiende al resto del cuerpo, con afección palmoplantar. Es el período de máxima infectividad.
A los 2 o 3 días se torna vesicular y, posteriormente, aparecen pústulas características, tensas, redondas y embebidas en la piel. La boca y la faringe se llenan de úlceras que dificultan la alimentación. En contraposición a la varicela, enfermedad con la que hay que realizar el diagnóstico diferencial, las lesiones son simultáneas en el tiempo y, por tanto, no presenta diferentes estadios de evolución, y son lesiones más profundas en la piel, y además aparece la referida afección palmoplantar. Las lesiones se curan produciendo profundas cicatrices, sobre todo en la región facial, debido a la afección de las glándulas sebáceas. La muerte ocurre a las 2 semanas de evolución de la enfermedad por toxemia.
Diagnóstico
Un solo caso de viruela diagnosticado en el mundo debe ser tratado como una emergencia mundial. Se realiza de forma rápida mediante la confirmación al microscopio electrónico de muestras obtenidas de los fluidos de las vesículas o pústulas, además de otros estudios que incluyen cultivo viral y técnicas de tipificación.
Profilaxis
En Europa, el último caso de viruela se produjo en Portugal en 1953. En 1977, en Somalia se dio el último caso en el mundo de viruela endémica. El 8 de mayo de 1980 se consideró la erradicación mundial de la enfermedad tras los programas de vacunación y erradicación. En la actualidad sólo hay dos centros que, oficialmente, conserven el virus variólico: los Center for Disease Control and Prevention, en los EE.UU., y el Centro Estatal de Virología y Biotecnología, en Rusia15.
Hasta 1972 la vacuna de la viruela era una vacuna de uso sistemático, y por tanto los menores de 29 años no han sido vacunados. El estado inmunológico de los mayores de esa edad no está claro, ya que la duración de la inmunidad no ha sido suficientemente estudiada. En la actualidad debe considerarse que la mayoría de la población es susceptible de adquirir la enfermedad. Las reservas mundiales de vacuna antivariólica están limitadas19.
Vacuna de la viruela (vaccinia). Dryvax, la vacuna de la viruela (vaccinia) comercializada en los EE.UU. es una preparación liofilizada de virus vivos de vaccinia. No contiene virus de viruela. Se administra mediante la técnica de la aguja bifurcada20.
Eficacia: parece que los anticuerpos neutralizantes disminuyen a los 5-10 años de la vacunación. Sin embargo, los que recibieron más de una dosis, tienen una inmunidad de entre 10 y 30 años de duración. Por tanto, la revacunación confiere una inmunidad más prolongada que la primovacunación. La administración de la vacuna en los primeros días tras exposición al virus de la viruela reduce los síntomas o previene la enfermedad.
Indicaciones:
* Rutinarias: personal de laboratorio en contacto con cultivos o animales contaminados o infectados con virus vaccinia atenuados o recombinantes y otros orthopoxvirus; personal sanitario en contacto con materiales contaminados (ropas). La revacunación debe efectuarse cada 10 años.
* No rutinarias: la vacunación preliberación de un posible ataque bioterrorista no se considera en la actualidad dado el bajo riesgo de tal acontecimiento. Si se produjera una liberación intencionada del virus de la viruela, la vacunación con vaccinia estaría recomendada en diversos grupos; éstos serían: personas inicialmente expuestas a la liberación inicial; contactos directos de dichas personas; personal sanitario y no sanitario involucrado en el tratamiento de estos pacientes; personal de laboratorio involucrado en el diagnóstico y transporte de muestras.
Las personas previamente inmunizadas requerirían sólo revacunación con una dosis y, en este caso, las personas sanas previamente vacunadas serían las seleccionadas para la atención programada a los pacientes infectados.
Los niños con contacto deberían ser vacunados con independencia de la edad. Las embarazadas deberían ser tratadas con inmunoglobulina específica y, en su defecto, en caso de alto riesgo, con la vacuna.
La organización de la inmunización de la población en estas circunstancias debería iniciarse por grupos de personal imprescindible para el funcionamiento de la sociedad.
No hay contraindicaciones absolutas a la vacunación en caso de emergencia por viruela.
En la actualidad se están desarrollando nuevas vacunas contra la viruela. Al igual que la anterior, contendrán virus de vaccinia vivos, pero producidos en cultivos de células mediante las técnicas modernas de producción de vacunas. El primer lote estará dispuesto para 2004, con 40 millones de dosis21,22, que es lo que se calcula por un modelo matemático para interrumpir la diseminación de la enfermedad en un año23.
Efectos secundarios y reacciones adversas: en una persona no inmune no inmunodeprimida, la respuesta vacunal esperada consiste en el desarrollo de una pápula en el punto de inoculación a los 2-5 días, posterior vesícula y escara que se desprende dejando una cicatriz. La fiebre es común en los niños, hasta el 70%, y menos frecuente en adultos.
La inoculación inadvertida en otros puntos origina la mayoría de las reacciones adversas. El uso de gammaglobulina específica disminuye los efectos en caso de inoculación ocular.
Las reacciones moderadas y graves que se producen (una muerte por cada millón de dosis en primovacunación y 0,25 por cada millón de dosis de revacunación) incluyen el eccema de vacunación en personas con dermatitis eccematosa previa; la vaccinia generalizada, que no requiere tratamiento excepto en personas inmunocomprometidas, y la vaccinia progresiva, que en ocasiones cursa con encefalitis, la más grave de las complicaciones. Puede ocurrir la transmisión del virus de la vaccinia a personas susceptibles tras contacto con un recién vacunado20.
Contraindicaciones: personas con dermatitis eccematosa e inmunodeprimidos o personas cuyos convivientes tengan una de las condiciones anteriores. Embarazadas. Alergia a los componentes de la vacuna.
Medidas de control
El aislamiento de los pacientes con sospecha de viruela es fundamental para el control de la enfermedad. Las medidas para evitar la diseminación aérea como las habitaciones con presión de ventilación negativa, etc. y el seguimiento por parte del personal de las precauciones estándar y de contacto (mascarillas, guantes, botines, etc.), así como el uso de material desechable incluso para ropa de cama o esterilización en autoclave.
Inmunoglobulina. La inmunoglobulina específica (VIG) puede ser utilizada como profilaxis postexposición, como tratamiento de las formas moderadas y severas de las complicaciones de la vacuna o juntamente con la vacuna en personas de alto riesgo en que esté indicado inmunizar y tenga contraindicaciones para ello. En caso de emergencia, se priorizarán las dos últimas circunstancias.
Tratamiento
Al paciente infectado en la actualidad se le trataría con terapia de soporte y antibióticos. Existen antivirales en estudio, como el cidofovir22.
Peste
Yersinia pestis, agente productor de la peste, es uno de los agentes biológicos críticos. Su disponibilidad en el mundo, la posibilidad de producción a gran escala, la fácil transmisión por aerosoles y la elevada tasa de letalidad hacen de esta enfermedad un arma biológica de gran preocupación.
Etiología y epidemiología
Y. pestis es un bacilo gramnegativo que se transmite a los humanos en la enfermedad natural a través de la picadura de pulgas infectadas de roedores que son el reservorio de la enfermedad. La mayoría de las personas infectadas por esta vía adquiere la peste bubónica y sólo un pequeño porcentaje desarrolla la peste septicémica. Ninguna de estas dos formas se transmite de persona a persona. Sin embargo, tanto la peste bubónica como la septicémica pueden desarrollar peste neumónica de forma secundaria y transmitir a su vez esta tercera forma de la enfermedad a las personas que la adquieran mediante las gotas respiratorias.
En caso de utilización de esta enfermedad como arma biológica, se recurriría a su diseminación mediante aerosoles.
Clínica
En la peste natural, el paciente desarrolla típicamente, a los 2-4 días de la picadura de una pulga infectada, un cuadro febril, debilidad, escalofríos y la aparición de un ganglio muy inflamado en la ingle, la axila o la región cervical, denominado «bubón»; posteriormente puede desarrollar una forma neumónica, aunque existen pacientes que desarrollan la peste septicémica primaria sin este bubón.
En caso de bioterrorismo, la forma esperada sería la aparición en brote de casos de neumonía grave y sepsis, y la presencia de hemoptisis sugeriría el diagnóstico de peste, más que el de ántrax. En la radiografía de tórax se observarían infiltrados bilaterales y condensación. En formas avanzadas de la enfermedad son características las lesiones purpúricas de la dermis y la necrosis de las partes acras. El tiempo desde la exposición a la muerte es de 2-6 días sin tratamiento antibiótico.
Diagnóstico
No existe ningún test rápido para detección de la enfermedad. Los estudios microbiológicos son fundamentales (tinción, cultivo esputo y sangre, entre otros). Otras técnicas están disponibles en los laboratorios más especializados.
Profilaxis
Vacuna. La producción de vacuna de bacterias enteras muertas ha sido interrumpida. Ésta era eficaz para prevenir y disminuir la gravedad de la peste bubónica, pero no la neumónica primaria.
Profilaxis post-exposición. Se administrará profilaxis postexposición durante 7 días a personas asintomáticas de contacto cercano (el contacto se define como el paciente situado a menos de 2 m), convivientes u hospitalarios. Las recomendaciones se exponen en la tabla 3.
Tratamiento
Las recomendaciones respecto al tratamiento vienen limitadas por la falta de estudios sobre el tratamiento en seres humanos de esta enfermedad. Se instaurará tratamiento a las personas con temperatura mayor o igual de 39,5 ºC o crisis de tos.
Tras establecer tratamiento inicial con gentamicina o estreptomicina, se valorará el seguimiento según los estudios de resistencia. En caso de afección masiva se llevarán a cabo terapias orales con doxiciclina o ciprofloxacino.
Otras medidas como el aislamiento, o el uso de mascarillas, bata y guantes son necesarias para evitar la diseminación de la enfermedad.
Debido a la ausencia de formas esporuladas de Y. pestis y la susceptibilidad al sol y al calor, se estima que en el peor de los casos, un área expuesta a la peste en aerosol sería efectiva e infecciosa durante una hora. Las medidas fundamentales consistirían en el tratamiento y detección de casos y la profilaxis de los contactos24.
Botulismo
Es una paradoja que la toxina botulínica se haya autorizado para el tratamiento de enfermedades humanas y hayamos de considerarla como una de las posibles armas biológicas más peligrosas. Es la sustancia conocida con mayor poder de intoxicación, que ya se ha intentado utilizar como arma biológica en numerosas ocasiones en el transcurso de la historia.
Etiología y epidemiología
Clostridium botulinium es un anaerobio obligado, formador de esporas, cuyo hábitat natural es el suelo, de donde puede aislarse sin dificultad, para producir la toxina botulínica, de la cual existen siete tipos antigénicos clasificados de la A a la G. Estos tipos de toxina se caracterizan por la ausencia de neutralización cruzada. La dosis letal de toxina se desconoce pero, por estimaciones en primates, se sabe que la toxina botulínica comercializada para uso terapéutico carece de capacidad letal25.
Todos los años se diagnostican casos de la enfermedad, fundamentalmente producidos por el consumo de conservas caseras26. Las tres formas naturales de la enfermedad son la intoxicación por alimentos contaminados, por infección de heridas o la forma intestinal. Todas las formas de la enfermedad proceden de la absorción de la toxina a través de mucosas (pulmón, intestino) o de una herida, ya que la toxina botulínica no atraviesa la piel intacta y no existe contagio de persona a persona.
Existe una cuarta forma artificial de la enfermedad: el botulismo inhalado. Ésta, junto con la intoxicación de alimentos, serían las formas elegidas para bioterrorismo.
Una vez que la toxina botulínica se ha absorbido, es transportada por la corriente sanguínea hasta las sinapsis colinérgicas periféricas de la unión neuromuscular, donde se une de forma irreversible, bloqueando la liberación de acetilcolina.
Clínica
El botulismo es una enfermedad aguda, afebril, que cursa con parálisis flácida, simétrica y progresiva, que siempre comienza en la musculatura bulbar. Es imposible el diagnóstico de botulismo ante un cuadro sin afección de varios pares craneales de forma simultánea. Sin embargo, la gravedad y el grado de afección pueden variar mucho de un paciente a otro. Éstos y la rapidez en la instauración de los síntomas depende de la cantidad y la absorción de toxina ingerida.
Los síntomas gastrointestinales (diarrea, vómitos, dolor abdominal) son frecuentes en la forma adquirida por alimentos contaminados, que pueden ser achacados a otro tipo de intoxicación alimentaria. Estos síntomas preceden a la afección neurológica.
Los pacientes con botulismo presentan dificultad para la visión, la deglución o el habla. La exploración neurológica pone de manifiesto ptosis palpebral, midriasis, diplopía, disartria, disfonía y disfagia, aunque no hay alteraciones sensitivas. Posteriormente pueden observarse pérdida de la sujeción de la cabeza, hipotonía y debilidad generalizada, acompañada de dificultad respiratoria que requiere ventilación en numerosas ocasiones.
La recuperación en adultos de este proceso puede durar semanas o meses.
El diagnóstico diferencial hay que realizarlo con el síndrome de Guillain-Barré, el ictus y la miastenia grave, entre otros.
Diagnóstico
Depende de un alto grado de sospecha clínica; algunos datos, expuestos en la tabla 4, hacen sospechar un ataque biológico.
El diagnóstico de botulismo se realiza mediante la detección de la toxina específica en la muestra que se va a investigar. Estas muestras pueden ser suero, heces, vómitos, la comida intoxicada o aspirado gástrico. La prueba clásica es el bioensayo en ratón, mediante la cual el ratón sobrevive a la administración de la muestra por tener administrada la antitoxina específica.
Profilaxis
El botulismo se puede prevenir por la presencia de anticuerpos neutralizantes en la sangre. La inmunidad pasiva se puede adquirir por la administración de antitoxina específica equina o por la administración de globulina específica humana hiperinmune. La administración de antitoxina post-exposición es limitada debido a la escasez de la sustancia y a su reactogenicidad. A estas personas se les debe someter a una vigilancia clínica intensiva.
La inmunización activa se puede adquirir por la vacunación con toxoide botulínico. En los EE.UU. existe una vacuna pentavalente (ABCDE) de toxoide botulínico que se utiliza para personal de laboratorio expuesto así como para personal militar. La vacunación sistemática de la población no es factible ni deseable de momento, debido al bajo riesgo natural de la enfermedad, la escasez del toxoide y la eliminación del posible papel terapéutico del toxoide botulínico. La vacuna no tiene ningún papel en la profilaxis post-exposición por el tiempo que tarda en producir anticuerpos protectores25.
Las medidas fundamentales para evitar el botulismo natural son la cocción de los alimentos en conserva a más de
80 ºC durante más de 5 min. En caso de botulismo en aerosol, las temperaturas extremas y la humedad degradan las proteínas.
Otras medidas consisten en la precaución estándar y el uso de mascarilla, el lavado de la ropa con agua y jabón y de las superficies infectadas con hipoclorito sódico al 0,1%.
Tratamiento
La mortalidad y las secuelas asociadas con el botulismo han descendido de un 25 a un 6% con las terapias actuales. El tratamiento consiste en terapia de soporte y la administración de antitoxina específica equina, que debe administrarse tan pronto como se diagnostique la enfermedad para minimizar la afección neurológica.
Consecuencias
El propósito de las armas biológicas y químicas es dañar vidas humanas; sin embargo, como armas militares son poco efectivas o tienen un uso limitado. Su poder fundamental, además del perjuicio físico y la muerte, es sembrar terror y causar destrucción a través de medios psicológicos: producir miedo, confusión e intranquilidad en la vida diaria, efectos potenciados por la difusión de estos hechos a través de los medios de comunicación. Estas secuelas pueden manifestarse a corto y largo plazo.
Las consecuencias pueden observarse como pánico de masas, reacciones anticipadas individuales o de colectivos y ser utilizadas por grupos ajenos al daño inicial para aumentar los grados de angustia.
Es posible que el nivel general de dolencia, miedo y ansiedad permanezca elevado durante años, exacerbando alteraciones psiquiátricas existentes. La incertidumbre actual de los efectos a largo plazo de valores bajos de tóxicos durante un tiempo prolongado incrementa la ansiedad de las comunidades afectadas y la falta de aseveración por parte de las autoridades de la inocuidad de determinadas acciones (sobre con polvo, exposición a agentes perjudiciales) originan frustración y falta de confianza en el sistema. Por ello, los efectos sociales y psicológicos pueden ser peores que los agudos iniciales y debemos estar preparados para afrontar este tipo de reacciones27.
Conclusiones
Aunque el riesgo de bioterrorismo en España se considere actualmente bajo, debido a los acontecimientos internacionales han de considerarse programas de formación y detección de estas situaciones. Son tres los tipos de circunstancias con diverso impacto social y en salud pública que entran en consideración: la utilización de agentes biológicos como arma (ántrax), el uso de patógenos habituales como Salmonella y las coacciones o falsas alarmas. El papel de los servicios de salud pública en el reconocimiento de este tipo de fenómenos es fundamental, y la relación de los laboratorios de referencia para su pronto diagnóstico con los servicios de atención primaria y especializada para la comunicación bidireccional es básica28. Para mitigar al máximo los efectos de un ataque de este estilo es preciso un diagnóstico rápido, una confirmación y una puesta en activo de una cadena de actuaciones a distintas escalas, que incluye el almacén de fármacos específicos y el desarrollo de nuevos medicamentos y vacunas29.
La formación al respecto de los médicos de atención primaria es prioritaria en nuestro Sistema Nacional de Salud, tanto para prontas sospechas como para seguir un ágil sistema de declaración29,30.
En la página web de la American Academy of Family Physicians se pueden encontrar más información de recursos en Internet sobre bioterrorismo31.
*M.A. Mayer Pujadas, M.J. Álvarez Pasquín, J. Gómez Marco, J. Redondo Sánchez, J. Muñoz Gutiérrez, M. Cereceda Ferrés, C. Batalla Martínez,
E. Comín Bertrán, A. Pareja Bezares, R. Piñeiro Guerrero, V. Niño Martín, J. Arranz Izquierdo, P. Carceller, E. Nodar Martín, J. Ortega Martínez
y J. Vázquez Villegas
Correspondencia: Miguel Ángel Mayer Pujadas. Colegio Oficial de Médicos de Barcelona. Plaza Francesc Macià, 1-2. 08021 Barcelona. España. Correo electrónico: mmayer@comb.es