Definición del problema
¿Está justificado el cribado del cáncer de próstata?
Síntesis de las evidencias
El cáncer de próstata es un problema de salud importante y todavía hoy existe un fuerte debate sobre los beneficios y riesgos de su detección precoz1.
Epidemiología
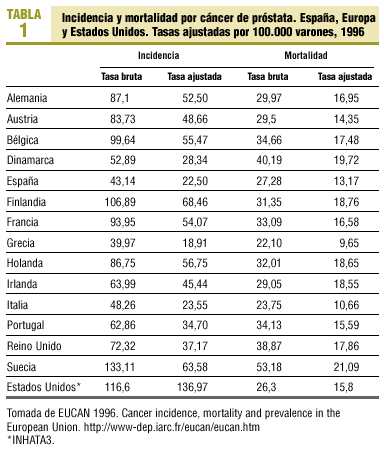
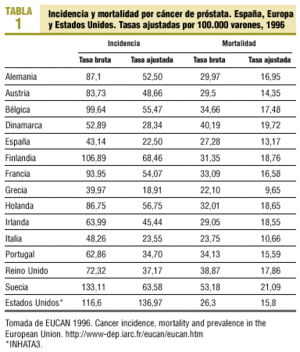
Las estimaciones de la International Agency for Research of Cancer (IARC)2 indican que en 1996 se diagnosticaron en España 8.348 cánceres de próstata, lo cual representa una tasa bruta de 43,14 por 100.000 varones y una tasa ajustada por población mundial de 22,5, muy inferiores a las de otros países (tabla 1).
En España, al igual que en la mayoría de países europeos, la incidencia está aumentando2, mientras que en Estados Unidos, tras el importante aumento detectado en la década de los ochenta, ha disminuido durante la última década. La tendencia negativa que se aprecia en Estados Unidos es atribuible a la detección precoz con antígeno prostático específico (APE)4 y refleja más la prevalencia de la enfermedad que su incidencia. Sin embargo, la prevalencia real del cáncer de próstata es difícil de determinar, ya que las necropsias indican que un 30% de los varones mayores de 50 años presentan un cáncer de próstata no conocido.
En 1996, en España las defunciones por esta causa fueron 5.278 (tasa ajustada de 13,17 por 100.000 varones)2. Esta tasa no es muy inferior a la de otros países (tabla 1), lo que podría explicar que, a pesar de las determinaciones de APE, sólo un grupo de tumores son clínicamente significativos y de mal pronóstico. La tendencia de la mortalidad en España es estable, mientras que en algunos países europeos y en Estados Unidos en los últimos años se empieza a observar una disminución2.
Los factores de riesgo implicados en el cáncer de próstata son4:
Edad. Más de un 75% de los cánceres de próstata se diagnostican en personas mayores de 65 años.
Historia familiar. Un 25% de los varones diagnosticados de cáncer de próstata presentan historia familiar. Una persona con familiares de primer grado afectados de cáncer de próstata tiene 2-3 veces mayor riesgo de manifestar la enfermedad.
Genética. La herencia es responsable de un 10% de los cánceres de próstata. Normalmente se diagnostica antes de los 50 años y en un estadio más avanzado.
Raza. Los varones de raza negra presentan mayor riesgo.
Dieta. Una dieta rica en grasa se ha asociado a mayor riesgo.
Métodos de cribado poblacional
Tacto rectal (TR). Es un método subjetivo que requiere entrenamiento y experiencia y es mal aceptado por la población. Sólo permite palpar la zona lateral y posterior de la glándula. Como método de cribado poblacional ha sido investigado en 2 estudios aleatorizados y la detección de cáncer en la población cribada fue del 1,1-2,4%, con unos valores predictivos positivos (VPP) del 28%5,6. El TR no es aceptado como único método de cribado y ningún estudio ha demostrado su influencia en la mortalidad.
Ecografia transrectal (ETR). El examen de la próstata con ETR consume numerosos recursos y requiere mucho entrenamiento. Las diferentes tasas de sensibilidad y especificidad referidas reflejan la incertidumbre de esta técnica. Sus VPP son bajos, debido a que no puede diferenciar entre nódulo benigno y maligno. No existe evidencia de que su uso como método de cribado mejore la mortalidad3. Su principal indicación es sólo como exploración diagnóstica.
Antígeno del APE. El APE es una glucoproteína órgano-específica, pero no cáncer-específica, por lo que un valor elevado también puede indicar4 hiperplasia benigna de próstata (HBP), retención urinaria, prostatitis, masaje prostático, eyaculación, y presentarse después de cistoscopia, biopsia o sondaje vesical. Debemos considerar asimismo que a los 6 meses de tratamiento con finasterina, el APE puede disminuir hasta un 50%.
Un valor de APE de 4,0 ng/ml se ha utilizado tradicionalmente como límite superior de normalidad del test. Con este punto de corte, la sensibilidad es inferior al 80%7 y su VPP no superior al 32%. Otras técnicas utilizadas para mejorar la precisión del APE3,4 son:
APE específico según edad: fijar el límite del APE en 2,5 ng/ml en personas jóvenes permite diagnosticar más cánceres. Establecer el valor en 6,5 ng/ml en personas mayores permite disminuir el número de falsos positivos y evita biopsias innecesarias. Sin embargo, no existe evidencia de que los rangos de referencia específicos por edad sean útiles en la detección precoz de este cáncer.
Velocidad del APE: la tasa de crecimiento del APE a lo largo del tiempo es mayor en pacientes con cáncer. No obstante, las controversias de los diversos estudios limitan su utilización.
Densidad APE: relaciona la concentración del PSA en sangre y el volumen de la glándula prostática. Un ratio > 0,15 indica cáncer y < 0,15 patología benigna. No existen estudios que apoyen su efectividad.
Porcentaje de APE libre: el PSA se une a la antiquimiotripsina sanguínea de los pacientes con cáncer en mayor medida que en los pacientes con HBP, 90% y 70%, respectivamente. Por lo tanto, la proporción de APE libre en relación al APE total es menor en el cáncer de próstata. La medición del APE libre puede reducir el número de biopsias innecesarias en pacientes con APE entre 4 y 10 ng/ml, con una mínima pérdida de la sensibilidad para la detección del cáncer.
El beneficio del cribado del cáncer de próstata con APE todavía no se ha demostrado. Actualmente se dispone de los resultados de un ensayo clínico controlado y están en curso otros dos, cuyos resultados en términos de reducción de la mortalidad no estarán disponibles antes de 2005-2009.
Quebec Prospective Randomized Controlled Trial8. Se inició en 1989. Población diana de 46.193 varones de 45-80 años. Test de cribado: APE (3 ng/ml) y TR. Resultados: en el grupo de estudio hay mayor reducción de la mortalidad; no obstante, sólo un 23% de los pacientes asignados al grupo de estudio aceptaron participar y las comparaciones con el grupo control no quedan apoyadas por una correcta asignación aleatoria.
European Randomized Study of Prostata Cancer (ERSPC)9. Se inició en 1994. Población diana: 190.000 varones de 55-75 años. La aleatorización difiere en los 7 países participantes. Test de cribado en el primer protocolo: APE 4 ng/ml (en la fase piloto 10 ng/ml) + TR. Protocolo actual: APE (3 ng/ml). Intervalo: cada 4 años. Resultados disponibles:
En el grupo de estudio se han diagnosticado 8 veces más cánceres, la proporción de metástasis es 8 veces menor y se estima que existe un sobrediagnóstico un 16% superior que en el grupo control10.
Cuando el objetivo es detectar el cáncer de próstata clínicamente significativo, el 94,7-100% de los TR son innecesarios. El APE aislado es válido como test de cribado inicial11.
Cuando se utiliza un nivel de APE de 4 ng/ml, se requieren 4 biopsias para diagnosticar un cáncer, y cuando éste es de 3 ng/ml se requieren 5 biopsias para diagnosticar un cáncer10.
Un 50% de los cánceres que presentan un APE de 2-4 ng/ml, y no exceden de la cápsula, tienen una puntuación en la escala de Gleason >= 7, lo cual representa un factor pronóstico adverso. El 27% de los cánceres diagnosticados en el primer cribado son incurables10.
PLCO (Prostate, Lung, Colon, Ovary) trial of the National Cancer Institute de EEUU12. Se inició en 1993. Población diana: 74.000 varones de 55-74 años, de 10 centros, a los que en los 3 años anteriores no se hubiera realizado un APE. Test de cribado: APE + TR. Intervalo: cada 5 años. Resultados: no disponibles.
La biopsia como prueba de referencia (gold standard). La confirmación histológica mediante biopsia se considera el estándar de referencia. Sin embargo, las biopsias se realizan sólo cuando las pruebas descritas anteriormente son sospechosas de cáncer y, por lo tanto, las mediciones de su sensibilidad y especificidad son sesgadas4. La biopsia sextante mediante la ETR produce resultados falsos negativos en un 25% de los casos4.
Tratamiento del cáncer de próstata. El tratamiento es muy controvertido. La mayoría de estudios disponibles son observacionales y sus resultados se han de interpretar con cautela3,4. Si bien es coincidente la opinión de optar por un tratamiento activo en la mayoría de casos, cada especialista se muestra partidario de la técnica relacionada con su propia especialidad13. También es generalizada la opinión de que tanto la prostatectomía radical, como la radiación externa o la braquioterapia se asocian a efectos indeseables mal aceptados por la población (disfunción sexual e incontinencia)4.
Traducción en la práctica clínica
Hoy por hoy no se dispone de una estrategia óptima de detección precoz del cáncer de próstata. La evidencia científica disponible es valorada de diferente manera por las instituciones, agencias de evaluación, sociedades científicas y guías de práctica clínica, como se observa en sus recomendaciones (tabla 2).
A pesar de que la mayor parte de las recomendaciones en nuestro medio apuntan a la no utilización de APE como test de cribado, la práctica clínica, como en otros campos, va por un camino distinto. Prueba de ello es que la mayoría de estudios en nuestro medio objetivan que el motivo principal de solicitudes de APE, y en un porcentaje muy elevado, es el cribado. La conducta de muchos médicos es añadir el APE a una solicitud de laboratorio por cualquier motivo, y una vez conocido el resultado plantearse qué hacer o, incluso en muchos casos, no hacer nada.
Solicitar un APE, ya sea por iniciativa del médico o a petición del paciente, requiere que éste sea informado de las connotaciones de la prueba: la probabilidad de diagnosticar un cáncer, de un falso positivo y la ansiedad que ello genera, de un falso negativo, así como la incertidumbre de este test en la reducción de la mortalidad. La mayoría de las sociedades que recomiendan este cribado ponen como condición que el paciente sea muy bien informado. Resultados de un ensayo clínico muestran que cuando el paciente está informado se reduce la proporción de varones que deciden ser cribados mediante APE, aunque se mantiene una proporción considerable que prefieren realizárselo20.