En investigación es fundamental informar adecuadamente a los pacientes y respetar el principio de autonomía. El objetivo de este estudio fue explorar la percepción de médicos de familia, investigadores y pacientes sobre el proceso del consentimiento informado (CI) en los ensayos clínicos (EC), y el papel que desempeña el médico de familia.
DiseñoEstudio transversal mediante 3 cuestionarios y revisión de CI, historias clínicas e informes de alta hospitalaria.
EmplazamientoMédicos de familia, investigadores y pacientes involucrados en EC.
ParticipantesQuinientos cuatro médicos de familia, 108 investigadores y 71 pacientes.
ResultadosEn el 50% de los CI se recomendaba consultar con el médico de familia. Constaba la participación en un EC en el 33% de las historias clínicas de atención primaria y en el 3% de informes de alta hospitalaria. Los médicos de familia suspendieron, con 3,54 puntos, la información recibida a través del investigador principal. La legibilidad del CI fue puntuada con 8,03 puntos por los investigadores y con 7,68 por los pacientes (rango: 1-10 puntos). La satisfacción de los pacientes se relacionó positivamente con el tiempo de reflexión concedido.
ConclusionesLos médicos de familia mostraron insatisfacción con la información que reciben sobre la participación de los pacientes de su cupo en EC. Los investigadores son conscientes de la necesidad de mejorar la información que reciben los médicos de familia, aunque están satisfechos con la información ofrecida a los pacientes. Los pacientes se mostraron colaboradores y satisfechos con la investigación biomédica y minimizaron los inconvenientes relacionados con la participación.
Adequate information for patients and respect for their autonomy are mandatory in research. This article examined insights of researchers, patients and general practitioners (GPs) on the informed consent process in clinical trials, and the role of the GP.
DesignA cross-sectional study using three questionnaires, informed consent reviews, medical records, and hospital discharge reports.
SettingGPs, researchers and patients involved in clinical trials.
ParticipantsIncluded, 504 GPs, 108 researchers, and 71 patients.
ResultsConsulting the GP was recommended in 50% of the informed consents. Participation in clinical trials was shown in 33% of the medical records and 3% of the hospital discharge reports. GPs scored 3.54 points (on a 1-10 scale) on the assessment of the information received by the principal investigator. The readability of the informed consent sheet was rated 8.03 points by researchers, and the understanding was rated 7.68 points by patients. Patient satisfaction was positively associated with more time for reflection.
ConclusionsGPs were not satisfied with the information received on the participation of patients under their in clinical trials. Researchers were satisfied with the information they offered to patients, and were aware of the need to improve the information GPs received. Patients collaborated greatly towards biomedical research, expressed satisfaction with the overall process, and minimised the difficulties associated with participation.
Los ensayos clínicos (EC) constituyen un diseño esencial para mejorar los tratamientos médicos. Para poder realizar un EC, los investigadores tienen la obligación, legal y ética, de obtener el consentimiento informado (CI) de los pacientes1. Con él, se pretende garantizar el respeto del principio de autonomía del paciente, aunque evidentemente es complejo2,3.
Investigadores y pacientes son los protagonistas del proceso del CI en EC. Los investigadores deben asegurarse de obtener un CI apropiado, cumpliendo la legislación y los principios éticos que protegen los derechos y el bienestar de los participantes4. Ello requiere un considerable esfuerzo, en ocasiones insatisfactorio por exceso de burocracia5. Por su parte, los pacientes acostumbran a valorar positivamente la investigación y los beneficios asociados6. Indirectamente, están implicadas otras personas. Con frecuencia los pacientes solicitan la opinión del médico de familia antes de otorgar su CI. Aunque sobre todo es evidente que, para proporcionar una adecuada atención médica, el médico de familia necesita disponer de un mínimo de información sobre la participación de sus pacientes en EC y sobre los fármacos implicados7.
La simple sospecha de que, probablemente sea frecuente que, los participantes en EC tengan una comprensión y un conocimiento insuficiente basta para explorar alternativas que mejoren el proceso del requerido CI8. Hasta ahora, los estudios se han centrado principalmente en la percepción de pacientes o investigadores. Consideramos útil conocer, además, la percepción del médico general y compararla, simultáneamente, con la del resto de implicados. Nuestra hipótesis es que contrastar sus experiencias puede enriquecer la comprensión del CI y permitir detectar áreas de mejora.
El objetivo de este estudio fue conocer las percepciones, opiniones y experiencias de médicos de atención primaria, investigadores y pacientes sobre el proceso del CI en los EC, y el papel desempeñado por el médico de familia. Se contrastaron los cuestionarios con la información que consta en las hojas informativas que acompañan al CI en EC, en las historias clínicas de los pacientes de atención primaria y/o en los informes de alta hospitalaria de los pacientes ingresados.
Material y métodosSe diseñaron 3 cuestionarios específicos, en 2012, dirigidos a médicos de familia, investigadores y pacientes. Para facilitar el acceso, se incluyó a médicos de familia, investigadores principales responsables de EC y pacientes que trabajaban en los centros sanitarios de los autores del estudio (Instituto Catalán de la Salud y Mútua Terrassa). Se garantizó confidencialidad y anonimato.
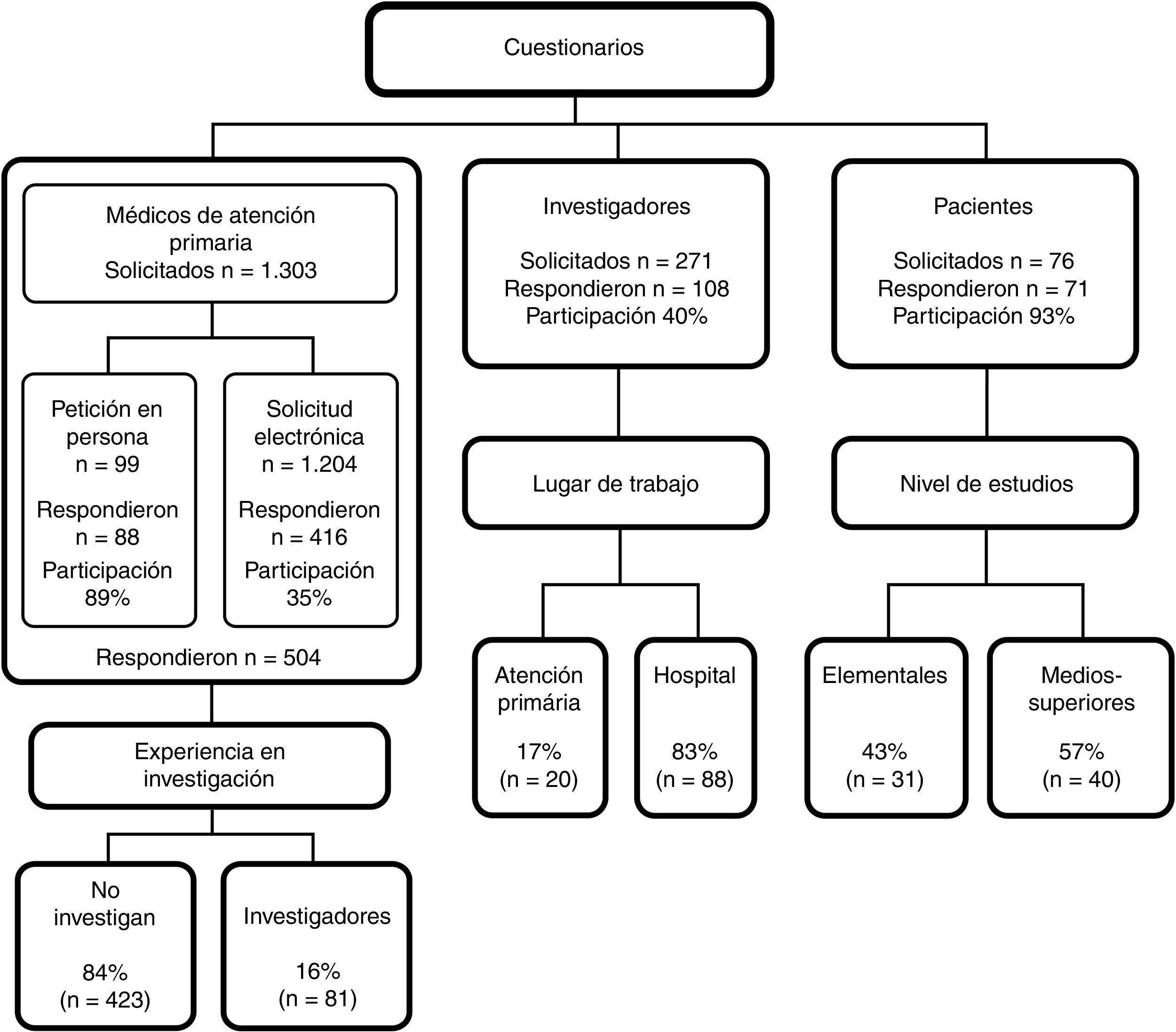
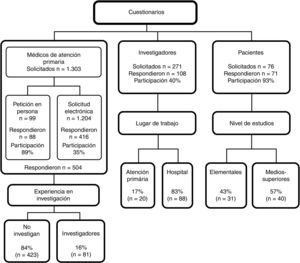
Los cuestionarios se distribuyeron entre septiembre del 2012 y junio del 2013. La participación está detallada en el esquema general del estudio. Cuando se disponía de los datos de contacto, se ofreció la posibilidad de responder personalmente o a través de Google Drive. Cuando se desconocía cómo contactar con los profesionales, para cumplir con la Ley Orgánica 15/1999, de 13 de diciembre, de Protección de Datos de Carácter Personal, se optó por la petición electrónica. Con los pacientes se contactó a través del investigador principal o del médico de familia.
Tras revisar los cuestionarios existentes8,9, y comprobar que no se adaptaban completamente a los objetivos de este estudio, los autores desarrollaron 3 cuestionarios específicos para ser autocumplimentados. Cada cuestionario constaba de 3 secciones: datos sociodemográficos, información sobre EC y sobre el CI. Se realizó una primera validación técnica (comprensión y pertinencia) de los 3 cuestionarios, consultando con expertos en bioética y en metodología de cuestionarios. Seguida de una prueba piloto con 30 participantes de cada grupo (médicos, investigadores y pacientes).
Los investigadores eran médicos del sistema público de salud, que hubieran sido investigadores principales de algún EC durante los últimos 5 años. Se incluyó a pacientes participantes en algún EC o que hubieran participado durante el último año. Se consideró como médico de familia aquel que trabaja en atención primaria: médicos generales, especialistas en medicina de familia y pediatras.
Se revisaron las hojas de CI para averiguar cuántas hacían referencia al médico de atención primaria y qué papel se le asignaba. Concretamente, se revisaron las hojas de información del CI que los pacientes entrevistados entregaron a los autores de este estudio. Y, además, se seleccionó una muestra aleatoria representativa de 45 hojas de información correspondientes a los 84 EC presentados en el CEIC de Mútua Terrassa, en 2011-2014, en los que se consideró que, por sus características, tenía interés clínico informar al médico de familia sobre la participación de pacientes de su cupo. Se excluyeron del análisis aquellos EC de duración breve y limitada a la estancia hospitalaria. Para el cálculo del tamaño muestral se utilizó: alfa 0,05, precisión 10% y proporción estimada del 50%. Además se revisaron los informes de alta de los pacientes participantes en EC con ingreso hospitalario, para comprobar si ello constaba en la historia clínica compartida. Y también se revisaron las historias clínicas de los pacientes participantes en EC de atención primaria, sin ingreso hospitalario.
Este estudio dispone de la conformidad de las diferentes direcciones y de la aprobación de los Comités éticos de investigación clínica de Mútua Terrassa y del Instituto de Investigación en Atención Primaria Jordi Gol.
Análisis estadísticoSe realizó un análisis descriptivo uni y bivariado. Para las variables significativas se establecieron intervalos de confianza (IC) del 95%. En el modelo multivariado de regresión múltiple, se consideró como variable dependiente la satisfacción del médico de familia con la información recibida sobre la participación de sus pacientes en EC y como variables predictivas se incluyeron aquellas que mostraron significación estadística en el análisis bivariado. El nivel de significación estadística se estableció en 0,05. Se utilizó el paquete SPSS 17.0 (SPSS Inc., Chicago, EE. UU.).
ResultadosLa participación se detalla en el esquema general del estudio y las características generales de cada grupo en la tabla 1. Sobre el proceso del CI, los resultados de las variables cuantitativas se muestran en la tabla 2. Los pacientes participantes en EC puntuaron su satisfacción con el proceso del CI con 8,59 puntos, mientras que los médicos de familia puntuaron con 3,54 puntos la información recibida por los investigadores acerca de los pacientes de su cupo.
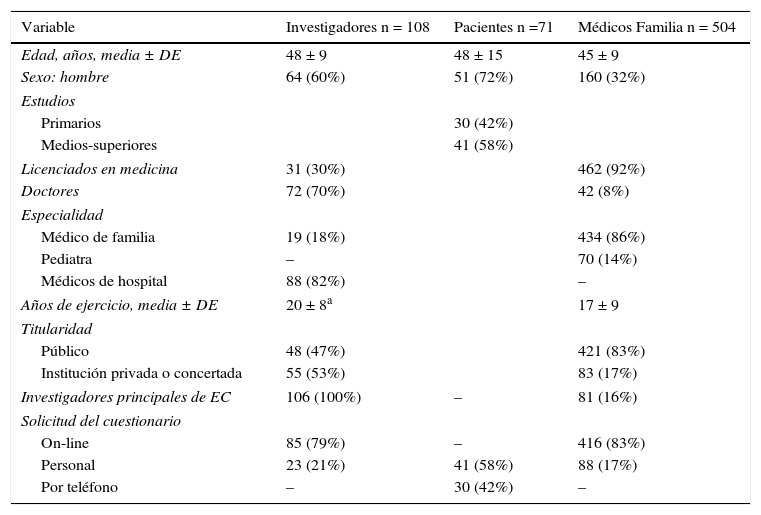
Características generales y sociodemográficas de los 3 grupos estudiados implicados en el proceso de CI en EC: investigadores, pacientes y médicos de familia
| Variable | Investigadores n = 108 | Pacientes n =71 | Médicos Familia n = 504 |
|---|---|---|---|
| Edad, años, media ± DE | 48 ± 9 | 48 ± 15 | 45 ± 9 |
| Sexo: hombre | 64 (60%) | 51 (72%) | 160 (32%) |
| Estudios | |||
| Primarios | 30 (42%) | ||
| Medios-superiores | 41 (58%) | ||
| Licenciados en medicina | 31 (30%) | 462 (92%) | |
| Doctores | 72 (70%) | 42 (8%) | |
| Especialidad | |||
| Médico de familia | 19 (18%) | 434 (86%) | |
| Pediatra | – | 70 (14%) | |
| Médicos de hospital | 88 (82%) | – | |
| Años de ejercicio, media ± DE | 20 ± 8a | 17 ± 9 | |
| Titularidad | |||
| Público | 48 (47%) | 421 (83%) | |
| Institución privada o concertada | 55 (53%) | 83 (17%) | |
| Investigadores principales de EC | 106 (100%) | – | 81 (16%) |
| Solicitud del cuestionario | |||
| On-line | 85 (79%) | – | 416 (83%) |
| Personal | 23 (21%) | 41 (58%) | 88 (17%) |
| Por teléfono | – | 30 (42%) | – |
DE: desviación estándar.
Percepción de investigadores, pacientes y médicos de familia sobre el proceso del CI. Variables cuantitativas, escala de 1 a 10 puntos
| Percepción sobre el proceso del CI | Media ± DE puntos |
| Percepción del investigador (n = 108) | |
| CI: legibilidad y comprensión | 8,03 ± 1,42 |
| Percepción del paciente (n = 71) | |
| CI: legibilidad y comprensión | 7,83 ± 2,22 |
| Satisfacción con el proceso del CI | 8,59 ± 1,63 |
| Satisfacción según tiempo disponible para reflexionar antes de firmar el CI | |
| Dispusieron de unos minutos (52%) | 6,62 ± 3,06 |
| Dispusieron de horas (14%) | 7,89 ± 2,47 |
| Dispusieron de días (34%) | 8,59 ± 1,94 |
| Global (100%) | 7,53 ± 2,73 |
| Comodidad con su participación | 7,30 ± 2,29 |
| Inconvenientes de participar en EC | 2,79 ± 2,15 |
| Percepción del médico de familia (n = 504) | |
| Información recibida de los investigadores sobre los pacientes de su cupo que participan en EC | 3,54 ± 2,53 |
DE: desviación estándar.
De 11 hojas de CI, de distintos EC, entregadas por los 71 pacientes participantes, únicamente una hacía referencia al médico de familia y recomendaba al paciente consultar con él, si lo deseaba, antes de decidir su participación en el EC. Sin embargo, en la muestra aleatorizada de 45 hojas de CI, en el 47% (n = 21) se recomendaba al paciente tomarse tanto tiempo como necesitase, hasta estar absolutamente seguro de su decisión de participar, y que consultase con sus familiares o su médico de familia si lo consideraba adecuado. De los 71 pacientes, 68 participaron en EC con ingreso hospitalario y 3 en EC en atención primaria. Esta participación constaba en el 3% (n = 2) de los 68 informes de alta hospitalaria y en el 33% (n = 1) de las 3 historias clínicas de atención primaria.
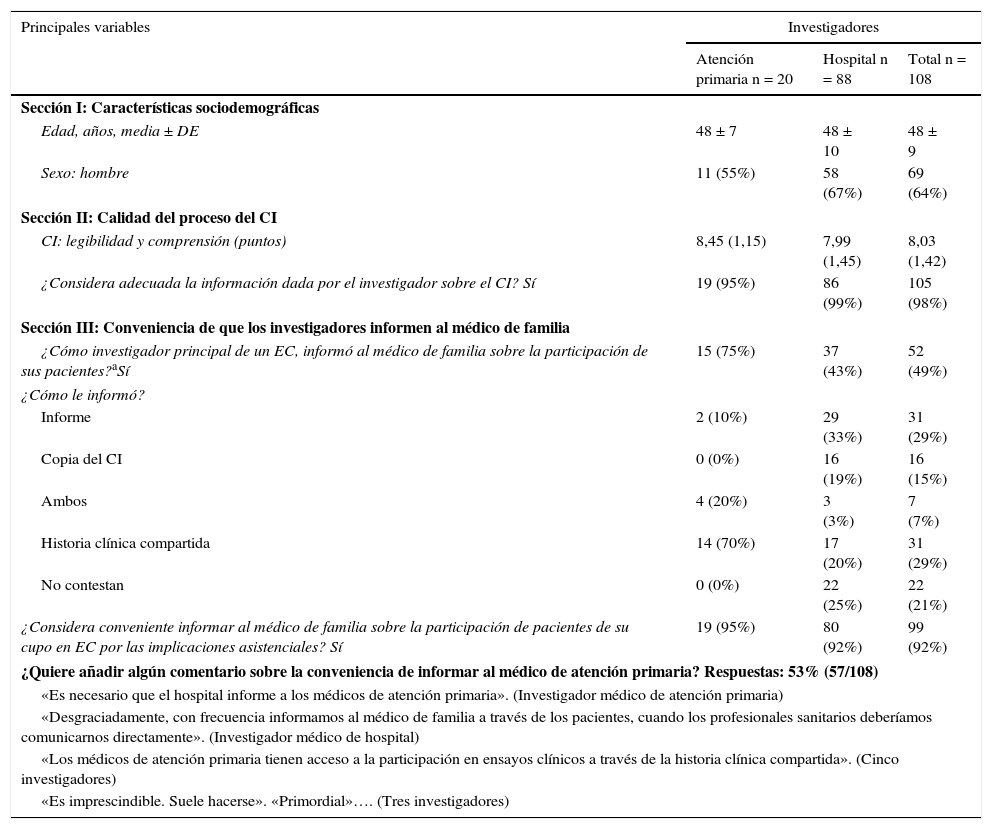
Investigadores principales de ensayos clínicosLas características de los investigadores y su percepción sobre los EC, el proceso de CI y la comunicación con los médicos de familia se muestran en la tabla 3. Los investigadores puntuaron la comprensión de la hoja del CI, de media, con 8,03 puntos. El 92% de los investigadores consideró apropiado, por razones asistenciales, informar al médico de familia sobre los pacientes participantes en EC, y el 49% declaró hacerlo. Cuando el investigador era, además, médico de familia, hubo un 32% más de investigadores que afirmaron informar al médico de familia con respecto a cuando el investigador trabajaba en un hospital (IC del 95%, 11-54%). El 48% (n = 52) respondió a la pregunta abierta sobre cómo mejorar el CI: 28 investigadores propusieron simplificarlo, 6 dedicarle más tiempo, para 3 ya era correcto y 15 hicieron otras propuestas.
Perspectiva del investigador sobre los principales aspectos bioéticos del proceso del CI en EC según su puesto de trabajo
| Principales variables | Investigadores | ||
|---|---|---|---|
| Atención primaria n = 20 | Hospital n = 88 | Total n = 108 | |
| Sección I: Características sociodemográficas | |||
| Edad, años, media ± DE | 48 ± 7 | 48 ± 10 | 48 ± 9 |
| Sexo: hombre | 11 (55%) | 58 (67%) | 69 (64%) |
| Sección II: Calidad del proceso del CI | |||
| CI: legibilidad y comprensión (puntos) | 8,45 (1,15) | 7,99 (1,45) | 8,03 (1,42) |
| ¿Considera adecuada la información dada por el investigador sobre el CI? Sí | 19 (95%) | 86 (99%) | 105 (98%) |
| Sección III: Conveniencia de que los investigadores informen al médico de familia | |||
| ¿Cómo investigador principal de un EC, informó al médico de familia sobre la participación de sus pacientes?aSí | 15 (75%) | 37 (43%) | 52 (49%) |
| ¿Cómo le informó? | |||
| Informe | 2 (10%) | 29 (33%) | 31 (29%) |
| Copia del CI | 0 (0%) | 16 (19%) | 16 (15%) |
| Ambos | 4 (20%) | 3 (3%) | 7 (7%) |
| Historia clínica compartida | 14 (70%) | 17 (20%) | 31 (29%) |
| No contestan | 0 (0%) | 22 (25%) | 22 (21%) |
| ¿Considera conveniente informar al médico de familia sobre la participación de pacientes de su cupo en EC por las implicaciones asistenciales? Sí | 19 (95%) | 80 (92%) | 99 (92%) |
| ¿Quiere añadir algún comentario sobre la conveniencia de informar al médico de atención primaria? Respuestas: 53% (57/108) | |||
| «Es necesario que el hospital informe a los médicos de atención primaria». (Investigador médico de atención primaria) | |||
| «Desgraciadamente, con frecuencia informamos al médico de familia a través de los pacientes, cuando los profesionales sanitarios deberíamos comunicarnos directamente». (Investigador médico de hospital) | |||
| «Los médicos de atención primaria tienen acceso a la participación en ensayos clínicos a través de la historia clínica compartida». (Cinco investigadores) | |||
| «Es imprescindible. Suele hacerse». «Primordial»…. (Tres investigadores) | |||
DE: desviación estándar.
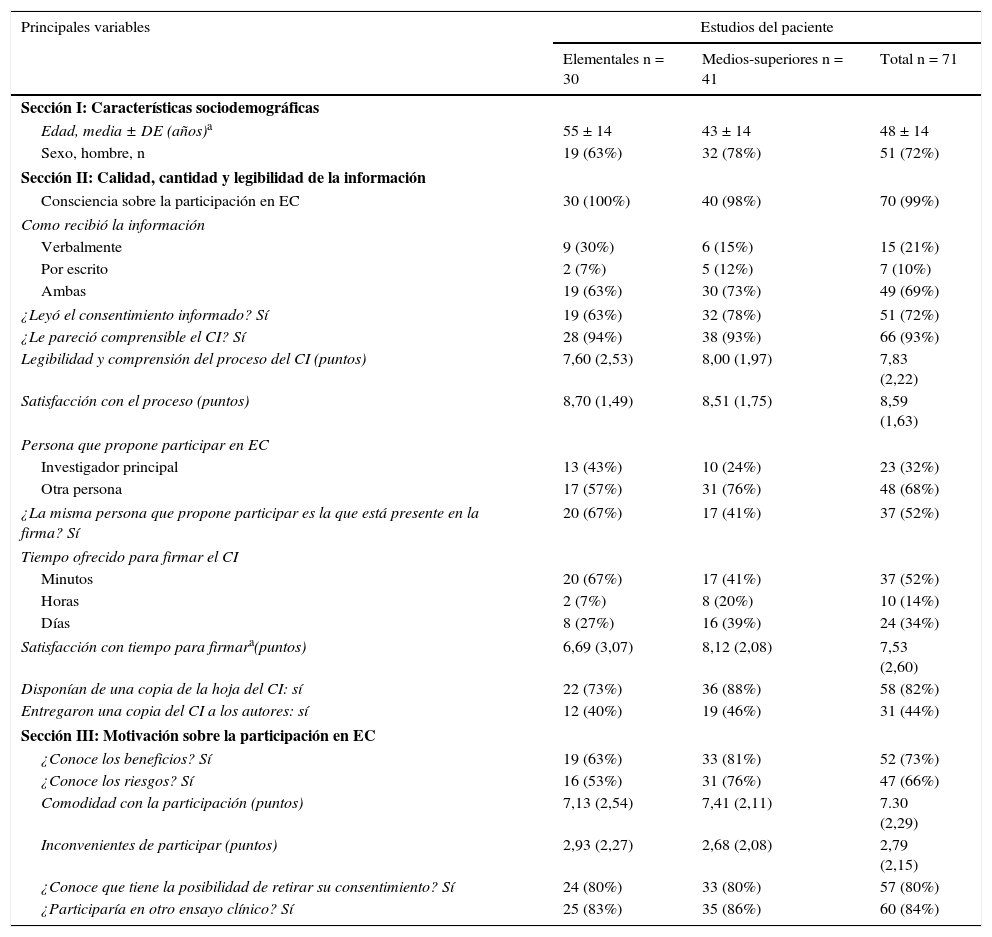
Su percepción se muestra en la tabla 4. El 93% comprendía el CI, y 72% dijeron haberlo leído. El 73% afirmó haber recibido información sobre los beneficios de participar en el EC y el 66% sobre los riesgos. La satisfacción con el proceso del CI fue puntuada, de media, con 8,59 puntos y los inconvenientes de participar con 2,79 puntos.
Perspectiva del paciente participante en EC sobre el proceso del CI según su formación
| Principales variables | Estudios del paciente | ||
|---|---|---|---|
| Elementales n = 30 | Medios-superiores n = 41 | Total n = 71 | |
| Sección I: Características sociodemográficas | |||
| Edad, media ± DE (años)a | 55 ± 14 | 43 ± 14 | 48 ± 14 |
| Sexo, hombre, n | 19 (63%) | 32 (78%) | 51 (72%) |
| Sección II: Calidad, cantidad y legibilidad de la información | |||
| Consciencia sobre la participación en EC | 30 (100%) | 40 (98%) | 70 (99%) |
| Como recibió la información | |||
| Verbalmente | 9 (30%) | 6 (15%) | 15 (21%) |
| Por escrito | 2 (7%) | 5 (12%) | 7 (10%) |
| Ambas | 19 (63%) | 30 (73%) | 49 (69%) |
| ¿Leyó el consentimiento informado? Sí | 19 (63%) | 32 (78%) | 51 (72%) |
| ¿Le pareció comprensible el CI? Sí | 28 (94%) | 38 (93%) | 66 (93%) |
| Legibilidad y comprensión del proceso del CI (puntos) | 7,60 (2,53) | 8,00 (1,97) | 7,83 (2,22) |
| Satisfacción con el proceso (puntos) | 8,70 (1,49) | 8,51 (1,75) | 8,59 (1,63) |
| Persona que propone participar en EC | |||
| Investigador principal | 13 (43%) | 10 (24%) | 23 (32%) |
| Otra persona | 17 (57%) | 31 (76%) | 48 (68%) |
| ¿La misma persona que propone participar es la que está presente en la firma? Sí | 20 (67%) | 17 (41%) | 37 (52%) |
| Tiempo ofrecido para firmar el CI | |||
| Minutos | 20 (67%) | 17 (41%) | 37 (52%) |
| Horas | 2 (7%) | 8 (20%) | 10 (14%) |
| Días | 8 (27%) | 16 (39%) | 24 (34%) |
| Satisfacción con tiempo para firmara(puntos) | 6,69 (3,07) | 8,12 (2,08) | 7,53 (2,60) |
| Disponían de una copia de la hoja del CI: sí | 22 (73%) | 36 (88%) | 58 (82%) |
| Entregaron una copia del CI a los autores: sí | 12 (40%) | 19 (46%) | 31 (44%) |
| Sección III: Motivación sobre la participación en EC | |||
| ¿Conoce los beneficios? Sí | 19 (63%) | 33 (81%) | 52 (73%) |
| ¿Conoce los riesgos? Sí | 16 (53%) | 31 (76%) | 47 (66%) |
| Comodidad con la participación (puntos) | 7,13 (2,54) | 7,41 (2,11) | 7.30 (2,29) |
| Inconvenientes de participar (puntos) | 2,93 (2,27) | 2,68 (2,08) | 2,79 (2,15) |
| ¿Conoce que tiene la posibilidad de retirar su consentimiento? Sí | 24 (80%) | 33 (80%) | 57 (80%) |
| ¿Participaría en otro ensayo clínico? Sí | 25 (83%) | 35 (86%) | 60 (84%) |
DE: desviación estándar.
Se observó una asociación positiva entre los pacientes con estudios universitarios y la percepción de que el investigador dedicaba más tiempo a informarles (p = 0,034). Entre aquellos con estudios primarios hubo un 25% más de pacientes que declararon que el investigador dedicó unos pocos minutos al CI (IC del 95%, 3-48%). Los pacientes con estudios primarios puntuaron, de media, su satisfacción con el tiempo concedido para firmar el CI con 1,43 puntos menos que aquellos con estudios medios-superiores (IC del 95%, 0,21-2,65).
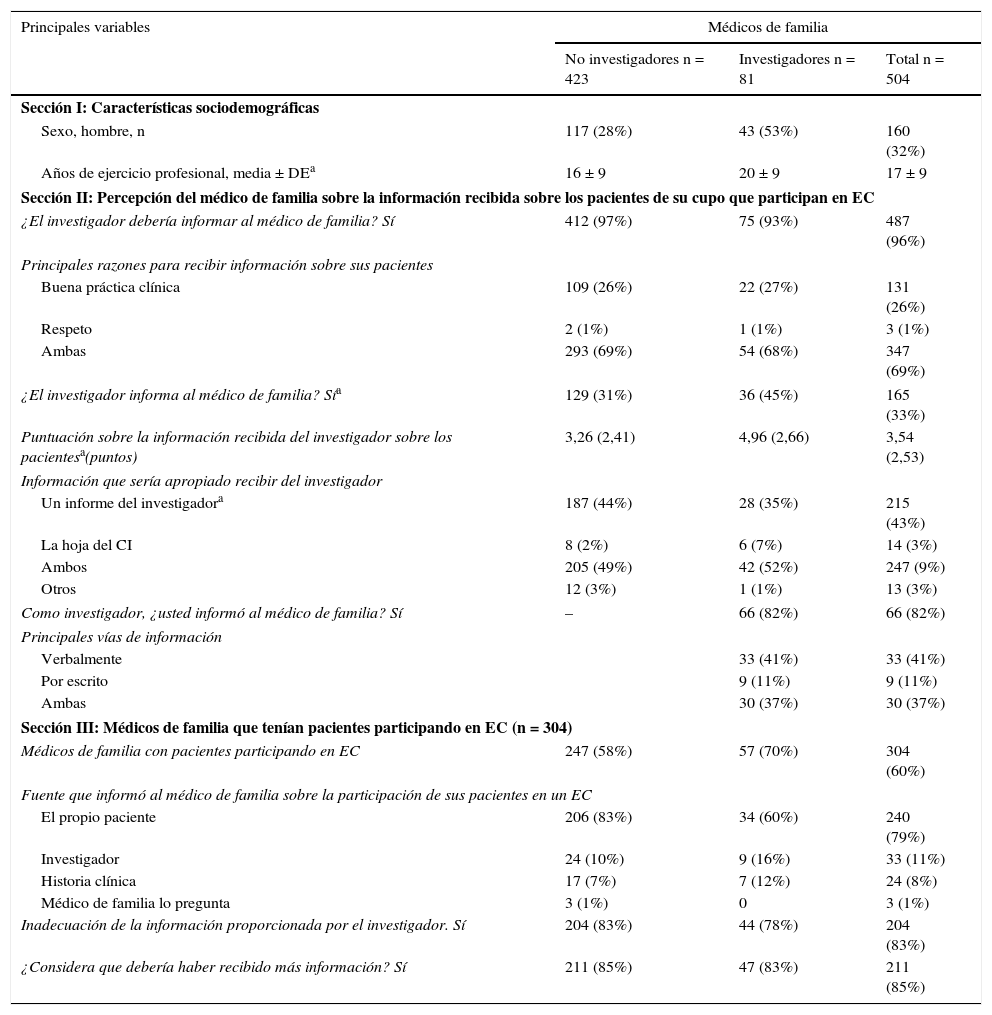
Médicos de atención primariaLas características generales de los médicos de atención primaria y su percepción sobre la información que deberían recibir y que reciben en realidad sobre los pacientes de su cupo participantes en EC se muestran en la tabla 5. Sobre esta percepción influía su condición como investigador de EC. El 96% de los médicos de familia consideró que deberían recibir información sobre los pacientes de su cupo involucrados en EC y la recibía el 33%. Además, entre los médicos de familia, cuando eran investigadores hubo un 14% más de médicos que se consideraron insuficientemente informados comparado con los que no eran investigadores (IC del 95%, 2-26). Los médicos de familia evaluaron la información que reciben del investigador por debajo de 5 puntos. Se observó una relación positiva entre las percepciones sobre la información recibida y la condición de investigador. Los médicos de familia investigadores puntuaron, de media, con 1,7 puntos más la información recibida que los que no eran investigadores (IC del 95%, 1,12-2,29). El 82% de los médicos de familia investigadores consideró que frecuentemente informaban a sus colegas médicos de atención primaria. El 60% de los médicos de familia eran conscientes de tener pacientes en su cupo participantes en EC y, en el 76% de los casos, esa información la recibieron a través del paciente. El 85% consideró insuficiente la información disponible.
Percepción del médico de familia sobre el proceso del CI en EC según su experiencia profesional
| Principales variables | Médicos de familia | ||
|---|---|---|---|
| No investigadores n = 423 | Investigadores n = 81 | Total n = 504 | |
| Sección I: Características sociodemográficas | |||
| Sexo, hombre, n | 117 (28%) | 43 (53%) | 160 (32%) |
| Años de ejercicio profesional, media ± DEa | 16 ± 9 | 20 ± 9 | 17 ± 9 |
| Sección II: Percepción del médico de familia sobre la información recibida sobre los pacientes de su cupo que participan en EC | |||
| ¿El investigador debería informar al médico de familia? Sí | 412 (97%) | 75 (93%) | 487 (96%) |
| Principales razones para recibir información sobre sus pacientes | |||
| Buena práctica clínica | 109 (26%) | 22 (27%) | 131 (26%) |
| Respeto | 2 (1%) | 1 (1%) | 3 (1%) |
| Ambas | 293 (69%) | 54 (68%) | 347 (69%) |
| ¿El investigador informa al médico de familia? Sía | 129 (31%) | 36 (45%) | 165 (33%) |
| Puntuación sobre la información recibida del investigador sobre los pacientesa(puntos) | 3,26 (2,41) | 4,96 (2,66) | 3,54 (2,53) |
| Información que sería apropiado recibir del investigador | |||
| Un informe del investigadora | 187 (44%) | 28 (35%) | 215 (43%) |
| La hoja del CI | 8 (2%) | 6 (7%) | 14 (3%) |
| Ambos | 205 (49%) | 42 (52%) | 247 (9%) |
| Otros | 12 (3%) | 1 (1%) | 13 (3%) |
| Como investigador, ¿usted informó al médico de familia? Sí | – | 66 (82%) | 66 (82%) |
| Principales vías de información | |||
| Verbalmente | 33 (41%) | 33 (41%) | |
| Por escrito | 9 (11%) | 9 (11%) | |
| Ambas | 30 (37%) | 30 (37%) | |
| Sección III: Médicos de familia que tenían pacientes participando en EC (n = 304) | |||
| Médicos de familia con pacientes participando en EC | 247 (58%) | 57 (70%) | 304 (60%) |
| Fuente que informó al médico de familia sobre la participación de sus pacientes en un EC | |||
| El propio paciente | 206 (83%) | 34 (60%) | 240 (79%) |
| Investigador | 24 (10%) | 9 (16%) | 33 (11%) |
| Historia clínica | 17 (7%) | 7 (12%) | 24 (8%) |
| Médico de familia lo pregunta | 3 (1%) | 0 | 3 (1%) |
| Inadecuación de la información proporcionada por el investigador. Sí | 204 (83%) | 44 (78%) | 204 (83%) |
| ¿Considera que debería haber recibido más información? Sí | 211 (85%) | 47 (83%) | 211 (85%) |
DE: desviación estándar.
En relación con la valoración de los médicos de familia sobre la información recibida de parte del investigador sobre los pacientes que participaban en EC, se obtuvo una única variable significativa en el análisis multivariado, ajustando por sexo y años de ejercicio profesional. Concretamente, se encontró una asociación positiva entre la información recibida y la condición de investigador del médico de familia: OR = 1.8 (IC del 95%, 1,1-2,3).
DiscusiónEste estudio proporciona una foto sobre las percepciones de investigadores, pacientes y médicos de familia involucrados en el proceso del CI en EC y las contrasta con la información contenida en las hojas de información de los EC, en los informes de alta hospitalaria y en las historias clínicas de atención primaria. Se evidencia la insatisfacción de los médicos de atención primaria, que consideraron que deberían recibir más información del investigador sobre los pacientes de su cupo participantes en EC, para poder garantizar una asistencia clínica adecuada y la seguridad del paciente, evitando interacciones entre fármacos y/o detectando posibles reacciones adversas que podrían pasar desapercibidas.
Esta insatisfacción contrastó con la satisfacción de los investigadores de EC con el proceso del CI, ya conocida por un estudio nuestro anterior10. Los pacientes, en general, estaban satisfechos (aunque algo menos), valoraron su participación positivamente y minimizaron los inconvenientes. Aun así, la satisfacción de los pacientes aumentó cuanto más tiempo les dedicaron los investigadores al explicar el CI y cuanto más tiempo les ofrecieron para reflexionar. Así, contrastar sus puntos de vista y necesidades específicas permitió detectar áreas de mejora en el CI. Los investigadores deberían encontrar tiempo para discutir en profundidad la información sobre el EC y ofrecer al paciente tiempo suficiente para reflexionar y consultar con quien considere oportuno (amigos, familiares y/o médico de familia).
Con este estudio pretendíamos debatir sobre el papel del médico de familia en el proceso del CI en los EC y la circunstancia de que no siempre disponen de información suficiente sobre los pacientes de su cupo que participan en EC7. Con frecuencia es el paciente quien informa al médico de familia; los propios investigadores reconocen informarles poco.
Entre las limitaciones, resalta que los resultados de los cuestionarios reflejan la percepción y la opinión de los encuestados, y no necesariamente una realidad objetiva. Esto podría explicar, por ejemplo, que la percepción del médico de familia varíe cuando, además, es investigador. Por otra parte, la implicación de los distintos colectivos fue desigual, con mayor participación de los pacientes y menor de los profesionales. Destacó especialmente la dificultad para acceder a pacientes y médicos cumpliendo con la Ley de Protección de Datos, que no permite el acceso directo. Para respetar esta ley, se contactó con los pacientes a través del médico de familia y con los médicos de familia a través del director del centro de atención primaria. En cambio, el acceso a los investigadores sí que fue directo, por ser profesionales conocidos con datos de contacto públicos. En conjunto, consideramos aceptable la participación en este estudio, aunque evidentemente fue mayor al solicitarlo en persona y menor por vía electrónica. Finalmente, al elaborar los cuestionarios se buscó reflexionar sobre los aspectos fundamentales del CI que acompaña a los EC, aunque sin pretender ser exhaustivos.
El CI del paciente que participa en EC es un requisito legal. El investigador debe proporcionar al paciente información clara y completa sobre el EC propuesto para que este libremente pueda decidir11. El CI debería ser un consentimiento comprendido12. Reflexionar sobre cómo mejorar el CI favorece la protección de los derechos del paciente y su seguridad13-21. Existe controversia sobre los beneficios y los riesgos asociados a la simplificación del CI. Simplificarlo facilita comunicar la informacion22, con el peligro de que tras una simplificación excesiva los pacientes infravaloren los riesgos potenciales23. Coincidiendo con otros estudios9,10,24,25, los pacientes confiaban en los médicos y mostraron satisfacción con el CI, en ocasiones incluso sin llegar a leer la hoja de información.
Preocupa averiguar que cuando el médico de familia dispone de información sobre la participación de un paciente de su cupo en un EC, lo más frecuente es que haya sido el propio paciente quien directamente ha informado al médico, principalmente verbalmente. Los médicos de familia mostraron su insatisfacción y consideraron necesario recibir un informe del investigador, por respeto y por buena práctica médica. Al igual que el investigador de un EC necesita conocer si el paciente está tomando otros fármacos, el médico de familia necesita, por la seguridad de sus pacientes7, conocer qué fármacos les están siendo administrados. En la práctica, fue excepcional que el médico de familia recibiese algún informe del investigador, pese a que los investigadores estuvieron de acuerdo en que deberían informarles. Sobre esta percepción del médico de familia influía su condición como investigador. Entre los médicos de familia predominó la insatisfacción con la información que reciben del investigador, pero aquellos que, además eran investigadores, mostraron menor insatisfacción, quizás por su mayor familiaridad con el funcionamiento de los EC.
Las percepciones de investigadores, pacientes y médicos de familia nos permiten concienciarnos de las necesidades y expectativas de cada grupo22. Resulta beneficioso contrastar puntos de vista y experiencias de pacientes, médicos de familia e investigadores, y podría enriquecer la comprensión del proceso del CI, mejorar la comunicación entre ellos14,24,25, y crear sinergias26-30.
Tomar la decisión de participar en un EC es un asunto importante, y las necesidades y expectativas del paciente no siempre coinciden con las de investigadores y médicos. Mientras tanto, el médico de familia precisa poder acceder a la información básica sobre el EC para proporcionar una asistencia sanitaria segura y de calidad. Por lo tanto, pese a que la ley no obligue a hacerlo, consideramos que facilitar la participación del médico de familia en el proceso del CI beneficia a todos.
Aprobación éticaEste estudio dispone de la conformidad de las diferentes direcciones y se ha realizado con la aprobación de los Comités éticos de investigación clínica de Mútua Terrassa y de IDIAP Jordi Gol i Gurina.
- –
La necesidad de investigación biomédica y de ensayos clínicos está bien establecida.
- –
Obtener el consentimiento informado es una piedra angular de la bioética.
- –
Este estudio analiza el punto de vista de pacientes, investigadores y médicos de familia que participan en el proceso del consentimiento informado.
- –
Mientras que los investigadores y los pacientes expresan satisfacción con el proceso, los médicos de familia declaran sentirse insatisfechos con la información que reciben sobre la participación de los pacientes de su cupo en ensayos clínicos.
- –
Facilitar la participación del médico de familia en el proceso del consentimiento informado beneficiaria a todos los implicados.
Ninguno que declarar.
Los autores quieren agradecer a Patricia Vigués la corrección del resumen en inglés, y a Manel Martori y Xavier Díaz por su ayuda con los gráficos. Agradecer también a Jesús Almeda, Montse Gavagnach, Eugenia Negredo, Carmen Riera y Concepción Violan, por su generosa colaboración para aumentar la participación de pacientes y profesionales. Nuestro agradecimiento también a los pacientes y a los profesionales que han cooperado en este estudio.