Evaluar el perfil de prescripción y los usos off-label (fuera de ficha técnica [FT]) y unlicensed (medicamentos no autorizados específicamente para niños) de medicamentos a nivel ambulatorio.
DiseñoEstudio transversal.
EmplazamientoConsultas de pediatría de 2 centros de salud urbanos y sala de urgencia general del Hospital Materno-Infantil de Málaga.
ParticipantesNiños de 0-14años que acudiesen a consulta y se les prescribiese al menos un medicamento.
Mediciones principalesVariables sociodemográficas, motivo de consulta y medicación. Clasificación de las prescripciones según información contenida en FT.
ResultadosSe incluyeron un total de 388 niños, una submuestra de 105 (27%) atendidos en urgencias, y se valoraron 462 prescripciones, que involucraron 74 principios activos diferentes. Cada niño recibió un promedio de 1,7 fármacos (IC95%: 1,6-1,9), siendo los más prescritos ibuprofeno, paracetamol, amoxicilina-clavulánico y budesonida. El grupo terapéutico más empleado y con mayor variedad de fármacos fue el respiratorio. El 27,4% de las prescripciones (IC95%: 23,5-31) fueron off-label, constituyéndose como causa más frecuente el uso del fármaco para una edad distinta de la autorizada (60%; IC95%: 54,1-63), seguida de distinta dosis (21,5%; IC95%: 18-25), diferente indicación (12%; IC95%: 9,2-15) y el 7% por distinta vía de administración (IC95%: 5,4-10).
ConclusionesLa tasa de usos off-label presenta cifras intermedias, pudiendo recibir este tipo de prescripciones una tercera parte de los niños. Esto no significa que sean prescripciones incorrectas, pero es recomendable respaldarlas con la mejor evidencia, así como seguir las directrices de la normativa sobre medicamentos en situaciones especiales.
to evaluate the prescription profile and to assess the off-label and unlicensed uses of medicines among non-hospitalised pediatric patients.
Designcross-sectional study.
Settingpediatric units in two urban health centers and general emergency room (Hospital Materno-Infantil, Málaga).
Main measurementssociodemographics variables, reasons for consultation and information about therapeutic medications. The classification of prescriptions was established according to information requirements contained in the Summary of Products Characteristics (SPC).
ResultsA total of 388 children were included (a subsample of 105 treated in the emergency room). Four hundred sixty-two prescriptions (involving 74 different active ingredients) were evaluated. Each infant received and average of 1,7 drugs (95% CI: 1,6-1,9). The most prescribed medicines were ibuprofen, paracetamol, amoxicillin-clavulanate and budesonide. The therapeutic group with the greatest variety of drugs was the respiratory group. 27,4% (95% CI: 23,5-31) of prescriptions were off-label and the main cause was different age (60%; 95% CI: 54,1-63), followed by different dose (21,5%; 95% CI: 18-25), different indication (12%; 95% CI: 9,2-15) and different route of administration (7%; 95% CI: 5,4-10).
ConclusionsThe rate of off-label uses presents intermediate figures. Around one third of the paediatric outpatients in our sample are exposed to at least one off-label or unlicensed prescription. We should, however, point out that such usage is based on scant official, quality information, although it is not necessarily incorrect. Evidence-based medicine should be encouraged to improve drug therapy in children, as well as following the rules on drugs in special situations.
Antes de que un medicamento esté disponible en el mercado ha debido demostrar, en base a los estudios adecuados, un balance beneficio-riesgo favorable. Sin embargo, tradicionalmente los ensayos clínicos han sido muy escasos en la población pediátrica debido a dificultades de índole principalmente ética y metodológica. Como consecuencia, la información de calidad sobre los efectos de los fármacos en los niños es escasa.
La ficha técnica (FT) es un documento específico requerido por las autoridades sanitarias antes de que cualquier medicamento sea autorizado para su comercialización. Este resumen es una descripción definitiva del producto en sus propiedades químicas, farmacéuticas, farmacológicas y de uso clínico. Es una parte intrínseca del proceso de autorización del fármaco por parte de las Agencias del Medicamento y constituye la base de información, destinada a los profesionales de la salud, sobre cómo usar de forma eficaz y segura el medicamento. Sin embargo, debido a la falta de evidencia o a retrasos en las actualizaciones de las FT, las recomendaciones pediátricas en muchas ocasiones están ausentes. Esto fuerza de algún modo a que los clínicos empleen frecuentemente en los niños medicinas que no han sido aprobadas para dicha población, o bien que las usen en condiciones distintas a las autorizadas en la FT. Y aunque en muchas ocasiones estas prescripciones pueden estar sustentadas por un buen nivel de evidencia, también se las ha relacionado con un mayor riesgo de reacciones adversas1.
La prevalencia de los usos conocidos como off-label (o FFT: fuera de ficha técnica) y unlicensed (medicamentos no aprobados para niños) se ha estudiado en los últimos años, pero con resultados muy dispares2,3. Aunque pueden encontrarse otros criterios, los más referenciados califican de uso off-label el correspondiente al empleo de medicinas aprobadas para niños pero prescritas en condiciones diferentes a las autorizadas en su FT, en términos de distinta indicación, dosis, rango de edad o vía de administración4.
La mayor parte de estudios sobre este tema se han realizado en unidades de cuidados intensivos y en salas de neonatología. Sin embargo, hay un menor número de estudios realizados en atención primaria, cuando es el ámbito en el que mayor cantidad de prescripciones se realiza. Y aunque la frecuencia de estos usos es menor a nivel ambulatorio, su impacto puede ser de relevancia debido a la mayor cantidad de niños atendidos a este nivel. Además, particularmente en España, las publicaciones sobre este tema son muy escasas y realizadas a un nivel distinto de la atención primaria5,6.
El objetivo del presente trabajo ha sido determinar el perfil de prescripción y la prevalencia de los usos off-label o FFT en pacientes pediátricos a nivel de atención primaria.
Pacientes y métodosDiseño y ámbitoEstudio transversal realizado en 4 consultas de pediatría de 2 centros de salud urbanos y en la sala de urgencias del Hospital Materno-Infantil, ambos en la ciudad de Málaga. Esta sala de urgencias es para tratamiento de casos que no requieren ingreso; no se trata de cuidados intermedios o graves, sino de una sala general. Para tener en cuenta la influencia estacional, se hicieron 2 cortes, uno en enero-febrero y otro en mayo-junio de 2011, estando la muestra repartida entre ambos periodos.
Población de estudioDurante una serie de días aleatorizados, se incluyeron consecutivamente los pacientes de entre 0 y 14años en cuya visita se indicara alguna prescripción farmacológica.
MedicionesRecogimos la edad, el peso y el motivo de consulta, así como los datos referidos al tratamiento farmacológico: indicación, dosis, frecuencia, forma farmacéutica y vía de administración. La fuente de datos fue la historia clínica individual y las recetas. Los medicamentos fueron agrupados de acuerdo con el índice ATC (Anatomical Therapeutic Chemical classification index).
Todas las prescripciones recogidas fueron clasificadas en 3 categorías: FFT (off-label), unlicensed y de acuerdo con FT, según la información que sobre su uso pediátrico apareciese contenida en la FT de los medicamentos. La FT es de fácil acceso y está disponible para todos los profesionales sanitarios en la página web de la Agencia Española del Medicamento y Productos Sanitarios (AEMPS) mediante la aplicación CIMA (Centro de Información online de Medicamentos de la AEMPS: http://www.aemps.gob.es/cima/fichasTecnicas.do). Así, se clasificaron «de acuerdo con FT» todas aquellas prescripciones que coincidían completamente con la FT en la indicación del uso, rango de edad, dosificación y vía de administración empleados. Se catalogaron como «usos FFT» las prescripciones de fármacos aprobados para niños pero que se emplearan para una enfermedad o proceso diferente a la indicación reflejada en FT, o bien para niños con edad diferente (habitualmente menor) a la autorizada en dicho documento oficial, o en dosis/vía diferentes a las recomendadas. Las prescripciones «unlicensed» recogían usos de fármacos en cuya FT estuviese específicamente contraindicado el uso del fármaco en niños, o que no viniese contemplada información alguna sobre uso pediátrico, o bien que se realizase una modificación del preparado para adaptarlo a los niños de menor edad (formulación magistral tipo papelillos o jarabes, por ejemplo). La clasificación de todas las prescripciones fue hecha por cada uno de los autores de forma independiente y posterior acuerdo conjunto, con una concordancia total, puesto que la FT es un documento claro y bien ordenado en la información que ofrece. Los criterios empleados han sido los publicados por Turner et al.4 (mayoritariamente citados en la literatura), que categorizaba como off-label las prescripciones realizadas en dosis, rango de edad, vía de administración o indicaciones distintas a las reflejadas en la documentación oficial de autorización del fármaco. Y entre las categorías de unlicensed se incluían los agentes terapéuticos aún no autorizados, los contraindicados específicamente en niños, la modificación de los preparados y aquellos en los que no constase información alguna sobre su uso pediátrico.
AnálisisEstadística descriptiva con cálculo de intervalos de confianza al 95%, utilizando el software SPSS 19.0 (Chicago, Illinois).
Aspectos éticosEstudio sin intervención, con anonimización de los datos de carácter personal y centrado básicamente en las prescripciones farmacológicas. El estudio cuenta con dictamen favorable del Comité Ético de Investigación.
ResultadosSe incluyeron un total de 388 pacientes ambulatorios (54% varones), con una media de edad de 4,8±3,6años (IC95%: 4,1-5,2años) (rango: 22días-14años). De ellos, 105 fueron atendidos en la sala de urgencias hospitalaria (27%). No hubo diferencias significativas en cuanto a la edad y el sexo entre los centros de salud y la sala de urgencias.
En el 65% de los casos no existían antecedentes de patología. Como enfermedades previas únicamente se detectó un 10% de hiperreactividad bronquial-asma y un 5% de bronquiolitis. Los principales motivos de consulta fueron las causas de origen respiratorio (45%), seguidas de las dermatológicas (12,7%) y otitis (12%). No hubo diferencias significativas entre ambos ámbitos, salvo la mayor presencia de bronquiolitis en la urgencia hospitalaria (72% vs 28%) (p<0,05).
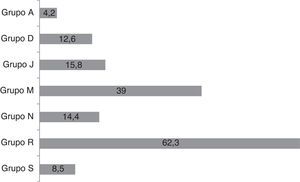
Se realizaron un total de 462 prescripciones, que involucraron a 74 principios activos y 107 medicamentos diferentes. Cada niño recibió un promedio de 1,7 fármacos (IC95%: 1,6-1,9). Los fármacos individualmente más prescritos fueron ibuprofeno, paracetamol, amoxicilina-clavulánico y budesonida. La figura 1 muestra los grupos terapéuticos más empleados. Los fármacos del grupo R (respiratorio) fueron los más ampliamente utilizados, seguidos de los de los grupos M (musculoesquelético), en el que predominó ibuprofeno; J (antiinfecciosos de uso sistémico), entre los que se encuentran amoxicilina-clavulánico, amoxicilina y azitromicina; N (sistema nervioso), principalmente paracetamol, y grupo D (dermatológico). El grupo R no es solo el que más se prescribe, sino también el que mayor número y variedad de principios activos incluyó (hasta 19). Hubo cierta influencia estacional en la selección de los medicamentos, ascendiendo un 17% el uso de los productos dermatológicos en verano y descendiendo los del grupo R un 19%.
Grupos terapéuticos más prescritos según clasificación ATC (Anatomical, Therapeutic, Chemical classification system). A: sistema digestivo y metabolismo; D: dermatológicos; J: antiinfecciosos de uso sistémico; M: sistema musculoesquelético; N: sistema nervioso; R: sistema respiratorio; S: órganos de los sentidos.En % de niños que reciben algún fármaco del grupo; n=388 niños.
El 28% (IC95%: 25,5-33) de los niños recibieron algún medicamento sin FT. Se trata de viejos fármacos, como por ejemplo las gotas oftálmicas de gentamicina asociada a dexametasona, o los supositorios de glicerina.
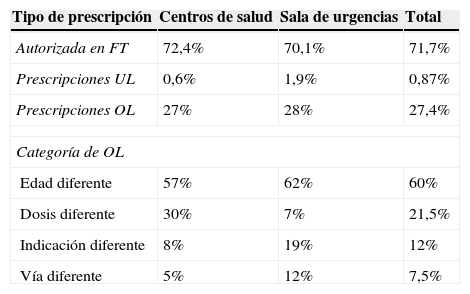
De las 462 prescripciones evaluadas, el 27,4% (IC95%: 23,5-31) fueron off-label, mientras que las de la categoría unlicensed estuvieron por debajo del 1%. Dos de las cuatro prescripciones unlicensed se debieron a la preparación en la farmacia de jarabe de dexametasona. El número de prescripciones off-label por niño osciló entre 0 y 3 (media, 0,39; IC95%: 0,30-0,48), mientras que las unlicensed entre 0 y 1 (media, 0,01; IC95%: 0,0-0,02). La frecuencia de las prescripciones off-label no mostró diferencias estadísticamente significativas entre los niños atendidos en los centros de salud y los atendidos en la sala de urgencias (27 y 28%, respectivamente). De los 388 niños incluidos, tuvieron al menos una prescripción off-label o unlicensed el 34,3% (IC95%: 29,6-39).
El empleo del fármaco en una edad distinta de la autorizada fue la causa de usos off-label en el 60% de los casos (IC95%: 54,1-63), seguida de distinta dosis en el 21,5% (IC95%: 18-25), diferente indicación en el 12% (IC95%: 9,2-15), y el 7% por uso de distinta vía de administración (IC95%: 5,4-10). Hubo algunas diferencias en el patrón de estas categorías entre las prescripciones de los centros de salud y las de la sala de urgencias, detectándose mayor proporción de off-label por dosis en las consultas extrahospitalarias y mayor proporción de off-label por indicación en las urgencias hospitalarias (tabla 1). Como ejemplos de off-label categoría edad se encontraron los usos de budesonida o dextrometorfano en menores de 2años, o el de paracetamol 650mg en menores de 14años; como ejemplo frecuente de infradosificación según peso, el jarabe de ibuprofeno al 2%. Los usos de budesonida o salbutamol en bronquiolitis supusieron casos de off-label por distinta indicación, como también lo fue el empleo de ondansetrón para los vómitos por gastroenteritis. Finalmente, como ejemplo de distinta forma de uso fue aerosolizar budesonida o salbutamol. El grupo farmacológico más implicado en usos off-label fue el R (63%), sobre todo en la categoría de edad, seguido del M y del J (18% en ambos casos), pero estos por distinta dosis.
Clasificación de prescripciones (n=462) basada en las condiciones autorizadas en la FT
| Tipo de prescripción | Centros de salud | Sala de urgencias | Total |
|---|---|---|---|
| Autorizada en FT | 72,4% | 70,1% | 71,7% |
| Prescripciones UL | 0,6% | 1,9% | 0,87% |
| Prescripciones OL | 27% | 28% | 27,4% |
| Categoría de OL | |||
| Edad diferente | 57% | 62% | 60% |
| Dosis diferente | 30% | 7% | 21,5% |
| Indicación diferente | 8% | 19% | 12% |
| Vía diferente | 5% | 12% | 7,5% |
FT: ficha técnica; OL: off-label; UL: unlicensed.
Pensamos que con este trabajo podemos contribuir al objetivo de la Directiva Europea sobre Medicamentos Pediátricos de promover la evaluación del uso de fármacos en niños, recogiendo datos en todos los Estados miembros para ir creando de este modo la base para futuras comparaciones y para la detección de las áreas con mayor necesidad de investigación7.
Entre las limitaciones del estudio hemos de reconocer que nuestra muestra no puede ser considerada como representativa de toda la población pediátrica, aunque pensamos que sí puede reflejar adecuadamente los hábitos de prescripción en atención primaria. Hemos intentado valorar prescripciones sobre niños ambulatorios que acudan no solo a los centros de salud, sino también a la sala de urgencias hospitalaria, así como controlar la posible influencia estacional. En este sentido, según nuestros resultados, en verano no hubo una significativa menor prescripción de fármacos, aunque sí cambió el perfil de forma coherente con las patologías más frecuentes en cada estación.
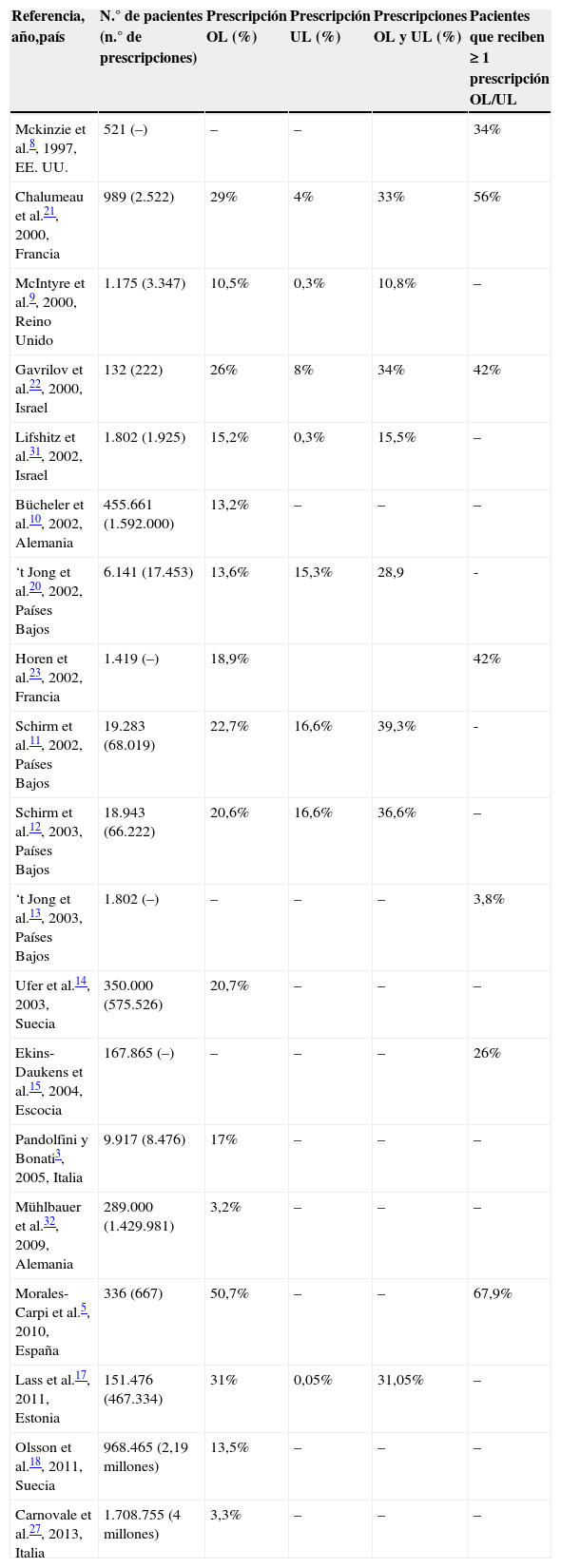
El principal problema para la comparabilidad de los datos es la importante heterogeneidad existente entre las distintas publicaciones, tanto en la clasificación de off-label y unlicensed, como en la metodología, y las fuentes de datos. Al contrario de lo que ocurre en los estudios de salas hospitalarias, la mayor parte de los trabajos realizados sobre pacientes ambulatorios se basan en registros de datos farmacéuticos, que aportan un importantísimo volumen de prescripciones pero que, como contrapartida, no suelen tener disponibles todas las variables de interés. La indicación clínica del tratamiento es un dato muy relevante que en la mayor parte de estos estudios sobre registros farmacéuticos se encuentra ausente8-18, aunque también pueden faltar las dosificaciones8,10-14,18,19, e incluso ambos criterios. Este hecho les confiere un sesgo de clasificación al poderse infraestimar la verdadera tasa de off-label. En nuestro estudio hemos recogido todos los datos de interés para poder aplicar de forma completa los criterios de clasificación. En la revisión que hemos realizado sobre los estudios a nivel ambulatorio, solo en 5 de ellos se recogieron todos los criterios5,20-23. Por otro lado, debe señalarse que hay estudios cuyo objetivo principal se centró a priori en un único criterio, como la edad8,13; en un único fármaco, como por ejemplo el paracetamol24; en un grupo terapéutico, como el grupo R25, o en una patología concreta, como el asma16. Teniendo en cuenta lo comentado, se entiende que los resultados de los distintos trabajos sean muy dispares. En una revisión de 2005 se concluyó que los usos off-label/unlicensed se encontraban entre el 11 y el 37% de las prescripciones3, datos similares a los revisados un año más tarde por Cuzzolin et al.26, quienes aportó el dato de que, en la comunidad, entre el 3,8 y el 56% de los niños, según el estudio y el país, podían recibir al menos una de estas prescripciones. En la tabla 2 se muestra una comparativa de las prevalencias detectadas hasta la fecha. En nuestro caso, algo más de la tercera parte de los pacientes (34%) recibían al menos una prescripción off-label/unlicensed, cifra intermedia y muy similar a la hallada recientemente por Lass et al.17 en Estonia, y previamente por Chalumeau et al.21 en Francia o Schirm et al.11 en Holanda. La prevalencia más baja se corresponde con un estudio sobre base de datos pero con ausencia de información sobre dosificaciones e indicaciones27. Las tasas más elevadas, detectadas en un trabajo realizado en Urgencias en otra región de España, podrían explicarse por el uso de otro sistema de clasificación, que entre las causas de off-label incorpora las contraindicaciones y la falta de información5.
Resumen de los estudios sobre prescripciones OL y/o UL en pacientes pediátricos ambulatorios
| Referencia, año,país | N.° de pacientes (n.° de prescripciones) | Prescripción OL (%) | Prescripción UL (%) | Prescripciones OL y UL (%) | Pacientes que reciben ≥1 prescripción OL/UL |
|---|---|---|---|---|---|
| Mckinzie et al.8, 1997, EE.UU. | 521 (–) | – | – | 34% | |
| Chalumeau et al.21, 2000, Francia | 989 (2.522) | 29% | 4% | 33% | 56% |
| McIntyre et al.9, 2000, Reino Unido | 1.175 (3.347) | 10,5% | 0,3% | 10,8% | – |
| Gavrilov et al.22, 2000, Israel | 132 (222) | 26% | 8% | 34% | 42% |
| Lifshitz et al.31, 2002, Israel | 1.802 (1.925) | 15,2% | 0,3% | 15,5% | – |
| Bücheler et al.10, 2002, Alemania | 455.661 (1.592.000) | 13,2% | – | – | – |
| ‘t Jong et al.20, 2002, Países Bajos | 6.141 (17.453) | 13,6% | 15,3% | 28,9 | - |
| Horen et al.23, 2002, Francia | 1.419 (–) | 18,9% | 42% | ||
| Schirm et al.11, 2002, Países Bajos | 19.283 (68.019) | 22,7% | 16,6% | 39,3% | - |
| Schirm et al.12, 2003, Países Bajos | 18.943 (66.222) | 20,6% | 16,6% | 36,6% | – |
| ‘t Jong et al.13, 2003, Países Bajos | 1.802 (–) | – | – | – | 3,8% |
| Ufer et al.14, 2003, Suecia | 350.000 (575.526) | 20,7% | – | – | – |
| Ekins-Daukens et al.15, 2004, Escocia | 167.865 (–) | – | – | – | 26% |
| Pandolfini y Bonati3, 2005, Italia | 9.917 (8.476) | 17% | – | – | – |
| Mühlbauer et al.32, 2009, Alemania | 289.000 (1.429.981) | 3,2% | – | – | – |
| Morales-Carpi et al.5, 2010, España | 336 (667) | 50,7% | – | – | 67,9% |
| Lass et al.17, 2011, Estonia | 151.476 (467.334) | 31% | 0,05% | 31,05% | – |
| Olsson et al.18, 2011, Suecia | 968.465 (2,19 millones) | 13,5% | – | – | – |
| Carnovale et al.27, 2013, Italia | 1.708.755 (4 millones) | 3,3% | – | – | – |
OL: off-label (fuera de ficha técnica); UL: unlicensed; –: no se indica.
En la mayor parte de los estudios la categoría más frecuente de off-label fue la dosis5,9,15,20,22. En nuestro caso, coincidiendo con Chalumeau et al.21, el principal motivo fue la edad. Este hecho es razonable si tenemos en cuenta que el 70% de los niños de nuestro estudio eran menores de 6años, y que el 37% estaba por debajo de los 2años, edades en las que en muchas ocasiones en la FT no viene garantizado el uso de determinados fármacos. Por otro lado, los motivos de off-label por indicación tuvieron diferente sustento en la evidencia: mientras que el uso de ondansetrón en gastroenteritis está apoyado por ensayos clínicos28, los corticoides inhalados y el salbutamol no están claramente recomendados en las bronquiolitis, según guías recientes29.
Los fármacos más implicados en los usos off-label coincidían con los más prescritos (antiasmáticos, antiinflamatorios y antibióticos), y fueron diferentes a los fármacos mayormente responsables de las prescripciones off-label en otros países como Alemania, Suecia y Estonia, donde predominan los medicamentos tópicos y dermatológicos10,14,17,18. Tampoco en nuestra muestra hubo un uso frecuente de hormonas sexuales, otra causa frecuente de off-label en otros estudios18, probablemente por la menor frecuentación de pacientes adolescentes en las consultas de atención primaria, y también porque el corte de edad en España para atención pediátrica es menor. En cuanto a los usos unlicensed, las cifras obtenidas son las más bajas de todas las revisadas. No se prescribieron fármacos no autorizados, y apenas se realizaron modificaciones de los preparados. Este hecho contrasta con cifras de hasta un 16,6% en países como Holanda, en los que hay mayor tradición de formular o adaptar preparados propios en las farmacias20.
Según nuestros resultados, podemos decir que la exposición a fármacos en los niños es menor que en otras series, que el perfil de uso es coherente con los motivos de consulta, que los antibióticos no se constituyen como el grupo más empleado (15% de los niños), que la tasa de off-label es intermedia, y que apenas hay prescripciones unlicensed.
Estos usos FFT no necesariamente implican un uso incorrecto; en muchas ocasiones son la mejor opción clínica, lo que ocurre es que no hay datos suficientes sobre eficacia y seguridad como para poder garantizar su autorización, y por tal motivo no aparecen reflejados en la FT. Es importante recordar en este punto la importancia legal de la FT y las posibles implicaciones derivadas de la prescripción de medicamentos en condiciones distintas de las autorizadas, que en caso de reclamaciones quedarían fuera de la responsabilidad de las compañías farmacéuticas y de las garantías de las Agencias de Medicamentos. Creemos por tanto que es de interés difundir el modo por el cual deben hacerse estas prescripciones, contempladas en el Real Decreto de disponibilidad de medicamentos en situaciones especiales30, y que podemos sintetizar en 2 requisitos: justificar o reflejar su uso en la historia clínica e informar a los padres, obteniendo su consentimiento, al menos verbal. Entendemos que la ficha técnica es un documento que no siempre se consulta y conocemos la escasez de tiempo disponible en consulta. Pero pensamos que es recomendable seguir la normativa vigente y apoyar las prescripciones en guías o protocolos con la mejor evidencia disponible.
- -
Es sabido que los ensayos clínicos en población pediátrica han sido escasos y que la información sobre el uso de los medicamentos en niños es mínima o está ausente en muchos casos.
- -
Los usos de fármacos off-label o fuera de ficha técnica en niños es algo estudiado principalmente a nivel hospitalario, sobre todo en neonatos. Y está demostrada su relación con un mayor riesgo de sufrir reacciones adversas a medicamentos.
- -
En España hay muy pocos estudios, y ninguno centrado en la atención primaria.
- -
Valores de prevalencia de prescripciones fuera de ficha técnica (27,4%). Alrededor de la tercera parte de los niños a nivel ambulatorio pueden recibir una prescripción off-label o unlicensed. Con ello aportamos datos sobre utilización de fármacos en niños, algo requerido desde la Directiva Europea de medicamentos pediátricos.
- -
Una revisión y comparativa con los estudios realizados a este nivel.
- -
Una actualización sobre los aspectos legales de la prescripción fuera de los términos contemplados en la ficha técnica de los medicamentos.
Ninguna fuente de financiación, pública ni privada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.