Introducción
En los años sesenta del pasado siglo xx se tenía constancia de la existencia de dos tipos de hepatitis víricas: la «hepatitis infecciosa», de corto período de incubación y propagación a través de la vía digestiva, y la denominada «hepatitis sérica o de la jeringuilla», de largo período de incubación y transmisión parenteral. Estas hepatitis, actualmente denominadas A y B, respectivamente, son producidas por los virus del mismo nombre. Además de ellos, otros virus tienen al hígado como órgano diana: virus C, D o delta, E y G. Así mismo, determinados agentes víricos pueden dar lugar a manifestaciones hepáticas, aunque el cuadro clínico habitual derive de la afectación de otros órganos y sistemas.
Hepatitis A
Enfermedad producida por el virus de la hepatitis A (VHA), virus ARN de 27 nm de diámetro, de la familia de los picornavirus y género Hepardaviridae (hepa-ARN-virus). El VHA carece de cubierta. Es resistente a la acción de los agentes externos.
La epidemiología de la hepatitis A ha variado notablemente en los últimos años debido al cambio experimentado en la edad de la infección, atribuible a la mejoría de las condiciones generales de higiene y saneamiento del medio. En áreas geográficas desarrolladas, la enfermedad afecta principalmente a adolescentes y adultos jóvenes, con un coste sanitario y social elevado. Al no disponerse de tratamiento etiológico, las medidas preventivas resultan especialmente eficaces para controlar la enfermedad. Entre un 8 y un 10% de los pacientes adultos que adquieren la infección y que previamente padecían una enfermedad hepática de origen alcohólico o vírico puede recidivar una vez finalizada la fase aguda o evolucionar de forma fulminante, con una letalidad del 0,1% en los menores de 14 años, del 0,3% en los de 15 a 39 años y del 2,1% en los mayores de 40 años1.
La estrategia preventiva para reducir de forma significativa el número de casos de enfermedad sería la vacunación universal. El problema fundamental es el coste, relativamente elevado, de la vacuna2. La disponibilidad de una vacuna combinada A + B ha reducido los costes de la vacunación haciendo más eficientes los programas de inmunización.
En 1998 se inició en Cataluña un programa piloto de vacunación frente a la hepatitis A + B en adolescentes, que tendrá una relación coste-beneficio favorable, debido a que el coste añadido es únicamente el diferencial entre la vacuna combinada y la de la hepatitis B3; este programa había comenzado en 1991.
En España, además, la vacuna monovalente contra la hepatitis A ha sido introducida en el calendario de Ceuta y Melilla, administrándose la primera dosis a los 18 meses de edad.
Vacuna de la hepatitis A
Aunque la prevención de la hepatitis A se basa en actuaciones de mejora de la higiene y de las condiciones sanitarias, la disponibilidad de vacunas seguras y eficaces ofrece una gran oportunidad para el control de la enfermedad.
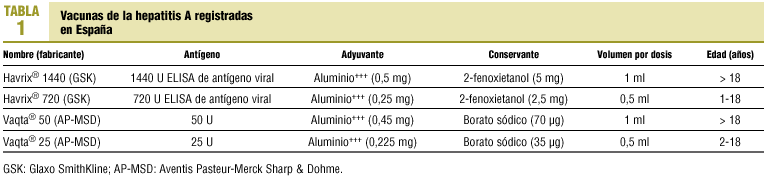
Las vacunas de la hepatitis A disponibles son vacunas inactivadas. Las vacunas registradas en España se exponen en la tabla 1. Se administran por vía intramuscular en el deltoides siguiendo una pauta de dos dosis (0 y 6-12 meses). No se han establecido recomendaciones acerca de la eventual necesidad de dosis de recuerdo4.
La inmunogenicidad de la vacuna es del 99-100% después de la administración de dos dosis. Los efectos adversos observados son leves, siendo los más frecuentes molestias en el sitio de administración, malestar y cefalea de duración inferior a 24 h en la mayoría de los casos y de resolución espontánea.
La vacunación está indicada en individuos susceptibles pertenecientes a los siguientes grupos de riesgo4,5:
Viajeros que se desplacen a zonas endémicas de hepatitis A.
Niños que viven en comunidades con elevadas tasas de hepatitis A y existencia de brotes esporádicos.
Personal de guarderías infantiles.
Trabajadores en contacto con aguas residuales no depuradas.
Personas con hepatopatías crónicas, en quienes la infección por el VHA podría tener un curso desfavorable.
Receptores habituales de hemoderivados (hemofílicos, etc.).
Varones homosexuales con contactos sexuales múltiples.
Consumidores de drogas por vía parenteral.
Otras situaciones que puedan determinar las autoridades sanitarias (ciertos manipuladores de alimentos, personal sanitario en situación de riesgo, etc.).
En situaciones de postexposición se recomienda el uso de inmunoglobulina humana polivalente (0,02 ml/kg de peso) simultáneamente a la vacunación, en zonas anatómicas diferentes. El uso simultáneo o exclusivo de la vacuna ha demostrado ser útil en el control de brotes6. Estudios de inmunogenicidad con la vacuna antihepatitis A demuestran que a los 14 días de la administración de la vacuna el 96% de las personas estaba protegido. El uso exclusivo de la vacuna para el control de brotes ha resultando eficaz en Alaska, Eslovaquia e Italia. Se ha estimado que se necesitaría vacunar a 18 personas para prevenir un caso de hepatitis A, aunque lógicamente esta cifra varía en función del número de personas previamente inmunes7,8.
Las contraindicaciones y precauciones de la vacunación son las generales de las vacunas. El embarazo no constituye una contraindicación formal.
Hepatitis B
El virus de la hepatitis B (VHB) es un virus ADN de 42 nm de diámetro, del género Hepadnaviridae (hepa-ADN-virus). Posee una cubierta lipoproteica que contiene el HBsAg. El VHB es muy resistente a la acción de los agentes externos9.
La infección se propaga a través de la vía parenteral, sexual y vertical de la madre al hijo10. El período de incubación es de 45-180 días, dos tercios de las infecciones suceden de modo asintomático. En el adulto más del 90% de las infecciones evoluciona a la curación.
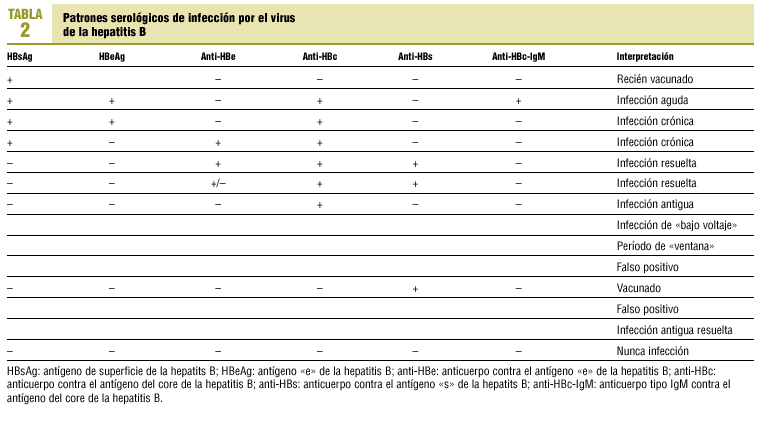
La infección da lugar a la aparición en sangre de una serie de antígenos y anticuerpos, denominados «marcadores», que varían en el curso de la infección y que sirven para caracterizar la etapa de la misma (tabla 2).
Vacuna de la hepatitis B
Las actualmente disponibles son vacunas inactivadas, preparadas con antígeno de superficie (HBsAg) del virus del VHB, mediante recombinación genética en la levadura común (Saccharomyces cerevisae)11.
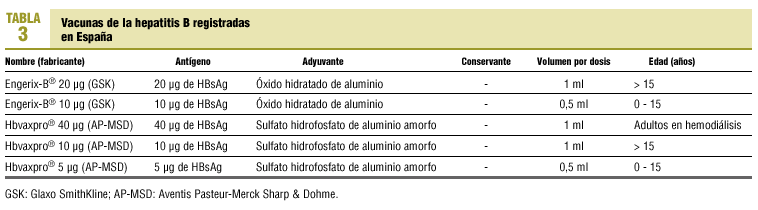
Las vacunas de la hepatitis B son vacunas inactivadas. Las registradas en España se recogen en la tabla 3. Estas vacunas actualmente disponibles han reemplazado recientemente a las vacunas con tiomersal (véase más adelante). Tanto la nueva vacuna Engerix® como la vacuna Hbvaxpro® (que sustituye a Recombivax HB®) carecen de tiomersal como preservante. Se administran por vía intramuscular en el deltoides siguiendo, generalmente, una pauta de tres dosis (0, 1 y 6 meses) y en ciertas circunstancias, como cuando se requiere protección urgente, de 4 dosis (0, 1, 2 y 6-12 meses).
En fechas relativamente recientes se autorizó en EE.UU. el empleo en adolescentes de 11-15 años de edad de pautas de dos dosis (0 y 6 meses) de 10 µg de HBsAg de la vacuna Recombivax HB® como alternativa a las pautas estándar de tres dosis de 5 µg de HBsAg del mismo fabricante12. El cumplimiento de las pautas de vacunación es inversamente proporcional al número de dosis requeridas para la inmunización. El empleo de pautas alternativas con menos dosis mejora la adhesión a los programas de vacunación.
Más del 95% de los vacunados desarrollan anticuerpos protectores (anti-HBs). En general, no se requiere la administración sistemática de dosis de recuerdo. En pacientes con deficiencias de tipo inmunitario (p. ej., pacientes en hemodiálisis o positivos para el virus de la inmunodeficiencia humana [VIH]) se recomienda la administración periódica (p. ej., anual) de dosis de recuerdo11. Debido a la baja respuesta a la vacuna en personas inmunodeprimidas se recomienda utilizar dosis dobles o presentaciones específicas con 40 µg de HBsAg. En algunos casos se precisan más de tres dosis para lograr la correcta inmunización de estos pacientes.
Los efectos adversos observados son poco frecuentes y leves, fundamentalmente de carácter local. Se ha comunicado algún caso de reacción de hipersensibilidad incluyendo urticaria, prurito y eritema nudoso13. El tiomersal, utilizado como preservante en la vacuna de la hepatitis B y en otras, podría ser el causante de estas reacciones. Además, se han señalado riesgos de intoxicación por metilmercurio, que es excretado muy lentamente por el organismo14, por lo que diversos organismos han emitido recomendaciones orientadas a eliminar progresivamente el tiomersal en la composición de las vacunas15.
La potencial asociación entre vacunación antihepatítica B y esclerosis múltiple ha sido objeto de polémica; sin embargo, en ningún caso ha podido establecerse la relación causal entre ambos fenómenos16,17.
Actualmente más de 150 países han incluido la vacunación antihepatítica B en sus calendarios sistemáticos de vacunación. La vacunación selectiva está indicada, además, en los siguientes grupos de riesgo5,11,18:
Recién nacidos de madre positiva para HBsAg en combinación con inmunoglobulina homóloga hiperinmune (HBIG).
Profesionales de la salud y estudiantes de ciencias de la salud (medicina, enfermería, odontología, formación profesional sanitaria, etc.).
Otros profesionales potencialmente expuestos a material contaminado (policías, bomberos, funcionarios de prisiones, personal de ambulancias, etc.).
Personas accidentalmente expuestas a material contaminado (pinchazos, etc.), combinando el uso de HBIG con la vacunación.
Personas ingresadas o que trabajan en instituciones para deficientes mentales.
Pacientes en programa de hemodiálisis, o que se prevea van a ser incorporados a éste.
Pacientes en programa de trasplante.
Receptores habituales de hemoderivados (hemofílicos, etc.).
Personas infectadas por el VIH.
Homosexuales masculinos.
Heterosexuales promiscuos.
Consumidores de drogas por vía parenteral.
Contactos domésticos y sexuales de portadores crónicos del VHB.
Ingresados en centros penitenciarios.
Viajeros internacionales (valorando áreas de destino, duración del viaje y actividades a realizar).
Otras indicaciones según valoración del riesgo individual de infección.
En situaciones de postexposición (recién nacidos de madre HBsAg positivo, exposición accidental a material contaminado) se requiere el empleo simultáneo y temprano, idealmente en las primeras 12 h, de HBIG. El empleo de ésta y de vacuna es esencial en la prevención perinatal de la hepatitis B. En personas en riesgo profesional debiera ser excepcional; ello es así cuando las estrategias de vacunación alcanzan altas coberturas.
La determinación de marcadores previa a la vacunación únicamente está indicada en grupos de población en que puedan esperarse prevalencias de anti-HBc superiores al 20% (la práctica totalidad de los grupos de riesgo)19. Las estrategias de vacunación universal no requieren la detección sistemática de marcadores, ya que es más eficiente la vacunación directa.
No se recomiendan de forma sistemática los exámenes posvacunales de anti-HBs (único anticuerpo inducido por la vacunación). En situaciones de vacunación selectiva, los análisis posvacunales estarían indicados en alguna de las siguientes circunstancias:
En personas en que pueda esperarse una mala respuesta por sus condiciones médicas previas (inmunodepresión) o por su edad (mayores de 30 años).
En personas reiteradamente expuestas a material contaminado (ciertos profesionales de la salud).
Las personas vacunadas que desarrollan títulos de anticuerpos por debajo de 10 mUI/ml deben recibir una segunda tanda de tres dosis.
Las contraindicaciones y precauciones de la vacunación son las generales de las vacunas. Las embarazadas pueden ser vacunadas en cualquier momento de la gestación si la vacuna está indicada.
Vacuna de la hepatitis A + B
Es una vacuna inactivada combinada contra la hepatitis A y la hepatitis B. La formulación para adultos (Twinrix® Adultos, Glaxo SmithKline) contiene por dosis de 1 ml: 720 U ELISA de Ag del VHA y 20 µg de HBsAg del VHB; es la empleada en los mayores de 15 años de edad. La formulación pediátrica (Twinrix® Pediátrico, Glaxo SmithKline) contiene la mitad de ambos antígenos en la mitad de volumen, 0,5 ml. Ambas formulaciones contienen aluminio+++ como adyuvante y 2-fenoxietanol como conservante.
La vacuna se administra por vía intramuscular, con la pauta de 0, 1 y 6 meses. Está indicada en aquellas situaciones en que se pretende la inmunización frente a ambas enfermedades. La eficacia y la seguridad de la vacuna combinada son similares a las observadas cuando se emplean ambos antígenos por separado20.
Hepatitis C
El virus de la hepatitis C (VHC) es un virus ARN del género Flavivirus que posee una región estructural estable y una región hipervariable formada por las proteínas de cubierta que puede variar entre diferentes enfermos e incluso en el mismo enfermo en distintos momentos de su evolución. La enfermedad se transmite por vía parenteral y más excepcionalmente por vía sexual y vertical. La infección aguda es asintomática en el 90% de los casos. El 50-80% de las infecciones evolucionan a la cronicidad. Existen dos perfiles de infección crónica: el portador del VHC (transaminasas normales y viremias persistentes o intermitentes) y el enfermo de hepatitis crónica (transaminasas elevadas y viremias intermitentes). El curso de la enfermedad está muy relacionado con el estado inmunológico del paciente, la asociación con otros virus (VHB o VIH) y con el consumo de alcohol. El diagnóstico de la hepatitis C se realiza mediante la determinación con técnicas ELISA de presencia de anticuerpos séricos frente a proteínas del core y de regiones no estructurales del virus y otras técnicas más específicas como el test de inmunoblot (RIBA) o la determinación de VHC-ARN por reacción en cadena de la polimerasa (PCR).
En los países occidentales las tasas de infección de la población oscilan entre el 1,5 y el 5%, y es del 2% en España. Actualmente se considera que el VHC es la causa del 25% de las hepatitis agudas, del 75% de las hepatitis crónicas, de más del 50% de las cirrosis hepáticas y de más del 65% de los carcinomas hepáticos en los países desarrollados.
Hasta el momento no se dispone de vacunas ni de inmunoglobulinas que permitan controlar la propagación de la enfermedad, de manera que su prevención se limita a evitar las circunstancias que facilitan su transmisión. Los principales obstáculos al desarrollo de vacunas frente al VHC son: la gran variabilidad genética del virus, no disponer de cultivos que permitan la producción de partículas víricas para la preparación de vacunas inactivadas y el potencial riesgo de infecciones crónicas en el caso de desarrollar una vacuna atenuada. Existen, sin embargo, diferentes vacunas en fase de investigación: vacunas recombinantes, vacunas virosómicas, vacunas peptídicas, vacunas activadoras de linfocitos T citotóxicos virus C específicos21,22.
Las vacunas recombinantes se han desarrollado a partir de las proteínas de envoltura del VHC C, especialmente la E2, ya que pueden estar implicadas en el reconocimiento virus-huésped y además tienen capacidad de generar anticuerpos neutralizantes. Una de estas vacunas demostró una buena correlación entre anticuerpos neutralizantes y protección. Sin embargo, cuando los animales de experimentación fueron inoculados con un virus heterólogo, ninguno de ellos resultó protegido. La utilización de partículas víricas que reproducen mejor la estructura de las proteínas estructurales nativas tiene mayores ventajas, pero el no disponer de cultivos celulares adecuados representa un obstáculo técnico importante.
Las vacunas ADN introducen plásmidos de ADN en células. Introducido el plásmido en la piel o en el músculo el antígeno es sintetizado en las células diana. Las ventajas de estas vacunas son su versatilidad, fácil manejo y fácil producción de ADN. Además, la producción de antígeno in situ posiblemente simula mejor el antígeno natural que la proteína recombinante. Las desventajas radican, fundamentalmente, en que se trata de una tecnología relativamente nueva, de la que se desconocen las dosis y formas de preparación (adyuvantes, conservantes, etc.).
Otras metodologías, como la utilización de virus defectivos recombinantes (adenovirus o virus vacuna), permiten la producción en el organismo de grandes cantidades de antígeno. Sin embargo, existen importantes dificultades técnicas. La utilización de péptidos no ha demostrado hasta este momento una gran eficacia debido a la enorme variabilidad del virus. La posibilidad de utilizar bacterias atenuadas (Salmonella) para vehiculizar ADN al organismo, que una vez dentro de las células del huésped será traducido a proteínas que estimularían la respuesta inmunitaria, ha demostrado su eficacia en experimentación animal y podría convertirse en el futuro en una alternativa para el desarrollo de vacunas frente a la hepatitis C23.
Hasta que las vacunas estén disponibles, la prevención de nuevas infecciones por el VHC debería ser un objetivo prioritario en salud pública con el fin de evitar la infección crónica por el virus C y sus secuelas.
Hepatitis D o delta
El virus de la hepatitis D o delta (VHD) es un virus defectivo, de ARN circular y 36 nm de diámetro. La replicación del VHD requiere el concurso del HBsAg del VHB, que constituye la cubierta del propio virus, por lo que la infección por el VHD sólo es posible si existe una infección previa por el VHB (sobreinfección), o bien si la transmisión de ambos virus sucede de modo simultáneo (coinfección). La sobreinfección provoca lesión hepática más grave y rápida que la coinfección, su pronóstico es similar al de la infección aislada por el VHB.
El VHD se transmite por vía parenteral, con frecuencia asociado a la drogadicción, y excepcionalmente por vía sexual. Las medidas de prevención de la hepatitis B y, singularmente, la vacunación son eficaces para evitar la infección por el VHD.
Hepatitis E
El virus de la hepatitis E, virus ARN de 32 nm, pertenece al género Calicivirus, carece de cubierta. Se han identificado dos serotipos. Se transmite por vía fecal/oral con un curso clínico similar a la hepatitis A. El porcentaje de casos de hepatitis fulminante es similar al de la hepatitis A; las embarazadas pueden presentar tasas de hasta un 20% cuando se infectan en el tercer trimestre.
Los casos de hepatitis E se dan, fundamentalmente, en zonas del mundo que presentan unas condiciones higienicosanitarias muy deficitarias y suelen presentarse en forma epidémica relacionadas con el agua. Suele afectar a personas jóvenes de mediana edad. En los países occidentales los casos de hepatitis E ocurren en personas que han viajado a zonas endémicas (India, Bangladesh, Myanmar, Nepal, Pakistán, Indonesia, repúblicas ex soviéticas, Irán, Etiopía, Argelia, Libia, Somalia y México).
Las medidas de prevención consisten en la correcta aplicación de las medidas higienicosanitarias. No se dispone de vacunas para la prevención de la enfermedad.
Otros virus
Hepatitis G
Virus ARN relacionado con Flavivirus que se transmite por vía parenteral. No está relacionado con el virus C, pero se han detectado infecciones simultáneas por el VHC y el virus de la hepatitis G.
Hepatitis GB
Se trata de un virus ARN, poco conocido, relacionado con Flavivirus y que se transmite por vía parenteral.
Virus de Epstein-Barr
La hepatitis que ocasiona habitualmente es leve y se manifiesta por alteración de las transaminasas, ligero aumento de la bilirrubina y de la fosfatasa alcalina24. En raras ocasiones puede producir hepatitis fulminante. No existe tratamiento específico y no se dispone de vacunas.
Citomegalovirus
Puede ser causa de hepatitis leves y autolimitadas. En algunos casos el cuadro de hepatitis puede ser más evidente y simular una hepatitis A, de la que se diferencia por la persistencia de fiebre, leucocitosis con linfocitosis reactivas y células mononucleares atípicas.
Virus herpes simple I y II
Pueden presentar hepatitis agudas asintomáticas y autolimitadas, aunque se ha descrito algún caso de hepatitis fulminante. Existe una vacuna recombinante en fase de investigación frente al virus herpes tipo II.
Virus varicela-zoster
Aunque raramente, se han descrito casos de hepatitis en pacientes que han presentado afectación pulmonar. Se dispone de una vacuna atenuada frente a la varicela, disponible para uso hospitalario e indicada para las personas en quienes la varicela puede ser especialmente grave.
Correspondencia:José María Bayas. Servicio de Medicina Preventiva. Hospital Clínic. C/ Villarroel, 170. 08036 Barcelona. España. Correo electrónico: bayas@medicina.ub.es