29 ensayos clínicos aleatorizados de metformina en monoterapia, con resultados sobre mortalidad, morbilidad y bioquímica. Extracción de datos. Programa informático RevMan 4. Dos revisores extrajeron los datos y evaluaron la calidad. Variables principales: cualquier acontecimiento clínico relacionado con la diabetes (mortalidad, coronariopatía, ictus, nefropatía, arteriopatía y retinopatía). Variables secundarias: peso y bioquímica. Resultados. Se analizaron 29 ensayos clínicos con 37 comparaciones de metformina (13 con sulfonilureas, 12 con placebo, 3 con dieta, 3 con tiazolidindionas, 2 con inhibidores de la *-glucosidasa, 2 con insulina y 2 con meglitinidas). La metformina mostró mayor beneficio que las sulfonilureas o la insulina para cualquier acontecimiento clínico relacionado con la diabetes (riesgo relativo = 0,78; intervalo de confianza [IC] del 95%, 0,65 a 0,94) y que la dieta (riesgo relativo = 0,74; IC del 95%, 0,60 a 0,90). La metformina disminuyó la hemoglobina A 1 glucosilada (diferencia media ponderada: 1,21%; IC del 95%, 1,48 a 0,94), colesterol unido a lipoproteínas de baja densidad (diferencia media ponderada: 0,24; IC del 95%, 0,40 a 0,09) y peso (diferencia media estandarizada: 0,11; IC del 95%, 0,18 a 0,04). La metformina presentó mayor beneficio que el placebo, la dieta o las tiazolidindionas en la hemoglobina A 1 glucosilada, y que las sulfonilureas o la insulina en el peso. Conclusiones. A largo plazo la metformina disminuye el riesgo de acontecimientos clínicos relacionados con la diabetes. No existen ensayos clínicos a largo plazo que comparen con metformina los inhibidores de la *-glucosidasa, meglitinidas y tiazolidindionas, en resultados primarios. Las diferentes intervenciones comparadas con metformina no obtuvieron más beneficio para los resultados secundarios evaluados.
3 with diet, 3 with thiazolidinediones,
2 with *-glucosidase inhibitors, 2 with insulin, and 2 with meglitinides). Metformin was more beneficial than the sulphonylureas or insulin for any clinical event associated with diabetes (relative risk [RR]=0.78; 95% confidence interval [CI], 0.65-0.94) and than diet (RR=0.74; 95% CI, 0.60-0,90). Metformin decreased glycosylated hemoglobin A 1 (weighted mean difference, 1.21%; 95% CI, 1.48 to 0.94), low density lipoprotein cholesterol (weighted mean difference, 0.24; 95% CI, 0.40 to 0.09), and weight (standardized mean difference, 0.11; 95% CI, 0.18 to 0.04). Metformin was more beneficial than the placebo, diet or the thiazolidinediones on glycosylated hemoglobin A 1, and than the sulphonylureas or insulin on weight. Conclusions. In the long term metformin reduces the risks of clinical events associated with diabetes. There are no long term clinical trials which compare
*-glucosidase inhibitors, meglitinides, and thiazolidinediones with metformin, in primary results. The different treatments compared with metformin did not obtain more benefit for the secondary results evaluated.
Introducción
La diabetes mellitus tipo 2 es una enfermedad crónica con una significativa morbilidad y mortalidad, e incidencia creciente en los países desarrollados. Todos los pacientes precisan consejo médico y la mayoría necesita medicación. Aunque existen múltiples agentes terapéuticos, no está claro cuál de ellos, y en qué subgrupos de pacientes, produce más beneficio en resultados primarios, como mortalidad, coronariopatía, ictus, nefropatía, arteriopatía y retinopatía1.
La metformina es una biguanida que aumenta la sensibilidad periférica y hepática de la insulina, mejora el perfil glucémico en ayunas y posprandrial2, y carece de riesgo significativo de producir acidosis láctica, que se había notificado anteriormente con otra biguanida3.
Hay publicados 2 metaanálisis de metformina comparada con sulfonilureas4,5 y con dieta5, que ofrecen resultados secundarios (cambios de peso, glucemia y lípidos), pero no notifican resultados primarios6.
Esta revisión tiene como objetivo contestar a 2 preguntas: si la utilización de metformina en monoterapia, comparada con cualquier otra intervención, en diabéticos tipo 2 se asocia a cambios beneficiosos en resultados primarios y secundarios, y si existe algún subgrupo de pacientes con diabetes tipo 2 que se beneficien en mayor medida de la intervención con metformina.
Material y métodos
Los criterios de inclusión han sido: ensayos clínicos aleatorizados, abiertos, simple o doble ciego, publicados o no publicados, en cualquier idioma, sobre la metformina en monoterapia (con metformina como primera opción de tratamiento o bien cambiando a ella desde un tratamiento diferente utilizado anteriormente), comparada con placebo, dieta, inhibidores de la *-glucosidasa, meglitinidas, sulfonilureas, tiazolidindionas o insulina, en población de diabéticos tipo 2, reclutados en clínicas de medicina general o de diabetes, con una intervención farmacológica mínima de 3 meses y que notificasen resultados primarios o secundarios.
Como resultados primarios se ha buscado cualquier acontecimiento relacionado con la diabetes (muerte, infarto de miocardio, angina, ictus, nefropatía, arteriopatía periférica, hemorragia vítrea, retinopatía y cataratas), mortalidad relacionada con la diabetes, mortalidad total y enfermedad microvascular. Como resultados secundarios se han incluido: hemoglobina A1 glucosilada (HbA1c), glucemia en ayunas, peso o índice de masa corporal (IMC), lípidos, péptido C, insulinemia, presión arterial sistólica y diastólica, microalbuminuria y reacciones adversas.
Se ha realizado una búsqueda en MEDLINE (1966 a 2003), EMBASE (1974 a 2003), LILACS (1986 a 2003) y la Cochrane Library (parte 3, 2003), empleando los términos: «metformin», «biguanide*», «type 2 diabetes», «non-insulin-dependent-diabetes», «random*» y «clinical trial». Se han revisado las listas de referencias de los estudios relevantes obtenidos. Dos revisores (A.S.C. e I.F.E.), independientemente, evaluaron cada título y resumen. Si la referencia parecía cumplir con los criterios de inclusión, se obtuvo una copia completa del artículo. Se estableció contacto con los fabricantes del medicamento para obtener referencias adicionales (sin que se añadiera ninguna referencia nueva) y con algunos autores para solucionar dudas. Se eliminaron duplicaciones.
Dos revisores (A.S.C. e I.F.E.), independientemente, extrajeron los datos y puntuaron la calidad7,8. Se dividieron los ensayos en 2 grupos de calidad: alta y media-baja. La calidad se consideró alta cuando el estudio obtenía 4 o 5 puntos en la escala de Jadad7 y en él se hacía mención de que se había intentado una adecuada ocultación de la asignación8. Para la incorporación de las evaluaciones de la validez de los estudios se utilizó un análisis de sensibilidad, mediante la inclusión y exclusión de los estudios de calidad media-baja, y metarregresión incluyendo la calidad como una covariable1. No se ocultó a los revisores la procedencia y autoría de los estudios. Las discrepancias se resolvieron por consenso. El acuerdo interobservadores se analizó utilizando el estadístico kappa9, que fue de 0,85, lo que indicaba acuerdo sustancial.
Para los cálculos se utilizaron RevMan versión 4.2 y Stata versión 5. Se han calculado la diferencia de medias ponderada (DMP) para datos en la misma escala y la diferencia de medias estandarizada (DME) para escalas diferentes. Siempre que fue posible se utilizó la media del cambio ± su desviación estándar10-16, y los resultados finales para el resto17-37, realizando un análisis por intención de tratar. Se incluyeron los datos dicotómicos como número de acontecimientos y riesgo relativo (RR). Hemos sumarizado los datos en un resultado combinado total utilizando el modelo de efectos aleatorios debido a la heterogeneidad detectada. Realizamos un análisis de sensibilidad basado en: ensayos doble ciego, ensayos de alta calidad y ensayos con ocultación de la asignación. Para evaluar la presencia de sesgos de publicación utilizamos el test de correlación de Begg38 y el gráfico de Egger39.
Hemos evaluado la heterogeneidad utilizando el marcador Z, el estadístico *2 y el estadístico I2 (consideramos excesivos los valores de I2 mayores del 50%)40, con metarregresión.
Se realizaron análisis de subgrupos para explorar la influencia de factores de riesgo cardiovascular en el tamaño del efecto y también si algún subgrupo se podría beneficiar en mayor medida de la intervención con metformina. Estos subgrupos fueron: obesidad (IMC > 30 o peso mayor de 85 kg), hipertensión, colesterol unido a lipoproteínas de baja densidad (cLDL > 3,99 mmol/l), fibrinogenemia, función plaquetaria y mayores de 65 años.
Resultados
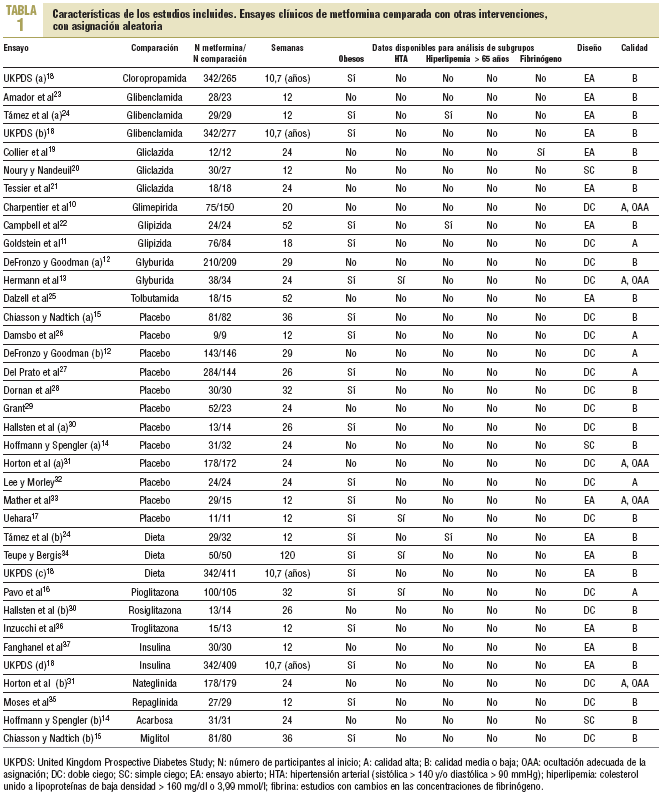
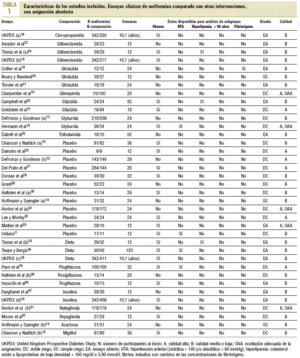
En la búsqueda se identificaron 1.306 referencias diferentes y 215 se consideraron relevantes. Se excluyeron 179 por no cumplir con los criterios de inclusión y 7 ensayos cruzados por no ofrecer datos al primer cruce. Se incluyeron 29 ensayos clínicos aleatorizados10-37 (con 37 grupos de tratamiento y 5.259 participantes) que comparaban la metformina (29 ensayos y 2.007 participantes) con sulfonilureas (13 estudios y 1.167 participantes)10-13,18-25, placebo (12 estudios y 702 participantes)12,14,15,17,26-33, dieta (3 estudios y 493 participantes)18,24,34, tiazolidindionas (3 ensayos y 132 participantes)16,30,36, insulina (2 ensayos y 439 participantes)18,37, meglitinidas (2 estudios y 208 participantes)31,35 e inhibidores de la *-glucosidasa (2 ensayos y 111 participantes)14,15. La metformina se utilizó hasta dosis de 3 g (rango: 1-3 g). Un ensayo clínico se obtuvo antes de su publicación17. La mediana de edad de los pacientes fue de 56 años (rango: 35-73), la mayoría era de raza blanca y había un 50% de mujeres.
La mediana de duración de los ensayos fue de 5 meses (rango: 3-24), y de 10,7 años el UK Prospective Diabetes Study (UKPDS)18. Diez estudios se consideraron de alta calidad. Cuatro presentaban asignación oculta adecuada (tabla 1).
Los tests de Begg y Egger indicaron que no había sesgos de publicación38,39. Con excepción de la obesidad, que se registró en 17 estudios, no se pudo combinar datos en los subgrupos previstos. Sólo 4 ensayos incluyeron a pacientes hipertensos y 2 a hiperlipémicos. Un ensayo estudió la función plaquetaria19 y ninguno ofreció datos específicos en mayores de 65 años.
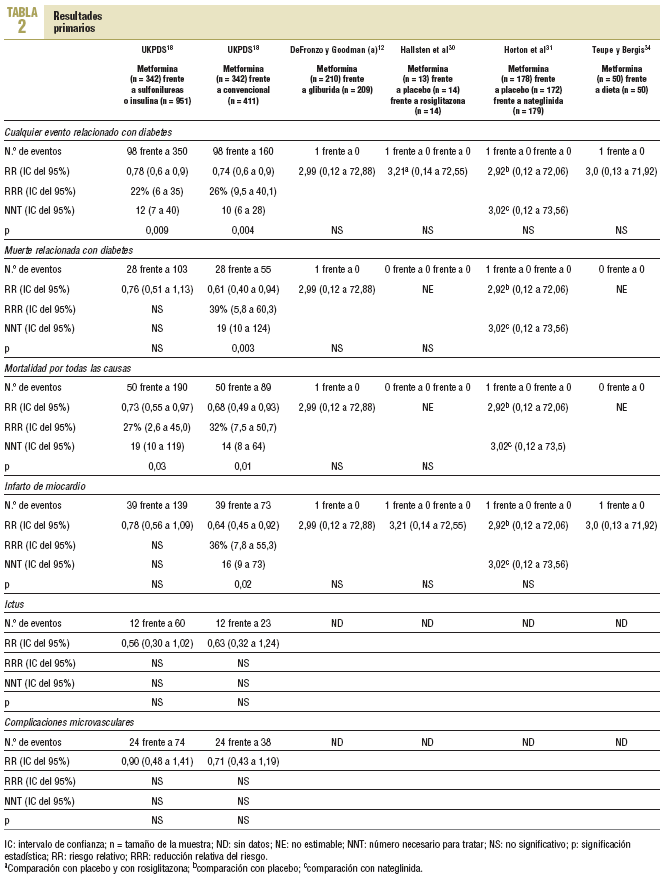
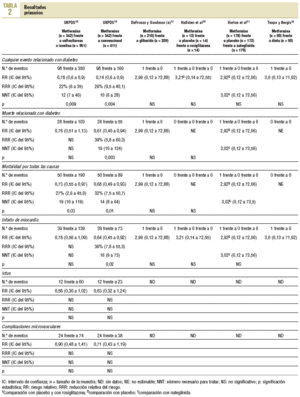
Resultados primarios (tabla 2)
Cinco estudios notificaron resultados primarios12,18,30,31,34 y otros 4 notificaron explícitamente no haberlos tenido14,16,35,36. En el UKPDS, en pacientes con sobrepeso18, la metformina en monoterapia (n = 342) mostró un mayor beneficio que la cloropropamida, glibenclamida o insulina (n = 951); todos intentando control glucémico intensivo (glucemia en ayunas < 106 mg/dl) para cualquier acontecimiento relacionado con la diabetes (98 frente a 350; RR = 0,78; intervalo de confianza [IC] del 95%, 0,65 a 0,94) y para la mortalidad total (50 frente a 190; RR = 0,73; IC del 95%, 0,55 a 0,97). La metformina se comparó con el tratamiento convencional no intensivo (glucemia en ayunas < 270 mg/dl; n = 411 pacientes) y mostró un mayor beneficio para cualquier acontecimiento relacionado con la diabetes (98 frente a 160; RR = 0,74; IC del 95%, 0,60 a 0,90), muerte relacionada con la diabetes (28 frente a 55; RR = 0,61; IC del 95%, 0,40 a 0,94), mortalidad total (50 frente a 89; RR = 0,68; IC del 95%, 0,49 a 0,93) e infarto de miocardio (39 frente a 73; RR = 0,64; IC del 95%, 0,45 a 0,92). Entre los otros 4 ensayos clínicos notificaron 4 infartos de miocardio, 2 de ellos fatales, y todos los acontecimientos se registraron en los pacientes del grupo de metformina (4 frente a 0; RR = 3,58; IC del 95%, 0,73 a 17,52).
Los resultados primarios no se registraron en los ensayos con pacientes hiperlipémicos, ni se ofrecieron datos de pacientes mayores de 65 años. Un ensayo pequeño registró cambios en la fibrinogenemia no significativos.
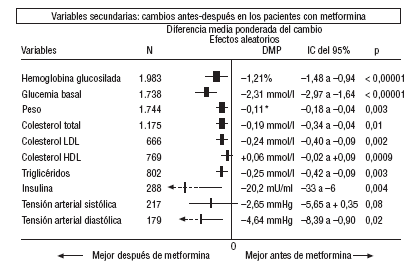
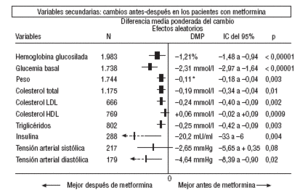
En cuanto a los resultados secundarios (figs. 1-4) en la comparación antes-después del tratamiento con metformina (fig. 1) los pacientes con metformina mostraron una reducción significativa de los valores de HbA1c (DMP: 1,21%; IC del 95%, 1,48 a 0,94), glucemia (DMP: 2,31 mmol/l; IC del 95%, 2,97 a 1,64), colesterol (DMP: 0,19 mmol/l; IC del 95%, 0,34 a 0,04), colesterol LDL (DMP: 0,24 mmol/l; IC del 95%, 0,40 a 0,09), triglicéridos (DMP: 0,25 mmol/l; IC del 95%, 0,42 a 0,09), insulina (DMP: 20 mU/ml; IC del 95%, 33 a 6), presión diastólica (DMP: 4,64 mmHg; IC del 95%, 8,39 a 0,90) y peso (DME: 0,11 kg; IC del 95%, 0,18 a 0,04).
Fig. 1. Cambios antes-después en los pacientes en tratamiento con metformina.
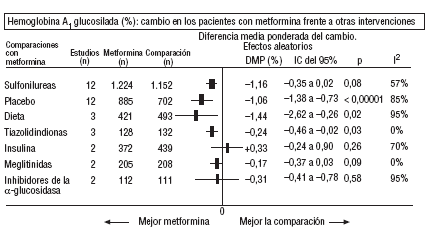
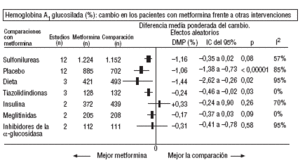
Fig. 2. Resultados combinados de la hemoglobina A1 glucosilada.
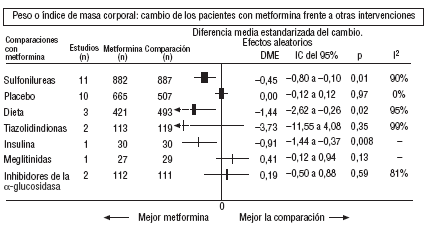
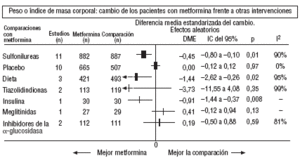
Fig. 3.Resultados combinados de peso.
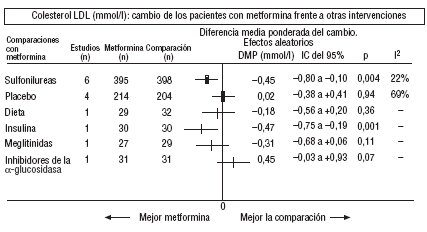
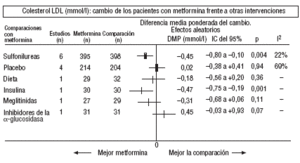
Fig. 4. Resultados combinados del colesterol unido a lipoproteínas de baja densidad (LDL).
En comparación con los pacientes en tratamiento con sulfonilureas, los pacientes con metformina mostraron un mayor beneficio para la glucemia (DMP: 0,31 mmol/l; IC del 95%, 0,57 a 0, 05), colesterol LDL (DMP: 0,22 mmol/l; IC del 95%, 0,35 a 0,10), triglicéridos (DMP: 0,24 mmol/l; IC del 95%, 0,46 a 0,02) y peso (IMC) (DME: 0,45; IC del 95%, 0,80 a 0,10). Un ensayo clínico pequeño23 mostró beneficio de la metformina para la microalbuminuria (DMP: 53 mg/día; IC del 95%, 86 a 19). La metarregresión no mostró ninguna variable explicativa significativa de la heterogeneidad. Estos resultados fueron consistentes con el análisis de sensibilidad de ensayos doble ciego. En el subgrupo de pacientes con obesidad la metformina presentó mayor beneficio en el peso (IMC) (DME: 0,58; IC del 95%, 1,00 a 0,16), colesterol (DMP: 0,38 mmol/l; IC del 95%, 0,55 a 0,20) y colesterol LDL (DMP: 0,27 mmol/l; IC del 95%, 0,40 a 0,14). Hubo más casos de hipoglucemia en los participantes que recibieron sulfonilureas (p = 0,004) y más diarrea con la metformina (p = 0,02).
En comparación con placebo, la metformina mostró mayor beneficio para la HbA1c (DMP: 1,06%; IC del 95%, 1,38 a 0,73) y la glucemia (DMP: 1,84 mmol/l; IC del 95%, 2,38 a 1,30). La metarregresión indicó un mayor efecto de la metformina en obesos (p < 0,0001) y en los estudios donde no se realizó refuerzo de dieta (p < 0,0001). Los resultados fueron consistentes con el análisis de sensibilidad de ensayos doble ciego en obesos, de calidad alta y con asignación oculta adecuada. Con la metformina hubo más casos de diarrea (p = 0,0005).
En comparación con la dieta, la metformina mostró mayor beneficio para la HbA1c (DMP: 1,44%; IC del 95%, 2,62 a 0,26), el colesterol (DMP: 0,61 mmol/l; IC del 95%, 0,93 a 0,29), la insulina (DMP: 60 mU/ml; IC del 95%, 79 a 40) y el péptido C (DMP: 0,61 nmol/l; IC del 95%, 0,89 a 0,33). Hubo menos hipoglucemias con la dieta (p = 0,01).
Comparada con las tiazolidindionas, la metformina mostró mayor beneficio para la HbA1c (DMP: 0,24%; IC del 95%, 0,46 a 0,02).
Comparada con la insulina, la metformina mejoró el peso (DME: 0,91 kg; IC del 95%, 1,44 a 0,37), el colesterol (DMP: 0,42 mmol/l; IC del 95%, 0,69 a 0,15), el colesterol LDL (DMP: 0,47 mmol/l; IC del 95%, 0,75 a 0,19), la presión arterial sistólica (DMP: 9,50 mmHg; IC del 95%, 15,15 a 3,85) y la diastólica (DMP: 7,00 mmHg; IC del 95%, 9,41 a 4,59).
Comparada con las meglitinidas, la metformina mostró mayor beneficio para la glucemia (DMP: 0,73 mmol/l; IC del 95%, 1,18 a 0,28). No hubo diferencias para el resto de comparaciones. Hubo más casos de diarrea en el grupo de metformina (p = 0,0002).
Al comparar la metformina con los inhibidores de la *-glucosidasa, las cifras de colesterol mejoraron en los pacientes con acarbosa (DMP: 1,92 mmol/l; IC del 95%, 1,20 a 2,64). Hubo menos molestias digestivas en el grupo de la metformina (p = 0,002).
No hubo casos de acidosis láctica en los 29 ensayos clínicos.
Discusión
El estudio prospectivo UKPDS18 continúa siendo el más largo a día de hoy (mediana de 10,7 años y 4.075 participantes). En los pacientes con sobrepeso, intentando un control intensivo de la glucemia, la metformina en monoterapia fue beneficiosa comparada con el control intensivo con clorpropamida, glibenclamida o insulina, pues redujo la incidencia de cualquier acontecimiento relacionado con la diabetes y mortalidad total; también lo fue cuando se la comparó con un tratamiento convencional (principalmente dieta), ya que redujo la incidencia de cualquier acontecimiento relacionado con la diabetes, la mortalidad y el infarto de miocardio. Estos resultados confirman los hallazgos del UKPDS, aunque no hemos encontrado (RR = 0,56; IC del 95%, 0,30 a 1,02) el beneficio notificado para el ictus, probablemente porque no hemos tenido acceso a los datos individuales18.
No ha sido objetivo de esta revisión el estudio del efecto de la adición de metformina a otros medicamentos, pero hay que resaltar que en el UKPDS el beneficio en los resultados primarios de la metformina no ha podido demostrarse al añadirla a una sulfonilurea; se notificó un incremento de la mortalidad en el grupo sin sobrepeso en tratamiento combinado metformina-sulfonilurea frente a sólo sulfonilurea, aunque como explicación se adujeron diferencias basales entre los pacientes18. A pesar de la duda planteada, los recientes ensayos clínicos de metformina combinada con otros tratamientos aún han de notificar resultados primarios, tanto en la combinación con sulfonilureas41 como con insulina42.
No se ha encontrado ningún ensayo clínico de una duración mayor de 8 meses que compare los nuevos agentes orales (nuevas sulfonilureas, inhibidores de la *-glucosidasa, megli-tinidas o tiazolidindionas) con metformina para poder compararlos con ésta en resultados primarios, lo que dificulta la recomendación de los nuevos fármacos antes que la metformina como primera opción terapéutica, pues los moderados beneficios en resultados secundarios aislados de los nuevos fármacos tienen todavía que demostrar beneficio en los resultados primarios. De hecho, el UKPDS ha demostrado que existe un beneficio en morbimortalidad con el control intensivo de la glucemia pero, dado el control similar en todos los grupos, el posible beneficio de la metformina podría no deberse sólo a su control glucémico y se han propuesto como hipótesis otros posibles efectos sobre la agregabilidad plaquetaria y la trombólisis43.
No hay que olvidar que la diabetes sumada a otros factores de riesgo cardiovascular aumenta el riesgo de enfermedad coronaria e ictus, y que en un subestudio del UKPDS el beneficio cardiovascular del control de la hipertensión fue mayor que el de la hiperglucemia44. Sin embargo, con excepción de un mayor beneficio obtenido con metformina en los pacientes con sobrepeso, esta revisión no ha encontrado o no ha podido combinar resultados específicos para los subgrupos de diabéticos hipertensos, hiperlipémicos, con alteraciones en la fibrinólisis o en mayores de 65 años, por lo que sería recomendable que en el futuro los investigadores hagan un esfuerzo en el reclutamiento de estas poblaciones para aplicar mejor sus resultados a nuestros pacientes habituales.
En el resultado combinado de los 29 ensayos, los pacientes con metformina mejoraron considerablemente el control glucémico (HbA1c del 1,21% y glucemia de 2,31 mmol/l) y de forma discreta el peso, los valores de lípidos y la presión arterial diastólica. Además, los pacientes con metformina consiguieron un mayor beneficio en el control glucémico que los asignados a placebo, dieta o tiazolidindionas, y un mayor beneficio en el control del peso y del colesterol LDL que los asignados a sulfonilureas o insulina. Por otra parte, los agentes más modernos como las tiazolidindionas y meglitinidas no proporcionaron mayor beneficio en la glucemia, valores lipídicos, peso o presión arterial que la metformina.
En esta revisión, que incluye a 2.007 pacientes asignados a tratamiento con metformina, se ha encontrado algún efecto adverso reversible menor (diarreas), pero no casos de acidosis láctica, lo que confirma la evidencia de seguridad de la metformina, que ya ha sido publicada en una revisión sistemática3.
Una limitación de esta revisión es el escaso número de ensayos clínicos doble ciego existentes, la falta de datos sobre la ocultación de la asignación y la heterogeneidad. Se ha estudiado esta última con metarregresión y se han encontrado 2 variables que la pueden explicar. Una es el mayor beneficio de la metformina en población con sobrepeso y otra el intento de protocolizar el refuerzo en el cumplimiento de la dieta, que supuso un factor independiente en la mejoría de la glucemia. Es probable que al establecer estos protocolos en este tipo de ensayos clínicos se eviten sesgos de realización.
Hay también algunos puntos destacables: los efectos combinados fueron consistentes en los análisis de sensibilidad realizados, no se detectaron sesgos de publicación y no hubo desacuerdo significativo entre los ensayos, a pesar de sus diferencias de diseño y calidad. Los resultados secundarios son concordantes con los de 2 revisiones sistemáticas previas realizadas, aunque la aportación de esta revisión es la ampliación del estudio a todos los medicamentos antidiabéticos, además de la insulina y la dieta, utilizados en esta enfermedad, así como el registro de los resultados primarios, que son los que más interesan a los pacientes4,5.
En resumen, a largo plazo la metformina en tratamiento intensivo único en pacientes con diabetes tipo 2 con sobrepeso, comparada con el tratamiento intensivo con glibenclamida, clorpromacina o insulina y con el tratamiento convencional, muestra mayores beneficios en resultados primarios. Ningún otro antidiabético ha sido testado contra la metformina en este sentido, por lo que esta revisión apoya la utilidad de ésta como primera opción terapéutica en la diabetes mellitus tipo 2, donde desempeña un papel importante en la prevención de complicaciones vasculares.
Agradecimientos
A Aureli Tobías, por su ayuda en la metodología estadística de los sesgos de publicación, y al Dr. Miguel Brito, por su lectura crítica del manuscrito.