Describir la asociación entre patrones de electrocardiograma (ECG) según MVP risk score(Morphology-Voltage-P-wave duration) y un diagnóstico de fibrilación auricular (FA).
DiseñoEstudio de cohorte prospectivo (1/01/2023-31/12/2024).
EmplazamientoCentros de atención primaria.
ParticipantesMuestra aleatorizada de 150 pacientes entre 65 y 85 años; sin diagnóstico previo de FA, ni ictus, ni tratamiento anticoagulante actual; alto riesgo de una futura FA; CHA2DS2-VASc ≥2; y capacidad para utilizar la aplicación (App) FibricheckR.
MedicionesA la inclusión, se realizó un ECG basal estándar, puntuación en MVP risk score y monitorización del ritmo cardíaco basal durante 15 días utilizando la App FibricheckR. Las variables dependientes fueron la presencia de patrones de la onda P en el ECG según MVP risk score y un nuevo diagnóstico de FA.
ResultadosEl diagnóstico de FA fue confirmado en 14 casos (9,3%, IC95% 5,6-15,1), 3 hombres y 11 mujeres. En 3 casos, la arritmia fue diagnosticada en el ECG basal, y en 11 por Holter después de ser informadas como posible FA por FibricheckR App. Se detectó una prevalencia superior de bloqueo interauricular avanzado (BIA-A) atípico (p=0,007) entre los participantes con FA, así como la prevalencia de onda P <0,1mV (p=0,006). Todos los nuevos diagnósticos de FA se realizaron en puntuaciones ≥4 en el MVP risk score.
ConclusionesUtilizar en atención primaria escalas para la identificación de patrones ECG en sujetos de alto riesgo puede facilitar el diagnóstico de FA desconocida.
To assess the association between electrocardiogram (ECG) patterns according to the MVP ECG risk score (morphology-voltage-P-wave duration) and a diagnosis of Atrial Fibrillation (AF).
DesignProspective observational cohort study (1/01/2023-31/12/2024).
SitePrimary care.
ParticipantsRandomized sample of 150 patients aged 65-85 years without prior diagnosis of AF, stroke, or current anticoagulant treatment; high risk of future AF; CHA2DS2-VASc ≥2; and ability to use the FibricheckR application (App).
MeasurementsAt baseline, a standard ECG, MVP risk score assessment, and cardiac rhythm monitoring for 15 days using the FibricheckR App were performed. The dependent variables were the presence of P-wave patterns on the electrocardiogram according to MVP risk score and a new diagnosis of AF.
ResultsThe diagnosis of AF was confirmed in 14 cases (9.3%, 95% CI 5.6-15.1), 3 men and 11 women. In 3 cases, the arrhythmia was diagnosed on the baseline ECG, and in 11 cases by Holter after being reported as possible AF by the FibricheckR App. A higher prevalence of atypical advanced interatrial block (A-AIB) (p 0.007) was detected among participants with AF, as well as the prevalence of P-wave <0.1mV. (p=0.006). All new diagnoses of AF were made at scores ≥4 in the MVP risk score.
ConclusionsUsing scales for identifying ECG patterns in high-risk subjects in primary care can facilitate the diagnosis of unknown AF.
La fibrilación auricular (FA) y el ictus son condiciones interrelacionadas y comparten vías causales complejas. No solo el envejecimiento demográfico está contribuyendo a que la incidencia, sola y combinada, de la FA y el ictus aumente progresivamente, sino también causas multifactoriales y complejas asociadas a los factores de riesgo cardiovascular clásicos1–3. Se estima que la incidencia de FA aumentará 2,5 veces en los próximos 50 años (2010-2060); y alrededor de un 34% la incidencia del ictus relacionado con la FA entre personas ≥75 años de edad, caracterizándose por su mayor severidad clínica y discapacidad residual, y un incremento en el gradiente de costes socioeconómicos relacionado con la edad del diagnóstico y la carga de comorbilidad4–6 convirtiéndose en uno de los principales desafíos para la sostenibilidad de la salud de la población europea7–11. Dado el coste medio estimado de un episodio de ictus7,12, una estrategia de diagnóstico precoz en individuos con alto riesgo de sufrir FA podría presentar una relación coste-beneficio claramente positiva a medio y largo plazo. Ante ello, el Stroke Action Plan for Europe 2018-203011 prioriza la disponibilidad de programas de detección y tratamiento en atención primaria que tengan como objetivo reducir el riesgo de ictus13–15 entre los pacientes de alto riesgo.
A pesar de que hasta en un 30% de ictus se diagnostica una FA previamente desconocida3, en atención primaria no se han establecido protocolos específicos para la detección de individuos con alto riesgo de sufrir una FA. Aunque existen recomendaciones de cribado sistemático u oportunista, no se ha demostrado que reduzcan la incidencia de ictus. Además, resulta difícil comparar la relación coste-efectividad por las variaciones en los entornos y modelos utilizados16,17. Por otra parte, sociedades científicas internacionales15,18,19 protocolizan el uso de nuevas tecnologías especialmente después de un ictus, pero no en la detección primaria y el seguimiento ambulatorio.
La miocardiopatía auricular (MA) es definida por anomalías morfológicas y/o estructurales, intrínsecamente protrombótica independientemente del ritmo cardíaco, y que se asocia al riesgo de nueva FA, ictus silentes y demencia20–22. Puede detectarse con electrocardiograma (ECG) mediante el análisis de la onda P. Recientemente se ha propuesto el MVP (morphology-voltage-P-wave duration) risk score23 como herramienta de predicción de una futura FA e ictus24–26 mediante la identificación de patrones electrocardiográficos2,23 de la onda P. Dada la accesibilidad al ECG en la atención primaria, dichos patrones podrían ser una oportunidad para mejorar el diagnóstico precoz de la FA3,18. El objetivo principal de este estudio es describir la asociación entre MVP ECG risk score y el diagnóstico de FA en población de alto riesgo1.
Material y métodosEl proyecto PREFATE es un estudio observacional de cohorte prospectivo (1/01/2023-31/12/2024) cuyo protocolo ha sido publicado previamente1 y registrado en ClinicalTrials.gov (NCT 05772806). Los datos del presente estudio incluyen los resultados del seguimiento desde el 1 de enero de 2023 hasta el 30 de junio de 2023.
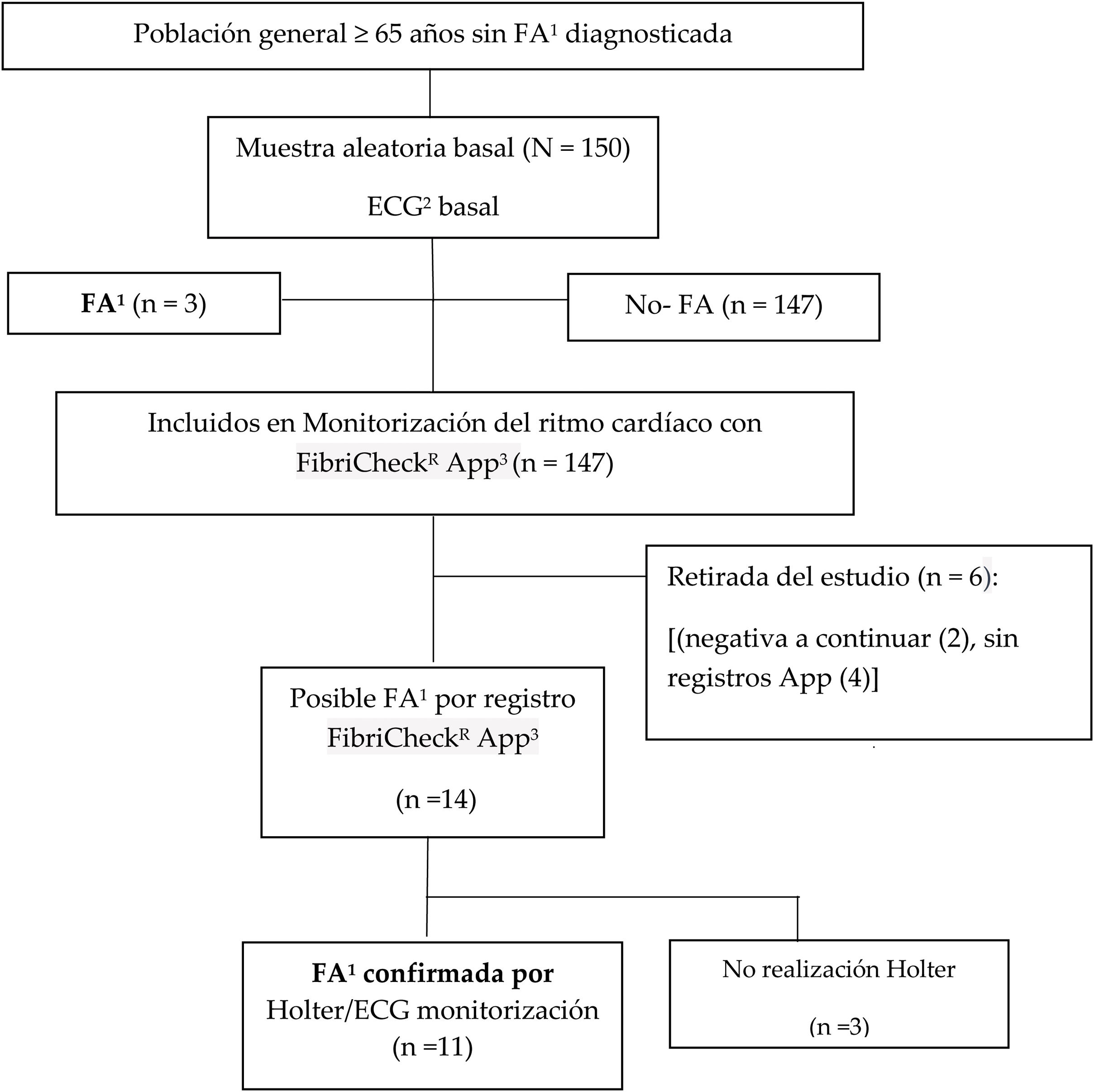
Se obtuvo una muestra aleatorizada de 150 pacientes a partir de los registros clínicos informatizados de los centros de atención primaria (CAP) del sur de Cataluña. En la figura 1 se muestra el diagrama de flujo (CONSORT) de los participantes.
Fueron criterios de inclusión: (1) edad 65-85 años; (2) sin diagnóstico previo de FA (cualquier tipo), ni ictus, ni tratamiento anticoagulante actual; (3) alto riesgo de una futura FA según fórmula publicada27; (4) un resultado ≥2 en la escala CHA2DS2-VASc; (5) capacidad para utilizar la aplicación (App) FibricheckR28, ya sea por el paciente o el cuidador. Todos los participantes fueron informados de los objetivos y requerimientos del estudio y firmaron un consentimiento informado.
Las variables dependientes fueron la presencia de patrones de la onda P en el ECG basal según MVP ECG risk score (tabla 1S); y un nuevo diagnóstico de FA posterior. Las variables independientes incluyeron aquellas necesarias para la estratificación según el riesgo de FA, factores sociodemográficos, clínicas, comorbilidades, escalas de riesgo cardiovascular, y tratamiento cardiovascular activo (tabla 1). Los datos basales se recopilaron de forma anónima, de manera automática cuando fuera posible o manualmente a partir de los registros clínicos electrónicos (E-cap, E-SAP, SIRE), así como a través de los registros generados por la App FibricheckR29.
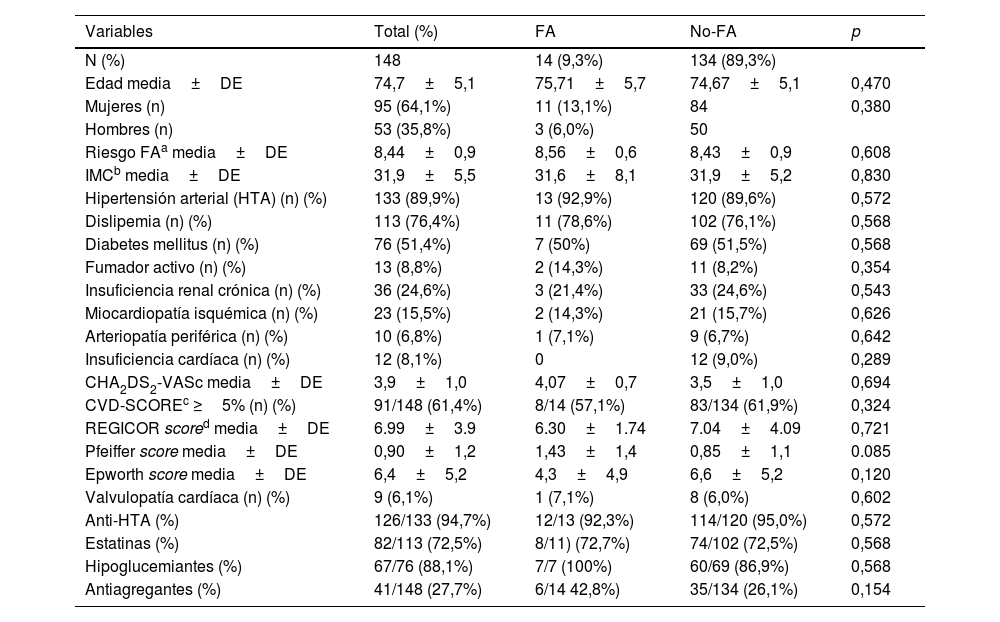
Características basales según diagnóstico de FA
| Variables | Total (%) | FA | No-FA | p |
|---|---|---|---|---|
| N (%) | 148 | 14 (9,3%) | 134 (89,3%) | |
| Edad media±DE | 74,7±5,1 | 75,71±5,7 | 74,67±5,1 | 0,470 |
| Mujeres (n) | 95 (64,1%) | 11 (13,1%) | 84 | 0,380 |
| Hombres (n) | 53 (35,8%) | 3 (6,0%) | 50 | |
| Riesgo FAa media±DE | 8,44±0,9 | 8,56±0,6 | 8,43±0,9 | 0,608 |
| IMCb media±DE | 31,9±5,5 | 31,6±8,1 | 31,9±5,2 | 0,830 |
| Hipertensión arterial (HTA) (n) (%) | 133 (89,9%) | 13 (92,9%) | 120 (89,6%) | 0,572 |
| Dislipemia (n) (%) | 113 (76,4%) | 11 (78,6%) | 102 (76,1%) | 0,568 |
| Diabetes mellitus (n) (%) | 76 (51,4%) | 7 (50%) | 69 (51,5%) | 0,568 |
| Fumador activo (n) (%) | 13 (8,8%) | 2 (14,3%) | 11 (8,2%) | 0,354 |
| Insuficiencia renal crónica (n) (%) | 36 (24,6%) | 3 (21,4%) | 33 (24,6%) | 0,543 |
| Miocardiopatía isquémica (n) (%) | 23 (15,5%) | 2 (14,3%) | 21 (15,7%) | 0,626 |
| Arteriopatía periférica (n) (%) | 10 (6,8%) | 1 (7,1%) | 9 (6,7%) | 0,642 |
| Insuficiencia cardíaca (n) (%) | 12 (8,1%) | 0 | 12 (9,0%) | 0,289 |
| CHA2DS2-VASc media±DE | 3,9±1,0 | 4,07±0,7 | 3,5±1,0 | 0,694 |
| CVD-SCOREc ≥5% (n) (%) | 91/148 (61,4%) | 8/14 (57,1%) | 83/134 (61,9%) | 0,324 |
| REGICOR scored media±DE | 6.99±3.9 | 6.30±1.74 | 7.04±4.09 | 0,721 |
| Pfeiffer score media±DE | 0,90±1,2 | 1,43±1,4 | 0,85±1,1 | 0.085 |
| Epworth score media±DE | 6,4±5,2 | 4,3±4,9 | 6,6±5,2 | 0,120 |
| Valvulopatía cardíaca (n) (%) | 9 (6,1%) | 1 (7,1%) | 8 (6,0%) | 0,602 |
| Anti-HTA (%) | 126/133 (94,7%) | 12/13 (92,3%) | 114/120 (95,0%) | 0,572 |
| Estatinas (%) | 82/113 (72,5%) | 8/11) (72,7%) | 74/102 (72,5%) | 0,568 |
| Hipoglucemiantes (%) | 67/76 (88,1%) | 7/7 (100%) | 60/69 (86,9%) | 0,568 |
| Antiagregantes (%) | 41/148 (27,7%) | 6/14 42,8%) | 35/134 (26,1%) | 0,154 |
Los datos se presentan como frecuencias (y porcentajes) o media (y desviación estándar).
A la inclusión, en el centro de atención primaria de referencia, se realizó un ECG basal estándar de superficie de 12 derivaciones (con una configuración de filtro de 150Hz, velocidad de registro de 25mm/s y calibración de 10mm/mV) para todos los pacientes; y una monitorización del ritmo cardíaco basal durante 15 días utilizando la App FibricheckR según protocolo.
Los registros generados por la App FibricheckR fueron revisados por el investigador referente. En caso de que informara de una posible FA, debía ser confirmada mediante ECG, y si el trazado era negativo para FA, se derivaba el paciente a Cardiología para la realización de un Holter según criterios de la European Heart Rhythm Association (EHRA)30. Todos los ECG y resultados del Holter fueron reevaluados manualmente por Cardiología en referencia a:
1/ Presencia de criterios del MVP ECG risk score2 (tabla S1). Utiliza las 6 derivaciones frontales, mostradas simultáneamente, para medir la duración de la onda P en milisegundos en V1, el voltaje en la derivación I en milivoltios; y su morfología en II, III, avF.
2/ Presencia de bloqueo interauricular avanzado (BIA-A) típico o atípico según los criterios definidos31. El diagnóstico clínico de A-IAB se basa en la detección del retraso en la conducción del estímulo sinusal entre la aurícula derecha y la aurícula izquierda. Su presencia se asocia a un incremento del riesgo de FA e ictus.
Los datos se presentan utilizando frecuencias y porcentajes para variables categóricas y medias con desviaciones estándar para variables continuas. Para evaluar las diferencias entre estos dos grupos, se aplicó la prueba de chi-cuadrado a variables categóricas y la prueba U de Mann-Whitney para variables continuas. Inicialmente, se realizó una correlación bivariada para explorar la relación entre criterios del MVP ECG risk y el diagnóstico de FA, una regresión logística binaria utilizando como variable dependiente el diagnóstico de FA y el R2 de Cox y Snell para la varianza de la variable dependiente. La capacidad discriminativa de las variables significativas se evaluó utilizando el área bajo la curva (AUC). Todos los análisis se realizaron con un nivel significación p≤0,05 bilateral utilizando el paquete estadístico IBM SPSS Statistics 19.
ResultadosEl diagnóstico de FA fue confirmado en 14 casos (9,3%, IC95% 5,6-15,1), 3 hombres y 11 mujeres. En 3 casos, la arritmia fue diagnosticada en el ECG basal y 11 tras la confirmación por Holter después de ser informadas como FA en la monitorización con el FibricheckR App. De estas, en la visita basal 5 habían sido calificadas como «anormales» y en 9 casos se registró un ritmo sinusal. En 3 casos no se realizó Holter por negativa del paciente.
En la tabla 1 se describen las características basales según la presencia o no de FA. No se identificaron diferencias significativas entre ambos grupos, excepto en el caso de la puntuación en el test de Pfeiffer que fue superior entre los casos con FA, pero sin alcanzar significación estadística.
Se diagnosticaron otras patologías cardíacas en pacientes adicionales: mixoma auricular (n=1), miocardiopatía dilatada (n=1), extrasístoles supraventriculares (n=17), episodios de bigeminismo o trigeminismo auricular (n=12), episodios de taquicardia supraventricular (n=3), bloqueos AV asociados a episodios de síncope con indicación de marcapasos (n=2). El número medio de autocontroles con FibricheckR App durante los 15 días de monitorización fue 32,7±19,5.
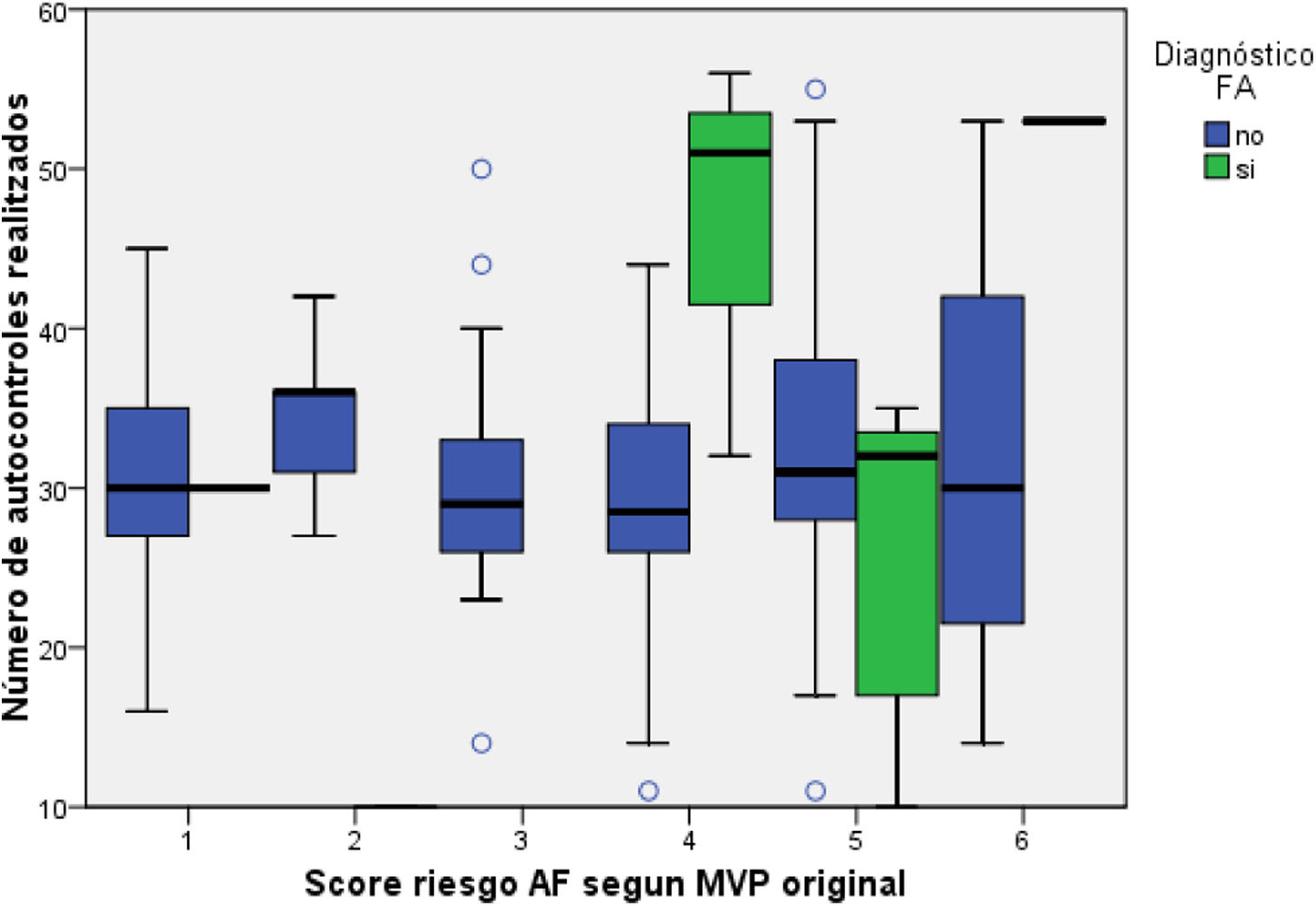
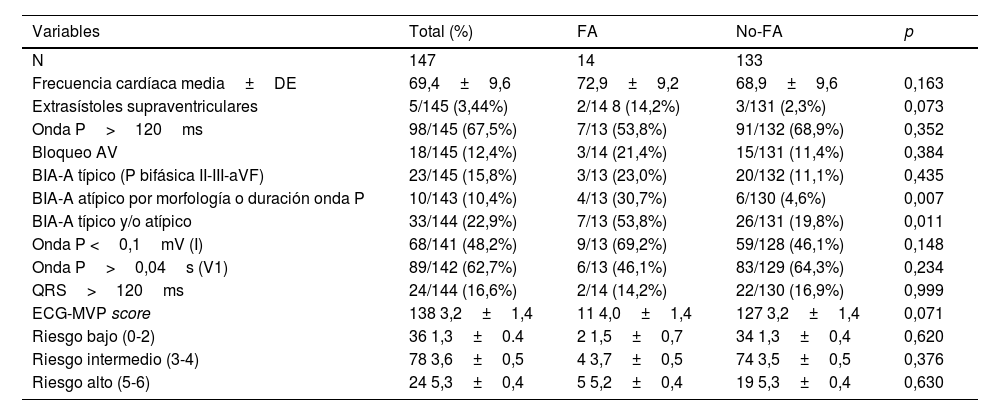
En relación con las variables en ECG (tabla 2), se detectó una prevalencia significativamente superior de BIA-A atípico (p=0,007) entre los participantes con FA, así como la prevalencia de onda P <0,1mV (p=0,006). El puntaje en el ECG-MVP score muestra valores mayores entre aquellos con FA, pero no cuando se estratifica por el nivel de riesgo. Todos los nuevos diagnósticos de FA se realizaron en puntuaciones ≥4 en el MVP ECG risk score (fig. 2). El denominador de algunos porcentajes fue inferior por valores perdidos, pero nunca >5%.
Resultados en variables ECG estándar según diagnóstico de FA
| Variables | Total (%) | FA | No-FA | p |
|---|---|---|---|---|
| N | 147 | 14 | 133 | |
| Frecuencia cardíaca media±DE | 69,4±9,6 | 72,9±9,2 | 68,9±9,6 | 0,163 |
| Extrasístoles supraventriculares | 5/145 (3,44%) | 2/14 8 (14,2%) | 3/131 (2,3%) | 0,073 |
| Onda P>120ms | 98/145 (67,5%) | 7/13 (53,8%) | 91/132 (68,9%) | 0,352 |
| Bloqueo AV | 18/145 (12,4%) | 3/14 (21,4%) | 15/131 (11,4%) | 0,384 |
| BIA-A típico (P bifásica II-III-aVF) | 23/145 (15,8%) | 3/13 (23,0%) | 20/132 (11,1%) | 0,435 |
| BIA-A atípico por morfología o duración onda P | 10/143 (10,4%) | 4/13 (30,7%) | 6/130 (4,6%) | 0,007 |
| BIA-A típico y/o atípico | 33/144 (22,9%) | 7/13 (53,8%) | 26/131 (19,8%) | 0,011 |
| Onda P <0,1mV (I) | 68/141 (48,2%) | 9/13 (69,2%) | 59/128 (46,1%) | 0,148 |
| Onda P>0,04s (V1) | 89/142 (62,7%) | 6/13 (46,1%) | 83/129 (64,3%) | 0,234 |
| QRS>120ms | 24/144 (16,6%) | 2/14 (14,2%) | 22/130 (16,9%) | 0,999 |
| ECG-MVP score | 138 3,2±1,4 | 11 4,0±1,4 | 127 3,2±1,4 | 0,071 |
| Riesgo bajo (0-2) | 36 1,3±0.4 | 2 1,5±0,7 | 34 1,3±0,4 | 0,620 |
| Riesgo intermedio (3-4) | 78 3,6±0,5 | 4 3,7±0,5 | 74 3,5±0,5 | 0,376 |
| Riesgo alto (5-6) | 24 5,3±0,4 | 5 5,2±0,4 | 19 5,3±0,4 | 0,630 |
Los datos se presentan como frecuencias (y porcentajes) o media (y desviación estándar).
Los resultados de la correlación bivariada entre patrones en el ECG y el diagnóstico de FA fueron: BIA-A típico (p<0,001), BIA-A típico y/o atípico (p=0,005), voltaje onda P <0,1mV (p=0,006), y presencia extrasístoles supraventriculares (p<0,001).
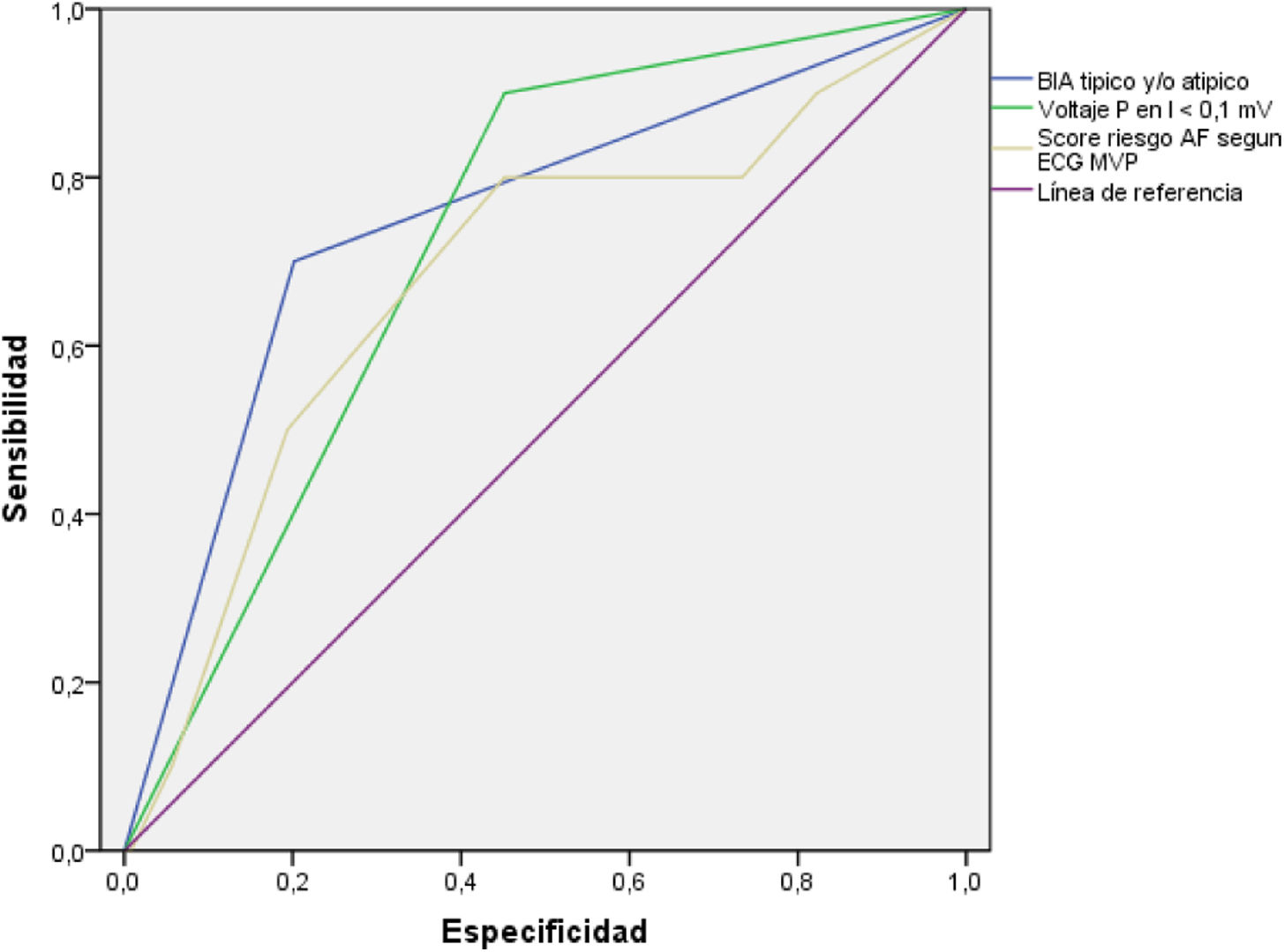
En el modelo de regresión, el BIA-A se identificó como único factor independiente [p=0,008]. El modelo de variables independientes es significativo (p=0,004), explica el 0,152-0,187 de la variable dependiente, y clasifica correctamente el 92,6% de los casos. En los resultados de la curva ROC (fig. 3) fueron significativos la identificación de un patrón ECG de BIA-A típico y/o atípico (0,78 IC95% 0,58-0,92; p=0,009); el voltaje onda P <0,1mV (0,72 IC95% 0,59-0,86; p=0.019); y el MVP ECG risk score (0,68 IC95% 0,50-0,86; p=0,057).
DiscusiónA pesar de tratarse de una muestra relativamente reducida, el uso del FibricheckR App en sujetos identificados con alto riesgo detectó 14 posibles FA, de las que se confirmaron 11. Este resultado es similar a los publicados previamente con el mismo modelo tecnológico de cribado, cuyos registros de sensibilidad oscilan entre el 79 y 100%29 y valor predictivo positivo del 97,5%±4,6, pero muy superior a los resultados obtenidos por la detección oportunista (NNS=1/13 vs. 1/147)3,32,33 apoyando la evidencia cada vez más reconocida de que una FA puede estar presente pero no ser reconocida, lo que se conoce como «fibrilación auricular silenciosa», mucho antes de que se realice cualquier diagnóstico clínico34. Además, la detección de episodios de FA por dispositivos es un indicador de un mayor riesgo de accidente cerebrovascular, insuficiencia cardíaca y muerte34–36. En contraste, más allá de la optimización de los factores de riesgo, el manejo ideal de la FA subclínica o detectada por dispositivos sigue sin definirse. Finalmente, es destacable que el diagnóstico de nueva FA sea el doble en mujeres, lo cual coincide con datos publicados37 sobre diferencias en salud cardiovascular en el territorio de estudio.
Actualmente, el enfoque clínico describe la hipótesis de que la disfunción auricular sería un primer paso de una cascada trombogénica que incrementaría el riesgo de sufrir un ictus38. El BIA-A típico y/o atípico podría facilitar el diagnóstico precoz de una FA destacando la importancia de reconocer estos patrones en el ECG para identificar individuos con mayor riesgo de FA. La conducción interauricular bloqueada, generalmente a nivel del septo y alto de la aurícula izquierda, es conocida como el síndrome de Bayes39,40 y se asocia a un mayor riesgo de FA y/o flutter auricular especialmente en sujetos con antecedentes de enfermedad cardíaca previa, accidente cerebrovascular cardioembólico y demencia41,42. Los resultados muestran una asociación significativa de BIA-A típico y/o atípico con el diagnóstico de FA, y el test de Pfeiffer fue superior en aquellos con nueva FA en la línea de la asociación de un mayor riesgo trombótico y la detección de ictus silentes hasta en el 22% de estudios con TAC y hasta en un 44% con resonancia magnética42.
Aunque el BIA-A está comúnmente presente en el contexto de la dilatación del AI, es reconocido como una entidad separada, pero ambos se expresan como una duración de la onda P ≥120ms. Su correcta interpretación puede estar limitada por la ubicación del electrodo y porque puede ser transitorio dependiendo del estado hemodinámico23,43. Respecto al voltaje de la onda P, los resultados muestran una diferencia en el eje que depende de la dirección de la despolarización auricular. Cuando hay interferencias en la conducción interauricular, como ocurre en presencia de BIA-A, el eje de la onda P se desplaza, lo que explicaría su resultado en la curva ROC. No obstante, ambos parámetros confirmarían su interés como predictivos de la incidencia de FA24. En este sentido, el MVP score sería un factor predictor del inicio de una FA, pero aún no estaría validado como tal en el caso del ictus. No obstante, el valor R2 obtenido indica que el modelo explicaría aproximadamente entre un 15,2 y 18,7% de la relación entre la presencia de BIA-A típico y/o atípico y la variable dependiente, es significativo y clasificaría correctamente el 92,6% de los casos.
Entre las fortalezas del estudio destaca la facilidad y accesibilidad al proceso de aprendizaje y uso del dispositivo FibricheckR, y el acceso a la información de la automonitorización generada automáticamente desde el primer día, facilitando la decisión de los profesionales en sus decisiones clínicas sobre exploraciones adicionales44. La detección de otras patologías tratables significa otro beneficio colateral.
Como limitaciones, desagregar los patrones ECG por sexo podría aportar información dado el mayor número de mujeres en la muestra, pero no era un objetivo identificar patrones ECG diferentes por sexo. Por otra parte, aunque el modelo es aceptable, el estudio no prueba causalidad; el puntaje MVP ECG risk score requiere de una aplicación semiautomática de calibradores digitales para poder encontrar diferencias en la duración de la onda P de al menos 20ms; y la falta de uniformidad por parte de los profesionales de diferentes niveles asistenciales en el protocolo a seguir ante la sospecha de una FA a partir de una monitorización del ritmo cardíaco con dispositivo homologado, que puede multiplicarse cuando los centros referentes son múltiples. Otros factores como la capacidad de manejo de la App es descrita como criterio de inclusión número 5. No obstante, en la ampliación futura del estudio se tendrán en cuenta posibles dificultades en el uso de la App, como accesibilidad, disponibilidad a pagar, disponibilidad de un dispositivo con la tecnología apropiada, y el uso de la misma.
En definitiva, utilizar en atención primaria escalas validadas de riesgo poblacional y patrones ECG puede facilitar la identificación de sujetos de alto riesgo a los que podrían indicarse pruebas más discriminativas como la ecocardiografía o el uso protocolizado añadido de dispositivos homologados para la monitorización del ritmo. Esto permitiría ahorrar costes tanto para los pacientes, que podrían monitorizar su ritmo cardíaco desde su hogar, como para los profesionales sanitarios que pueden acceder a los registros telemáticos con una mejora significativa en su efectividad diagnóstica, ya que aumentaría la sensibilidad diagnóstica de la FA y el inicio de tratamiento con anticoagulantes, reduciendo derivaciones y pruebas. La inclusión de algoritmos de IA o/y la identificación automatizada de estos patrones ECG45–48, tal como se realiza habitualmente con otros parámetros ECG en la práctica clínica habitual, podría facilitar la identificación de sujetos de alto riesgo de sufrir una FA, y mejorar la prevención del ictus y sus incrementales consecuencias tanto para el individuo como para la sociedad. Finalmente, los resultados plantean de nuevo la opción del uso protocolizado de la monitorización Holter o la alternativa de dispositivos substitutivos49 en atención primaria sin tener que derivar a otros niveles asistenciales.
- •
El Stroke Action Plan for Europe 2018-2030 prioriza la disponibilidad de programas de detección y tratamiento en atención primaria para mejorar el diagnóstico y seguimiento de poblaciones en riesgo de fibrilación auricular (FA).
- •
Se han descrito patrones electrocardiográficos asociados a la morfología de la onda P como factor de riesgo de una futura FA e ictus, y se ha propuesto el MVP risk score como herramienta de cribado para identificar individuos de alto riesgo que podrían beneficiarse de una investigación adicional para el diagnóstico o seguimiento de FA.
- •
La conducción interatrial bloqueada se asocia a un mayor riesgo de FA y/o flutter.
- •
Todos los nuevos diagnósticos de FA se realizaron en puntuaciones ≥4 en el MVP score, sin diferencias en el número de autocontroles realizados mediante la App FibricheckR.
- •
Se detectó una prevalencia significativamente superior de BIA-A típico (p=0,007) y/o atípico (p=0,011) entre aquellos en los que se diagnosticó una FA.
- •
En el modelo de regresión el BIA-A típico y/o atípico se identificó como único factor predictor independiente [OR: 2,6 IC95%: 1,34-5,00; p=0,004], y explicaría aproximadamente un 15,2% de la relación entre las variables ECG y la variable dependiente.
El proyecto PREFATE está registrado en ClinicalTrials.gov como NCT05772806 (3 de abril de 2023). El estudio se llevó a cabo conforme a los estándares de protección de datos y privacidad según la Declaración de Helsinki de 1975 actualizada, y fue evaluado por el Comité de Revisión Ética del IDIAP Jordi Gol (número de registro: 22/090-P). Todos los participantes firmaron el consentimiento informado.
FinanciaciónEl presente trabajo ha sido financiado por la beca PERIS 2022 4R22/031 (SLT021/21/000027).
Conflicto de interesesNinguno de los autores declara conflictos de interés.
A todo el personal clínico y administrativo, tanto de los centros de atención primaria como de los servicios referentes en la realización de pruebas complementarias incluidas en el protocolo, por su participación directa y/o indirecta en el complejo proceso asistencial añadido a la práctica clínica diaria; así como al Instituto de Investigación en Atención Primaria - IDIAP Jordi Gol por su continuo compromiso con la investigación en atención primaria.
A. Panisello-Tafalla, J. Clua-Queralt (EAP Tortosa est); A.Grau-Roche, T. Forcadell-Arenas, KV. Yañez-Cabrera (EAP Tortosa oest); E. Muria-Subirats, EM. Llorens-Insa; MJ. Forcadell-Peris (EAP Amposta); G. Batlle-Escolies, S. Sancho-Maigi, M. Saura-Prades, M. Miravalls-Joan, A. Quilez-Recio (EAP Aldea-Camarles-Ampolla); G. Lucas-Noll, C. Calduch-Noll (EAP La Ràpita-Alcanar); C. de Diego-Cabanes, A. Diaz-Vilarasau (CAP Centre Salou); D. Ribas-Seguí, C. Molins-Rojas (Centre Sant Pere i Sant Pau); I. Lechuga Duran (Cardiología Hospital Virgen de la Cinta de Tortosa); M. Guillen-Marzo, LA. Anmad-Shihadeh, A. Bardají-Ruiz (Cardiología Hospital Joan XXIII de Tarragona); JA. Izuel-Navarro, AM.Viveros-Castaño (Institut de Diagnostic per la Imatge –IDI- Terres de l’Ebre); M. Rovira-Beltran, E. Salvado-Geli, A. Samitier-Pastor (IDI Camp de Tarragona); P. Delgado-Martínez, A Penalba-Morenilla (VHIR, Barcelona).