La opción terapéutica más evaluada para modificar el perfil lipídico consiste en la reducción del colesterol de las lipoproteínas de baja densidad (cLDL) mediante la utilización de estatinas en las dosis estándares1. Otra opción terapéutica es potenciar la reducción del cLDL conseguida con las dosis estándares de estatinas mediante el empleo de dosis altas o asociando fármacos que interfieran con la absorción intestinal del colesterol (resinas o ezetimiba).
También se puede actuar sobre los otros componentes del perfil lipídico distintos del cLDL. Entre estas actuaciones, el aumento del colesterol ligado a lipoproteínas de alta densidad (cHDL) tiene pruebas científicas que relacionan su elevación farmacológica con la reducción de la enfermedad cardiovascular2. Debido a que el efecto de las estatinas sobre el cHDL es modesto, para poner en práctica esta estrategia se requiere la asociación de otros fármacos, como pueden ser los fibratos o la niacina (fármaco actualmente no disponible en España).
De cada una de estas opciones se presenta el enunciado que justifica la opción terapéutica, se analizan los fármacos utilizados, los argumentos a favor de su uso y los argumentos en contra o las limitaciones que presentan. Finalmente, se comentan las recomendaciones de las guías clínicas y se propone una estrategia terapéutica de tratamiento de la dislipemia.
Reducir el cLDLEnunciadoLa reducción del cLDL determina el beneficio cardiovascular del tratamiento con estatinas.
FármacosLos fármacos utilizados en esta opción terapéutica son las estatinas en monoterapia en las dosis estándares, es decir, las utilizadas en la mayoría de los ensayos clínicos que comparan las estatinas frente a placebo (pravastatina [40mg/día], lovastatina [20–40mg/día], simvastatina [20–40mg/día], fluvastatina [80mg/día] y atorvastatina [10mg/día]). En estas dosis se consigue una reducción del cLDL en torno a 1mmol/l (39mg/dl)1.
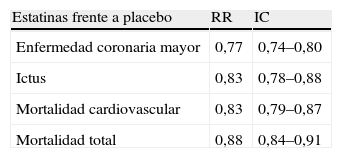
Argumentos a favorLos argumentos de la utilización de estatinas en dosis estándares son más abundantes y de mejor calidad que los argumentos disponibles para cualquier otra opción. Se pueden resumir en el metaanálisis de Baigent et al, que concluye que el descenso de 1mmol/l de cLDL (39mg/dl) con las estatinas reduce la incidencia de cardiopatía isquémica, enfermedad cerebrovascular, mortalidad cardiovascular y mortalidad total (tabla 1)1.
Riesgo relativo de los ensayos clínicos que comparan estatinas en dosis estándares frente a placebo y por 1mmol/l de descenso del cLDL1
| Estatinas frente a placebo | RR | IC |
| Enfermedad coronaria mayor | 0,77 | 0,74–0,80 |
| Ictus | 0,83 | 0,78–0,88 |
| Mortalidad cardiovascular | 0,83 | 0,79–0,87 |
| Mortalidad total | 0,88 | 0,84–0,91 |
IC: intervalo de confianza al 95%; RR: riesgo relativo.
En general, las estatinas son fármacos bien tolerados con un perfil de tolerabilidad y de seguridad muy bueno y ampliamente utilizadas. Sin embargo, presentan 2 efectos adversos relevantes que obligan a una vigilancia del paciente. Éstos son la hepatopatía, que generalmente se manifiesta como hipertransaminemia, y la miopatía (su consecuencia más grave es la rabdomiolisis); ambos son más frecuentes con dosis más altas de estatinas3,4.
Las estatinas reducen la enfermedad cerebrovascular a expensas de reducir los ictus isquémicos, pero no han demostrado un descenso de los ictus hemorrágicos1. Además, en pacientes con enfermedad cerebrovascular previa se ha demostrado que un tratamiento con altas dosis de estatinas produce un descenso de la enfermedad cerebrovascular globalmente considerado (riesgo relativo [RR] de 0,84; IC del 95%: de 0,71 a 0,995), pero con aumento de los ictus hemorrágicos (RR de 1,73; IC del 95%: de 1,19 a 2,50)6.
Reducir más el cLDLEnunciadoUna reducción más acusada del cLDL consigue reducciones mayores de la enfermedad cardiovascular.
FármacosLos fármacos utilizados para reducir más el cLDL son las estatinas en dosis máximas, fundamentalmente la atorvastatina (80mg/día), que consigue reducciones del cLDL de un 50 a un 55%7. La ezetimiba cuando se añade a la estatina desciende adicionalmente el cLDL un 25%8 y las resinas hasta un 20% (variable en función de la dosis)9,10. La niacina disminuye el cLDL en torno a un 20%, si bien al aumentar simultáneamente el cHDL se expone la estrategia de disminuir el cLDL y de aumentar simultáneamente el cHDL.
Argumentos a favorLos argumentos a favor de una reducción mayor del cLDL que la conseguida con las dosis estándares de estatinas son, en general, de 2 tipos:
- 1)
La existencia de una relación lineal entre la reducción del cLDL y el descenso de la enfermedad coronaria. El metaanálisis de Baigent et al1 ha demostrado que la posibilidad más factible de relación entre la reducción del cLDL y la reducción de la enfermedad cardiovascular es la relación lineal. Esto significa que la reducción del riesgo es directamente proporcional a la reducción del cLDL, lo que establece que un descenso de 1mmol/l (39mg/dl) determina una reducción del riesgo cardiovascular de un 21%. Si se cumple esta relación lineal, los mayores descensos del cLDL conseguidos con dosis máximas de estatinas obtendrían mayores beneficios que con dosis estándares. Aún no se ha establecido el umbral de LDL sobre el que una reducción mayor no obtenga beneficios.
- 2)
La reducción de la enfermedad cardiovascular con dosis altas de estatinas. Se han realizado varios ensayos clínicos en pacientes con cardiopatía isquémica crónica o después de un síndrome coronario agudo para comparar un tratamiento más intensivo con dosis altas de estatinas (simvastatina [80mg/día] o atorvastatina [80mg/día], más frecuentemente) con otro tratamiento con dosis estándares. El metaanálisis de estos estudios ha concluido que el tratamiento intensivo reduce las LDL una media de 0,72mmol/l (28mg/dl) con respecto al tratamiento con dosis estándares de estatinas, y consiguió beneficios significativos en la reducción de la enfermedad coronaria mayor e ictus, sin afectar a la mortalidad total (tabla 2)11.
Recientemente, el estudio Simvastatin and Ezetimibe in Aortic Stenosis (SEAS) evaluó la administración de simvastatina (40mg/día) junto con ezetimiba frente a placebo en pacientes con estenosis aórtica. En este estudio se observó una reducción de la enfermedad cardiovascular isquémica (RR de 0,78; IC del 95%: de 0,63 a 0,97), sobre todo a expensas del descenso del número de intervenciones de revascularización, y sin afectar a la enfermedad cardiovascular en general, incluido el reemplazo quirúrgico de la válvula aórtica12.
Argumentos en contraEl aumento de los efectos adversos de los medicamentos supone el argumento principal en contra de esta opción terapéutica, ya que puede contrarrestar en parte los beneficios. Así, la miopatía con o sin rabdomiolisis y la elevación de las aminotransferasas son más frecuentes con dosis altas de estatinas3,4 que con dosis estándares y la ezetimiba aumenta la frecuencia de hipertransaminemia13. Además, todavía se desconoce la seguridad a largo plazo de alcanzar unas cifras de cLDL tan bajas.
Por otro lado, el tratamiento intensivo con estatinas parte de una concentración de cLDL más baja que el tratamiento con dosis estándar. Esto ocasiona que a medida que el cLDL está más bajo, los mg que se pueden reducir del LDL son menores y, de acuerdo con la relación lineal entre la reducción del cLDL y la reducción de riesgo del metaanálisis de Baigent et al1, menor será el porcentaje de descenso de la enfermedad cardiovascular.
Recientemente, el estudio SEAS, comentado en los argumentos a favor, también plantea algunos interrogantes de la estrategia de tratamiento combinado de estatinas con ezetimiba. Así, en este estudio se observó un aumento del cáncer en el grupo tratado con simvastatina y ezetimiba (105 frente a 70; p = 0,01), aunque en una revisión de los ensayos clínicos realizados o actualmente en marcha con ezetimiba no se observó este aumento de casos de cáncer (216 frente a 254 en el grupo control; p = 0,08)14. La publicación final de los ensayos clínicos de ezetimiba ayudará a clarificar mejor estos hallazgos.
Reducir el cLDL y aumentar el cHDLEnunciadoEl aumento del cHDL tiene un efecto aditivo beneficioso al descenso del cLDL en la reducción de la enfermedad cardiovascular.
FármacosEsta estrategia requiere la utilización de un tratamiento combinado basado en la asociación de una estatina a la niacina (o ácido nicotínico) o a los fibratos. La utilización de niacina o de fibratos en monoterapia no está considerada como la primera opción terapéutica para el tratamiento de la dislipemia debido a que los resultados en cuanto a la reducción de la morbimortalidad cardiovascular son inferiores a los de las estatinas. Aunque las estatinas también aumentan el cHDL, lo hacen en un escaso porcentaje (entre un 3 y un 9%)15.
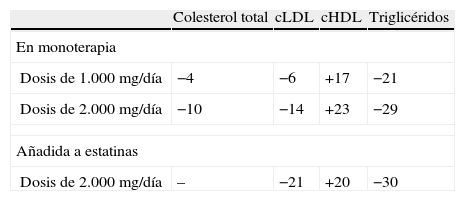
La formulación que se utiliza actualmente es la niacina de liberación extendida que tiene una velocidad de absorción intestinal intermedia entre la niacina de liberación rápida (descartada por mayor frecuencia de sofocos) y la niacina de liberación lenta (descartada por hepatotoxicidad)16. La niacina tiene un efecto global sobre los componentes del perfil lipídico: aumenta el cHDL y disminuye el cLDL, los triglicéridos y los quilomicrones. En pacientes tratados con estatinas, la niacina (2g/día) desciende adicionalmente el cLDL en torno a un 20% y también aumenta el cHDL un 20% (tabla 3)17.
Modificación del perfil lipídico (%) por la niacina de liberación extendida
| Colesterol total | cLDL | cHDL | Triglicéridos | |
| En monoterapia | ||||
| Dosis de 1.000mg/día | −4 | −6 | +17 | −21 |
| Dosis de 2.000mg/día | −10 | −14 | +23 | −29 |
| Añadida a estatinas | ||||
| Dosis de 2.000mg/día | – | −21 | +20 | −30 |
cHDL: colesterol ligado a lipoproteínas de alta densidad; cLDL colesterol ligado a lipoproteínas de baja densidad.
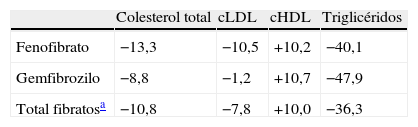
Los fibratos son los fármacos hipolipidemiantes que más reducen los triglicéridos; también aumentan el cHDL y reducen en menor medida el cLDL. Entre los fibratos, el fenofibrato produce mayores reducciones del cLDL que del gemfibrozilo18 (tabla 4). El fenofibrato asociado a la atorvastatina en diabéticos consigue reducciones significativas frente a la atorvastatina sola del cLDL y frente a triglicéridos e incrementos del cHDL19.
Modificación del perfil lipídico por los fibratos (%)18
| Colesterol total | cLDL | cHDL | Triglicéridos | |
| Fenofibrato | −13,3 | −10,5 | +10,2 | −40,1 |
| Gemfibrozilo | −8,8 | −1,2 | +10,7 | −47,9 |
| Total fibratosa | −10,8 | −7,8 | +10,0 | −36,3 |
cHDL: colesterol ligado a lipoproteínas de alta densidad; cLDL colesterol ligado a lipoproteínas de baja densidad.
Estudios observacionales han demostrado que una reducción del 1% del cLDL consigue un 1% de descenso del riesgo cardiovascular, pero si a la vez se aumenta el cHDL, por cada aumento del 1% se añadiría un 1% de reducción del riesgo2.
En un metaanálisis de ensayos clínicos realizados con combinaciones de fármacos hipolipidemiantes que incluyen la niacina se obtuvieron reducciones de enfermedad cardiovascular del 66% con respecto al grupo placebo2. Estas reducciones tan importantes del riesgo se relacionan con la reducción del cLDL y con el aumento simultáneo del cHDL2. También hay ensayos clínicos en monoterapia con fibratos o niacina que han demostrado reducción del riesgo de enfermedad coronaria18,20.
Otro argumento a favor de esta estrategia de tratamiento es que, incluso si se consiguen descensos agresivos del cLDL con tratamiento intensivo con estatinas, la incidencia de complicaciones cardiovasculares sigue siendo elevada en los pacientes de alto riesgo. Así, por ejemplo, en el ensayo clínico Treating to New Targets (TNT), el grupo tratado con 10mg/día de atorvastatina tuvo una incidencia de complicaciones cardiovasculares del 33% en 5 años, mientras que en el grupo tratado con 80mg/día de atorvastatina, la incidencia fue aún del 28%. Es decir, incluso cuando se redujo un 22% el riesgo en los pacientes tratados con atorvastatina en altas dosis, el riesgo cardiovascular permaneció muy elevado. En este mismo estudio, incluso en los pacientes en los que se descendió el cLDL por debajo de 70mg/dl, aquéllos con cifras bajas de cHDL fueron los que más incidencia de complicaciones cardiovasculares tuvieron. Dada la existencia de este elevado riesgo cardiovascular residual en los pacientes tratados adecuadamente con estatinas, la estrategia de aumentar simultáneamente el cHDL puede ser una opción para reducir aún más el riesgo cardiovascular21.
Según las declaraciones de efectos adversos realizadas a la Food and Drug Administration, la niacina de liberación extendida presenta una frecuencia de efectos adversos graves, hepatotoxicidad y rabdomiolisis inferior al de los fibratos y semejante al de las estatinas más utilizadas. El uso combinado de la niacina de liberación extendida y las estatinas presenta una frecuencia de efectos adversos (efectos adversos graves, hepatotoxicidad y rabdomiolisis) semejante al que presentan los fármacos por separado22. Este argumento a favor, no excluye la realización de un estrecho seguimiento clínico y analítico para valorar la posible aparición de toxicidad hepática o muscular, sobre todo, cuando se asocia con estatinas.
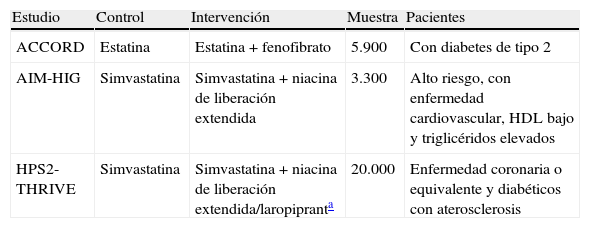
Argumentos en contraActualmente, no se disponen de estudios con la asociación de estatinas a fibratos o a niacina y con un seguimiento prolongado que demuestre reducción del riesgo cardiovascular. La evaluación del tratamiento combinado frente a la estatina sola es el objetivo principal de los ensayos clínicos en curso y pendientes de publicación (tabla 5). Además, los estudios contemplados en el metaanálisis de la combinación de fármacos hipolipidemiantes, ya comentado en el apartado de argumentos a favor, no tienen como objetivo principal la valoración de la reducción del riesgo cardiovascular y son de corta duración (entre 1 y 2,5 años)2.
Ensayos clínicos en marcha con combinaciones que reducen el cLDL y aumentan el cHDL
| Estudio | Control | Intervención | Muestra | Pacientes |
| ACCORD | Estatina | Estatina + fenofibrato | 5.900 | Con diabetes de tipo 2 |
| AIM-HIG | Simvastatina | Simvastatina + niacina de liberación extendida | 3.300 | Alto riesgo, con enfermedad cardiovascular, HDL bajo y triglicéridos elevados |
| HPS2-THRIVE | Simvastatina | Simvastatina + niacina de liberación extendida/laropipranta | 20.000 | Enfermedad coronaria o equivalente y diabéticos con aterosclerosis |
ACCORD: Action to Control Cardiovascular Risk in Diabetes; AIM-HIG: Atherothrombosis Intervention in Metabolic Syndrome with Low HDL/High Triglycerides and Impact on Global Health Outcomes; HDL: lipoproteínas de alta densidad; HPS2-THRIVE: Heart Protection Study 2-Treatment of HDL to Reduce the Incidence of Vascular Events 2.
La mortalidad total o cardíaca no disminuye significativamente en los estudios realizados con fibratos o niacina en monoterapia23, aunque la prolongación a los 15 años del estudio Coronary Drug Project (CDP) que comparó la niacina de liberación rápida frente a placebo en prevención secundaria mostró un efecto beneficioso sobre la mortalidad total: un 11% más baja en el grupo tratado con niacina (el 52 frente al 58%; p = 0,0004)24. Con los fibratos, se ha observado un aumento de la mortalidad por causas no cardiovasculares23, pero esto ocurrió cuando se incluyeron estudios con clofibrato25.
Los fibratos pueden causar, como las estatinas, rabdomiolisis cuando se administran en monoterapia, lo que aumenta el riesgo cuando se asocian los 2 fármacos. La utilización de ácido nicotínico ha sido muy limitada debido a la elevada incidencia de episodios de sofocos (enrojecimiento de la piel, en especial de la cara y del torso, con sensación de calor). La incidencia y la gravedad de este efecto adverso, leve pero incómodo, puede disminuir de diversas maneras: al utilizar formas farmacéuticas que enlentencen la liberación (niacina de liberación extendida), al aumentar la dosis progresivamente, al administrar aspirina u otros antiinflamatorios no esteroideos 30min antes de tomar la niacina, al tomar el fármaco al acostarse o con las comidas o, finalmente, al combinar la niacina con antagonistas de los receptores de la prostaglandina D2 (laropiprant).
Por último, dentro de esta estrategia terapéutica se encontraba el torcetrapib, un fármaco inhibidor de la CETP (cholesterol ester transfer protein ‘proteína transferidora de ésteres del colesterol’). Este fármaco producía un aumento muy importante del cHDL, pero fracasó en demostrar un efecto preventivo de la enfermedad cardiovascular. Es más, en los pacientes tratados con torcetrapib asociado a atorvastatina se observó un aumento de la enfermedad, de la mortalidad cardiovascular y de la mortalidad total en comparación con el tratamiento con atorvastatina en monoterapia. Esta paradoja se ha explicado por algunos efectos propios de este fármaco, como el aumento de la actividad mineralcorticoide (con aumento de la aldosterona y de la presión arterial) o la inmunodepresión26–28. Otros fármacos de este grupo, actualmente en fase de investigación clínica, no aumentan la presión arterial, por lo que la vía de investigación de la inhibición de la CETP aún no está cerrada29.
Estrategias terapéuticas en las guías clínicasEl cLDL es la diana terapéutica principal en todas las guías clínicas y se recomiendan diferentes objetivos de control en función del riesgo cardiovascular30,31. En general, en pacientes de riesgo cardiovascular alto se aconseja un cLDL inferior a 100mg/dl e, incluso, inferior a 7030 u 8031mg/dl si fuera factible.
Ninguna de las 2 guías30,31 establece una cifra determinada de cHDL como objetivo terapéutico, pero sí se consideran los cHDL en la tabla recomendada para calcular el riesgo coronario y también como uno de los criterios para el diagnóstico del síndrome metabólico (inferior a 40mg/dl en varones e inferior a 50mg/dl en mujeres).
El Adult Treatment Panel III (ATP III)30 establece 3 prioridades en el control del perfil lipídico: primero, el control del cLDL, posteriormente alcanzar los objetivos de colesterol no HDL (colesterol total – cHDL) y, finalmente, si sigue el cHDL bajo (establecido como HDL inferior a 40mg/dl), utilizar medidas para incrementarlo. Es decir, la importancia directa del cHDL en las decisiones de tratamiento se marca cuando se han controlado los otros parámetros del perfil lipídico.
Las sociedades europeas admiten que aún no hay suficientes pruebas para establecer un determinado objetivo terapéutico del cHDL, pese a que hay una relación fuerte entre el cHDL y la enfermedad cardiovascular. Además, comentan la posibilidad del tratamiento combinado con diferentes fármacos hipolipidemiantes, sin especificar más31.
También la American Diabetes Association (ADA) considera el LDL como el objetivo primario, pero, a diferencia de las anteriores, sí establece unos objetivos deseables de triglicéridos (inferior a 150mg/dl) y de HDL (superior a 40mg/dl en varones y superior a 50mg/dl en mujeres). Además, se podría considerar el tratamiento combinado para conseguir los objetivos terapéuticos, aunque no hay estudios que hayan evaluado los resultados de morbimortalidad cardiovascular o de seguridad32.
ConclusionesLa opción de tratamiento hipolipidemiante que ocuparía el primer lugar sería la utilización de dosis estándares de estatinas para reducir el cLDL. Excepto en casos con dislipemias familiares o cLDL muy elevado, este escalón sería suficiente en la prevención primaria de la enfermedad cardiovascular.
En pacientes con enfermedad cardiovascular, sobre todo con cardiopatía isquémica y más específicamente en pacientes con síndrome coronario agudo, se puede reducir aún más el cLDL con estatinas en altas dosis. Este tratamiento ocuparía el segundo escalón en la estrategia terapéutica de la dislipemia. Alternativamente, está la posibilidad de asociar ezetimiba a las estatinas, aunque esta opción esta pendiente de evaluar su eficacia en la reducción de la enfermedad cardiovascular.
Hasta ahora, los 2 escalones descritos hacen referencia a la reducción del cLDL. Sin embargo, al utilizar la combinación de estatinas con fibratos o niacina, se abre otra posibilidad: actuar simultáneamente reduciendo el cLDL y aumentando el cHDL. Las mejores pruebas de las que se dispone actualmente sobre esta opción derivan de estudios de regresión de la placa de ateroma que han encontrado una reducción importante del riesgo cardiovascular en combinaciones que incluyen a la niacina. Esta alternativa terapéutica actualmente está en fase de desarrollo para evaluar su eficacia en pacientes con enfermedad cardiovascular, pacientes diabéticos y pacientes con cHDL bajo.