Estimar la prevalencia de infección por genotipos del virus del papiloma humano (VPH) de alto riesgo no vacunables.
DiseñoEstudio descriptivo transversal.
EmplazamientoSiete centros de salud de Cantabria seleccionados aleatoriamente.
ParticipantesSe incluyó a todas las mujeres con una citología vaginal valorable (n=3.359) entre 2010-2011.
Mediciones principalesSe recogieron diagnóstico citológico, resultado de PCR y método anticonceptivo. Los resultados de las citologías se clasificaron con el sistema Bethesda. Para la tipificación de VPH según el riesgo oncogénico se utilizó la clasificación de Muñoz et al. Se estimaron proporciones y odds ratio (OR) con sus correspondientes intervalos de confianza al 95% (IC95%).
ResultadosLa prevalencia de infección por VPH fue del 2,71% (IC95%: 2,15-3,27). La prevalencia de genotipos de VPH de alto riesgo oncogénico fue del 2,26%; (IC95%: 1,75-2,78). El genotipo más frecuente fue el 16 (28,89%). Más de la mitad de las mujeres fueron positivas para algún genotipo de alto riesgo no vacunable: 51 (18,89%) o 58 (13,33%) o 68 (12,22%) o 31 (11,11%). En el 23,33% de las mujeres coexistieron al menos 2 genotipos de alto riesgo no vacunables. Las mujeres más jóvenes (≤30 años) tuvieron 2 veces más riesgo de infección por cualquier VPH: OR 2,01; (IC95%: 1,02-3,96); y 2 veces más probabilidad de usar anticonceptivos hormonales frente al preservativo: OR 2,09; (IC95%: 1,64-2,67).
ConclusionesAtendiendo al alto porcentaje de VPH de alto riesgo oncogénico no vacunable, habría que replantear la estrategia de prevención en la población, que podría tener una falsa sensación de protección.
To estimate the prevalence of infection with non-vaccinable high risk genotypes of human papillomavirus (HPV).
DesignCross-sectional study.
LocationSeven randomly selected health centres in Cantabria (Northern Spain).
ParticipantsAll women with an evaluable vaginal smear (n=3,359) between 2010 and 2011.
Main measuresThe variables collected were cytological diagnosis, PCR results, and family planning method. The vaginal smear results were classified with the Bethesda system. The classification by Muñoz et al. was used for typing as oncogenic risk HPV. Proportions and odds ratio (OR) were estimated with corresponding confidence intervals at 95% (95% CI).
ResultsThe prevalence of HPV infection was 2.71% (95% CI: 2.15 to 3.27). The prevalence of high oncogenic risk HPV genotypes was 2.26%; (95% CI: 1.75 to 2.78). The most frequent genotype was 16 (28.89%). More than half of the women were positive for one of the non-vaccinable high risk genotypes: 51 (18.89%) and 58 (13.33%) and 68 (12.22%) or 31 (11.11%). At least two non-vaccinable high-risk genotypes co-existed in 23.33% of women. Younger women (≤30 years) had twice the risk of any HPV infection: OR 2.01 (95% CI: 1.02 to 3.96); and were twice as likely to use condoms compared to hormonal contraceptives, OR 2.09 (95% CI: 1.64 to 2.67).
ConclusionsAccording to the high percentage of non-vaccinable high oncogenic risk HPV types, there should be a re-think of the prevention strategy in the population, who may have a false sense of protection.
El cáncer de cérvix representa aproximadamente el 10% de todos los cánceres en la mujer1. Es el cuarto cáncer más frecuente en mujeres en el mundo1, afectando además a mujeres jóvenes, mayoritariamente entre 35 y 50 años2. Según los últimos datos publicados por la International Agency for Research on Cancer, durante el 2012 el cáncer de cérvix representó el 7,5% de todas las muertes por cáncer en mujeres en el mundo1.
Es posible disminuir su incidencia y mortalidad, ya que se dispone de métodos de detección precoz que se han demostrado eficaces para reducir la mortalidad por dicho cáncer3. La supervivencia a 5 años es del 90% si se diagnostica en estadios iniciales, frente al 14% cuando se diagnostica en estadios avanzados4.
En España, en las últimas décadas, se ha registrado un descenso global en la incidencia del cáncer de cérvix invasivo (0,9%; intervalo de confianza al 95% [IC95%]: 0,5-1,3)5. Este descenso, iniciado a partir de los años 90, fue diferente según la edad: entre las mujeres más jóvenes (menores de 44 años) descendió un 1,2% anual y entre las mujeres mayores 44 años descendió en un 1,5% anual5.
Su agente causal, el virus del papiloma humano (VPH), tiene un largo periodo de latencia de 10-15 años desde la displasia leve al cáncer invasivo6,7. La infección persistente por VPH de un genotipo de alto riesgo oncológico, así como la coinfección de genotipos de alto riesgo, favorece la progresión neoplásica8,9.
Entre los factores de riesgo conocidos para infección por VPH destacan el incremento en el número de parejas sexuales6, la edad de la mujer (mayor riesgo en menores de 35 años)10,11 y el uso de métodos anticonceptivos que no sean de barrera6,8,12.
En la actualidad existen 2 vacunas autorizadas contra el VPH: Gardasil© (Sanofi-Pasteur) y Cervarix© (GlaxoSmithKline). Gardasil© proporciona protección frente al VPH 6, 11 (genotipos de bajo riesgo oncológico relacionados con la aparición de verrugas vulvares) y 16, 18 (genotipos de alto riesgo oncológico). Cervarix© proporciona protección frente al VPH 16, 18. En Cantabria se administra esta última desde el año 2008, dentro del programa de vacunación, a las niñas de 14 años. Ambas vacunas ofrecen títulos adecuados de inmunogenicidad, seguridad y eficacia frente a 4 genotipos, por lo que se trata de una protección incompleta13.
Ante la ausencia de un estudio de estas características en Cantabria, a partir de los resultados del Protocolo de Diagnóstico Precoz de Cáncer de Cérvix, se planteó este estudio con el objetivo de estimar la prevalencia de infección por genotipos del VPH de alto riesgo no vacunables en Cantabria.
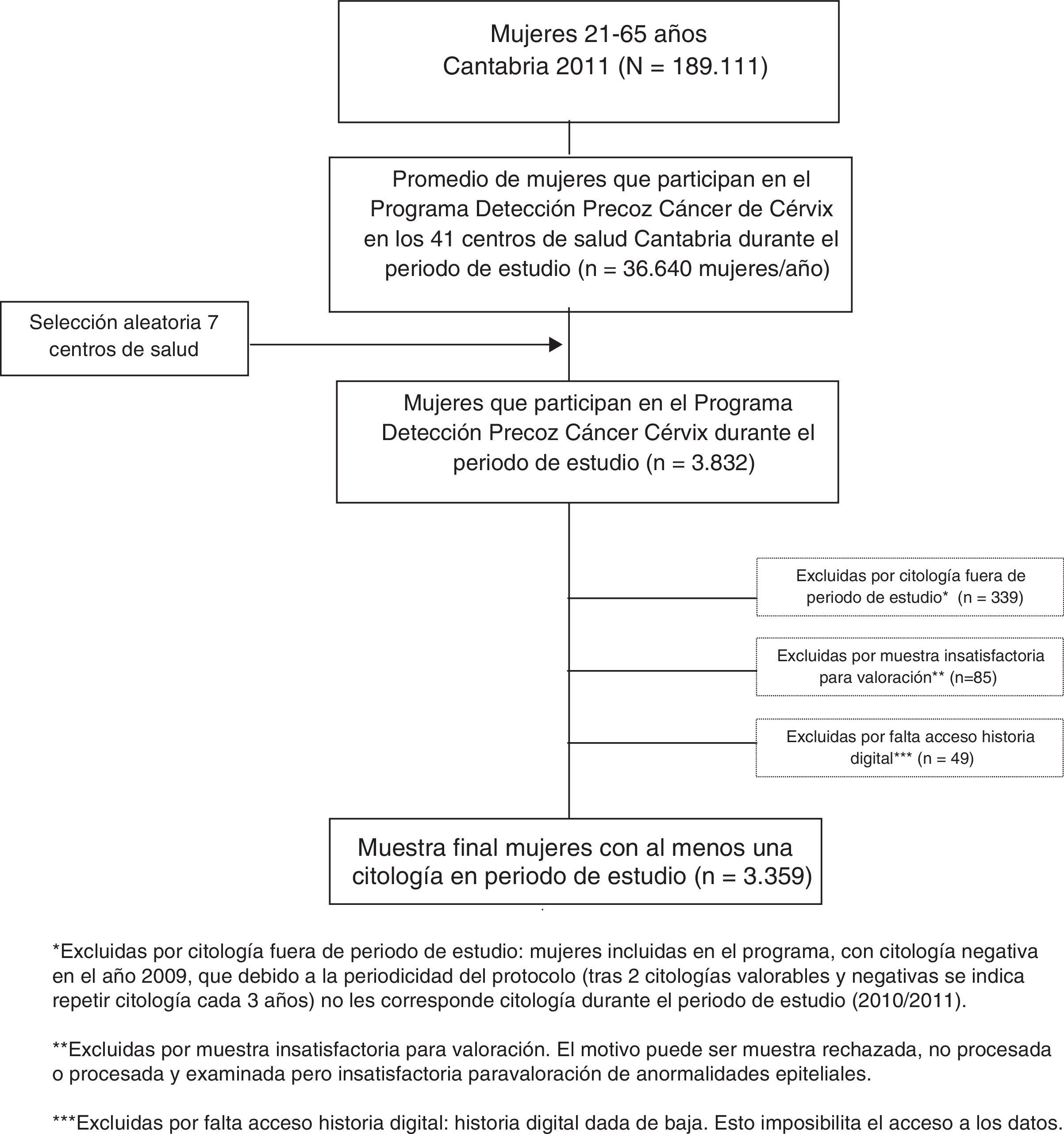
Material y métodosTipo de estudio: descriptivo transversal de los resultados del cribado del Diagnóstico Precoz de Cáncer de Cérvix mediante muestreo aleatorizado simple de 7 de centros de salud del total de 41 centros de salud pertenecientes al Servicio Cántabro de Salud. Se incluyeron el total de mujeres de cada centro de salud con al menos una citología valorable durante el periodo de estudio, entre el 1 de enero de 2010 y 31 de diciembre de 2011.
Población: la población susceptible de estudio, ajustándonos a los criterios del Protocolo de Diagnostico Precoz de Cáncer de Cérvix en Cantabria14 fue: a) mujeres entre 21 y 65 años con actividad sexual coital, no histerectomizadas, b) mujeres menores de 21 años que hayan iniciado relaciones sexuales 2 años antes y c) mujeres mayores de 65 años sin cribado previo adecuado. El algoritmo general de cribado, así como los distintos algoritmos específicos en función de los resultados de la citología, pueden consultarse de forma online en el mencionado Protocolo de Diagnóstico Precoz de Cáncer de Cérvix en Cantabria14.
Fuente de datos: a partir de los listados del Protocolo de Diagnóstico Precoz de Cáncer de Cérvix de la Cartera de Servicios de Atención Primaria se identificó a las mujeres en las que constaba en su historia clínica el resultado de al menos una citología valorable realizada en el periodo de estudio (n=3.359). Para cada mujer, los datos se recogieron a partir de las historias clínicas informatizadas a través del programa OMI, utilizado en atención primaria del Servicio Cántabro de Salud y se completaron los datos con las historias clínicas en papel y el visor de historias clínicas de atención especializada cuando fue necesario.
Variables: como principales variables se recogieron fecha de nacimiento, número de citologías realizadas durante el periodo de estudio, resultados de las citologías, determinación de genotipo de VPH y el método anticonceptivo. Los resultados de las citologías se clasificaron de acuerdo con el sistema Bethesda 200115. Se consideraron citologías positivas cuando el resultado se clasificó como lesión escamosa intraepitelial de alto grado (HSIL), lesión escamosa intraepitelial de bajo grado (LSIL), células escamosas o glandulares atípicas de significado indeterminado o células atípicas con sospecha de cáncer (ASC-US/ASCH).
En todas las mujeres con citología positiva informada de HSIL, LSIL o ASC-US/ASCH se realiza determinación de genotipo de VPH mediante reacción en cadena de la polimerasa (PCR). Ante un resultado negativo de la determinación, se repite citología y determinación de genotipo al año o 6 meses según la indicación del patólogo. Si la citología es negativa para lesión intraepitelial o malignidad no se determina VPH.
Los genotipos de VPH se clasificaron según el riesgo para el desarrollo del cáncer de cuello uterino atendiendo criterio de Muñoz et al.16. Se consideraron genotipos virales probable alto riesgo el 26, 53 y 66; y de alto riesgo el 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73 y 82. El hallazgo de 2 o más genotipos de alto riesgo en la misma mujer se definió como coinfección17.
Los métodos anticonceptivos se clasificaron como barrera (preservativo), hormonales (vía oral, inyectable o vaginal) y otros (naturales, dispositivos intrauterinos y esterilización quirúrgica).
Análisis estadístico: para realizar el análisis de los distintos contrastes y estadísticos se utilizó el paquete estadístico SPSS 22.0 para Windows. El análisis de datos incorporó un análisis descriptivo inicial. Para las variables continuas se estimaron medias con su desviación estándar [DE]. Para las variables discretas se estimaron proporciones con sus correspondientes IC95%. Se utilizó la prueba ji-cuadrado de Pearson para realizar comparaciones. Mediante regresión logística no condicional se estimaron odds ratios (OR) y sus IC95%.
Consideraciones éticas: El estudio fue aprobado por el Comité Ético de Investigación Clínica de Cantabria. Los datos fueron anonimizados previo al análisis de los mismos.
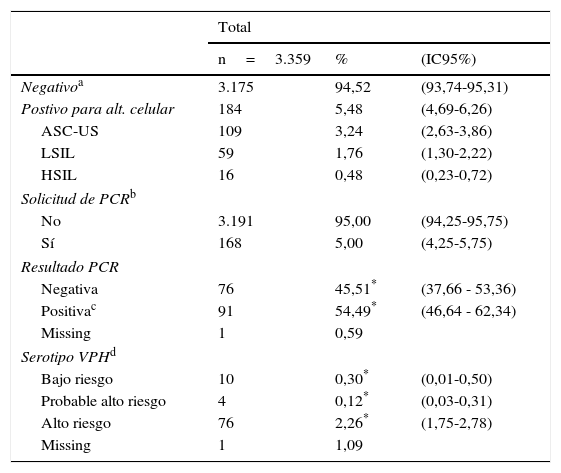
Esquema general del estudio: Estudio descriptivo de los resultados del Programa Detección Precoz de Cáncer de Cérvix en Cantabria.ResultadosEl total de mujeres incluidas en el estudio fue 3.359. El porcentaje de mujeres que presentaron al menos una citología con alteración morfológica (ASCUS/ASCH, LSIL, HSIL) en el total de la muestra fue del 5,48%; (IC95%: 4,69-6,26). La prevalencia de atipias de ASC-US fue del 3,24%; (IC95%: 2,63-3,86), LSIL 1,76%; (IC95%: 1,30-2,22), y HSIL 0,48%; (IC95%: 0,23-0,72). La prevalencia de infección por VPH fue del 2,71% (IC95%: 2,15-3,27). La prevalencia de genotipos de VPH de alto riesgo fue de 2,26%; (IC95% 1,75-2,78) (tabla 1).
Resultados de las tomas citológicas vaginales y PCR para virus del papiloma humano por mujer estratificando por medio de análisis citológico. Cantabria: mujeres con al menos una toma citológica valorable, 2010-2011
| Total | |||
|---|---|---|---|
| n=3.359 | % | (IC95%) | |
| Negativoa | 3.175 | 94,52 | (93,74-95,31) |
| Postivo para alt. celular | 184 | 5,48 | (4,69-6,26) |
| ASC-US | 109 | 3,24 | (2,63-3,86) |
| LSIL | 59 | 1,76 | (1,30-2,22) |
| HSIL | 16 | 0,48 | (0,23-0,72) |
| Solicitud de PCRb | |||
| No | 3.191 | 95,00 | (94,25-95,75) |
| Sí | 168 | 5,00 | (4,25-5,75) |
| Resultado PCR | |||
| Negativa | 76 | 45,51* | (37,66 - 53,36) |
| Positivac | 91 | 54,49* | (46,64 - 62,34) |
| Missing | 1 | 0,59 | |
| Serotipo VPHd | |||
| Bajo riesgo | 10 | 0,30* | (0,01-0,50) |
| Probable alto riesgo | 4 | 0,12* | (0,03-0,31) |
| Alto riesgo | 76 | 2,26* | (1,75-2,78) |
| Missing | 1 | 1,09 | |
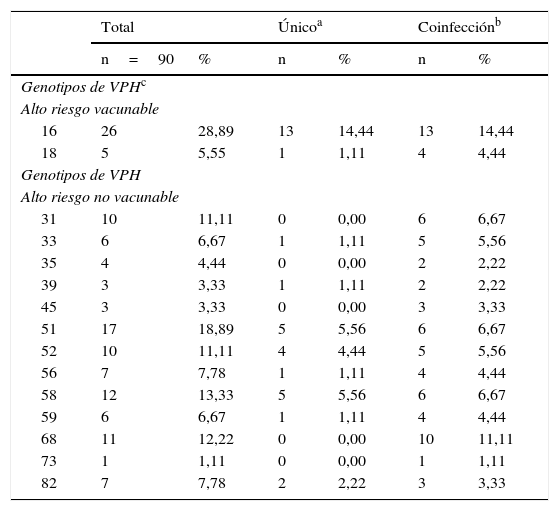
El genotipo 16 fue el más frecuente (28,89%). Los genotipos 16 y/o 18 se detectaron en el 34,45% de las mujeres. Más de la mitad de las mujeres fue positiva para el genotipo 51 (18,89%) o 58 (13,33%) o 68 (12,22%) o 31 (11,11%) o 45 (3,33%), no incluidos en las actuales vacunas disponibles (tabla 2).
Resultados de PCR para virus del papiloma humano de alto riesgo oncogénico. Cantabria: mujeres con al menos una toma citológica valorable, 2010-2011
| Total | Únicoa | Coinfecciónb | ||||
|---|---|---|---|---|---|---|
| n=90 | % | n | % | n | % | |
| Genotipos de VPHc | ||||||
| Alto riesgo vacunable | ||||||
| 16 | 26 | 28,89 | 13 | 14,44 | 13 | 14,44 |
| 18 | 5 | 5,55 | 1 | 1,11 | 4 | 4,44 |
| Genotipos de VPH | ||||||
| Alto riesgo no vacunable | ||||||
| 31 | 10 | 11,11 | 0 | 0,00 | 6 | 6,67 |
| 33 | 6 | 6,67 | 1 | 1,11 | 5 | 5,56 |
| 35 | 4 | 4,44 | 0 | 0,00 | 2 | 2,22 |
| 39 | 3 | 3,33 | 1 | 1,11 | 2 | 2,22 |
| 45 | 3 | 3,33 | 0 | 0,00 | 3 | 3,33 |
| 51 | 17 | 18,89 | 5 | 5,56 | 6 | 6,67 |
| 52 | 10 | 11,11 | 4 | 4,44 | 5 | 5,56 |
| 56 | 7 | 7,78 | 1 | 1,11 | 4 | 4,44 |
| 58 | 12 | 13,33 | 5 | 5,56 | 6 | 6,67 |
| 59 | 6 | 6,67 | 1 | 1,11 | 4 | 4,44 |
| 68 | 11 | 12,22 | 0 | 0,00 | 10 | 11,11 |
| 73 | 1 | 1,11 | 0 | 0,00 | 1 | 1,11 |
| 82 | 7 | 7,78 | 2 | 2,22 | 3 | 3,33 |
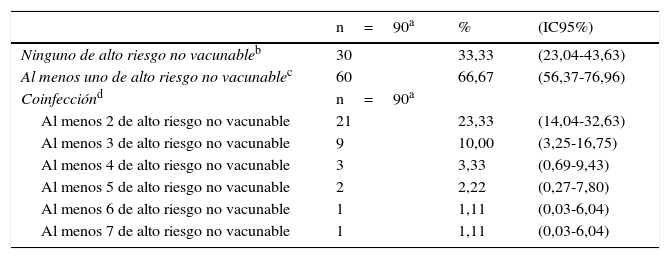
En el 84,44%; (IC95%: 76,40-92,49) de las mujeres con infección por VPH se detectó al menos un genotipo de alto riesgo. En el 32,22%; (IC95%: 22,01-42,43) de las mujeres se detectó coinfección por 2 o más genotipos de alto riesgo. El 23,33% de las mujeres presentaron coinfección por al menos 2 genotipos de alto riesgo no vacunables y en el 10,00% por al menos 3 genotipos de alto riesgo oncogénico no vacunables (tabla 3).
Coinfección del virus del papiloma humano de alto riesgo oncogénico no vacunable. Cantabria: mujeres con al menos una toma citológica valorable, 2010-2011
| n=90a | % | (IC95%) | |
|---|---|---|---|
| Ninguno de alto riesgo no vacunableb | 30 | 33,33 | (23,04-43,63) |
| Al menos uno de alto riesgo no vacunablec | 60 | 66,67 | (56,37-76,96) |
| Coinfecciónd | n=90a | ||
| Al menos 2 de alto riesgo no vacunable | 21 | 23,33 | (14,04-32,63) |
| Al menos 3 de alto riesgo no vacunable | 9 | 10,00 | (3,25-16,75) |
| Al menos 4 de alto riesgo no vacunable | 3 | 3,33 | (0,69-9,43) |
| Al menos 5 de alto riesgo no vacunable | 2 | 2,22 | (0,27-7,80) |
| Al menos 6 de alto riesgo no vacunable | 1 | 1,11 | (0,03-6,04) |
| Al menos 7 de alto riesgo no vacunable | 1 | 1,11 | (0,03-6,04) |
Mujeres con resultados de PCR positiva para virus del papiloma humano de alto riesgo oncogénico. Clasificación del riesgo oncogénico: Muñoz et al.16.
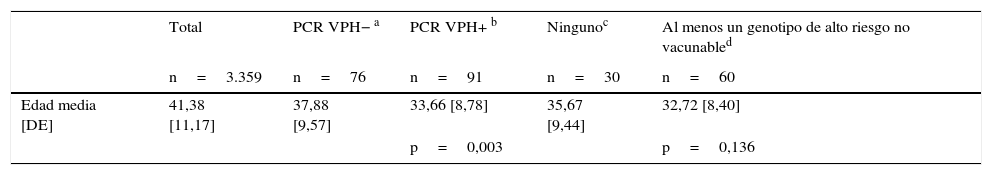
La edad media de las mujeres de la muestra fue de 41,38 años [DE 11,17]. Las mujeres con PCR positiva (infección por cualquier VPH) fueron 4,22 años más jóvenes (media=33,66; DE: 8,78) p=0,003. La media de edad en las infectadas por al menos un genotipo de alto riesgo no vacunable fue asimismo menor (media=32,72; DE: 8,40), si bien esta diferencia no alcanzo significación estadística debido al escaso tamaño muestral (n=90) (tabla 4).
Edad media de las mujeres según resultados de PCR para virus del papiloma humano. Cantabria: mujeres con al menos una toma citológica valorable, 2010-2011
| Total | PCR VPH− a | PCR VPH+ b | Ningunoc | Al menos un genotipo de alto riesgo no vacunabled | |
|---|---|---|---|---|---|
| n=3.359 | n=76 | n=91 | n=30 | n=60 | |
| Edad media [DE] | 41,38 [11,17] | 37,88 [9,57] | 33,66 [8,78] | 35,67 [9,44] | 32,72 [8,40] |
| p=0,003 | p=0,136 |
Mujeres con ningún genotipo de alto riesgo del virus del papiloma humano no vacunable. Clasificación del riesgo oncogénico: Muñoz et al.16.
Al categorizar la edad en 30 años, las más jóvenes (≤30) tuvieron asimismo 2 veces más riesgo de infección por cualquier VPH: OR 2,01 (IC95%: 1,02-3,96). Las mujeres≤30 años tuvieron más riesgo de infección por al menos un genotipo de alto riesgo no incluido en las actuales vacunas, si bien las diferencias no alcanzaron significación estadística: OR 1,68 (IC95%: 0,66-4,24) (tabla 5).
Asociación entre el riesgo de infección para virus del papiloma humano y la edad de las mujeres. Cantabria: mujeres con al menos una toma citológica valorable, 2010-2011
| PCR VPH− a | PCR VPH+ b | Ningunoc | Al menos un genotipo de alto riesgo no vacunabled | |||||
|---|---|---|---|---|---|---|---|---|
| n=76 | n=91 | ORe | (IC95%) | n=30 | n=60 | ORe | (IC95%) | |
| Edad>30 | 58 | 56 | 1 | 21 | 35 | 1 | ||
| Edad≤ 30 | 18 | 35 | 2,01 | (1,02-3,96) | 9 | 25 | 1,68 | (0,66-4,24) |
Mujeres con ningún genotipo de alto riesgo del virus del papiloma humano no vacunable. Clasificación del riesgo oncogénico: Muñoz et al.16.
Cuando se comparó la media de edad en función del método anticonceptivo utilizado, las más jóvenes usaron en mayor medida métodos hormonales (media=32,55; DE: 6,96). La media de edad para las usuarias de preservativo fue de 35,98 [DE: 7,50]. Las mujeres más mayores de nuestra muestra usaron otros métodos no-barrera y no-hormonales (naturales, dispositivo intrauterino o esterilización quirúrgica) (media=47,54; DE: 10,95) (p<0,001).
Al categorizar la edad en 30 años, las más jóvenes (≤30 años) tuvieron 2 veces más probabilidad de usar anticonceptivos hormonales con relación a los métodos barrera (OR: 2,09; [IC95%: 1,64-2,67]), y tuvieron menos probabilidad de usar otros métodos no-barrera y no-hormonales (OR: 0,24; [IC95% 0,19-0,32]) (tabla 6).
DiscusiónLa prevalencia de citologías positivas en nuestra muestra fue similar a la mostrada en diversos estudios nacionales18,19 e internacionales6,11. El 5,48% de las mujeres presentaron al menos una citología con alteración morfológica (cribado positivo). En un estudio nacional reciente realizado en Cataluña encuentran que el 4,41% de las citologías realizadas en el periodo 2008-2011 fueron positivas19, empleando el mismo criterio de positividad que el presente estudio.
El porcentaje de ASCUS del 3,24% detectado en nuestra muestra está dentro de lo esperado en una población de bajo riesgo (<5%). En países como EE. UU. y Suecia los porcentajes de ASCUS son del 5% y el 2% respectivamente20,21.
El 45,51% de las determinaciones de genotipo de VPH solicitadas dieron un resultado negativo (n=76). Estas determinaciones corresponden con las solicitudes de genotipo de VPH tras citología positiva informada de células escamosas o glandulares atípicas de significado indeterminado o LSIL. Aunque el LSIL es una lesión que expresa una infección por VPH, en la mayoría de los casos suelen ser infecciones transitorias en mujeres jóvenes (menores de 30 años) que se resuelven de forma espontánea6,7.
La prevalencia de genotipos de VPH de alto riesgo encontrada en nuestra muestra (2,26%) fue ligeramente inferior a la esperada22. Esto puede deberse a las características de la población de estudio: mujeres sanas que participan en el cribado de cáncer de cérvix y edad media de la muestra de 41,38 años. Diversos estudios realizados en España muestran diferencias en la prevalencia de infección por VPH de alto riesgo según la edad media de la población estudiada. De Sanjose et al., en un estudio realizado en una población con una edad media de 43 años estimó una prevalencia del 3,4%22. Trigo-Daporta et al. en una muestra con una edad media de 32 años encontraron una prevalencia del 10,1%17.
Respecto a la prevalencia de VPH-16 y VPH-18, hemos obtenido resultados similares entre nuestra muestra (28,89 y 5,55% respectivamente) y otros trabajos publicados en el norte de España. De Oña et al. aportaron los siguientes datos: en cuanto al VPH-16, un 26,94% en Asturias (1992-2007) y un 21,2% en Lugo (1997-2007); y para el VPH-18, un 5,65% en Asturias y un 4,89% en Lugo (mismo periodo)23.
Se detectaron un 11,11% y un 3,33% de mujeres infectadas con el genotipo 31 o 45, que junto con el 16 y el 18, son los que producen una mayor inestabilidad cromosómica y por tanto una mayor riesgo de desarrollo de cáncer de cérvix11.
Actualmente, se ha observado un efecto protector cruzado de ambas vacunas frente a infecciones y lesiones premalignas causadas por genotipos no incluidos en ellas24. La mayor protección cruzada se ha demostrado con la vacuna bivalente, para los genotipos 31 y 45 (eficacia reportada para la neoplasia intraepitelial de cérvix del 96,1%; IC95%: 82,2-100,0)24. Para los 3 genotipos no vacunables más prevalentes en nuestra muestra (el 51, 58 y el 68), la protección reportada para la neoplasia intraepitelial de cérvix ha sido menor (66,1%; IC95%: 37,3-82,6)24. Debido a que la protección cruzada no parece actuar por igual en todos los genotipos de alto riesgo no vacunables, nuestros resultados apoyan la necesidad de continuar con los programas de cribado Detección Precoz de Cáncer de Cérvix y de educación sanitaria como complemento a los programas sistemáticos de vacunación en preadolescentes.
Nuestros resultados han mostrado cifras elevadas de infección o coinfección. En el 84,44% de las mujeres con infección por VPH se detectó al menos un genotipo de alto riesgo. La presencia de al menos un genotipo de alto riesgo ya había sido constatado por otros autores25,26, detectándose en aproximadamente en el 90% de los casos. En el 32,22% se detectó coinfección por al menos 2 o más genotipos de alto riesgo y el 23,33% presentó al menos 2 genotipos de alto riesgo no vacunables.
En las mujeres más jóvenes de nuestra muestra (≤30 años) se encontró un mayor riesgo de infección por VPH, incluyendo infección por al menos un genotipo de alto riesgo no incluido en las actuales vacunas. Nuestros hallazgos coinciden con la bibliografía donde se detectó una mayor prevalencia de la infección por VPH en mujeres jóvenes17,23–28.
Las mujeres más jóvenes de nuestra muestra (21-30 años) usaron más los métodos hormonales, exponiéndose más al riesgo de infección. Según los datos del Observatorio de Salud Sexual y Reproductiva en España, se produce un inicio tardío de la planificación familiar, en torno a los 21 años, y la utilización de la píldora anticonceptiva alcanza sus cifras más elevadas entre los 20 y 29 años29.
Diversos estudios muestran que la edad puede condicionar la elección del método anticonceptivo. De forma general, el preservativo se utiliza mayoritariamente en los primeros años de iniciación en la vida sexual, progresivamente se incorpora el uso de la píldora anticonceptiva (en torno a los 20-29 años) y a partir de los 30 años se empieza a utilizar más el DIU, dejando para el final de la vida fértil los métodos irreversibles29–31. Nuestros resultados no coindicen en la edad media de uso de los métodos barrera (35 años) debido a que las mujeres menores de 21 años participan minoritariamente en el cribado. Atendiendo a los criterios del Protocolo de Diagnóstico Precoz de Cáncer de Cérvix en Cantabria participan las mujeres entre 21 y 65 años con actividad sexual coital y mujeres menores de 21 años con 2 años de actividad sexual coital.
Por otro lado, también existen cambios específicos según la edad en el tipo de infecciones vaginales y en la microflora, que podrían afectar a la infección por VPH28.
Diversos estudios señalan que las mujeres más jóvenes podrían tener una falta de información y por ello una falsa sensación de protección tras la vacunación13,32. Este hecho, unido a un menor uso del preservativo, conlleva un mayor riesgo de infección por al menos un genotipo de alto riesgo no incluido en las actuales vacunas.
Sería necesario ampliar el presente estudio incluyendo otros factores de riesgo para la infección por VPH como el patrón sexual, los cambios en la flora y/o pH vaginal, posibles coinfecciones, factores genéticos y otros factores relacionados con la respuesta inmune16,28.
Limitaciones del estudioEn nuestro estudio no ha sido posible recoger el tiempo de uso de los métodos anticonceptivos. En los registros consta el método actualmente utilizado, pero no el tiempo de uso de los mismos.
Asimismo, otros factores de riesgo de progresión hacia la enfermedad tumoral como el consumo de tabaco, la paridad y la coinfección con otros agentes, factores genéticos y otros factores relacionados con la respuesta inmune no estaban disponibles de forma homogénea en los registros secundarios utilizados.
En conclusión, teniendo en cuenta que un alto porcentaje de los virus de alto riesgo oncogénico que aparecen en nuestra muestra no están incluidos en las vacunas frente al VPH disponibles, debemos replantear la estrategia de prevención sobre todo en la población joven en la que podría generarse una falsa sensación de protección tras la vacunación frente a estas enfermedades.
En el momento de la vacunación sería necesario informar de la protección incompleta de la vacuna, la importancia del uso del preservativo como método anticonceptivo de barrera y enfatizar en la importancia de asistir al cribado de cáncer de cérvix.
- 1.
La infección persistente por un genotipo de alto riesgo oncológico del virus del papiloma humano (VPH), así como la coinfección de genotipos de alto riesgo, favorece la progresión neoplásica.
- 2.
Entre los factores de riesgo para infección por VPH se encuentran la edad (<35 años) y el uso métodos anticonceptivos que no sean de barrera.
- 3.
En la actualidad existen 2 vacunas autorizadas contra el VPH que ofrecen protección incompleta frente a todos los genotipos de alto riesgo.
- 1.
Más de la mitad de las mujeres fueron positivas para algún genotipo de alto riesgo no vacunable.
- 2.
Las mujeres más jóvenes (≤30 años) tuvieron 2 veces más riesgo de infección por cualquier VPH y 2 veces más probabilidad de usar anticonceptivos hormonales frente al preservativo.
- 3.
En el momento de la vacunación sería necesario informar de la protección incompleta de la vacuna, de la importancia del uso del preservativo y enfatizar en la importancia de asistir al cribado de cáncer de cérvix.
Los autores declaran no tener ningún conflicto de intereses.