Programa de Actividades Preventivas y de Promoción de la Salud-PAPPS 2022
Más datosLa actualización de las actividades preventivas de este año 2022 en el campo de las enfermedades infecciosas es de especial relevancia debido a la importancia que ha cobrado la prevención y, más concretamente, la vacunación como herramienta para controlar la pandemia producida por el virus SARS-CoV-2 declarada el 11 de marzo de 2020.
La pandemia ha centrado gran parte de los esfuerzos de prevención en su contención, pero no se debe olvidar la importancia de mantener altas coberturas de vacunación del resto de las vacunas recomendadas para mantener un buen control de las enfermedades inmunoprevenibles y evitar complicaciones en pacientes especialmente vulnerables.
En la revisión de este año presentamos un documento práctico con el objetivo de facilitar herramientas a los profesionales de atención primaria que trabajan con adultos, para hacer la indicación de cada vacuna tanto si está recomendada de forma sistemática como si lo está porque el paciente pertenece a algún grupo de riesgo por su condición o por patología de base. De esta manera, a lo largo del documento comentaremos los aspectos más novedosos en la vacunación sistemática (gripe, neumococo, vacunas antimeningocócicas y vacunas contra el virus del papiloma humano [VPH]), las nuevas vacunas (vacunas pandémicas contra la COVID-19, vacunas contra el herpes zóster de subunidades, vacunas contra la viruela del mono) y las vacunas recomendadas según condición de riesgo (embarazo y lactancia, sanitarios, viajeros, pacientes con inmunosupresión o patología de base).
The update of the preventive activities for this year 2022 in the field of infectious diseases is of special relevance due to the importance that prevention has gained and more specifically, vaccination as a tool to control the pandemic caused by the SARS-CoV-2 virus declared on March 11, 2020.
The pandemic has focused much of the prevention efforts on its containment, but the importance of maintaining high vaccination coverage of the rest of the recommended vaccines to maintain good control of vaccine-preventable diseases and avoid complications in particularly vulnerable patients should not be forgotten.
In this year's review we present a practical document with the aim of providing tools to primary care professionals who work with adults, to make the indication of each vaccine whether it is systematically recommended or if it is because the patient belongs to some risk group due to their condition or underlying pathology. In this way, throughout the document, we will comment on the most innovative aspects of systematic vaccination (flu, pneumococcus, meningococcal vaccines and vaccines against the human papillomavirus [HPV]), the new vaccines (pandemic vaccines against COVID-19, vaccines against herpes zoster of subunits, vaccines against monkeypox) and the recommended vaccines according to risk condition (pregnancy and lactation, travelers, patients with immunosuppression or underlying pathology).
La vacunación es una actividad preventiva sin fecha de caducidad a lo largo de la vida de una persona y que además se debe adaptar a las circunstancias cambiantes de cada persona (enfermedades de base, viajes, trabajo) o de cohortes de personas (colegios, residencias) o contextos epidemiológicos como los brotes de enfermedades infecciosas.
La actualización de las actividades preventivas de este año 2022 en el campo de las enfermedades infecciosas es de especial relevancia debido a la importancia que ha cobrado la prevención y, más concretamente, la vacunación como herramienta para controlar la pandemia producida por el virus SARS-CoV-2 declarada el 11 de marzo de 2020.
La pandemia ha centrado gran parte de los esfuerzos de prevención en su contención, pero no se debe olvidar la importancia de mantener altas coberturas de vacunación del resto de las vacunas recomendadas para mantener un buen control de las enfermedades inmunoprevenibles y evitar complicaciones en pacientes especialmente vulnerables.
Esta actualización se centrará en las novedades que se han dado en el campo de la vacunología (las vacunas contra la COVID-19, la nueva vacuna de subunidades para la prevención del herpes zóster, las novedades en la vacunación contra el neumococo, las vacunas contra la viruela del mono) y aporta herramientas para que los profesionales de atención primaria hagan la indicación de las vacunas tanto sistemáticas como por grupo de riesgo.
Para ampliar información vacuna por vacuna, especialmente de las que no han precisado actualización, remitimos al documento «Prevención de las enfermedades infecciosas. Actualización en vacunas, 2020»1.
InmunosenescenciaEl término «inmunosenescencia», acuñado por Walford en 1969 para designar los cambios que se producen en el sistema inmune con la edad, designa el progresivo deterioro del sistema inmunitario provocado por cambios, tanto innatos como adaptativos, que ocurren con el envejecimiento. No significa inmunodeficiencia, sino que se trata de una disregulación progresiva de la funcionalidad del sistema inmunitario que conduce a una reducción progresiva de la capacidad de generar respuestas celulares y de anticuerpos eficaces frente a antígenos, ya sean provenientes de infección natural o de vacunas2.
Las principales consecuencias de la inmunosenescencia son3:
- •
Aumento de la susceptibilidad y de la severidad de las infecciones.
- •
Reactivación de infecciones por virus latentes.
- •
Disminución de la eficacia de la vacunación.
- •
Aumento de la prevalencia de cáncer.
- •
Aumento de la prevalencia de enfermedades autoinmunes.
- •
Mayor incidencia de enfermedades crónicas con estado proinflamatorio: fragilidad, osteopenia, sarcopenia, enfermedades cardiovasculares, diabetes mellitus tipo2, enfermedades neurodegenerativas4.
Para mejorar la respuesta a la vacunación en los mayores o en las personas inmunocomprometidas por determinadas patologías o tratamientos se han investigado varias estrategias que mejoren la respuesta inmunológica. Algunas de ellas son5:
- •
Administrar mayores dosis de antígenos vacunales (gripe, VVZ).
- •
Añadir adyuvantes, que han demostrado mejorar la respuesta inmune innata (gripe, vacuna HZ).
- •
Utilizar diferentes vías de administración, dado que la vía intramuscular produce menor respuesta IgA.
- •
Contrarrestar la inflamación crónica con drogas antinflamatorias, inmunomoduladoras o senolíticos.
En España, desde el Consejo Interterritorial del Sistema Nacional de Salud (CISNS) se establecen acuerdos para mantener la coordinación y la cohesión entre todas las comunidades autónomas y se propone, anualmente, un calendario común a lo largo de toda la vida6 (tabla 1)
Calendario común de vacunación a lo largo de toda la vida. 2022
| Vacunación | 2 meses | 4 meses | 11 meses | 12 meses | 15 meses | 3 años | 6 años | 12 años | 14 años | A partir de 65 años |
|---|---|---|---|---|---|---|---|---|---|---|
| Poliomielitis | VPI | VPI | VPI | VPI | ||||||
| Difteria-Tétanos-Pertussis | DTPa | DTPa | DTPa | dTpa | Td | Td | ||||
| Hemophilus Influenzae tipo b | Hib | Hib | Hib | |||||||
| Hepatitis B | HB | HB | HB | |||||||
| Enfermedad meningocócica | MenC | MenC | MenACWY | |||||||
| Sarampión-Rubeola-Parotiditis | TV | TV | ||||||||
| Varicela | VVZ | VVZ | ||||||||
| Virus del papiloma humano | VPH | |||||||||
| Enfermedad neumocócica | VNC13 | VNC13 | VNC13 | VNP23 | ||||||
| Gripe | Gripe anual | |||||||||
| SARS-CoV-2 | Las actualizaciones continuas de estas vacunas hacen que hayamos decidido no detallarla en esta tabla.Las indicaciones por grupo de riesgo o edad son determinadas y revisadas de manera continua por las autoridades sanitarias. El objetivo es una vacunación universal respetando los criterios de equidad, desarrollando una red para su administración que facilite el acceso a la vacuna y fomentando la confianza de la población en su seguridad.Hoy en día las vacunas autorizadas en España y los datos de las próximas candidatas nos abren la puerta a la esperanza de reducir sustancialmente la incidencia de la COVID-19. (ver apartado y tabla COVID) | |||||||||
Modificada del calendario PAPPS 2022. Basado en el Calendario común de vacunación a lo largo de toda la vida, recomendado para el año. 2022. Consejo Interterritorial. Sistema Nacional de Salud. Disponible en: https://www.sanidad.gob.es/profesionales/saludPublica/prevPromocion/vacunaciones/calendario-y-coberturas/docs/CalendarioVacunacion_Todalavida.pdf.
Las epidemias anuales de gripe infectan cada año del 10 al 30% de la población europea, y se asocian a incrementos de tasa de hospitalizaciones, mortalidad y demanda de recursos en salud. Hay relación entre la infección de gripe y procesos como infarto de miocardio o ingresos hospitalarios en grupos de riesgo para la vacunación, como los diabéticos. La coinfección de COVID-19 y gripe incrementa el riesgo de enfermedad grave y muerte en comparación con los pacientes que tienen COVID-19 solo o con otros virus.
Hay dos tipos de vacunas antigripales: las de virus vivos atenuados y las inactivadas. En España, desde abril de 2022 solo están comercializadas vacunas inactivadas tetravalentes (con dos cepas del virusA y dos del virusB) y una vacuna atenuada nasal. Para población de mayor riesgo están disponibles vacunas de alta carga para >60años y vacunas con adyuvante para >65años que aumentan la respuesta inmunológica. Las vacunas se utilizarán de acuerdo con las indicaciones de su ficha técnica correspondiente.
La disponibilidad y el uso de unas u otras están sujetos a las compras y recomendaciones de las autoridades sanitarias.
Las vacunas de la gripe deben modificarse año a año, y su composición debe adaptarse a las cepas que la Organización Mundial de la Salud (OMS) prevé que van a circular en la temporada siguiente. La eficacia/efectividad de la vacuna antigripal está sujeta a factores como la concordancia anual de la vacuna con los virus circulantes, el nivel de inmunidad y la cobertura vacunal de la población, las características personales de los pacientes (como edad, enfermedades de base, vacunaciones antigripales previas, etc.), el diseño de los estudios sobre resultados de la vacunación o los indicadores a los que se aplica (p.ej., gripe confirmada por laboratorio, ingresos hospitalarios, ingresos en unidades de cuidados intensivos o mortalidad). La vacuna de la gripe es el medio más eficaz disponible para prevenir las consecuencias graves o mortales de la gripe en grupos de riesgo por edad o con morbilidades subyacentes.
En mayores de 60años reduce la gripe confirmada por laboratorio y sus hospitalizaciones. Es efectiva para prevenir la infección y sus complicaciones en niños y en mujeres embarazadas, tanto para la madre como para el recién nacido hasta los 6meses de edad. Ha demostrado reducción de eventos cardiovasculares (infarto de miocardio, accidente cerebrovascular) relacionados con la infección gripal. La vacuna es segura. La tradicional contraindicación por alergia al huevo ha pasado a ser una precaución para la administración de la vacuna, que, en cualquiera de sus presentaciones, no puede causar enfermedad gripal.
Los grupos de riesgo para los que se recomienda la vacuna antigripal aparecen en la tabla 2.
Indicaciones de la vacuna de la gripe
| Personas ≥ 65 años | Especialmente en personas institucionalizadas |
|---|---|
| Menores > 6 meses y adultos < 65 años con patología de base | Enfermedades crónicas cardiovasculares, neurológicas o respiratorias, incluyendo displasia broncopulmonar, fibrosis quística y asmaDiabetes mellitusObesidad mórbida (índice de masa corporal ≥ 40 en adultos, ≥ 35 en adolescentes o ≥ 3 DE en la infancia)Enfermedad renal crónica y síndrome nefróticoHemoglobinopatías y anemias. Hemofilia, otros trastornos de la coagulación y trastornos hemorrágicos crónicos, así como receptores de hemoderivados y transfusiones múltiplesAsplenia o disfunción esplénica graveEnfermedad hepática crónica, incluyendo alcoholismo crónicoEnfermedades neuromusculares gravesInmunosupresión (incluyendo las inmunodeficiencias primarias y la originada por la infección por VIH, por fármacos —incluyendo tratamiento con eculizumab—, en los receptores de trasplantes y déficit de complemento)Cáncer y hemopatías malignasImplante coclear o en espera del mismoFístula de líquido cefalorraquídeoEnfermedad celíacaEnfermedad inflamatoria crónicaTrastornos y enfermedades que conllevan disfunción cognitiva: síndrome de Down, demencias, etc.Menores entre los 6 meses y los 18 años de edad, que reciben tratamiento prolongado con ácido acetilsalicílico |
| Personas de cualquier edad (≥ 6 meses) institucionalizadas de manera prolongada | |
| Mujeres embarazadas en cualquier trimestre de gestación | |
| Personas que pueden transmitir la gripe a pacientes de alto riego | Personal de los centros sanitarios y sociosanitariosEstudiantes en prácticas en centros sanitarios y sociosanitariosPersonas que proporcionen cuidados domiciliarios a pacientes de alto riesgoConvivientes con personas de grupos de riesgo |
| Otros grupos en los que se recomienda la vacunación | Personas que trabajan en servicios públicos esenciales (policía, bomberos, servicios de protección civil, servicios de emergencias sanitarias, personal de instituciones penitenciarias y de otros centros de internamiento por resolución judicial)Personas con exposición laboral directa a aves domésticas o a cerdos en granjas o explotaciones avícolas o porcinas y a aves silvestres |
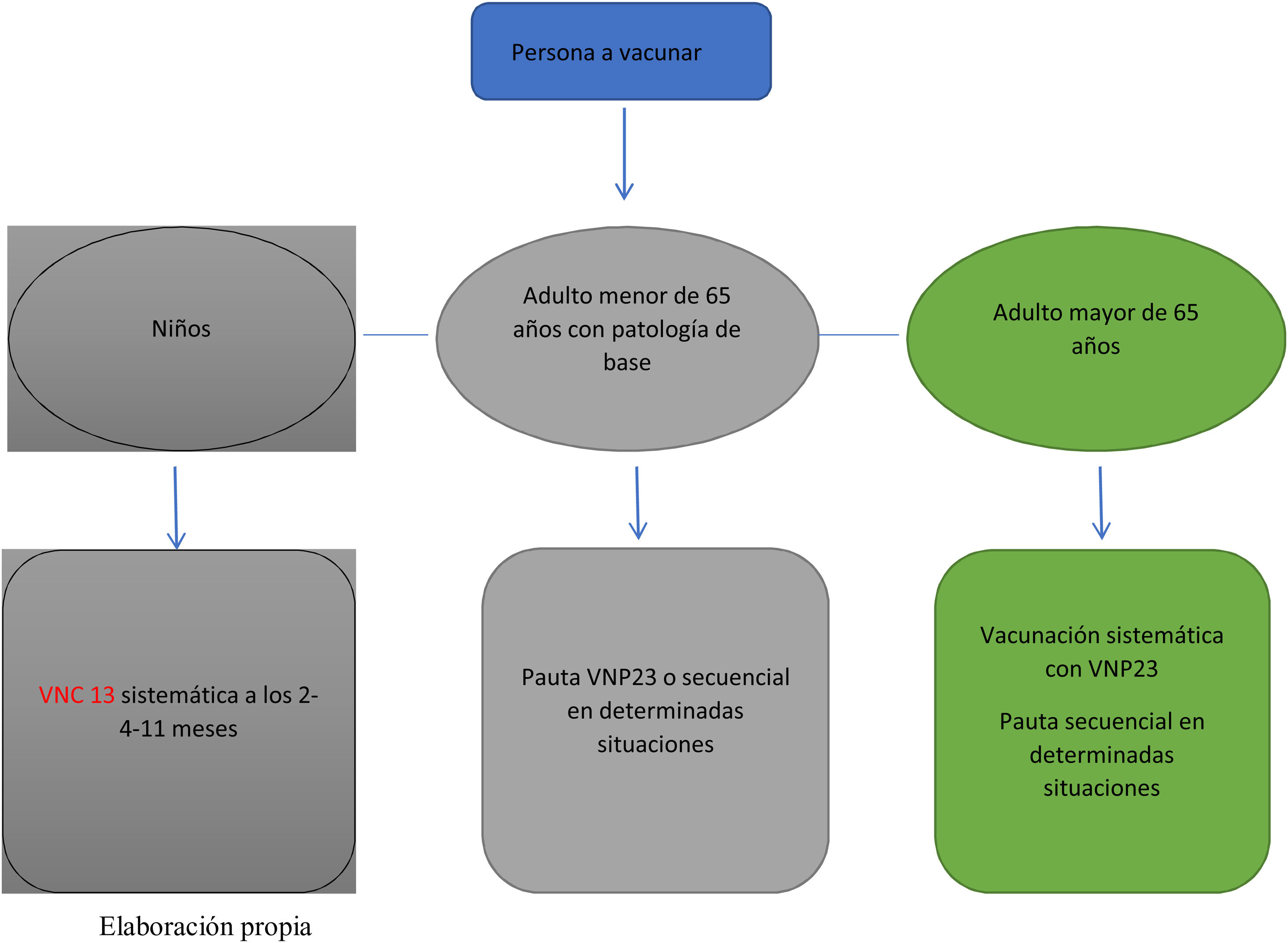
Streptococcus pneumoniae o neumococo es un patógeno del que se han identificado más de 90 serotipos13. Cada uno de ellos presenta diferencias en cuanto a manifestaciones clínicas, epidemiología, virulencia y resistencia a los antibióticos. Produce patología a cualquier edad; su incidencia y su gravedad son más importantes en los dos extremos de la vida14. En niños se manifiesta como otitis media aguda, neumonía, bacteriemia-sepsis y meningitis. En adultos, la manifestación clínica más frecuente es la neumonía no bacteriémica (75%), la neumonía bacteriémica, la bacteriemia y la meningitis15. El ser humano es el único reservorio. Diferentes situaciones de base predisponen a sufrir la enfermedad, como estados de inmunosupresión, tabaquismo, enfermedad pulmonar obstructiva crónica y diabetes; la edad es un factor fundamental para su aparición
Vacunas disponibles (fig. 1)a) Vacuna antineumocócica 23v. Recomendada en personas de 2años de edad o mayores que presenten un mayor riesgo de morbilidad y mortalidad por la enfermedad neumocócica. Está incluida en el calendario vacunal de las diferentes comunidades autónomas desde el año 2003 para la vacunación de adultos. Es una vacuna inactivada de polisacáridos capsulares que contiene 23 serotipos y que cubre el 60-70% de los serotipos circulantes causantes de la enfermedad. No erradica la colonización nasofaríngea ni produce efecto rebaño. Produce una respuesta inmunitaria basada en la producción de inmunoglobulinas por linfocitosB que decae con el tiempo y en pocos años desaparece. No produce memoria inmunológica. Induce el fenómeno de tolerancia inmune o hiporrespuesta con las revacunaciones, por lo que los refuerzos no son eficaces16.
b) Vacuna conjugada 13v. Incluye 13 serotipos. No existe protección cruzada, por lo que su nivel de protección depende de los serotipos circulantes. Produce memoria inmunológica. La inmunidad se mantiene varios años. Tiene capacidad para erradicar la bacteria de la nasofaringe y produce efecto rebaño. La debilidad de esta vacuna radica en que produce reemplazo de serotipos17, con lo que con los años los serotipos que producen enfermedad son diferentes a los incluidos en la vacuna y pierde su capacidad de protección18-19. Se puede utilizar en adultos.
c) Vacuna conjugada 15v. Aprobada para la inmunización activa de la enfermedad invasiva y la neumonía causada por Streptococcus pneumoniae en individuos de 18años o más.
d) Vacuna conjugada 20v. La vacuna está aprobada para la inmunización activa para la prevención de la enfermedad invasiva y la neumonía causada por Streptococcus pneumoniae en individuos de 18años o más.
ComposiciónConsultar:
- •
- •
https://ec.europa.eu/health/documents/community-register/2015/20150226131086/anx_131086_es.pdf
- •
Las recomendaciones son cambiantes en función de los serotipos más prevalentes en cada momento, de la composición de las vacunas disponibles y de las diferentes situaciones nacionales. En Europa existe un cierto consenso general para recomendar la utilización de vacunas conjugadas en la infancia y vacuna polisacárida 23v en adultos, con matizaciones según la edad, la patología de base y el país20. Se puede consultar el calendario vacunal comparado en esta materia de cada país en https://vaccine-schedule.ecdc.europa.eu/Scheduler/ByDisease?SelectedDiseaseId=25&SelectedCountryIdByDisease=-1
En el año 2007 la OMS recomendó la inclusión de la vacunación antineumocócica con vacunas conjugadas en todos los calendarios sistemáticos infantiles. En 2020, 146 países seguían esta recomendación.
Los CDC (https://www.cdc.gov/pneumococcal/vaccination-sp.html) recomiendan la VNC13 para las siguientes personas:
- •
Todos los niños menores de 2 años.
- •
Personas de 2 años o más que tengan ciertas afecciones.
- •
No recomiendan la vacunación sistemática en adultos. Valorar la vacunación en determinadas situaciones con patología de base.
Los CDC recomiendan la VNP23 para las siguientes personas:
- •
Todos los adultos de 65 años o más.
- •
Personas de 2 a 64 años de edad que tengan ciertas afecciones.
- •
Adultos de 19 a 64 años de edad que fumen cigarrillos.
El Ministerio de Sanidad del Gobierno de España recomienda la vacunación sistemática de niños con vacuna conjugada (https://www.sanidad.gob.es/profesionales/saludPublica/prevPromocion/vacunaciones/calendario-y-coberturas/docs/CalendarioVacunacion_Todalavida.pdf).
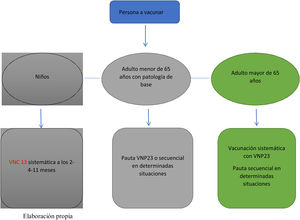
La vacunación del adulto se basa en la recomendación generalizada de vacunar a estas personas con la vacuna 23 valente. Se recomienda la vacunación conjunta con la vacuna 13 valente en determinadas situaciones (tabla 3).
Pautas de vacunación antineumocócica en adultos
| Grupos de riesgo | Pauta recomendada | Intervalo entre vacunas |
|---|---|---|
| Inmunodeprimidosa | ||
| Inmunodeficiencias humorales o celulares, deficiencias del complemento y trastornos de la fagocitosis | VNC13 + VNP23b | Óptimo: 12 mesesMínimo: 8 semanas |
| Leucemia, linfoma, mieloma múltiple, enfermedad de Hodgkin | VNC13 + VNP23b | Óptimo: 12 mesesMínimo: 8 semanas |
| Otras neoplasias | VNC13 + VNP23b | Óptimo: 12 mesesMínimo: 8 semanas |
| Infección por VIH | VNC13 + VNP23b | Óptimo: 12 mesesMínimo: 8 semanas |
| Insuficiencia renal crónica y síndrome nefrótico | VNC13 + VNP23b | Óptimo: 12 mesesMínimo: 8 semanas |
| Tratamiento inmunosupresorc | VNC13 + VNP23b | Al menos 8 semanas |
| Trasplante de progenitores hematopoyéticos | 3 dosis VNC13Se vacunará a partir de los 3-6 meses postrasplante | Administrar a los 24 meses del trasplante la VPN23b |
| Trasplante de órgano sólido | VNC13 + VNP23b | Óptimo: 12 mesesMínimo: 8 semanas |
| Asplenia anatómica o funcional | VNC13 + VNP23b | Al menos 8 semanas |
| Personas inmunocompetentes con patología de base o factores de riesgo | ||
| Fístula de líquido cefalorraquídeo | VNC13 + VNP23 | Óptimo: 12 mesesMínimo: 8 semanas |
| Portadores de implante coclear | VNC13 + VNP23 | Óptimo: 12 mesesMínimo: 8 semanas |
| Antecedentes de ENI confirmada | VNC13 + VNP23 | Óptimo: 12 mesesMínimo: 8 semanas |
| Cirrosis hepática | VNC13 + VNP23 | Óptimo: 12 mesesMínimo: 8 semanas |
| Enfermedad cardiovascular crónica (cardiopatía coronaria, insuficiencia cardiaca congestiva y accidente cerebrovascular) | VNP23 | |
| Enfermedad pulmonar crónica (EPOC, asma grave y patología intersticial difusa) | VNP23 | |
| Diabetes mellitus | VNP23 | |
| Hepatopatía crónica | VNP23 | |
| Alcoholismo | VNP23 | |
| Personas ≥ 65 años de edad | VNP23 | |
| Personas institucionalizadas sin límite de edad | VNP23 | |
ENI: enfermedad neumocócica invasiva.
En el caso de haber recibido con anterioridad una/s dosis de VNP23, se aplicará la misma pauta pero dejando al menos 12 meses de intervalo entre la última dosis de VNP23 y el inicio de la pauta secuencial. Si han recibido dos dosis de VNP23 antes de los 64 años, recibirán una tercera a partir de los 65 años siempre que hayan transcurrido 5 o más años desde la dosis anterior.
La pauta de vacunación depende de la edad de la persona y de si se ha vacunado previamente. En menores de 2años se recomienda VNC13 por ser la que cubre mayor número de serotipos. El número de dosis depende de la edad de inicio: pauta 3 +1 si comienzan antes de los 6meses de vida seguida de VNP23 a partir de los 2años de edad; entre los 2 y 6años de edad se administrarán 2 dosis de VNC13 y una dosis de VNP23 a los 12meses (intervalo mínimo de 8semanas) de haber recibido la última dosis de VNC13; a partir de los 6años se administrará pauta secuencial (VNC13 +VNP23) con un intervalo recomendado de 12meses (mínimo de 8semanas). En todas las situaciones se administrará una dosis de VNP23, que se repetirá 5años después únicamente en pacientes con asplenia o pacientes con inmunosupresión (fig. 2).
Los estudios sobre pautas secuenciales VNC13 +VNP23 sugieren que los intervalos cortos entre ambas (p.ej., 8semanas) pueden asociarse con un incremento de reactogenicidad local al compararlos con intervalos más amplios, y que intervalos iguales o superiores a un año pueden dar lugar a una respuesta inmune mejorada frente a los serotipos de ambas vacunas, al compararlos con respuestas a dosis únicas de cualquiera de ellas. Aunque el intervalo mínimo entre las vacunas VNC13 y VNP23 es de 8semanas, se recomienda, por lo anteriormente expuesto, un intervalo de 12meses entre ambas.
En caso de que hubieran recibido previamente VNP23, se administrará una dosis de VNC13 al menos 12meses más tarde desde la última dosis.
Vacunas antimeningocócicas21-31La mayoría de los casos de enfermedad meningocócica invasiva (EMI) están causados por 6 serogrupos (A, B, C, W, X e Y). En España la incidencia es baja (0,74 por 100.000 habitantes), con una tendencia ascendente desde el año 2014 a expensas de los serogrupos C, W e Y, mientras que el serogrupoB, el causante del mayor número de casos (40% en 2018), mantiene una incidencia estable. En 2019 se incluyó en el calendario la vacuna tetravalente MenACWY, que sustituyó a la vacuna frente a MenC a los 12años, y se recomendó una dosis de rescate en adolescentes hasta los 18años, con el objetivo de aumentar la protección comunitaria frente a dichos serogrupos.
La letalidad en 2017-2018 fue del 12,7% (más elevada para los serogrupos W y C). Los grupos más vulnerables son los menores de 5años y mayores de 65años. Se estima una presencia de portadores asintomáticos en torno al 10%, mayoritariamente adolescentes. Las vacunas conjugadas (MenC y MenACWY) eliminan la bacteria de la nasofaringe evitando el contagio. Después de la infección se suele producir inmunidad específica de grupo de duración desconocida.
Tipos de vacunasSe dispone de 6 vacunas conjugadas con el antígeno oligosacárido/polisacárido capsular de diferentes serogrupos: 3 monovalentes frente al serogrupo C (Meningitec, Menjugate, Neisvac-C) y 3 tetravalentes frente a los serogrupos ACWY (Menveo, Nimenrix y Menquadfi). Todas son inactivadas y tienen capacidad de producir anticuerpos circulantes desde los primeros meses, memoria inmunológica y protección de grupo.
Frente al serogrupo B disponemos de 2 vacunas recombinantes multiantigénicas de componentes proteicos (Bexero y Trumenba). Protegen a la persona vacunada frente a algunas cepas del serogrupoB, pero aún se desconoce la duración de esta protección. Por el momento no está incluida en el calendario recomendado por el CISNS, salvo en brotes, pero algunas comunidades autónomas ya la han introducido en sus calendarios oficiales (Canarias, Castilla y León, Andalucía, Cataluña y Galicia).
Esquema de vacunaciónLa pauta de vacunación sistemática para el año 2022 se presenta en la tabla 1: Catch-up en adolescentes hasta los 18años con una dosis de MenACWY.
La pauta de vacunación antimeningocócica en determinadas condiciones de riesgo se resume en la tabla 4.
Grupos o situaciones de riesgo con indicación de vacuna antimeningocócica
| Vacunación sistemática |
| Primer año de vida: MenC 1 dosis a los 4 meses o 2 dosis a los 2 y 4 meses, según la vacuna utilizada |
| Vacunación a los 12 años: MenACWY 1 dosis |
| Catch-up en adolescentes no vacunados con MenACWY hasta los 18 años |
| MenACWY 1 dosis |
| Condiciones de riesgo: MenB (pauta de 2 dosis) + MenACWY (pauta de 2 dosis) |
| Asplenia anatómica o disfunción esplénica grave |
| Deficiencias sistema complemento |
| Tratamiento con eculizumab |
| Trasplante de progenitores hematopoyéticos |
| Antecedente personal de enfermedad meningocócica invasora |
| Personal de laboratorio expuesto a meningococo |
| Además, en VIH se administrarán 2 dosis de MenACWY |
Reacciones locales leves hasta en un 50% de los vacunados. Con MenB los síntomas sistémicos (la fiebre y/o la irritabilidad) son más frecuentes. Solo contraindicadas ante reacciones previas de hipersensibilidad a los principios activos o a alguno de los excipientes incluidos en las vacunas.
Vacunas frente al virus del papiloma humanoLa infección por el VPH es la infección de transmisión sexual más frecuente en Occidente. Infecta piel y mucosas, tanto genitales, anales como orofaríngeas. Se estima que el 75% de mujeres y el 85% de varones sexualmente activos se infectarán a lo largo de su vida. El riesgo estimado de contagio tras una relación sexual sin protección con una persona infectada es elevado (oscila entre el 40 y el 80%). La infección por un genotipo no protege de las causadas por otros genotipos ni de las reinfecciones; por tanto, los principales factores de riesgo son la edad de inicio de relaciones y el número de compañeros sexuales a lo largo de la vida. La mayor parte de las infecciones se resuelven espontáneamente en 2años. Del 10% que persisten, el 1% pueden evolucionar a lesiones preneoplásicas y neoplasias en unos 10-20años. Existen unos 200 genotipos de VPH, que podemos clasificar en: bajo riesgo oncogénico, relacionados con condilomas (el 90% corresponden a genotipos6 y 11), y alto riesgo oncogénico, relacionados hasta la actualidad con cánceres genitales (cérvix, vagina, vulva, ano, pene) y extragenitales (orofaringe, laringe). De entre ellos, los genotipos 16 y 18 se relacionan con el 90% de los cánceres anales y con el 65-70% de cánceres de cérvix, y los genotipos 31, 33, 45, 52 y 58 se han relacionado con un 20% adicional de cáncer de cérvix, con lo que globalmente supone un 85-90%32,33. Últimamente, estudios observacionales han comunicado evidencia de aumento de riesgo para algunos subtipos de cáncer de pulmón (serotipos16 y 18) y de próstata (serotipo16). También relación con la papilomatosis respiratoria recurrente en niños causada por la infección en el canal del parto, sobre todo por los tipos 6 y 1134. La prevención de la infección y de las lesiones ocasionadas por el VPH incluye el uso de preservativo masculino y femenino (aunque sin asegurar protección completa), la vacunación y el cribado con citologías cervicales. La vacunación no modifica la historia natural de la infección si esta ya se ha producido por alguno de los genotipos incluidos en la vacuna. La respuesta inmunogénica en títulos de anticuerpos es mayor tras la vacunación que tras la infección natural. La OMS anunció en 202035,36 la estrategia mundial «90-70-90» para acelerar la eliminación del cáncer de cuello uterino en 2030. En sus objetivos está que todos los países pueden lograr una cobertura de vacunación del 90% en mujeres de 9 a 14años, del 70% de detección mediante cribado en mujeres, una vez antes de los 35años y otra antes de los 45años, y un acceso del 90% al tratamiento. En España, las coberturas vacunales varían según las comunidades autónomas37: globalmente se estima en un 91,5% con la primera dosis y un 81,8% con la segunda. Todas las vacunas disponibles están indicadas a partir de los 9años, son inactivadas (obtenidas por tecnología ADN recombinante) y demuestran seroconversión cercana al 100%, con una duración de la protección de 10años, y se presentan en la tabla 531,38.
Vacunas disponibles frente al VPH
| Tipo de vacuna | Genotipos que cubre | Pauta desde los 9 hasta los 15 años | Pauta a partir de los 15 años |
|---|---|---|---|
| VPH bivalente | 16 y 18 | 2 dosis, a los 0 y 6 meses | 3 dosis, a los 0, 1 y 6 meses |
| VPH tetravalente | 6, 11, 16 y 18 | 2 dosis, a los 0 y 6 meses | 3 dosis, a los 0, 2 y 6 meses |
| VPH nonavalente | 6, 11, 16, 18, 31, 33, 45, 52 y 58 | 2 dosis, a los 0 y 5-13 meses | 3 dosis, a los 0, 2 y 6 meses |
La introducción de la vacunación sistemática en calendarios oficiales en mujeres adolescentes produce una reducción significativa de la infección persistente por VPH, incluso cierto grado de protección cruzada frente a los tipos 31, 33 y 45 con la bivalente. La reducción global del cáncer de cuello uterino en vacunadas respecto a no vacunadas se ha constatado en varios países, como Suecia o Reino Unido39,40. La vacuna bivalente se ha mostrado efectiva en reducir las infecciones orofaríngeas asociadas con el aumento de cánceres de cabeza y cuello en los países occidentales. En Australia se ha comunicado una reducción significativa de la papilomatosis respiratoria recurrente de inicio juvenil desde la introducción de la vacunación y un importante grado de protección del varón en la carga de la enfermedad por el VPH gracias a la vacunación sistemática de la mujer. Algunos países y algunas comunidades autónomas recomiendan la vacunación en varones41. La FDA aprobó en ficha técnica la indicación de la vacuna nonavalente para prevención de cáncer de orofaringe y de cabeza y cuello, pendiente de aprobación por la EMA en Europa. El esquema vacunal y las recomendaciones de estas vacunas por grupos de riesgo se presentan en la tabla 66,25. No existen datos de seguridad, inmunogenicidad o eficacia que apoyen el intercambio entre vacunas, pero algunos países y comunidades autónomas lo autorizan.
Indicaciones de la vacuna frente al VPH
| Vacunación sistemática |
| Niñas a los 12 años: 2 dosis con una separación de al menos 5-6 meses |
| Mujeres hasta los 18 años no vacunadas o con pauta incompleta |
| 3 dosis (0, 1-2, 6 meses) |
| Condiciones de riesgoa |
| Pauta con 3 dosis (0, 1-2, 6 meses) |
| Síndrome WHIM (vacuna que cubra tipos 6 y 11) |
| Infección por VIH (hasta los 26 años) |
| Hombres que tienen relaciones sexuales con hombres (hasta los 26 años) |
| Personas en situación de prostitución (hasta los 26 años) |
| Mujeres con tratamiento escisional de cérvix (cualquier edad) |
| En algunas comunidades autónomas también se incluye la vacunación sistemática en niños y niñas con antecedente de agresión sexual hasta los 26 años |
Recientemente la OMS42,43 ha emitido una recomendación de pauta vacunal con dosis única, basada en la revisión de la evidencia de eficacia comparable a los regímenes de dos o tres dosis, aunque aún no se ha incorporado a los calendarios oficiales. Esto facilitaría aumentar las coberturas tanto en niñas como el «rescate» vacunal en mujeres jóvenes. En varones seguirían el mismo esquema de dosis que en mujeres. Solo en pacientes con VIH y en inmunocomprometidos se mantendría el esquema de tres dosis, dado que en dichos grupos hay evidencia limitada a pautas de una o de dos dosis.
Seguridad34,41,44Los efectos adversos son habitualmente locales y similares a los descritos en cualquier otra vacuna. Hasta el momento, se ha descartado la asociación de estas vacunas con el desarrollo de enfermedades autoinmunes y neurológicas (síndrome de Guillain-Barré, taquicardia paroxística, dolor crónico, tromboembolismo venoso o fallo ovárico precoz). No se recomienda en mujeres embarazadas, aunque mujeres vacunadas con embarazo inadvertido no han presentado anomalías durante el embarazo ni en el feto. Se puede administrar durante la lactancia. No existen datos de seguridad, inmunogenicidad y eficacia en personas inmunodeprimidas. Solo hay algunos estudios con muestra pequeña de personas infectadas con el virus de la inmunodeficiencia humana (VIH) en la que se demuestra seroconversión solo algo menor que en personas no infectadas con VIH.
Nuevas vacunasVacunas pandémicas frente al virus SARS-CoV-2El 11 de marzo de 2020, la OMS45 declaró el estado de pandemia debido a la infección por un nuevo virus: el virus SARS-CoV-2. La pandemia46,47 ha evolucionado en forma de ondas epidémicas en relación con los cambios del virus en su proceso de readaptación con la aparición de variantes (alfa, delta y ómicron) con diferentes comportamientos respecto a su capacidad de infectividad, gravedad y escape vacunal. Se iniciaron diferentes medidas de salud pública, tanto de carácter general (confinamiento, restricción de la circulación de personas, limitaciones de actividades sociales y laborales, etc.) como personal: uso de mascarilla, lavado de manos y distanciamiento entre personas.
La estrategia fundamental para minimizar los efectos del virus se ha basado en el desarrollo de vacunas frente al mismo.
En diciembre del 2019, la Unión Europea aprobó la primera vacuna para el SARS-CoV-2. Actualmente tenemos disponibles en nuestro medio cinco vacunas con el objetivo común de disminuir la morbimortalidad de la COVID-19 pero con plataformas tecnológicas, dosificación y perfiles de eficacia/efectividad y seguridad distintos48 (tabla 7).
Vacunas pandémicas para el SARS-CoV-2 actualmente disponibles en España
| Vacuna/Farmacéutica | Plataforma tecnológica | Edad/Esquema vacunal | Dosis/vía | Fecha autorización | Dosis administradas (1-4-2022) |
|---|---|---|---|---|---|
| Comirnaty®BioN-Tech/Pfizer | ARNm que codifica la proteína S | Edad: a partir de 12 años2 dosis: 0-21 días | 0,3 mli.m. | 22-12-2020 | 62.193.190 |
| Comirnaty®pediátrica | ARNm que codifica la proteína S. | Edad: 5-11 años2 dosis: 0-8 semanas | 0,2 mli.m. | 25-11-2021 | 3.232.575 |
| Spikevax®Moderna | ARNm que codifica la proteína S | Edad: partir de 12 añosDos dosis: 0-28 días | 0,5mli.m. | 6-1-202123-7-202 para 12-17 años | 16.802.733 |
| Vaxzevria®Oxford/Astra-Zeneca | Adenovirus de chimpancé que vehiculiza la proteína S | Edad: a partir de 18 años2 dosis: 0-(10-12) semanas | 0,5 mli.m. | 29-1-2021 | 9.794.734 |
| Janssen | Adenovirus humano 26 que vehiculiza la proteína S | Edad: a partir de 18 añosUna dosis | 0.5 mli.m. | 11-3-2021 | 1.981.811 |
| Nuvaxovid®Novavax | ADN recombinante | Edad: a partir de 18 añosDos dosis: 0-21 días | 0,5 mli.m. | 20-12-2021 |
La eficacia de las vacunas para prevenir la enfermedad viene documentada de los ensayos clínicos (tabla 8) realizados y aprobados por las autoridades sanitarias europeas por procedimiento acelerado dada la situación pandémica.
Eficacia de las vacunas actualmente disponibles en España para el SARS-CoV-2
| Vacuna | Plataforma tecnológica | Esquema vacunal | Eficacia global tras pauta completa de vacunación frente a la infección(IC 95%) |
|---|---|---|---|
| Comirnaty® | ARNm | 2 dosis. | 95,0 (90,0; 97,9) |
| Spikevax® | ARNm | 2 dosis | 94,1 (89,3; 96,8) |
| Vaxzevria® | Adenovirus | 2 dosis | 59,5 (50,9; 71,5) |
| J&J/Janssen | Adenovirus | 1 dosis | 66,1 (59,01; 74,80) |
| Nuvaxovid® | ADN recombinante | 2 dosis | 88,9% (20,2%-99,7% |
Fuente: elaboración propia a partir de datos publicados.
La efectividad se define como la respuesta de las vacunas una vez administradas a la población diana (tabla 9). Las vacunas son efectivas tanto para prevenir la infección como las complicaciones graves, el ingreso hospitalario y la muerte, siendo más eficaces para la prevención de complicaciones que para prevenir la infección.
Efectividad de vacunas para el SARS-CoV-2
| Localización del estudio | Tipo de estudio | Vacunas utilizadas (pauta completa) | Población de estudio | Efectividad/evento(IC 95%) |
|---|---|---|---|---|
| España | Cohortes | Vacunas RNAmComirnaty y Moderna | Mayores de 65 residentes en centros sociosanitarios | Prevenir la infección: 81% (80-82) |
| España | Observacional retrospectivo | Vacunas RNAm | Mayores de 65 residentes en centros sociosanitarios | Infección: 71% (56-82)Hospitalización: 88% (75-95)Fallecimiento: 97% (92-99) |
| Israel | Observacional | Vacunas RNAm | Mayores de 16 años | Infección asintomática: 91% (90-92)Infección sintomática: 97% (96-97)Hospitalización: 97% (97-98)Fallecimiento: 96% (96-97) |
| Estados Unidos | Casos y controles | Vacunas RNAm | Mayores de 65 años | Hospitalización: 94% (49-99) |
| Estados Unidos | Cohortes | Vacunas RNAm | Personal sanitario y trabajadores esenciales | Infección: 90% (68-97) |
| Cataluña | Cohortes prospectivo | Vacunas RNAm | Residencias de ancianos, personal y sanitarios | Infección: 85% (84,8-85,1)Hospitalizaciones: 95% (94-95)Fallecimientos: 96 (96,4-96,9) |
| Navarra | Cohortes prospectivo | Vacunas RNAm | Mayores de 18 años | Infección: 66% (57-74)Hospitalización: 95% (62-99) |
IC 95%: intervalo de confianza al 95%.
Fuente: elaboración propia a partir de la bibliografía.
Las reacciones indeseables posteriores a la vacunación pueden ser el resultado de una reacción individual de la persona vacunada a la administración de la vacuna, un error de implementación o un error de administración, o fenómenos independientes que ocurren concomitantes tras la vacunación sin relación de causalidad.
Hasta el 6 de marzo del 2022 se han administrado en España 99.455.472 dosis de vacunas frente a la COVID-19. El 65% de las dosis administradas correspondieron a Comirnaty (BioNTech, Pfizer), el 23% a Spikevax (Moderna), el 10% a Vaxzevria (AstraZeneca) y el 2% a COVID-19 Vaccine Janssen. Respecto a los grupos de edad, el 67% corresponde a personas de entre 18 y 65años, el 21% a mayores de 65años, el 7% a personas de entre 12 y 17años y el 5% a niños menores de 12años.
Hasta marzo de 2022 se han notificado 64.427 acontecimientos adversos. El 68% han sido comunicados por profesionales sanitarios y el 32% por ciudadanos. Los acontecimientos adversos más frecuentemente declarados son: trastornos generales (fiebre y dolor en la zona de inyección), cefalea, mareos, mialgias y artralgias. De las 64.427 notificaciones, 12.370 se consideraron efectos adversos graves y 415 presentaron un desenlace mortal, sin que ello implique necesariamente una relación causal.
La vacunación no reduce las muertes por otras causas diferentes a la COVID-19, por lo que durante la campaña de vacunación es esperable fallecimientos por otros motivos diferentes sin relación causal con las vacunas.
Hasta el día 6 de marzo de 2022 se administraron en España un total de 24.071.919 dosis de refuerzo: el 44% de Comirnaty y el 56% de Spikevax. Ha habido 1.208 notificaciones de acontecimientos adversos tras la administración de la tercera dosis, y 423 fueron considerados graves.
Algunos efectos secundarios graves son de especial seguimiento:
- •
Es el caso de miocarditis y pericarditis tras la administración de las vacunas de ARNm. Respecto a Comirnaty, se han notificado hasta diciembre de 2021 un total de 240 casos, siendo más frecuentes en varones tras la segunda dosis y en la primera semana. La recuperación fue total, excepto en tres personas, que fallecieron. Para la vacuna Spikevax se notificaron 81 casos, sin constatar fallecidos.
- •
Las vacunas de vectores, Vaxzevria (AstraZeneca) y Janssen, se han relacionado con el síndrome de trombosis con trombocitopenia (STT), incluido en ficha técnica como posible reacción adversa que ocurre mayormente dentro de las tres primeras semanas después de la vacunación. En el caso de Vaxzevria se contraindica la segunda dosis en personas que hayan sufrido STT.
- •
Otro posible efecto adverso incluido en ficha técnica de Vaxzevria es el síndrome de fuga capilar sistémica, contraindicándose la administración de cualquier dosis de esta vacuna en personas que lo hayan padecido.
- •
Hasta ahora, excepto para la vacuna de Janssen, se ha descrito la linfadenopatía axilar tras la inmunización contra la COVID-19 como poco frecuente para Vaxzevria y Pfizer y más habitual para Moderna.
- •
También está descrita la aparición de linfadenopatía supraclavicular para las vacunas mRNA, siendo más frecuente con la tercera dosis.
- •
Mielitis transversa relacionado con la vacuna de Vaxzevria, aunque solo se ha notificado un caso hasta enero del 2022.
En primovacunación, al inicio de la vacunación, se utilizaron tanto vacunas ARNm como de adenovirus en función de la disponibilidad en la emergencia sanitaria. Actualmente se utilizan vacunas ARNm. En el caso de intolerancia, alergia o reacciones adversas graves a vacunas ARNm, una opción posible es la vacuna Nuvaxovid®.
Para las dosis de recuerdo se están utilizando vacunas ARNm.
Vacuna frente al herpes zósterEl herpes zóster (HZ) es la manifestación clínica de la reactivación del virus varicela zóster (VVZ), de la familia Herpesviridae. Tras la primoinfección por el VVZ (varicela), el virus se queda acantonado en forma latente en los ganglios de las raíces nerviosas sensoriales dorsales o craneales. Es una enfermedad muy prevalente en población general (351 casos/100.000 habitante-año entre 2014 y 2018)50. El riesgo de desarrollar HZ en nuestro entorno es aproximadamente del 30% a lo largo de la vida, pudiendo llegar al 50% en las personas a partir de los 85años. La incidencia aumenta con la edad, a partir de los 50años, en pacientes inmunodeprimidos y con determinadas condiciones de riesgo. La incidencia de HZ es más alta en mujeres en cualquier grupo de edad51.
La población vacunada en la infancia frente a varicela también puede desarrollar HZ, aunque el riesgo es menor (se estima un 69% menor), dado que la cepa VVZ vacunal tiene menor reactivación que la cepa VVZ de la infección natural.
La reactivación del VVZ está en relación con disminución de la inmunidad celular, ya sea por la inmunosenescencia fisiológica que aparece con los años o por patologías, condiciones de riesgo y/o tratamientos que producen inmunocompromiso/inmunodepresión. Se espera un aumento de la incidencia debido al envejecimiento de la población y al creciente número de personas con comorbilidades y con inmunodepresión.
El riesgo de hospitalizaciones y mortalidad por HZ es bajo, pero la importancia de la prevención del HZ radica en evitar su principal complicación, la neuralgia postherpética (NPH). Esta tiene una frecuencia de aparición del 5-30% de los pacientes con HZ, aumentando el riesgo igualmente con la edad52. Produce un importante deterioro de la calidad de vida, así como discapacidad y un aumento de costes directos e indirectos. El dolor y el malestar de la NPH pueden durar semanas, meses o incluso años tras la resolución de la erupción vesicular. Otras complicaciones son la sobreinfección bacteriana de la erupción, el compromiso oftálmico e incluso la ceguera, la parálisis facial y la hipoacusia, así como el aumento de riesgo de accidente cerebrovascular isquémico.
Actualmente se dispone de dos vacunas autorizadas en España frente a HZ:
- •
Vacuna de virus vivos atenuados (Zostavax®). Su eficacia disminuye con el tiempo y con la edad, pasando del 64% en <70años a menos del 20% en >80años. No hay datos que avalen dosis de refuerzo en mayores. Contraindicada en inmunocomprometidos. Actualmente ya no está comercializada en España.
- •
Vacuna recombinante de la glicoproteína E del VVZ con sistema adyuvante AS01B basado en liposomas (HZ/su) (Shingrix®). Utiliza dos adyuvantes MPL y QS21 para mejorar la presentación de antígenos y la respuesta humoral. Tiene una eficacia del 97,2% en >50años y del 89,8% en >70años. Ha demostrado inducir respuesta inmune humoral y celular potente y mantenida en el tiempo hasta 10años tras la vacunación. Es una vacuna segura, y la segunda dosis no es más reactógena que la primera. Es idónea para inmunocomprometidos. Las indicaciones de vacunación de la vacuna de herpes zóster de subunidades se resumen en la tabla 10.
Tabla 10.Indicaciones vacuna herpes zóster
Vacunación sistemática ≥ 65 añosCaptación de cohorte de 80 años en 2022 y sucesivamente según disponibilidad de dosis Vacunación en condiciones de riesgo ≥ 18 años en las siguientes condiciones:Trasplante de progenitores hematopoyéticosTrasplante de órgano sólidoTratamiento con fármacos antiJAKVIH (estables con TAR al menos un año)Hemopatías malignasTumores sólidos en tratamiento con quimioterapia - •
La pauta vacunal es de dos dosis por vía intramuscular separadas al menos 2meses.
- •
Los vacunados anteriormente con la vacuna viva atenuada podrán recibir una dosis de la vacuna recombinante pasados 5años.
- •
Dado que el HZ puede ser recurrente, el antecedente de HZ no contraindica la vacunación, aunque se debe posponer hasta la resolución de la fase aguda del mismo.
- •
Las personas sin antecedente de haber padecido varicela ni de vacunación de la misma no tienen indicación de vacunación frente a HZ53.
La viruela es una enfermedad causada por un Orthopoxvirus de la familia Poxviridae. El género Orthopoxvirus incluye el virus de la viruela (el causante de la viruela), el virus Vaccinia (utilizado en la vacuna contra la viruela) y el virus de la viruela bovina. Igualmente incluye el virus de la viruela del mono (MPXV), un virus ADN, causante de la viruela de los monos (monkeypox [MPX]). Este MPXV actualmente es el Orthopoxvirus más importante desde la erradicación de la viruela humana54.
En España la vacunación frente a la viruela se inició en 1903, y debido a la escasa cobertura se declaró vacunación obligatoria entre 1944 y 1979. La vacuna se administraba a los 20meses de edad.
Desde 1977 no se han informado casos de viruela humana en todo el mundo gracias a la vacunación. La OMS consideró erradicada la enfermedad en 1979, y en 1980 recomendó la suspensión de la vacunación antivariólica sistemática. En Estados Unidos, la vacunación obligatoria se abandonó en 197255.
Sí se ha mantenido la recomendación de vacunación frente a viruela en personal que trabaja en laboratorios con Orthopoxvirus.
Los primeros casos de viruela del mono en humanos datan de 1970 en la República Democrática del Congo. Desde entonces el número de casos en África Occidental y Central ha aumentado, manteniendo brotes activos. Los casos fuera del continente africano se han vinculado a un caso importado o al contacto con animales importados desde zonas endémicas56.
El brote actual en Europa fue notificado el 14 de mayo de 2022 por la Agencia Nacional de Seguridad Sanitaria de Reino Unido (UK Health Security Agency [UKHSA]), que informó sobre la identificación de dos casos de MPX sin antecedente reciente de viaje y sin contacto con un caso de MPX importado semanas previas y del que se había informado el 7 de mayo57.
A fecha de 16 de junio de 2022, en la Red Nacional de Vigilancia Epidemiológica (RENAVE)58 se han notificado un total de 497 casos confirmados de MPX en España. De estos, 491 son hombres, 5 son mujeres y en otro no consta esta información. La mediana de edad son 36años. La mayoría presentaron fiebre, astenia, exantema y linfadenopatías a lo largo de su proceso clínico. El mecanismo de transmisión más probable en 112 de los 116 casos de los que hay información disponible fue el contacto íntimo y prolongado durante las relaciones sexuales.
En el resto de Europa se han notificado a esa misma fecha 1.474 casos confirmados, y en el resto del mundo, 298.
El antecedente de vacunación frente a viruela humana puede conferir protección cruzada frente a MPX. Aunque el efecto protector de la vacuna va disminuyendo con el tiempo, es esperable que la protección frente a la enfermedad grave se mantenga en adultos de más de 50años vacunados en la infancia59. Según datos de África, parece que las vacunas frente a la viruela de primera generación protegerían frente a MPX en más del 85%.
Se han desarrollado vacunas de viruela de tercera generación, con menos efectos secundarios. En Estados Unidos la FDA aprobó en 2019 JYNNEOS® para prevenir viruela y MPX. En Europa, la EMA autorizó en 2013 esta misma vacuna con el nombre de IMVANEX® (de Bavarian Nordic), pero solo para la prevención de la viruela60,61.
Aunque en Europa no hay ninguna vacuna específicamente aprobada frente a MPX, se ha visto que la vacunación postexposición de forma temprana puede prevenir la infección por MPX o presentar una clínica menos grave.
Vacuna IMVANEX® en Europa y JYNNEOS ® en Estados UnidosEs una vacuna de replicación deficiente que se utiliza para proteger contra la viruela en adultos. Contiene una forma viva modificada del virus Vaccinia llamada Vaccinia Ankara, que está relacionada con el virus de la viruela. El virus Vaccinia no causa enfermedad en humanos y no puede replicarse en células humanas. Se puede utilizar para la vacunación de personas mayores de 18años con ciertas deficiencias o afecciones inmunitarias, como el VIH o la dermatitis atópica61,62.
Pauta vacunal- •
No vacunados previamente: requiere dos dosis de 0,5ml separadas por al menos 28días. Se administra en inyección subcutánea en la zona superior del brazo.
- •
Vacunados previamente hace años: si es necesaria una dosis de refuerzo, se debe administrar una dosis única de 0,5ml.
- •
Vacunados previamente, pero con condición de inmunocompromiso: requieren dos dosis de 0,5ml separadas por al menos 28días.
- •
Eficacia clínica desconocida.
- •
Seroconversión tras 2 dosis del 80-100% en personas sanas, y del 60% en inmunocomprometidas.
- •
Tras una dosis única la seroconversión en personas sin antecedente de vacunación frente a viruela, es de entre el 5 y el 11% a los 7días, y de entre el 11 y el 57% a los 28días, aunque en personas con antecedente de vacunación puede llegar al 80%.
- •
Los datos anteriores de África sugieren que la vacuna contra la viruela es al menos un 85% efectiva para prevenir la viruela del mono.
Los datos de los estudios muestran que la inmunidad comienza a desaparecer después de 5años y probablemente sea insignificante después de 20años. Si las personas han sido revacunadas con éxito una o más veces, puede persistir cierta inmunidad residual durante ≥30años.
Los efectos adversos más frecuentes son: dolor de cabeza, náuseas, mialgia (dolor muscular), cansancio y reacciones en el lugar de la inyección (dolor, enrojecimiento, hinchazón, endurecimiento y picor). A diferencia de la vacuna de la viruela de primera generación, no se produce el eccema vaccinatum o infección a otras personas por la pústula tras la vacunación. No se han documentado efectos adversos graves.
Esta vacuna no está autorizada para su uso en la población infantil, en embarazadas y en mujeres lactantes, aunque se recomienda individualizar en estos casos, dado que no hay contraindicación absoluta, y se ha utilizado en los brotes ocurridos en Reino Unido en la población infantil. Se han realizado estudios que incluían participantes inmunocomprometidos sin que se haya observado un incremento de eventos adversos en este grupo de población.
Profilaxis postexposición59Las vacunas contra la viruela son efectivas para proteger a las personas contra la viruela del simio cuando se administran antes de la exposición. Los expertos también creen que la vacunación después de una exposición a la viruela del simio puede ayudar a prevenir la enfermedad o a hacerla menos grave.
Los CDC recomiendan que la vacuna se administre dentro de los 4días posteriores a la fecha de exposición para prevenir la aparición de la enfermedad. Si se administra entre 4 y 14días después de la fecha de exposición, la vacunación puede reducir los síntomas de la enfermedad, pero es posible que no la prevenga.
Actualmente en España y en el contexto de escasas dosis disponibles se recomienda la profilaxis postexposición con contactos estrechos de un caso confirmado. Se han establecido dos posibles escenarios diferentes:
- 1.
Vacunación de los contactos estrechos identificados.
- 2.
Vacunación de contactos estrechos que sean personas con alto riesgo de gravedad o de exposición.
Se priorizará la oferta de la vacunación a:
- •
Personas con inmunodepresión, incluyendo infección con VIH con <200 células/ml.
- •
Personal sanitario que haya tenido un contacto cercano (inferior a 1 metro en la misma habitación) sin EPI o que ha presentado alguna incidencia en el uso del EPI.
- •
Personal de laboratorio que maneje muestras de pacientes sospechosos o confirmados de MPX que ha presentado alguna incidencia en el uso del EPI.
Se recomienda administrar una dosis de vacuna en los primeros 4días tras el contacto para intentar evitar la enfermedad. Posteriormente, y si hay disponibilidad de dosis, se administrará una segunda dosis a los 28días de la primera en personas sin antecedente de vacunación frente a la viruela. Si presentan antecedente de vacunación, se valorará si precisan la segunda dosis.
Recomendaciones de vacunación en grupos de riesgoRecomendaciones de vacunación del personal sanitario (tabla 11)Se considera personal sanitario a los profesionales sanitarios y a cualquier personal que pueda estar en contacto con pacientes, con materiales potencialmente infecciosos o expuesto a infecciones transmitidas hacia y desde los profesionales sanitarios: personal de limpieza, seguridad, administrativo, estudiantes, mantenimiento, voluntarios63.
Vacunas recomendadas para el personal sanitario (PS)
| Vacunas | Indicaciones | Serología | Pauta de vacunación y consideraciones |
|---|---|---|---|
| Hepatitis B | No vacunado, vacunación incompleta o no serología posvacunal | Sí para conocer no respondedores | Pauta:Completa si no vacunación: 0,1,6 mesesSi pauta incompleta: completarSi desconocimiento: 1 dosis y serologíaRealizar serología 1-2 meses tras vacunaProfilaxis postexposición: según estado vacunal y respuesta previa a la misma |
| Triple vírica (SRP) | Ausencia de vacunaciónSerología sarampión negativa | Si sospecha susceptibilidada | Pauta: 2 dosis (0,1 meses)Profilaxis postexposición: antes de las 72 horas |
| Tétanos-Difteria (Td) | Menos de 5 dosis frente a tétanos y difteria | No | Vacunación incompleta: completar, no reiniciarProfilaxis heridas tetanígenas |
| Tosferina (dTpa) | Personal de obstetricia y neonatologíaEmbarazadas | No | 1 dosis |
| Gripe | Todo el personal sanitario | No | 1 dosis anual |
| Varicela | No vacunados ni haber padecido la enfermedad | Si sospecha de susceptibilidadb | Pauta 2 dosis (0,1 meses) |
| Hepatitis A | Personal en entornos de riesgo o factores de riesgoc | Si indicado y nacidos antes de 1977 | Pauta: 2 dosis (0,6 meses) |
| Enfermedad meningocócica invasiva (EMI): MenC, MenACYW, MenB | Personal de laboratorioPersonal de riesgo | No | 1 dosis de MenC o MenACYW2 dosis de MenB |
| Fiebre tifoidea | Personal de laboratorio que manipula S. tiphy | No | Vacuna intramuscular: 1 dosis y recuerdo cada 3 añosVacuna oral: 3 dosis y recuerdo cada 3 años |
| Poliomielitis | Personal que trabaja en zonas de riesgo y de laboratorio que manipula muestras de poliovirus | No | Sin vacunación previa: 3 dosis: 0,1-2 meses y 6-12 mesesCon vacunación previa: 1 dosis si han transcurrido más de 10 años de la última dosis |
Se recomienda la vacunación en personas sin historia documentada de vacunación nacidos en España a partir de 1970. La pauta completa de vacunación son dos dosis.
Los trabajadores sanitarios pueden ser fuente de transmisión y adquisición de enfermedades infecciosas tanto a pacientes como al resto de trabajadores. Ese riesgo se puede minimizar, entre otras medidas, mediante la vacunación8.
Aunque en España la vacunación de sanitarios no está sujeta a obligatoriedad, la recomendación debe considerarse como una obligación de ética profesional.
No hay datos globales en España sobre las coberturas vacunales en sanitarios, pero sí hay datos sobre coberturas de vacunación antigripal, que están entre 31% de la temporada 2017-2018 al 62% en la temporada 2020-2021, lo que indica una mejoría, aunque está lejos de las recomendaciones de la OMS (75%)64.
Mujer: edad fértil y embarazo65La decisión de vacunar a una mujer embarazada se debe basar en la valoración del riesgo-beneficio para la madre y el recién nacido, hasta que el lactante inicie su calendario vacunal. Las vacunas inactivadas se pueden administrar, preferentemente en el segundo y tercer trimestres, debido a la falta de estudios en el primer trimestre y para evitar la asociación coincidente con el aborto espontáneo, que es más frecuente al inicio de la gestación. Están contraindicadas las vacunas atenuadas (triple vírica [sarampión, rubeola, parotiditis] y varicela), que deben evitarse incluso durante las 4semanas previas a la concepción, aunque no se han evidenciado efectos adversos para la gestación o para el feto en el caso de la administración inadvertida y no justifica la interrupción del embarazo. Es por ello que, en toda mujer en edad fértil con deseo de embarazo, debemos repasar su calendario vacunal haciendo énfasis en las vacunas atenuadas.
En 2020 en España se constatan coberturas altas para dTpa (85,4%) pero disminuyen para gripe (61,9%).
COVID y embarazo66-68: presentan un mayor riesgo de enfermedad grave, de hospitalización y muerte, además de un riesgo incrementado de parto pretérmino y de los riesgos neonatales derivados. Precisan dosis de refuerzo a partir de los 6meses de la segunda dosis de ARNm (o a partir de los 3meses tras vacunación completa con AstraZeneca o Janssen). Si el embarazo ocurre en el periodo entre dosis, y la previa hubiera sido AstraZeneca o Janssen, se recomienda utilizar vacuna de ARNm para la siguiente dosis. Son vacunas seguras y efectivas, con una reactogenicidad similar a la de la población general, incluida la tercera dosis.
Durante la lactancia65 se puede administrar cualquier tipo de vacuna de nuestro calendario, tanto a la madre como al niño, a excepción de la fiebre amarilla, ya que los lactantes corren el riesgo de desarrollar enfermedad. Se puede vacunar con cualquier vacuna a los convivientes. Las vacunas recomendadas en el embarazo se resumen en la tabla 12.
Vacunas recomendadas en el embarazo
| Tétanos | Completar si <5 dosis con Td (una de las dosis se sustituye por dTpa en la 27-36 semana) |
| Hepatitis | Determinar AgHBs, anti-HBs, anti-HBc y completar pauta o iniciar si pertenecen a grupos de riesgo, tienen conductas de riesgo o exposición |
| Vacunas especialmente recomendadasa | |
| Gripe (1,2,3) | En cualquier trimestre con vacunas inactivadas (protegen a la madre y al recién nacido, al que no se le puede vacunar en los primeros 6 meses de vida) |
| Tosferina (4,5,6) | Una dosis de dTpa en cada embarazo, entre la 27-36 semana de gestaciónAdministrar una dosis de dTpa independientemente de las dosis de Td recibidas anteriormente y de dTpa si fueron antes de la semana 20 del embarazoLa vacunación de las madres fortalece la inmunidad de los recién nacidos mejorando la protección frente a tosferina en los dos primeros meses (antes de que inicien la primovacunación) y reduciendo la enfermedad grave en los lactantes |
| COVID | En cualquier trimestre si hay alto riesgo de exposición o comorbilidad (preferible después de la 14 semanas), con vacunas ARNm. Dosis de refuerzo a partir de los 6 meses (o a partir de los 3 meses si se usaron AstraZeneca o Janssen) |
| Vacunas a considerar en situaciones de alto riesgo | |
| Neumococo, meningococo, H. influenzae tipo b, hepatitis A, rabia, VPI (polio inactiva), fiebre tifoidea y fiebre amarilla (atenuada y no exenta de riesgos durante el embarazo; por tanto, puede solicitarse una exención médica de vacunación en viajes internacionales) | |
Los pacientes inmunocomprometidos son una población muy heterogénea que abarca no solo las deficiencias inmunitarias primarias o secundarias a tratamientos inmunosupresores, sino que incluye también a los pacientes con patologías crónicas que tendrán una respuesta inmune menor y a aquellos con conductas/situaciones de riesgo que incrementan la susceptibilidad a determinadas infecciones.
Es fundamental la coordinación entre atención primaria y atención hospitalaria para elegir el momento óptimo en que se administrará la vacuna, completando el calendario sistemático vigente con pautas aceleradas si es preciso.
En general, las vacunas inactivadas, toxoides y de polisacáridos se administran con las mismas recomendaciones. Las vacunas atenuadas (varicela, triple vírica, polio oral, fiebre tifoidea oral, cólera oral, fiebre amarilla y gripe intranasal) están contraindicadas en la inmunodepresión grave.
Es preferible vacunar en fases tempranas o estables de la enfermedad, de 2 a 4semanas antes del inicio del tratamiento inmunosupresor y de 1 a 6meses después si la inmunodepresión es transitoria.
Conviene solicitar serologías pre y posvacunales (varicela, sarampión, rubéola y parotiditis) y hepatitisB (±hepatitisA) en función de los antecedentes clínicos y/o vacunales del paciente, con el objetivo de programar dosis de refuerzo si fuesen necesarias.
El personal sanitario que atiende a estos pacientes, los cuidadores y los convivientes deberían ser inmunes a la hepatitisA, la polio, la varicela, el sarampión, la parotiditis, la triple vírica, la tosferina y la gripe.
Vacunación en pacientes con enfermedades crónicasLa frecuencia de pacientes con patologías crónicas es cada vez mayor, y presentan un mayor riesgo de adquisición y una mayor gravedad de las infecciones, que pueden alterar el curso de su enfermedad de base. En la tabla 13 se indican las recomendaciones vacunales adaptadas a las principales patologías crónicas.
Vacunación en enfermedades crónicas
| Enfermedades crónicas | Vacunas | |||
|---|---|---|---|---|
| Gripe1 | Neumococo2 | Hepatitis B | Hepatitis A | |
| Enfermedades cardiovasculares y respiratorias crónicas | Anual | VNP23 | − | − |
| Enfermedades neurológicas y neuromusculares graves3 | Anual | VNP23 | − | − |
| Enfermedad renal crónica y síndrome nefrótico | Anual | VNC13 + VNP23 | −4 | − |
| Enfermedad hepática crónicaAlcoholismo crónico y cirrosis | AnualAnual | VNP23VNC13 + VNP23 | SíSí | SíSí |
| Diabetes mellitus | Anual | VNP23 | ||
| Hemofilia y trastornos hemorrágicos crónicos. Receptores de hemoderivados y transfusiones múltiples | Anual | − | Sí con determinación de anticuerpos posvacunación 4-8 semanas | − |
| Hemoglobinopatías y anemiasObesidad mórbidaTabaquismo | Anual | − | − | − |
| Enfermedades inflamatorias crónicas | Anual | VNC13 + VNP23 si inmunosupresión terapéutica | 3 dosis (0,1 y 6 meses)5 | − |
| Enfermedad celiaca | Anual | VNP23 | −6 | − |
| Implante coclear | Anual | VNC13 + VNP237 | − | − |
| Fístula de líquido cefalorraquídeo | Anual | VNC13 + VNP237 | − | − |
| Tratamiento crónico con AAS o anticoagulantes | Anual | − | − | − |
| Síndrome de Down | Anual | VNC13 + VNP237 | 3 dosis, si necesario repetir tras serología | − |
| Mujeres con tratamiento escisional de cérvix8 | − | − | − | − |
1A partir de los 6 meses. 6 meses-8 años: una o ninguna dosis anterior: 2 dosis (separadas 4 semanas), si dosis anterior: 1 dosis al año. > 8 años: dosis anual.
2Enfermedad neumocócica invasiva: <12 meses: según calendario (2,4 y 11 meses), sin vacunación previa de VNC: 2 dosis, separadas 8 semanas; > 5 años, adultos y > 65 años: 1 dosis VNC13 y 1 dosis VNP23. Dosis de recuerdo VNP23 5 años después (> 65 años). Pauta secuencial (VNC + VNP23): 1 dosis VNC (> 5 años será VNC13), seguida de 1 dosis de VNP23, con un intervalo de 12 meses, y mínimo 8 semanas. Si ha recibido dosis de VNP23, se recomienda administrar VNC13, con intervalo de 12 semanas entre ellas. También se recomienda una 2 dosis de VNP23 a los 5 años de la primera.
3En enfermedades neurológicas y neuromusculares graves que hayan desarrollado una enfermedad neurológica inflamatoria autoinmune tras la recepción de alguna vacuna (síndrome de Guillain-Barré, encefalomielitis, etc.) debe realizarse una valoración individual de la administración de la vacuna.
4Si <12 meses (según calendario). Vacunados previamente: se precisa realizar seguimiento serológico. Si exposición y no respondedores: inmunoglobulina específica antihepatitis B. Al principio de la enfermedad, vacunación estándar. Diálisis y prediálisis: <15 años: vacuna con 20 μg de AgHBs (0, 1 y 6 meses). > 15 años: vacuna 20 μg de AgHBs y adyuvante (0, 1 y 6 meses) o vacuna de 40 μg de AgHBs (0, 1, 6 meses).
5Se administrará si riesgo de exposición, precisando realizar marcadores (anti-HBc, anti-HBs, AgHBs) para confirmar susceptibilidad.
6Adultos no necesaria la vacunación si buen control y no asociación con enfermedad autoinmune o maligna. En menores, solicitar marcadores (anti-HBs) a las 4-8 semanas de la vacunación (según calendario), para valorar dosis de recuerdo.
7Entre ambas vacunas intervalo mínimo de 8 semanas, habitualmente 12 meses.
8Independientemente de la edad. Administración precoz tras el diagnóstico de la lesión preferentemente antes de la intervención y hasta 12 meses tras la misma.
Disponible en: https://www.sanidad.gob.es/profesionales/saludPublica/prevPromocion/vacunaciones/programasDeVacunacion/riesgo/docs/Enfermedades_cronicas.pdf
https://www.sanidad.gob.es/profesionales/saludPublica/prevPromocion/vacunaciones/programasDeVacunacion/riesgo/docs/Otros_grupos_riesgo.pdf
Fuente: Vacunación en pacientes con enfermedades crónicas. Ministerio de Sanidad, 2022.
Las personas con enfermedad cardiovascular y/o enfermedad respiratoria crónica tienen un mayor riesgo de padecer gripe y enfermedad neumocócica invasora, así como mayor riesgo de tener cuadros más graves y de desarrollar complicaciones. Se recomienda la vacunación anual frente a la gripe, excepto en HTA aislada y enfermedad respiratoria crónica, incluyendo el asma, así como los convivientes y cuidadores.
En las personas con enfermedades neurológicas y neuromusculares graves que hayan desarrollado una enfermedad neurológica inflamatoria autoinmune tras la recepción de alguna vacuna (síndrome de Guillain-Barré, encefalomielitis, etc.) debe realizarse una valoración individual de la administración de más dosis de esa vacuna.
La enfermedad renal crónica conlleva mayor grado de inmunosupresión en estadios avanzados de la enfermedad. Se debe realizar la vacunación preferiblemente al inicio del declive de la función renal, para lograr una mejor respuesta autoinmune, y siempre antes de empezar con diálisis. En vacunados previamente es necesario realizar seguimiento serológico. No respondedores: en caso de exposición a VHB, deberán recibir inmunoglobulina específica antihepatitisB. En pacientes en diálisis y prediálisis ≥15años, administrar vacuna con 20μg de AgHBs y adyuvante, pauta 0-1-2-6meses, o vacuna de 40μg de AgHBs 0-1-6meses.
Las personas con enfermedad hepática crónica (incluyendo pacientes con esteatosis hepática, en terapia hepatotóxica y con alcoholismo crónico) y cirrosis tienen mayor susceptibilidad a las infecciones, sobre todo bacterianas. Además, tienen mayor riesgo de hepatitis fulminante por VHA y VHB.
Los diabéticos presentan una menor respuesta de anticuerpos ante infecciones, alteración de la función fagocítica y de los leucocitos, y mayor predisposición a la colonización bacteriana. Al poder tener alterada la función de otros órganos por la propia enfermedad, el riesgo de complicaciones tras infecciones está aumentado.
En las personas con trastornos de la coagulación y en las que reciben tratamiento anticoagulante es importante realizar control tras vacunación por el riesgo de formación de hematomas tras la inyección. La administración por vía subcutánea podría considerarse como alternativa, pero es preferible la administración intramuscular, porque para algunas vacunas podría haber disminución de la inmunogenicidad. En pacientes con hemofilia o en tratamiento con factores de coagulación o terapia similar, la administración de la vacuna intramuscular debe realizarse tan pronto como sea posible después de recibir la medicación.
En las personas con hemoglobinopatías y anemias se recomienda la vacunación anual frente a la gripe. La betatalasemia minor y la presencia de rasgo falciforme no suponen inmunosupresión, por lo que recibirán la misma pauta de vacunación que la población general.
Las personas con obesidad mórbida tienen mayor riesgo de hospitalización por complicaciones respiratorias por infección por el virus de la gripe.
Entre las enfermedades inflamatorias crónicas se incluyen la enfermedad inflamatoria intestinal, las artropatías inflamatorias (lupus eritematoso sistémico, artritis reumatoide, etc.) y determinadas condiciones dermatológicas inflamatorias. La evidencia científica sobre la respuesta y la seguridad vacunal es limitada, ya que el número de estudios es limitado y el tamaño muestral es reducido.
La enfermedad celiaca se ha asociado con cierto grado de hipoesplenismo asociado a la duración de la exposición al gluten que suele revertir tras la retirada del mismo de la dieta. En caso de disfunción esplénica, el riesgo de enfermedad invasora neumocócica es mayor. En edad adulta no es necesaria la vacunación frente al VHB si hay buen control dietético y sin asociación de enfermedad autoinmune o maligna.
Vacunación en pacientes inmunodeprimidos (tabla 14)Deficiencias inmunitarias primarias y congénitasSíndromes habitualmente causados por mutaciones genéticas diversas, muchas de las cuales son hereditarias. Se caracterizan por la ausencia o la deficiencia en alguno de los componentes del sistema inmune innato o adaptativo. Las personas con este tipo de patologías presentan respuestas a las vacunas menos robustas y de menor duración, existiendo además el riesgo de que se produzca una infección diseminada cuando se administran vacunas de microorganismos vivos.
Vacunación en pacientes con inmunosupresión
| Grupos de riesgo | Gripe | Neumococo | Meningococo ACWY | MenB | Hib | Hepatitis A | Hepatitis B | dTPa | Triple vírica | Varicela | VPH | VPI | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Asplenia1 | Sí | NVC13+NVP23, pauta secuencial (intervalo 12 semanas, mínimo 8 semanas). Dosis recuerdo NVP23 si han transcurrido más 5 años2. | Si, 2 dosis (0, 2 meses). Dosis de recuerdo a los 5 años3 | Si4MenB 4C: 2 dosis intervalo mínimo 4 semanasMenB fHbp: 3 dosis, pauta 0, 2 y 6 meses | Sí, dosis única5. | Sí, si coexisten otros factores de riesgo | Sí, si coexisten otros factores de riesgo | Sí | Sí | Sí | − | − | |
| VIH | Sí. Inactivada6 | NVC13+NVP23, pauta secuencial (intervalo 12 semanas, mínimo 8 semanas). Dosis recuerdo NVP23 si han transcurrido más 5 años | Sí, 2 dosis (0, 2 meses). Dosis de recuerdo a los 5 años | − | − | Sí7 | Sí8, 4 dosis (0, 1, 2 y 6 meses) | Sí9 | Sí en seronegativos si CD4 > 200 células/mm3 mantenidos <6 meses. Pauta de 2 dosis (intervalo 4 semanas)10 | Sí en seronegativos si CD4 > 200 células/mm3, mantenidos. Pauta de 2 dosis (0 y 3 meses). No usar tetravírica11 | Sí12 | − | |
| Neoplasias | Sí, vacuna inactivada | Sí pauta secuencial (intervalo 12 semanas, mínimo 8 semanas) | − | − | − | − | Actuar según estudio serológico pretratamiento y riesgo de exposición al virus13 | Sí, 1 dosis | Actuar según vacunación previa14 | Actuar según vacunación previa15 | − | − | |
| Déficit de complemento | Anual | Sí pauta secuencial VNC13 +VNP23 (intervalo 12 semanas, mínimo 8 semanas)2 | 2 dosis (intervalo mínimo 8 semanas)16 | MenB 4C: 2 dosis intervalo mínimo 4 semanasMenB fHbp: 3 dosis, pauta 0, 2 y 6 meses4 | 1 dosis, con independencia de vacunación previa | − | 3 dosis (0, 1 y 6 meses)17 | − | − | − | − | − | |
| Tratamiento inmunosupresor | Anual | Sí pauta secuencial VNC13+VNP23 (intervalo 12 semanas, mínimo 8 semanas)2 | − | − | − | Si riesgo y hepatotoxicidad: 2 dosis (0 y 6 meses)18 | Si riesgo elevado y hepatotoxicidad: 3 dosis (0, 1 y 6 meses)19 | − | − | − | − | − | |
| Trasplante de órgano sólido (TOS) | Pretrasplante20 | Anual | Sí, pauta secuencial | − | − | − | Sí, 2 dosis (0 y 6 meses) | Sí, 4 dosis (0, 1. 2 y 6 meses) | 1 dosis | Sí | Sí, 2 dosis (0 y 4 semanas) | Sí | − |
| Postrasplante21 | Anual | Sí, pauta secuencial | − | − | − | Sí, 2 dosis (0 y 6 meses) | Sí, 4 dosis (0, 1, 2 y 6 meses) | 1 dosis | Contraindicada | Contraindicada | Sí | − | |
| Determinación de anticuerpos | No | No | − | − | − | Pre y posvacunación | Pre y posvacunación | No | Pre25 y posvacunación | Pre y posvacunación | No | − | |
| Comentarios | Vacuna inactivada22 | Pauta secuencial VNC13 +VNP23 (intervalo mínimo 8 semanas)2 | − | − | − | Se recomienda23 | Vacuna de carga elevada (40 μg) o con adyuvante (AS04C)24 | No, durante los 10 últimos años | − | No usar vacuna tetravírica | Si no vacunada previamente. En mujeres hasta 26 años | − | |
| Trasplante de progenitor hematopoyético26 (TPH) | Anual. | VNC13: 1ª dosis ≥ 3 meses, 2ª ≥ 4 meses, 3ª ≥ 5 meses.VNP2327: 1ª ≥ 12 meses (intervalo 2 meses tras VNC13) | 1ª dosis ≥ 12 meses, 2ª ≥ 18 meses (intervalo mínimo 6 meses) | 1ª dosis ≥ 12 meses, 2ª ≥ 18 meses (intervalo mínimo 1 mes) | 1ª dosis ≥ 6 meses, 2ª ≥ 7 meses, 3ª ≥ 8 meses, 4ª ≥ 18 meses (intervalo mínimo 1 mes)28 | 1ª dosis ≥ 12 meses, 2ª ≥ 18 meses (intervalo mínimo 6 meses) | 1ª dosis ≥ 6 meses, 2ª ≥ 7 meses, 3ª ≥ 8 meses, 4ª ≥ 18 meses (intervalo mínimo 1 mes)28-29 | 1ª dosis ≥ 6 meses, 2ª ≥ 7 meses, 3ª ≥ 8 meses, 4ª ≥ 18 meses (intervalo mínimo 1 mes)28 | 1ª dosis ≥ 24 meses. 2ª dosis al mes30 | 1ª dosis ≥ 24 meses. 2ª dosis a los 2 meses31 | 1ª dosis ≥12 meses, 2ª ≥ 13-14 meses, 3ª ≥ 18 meses. Pauta 3 dosis. En mujeres hasta 26 años32 | Inactivada1ª dosis ≥ 6 meses, 2ª ≥ 7 meses, 3ª ≥ 8 meses, 4ª ≥ 18 meses (intervalo mínimo 1 mes)28 | |
1La asplenia por sí misma no contraindica el calendario de vacunación vigente.
2En <65 años, 1 dosis adicional al cumplir los 65 años (intervalo mínimo 5 años respecto de la dosis anterior de VNP23). Si se considera necesario se puede administrar dosis de recuerdo con un intervalo ≥ 5 años entre dosis.
3Según la evidencia disponible.
4En función de la evidencia se valorará la administración de dosis de recuerdo de vacuna frente al serogrupo B.
5Independientemente de la vacunación anterior.
6La vacuna atenuada está contraindicada.
7Menos de la mitad seroconvierten tras la primera dosis, aumentando al 70% tras las 2 dosis. Si CD4 > 350mm3, pauta de 2 dosis (0, 6 meses). Serología posvacunación negativa (2-3 meses), se administrará 1 dosis adicional. Si CD4 <350mm3, pauta 3 dosis (0, 1 y 6 meses). Serología posvacunación negativa (2-3 meses), se administrará 1 dosis adicional. Serología prevacunal coste-efectiva en nacidos antes de 1977, residentes en zonas de alta o moderada endemicidad, hombres que tienen sexo con hombres, personas que se inyectan drogas. Recuerdos en personas con riesgos de exposición.
8Determinación de anticuerpos pre/posvacunación. Serología negativa y no inmunodepresión, pauta de 0, 1 y 6 meses; si negativa e inmunodepresión, pauta de 0, 1, 2 y 6 meses (vacuna adyuvada AS04 o alta carga 40 μg). Serología posvacunal 4-8 semanas: no seroconversión, 3 dosis adicionales separadas 1 mes (vacuna adyuvada AS04 o alta carga 40 μg). Si no seroconversión: determinación anual de AgHBs y si factores de riesgo profilaxis postexposición. La información disponible no determina el número máximo de dosis de recuerdo.
9Si correctamente vacunado (5 dosis), valorar dosis de recuerdo en personas con riesgo de exposición (cada 10 años).
10Determinar anticuerpos pre/posvacunación. Igualmente en mujeres en edad fértil (siempre que no estén embarazadas. Previa serología frente a la rubeola para asegurar protección) si seronegativas (CD4 > 200 células/mm3 mantenidos durante al menos 6 meses). La vacuna está contraindicada si CD4 <200 células/mm3.
11Determinación de anticuerpos pre/posvacunación.
12Se recomienda la vacunación hasta los 26 años, tanto en hombres como en mujeres, independientemente de la carga viral, nivel de CD4, o la existencia o no de tratamiento (la respuesta es mejor si CD4 > 200mm3 o reciben antirretrovirales).
13Estudio serológico previo (AgHBs, anti-HBc y anti-HBs), antes de iniciar tratamiento independientemente de estado vacunal previo. Si marcadores negativos, se administrara dosis de recuerdo o una pauta completa, en función de la dosis previa recibida.
14Serología negativa: 1 dosis/4 semanas antes de iniciar el tratamiento (o 2 dosis separadas 4 semanas). A los 12 meses, serología, si negativa se administrará 1 o 2 dosis, en función de las recibidas previamente. Serología positiva, se repite a los 12 meses, si negativa administrar 1 dosis.
15Mismo razonamiento que en triple vírica.
16Dosis de recuerdo a los 5 años. Dosis posteriores sujetas a la evidencia disponible.
17En pacientes con angioedema hereditario.
18Riesgo elevado de exposición: sexual, personas que se inyectan drogas, hepatopatía crónica, TOS, TPH y riesgo ocupacional.
19Riesgo elevado de exposición: sexual, personas que se inyectan drogas, contacto portador AgHBs, infección crónica VIH o VHC, hepatopatía crónica, TOS, TPH, recepción de hemoderivados o riesgo ocupacional.
20Documentar el estado de vacunación previo.
21Se prefiere vacunación pretrasplante. Se vacunará después en los casos en los que no se haya podido hacer con anterioridad o en los casos que requieran repetir dosis. El intervalo recomendado es de 6 meses tras el trasplante.
22El intervalo entre trasplante y vacuna antigripal se puede acortar de 6 meses a 1 mes tras el trasplante, si coincide con la temporada de gripe.
23Se recomienda únicamente si se presentan otros factores de riesgo, como trasplante hepático, hepatopatías, etc.
24Si no respondedor, administrar 2 dosis adicionales y valorar inmunoprofilaxis ante posibles exposiciones.
25Si es previsible que el trasplante se realice rápidamente, se puede valorar la vacunación con 1 dosis el mismo día en que se haga la extracción para la determinación de anticuerpos. La 2.a dosis dependerá de los resultados de la serología previa.
26El momento del inicio de la vacunación debe individualizarse, en función de las características de la persona. Si el inicio es después de los 3 meses, individualizar el calendario respetando los intervalos mínimos entre dosis (mínimo 1 mes).
27En enfermedad del injerto contra el huésped crónica donde es improbable que respondan a VNP23, es preferible administrar una 4.ª dosis de VNC13.
28Se administrara con vacuna combinada hexavalente.
29Realizar marcadores (AgHBs, anti-HBs y anti-HBc) antes de vacunar. Tras la 4.ª dosis (1-2 meses), solicitar anti-HBs. Los no respondedores, revacunación con vacuna de alta carga (40 μg) o con adyuvante (AS04C).
30Vacunación en seronegativos y a partir de los 2 años del trasplante y más de 1 año sin inmunosupresión; y al menos 8-11 meses desde la última dosis de inmunoglobulina o de la última dosis de plasma.
31No se recomiendan las vacunas vivas hasta al menos 2 años postrasplante. No se recomienda la serología posvacunal por las técnicas convencionales. Si se dispone de la técnica de fluorescencia indirecta contra el antígeno de la membrana, se debe realizar tras la 2.ª dosis (al 1-2 meses).
32Comenzar a los 12 meses del trasplante.
Disponible en: https://www.sanidad.gob.es/profesionales/saludPublica/prevPromocion/vacunaciones/programasDeVacunacion/riesgo/docs/Vac_GruposRiesgo.pdf
Por tratarse de entidades muy específicas, conviene revisar las últimas evidencias de que se disponga (ver documento de la Ponencia de Programas y Registro de Vacunaciones «Vacunación en grupos de riesgo de todas las edades y en determinadas situaciones».
Deficiencias inmunitarias secundarias a terapias inmunosupresorasSe considera terapia inmunosupresora:
- •
El tratamiento con esteroides si se utilizan ≥20mg diarios de prednisona o equivalente durante ≥2 semanas (o ≥2mg/kg/día en personas de menos de 10kg). Para administrar vacunas atenuadas se recomienda esperar un mes después de finalizar el tratamiento para garantizar inmunogenicidad óptima.
- •
Tratamiento con antimetabolitos, anti-TNF y otros fármacos biológicos: cualquier dosis y duración del tratamiento. Se recomienda no administrar vacunas atenuadas durante los siguientes 3-6meses si hay tratamiento con antimetabolitos y con la mayoría de fármacos biológicos, y 12meses si hay tratamiento con anti-CD20 y anti-CD52. El tratamiento con eculizumab (anticuerpo monoclonal contra el factor C5 del sistema del complemento, que inhibe la activación de la cascada terminal del complemento) comporta un riesgo elevado de padecer enfermedad meningocócica, por lo que se recomienda vacunación con MenACYW y MenB, además de realizar quimioprofilaxis durante el tratamiento e iniciar antibioterapia precoz en caso de aparición de síntomas de enfermedad meningocócica.
Las personas con asplenia anatómica o funcional presentan un riesgo aumentado de infección grave por algunos microorganismos entéricos gramnegativos y bacterias encapsuladas, especialmente neumococo, meningococo y Haemophilus influenzae tipob, incluso a pesar de haber sido correctamente vacunadas.
En el caso del VIH, la presencia de elevada carga viral puede disminuir la efectividad de algunas vacunas, aunque esto no supone una razón para retrasar la vacunación, y en general la respuesta presenta una relación directa con el nivel de linfocitosT-CD4. Las vacunas inactivadas son seguras. En la vacunación frente a las hepatitis se realizará una determinación de anticuerpos pre y posvacunación. Frente al VHB se usará vacuna con mayor carga antigénica o adyuvantes más potentes. Si no se es respondedor, se administrarán 3dosis adicionales con intervalos de 4semanas. Las vacunas atenuadas triple vírica y varicela están contraindicadas en los estadios de inmunodepresión grave y se debe realizar serología pre y posvacunación. En seronegativos frente a sarampión y varicela y en mujeres en edad fértil seronegativas frente a rubeola deben vacunarse si los CD4 >200 células/mm3 mantenidos durante al menos 6meses. Es necesaria la determinación de anticuerpos pre y posvacunación.
Las personas con cáncer pueden presentar inmunosupresión como resultado de su enfermedad subyacente y/o por el tratamiento quimioterápico con o sin radioterapia (esta situación puede durar hasta unos meses tras la suspensión del tratamiento). Además, pueden perder total o parcialmente la protección conferida por las vacunas administradas antes del proceso mórbido. Esta inmunosupresión puede revertirse no antes de los 6meses para los linfocitosB y de 9 a 12meses para las célulasT, tras la finalización del tratamiento.
Trasplante de órgano sólido y trasplante de progenitores hematopoyéticosLas personas con trasplante de órgano sólido (TOS) requieren un tratamiento inmunosupresor permanente para evitar posibles rechazos, por lo que su inmunidad humoral y celular está disminuida y su riesgo de infección es mayor. La inmunosupresión suele ser mayor durante los 3 a 6primeros meses tras el trasplante y menor después del primer año. Nuestra aportación como profesionales de atención primaria ha de consistir en revisar y poner al día su calendario vacunal, preferiblemente pretrasplante. Se vacunará después del trasplante en aquellos casos que no se haya podido hacer con anterioridad o en casos que se requiera repetir la vacunación. Se recomienda respetar un intervalo de 6meses tras el trasplante para reiniciar la vacunación. En relación con la vacunación antigripal este intervalo puede ser de un mes si coincide con la temporada de gripe. Si el trasplante es urgente se puede valorar la administración de una dosis de TV en el mismo momento de la extracción para la determinación de anticuerpos. La administración de la segunda dosis dependerá del resultado de la serología previa. Para la inmunización frente a neumococo usaremos la pauta secuencial VNC13 +VNP23 con intervalo mínimo de 8semanas.
En los trasplantes progenitores hematopoyéticos (TPH) la inmunidad previa se pierde total o parcialmente porque la ablación de las células hematopoyéticas en la médula ósea elimina la memoria inmune y requieren repetición completa de la vacunación. La enfermedad injerto contra huésped crónica se asocia con una hipoesplenia funcional de intensidad variable, aumentando el riesgo de infección por bacterias encapsuladas, especialmente neumococo.
Vacunas del viajero (tabla 15)La mayoría de las vacunas, así como otros consejos para la prevención de enfermedades durante el viaje, son asumibles en una consulta de atención primaria. Se revisará su carné vacunal para ponerlo al día si fuese necesario y se decidirá si precisa alguna vacuna específica por sus condiciones personales, de salud o de su viaje, teniendo en cuenta los protocolos para los viajes internacionales con origen o destino España en el contexto de la pandemia COVID-19. Idealmente, la consulta y la administración de vacunas, si están indicadas, debería hacerse un mes antes de iniciar el viaje.
Vacunas del viajero
| Recomendadas | |
| Sistemáticas | Forman parte del calendario vacunal |
| Específicas del viajero según | Sus condiciones personales:• Edad. En mayores de 65 años algunas vacunas pueden ser menos efectivas (gripe, VHA, VHB, encefalitis centroeuropea) o incrementar la probabilidad de sus efectos secundarios graves (fiebre amarilla)• Embarazo• Patología de base y medicación. Valorar las situaciones de inmunocompromiso. Consultar las tablas 13 y 14 y https://wwwnc.cdc.gov/travel/yellowbook/2020/travelers-with- additional-considerations/immunocompromised-travelers• Antecedentes vacunales y posibles precauciones y/o contraindicacionesDel tipo o motivo del viaje:• De aventura, organizado, de cooperación, asistencia a eventos de masas, etc.• Del país de destino y sus condiciones sanitarias, las zonas visitadas (rurales, urbanas), la época del año del viaje, la duración o la periodicidad• De estudios en adolescentes y adultos jóvenes. Revisar calendario vacunal del país de destino y completar si fuese necesario. Podemos ver los calendarios europeos en: https://vaccine- schedule.ecdc.europa.eu/ y los mundiales en: https://www.mscbs.gob.es/profesionales/saludPublica/sanidadExterior/salud/enlaceOMS.htm |
| Obligatoriasa | |
| Exigidas para poder entrar a un determinado país. Consultar en:https://www.mscbs.gob.es/profesionales/saludPublica/sanidadExterior/docs/LISTADO_DE_PAISES.pdf• Vacuna frente a la fiebre amarilla.• Vacuna antimeningococo frente a los serotipos A, C, W135, Y para los peregrinos a La Meca o Medina (Hajj y Umrah). Los requisitos se publican anualmente en la web del ministerio de exteriores saudí (disponible en: https://www.moh.gov.sa/en/Hajj/HealthGuidelines/HealthGuidelinesDuringHajj/Pages/HealthRe quirements.aspx)• Algunos países libres de polio exigen la vacunación a viajeros procedentes de zonas endémicas | |
La indicación ha de ser personalizada en un centro de vacunación internacional. Su administración debe acompañarse del certificado oficial expedido por los centros adscritos a la OMS. El certificado de exención también ha de ser expedido por los centros oficiales, cuya ubicación está disponible en web del ministerio mencionada.
Podemos apoyarnos en las recomendaciones del Ministerio de Sanidad y consultar también los centros de vacunación internacional en: https://www.mscbs.gob.es/profesionales/saludPublica/sanidadExterior/salud/home.htm
- •
En medicina, el desarrollo de vacunas es uno de los sectores que mayor expansión está teniendo y va a tener en el futuro.
- •
En este documento revisamos las últimas recomendaciones sobre vacunación por enfermedad y por grupo de riesgo, dando especial importancia a los aspectos más novedosos en la vacunación sistemática (gripe, neumococo, vacunas antimeningocócicas y vacunas contra el virus del papiloma humano [VPH]), las nuevas vacunas (vacunas pandémicas contra la COVID-19, vacunas contra el herpes zóster de subunidades, vacunas contra la viruela del mono) y las vacunas recomendadas según condición de riesgo (embarazo y lactancia sanitarios, viajeros, pacientes con inmunosupresión o patología de base).
- •
Cualquier médico de atención primaria debe saber manejar las vacunas como lo hace con cualquier otro fármaco, conociendo el manejo, las indicaciones y las contraindicaciones de ellas. Con la exposición de los temas y las tablas, se aportan herramientas para alcanzar este objetivo.
Es un artículo por encargo de la revista. Monográfico del Papps bianual. El grupo de trabajo del Papps no recibe financiación alguna.
Conflicto de interesesLos autores del documento PAPPS de prevención de enfermedades infecciosas declaran no presentar conflicto de intereses en la elaboración de las nuevas recomendaciones.