La diabetes tipo 2 es una enfermedad caracterizada por una hiperglucemia crónica secundaria a un doble mecanismo patogénico: resistencia a la acción de la insulina asociada a un fallo progresivo en la secreción pancreática de insulina. La resistencia insulínica suele mantenerse a lo largo de la evolución de la enfermedad, pero puede mejorar con modificaciones en el estilo de vida (terapia nutricional y ejercicio), con la consecución de unas características antropométricas más favorables y con algunos fármacos. El fallo progresivo de la secreción de insulina pancreática aconseja adoptar una actitud precoz y activa, con un incremento progresivo de la dosis y el número de fármacos para mantener los objetivos de control.
Algunas sociedades científicas1–6 han elaborado consensos con recomendaciones sobre objetivos de control, escalonamiento de los distintos fármacos y adaptación de ambos a las características del paciente. Entre ellos, existen algunas concordancias y discrepancias, dada la dificultad que representa la ausencia de ensayos clínicos aleatorizados y con potencia suficiente que comparen directamente las distintas pautas terapéuticas recomendadas. Por ello, la Junta Directiva de la Sociedad Española de Diabetes (SED) decidió encargar a nuestro Grupo de Trabajo la elaboración de un documento que adaptara lo más posible las evidencias disponibles y las distintas recomendaciones a la situación en España, teniendo en cuenta que la decisión terapéutica definitiva dependerá en cada momento del médico, que deberá individualizar el tratamiento según las características del paciente en cuestión. El Grupo de Trabajo se ha planteado que el presente documento debe ser dinámico y que ha de actualizarse periódicamente, de acuerdo con las evidencias que vayan surgiendo y con las sugerencias de los miembros de la SED.
Objetivos de controlLa consecución de un buen control metabólico puede evitar o retrasar la aparición de las complicaciones micro y macrovasculares, tal como han demostrado diversos estudios con seguimiento a largo plazo, tanto en pacientes con diabetes tipo 1 (DCCT/EDIC)7 como con diabetes tipo 2 (United Kingdom Prospective Diabetes Study [UKPDS])8. No obstante, si el control estricto de la glucemia se realiza en pacientes con una diabetes muy evolucionada, con complicaciones avanzadas o con enfermedades asociadas graves, no sólo no se consigue una mayor prevención cardiovascular (Action in Diabetes and Vascular disease: preterAx DiamicroN MR Controlled Evaluation [ADVANCE]9 y Veterans Affairs Diabetes Trial [VADT]10), sino que la mortalidad puede aumentar (Action to Control Cardiovascular Risk in Diabetes [ACCORD])11. Por ello, se recomienda conseguir un control muy estricto en las primeras fases del tratamiento de la diabetes (hemoglobina glucosilada [HbA1c]<6,5%), siempre y cuando el paciente no sea mayor de 70 años, presente complicaciones avanzadas micro o macrovasculares en el momento del diagnóstico o presente alguna enfermedad asociada que haga aconsejable evitar las hipoglucemias. En este caso, se recomendaría un objetivo de control de HbA1c<7,5%, o el mejor posible primando la seguridad del tratamiento, adaptado a la situación del paciente y a la compatibilidad con los fármacos asociados. En general se admite que, después de unos 10 años de evolución, el tratamiento en monoterapia suele ser insuficiente y la mayoría de los pacientes requerirá tratamiento combinado, en muchos casos con insulina. En esta situación, puede ser recomendable incrementar el objetivo de control a una HbA1c < 7,5%, salvo que el objetivo clásico del 7% sea factible primando la seguridad.
No puede olvidarse que la hiperglucemia es un factor de riesgo cardiovascular más en el paciente con diabetes, y que existen otros factores de riesgo asociados, como dislipemia, hipertensión, obesidad o tabaquismo. Éstos van a condicionar, en gran parte, la posible aparición de complicaciones y la supervivencia del paciente. Por ello, aunque está fuera del ámbito de este documento, se recomienda explícitamente el control de estos factores de riesgo, ya que esta aproximación ha demostrado ser muy eficaz (STENO-2)12.
Inercia terapéuticaTras el inicio del tratamiento, o si se han llevado a cabo modificaciones terapéuticas, es necesario valorar una serie de aspectos, como el control metabólico, mediante la determinación de HbA1c y con perfiles de glucemia capilar (cuando estén indicados), la tolerancia a las modificaciones realizadas, y la evolución de las complicaciones y enfermedades asociadas.
Todo ello se hará con una periodicidad de aproximadamente 3 meses tras la fase aguda de ajuste del tratamiento, y al menos hasta la estabilización del cuadro. Después, cuando se hayan conseguido los objetivos, se revisará a todos los pacientes al menos dos veces al año. Si las modificaciones realizadas no han sido eficaces en el primer periodo de 3 meses en cuanto al objetivo de control, sin que hayan incidido enfermedades intercurrentes o uso de fármacos que lo justifiquen, es necesario intensificar el tratamiento y no retrasar la toma de decisiones. Es de gran importancia mantener el buen control metabólico, sobre todo en pacientes con un corto periodo de evolución, que pueden estar asintomáticos a pesar de no haber conseguido los objetivos de control. Las principales barreras para la intensificación del tratamiento pueden darse cuando el cambio terapéutico exija un proceso de educación diabetológica adicional; por ejemplo, con la introducción de secretagogos o insulina, situaciones que debemos tener previstas para evitar demoras innecesarias.
Si es importante prever las pautas de actuación médica, de enfermería y de seguimiento farmacoterapéutico por parte del farmacéutico para la intensificación de las dosis, no lo es menos programar las modificaciones del tratamiento necesarias ante procesos intercurrentes agudos que pueden provocar un cierto grado de deshidratación o dificultades en la ingesta (síndromes febriles, vómitos, diarreas, etc.). Estos procesos pueden hacer inseguro el tratamiento habitual del paciente y obligar a su modificación urgente13.
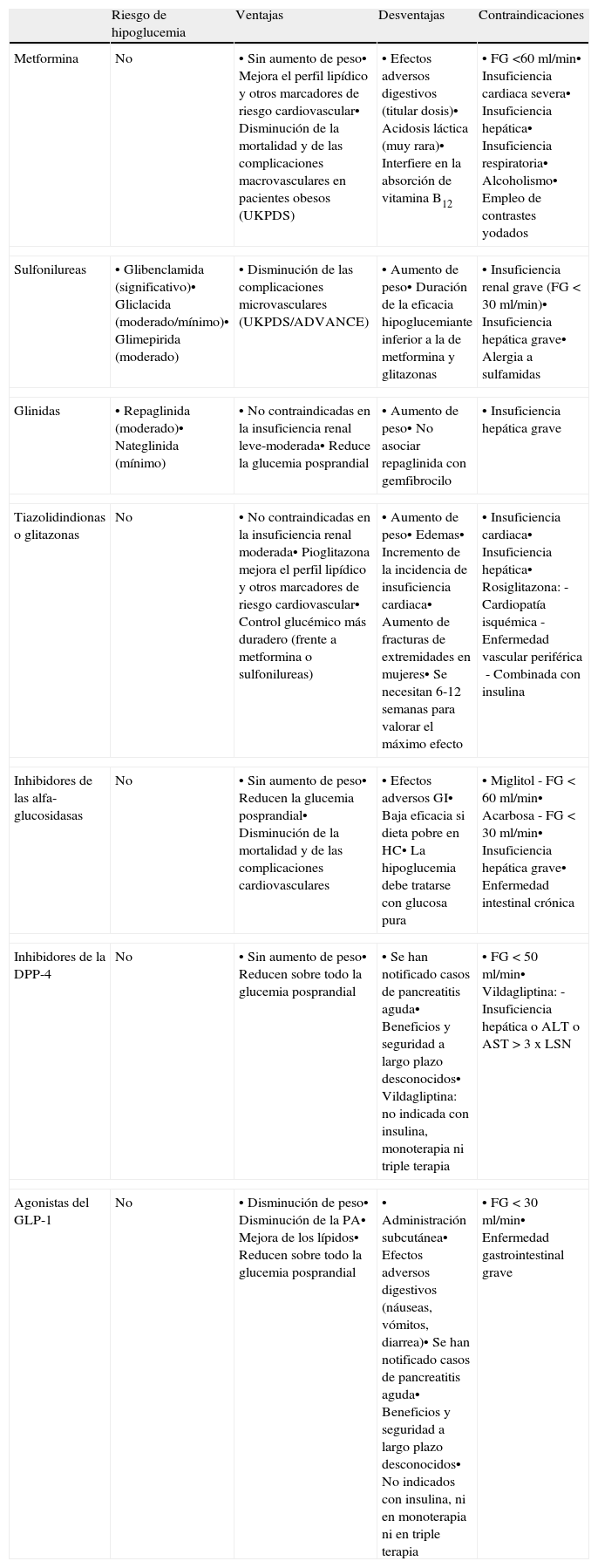
Escalonamiento terapéuticoEn la actualidad disponemos de una serie de fármacos para el tratamiento de la diabetes, como metformina, sulfonilureas, glinidas, tiazolidindionas, inhibidores de las disacaridasas, inhibidores de la dipeptidil-peptidasa 4 (DPP-4) y agonistas del receptor del péptido 1 semejante al glucagón (glucagon-like peptide-1 [GLP-1]), que junto con la insulina pueden utilizarse en monoterapia o en asociación. Estos fármacos deben usarse tras la consideración de sus respectivas fichas técnicas; algunas asociaciones han demostrado su seguridad, otras no están recomendadas, y en otras la seguridad a largo plazo no es conocida. La elección del tratamiento va a depender de la potencia para reducir la HbA1c, del riesgo de inducir hipoglucemias y del grado de control previo, de la influencia en el peso corporal y de la dislipemia, del impacto preferente sobre la glucemia basal o prandial, de las complicaciones o enfermedades asociadas que presente el paciente, del riesgo de efectos adversos relacionados con el fármaco, de la tolerancia y del coste (tabla 1).
Características principales de los antidiabéticos orales
| Riesgo de hipoglucemia | Ventajas | Desventajas | Contraindicaciones | |
| Metformina | No | • Sin aumento de peso• Mejora el perfil lipídico y otros marcadores de riesgo cardiovascular• Disminución de la mortalidad y de las complicaciones macrovasculares en pacientes obesos (UKPDS) | • Efectos adversos digestivos (titular dosis)• Acidosis láctica (muy rara)• Interfiere en la absorción de vitamina B12 | • FG <60 ml/min• Insuficiencia cardiaca severa• Insuficiencia hepática• Insuficiencia respiratoria• Alcoholismo• Empleo de contrastes yodados |
| Sulfonilureas | • Glibenclamida (significativo)• Gliclacida (moderado/mínimo)• Glimepirida (moderado) | • Disminución de las complicaciones microvasculares (UKPDS/ADVANCE) | • Aumento de peso• Duración de la eficacia hipoglucemiante inferior a la de metformina y glitazonas | • Insuficiencia renal grave (FG<30 ml/min)• Insuficiencia hepática grave• Alergia a sulfamidas |
| Glinidas | • Repaglinida (moderado)• Nateglinida (mínimo) | • No contraindicadas en la insuficiencia renal leve-moderada• Reduce la glucemia posprandial | • Aumento de peso• No asociar repaglinida con gemfibrocilo | • Insuficiencia hepática grave |
| Tiazolidindionas o glitazonas | No | • No contraindicadas en la insuficiencia renal moderada• Pioglitazona mejora el perfil lipídico y otros marcadores de riesgo cardiovascular• Control glucémico más duradero (frente a metformina o sulfonilureas) | • Aumento de peso• Edemas• Incremento de la incidencia de insuficiencia cardiaca• Aumento de fracturas de extremidades en mujeres• Se necesitan 6-12 semanas para valorar el máximo efecto | • Insuficiencia cardiaca• Insuficiencia hepática• Rosiglitazona:- Cardiopatía isquémica- Enfermedad vascular periférica- Combinada con insulina |
| Inhibidores de las alfa-glucosidasas | No | • Sin aumento de peso• Reducen la glucemia posprandial• Disminución de la mortalidad y de las complicaciones cardiovasculares | • Efectos adversos GI• Baja eficacia si dieta pobre en HC• La hipoglucemia debe tratarse con glucosa pura | • Miglitol- FG<60 ml/min• Acarbosa- FG<30 ml/min• Insuficiencia hepática grave• Enfermedad intestinal crónica |
| Inhibidores de la DPP-4 | No | • Sin aumento de peso• Reducen sobre todo la glucemia posprandial | • Se han notificado casos de pancreatitis aguda• Beneficios y seguridad a largo plazo desconocidos• Vildagliptina: no indicada con insulina, monoterapia ni triple terapia | • FG<50 ml/min• Vildagliptina:- Insuficiencia hepática o ALT o AST > 3 x LSN |
| Agonistas del GLP-1 | No | • Disminución de peso• Disminución de la PA• Mejora de los lípidos• Reducen sobre todo la glucemia posprandial | • Administración subcutánea• Efectos adversos digestivos (náuseas, vómitos, diarrea)• Se han notificado casos de pancreatitis aguda• Beneficios y seguridad a largo plazo desconocidos• No indicados con insulina, ni en monoterapia ni en triple terapia | • FG<30 ml/min• Enfermedad gastrointestinal grave |
FG: filtrado glomerular; GI: gastrointestinales; HC: hidratos de carbono.
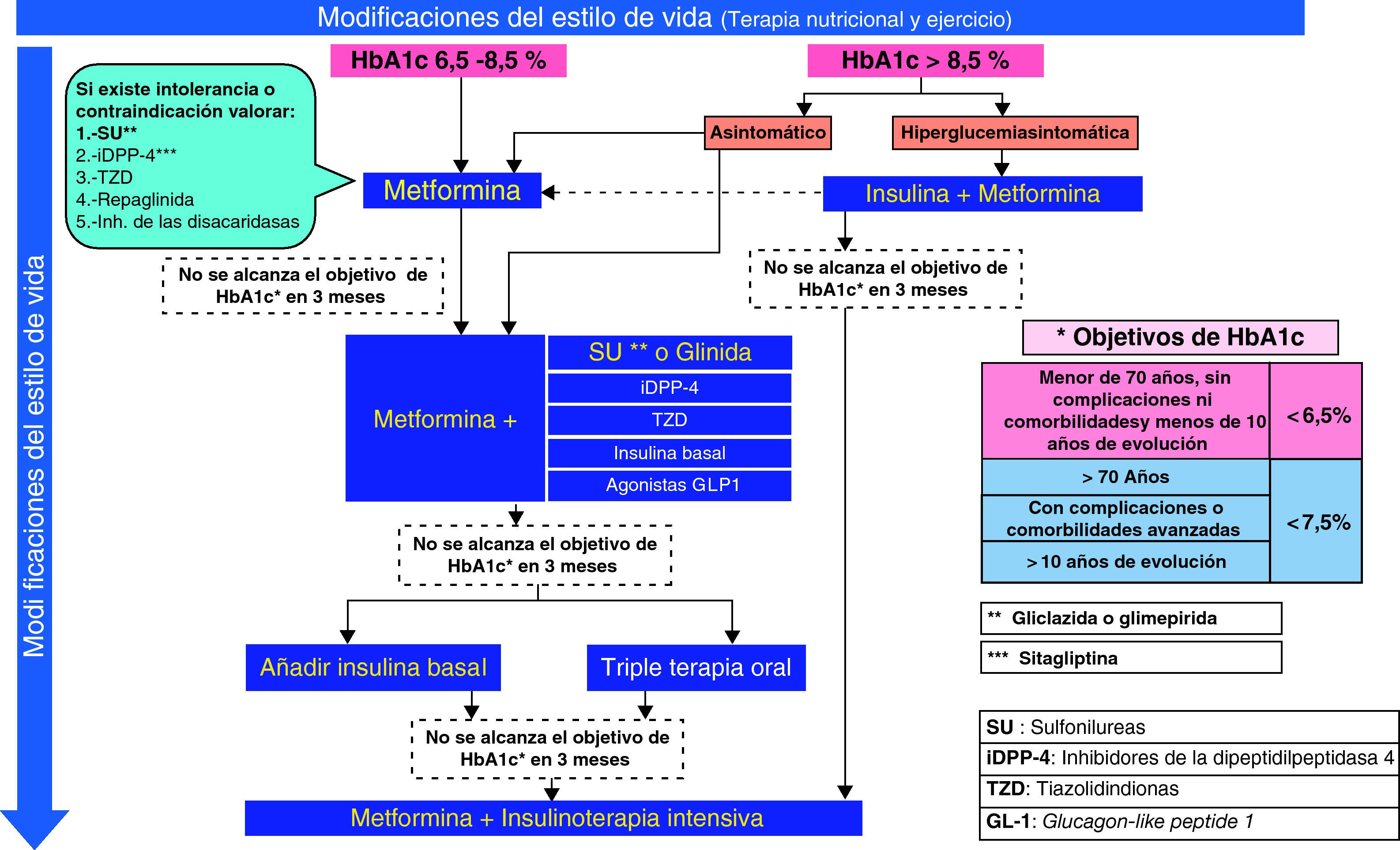
El tratamiento farmacológico inicial variará en función del grado de control previo, la edad, la presencia de enfermedades asociadas y el uso concomitante de otros fármacos. Como se ve en el algoritmo (fig. 1), se iniciará habitualmente con un fármaco, planteando en un segundo escalón el tratamiento con 2 fármacos. Finalmente, puede ser necesaria la insulinización o la triple terapia si el grado de control del paciente lo hace recomendable.
Primer escalónPacientes con HbA1c del 6,5 al 8,5%En algunos casos, el objetivo de control (HbA1c < 6,5%) puede conseguirse con algunas modificaciones del estilo de vida14, aunque este planteamiento no siempre es eficaz, ya que depende de las características del paciente y de su grado de adherencia a las recomendaciones. Por este motivo, la SED aconseja desde el inicio asociar metformina de forma concomitante en la mayoría de los pacientes15,16. En todo caso, no es recomendable demorar más de 3 meses la introducción de metformina si no se ha conseguido el objetivo de control. Para mejorar la tolerancia a este fármaco, se aconseja una titulación progresiva de las dosis17; por ejemplo, con medio comprimido de 850–1.000mg inicialmente, aumentando a medio comprimido cada 12h a los 4-5 días si existe una buena tolerancia, y así progresivamente hasta llegar a una dosis de 850 a 1.000mg cada 12h. Si se observa intolerancia, debe reducirse de nuevo a la dosis previa tolerada y reintentar el incremento con un lapso de tiempo mayor.
Como alternativas al tratamiento con metformina, en caso de contraindicación o intolerancia, se proponen las siguientes:
- •
Primera alternativa: sulfonilureas. Con un objetivo de control de HbA1c<6,5%, como secretagogos potentes inducen un riesgo importante de hipoglucemia, aunque este riesgo es distinto según el principio activo que se utilice18–20. Por ello, se recomienda plantear una titulación muy cuidadosa de la dosis y utilizar preferentemente gliclazida de liberación prolongada o glimepirida, desaconsejándose la utilización de glibenclamida o clorpropamida. Algunos estudios indican que las sulfonilureas inducen el fallo secundario de la célula beta antes que la metformina o que las glitazonas21. Se asocian también a un incremento de 1-3kg de peso22,23. Algunas guías no las recomiendan en este escalón terapéutico.
- •
Segunda alternativa: inhibidores de la DPP-4 (dipeptidilpeptidasa 4). Presentan claras ventajas para su utilización en este escalón terapéutico como alternativa a la metformina si ésta no se tolera. Comportan un mínimo riesgo de hipoglucemia en monoterapia y no tienen impacto en el peso del paciente24,25. Hoy por hoy, las principales limitaciones para su uso se basan en la ausencia de estudios que demuestren su eficacia y seguridad a largo plazo, así como en su elevado precio. Hasta la fecha, sólo se ha aprobado para esta indicación la sitagliptina26, aunque otros principios activos de la misma familia están pendientes de autorización27,28.
- •
Tercera alternativa: glinidas. La opción en este escalón es la repaglinida29. La nateglinida, por sus características farmacodinámicas y potencia, debe utilizarse en combinación30. En principio presenta las mismas limitaciones que las sulfonilureas, si bien, por sus características y forma de administración, puede ser superior en pacientes con irregularidades en la dieta y en la actividad física31,32.
- •
Cuarta alternativa: tiazolidindionas o glitazonas. Requieren entre 10 y 12 semanas para conseguir su máxima eficacia, con una potencia, en cuanto a la reducción de la HbA1c, similar a la de metformina y las sulfonilureas. Entre los posibles efectos secundarios destacan el aumento de peso, la aparición de edemas, anemia, fracturas e insuficiencia cardiaca en algunos grupos de pacientes33–35, lo que ha limitado sus indicaciones. Tampoco está definitivamente aclarado si existen o no diferencias entre rosiglitazona y pioglitazona, como se ha sugerido en algunos estudios observacionales36, por lo que la cuestión permanece abierta hasta la conclusión de estudios que comparen ambas moléculas directamente. Pueden tener un papel más relevante en pacientes con síndrome metabólico severo37 y/o con esteatosis hepática no alcohólica38.
- •
Quinta alternativa: inhibidores de las disacaridasas. Poseen menos potencia que los citados hasta ahora y, en monoterapia, no se asocian a hipoglucemias. Su mayor limitación es la intolerancia intestinal, que obliga a suspender el tratamiento en un porcentaje elevado de pacientes39. Su mayor beneficio es que parecen mejorar significativamente el riesgo cardiovascular (STOP-NIDDM)40. Se han comercializado 2 preparados: acarbosa y miglitol.
- •
Sexta alternativa: insulina basal. Reservada en este escalón para los pacientes que presenten contraindicaciones para la utilización de fármacos orales.
En pacientes con clínica importante de hiperglucemia (clínica cardinal y/o pérdida de peso) en el momento de manifestarse la enfermedad, suele ser necesario comenzar el tratamiento con insulina41–43, sola o asociada con metformina. Tras el control inicial y la mejora de la gluco y lipotoxicidad, es probable que desciendan progresivamente las necesidades de insulina, y que en algunos casos pueda mantenerse el control con fármacos orales, bien en monoterapia o en combinación.
En pacientes asintomáticos es recomendable comenzar con metformina, con una titulación más rápida y, según la respuesta, asociar un segundo fármaco44, controlando la evolución a corto plazo para ajustar el tratamiento definitivo.
Segundo escalónEn aquellos pacientes en los que no se han conseguido los objetivos de control o que, tras un periodo de buen control, presentan un deterioro por la evolución de su diabetes (sin que se haya asociado otra enfermedad o fármaco que incremente la glucemia), es necesario añadir un segundo fármaco.
En la mayoría de las asociaciones de fármacos faltan estudios comparativos a largo plazo, lo que dificulta la toma de decisiones. En principio, se recomienda que los fármacos asociados tengan un mecanismo de acción diferente y complementario. Según la respuesta, debe incrementarse la dosis hasta la máxima efectiva, algo inferior a la dosis máxima permitida. También debe tenerse presente que las contraindicaciones, las limitaciones de uso y los posibles efectos secundarios son los mismos que los de ambos fármacos por separado.
Combinaciones con metformina- •
Sulfonilureas y glinidas. La asociación metformina-sulfonilureas es la combinación más estudiada y ha demostrado su eficacia y seguridad42–45, aunque todavía persiste la duda sobre el incremento de la mortalidad en algún subgrupo, apreciado en el UKPDS46, de aquellos pacientes que iniciaban el tratamiento con sulfonilureas y en los que se asociaba en un segundo escalón metformina. Existen diversos estudios observacionales que se plantearon esta cuestión47–51, con algunas discrepancias en sus resultados; resultados que, por otro lado, posiblemente no sean superponibles con los obtenidos con los preparados más recientes. Los riesgos para el objetivo de control (HbA1c<6,5%) son similares a los observados en monoterapia, por lo que se mantienen las mismas recomendaciones. Las glinidas constituyen una buena alternativa a las sulfonilureas en pacientes con ingestas más irregulares por su corto periodo de acción, así como en pacientes alérgicos a sulfamidas o, en el caso de la repaglinida, en pacientes que presenten insuficiencia renal moderada52. En cuanto al riesgo de hipoglucemia e incremento de peso, pueden considerarse superponibles, con una potencia inferior a la de nateglinida53 y bastante similar a la de repaglinida54.
- •
Inhibidores de la DPP-4. Junto con los agonistas del receptor de GLP-1, forman un grupo novedoso de secretagogos que actúan tanto sobre la secreción de insulina como sobre la de glucagón. Presentan ventajas evidentes frente a las sulfonilureas y glinidas: el bajo riesgo de hipoglucemias y su neutralidad en el peso55,56. Aun así, se desconoce su seguridad a largo plazo y su influencia en la evolución de la diabetes y sus complicaciones. Su potencia no parece ser inferior a la de las sulfonilureas en cuanto a la reducción de la HbA1c57,58. Podrían ser la opción preferente en aquellos pacientes en los que la hipoglucemia sea inasumible.
- •
Agonistas del receptor de GLP-1. Son preparados de administración parenteral que consiguen un efecto sobre los receptores de GLP-1 más intenso y prolongado que el logrado por los inhibidores de la DPP-4. En los estudios publicados, a corto plazo, se ha demostrado que mejoran el control glucémico, sobre todo la glucemia posprandial, y en parte también la glucemia basal59. Enlentecen el vaciamiento gástrico, creando sensación de saciedad, con lo que se consigue una reducción de peso sostenida en un apreciable porcentaje de pacientes60,61. Además, consiguen mejorar algunos de los factores de riesgo vascular62. En nuestro país se ha comercializado exenatida para administración parenteral dos veces al día (antes de las principales comidas, con un intervalo de tiempo entre ambas de, al menos, 6h), asociada a metformina y/o sulfonilureas y a metformina con glitazonas63, en pacientes con un índice de masa corporal superior a 30kg/m2. En el momento de redactar esta guía, está pendiente de comercialización la liraglutida64, por lo que recomendamos estudiar su ficha técnica para valorar sus indicaciones y limitaciones de uso. Pueden ser un grupo de fármacos muy útiles en pacientes en los que la obesidad suponga un problema esencial, pero queda por definir su papel frente a otros fármacos o frente a otras aproximaciones del tratamiento, como la cirugía.
- •
Tiazolidindionas. Actúan incrementan-do la sensibilidad a la insulina por un mecanismo diferente a la metformina, por lo que se utilizan frecuentemente en asociación65–68. En principio, la indicación se centraría en pacientes con un buen control prandial de la glucemia y elevación de la glucemia basal, que no se corrige totalmente con la metformina. Los efectos secundarios son similares a los de cada fármaco por separado, por lo que se mantienen las mismas limitaciones que en monoterapia.
- •
Insulina basal. La asociación de insulina basal a la metformina es una buena opción terapéutica, con seguridad y eficacia probadas69–71. Está indicada preferentemente en aquellos pacientes con un buen control prandial, pero con una HbA1c por encima del objetivo. Aunque con esta pauta se incrementa el número de hipoglucemias, éstas son todavía muy inferiores a las observadas en pacientes con multidosis de insulina. Es una buena alternativa para los pacientes con limitaciones para el tratamiento con glitazonas.
- •
Inhibidores de las disacaridasas. Su asociación con metformina es segura, ya que no se van a producir hipoglucemias, pero su eficacia es muy limitada, con descensos de la HbA1c que difícilmente superan el 0,5%72. Su limitación principal es la intolerancia digestiva. Por todo ello, no se recomienda como alternativa a un segundo fármaco en este escalón terapéutico.
En pacientes tratados con 2 fármacos, con mal control metabólico, el siguiente paso terapéutico es la insulinización. Exceptuando los casos de resistencia a la insulinización, no existen «ventajas» para retrasar la introducción de la insulina en el régimen terapéutico tras el fracaso de una terapia combinada doble. El beneficio a largo plazo y la seguridad de una triple terapia oral frente a la insulinización son inciertos, ya que el seguimiento en los diferentes ensayos clínicos no llega más allá de los 12 meses.
Combinaciones sin insulinaDentro de las distintas y válidas asociaciones de agentes orales, la asociación de metformina, sulfonilurea y glitazona es la más estudiada y la más utilizada en la práctica asistencial. Sería, por tanto, la recomendada en la mayoría de los casos de pacientes con diabetes tipo 2 y mal control con terapia dual73–77. En los pacientes ancianos78, la asociación de metformina, repaglinida y glitazona puede ser más segura. En aquellos pacientes con limitaciones para el uso de las glitazonas, las alternativas más razonables serían metformina más sulfonilureas más DPP-479 o metformina más repaglinida más DPP-480, con el inconveniente de que están menos estudiadas.
Combinaciones con insulinaLa mayoría de los pacientes habrán recibido tratamiento con combinaciones de metformina con secretagogos. En este caso se procederá a la asociación de una insulina basal. Si el tiempo de evolución es superior a los 10 años, y/o han aparecido complicaciones o enfermedades intercurrentes, se revisará el objetivo de control a menos del 7,5% o el mejor posible, con seguridad para el paciente. Esta pauta puede conseguir un periodo de buen control, pero no excesivamente prolongado, a juzgar por los resultados del estudio 4T (Treating-To-Target in Type 2 diabetes)81, por lo que la mayoría de los pacientes en un periodo de alrededor de 3 años van a requerir una pauta intensificada de insulina. En este caso, se recomienda mantener el tratamiento con metformina asociado a la insulina, y suspender el resto del tratamiento antidiabético oral.
Cuarto escalónEn cuanto a la posibilidad de una cuádruple terapia, cuyo abordaje (debido a los diferentes caminos fisiopatológicos desde el punto de vista farmacológico) es factible, consideramos que en el momento actual esta posibilidad entra más en el campo de la investigación que en el de la práctica clínica.
ConclusionesUna vez instaurados los cambios en el estilo de vida, el objetivo del tratamiento farmacológico de la diabetes tipo 2 será conseguir un control metabólico optimizado con la máxima seguridad posible, debiéndose plantear como objetivo una HbA1c<6,5% en las primeras fases de la enfermedad y < 7,5% en fases más avanzadas o con riesgo de hipoglucemias.
El tratamiento se divide en 3 escalones terapéuticos. En el primero, y si la hiperglucemia no es excesiva (HbA1c: 6,5-8,5%), la metformina es el fármaco de elección. Sólo en casos de intolerancia o contraindicación se usarán otros fármacos alternativos. Si la hiperglucemia es elevada (HbA1c>8,5%), el tratamiento inicial debe realizarse de entrada con varios fármacos orales en combinación o bien iniciar la insulinización. El segundo escalón consiste en la adición de un segundo fármaco de acción sinérgica. Para ello se dispone de diversas opciones, que deben individualizarse en función de las características de cada paciente. Finalmente, el tercer escalón implica la introducción de insulina basal como opción preferente frente a la triple terapia oral, que se reservará sólo para los casos de resistencia a la insulinización.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Estudio promovido por la Sociedad Española de Diabetes (SED) en colaboración con:
Sociedad Española de Arteriosclerosis (SEA).
Sociedad Española de Cardiología (SEC).
Sociedad Española de Endocrinología y Nutrición (SEEN).
Sociedad Española de Farmacia Comunitaria (SEFAC).
Sociedad Española de Medicina Familiar y Comunitaria (SEMFYC).
Sociedad Española de Medicina Interna (SEMI).
Sociedad Española de Médicos de Atención Primaria (SEMERGEN).
Sociedad Española de Médicos Generales y de Familia (SEMG).
Sociedad Española de Nefrología (SEN).
Componentes del Grupo de Trabajo de Consensos y Guías Clínicas de la Sociedad Española de Diabetes:
Jose Juan Alemán Sánchez, Ramiro Antuña de Aláiz, Francisco Javier Escalada San Martín, Fernando Escobar Jiménez, Juan Carlos Ferrer García, José Antonio Fornos Pérez, Ricardo García Mayor, Sonia Gaztambide Sáenz, María Luisa López Fernández, José Luis Martín Manzano, Javier Martínez Martín, Juan Carlos Méndez Segovia, Jorge Navarro Pérez, Eduard Montanya Mías, Carlos Ortega Millán, Itxaso Rica Etxebarría y Teresa Tartón García.
Adenda al Documento de Consenso «Recomendaciones para el tratamiento farmacológico de la hiperglucemia en la diabetes tipo 2»
Con fecha 23 de septiembre de 2010 la EMA ha decidido suspender la comercialización de todas las especialidades que contienen rosiglitazona como principio activo (Avandia®, Avandamet® y Avaglim®), dado que considera que los beneficios del fármaco no superan los posibles riesgos. En este contexto, la FDA ha decidido mantener su comercialización, pero ha propuesto una serie de medidas de farmacovigilancia. Este último organismo considera que los datos sobre un posible incremento de riesgo cardiovascular asociado a rosiglitazona son controvertidos y no definitivos. Se ha solicitado una verificación independiente de los resultados del estudio RECORD.
Ver Anexo al final del artículo.
De acuerdo con los autores y los editores, este artículo se publica de forma íntegra en las siguientes publicaciones: Avances en Diabetología (Av Diabetol. 2010;26:331-8), Endocrinología y Nutrición (Endocrinol Nutr. 2011. doi: 10.1016/j.endonu.2010.07.005), Semergen (Semergen. 2011.doi:10.1016/j.semerg.2010.11.002) y Clínica e Investigación en Arteriosclerosis (Clin Invest Arterioscl. 2011. doi: 10.1016/j.arteri.2011.01.007) y Revista Clínica Española (Rev Clin Esp. 2011. 10.1016/j.rce.2010.11.006).