Comprobar si las tablas de riesgo cardiovascular (RCV) habitualmente empleadas son capaces de identificar el incremento de riesgo producido por la terapia de bloqueo androgénico (BA) en los pacientes con cáncer de próstata (CP).
DiseñoEstudio de cohortes retrospectivo.
EmplazamientoCentros de salud urbanos y rurales de la provincia de Ourense.
ParticipantesPacientes diagnosticados de CP que tenían prescrito tratamiento de BA entre los años 2007 y 2008.
Mediciones principalesSe registró edad, residencia (rural/urbana), estadificación (Gleason), procedimiento diagnóstico y, al comienzo y fin del seguimiento, perfil lipídico, presión arterial, diagnóstico de diabetes mellitus, tabaquismo, uso de fármacos hipotensores e hipolipemiantes, e índices Framingham calibrado y ATP III. Se registraron los eventos cardiovasculares (ECV) a lo largo del seguimiento. Cada paciente fue su propio control. Para calcular los índices al final del período no se consideró el incremento de edad. Los índices se compararon utilizando la t de Student para muestras apareadas (SPSS 15.0).
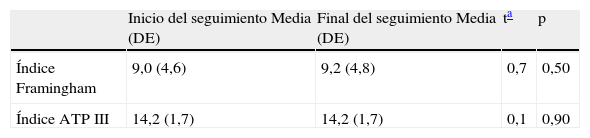
ResultadosSe incluyeron 209 casos. La media (DE) de edad fue de 73,8 (8,0) años, con un 64,6% de casos urbanos. Los índices al inicio y a los 12 meses de seguimiento fueron: Framingham 9,0 (4,6) y 9,2 (4,8) (p=0,5); ATP III 14,2 (1,7) y 14,2 (1,7) (p=0,9).
ConclusiónLas tablas de RCV no permiten valorar adecuadamente el incremento del riesgo asociado a la terapia de bloqueo androgénico en cáncer de próstata.
To assess if cardiovascular risk (CVR) charts are able to identify the increased risk caused by androgen deprivation therapy (ADT) in patients with prostate cancer (PCa).
DesignRetrospective cohort study.
LocationUrban and rural health centres in the province of Ourense.
ParticipantsPatients diagnosed with PCa who had been prescribed treatment for ADT between 2007 and 2008.
Main measuresAge, residence (rural/urban), staging (Gleason), diagnostic procedure and, at the beginning and end of follow-up, lipid profile, blood pressure, diagnosis of diabetes mellitus, smoking, use of antihypertensive and lipid-lowering drugs, and Framingham calibrated and ATP III indexes, were determined. Cardiovascular events were recorded during the follow-up. Each patient was his own control. Increasing age was not used in the calculation of the scores at the end of the follow up period. The scores were compared using the t-test for paired samples (SPSS 15.0).
ResultsA total of 209 cases were included. The mean (SD) age was 73.8 (8.0) years, with 64.6% of urban cases. The scores at baseline and at 12 months of follow-up were: Framingham 9.0 (4.6) and 9.2 (4.8) (P=0.5), ATP III 14.2 (1.7) and 14.2 (1.7) (P=0.9).
ConclusionCVR charts do not assess the increased risk associated with androgen deprivation therapy in prostate cancer.
El cáncer de próstata (CP) es el tumor maligno más frecuente en los varones españoles (17% en 2002)1. En las últimas décadas, la incidencia en edades más tempranas ha aumentado debido a un diagnóstico más precoz2.
El estudio Eurocare 43, muestra los datos de supervivencia en distintos países europeos de pacientes que fueron diagnosticados de CP entre los años 1995-1999 y seguidos hasta el final de 2003. La media española es de 74,7%, cifra similar a la media (73,9%) obtenida para los 23 países europeos que fueron incluidos en el estudio. El aumento en la supervivencia observado parece deberse, además de a un diagnóstico más temprano, a un avance en cuanto a los tratamientos utilizados4,5.
Actualmente, la terapia de bloqueo androgénico (BA) con agonistas de la hormona liberadora de LH y/o bloqueadores de los receptores androgénicos es, junto a la cirugía, el tratamiento más común en CP avanzado6, habiendo aumentado su uso en todos los estadios del tumor como primera opción7.
Los niveles bajos de testosterona, consecuencia del BA, se comportan como un factor de riesgo independiente para la diabetes y el síndrome metabólico8, y algunos estudios han demostrado que se asocian a un riesgo aumentado de enfermedad cardiovascular. Una reciente revisión9 concluyó que el riesgo de mortalidad cardiovascular se incrementaba un 17% en los pacientes tratados con BA. Todo ello ha conducido a que diversas sociedades científicas elaboren recomendaciones sobre la necesidad de valorar el incremento del riesgo que se produce en estas circunstancias10.
Uno de los principios básicos de la prevención en el campo de las enfermedades cardiovasculares es discernir qué pacientes tienen más riesgo y qué factores de riesgo cardiovascular (RCV) tienen más relevancia, para actuar sobre ellos y poder prevenir la aparición de eventos cardiovasculares (ECV)11. Las guías europeas recomiendan la utilización de tablas de riesgo que estratifiquen a los pacientes, aconsejando el uso de tablas calibradas para cada país12. Algunas de ellas, basadas en el estudio de Framinghan, como la tabla de Riesgo Coronario ATP III13 y la tabla de Framinghan de riesgo coronario calibrada para la población española14, evalúan el riesgo coronario.
Desde esta perspectiva, el médico de familia debe decidir sobre la adecuación de utilizar alguno de estos instrumentos para valorar el RCV de un paciente concreto. Obviamente, esto requiere que la capacidad predictiva de dichos instrumentos haya sido demostrada en las circunstancias específicas en las que se van a usar.
En este contexto, el objetivo del presente estudio es estimar si existen cambios en el valor del RCV medido mediante las diferentes tablas de riesgo en pacientes diagnosticados de CP después de un año de tratamiento con BA.
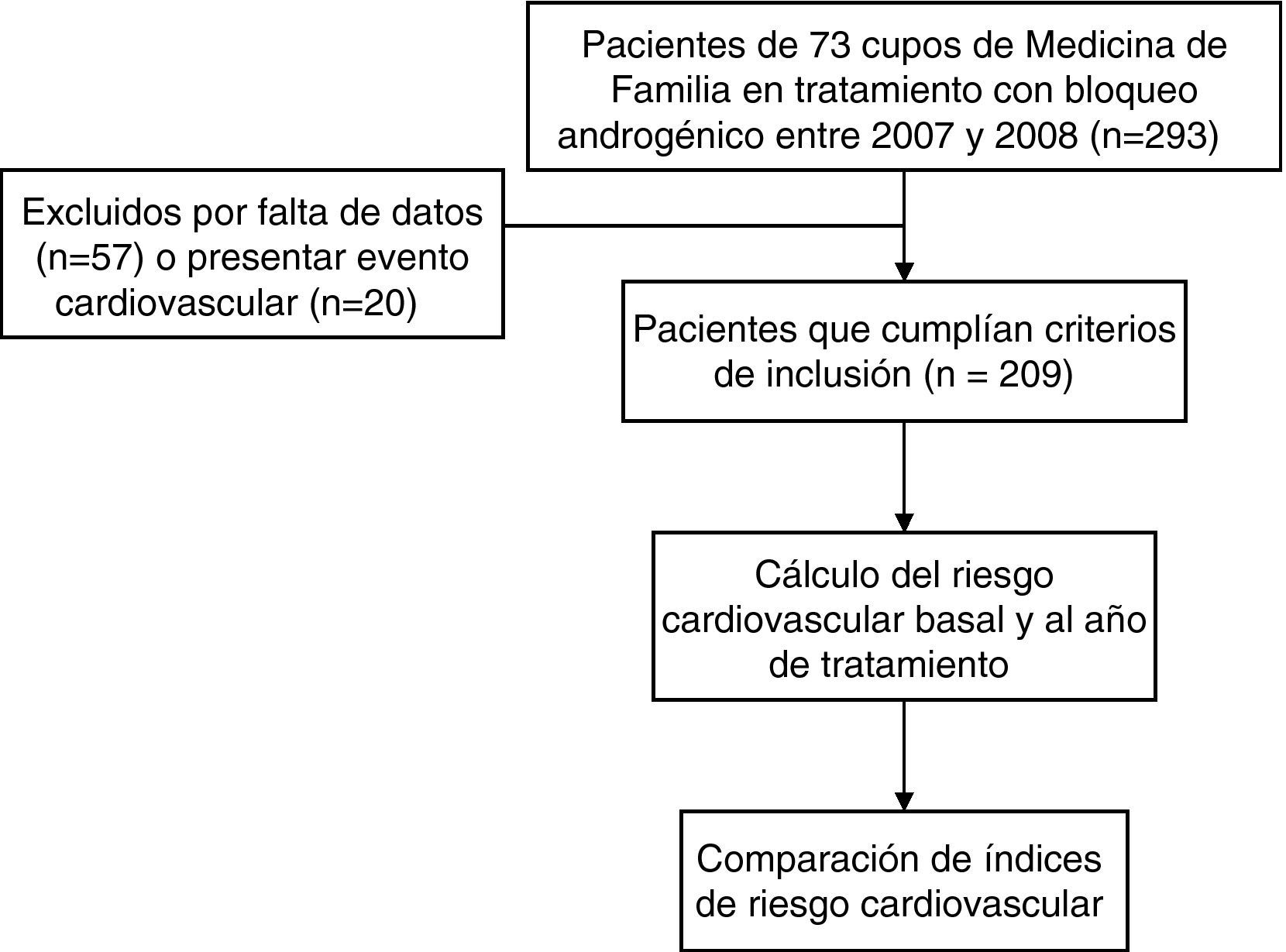
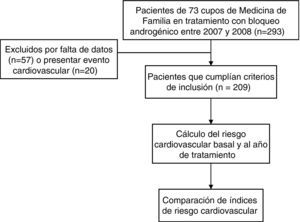
Material y métodosSe realizó un estudio de cohortes retrospectivo. Fueron incluidos todos los pacientes pertenecientes a 73 cupos de medicina de familia seleccionados mediante muestreo de conveniencia (criterio de accesibilidad) y que cumplían los criterios de inclusión. Para identificarlos se utilizó el listado de pacientes crónicos de los diferentes cupos y el listado de pacientes a los que se les prescribió BA en los años 2007 y 2008, proporcionado por la Subdirección Xeral de Farmacia e Produtos Sanitarios del Servizo Galego de Saúde (Sergas).
Los criterios de inclusión fueron: diagnóstico establecido de CP; llevar al menos un año en tratamiento con BA (análogos de la LH-RH y/o antiandrógenos); poseer historia clínica de atención primaria (HCAP); existencia de los datos necesarios para realizar el cálculo del RCV en el momento de la inclusión y un año antes (en este caso con un margen de±1 mes) y disponer del consentimiento informado firmado por el paciente o persona responsable. Se excluyeron los pacientes con antecedentes de ECV para el cálculo de los índices de RCV tanto al principio como al final del seguimiento.
El tamaño muestral se determinó para la comparación de dos medias con un diseño de medidas repetidas. Se realizó una prueba piloto con 20 casos, donde se determinó que la desviación estándar del RCV con el índice de Framingham era de 3,9 al inicio del seguimiento y de 4,2 al final del mismo. Se calculó un coeficiente de correlación de 0,36 entre ambas medidas. Se estableció que la diferencia mínima del índice de Framingham entre los dos grupos que se consideraba de relevancia clínica era de 2 puntos. Con estas asunciones, un valor alfa de 0,05 y una potencia estadística del 90%, el programa EPIDAT versión 3.1 (Xunta de Galicia/OPS-OMS) determinó un tamaño muestral de 56 pares.
Se calcularon los índices de RCV en el momento de la inclusión en el estudio y 12 meses antes. Se consideró que el paciente tenía la misma edad al final del seguimiento que al inicio, con el fin de eliminar el efecto de la edad. Dada la media de edad de los pacientes incluidos no se consideró el uso de la tabla de riesgo SCORE. Para los cálculos se utilizaron las aplicaciones disponibles en www.regicor.org (Framinghan calibrado) y www.bd-access.com.ar/cardiocalc.htm (NCEP-ATP III).
Con la finalidad de valorar la posible modificación del RCV producida por el uso de algunos fármacos se determinó también el uso de estatinas e hipotensores al inicio y final del período de seguimiento.
El análisis de los datos se realizó con el programa SPSS v15.0 (SPSS Inc.). Las variables categóricas se representaron mediante estimación de proporciones con su intervalo de confianza del 95% (IC95). Las variables cuantitativas se representaron mediante media y desviación estándar (DE), con el correspondiente IC95. La comparación de medias para medidas relacionadas se realizó mediante la «t» de Student para muestras apareadas.
Para valorar la asociación entre las diferentes variables registradas y la presencia de ECV al final del seguimiento se utilizó una regresión logística, incluyendo como variables independientes la edad, el índice de Framingham al inicio, el uso de estatinas e hipotensores, el medio de procedencia, y la presencia de diabetes mellitus y tabaquismo, y aplicando el método de selección hacia atrás por pasos (Backward stepwise). Se comprobó el ajuste del modelo mediante la prueba de Hosmer–Lemeshow. Los resultados se expresan en forma de Odds ratio con su correspondiente IC95. El grado de significación estadística que se consideró fue un valor de p≤0,05.
ResultadosSe seleccionaron 384 pacientes diagnosticados de CP, de los que 293 se encontraban en tratamiento con BA. Se obtuvieron 209 HCAP en las que fue posible determinar los índices de RCV. Los pacientes tenían una media de edad de 73,8 (DE: 8,0) años (IC95: 72,7–74,9), con rango entre 50 y 92 años. 74 individuos (35,4%) procedían del medio rural. No se registraron fallecimientos en el período considerado.
La mayoría de los pacientes (n=182; 87,1%) recibían análogos de la LHRH (leuprolide, triptorelina, goserelina) en combinación con antiandrógenos (habitualmente bicalutamida). Veintiún (10%) pacientes recibían sólo análogos de la LHRA y 6 (2,9%) sólo antiandrógenos.
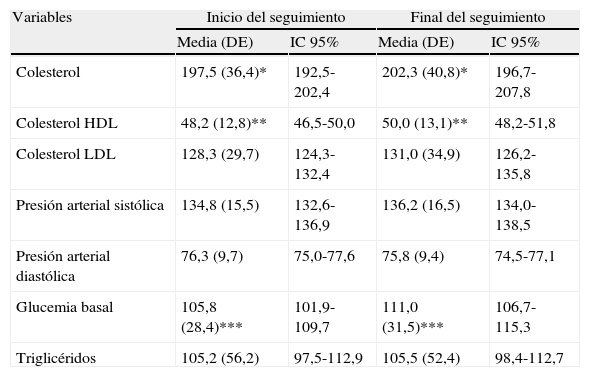
La tabla 1 muestra los valores obtenidos en los diversos parámetros que fueron utilizados para el cálculo de los índices de RCV.
Variables utilizadas en el cálculo del riesgo cardiovascular
| Variables | Inicio del seguimiento | Final del seguimiento | ||
| Media (DE) | IC 95% | Media (DE) | IC 95% | |
| Colesterol | 197,5 (36,4)* | 192,5-202,4 | 202,3 (40,8)* | 196,7-207,8 |
| Colesterol HDL | 48,2 (12,8)** | 46,5-50,0 | 50,0 (13,1)** | 48,2-51,8 |
| Colesterol LDL | 128,3 (29,7) | 124,3-132,4 | 131,0 (34,9) | 126,2-135,8 |
| Presión arterial sistólica | 134,8 (15,5) | 132,6-136,9 | 136,2 (16,5) | 134,0-138,5 |
| Presión arterial diastólica | 76,3 (9,7) | 75,0-77,6 | 75,8 (9,4) | 74,5-77,1 |
| Glucemia basal | 105,8 (28,4)*** | 101,9-109,7 | 111,0 (31,5)*** | 106,7-115,3 |
| Triglicéridos | 105,2 (56,2) | 97,5-112,9 | 105,5 (52,4) | 98,4-112,7 |
*p=0,05; **p=0,05; ***p=0,01.
Fue posible conocer la estadificación inicial del proceso en 125 casos, oscilando los valores del índice Gleason entre 3 y 10, con una media de 6,3 (DE: 1,6).
Los pacientes procedentes del medio rural eran significativamente más viejos que los procedentes del medio urbano, con una diferencia de edad de 4,0 años (IC95: 1,8–6,2; p<0,001). No se constataron diferencias en el riesgo en función del índice Gleason. Con la excepción de la presión arterial diastólica, todos los parámetros utilizados en el cálculo de los índices experimentaron un incremento a lo largo de los 12 meses de seguimiento, encontrándose diferencias significativas en colesterol total y HDL y glucemia basal (tabla 1). No se observaron diferencias significativas entre los valores de los diferentes índices de riesgo al inicio y al final del período de seguimiento (tabla 2).
Resultado de la prueba t de comparación de medias para muestras relacionadas
| Inicio del seguimiento Media (DE) | Final del seguimiento Media (DE) | ta | p | |
| Índice Framingham | 9,0 (4,6) | 9,2 (4,8) | 0,7 | 0,50 |
| Índice ATP III | 14,2 (1,7) | 14,2 (1,7) | 0,1 | 0,90 |
El análisis de regresión logística se realizó con 229 pacientes y mostró una asociación negativa con el uso de estatinas (tabla 3).
DiscusiónDe entre todos los estudios publicados sobre el incremento del RCV producido por el tratamiento del cáncer de próstata con BA, éste es el primero, hasta donde sabemos, en estimar ese riesgo con las tablas indicadas por las distintas sociedades científicas.
La mayoría de esos estudios sugieren relación entre el bajo nivel de testosterona en sangre (consecuencia del BA) y la aparición de diversas complicaciones cardiovasculares (aumento de la morbimortalidad cardiovascular, síndrome metabólico y diabetes mellitus)15–20. Nuestro estudio, por el contrario, no ha observado cambios significativos en el RCV medido por las diferentes escalas utilizadas. Una posible explicación sería aceptar que el comportamiento de las diversas poblaciones es diferente frente al problema descrito. Así, las poblaciones mediterráneas, entre ellas la española, tienen una morbimortalidad cardiovascular reducida comparada con la que le correspondería de acuerdo a los factores de riesgo reconocidos21, la denominada “paradoja española”, y ello redundaría igualmente en una menor expresividad del mayor riesgo producido por el tratamiento. En nuestra opinión, no hay evidencia que permita sugerir que diversas poblaciones se comportarían de forma diferente frente al BA.
Consistente con lo anterior, otra posible explicación sería asumir que, en el caso del incremento del RCV causado por el BA, la medición proporcionada por las tablas de riesgo no es útil porque no es capaz de medir el impacto que el bloqueo hormonal produce en la fisiología del paciente, quizá en relación con cambios que no responden a los criterios tradicionales del síndrome metabólico22. Analizando más detalladamente los cambios significativos acontecidos (colesterol total, colesterol HDL y glucemia basal) se aprecia que, dada la composición de los índices de RCV, la magnitud de la variación es insuficiente para poder tener influencia en el resultado final.
En suma, a la vista de los resultados obtenidos parece recomendable no recurrir a las tablas de RCV vigentes para intentar calibrar el incremento del riesgo añadido por el BA, y ello en consonancia con las últimas recomendaciones publicadas al respecto por diferentes sociedades científicas10. Este hecho es más relevante si cabe debido al alto índice de pacientes diagnosticados de CP que se encuentran en tratamiento con BA en nuestro medio, a diferencia de lo encontrado en otros países23.
Creemos que el resultado del análisis multivariante merece un comentario adicional. A pesar de que el diseño no es el más adecuado ni era un objetivo principal del estudio, la asociación negativa encontrada entre ECV y el uso de estatinas refuerza la idea de que estos fármacos son beneficiosos en estos pacientes incluso si no existe una indicación clara para su uso (hiperlipemia). Si estos resultados fueran confirmados por un estudio prospectivo debería recomendarse la utilización de estatinas conjuntamente con la terapia de BA en pacientes con cáncer de próstata.
Existen varias limitaciones en el presente estudio que deben ser consideradas. Dado que se trata de un estudio de cohortes retrospectivo en que sólo se registran los casos que alcanzan vivos el fin del seguimiento, los resultados podrían estar sesgados debido a que habrían podido eliminarse los casos con riesgo cardiovascular aumentado fallecidos en el período considerado. Sin embargo, este hecho queda descartado al no haberse registrado fallecimientos en el grupo estudiado.
Por otra parte, algunos de los pacientes incluidos en el estudio tenían edades no contempladas en las tablas de riesgo utilizadas. Sin embargo, el hecho de no haber modificado la edad en el cálculo de los índices y poder medir la modificación del riesgo debida a otros factores, hubiera permitido apreciar posibles variaciones en los mismos.
- •
Una gran proporción de pacientes con cáncer de próstata reciben tratamiento con antiandrógenos
- •
El tratamiento de bloqueo androgénico del cáncer de próstata incrementa el riesgo cardiovascular de los pacientes.
- •
No es posible apreciar modificaciones en los valores de riesgo cardiovascular medidos con las tablas de riesgo habituales después de un año de tratamiento
- •
Las tablas de riesgo cardiovascular no deben ser empleadas para cuantificar el incremento del riesgo producido por el bloqueo androgénico.
Los autores declaran no tener ningún conflicto de intereses.