La comisión del Lancet Oncology, integrada por médicos e investigadores de atención primaria (AP), sobre la base de la evidencia científica y argumentos amplios y exhaustivos, ha elaborado un informe sobre la importancia cada vez mayor de la AP en el control del cáncer, desde la prevención hasta el seguimiento después del tratamiento, o en la atención de final de vida1.
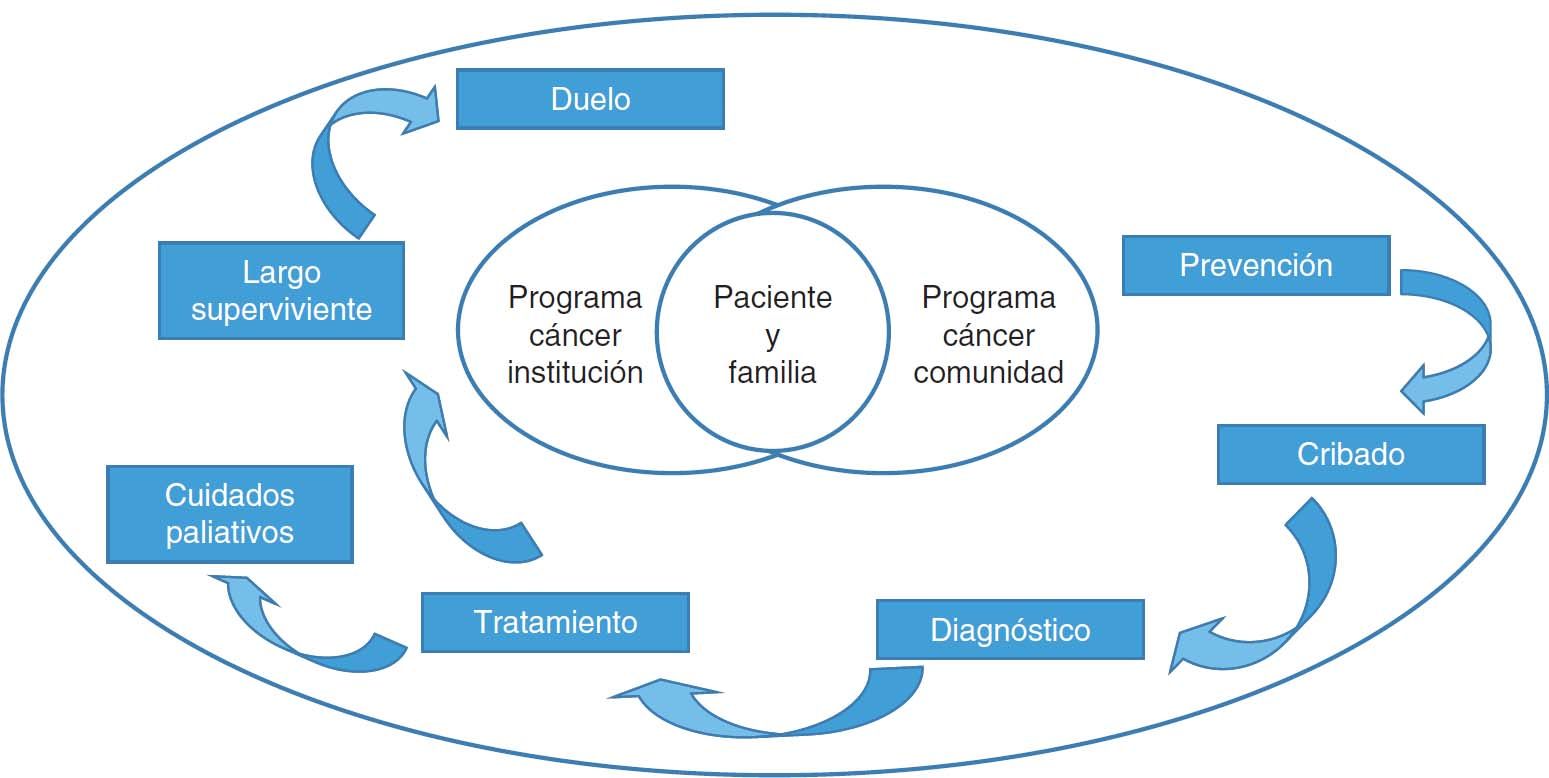
El informe de la comisión señala la necesidad de modelos de atención integrados, coordinados y acordados entre niveles asistenciales1. En la figura 1 se presenta, a modo de ejemplo, el modelo compartido propuesto por el Cancer Care Manitoba de Canadá2. Destaca la influencia de los profesionales de AP en facilitar estrategias de prevención dirigidas a modificar los estilos de vida y factores de riesgo de cáncer conocidos1. También señala que, cuando los médicos de familia se involucran en los programas de cribado, las tasas de participación aumentan1. Otro elemento en el que incide el informe es en que, para conseguir un diagnóstico de cáncer más precoz, el médico de familia debe tener un mejor acceso a las pruebas diagnósticas y disponer de herramientas de apoyo a las decisiones clínicas a través de la historia clínica informatizada1. Asimismo, apunta la necesidad de ofrecer una atención holística integral que cubra las consecuencias físicas y psicológicas de las personas que han sobrevivido al cáncer1.
Modelo compartido entre atención primaria y oncología. Adaptada del Cancer Care Manitoba. UPCON - Uniting Primary Care and Oncology. Disponible en: http://www.cancercare.mb.ca/home/health_care_professionals/information_for_health_care_professionals/upcon
En este artículo, el grupo de Prevención del Cáncer del Programa de Prevención y Promoción de la Salud (PAPPS) de la Sociedad Española de Medicina Familiar y Comunitaria (semFYC)3 actualiza las evidencias y recomendaciones sobre prevención y detección precoz del cáncer en población de riesgo medio y de riesgo elevado. Para clasificar la calidad de la evidencia y la fuerza de las recomendaciones, se ha utilizado el sistema GRADE (Grading of Recommendations Assessment, Development and Evaluation)4,5.
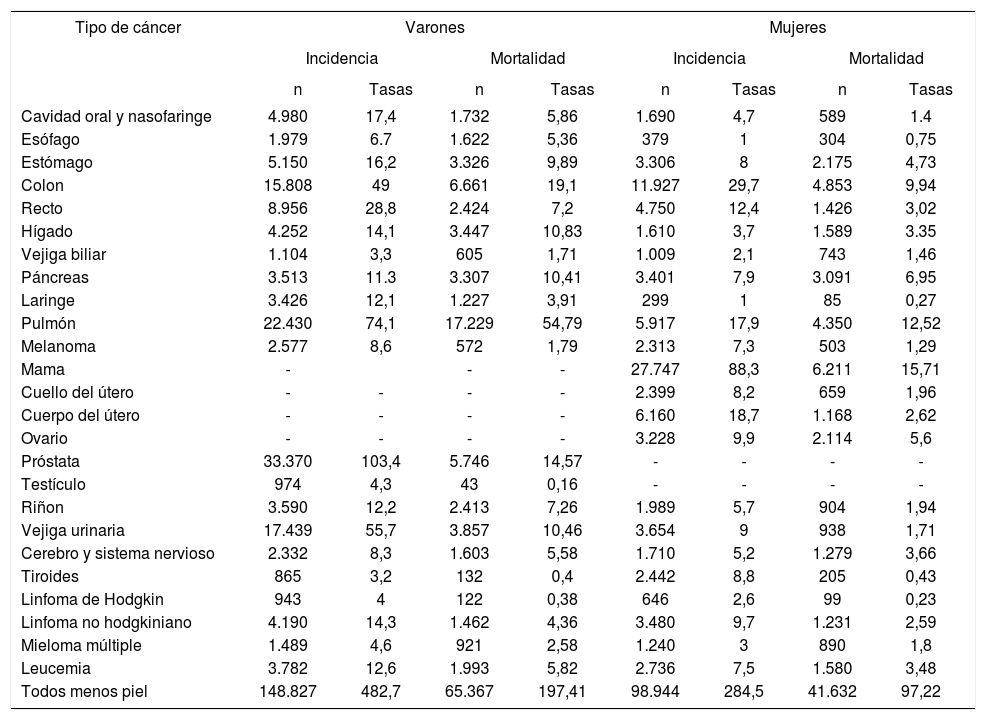
Magnitud del problema del cáncerEl cáncer constituye uno de los problemas de salud más relevantes del ámbito mundial6. En España, en el año 2015, el número total de nuevos casos de cáncer invasivo fue de 247.771, 148.827 en varones (tasa estandarizada por población europea de 482,7 casos por cada 100.000) y 98.944 en mujeres (284,5 casos por cada 100.000) (tabla 1)7. Estas tasas, comparadas con los países europeos y en el ámbito mundial, se sitúan en una posición intermedia-baja6. En su conjunto, los 5 cánceres más comunes son: colorrectal (CCR) (41.441), próstata (33.370), pulmón (28.347), mama (27.747) y vejiga urinaria (21.093)7 (tabla 1). Las tasas de incidencia han aumentado de 334 por 100.000 en 1993 a 379 por 100.000 en 2007. Las tasas estimadas para 2015 se mantienen similares a las de 2007 (384 por 100.000)7
Incidencia estimada y mortalidad por cáncer en España, 2015
| Tipo de cáncer | Varones | Mujeres | ||||||
|---|---|---|---|---|---|---|---|---|
| Incidencia | Mortalidad | Incidencia | Mortalidad | |||||
| n | Tasas | n | Tasas | n | Tasas | n | Tasas | |
| Cavidad oral y nasofaringe | 4.980 | 17,4 | 1.732 | 5,86 | 1.690 | 4,7 | 589 | 1.4 |
| Esófago | 1.979 | 6.7 | 1.622 | 5,36 | 379 | 1 | 304 | 0,75 |
| Estómago | 5.150 | 16,2 | 3.326 | 9,89 | 3.306 | 8 | 2.175 | 4,73 |
| Colon | 15.808 | 49 | 6.661 | 19,1 | 11.927 | 29,7 | 4.853 | 9,94 |
| Recto | 8.956 | 28,8 | 2.424 | 7,2 | 4.750 | 12,4 | 1.426 | 3,02 |
| Hígado | 4.252 | 14,1 | 3.447 | 10,83 | 1.610 | 3,7 | 1.589 | 3.35 |
| Vejiga biliar | 1.104 | 3,3 | 605 | 1,71 | 1.009 | 2,1 | 743 | 1,46 |
| Páncreas | 3.513 | 11.3 | 3.307 | 10,41 | 3.401 | 7,9 | 3.091 | 6,95 |
| Laringe | 3.426 | 12,1 | 1.227 | 3,91 | 299 | 1 | 85 | 0,27 |
| Pulmón | 22.430 | 74,1 | 17.229 | 54,79 | 5.917 | 17,9 | 4.350 | 12,52 |
| Melanoma | 2.577 | 8,6 | 572 | 1,79 | 2.313 | 7,3 | 503 | 1,29 |
| Mama | - | - | - | 27.747 | 88,3 | 6.211 | 15,71 | |
| Cuello del útero | - | - | - | - | 2.399 | 8,2 | 659 | 1,96 |
| Cuerpo del útero | - | - | - | - | 6.160 | 18,7 | 1.168 | 2,62 |
| Ovario | - | - | - | - | 3.228 | 9,9 | 2.114 | 5,6 |
| Próstata | 33.370 | 103,4 | 5.746 | 14,57 | - | - | - | - |
| Testículo | 974 | 4,3 | 43 | 0,16 | - | - | - | - |
| Riñon | 3.590 | 12,2 | 2.413 | 7,26 | 1.989 | 5,7 | 904 | 1,94 |
| Vejiga urinaria | 17.439 | 55,7 | 3.857 | 10,46 | 3.654 | 9 | 938 | 1,71 |
| Cerebro y sistema nervioso | 2.332 | 8,3 | 1.603 | 5,58 | 1.710 | 5,2 | 1.279 | 3,66 |
| Tiroides | 865 | 3,2 | 132 | 0,4 | 2.442 | 8,8 | 205 | 0,43 |
| Linfoma de Hodgkin | 943 | 4 | 122 | 0,38 | 646 | 2,6 | 99 | 0,23 |
| Linfoma no hodgkiniano | 4.190 | 14,3 | 1.462 | 4,36 | 3.480 | 9,7 | 1.231 | 2,59 |
| Mieloma múltiple | 1.489 | 4,6 | 921 | 2,58 | 1.240 | 3 | 890 | 1,8 |
| Leucemia | 3.782 | 12,6 | 1.993 | 5,82 | 2.736 | 7,5 | 1.580 | 3,48 |
| Todos menos piel | 148.827 | 482,7 | 65.367 | 197,41 | 98.944 | 284,5 | 41.632 | 97,22 |
Tasas ajustadas por población estándar europea por 100.000.
Fuentes: Galceran J, et al, 2017; INE, estadísticas mortalidad 2015. Dsiponible en: http://www.ine.es/
El cáncer es una de las principales causas de mortalidad en España (106.999 defunciones en el año 2015)8 Por sexo, los tumores malignos fueron la primera causa de muerte en los varones (66.537 muertes con una tasa estandarizada por población europea de 197,41 fallecidos por cada 100.000) y la segunda causa en mujeres, por detrás de las enfermedades cardiovasculares (41.632 muertes, con una tasa de 97,22 fallecidas por cada 100.000)8 (tabla 2). En su conjunto, los 5 cánceres con mayor mortalidad son: pulmón (21.579 casos), CCR (15.364), páncreas (6.398), mama (6.211) y próstata (5.746).
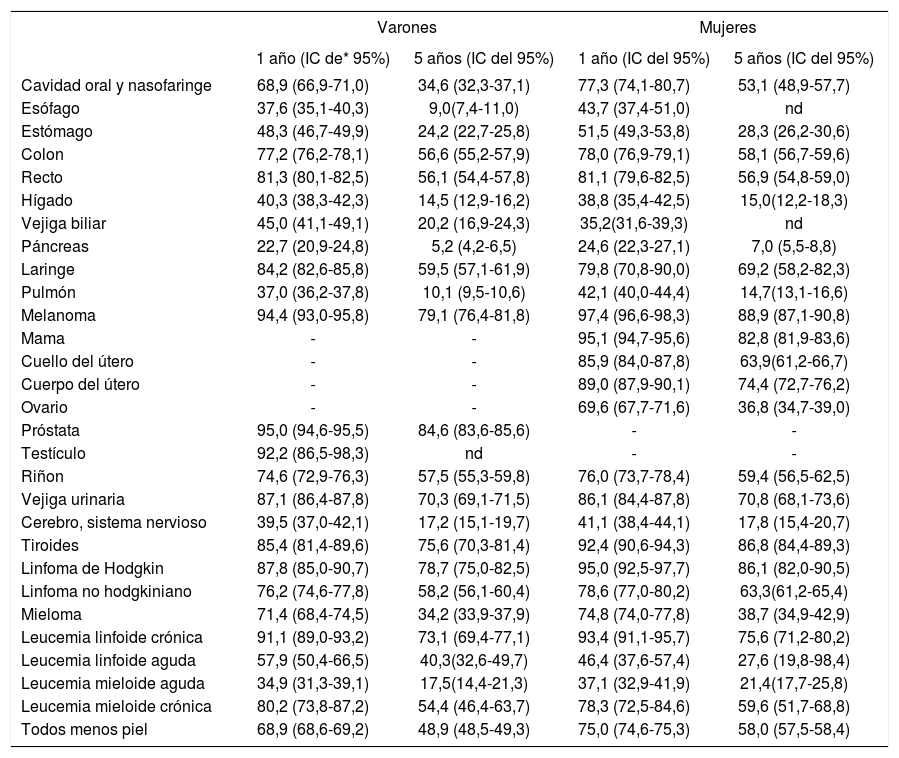
Supervivencia relativa a 1 y 5 años, estandarizada por edad (intervalo de confianza [IC] del 95%), para pacientes adultos (> 15 años) diagnosticados de cáncer en España en el período 2000-2007
| Varones | Mujeres | |||
|---|---|---|---|---|
| 1 año (IC de* 95%) | 5 años (IC del 95%) | 1 año (IC del 95%) | 5 años (IC del 95%) | |
| Cavidad oral y nasofaringe | 68,9 (66,9-71,0) | 34,6 (32,3-37,1) | 77,3 (74,1-80,7) | 53,1 (48,9-57,7) |
| Esófago | 37,6 (35,1-40,3) | 9,0(7,4-11,0) | 43,7 (37,4-51,0) | nd |
| Estómago | 48,3 (46,7-49,9) | 24,2 (22,7-25,8) | 51,5 (49,3-53,8) | 28,3 (26,2-30,6) |
| Colon | 77,2 (76,2-78,1) | 56,6 (55,2-57,9) | 78,0 (76,9-79,1) | 58,1 (56,7-59,6) |
| Recto | 81,3 (80,1-82,5) | 56,1 (54,4-57,8) | 81,1 (79,6-82,5) | 56,9 (54,8-59,0) |
| Hígado | 40,3 (38,3-42,3) | 14,5 (12,9-16,2) | 38,8 (35,4-42,5) | 15,0(12,2-18,3) |
| Vejiga biliar | 45,0 (41,1-49,1) | 20,2 (16,9-24,3) | 35,2(31,6-39,3) | nd |
| Páncreas | 22,7 (20,9-24,8) | 5,2 (4,2-6,5) | 24,6 (22,3-27,1) | 7,0 (5,5-8,8) |
| Laringe | 84,2 (82,6-85,8) | 59,5 (57,1-61,9) | 79,8 (70,8-90,0) | 69,2 (58,2-82,3) |
| Pulmón | 37,0 (36,2-37,8) | 10,1 (9,5-10,6) | 42,1 (40,0-44,4) | 14,7(13,1-16,6) |
| Melanoma | 94,4 (93,0-95,8) | 79,1 (76,4-81,8) | 97,4 (96,6-98,3) | 88,9 (87,1-90,8) |
| Mama | - | - | 95,1 (94,7-95,6) | 82,8 (81,9-83,6) |
| Cuello del útero | - | - | 85,9 (84,0-87,8) | 63,9(61,2-66,7) |
| Cuerpo del útero | - | - | 89,0 (87,9-90,1) | 74,4 (72,7-76,2) |
| Ovario | - | - | 69,6 (67,7-71,6) | 36,8 (34,7-39,0) |
| Próstata | 95,0 (94,6-95,5) | 84,6 (83,6-85,6) | - | - |
| Testículo | 92,2 (86,5-98,3) | nd | - | - |
| Riñon | 74,6 (72,9-76,3) | 57,5 (55,3-59,8) | 76,0 (73,7-78,4) | 59,4 (56,5-62,5) |
| Vejiga urinaria | 87,1 (86,4-87,8) | 70,3 (69,1-71,5) | 86,1 (84,4-87,8) | 70,8 (68,1-73,6) |
| Cerebro, sistema nervioso | 39,5 (37,0-42,1) | 17,2 (15,1-19,7) | 41,1 (38,4-44,1) | 17,8 (15,4-20,7) |
| Tiroides | 85,4 (81,4-89,6) | 75,6 (70,3-81,4) | 92,4 (90,6-94,3) | 86,8 (84,4-89,3) |
| Linfoma de Hodgkin | 87,8 (85,0-90,7) | 78,7 (75,0-82,5) | 95,0 (92,5-97,7) | 86,1 (82,0-90,5) |
| Linfoma no hodgkiniano | 76,2 (74,6-77,8) | 58,2 (56,1-60,4) | 78,6 (77,0-80,2) | 63,3(61,2-65,4) |
| Mieloma | 71,4 (68,4-74,5) | 34,2 (33,9-37,9) | 74,8 (74,0-77,8) | 38,7 (34,9-42,9) |
| Leucemia linfoide crónica | 91,1 (89,0-93,2) | 73,1 (69,4-77,1) | 93,4 (91,1-95,7) | 75,6 (71,2-80,2) |
| Leucemia linfoide aguda | 57,9 (50,4-66,5) | 40,3(32,6-49,7) | 46,4 (37,6-57,4) | 27,6 (19,8-98,4) |
| Leucemia mieloide aguda | 34,9 (31,3-39,1) | 17,5(14,4-21,3) | 37,1 (32,9-41,9) | 21,4(17,7-25,8) |
| Leucemia mieloide crónica | 80,2 (73,8-87,2) | 54,4 (46,4-63,7) | 78,3 (72,5-84,6) | 59,6 (51,7-68,8) |
| Todos menos piel | 68,9 (68,6-69,2) | 48,9 (48,5-49,3) | 75,0 (74,6-75,3) | 58,0 (57,5-58,4) |
nd: no dispaiible.
Fuente: referencia 9.
Las estimaciones de supervivencia relativa de cáncer en España para los diferentes tumores, según los resultados del estudio EUROCARE-5 (Survival of cancer patients in Europe) en los pacientes mayores de 15 años diagnosticados de cáncer en España en 2000-2007, se presentan en la tabla 2. La supervivencia a 1 año se estima del 68,9% (intervalo de confianza [IC] del 95%, 68,6-69,2%) en los varones y del 75,0% (IC del 95%, 74,6-75,3%) en mujeres. La supervivencia a 5 años es del 48,9% (IC del 95%, 48,5-49,3%) y el 58,0% (IC del 95%, 57,5-58,4%), respectivamente9.
Prevención primariaEl cáncer es una enfermedad multifactorial debida al efecto combinado de factores genéticos y factores externos (estilos de vida y ambientales). El tabaco es la principal causa de cáncer y de muerte por cáncer10,11. La dieta, incluido el consumo de alcohol, el control del peso y la actividad física, puede prevenir un tercio de los cánceres más comunes12. Asimismo, en grupos de población específica, son factores de riesgo destacables: la exposición a carcinógenos ocupacionales, la contaminación atmosférica, los agentes infecciosos, aspectos de la vida sexual y reproductiva y el nivel socioeconómico. Las desigualdades socioeconómicas influyen, sin duda, en la adopción de estilos de vida saludables. En la tabla 3 se pueden consultar los factores de riesgo asociados de forma más significativa a los diferentes cánceres.
Factores de riesgo para los cánceres más comunes
| Tipo | Factores de riesgo |
|---|---|
| Colorrectal | Portadores de las mutaciones del síndrome de Lynch o de síndromes de poliposis familiar Colitis ulcerosa, enfermedad de Crohn Poliposis colónica (adenomas, pólipos serrados) Obesidad Sedentarismo Dieta (carne procesada y roja) Tabaquismo Alcohol Edad > 50 años |
| Pulmón | Tabaco Fibrosis pulmonar, sarcoidosis, esclerodermia, TBC, EPOC Radioterapia de mama o pulmón previa Exposición ambiental al humo del tabaco, radón, arsénico, amianto Exposición laboral al cromo, berilio, cadmio, níquel, hidrocarburos aromáticos policíclicos Edad > 40 años |
| Melanoma | Antecedente personal o familiar de melanoma Piel y ojos claros, pelo rubio o pelirrojo Quemaduras solares en la infancia Exposición solar acumulada Bronceado con rayos UVA Nevus displásicos Tratamientos inmunosupresores |
| Mama | Portadores de la mutación del síndrome mama/ovario hereditario (BRCA) Radioterapia previa de la mama Obesidad Sedentarismo Alcoholismo Primer embarazo > 30 años, nuliparidad, no lactancia THS > 5 años Sexo femenino Edad > 50 años |
| Ovario | Portadora de la mutación del síndrome mama/ovario hereditario (BRCA) o del síndrome de Lynch Tabaco (carcinoma mucinoso) Menarquia precoz, menopausia tardía, nuliparidad, infertilidad, endometriosis, síndrome de ovario poliquístico, no lactancia THS > 5 años Edad > 50 años |
| Cuello uterino | Infección persistente VPH-AR Portadora del VIH, tratamiento inmunosupresor Tratamiento previo de HSIL o CCU Tabaco Multiparidad, anticoncepción oral, ETS (Chlamydia, VHS) Ausencia de cribado o cribado inadecuado Nivel socioeconómico bajo Edad > 30 años |
| Endometrio | Portadora de la mutación del síndrome de Lynch Tratamiento con tamoxifeno (por cáncer de mama previo) Hiperplasia endometrial Obesidad Diabetes tipo 2 THS sin progestágenos, nuliparidad, infertilidad, síndrome de ovario poliquiìstico Edad > 55 años |
| Próstata | Portador de la mutación del síndrome mama/ovario (BRCA2) Antecedente familiar de primer grado de cáncer próstata Africanos y caribeños Exposición a andrógenos Dieta rica en grasas animales (carne roja y lácteos) Sedentarismo Edad > 50 años |
| Tiroides | Portadores de mutaciones del síndrome del carcinoma medular de tiroides familiar, síndrome de neoplasia endocrina múltiple Exposición a radiaciones ionizantes (terapéuticas o diagnósticas) en infancia Obesidad, diabetes Sexo femenino Edad 25-65 años |
CCU: cáncer de cuello uterino; EPOC: enfermedad pulmonar obstructiva crónica; ETS: enfermedades de trasmisión sexual; HSIL: lesión escamosa intraepitelial de alto grado; TBC: tuberculosis; THS: tratamiento hormonal sustitutivo; VHS: virus del herpes simple; VIH: virus de la inmunodeficiencia humana; VPH-AR: virus del papiloma humano de alto riesgo.
En la tabla 4 se describen las recomendaciones del World Cancer Research Fund (WCRF) internacional en relación con la dieta, la alimentación, el peso y el ejercicio físico, para reducir el riesgo de cáncer y aumentar la supervivencia del cáncer12. Las intervenciones dirigidas a la reducción del riesgo disminuyen también el riesgo de enfermedades cardiovasculares y otras enfermedades asociadas a estos mismos factores de riesgo. El Código Europeo Contra el Cáncer13 hace énfasis en las recomendaciones de prevención primaria del cáncer para la población europea (tabla 5).
Recomendaciones para reducir el riesgo de cáncer y aumentar la supervivencia del World Cancer Research Fund (WCRF)
|
Adaptada de referencia 12.
Código Europeo Contra el Cáncer. Doce formas de reducir el riesgo de cáncer
|
THS: terapia hormonal substitutiva; VPH: virus del papiloma humano.
Fuente: referencia 13.
La AP es el nivel asistencial mejor ubicado para recomendar intervenciones de prevención primaria del cáncer, ya que brinda acceso y cobertura universales. Las intervenciones breves en la consulta para disminuir el consumo de riesgo de alcohol o el abandono del tabaco son efectivas para cambiar las conductas de salud de los pacientes y también pueden mejorar las conductas dietéticas a corto plazo, aunque la evidencia del cambio de comportamiento a largo plazo es limitada. Las intervenciones sobre el estilo de vida se pueden consultar en las recomendaciones del grupo de expertos del PAPPS sobre estilo de vida14. Los profesionales de AP deben gestionar su consulta para que estas intervenciones se puedan realizar de manera eficiente dentro del contexto de una práctica clínica con excesiva demanda.
Prevención secundariaEl objetivo del cribado es detectar el cáncer antes de que se manifieste clínicamente, con la finalidad de poder ofrecer un tratamiento precoz y aportar beneficios a las personas en términos de reducción de la mortalidad y aumento de la calidad de vida15. Sin embargo, el cribado no está exento de riesgos, principalmente falsos positivos y exposición a pruebas adicionales innecesarias, falsos negativos (falsa seguridad), sobrediagnóstico y sobretratamiento de lesiones indolentes. La decisión informada del paciente sobre la realización de un cribado debe incluir información sobre los beneficios y los riesgos. Los valores y preferencias personales son clave a la hora de tomar una decisión. Asimismo, el coste de los cribados no debería ser una carga onerosa para el sistema de salud15.
El sobrediagnóstico es un término reciente, definido como el diagnóstico de una condición/enfermedad que nunca causaría síntomas en la vida de la persona16,17. La enfermedad se detecta correctamente, pero el diagnóstico es irrelevante. El sobrediagnóstico del cáncer es consecuencia de la no progresión tumoral o bien de la mortalidad competitiva debida a otras causas (el paciente morirá a consecuencia de otra enfermedad antes de que el cáncer haya causado sín- tomas)16,17. El sobrediagnóstico del cáncer convierte a personas asintomáticas, en principio sanas, en enfermas (etiquetadas de por vida), conduce a tratamientos innecesarios (intervención quirúrgica, quimioterapia, radioterapia, tratamientos sustitutivos) que, al no aportar ningún beneficio a la salud, solo causan daño físico y psicosocial (efectos secundarios a corto, medio y largo plazo)16,17.
Es necesario diferenciar los cribados de base poblacional dirigidos a la población de riesgo medio de los cribados oportunistas (case-finding). En diciembre de 2003, el Consejo Europeo aprobó la recomendación del cribado poblacional del cáncer de mama, CCR y de cuello de útero para la población de riesgo medio de sus estados miembros18. Estos 3 cribados son los recomendados en el Código Europeo Contra el Cáncer (tabla 5)13, contemplados en la Estrategia en Cáncer del Sistema Nacional de Salud (SNS)19 e incluidos en la cartera de servicios como prestación básica del SNS20. Cada comunidad autónoma debe garantizar la estricta calidad de todos los procesos y la evaluación de los programas de cribado poblacional de forma global.
Los cribados oportunistas son los que se solicitan y/o se realizan en la consulta, a iniciativa del profesional o a petición del paciente, y van dirigidos a personas de riesgo medio y de riesgo elevado15.
Cualquier estrategia y modalidad de cribado requiere informar a las personas sobre el balance entre beneficios y riesgos, tener en cuenta las preferencias del paciente, y garantizar la calidad de las pruebas de cribado y la accesibilidad a las pruebas de confirmación diagnóstica en un plazo de tiempo adecuado.
Clasificación del riesgo de cáncerEl cáncer aparece como consecuencia de mutaciones en los genes de las células que controlan el crecimiento y la diferenciación celular. Las mutaciones que afectan a las células somáticas son el resultado del envejecimiento celular (cuantas más divisiones celulares, mayor posibilidad de errores aleatorios en las copias) y de la exposición a carcinógenos ambientales (epigenética). Por tanto, el riesgo de cáncer aumenta con la edad. En la mayoría de los cánceres, el riesgo aumenta a partir de los 50 años.
En una pequeña proporción de casos (15%), las mutaciones afectan a las células germinales (óvulos y espermatozoides). Los portadores de determinadas mutaciones tienen un riesgo elevado de desarrollar distintos tipos de cáncer a lo largo de la vida. En la mayoría de casos, las mutaciones se transmiten de padres a hijos siguiendo un patrón autosómico dominante (un solo gen heredado de cualquiera de los padres es suficiente para causar la predisposición, cada hijo tiene un 50% de posibilidades de heredar la mutación). En estos casos, la edad de presentación del cáncer es más precoz. El conocimiento de la historia familiar permite identificar a los individuos con un posible síndrome hereditario de predisposición al cáncer, en cuyo caso habrán de ser dirigidos a unidades de consejo genético para, en caso necesario, realizar el test genético, asesorar y recomendar vigilancia específica a los portadores (cribados en población de alto riesgo)15.
Por otro lado, existen ciertos factores de riesgo con un peso específico para el desarrollo de determinados cánceres (tabla 3). A modo de ejemplos, el tabaco en el cáncer de pulmón, el virus del papiloma humano (VPH) en el cáncer de cuello de útero (CCU), las enfermedades inflamatorias intestinales en el CCR. Sin embargo, los factores de riesgo relacionados con el estilo de vida, como la dieta, la actividad física, el sobrepeso o los relacionados con factores hormonales y reproductivos, aunque su asociación está bien establecida, tienen una utilidad limitada para la predicción del riesgo individual.
A nivel práctico, la clasificación según el riesgo individual de cáncer se basa en la edad, los antecedentes personales y los antecedentes familiares. Ello permite clasificar al sujeto en 3 categorías: riesgo bajo (< 50 años, sin antecedentes personales de cáncer, enfermedades predisponentes, ni antecedentes familiares), riesgo medio (≥ 50 años, sin antecedentes personales de cáncer, enfermedades predisponentes, ni antecedentes familiares) y riesgo elevado (cualquier edad, con antecedentes personales de cáncer o enfermedades predisponentes o antecedentes familiares). El valor predictivo positivo (VPP) de las pruebas de cribado y diagnósticas varía en función de la categoría de riesgo.
Detección temprana de signos y síntomas de cáncerLa gran mayoría de los cánceres se diagnostican en fase sintomática. En nuestro medio, la AP es la vía de acceso a la atención especializada (AE). La oportunidad de realizar una detección temprana de cáncer en AP depende básicamente de la posibilidad de acortar 2 intervalos de tiempo: a) intervalo paciente o tiempo transcurrido entre el inicio del primer síntoma y la primera consulta al profesional de AP, y b) intervalo de AP o tiempo transcurrido entre la primera consulta y la derivación a la AE para confirmación diagnóstica21.
Una encuesta realizada en Reino Unido reveló que el 23% de los pacientes con diagnóstico de cáncer y síntomas de sospecha informó de que había visitado a su médico de AP 3 o más veces antes de ser derivados al hospital22. Los signos y síntomas iniciales del cáncer habitualmente son inespecíficos y compatibles con otros diagnósticos diferentes al cáncer. El VPP de estos es bajo, dada la baja prevalencia del cáncer en las consultas de AP. Un médico de AP, en 1 año, verá muy pocos nuevos casos de cáncer (5-7 casos); puede pasar años, incluso toda una vida laboral, sin llegar a ver determinados cánceres poco frecuentes. Quizá, el principal reto para el médico de familia es no pensar siempre en el cáncer, ser capaz de convivir con la incertidumbre y evitar intervenciones innecesarias o inapropiadas23.
En pacientes sintomáticos, la clasificación del riesgo individual en bajo, medio y alto riesgo es imprescindible para la toma de decisiones. La presencia de síntomas persistentes, progresivos o asociados entre ellos aumenta el VPP. Un VPP ≥ 5% (1:20) se considera suficiente para iniciar el proceso diagnóstico24. En la tabla 6 se describen los signos y síntomas con mayor VPP para los cánceres más comunes y las recomendaciones adecuadas en cada caso25. La accesibilidad a las pruebas diagnósticas y el acceso a la AE condicionan claramente la duración del intervalo de AP.
Signos y síntomas con mayor valor predictivo positivo para distintos tipos de cáncer y recomendaciones
| Tipo | Signos y síntomas | Recomendación |
|---|---|---|
| Colorrectal | Rectorragia más: • Cambio de hábito intestinal (aumento de frecuencia y disminución de consistencia) • Moco en heces • Ausencia de síntomas anales (prurito, escozor, dolor) Anemia ferropénica en > 60 años: < 12 g/dl varones y < 11 g/dl mujeres SOH+ Cambio del ritmo intestinal de > 3 meses Masa abdominal o rectal palpable Oclusión intestinal Pérdida de peso y dolor abdominal | Masa abdominal o rectal palpable y oclusión intestinal, derivación urgente. En el resto, colonoscopia antes de 2 semanas |
| Pulmón | Hemoptisis Persistencia (> 3 semanas) de: • Dolor torácico • Cambios en la tos y/o expectoración • Disfonía • Disnea Neumonía de lenta resolución o de repetición Acropaquia, trombocitosis Adenopatía supraclavicular o cervical Síndrome tóxico acompañado de cualquiera de los anteriores síntomas Estridor laríngeo Signos de compresión de la vena cava superior | Si la radiografía es sospechosa o hay hemoptisis en > 40 años, broncoscopia antes de 2 semanas |
| Melanoma | Cambio del tamaño, forma o color, ulceración de un nevus • Asimetría • Bordes irregulares • Color no uniforme • Diámetro > 7 mm de crecimiento rápido | Si dermatoscopia sugestiva, resección quirúrgica antes de 2 semanas |
| Mama | Nódulo mamario con o sin dolor Adenopatía axilar unilateral Retracción pezón y cambios forma de la mama Telorrea/telorragia unilateral Edema, eritema, celulitis, ulceración | Mamografía o ecografía (jóvenes) antes de 2 semanas |
| Ovario | Persistencia (> 3 semanas) o frecuencia (> 12 veces al mes) de ≥ 1 síntomas: • Dolor abdominal o pélvico • Saciedad precoz o pérdida de apetito • Hinchazón o distensión abdominal • Urgencia o frecuencia urinaria (excluyendo otras causas) • Cambio del ritmo intestinal • Dolor de espalda o costal Hemorragia vaginal anómala Pérdida de peso, fatiga inexplicada Masa abdominopélvica (no miomas) Ascitis | Ascitis o masa abdominopélvica palpable, derivación urgente En el resto, Ca-125 > 35 y/o ecografía sugestiva, derivación antes de 2 semanas |
| Cuello | Hemorragia vaginal anormal espontánea o poscoital | Colposcopia y biopsia dirigida antes de |
| uterino | Secreción vaginal Dolor o presión en zona pelviana | 2 semanas |
| Endometrio | Metrorragia posmenopáusica Secreción vaginal Hematuria Trombocitosis | Ecografía y legrado endometrial antes de 2 semanas |
| Próstata | Dificultad para iniciar la micción, polaquiuria, disminución de la fuerza, goteo terminal, nicturia, obstrucción, disuria Hematuria Hemospermia Eyaculación dolorosa Disfunción eréctil Dolor óseo (metástasis) | Si tacto rectal sospechoso y/o PSA elevado, biopsia transrectal dirigida por ecografía antes de 2 semanas |
| Tiroides | Nódulo tiroideo con o sin adenopatía cervical | Ecografía de tiroides + PAAF antes de 2 semanas |
PAAF: punción aspiración con aguja fina; PSA: antígeno prostático específico; SOH: sangre oculta heces. Adaptada de referencia 24.
Los circuitos de diagnóstico rápido (CDR) tienen como objetivo reducir el tiempo entre la sospecha fundamentada de cáncer, la confirmación diagnóstica y el inicio del tratamiento. Consisten en establecer vías de acceso específicas y preferentes, desde la AP a la AE, para pacientes con síntomas con elevado VPP. Actualmente, la mayoría de comunidades autónomas (CC. AA.) dispone de CDR para los cánceres de mama, pulmón, CCR, próstata y vejiga urinaria19. Reducir la demora atribuible al sistema sanitario (intervalo sistema sanitario) puede contribuir a reducir la ansiedad que experimenta una persona en estas circunstancias, a un diagnóstico y tratamiento más tempranos y a la mejora de la calidad de todo el proceso asistencial.
Recomendaciones de prevención del cáncerA continuación se presentan las evidencias científicas y los elementos más significativos que se han tenido en cuenta para asignar la fuerza de la recomendación sobre las intervenciones de prevención de los cánceres con mayor impacto. En la tabla 7 se describen las variables de resultado identificadas de las intervenciones de cribado y la puntuación consensuada.
Puntuación de las variables de resultado en salud identificadas. Sistema GRADE
| Pregunta PICO: paciente (persona sana con riesgo medio de padecer un cáncer), intervención (la prueba de cribado), comparación (nada o la prueba de cribado para comparar), outcomes (resultados en términos de beneficios y riesgos esperados) | |
|---|---|
| Variables de resultados en salud identificadas | Puntuación de importancia |
| Mortalidad específica (del propio cáncer cribado) | 9 |
| Mortalidad global (mortalidad por cualquier causa) | 9 |
| Tasas de cáncer | 7 |
| Tasas de detección de lesiones premalignas | 7 |
| Sobrediagnóstico (casos que dejados a su evolución natural nunca se hubieran diagnosticado) | 9 |
| Sobretratamiento (casos que dejados a su evolución natural nunca se hubieran tratado) | 9 |
| Efectos adversos importantes de las pruebas (p. ej., perforaciones en el caso de la colonoscopia) | 9 |
Puntuación: 7-9, crítico para tomar la decisión; 4-6, importante pero no crítico para tomar la decisión; 1-3, no importante para tomar la decisión.
El cáncer de mama es el cáncer más frecuente en las mujeres. En España se estima que en 2015 se diagnosticaron 27.747 cánceres de mama, con un incremento en su tenden- cia7. Es el tumor que provoca mayor mortalidad en las mujeres españolas (6.211), aunque con una tendencia descendente8 (tabla 1). La supervivencia ha aumentado notablemente en las últimas 2 décadas, y actualmente se estima del 95,1% al año y del 82,8% a los 5 años (tabla 2)9.
La historia familiar es el factor de riesgo más importante y junto con la edad son factores de riesgo no modificables. La historia familiar incluye los cánceres de agregación familiar y los síndromes de predisposición hereditaria (5-6% de los cánceres de mama)26. Las mutaciones germinales BRCA1 y BRCA2 son las que con más frecuencia se asocian al síndrome de cáncer de mama/ovario, aunque también se han descrito otros genes que pueden modificar el riesgo: P53 (síndrome de Li-Fraumeni), PTEN (síndrome de Cowden) y STK11 (síndrome de Peutz-Jeghers)26. Las mutaciones BRCA1 y BRCA2 se heredan de forma autosómica dominante y confieren un riesgo elevado de cáncer de mama de entre el 55 y el 70% en la mutación BRCA1 y del 45-70% en la BRCA227. La incidencia aumenta a principios de la edad adulta hasta los 30 a 40 años en las mujeres portadoras BRCA1 y hasta los 40 a 50 años para las portadoras de BRCA227. El riesgo de padecer cáncer contralateral en portadoras BRCA se estima hasta en un 63% a los 25 años después del diagnóstico, pero altamente dependiente de la edad27.
El riesgo de desarrollar cáncer en las mujeres, tanto las de riesgo elevado (portadoras de mutaciones BRCA) como las de riesgo medio, puede estar influenciado por diversos factores exógenos26 (tabla 3). El riesgo de cáncer de mama en mujeres con mutaciones BRCA es más elevado en las mujeres obesas, físicamente inactivas durante su adolescencia y nulíparas28. Se estima que la actividad física reduce el riesgo en un 25% en las mujeres pre- y posmenopáusicas, y tiene un gran impacto sobre la incidencia y la mortalidad29.
Las mujeres con una predisposición genética conocida para el cáncer de mama (mutaciones BRCA1 o BRCA2) deben ser remitidas a las unidades de consejo genético y recibir consejo sobre las diversas opciones preventivas30 (tabla 8).
Indicaciones de estudio genético y recomendaciones de prevención en los portadores de mutación BRCA
|
ETV: ecografía transvaginal; RM: resonancia magnética. Adaptada de referencia 30.
La historia natural del cáncer de mama favorece la detección precoz mediante la mamografía de cribado. A partir de los resultados beneficiosos de la mamografía, en términos de reducción de la mortalidad por cáncer de mama, en la década de 1990 en Europa se empezaron a implementar programas de cribado de cáncer de mama. Actualmente, en todas las CC. AA. se llevan a cabo programas poblacionales de cribado de cáncer de mama destinados a las mujeres de entre 50 y 69 años, mediante mamografía de cribado cada 2 años19.
Desde hace más de una década, a pesar de la evidencia acumulada, persiste la divergencia en las conclusiones de las diferentes revisiones sistemáticas disponibles, en la actualidad más de 5031. En general, la comunidad científica está de acuerdo en que la mamografía de cribado reduce la mortalidad por cáncer de mama, aunque no la mortalidad por todas las causas, y que conlleva un riesgo de sobrediagnóstico y de sobretratamiento31. El desacuerdo está en las estimaciones de las tasas de reducción de la mortalidad y de sobrediagnóstico. Muchos expertos creen que los beneficios, en términos de reducción de la mortalidad por cáncer de mama, superan los daños (sobrediagnóstico y el correspondiente sobretratamiento), mientras que otros piensan lo contrario. Asimismo, el balance beneficio-riesgo es diferente para cada grupo de edad. Algunos autores que sitúan la mamografía de cribado como ejemplo de investigación extremadamente polarizada y con fuertes intereses profesionales32 piensan que los científicos también pueden tomar decisiones sobre la base de intereses falsos y hechos alternativos32.
La revisión sistemática (RS) Cochrane, que solo incluyó los 3 ensayos clínicos aleatorizados (ECA) considerados de calidad, no muestra reducción de la mortalidad por cáncer de mama (riesgo relativo [RR] en el grupo de 50 a 69 años: 1,02; IC del 95%, 0,95-1,10)33. La RS de la US Preventive Services Task Force (USPSTF)34 muestra una reducción marginal de la mortalidad por cáncer de mama y el efecto se concentra en los grupos de edad de 50 a 59 (RR: 0,86; IC del 95%, 0,680,97) (7 ECA; 8 muertes evitadas) y de 60 a 69 (RR: 0,67; IC del 95%, 0,54-0,83) (5 ECA; 21 muertes evitadas). La Canadian Task Force (CTF)35, en su última RS en 2011, concluyó que, para el grupo de mujeres de 50 a 69 años, el cribado se asoció a una reducción en la mortalidad por cáncer de mama del 21% (RR: 0,79; IC del 95%, 0,68-0,90). Sin embargo, estos ECA no reflejan los cambios en la tecnología (mamografía digital), ni tampoco la mejoría de la supervivencia con los tratamientos actuales. Además, se estima que los tratamientos actuales, tanto en población cribada como no cribada, han aumentado la supervivencia por cáncer de mama en un 1220%. No obstante, la RS de la USPSTF, a partir de los estudios observacionales realizados más recientemente, estima una reducción de entre el 25 y el 31% en el grupo de 50 a 69 años34. En el grupo de mujeres de 40-49 años (4 ECA), los resultados de la RS más reciente36 no muestran reducción significativa en la mortalidad por cáncer de mama (RR: 0,93; IC del 95%, 0,80-1,09).
Los riesgos de la mamografía de cribado no son desdeñables. Antes de la introducción de la mamografía de cribado, los carcinomas ductales in situ (CDIS) rara vez se diagnosticaban y existe controversia sobre si el CDIS es la etapa ideal para la detección temprana, o si la detección de CDIS representa un sobrediagnóstico y, en consecuencia, un sobretratamiento. Según estudios, el sobrediagnóstico oscila desde un 11 hasta un 30%, los resultados falsos positivos se cifran en un 20% (en el grupo de 50 a 70 años durante 10 años de cribado) y el riesgo de cáncer por radiación es de 1 a 10 por cada 100.000 mujeres cribadas37. Las variaciones en estas estimaciones probablemente están relacionadas con el diseño, los criterios de inclusión (carcinomas in situ), los grupos de edad y el método de estimación del sobrediagnóstico en los diferentes estudios. La RS Cochrane estima el sobrediagnóstico (CDIS que nunca hubieran dado manifestaciones clínicas) y el sobretratamiento en un 30%33. No obstante, los ECA incluidos en esta RS se diseñaron con el objetivo de demostrar la eficacia de la mamografía en la reducción de la mortalidad, pero no para determinar el riesgo de sobrediag- nóstico33. La RS para el grupo de 40-49 años estima un sobrediagnóstico del cáncer de mama invasivo a los 5 años después del cese del cribado del 32% y a los 20 años del 48%. Cuando se incluye CDIS, estas cifras se sitúan en el 41 y el 55%, respectivamente36.
El cáncer de mama integra a un grupo muy diverso de tumores que difieren en su histología y comportamiento biológico38. La clasificación histológica no explica la diversidad de comportamiento biológico38. Sobre la base de los perfiles de expresión génica, se conocen 4 subtipos moleculares38: a) luminal A, con receptores hormonales positivos y receptores HER2 negativos; b) luminal B, con receptores hormonales positivos y receptores HER2 positivos; c) sobreexposición del HER2, presente en aproximadamente el 10-15% de cánceres de mama y generalmente negativos para ER y PR, y d) basal, que pertenece a la categoría de cánceres de mama triple negativos (ER, PR y HER2 negativos). El luminal A es el más frecuente y el de mejor pronóstico, y el basal, el de peor pronóstico.
La USPSTF y la CTF recomiendan el cribado de cáncer de mama en la población de riesgo medio de 50-69 años, pero han reducido la fuerza de las recomendaciones (tabla 9). El PAPPS adoptó recomendaciones más restrictivas en 2012. No obstante, las actuales estrategias de cribado no discriminan entre las mujeres con bajo riesgo de cáncer de mama o con lesiones que pueden evolucionar lentamente de las que presentan tumores más agresivos. En este sentido, sería necesario individualizar el cribado de cáncer de mama según el riesgo individual de cada mujer, teniendo en cuenta la edad, los resultados de la mamografía según la clasificación BI- RADS (Breast Imaging Reporting and Data System) y la densidad de la mama (mayor riesgo de presentar “cáncer de intervalo” o falsos negativos en la mamografía)39. Actualmente, con la información disponible sería posible desarrollar programas que sean más coste-efectivos y estén mejor adaptados a las necesidades de la población diana susceptible de cribado de cáncer de mama; es decir, programas que maximicen los beneficios de la mamografía.
Resumen de las recomendaciones de la US Preventive Services Task Froce (USPSTF) y de la Canadian Task Force (CTF) para los cribados de cáncer
| Cáncer de mama | |
| USPSTF, 2016 | CTF, 2011 |
| • 50 a 74 años: mamografía cada 2 años (recomendación B) • 40 y 49 años: decisión individualizada. Las mujeres que otorgan un mayor valor al beneficio potencial que a los posibles daños pueden optar por comenzar el cribado bienal (recomendación C) • ≥ 75 años: evidencia insuficiente para evaluar balance de beneficios y riesgos • Mujeres con mamas densas: evidencia insuficiente para evaluar balance de beneficios y riesgos | • 40-49 años: no se recomienda cribado sistemático con mamografía (recomendación débil, evidencia de calidad moderada) • 50-69 años: se recomienda una mamografía cada 2 a 3 años (recomendación débil, evidencia de calidad moderada) • 70-74 años: se recomienda habitualmente el cribado con mamografía cada 2 a 3 años (recomendación débil, evidencia de baja calidad) |
| Cuello de útero | |
| USPSTF, borrador 2017 | CTF, 2011 |
| • 21 a 29 años: detección cada 3 años con citología (recomendación A) • 30 a 65 años: realizar exámenes de detección con citología cada 3 años, o cada 5 años con el test del VPH (recomendación A) • > 65 años: en contra del cribado (recomendación D) • < 21 años: en contra del cribado (recomendación D) • Mujeres que se han sometido a una histerectomía con extirpación del cuello uterino y que no tienen antecedentes de lesión precancerosa de alto grado (CIN2 o CIN3) o CCU: en contra del cribado (recomendación D) | • < 20 años: no se recomienda (recomendación fuerte, evidencia de alta calidad) • 20 a 24: años no se recomienda (recomendación débil, evidencia moderada) • 25 a 29 años: se recomienda el cribado cada 3 años (recomendación débil, evidencia moderada) • 30 a 69 años: se recomienda cada 3 años (recomendación fuerte, evidencia alta) • 70 años: correctamente cribadas y con resultados negativos (3 Papanicolaou en los últimos 10 años), se recomienda terminar los cribados. Para el resto de las mujeres de 70 años o más se recomienda continuar con cribado hasta que se hayan obtenido 3 resultados negativos (recomendación débil, evidencia baja) |
| Ovario | |
| USPSTF, 2017 | |
| • En contra del cribado (recomendación D) | — |
| Colorrectal | |
| USPSTF, 2017 | CTF, 2016 |
| • 50 a 75 años: cribado del CCR anual si SOH, cada10 años si colonoscopia y cada 5 para la sigmoidoscopia (recomendación A). Los riesgos y beneficios de las diferentes pruebas varían • 76 a 85 años: decisión individual, teniendo en cuenta la salud general del paciente y los resultados de los cribados previos (recomendación C) | • 50-59 años: se recomienda el cribado con SOH cada 2 años o sigmoidoscopia flexible cada 10 años (recomendación débil, evidencia moderada) • 60-74 años: se recomienda el cribado con SOH cada 2 años o sigmoidoscopia flexible cada 10 años (recomendación fuerte, pruebas moderadas) • ≥ 75 años: no se recomienda el cribado de CCR (recomendación débil, evidencia baja) • Se recomienda no usar la colonoscopia como prueba de cribado de CCR (recomendación débil, evidencia baja) |
| Próstata | |
| USPSTF, borrador 2017 | CTF, 2014 |
| • 50 a 69 años: recomienda que los médicos informen sobre los posibles beneficios y daños del cribado con PSA y que la decisión sea individualizada (recomendación C) • > 70 años: en contra del cribado (recomendación D) | • < 55 años: no se recomienda cribado de cáncer de próstata con PSA (recomendación fuerte, evidencia baja) • 55-69 años: no se recomienda cribado de cáncer de próstata con PSA (recomendación débil, evidencia moderada) • > 70 años: no se recomienda cribado de cáncer de próstata con PSA (recomendación fuerte, evidencia baja) |
| Pulmón | |
| USPSTF, 2013 | CTF, 2016 |
| • Cribado anual con TCBD en las personas de 55 a 80 años que han fumado 30 paquetes-año, que son fumadores en la actualidad o que han dejado de fumar en los últimos 15 años. Se excluye a las personas que no han fumado durante los últimos 15 años o que desarrollan un problema de salud que limita sustancialmente la esperanza de vida, o que no tienen la capacidad o la voluntad de someterse a un tratamiento quirúrgico de pulmón (recomendación B) | • 55-74 años, con una historia de tabaquismo de al menos 30 paquetes/año que fuman o dejaron de fumar hace menos de15 años: se recomienda el cribado anual con 3 TC consecutivas. Proyección solo debe llevarse a cabo en centros de atención de la salud especializados en el diagnóstico y tratamiento de cáncer de pulmón en estadio precoz (recomendación débil, evidencia baja) |
| Piel | |
| USPSTF, 2016 | |
| • Personas asintomáticas: evidencia insuficiente para evaluar el balance riesgo-beneficio del examen visual de la piel | — |
| Tiroides | |
| USPSTF, 2018 | |
| • En contra del cribado (recomendación D) | — |
CCR: cáncer colorrectal; CCU: cáncer de cuello uterino; SOH: sangre oculta en heces; TC: tomografía computarizada;
TCBD: tomografía computarizada de baja dosis; VPH: virus del papiloma humano.
Fuente: Canadian Tak Froce Guidelines. Disponible en: https://canadiantaskforce.ca/; US Preventive Srvice Task Force. Disponible en: https://www.uspreventiveservicestaskforce.org/
Los profesionales de AP deben proporcionar información objetiva y contrastada que permita a cada mujer tomar su propia decisión, en el sentido de participar o no en los programas de cribado. La información debería incluir aspectos como el sobrediagnóstico, el sobretratamiento y los falsos positivos. Se recomienda evaluar, además, el riesgo de cáncer de mama en función de la historia personal y familiar, y derivar a las pacientes de alto riesgo a las unidades de consejo genético.
- •
En las mujeres de 40 a 49 años, de riesgo medio, no debería recomendarse la mamografía de cribado (evidencia moderada, recomendación débil en contra)
- •
En las mujeres de 50 a 69 años, de riesgo medio, debería recomendarse la mamografía de cribado cada 2 años (evidencia moderada, recomendación débil a favor)
- •
En las mujeres de 70 a 74 años, de riesgo medio, debería recomendarse la mamografía de cribado cada 2 años (evidencia baja, recomendación débil a favor)
- •
Los profesionales de AP deben identificar a mujeres con riesgo elevado de cáncer de mama (antecedentes personales y/o familiares) o mujeres con antecedentes familiares de cáncer hereditario asociado a mutaciones BRCA, y derivarlas a centros especializados o a las unidades de consejo genético, o para la realización del test genético, asesoramiento y vigilancia específica
La incidencia y la mortalidad por cáncer de cuello de útero (CCU) en España son de las más bajas de Europa y del mundo, y existen algunas diferencias entre CC. AA.6. Se estima que en 2015 se diagnosticaron 2.399 nuevos vasos de CCU7 y ocurrieron 659 defunciones8 (tabla 1). El CCU es el décimo cáncer más frecuente entre las mujeres en España y el segundo cáncer más frecuente entre las mujeres de entre 15 y 44 años40. La supervivencia relativa a los 5 años estandarizada por edad de las pacientes diagnosticadas de CCU fue del 63,9%9 (tabla 2).
El VPH es el principal factor de riesgo de la práctica totalidad de los casos de CCU y de sus lesiones precursoras41. El VPH es una causa común de infección de transmisión sexual en varones y mujeres. Este virus también se transmite por la piel y las membranas mucosas y se asocia a los cánceres de ano, vulva, vagina, pene y faringe40.
Aproximadamente, el 80% de la población femenina está expuesta al VPH en algún momento de su vida, pero la infección suele ser transitoria y desaparece a los 12-24 meses; por tanto, es irrelevante desde el punto de vista oncogéni- co. El modelo de carcinogénesis está basado en la persistencia de la infección por VPH como elemento necesario para el desarrollo de lesiones precursoras, que si no se tratan pueden progresar a CCU41.
Se han identificado más de 200 genotipos del VPH, pero solo algunos de ellos, los denominados de alto riesgo (VPH- AR), se asocian con infecciones en el tracto genital y el desarrollo y progresión del CCU. En el ámbito mundial, los genotipos 16 y 18 explican el 63,1% de los CCU invasivos40, y otros 5 tipos (31, 33, 45, 52 y 58) explican un 20% adicional42. Conocer la distribución de los genotipos del VPH en el CCU invasivo es fundamental para guiar la introducción y evaluar el impacto de las vacunas profilácticas frente al VPH41.
La distribución geográfica de la prevalencia del VPH muestra un rango amplio de valores entre poblaciones, que van del 1,4 al 25,6%43. Las mujeres mayores de 30 años experimentan una clara disminución de la prevalencia. En España, la prevalencia de infección por VPH (carga de la enfermedad) se estima del 11,2% (IC del 95%, 10,5-11,9) en mujeres con citología normal y la prevalencia de infección de los genotipos 16 y 18 en las citologías se distribuye de la siguiente manera: en el 2,7% (IC del 95%, 2,3-3,2) de las citologías normales; en el 23,7% (IC del 95%, 21,9-25,5) de las lesiones de bajo grado; en el 46,3% (IC del 95%, 43,0-49,6) de las lesiones de alto grado, y en el 63,1% (IC del 95%, 60,665,5) de los CCU40.
La vacunación profiláctica frente a la infección por VPH es la forma más eficaz de prevenir el CCU, pero solo protege frente a los genotipos incluidos en ella y parcialmente frente a algunos VPH-AR (especialmente el 31, 33, 45 y 52) debido a la protección cruzada. En España, el programa de vacunación frente al VPH se inició el año 2007 y están aprobadas las vacunas de 2 serotipos (bivalente: 16 y 18), 4 serotipos (tetravalente: 6, 11, 16 y 18) y de 9 serotipos (nonavalente: 6, 11, 16, 18, 31, 33, 45, 52 y 58). El calendario de vacunación del Consejo Interterritorial del Sistema Nacional de Salud (última actualización para 2018) establece vacunar solo a las niñas con la administración de 2 dosis a los 12 años44 45. Las personas que ya han mantenido relaciones sexuales pueden vacunarse, pero la eficacia máxima de la vacuna se alcanza antes de la exposición, es decir, antes del inicio de relaciones sexuales. En España, un 24% de las adolescentes y un 19% de los adolescentes de 15 años han tenido relaciones sexuales. El rango de edad de inicio de las relaciones sexuales en los varones es de entre 17 y 18 años y en las mujeres, de entre 16,5 y 22,740.
A pesar de que el VPH es un factor necesario para el desarrollo y progresión del CCU, no es un factor suficiente. La respuesta inmunológica a la infección del VPH es un cofactor crucial en esta progresión (genotipos y variantes virales, carga viral, inmunosupresión)46. Otros cofactores que aumentan la probabilidad de padecer un CCU son el tabaco, la tasa de fertilidad o el uso prolongado de anticonceptivos orales40. Las infecciones cervicovaginales por Chlamydia y el virus del herpes simple también se consideran cofactores46 (tabla 3).
El consejo sobre tabaco, alcohol y protección en contactos sexuales disminuye el riesgo de lesiones precursoras y de CCU47. El preservativo reduce el riesgo de contagio del VPH, aunque solo lo evita en un 60-70% de los casos debido al contacto de zonas genitales no cubiertas o a su uso inadecuado. Se recomienda consejo sobre el uso correcto y constante del preservativo en los contactos sexuales47. El uso del preservativo evita embarazos y constituye una práctica sexual segura por su eficacia para prevenir otras enfermedades de transmisión sexual. Otro factor preventivo descrito es la circuncisión en varones, ya que esta práctica reduce la prevalencia de infección en el varón, acorta el tiempo de aclaramiento viral y paralelamente puede disminuir el riesgo de contagio en la mujer47.
A pesar de la introducción de la vacuna frente al VPH, el cribado de CCU sigue siendo importante por varias razones: las mujeres adultas no se han vacunado, la cobertura es incompleta, la vacuna no confiere una protección frente a todos los tipos oncogénicos de VPH y los posibles beneficios se obtendrán cuando las niñas actualmente vacunadas alcancen la edad adulta. No obstante, aunque no se ha realizado análisis posvacunación a largo plazo, para optimizar el cribado de CCU se deben tener en cuenta los cambios inducidos por esta vacuna48.
La larga fase preclínica de la infección por VPH desde la transformación del epitelio cervical hasta su invasión (1015 años) permite la identificación y tratamiento de las lesiones41. La citología cervical está avalada por los resultados de reducción de la mortalidad de los estudios observacionales49. A la mayoría de las mujeres con diagnóstico de CCU no se le había realizado una citología en los 5-10 años previos. La citología es una prueba de cribado sencilla, que permite determinar la presencia de células anormales en el cuello del útero. Su sensibilidad para la detección de lesiones de alto grado es del 47-62% y la especificidad, del 90%50. La evidencia directa para determinar la edad y el intervalo óptimos para el cribado es limitada. Entre los riesgos de este cribado cabe considerar la hemorragia, el dolor y la infección al realizar la citología, los tratamientos innecesarios de las lesiones que regresan, la conificación, que supone un mayor riesgo de partos prematuros y de nacimientos con bajo peso, la rotura prematura de membranas y la mortalidad perinatal, que se asocian a la extirpación electroquirúrgica de la lesión51.
El conocimiento del papel del VPH en el CCU y el desarrollo de las técnicas moleculares de amplificación genómica para la identificación del virus están cambiando las estrategias de este cribado. El test del VPH se ha utilizado para el cribado primario, el cotest (el test del VPH y la citología realizadas simultáneamente) y las pruebas de seguimiento de los resultados de las citologías positivas.
Las RS más recientes son las realizadas por la Cochrane52 y la USPSTF, publicadas en el 201753. La evidencia a partir de ECA sugiere que la detección mediante citología es discretamente menos sensible para detectar CIN2 y CIN3 (neoplasia cervical intraepitelial) que el test del VPH; sin embargo, la mayor detección de CIN2 y CIN3 implica realizar más colpos- copias diagnósticas52 53. Los modelos de análisis de decisión sugieren que el test del VPH cada 5 años en mujeres de 30 a 65 años, comparado con una citología cada 3 años, se traduce en una discreta reducción de la tasa de mortalidad (aproximadamente 10 años de vida ganados por cada 1.000 mujeres examinadas), pero con un aumento de las pruebas de seguimiento y colposcopia (en el caso de la citología, 39 colposcopias por cada caso de cáncer evitado, y en el del test del VPH, 640 colposcopias adicionales por caso adicional de cáncer evitado)54.
Tanto la evidencia a partir de los ECA como la modelización sugieren que el cotest aumenta las tasas de detección de CIN3+ en la ronda de cribado inicial, seguido de tasas más bajas en la segunda ronda, con el consiguiente aumento de falsos positivos, del número de pruebas de seguimiento y el consiguiente gasto de recursos. La modelización concluye que el cotest no ofrece ningún beneficio en términos de reducción de cáncer o años de vida ganados comparado con el test del VPH solo, pero aumenta el número de pruebas y procedimientos por cada caso evitado y no conduce a una mayor detección de CIN3+ (CIN3 y todos los cánceres invasivos) o CCU, en comparación con el test del VPH55.
Existen diferentes protocolos para la clasificación de los resultados positivos de la citología y/o test del VPH. Una RS (2 ECA) muestra que la determinación del VPH como prueba primaria y posterior triaje con citología tienen una tasa de detección significativamente superior a la citología sola, tanto en lesiones CIN2+ como en lesiones CIN3+56. Los diferentes protocolos de triaje generalmente tienen tasas de detección similares para CIN2 y CIN3 y conllevan menor número de colposcopias que si se realiza directamente colposcopia sin un protocolo de triaje previo55.
La prueba del VPH presenta una menor variabilidad en la interpretación de los resultados, ya que la lectura automatizada no presenta la subjetividad de la citología. Las muestras deben recogerse en medio líquido, lo cual posibilita, si fuera necesario, el estudio diferido para conocer la existencia de lesiones precursoras mediante citología réflex y evita tener que volver a citar a la paciente.
Actualmente, en España, el cribado de CCU es de tipo oportunista, excepto en Castilla y León, que es poblacional, y la organización y los protocolos competencia de cada CC. AA. son muy heterogéneos57. Un informe de evaluación de tecnologías sanitarias sobre el impacto del cribado de CCU56 concluía que la implantación de un programa de cribado poblacional de cáncer de cérvix puede reducir de forma significativa y relevante la incidencia y la mortalidad por cáncer de cérvix en relación con el cribado oportunista, si se realiza de forma organizada y con un correcto control de su calidad.
La Red de Programas de Cribado del Cáncer58 propone el test VPH-AR como prueba primaria de cribado. Para aumentar su especificidad, por una parte recomienda limitar su utilización en mujeres de 35 años o más y, por otra, realizar un triaje con citología a mujeres de 35 años o más con el test VPH-AR positivo, antes de su derivación a colposcopia. La utilización de este esquema permite aumentar el intervalo entre cribados en las mujeres VPH-AR negativas, que deberán someterse a un nuevo test VPH-AR en un plazo no inferior a 5 años.
La guía de consenso del cribado del CCU en España de 201457 consensuó las siguientes recomendaciones:
Mujeres < 25 años: no se recomienda ningún tipo de cribado.
Mujeres de 25 a 30 años que hayan iniciado actividad sexual: citología cada 3 años (no se debe realizar prueba del VPH-AR, dada la elevada prevalencia de infección por VPH clínicamente irrelevante y el riesgo de sobrediagnóstico y sobretratamiento de lesiones destinadas a regresar de forma espontánea).
Mujeres de 30 a 65 años: son válidas 3 opciones: a) continuar la citología cada 3 años; b) cotest (citología + prueba de detección del VPH), y c) prueba de detección del VPH cada 5 años (opción preferente). En este grupo de edad existe una menor prevalencia de infección por el VPH y mayor porcentaje de infección persistente, es decir, mayor riesgo e incidencia de lesiones precursoras de CCU.
El cribado finalizará a los 65 años, siempre que se den estas 2 condiciones: a) cribado previo adecuado y negativo (3 resultados citológicos consecutivos negativos, o bien 2 pruebas VPH negativas en los 10 años previos, el último en los 5 últimos años), y b) ausencia de antecedentes CIN o CCU tratado durante los 20 años previos.
Una vez finalizado el cribado, no debería retomarse por ningún motivo, incluso aunque la mujer refiera cambio de pareja sexual.
La diferencia entre las recomendaciones de la guía de cribado del CCU57 y la Red de Programas de Cribado del Cáncer58 está en la edad de inicio de la prueba del VPH. La guía avanza esta prueba a los 30 años mientras que la Red de Programas de Cribado la sitúa en 35 años. La IARC recomienda el cribado con prueba del VPH también a partir de los 35 años56. La USPSTF55 y la CTF59 (tabla 9) recomiendan la prueba del VPH a partir de los 30 años.
Los profesionales de AP tienen un papel fundamental en promocionar la participación en el cribado, especialmente en las mujeres con mayor riesgo o cribado inadecuado.
- •
Los profesionales de AP deben proporcionar consejo sobre protección en los contactos sexuales (evidencia moderada, recomendación fuerte a favor)
- •
En mujeres menores de 25 años, no se recomienda el cribado (evidencia moderada, recomendación fuerte a favor)
- •
En mujeres asintomáticas de 25 a 30/35 años se recomienda la citología de cribado cada 3 años (evidencia alta, recomendación fuerte a favor)
- •
En mujeres asintomáticas de 30/35 a 65 años se recomienda la prueba del VPH cada 5 años (evidencia moderada, recomendación fuerte a favor) o la citología de cribado cada 3 años (nivel de evidencia moderada, recomendación débil a favor)
- •
El cribado finalizará a los 65 años, siempre que exista un cribado previo adecuado y negativo (10 años) y no haya antecedentes de CIN o CCU (20 años) (nivel de evidencia moderada, recomendación fuerte a favor)
- •
No se realizará cribado en mujeres que no han tenido relaciones sexuales ni en mujeres que han tenido una histerectomía con extirpación del cuello de útero (nivel de evidencia moderada, recomendación fuerte a favor)
- •
Los profesionales de AP deben realizar una búsqueda activa dirigida a aumentar la participación de la población diana, con especial énfasis en la población con mayor riesgo
El cáncer de endometrio es el cáncer ginecológico más frecuente. En España se estima que en 2015 se diagnosticaron 6.160 casos de cáncer de endometrio7 y fallecieron 1.168 mujeres por esta causa8 (tabla 1). Las tasas de supervivencia a 1 y 5 años son altas (el 89 y el 74,4%, respectivamente)9 (tabla 2), ya que en el 85% de los casos el cáncer de endometrio se diagnostica en estadio temprano.
La edad de presentación se sitúa en torno a los 60 años. Los principales factores de riesgo conocidos son el uso prolongado de la terapia estrogénica sin oposición con proges- tágenos, la hiperplasia endometrial, el síndrome del ovario poliquístico, la obesidad, la diabetes mellitus tipo 2, el tratamiento con tamoxifeno tras cáncer de mama y pertenecer a una familia con síndrome de Lynch (cáncer colorrectal hereditario no polipósico)60 (tabla 3).
En mujeres asintomáticas, ninguna prueba de cribado (examen pélvico, citología, ecografía, biopsia) ha demostrado tener impacto sobre la reducción de la mortalidad por cáncer de endometrio61. La mejor estrategia de detección precoz es dar consejo a las mujeres posmenopáusicas, especialmente si tienen factores de riesgo, para que consulten ante cualquier hemorragia vaginal, dado que este signo está presente en el 75-90% de los casos de cáncer de endometrio62 (tabla 3).
En las mujeres con síndrome de Lynch, aunque no se ha establecido claramente su utilidad, los expertos recomiendan exploración pélvica, ecografía transvaginal (ETV), CA125 y biopsia/aspirado endometrial con periodicidad anual, desde los 30 a los 35 años (o 5-10 años antes de la edad del familiar más joven diagnosticado de cáncer).
- •
En las mujeres de riesgo medio asintomáticas, no se debe recomendar el cribado de cáncer de endome- trio (evidencia moderada, recomendación fuerte en contra)
- •
Los profesionales de AP deben realizar consejo apropiado a las mujeres posmenopáusicas, especialmente a aquellas con riesgo elevado de cáncer de endometrio, para que consulten ante cualquier hemorragia vaginal
El cáncer de ovario, pese a su baja incidencia, es la segunda causa de muerte por cáncer ginecológico. En España se estima que en 2015 se diagnosticaron 3.228 casos de cáncer de ovario7 y fallecieron 2.114 mujeres por este cáncer8 (tabla 1). La supervivencia del cáncer de ovario es la más baja de los cánceres ginecológicos, siendo a 1 año del 69,6% y a los 5 años del 36,8% (tabla 2)9. La supervivencia está relacionada con el tipo de tumor y el estadio en el momento del diagnóstico (más del 70% se diagnostica en estadios avanzados).
El 90% de los tumores ováricos malignos se origina en el epitelio (carcinomas). Actualmente, se considera que existen 2 tipos de carcinomas ováricos, el tipo I y el tipo II, con perfiles moleculares diferentes y, probablemente, con estrategias de prevención diferentes63. El tipo I (30%) lo constituyen los carcinomas endometrioides, de células claras, mucinosos y serosos de bajo grado. Se forman secuencial- mente a partir de lesiones precursoras, presentan mutaciones en los genes KRAS, BRAF, PIK3CA, CTNNB, PPP2R1A y BCL2, son de crecimiento lento, generalmente están confinados al ovario y tienen pobre respuesta a la quimioterapia. El tipo II (70%) está formado, casi exclusivamente, por el carcinoma seroso de alto grado (incluye los originados en las trompas y en el peritoneo), es el tumor ovárico más común y el más letal. Con frecuencia, las mujeres que lo presentan tienen la mutación BRCA, las células del epitelio tubárico de las fimbrias adquieren la mutación p53, aparecen cambios displásicos y posteriormente se transforma en carcinoma invasivo. Generalmente son bilaterales, crecen y se diseminan rápidamente al peritoneo, responden bien a la quimioterapia, pero la recurrencia es frecuente63.
Tener más de 50 años es un factor de riesgo para el cáncer de ovario, pero se considera riesgo elevado la presencia de antecedentes personales y familiares de cáncer y la identificación de los portadores de la mutación en las familias con predisposición hereditaria al cáncer. Los factores hormonales y reproductivos y los factores relacionados con el estilo de vida tienen un valor limitado para la clasificación del riesgo individual.
En cuanto a la prevención secundaria, el estudio PLCO Cancer Screening Trial de Estados Unidos confirma, tras 15 años de seguimiento64, que no existen diferencias en la mortalidad de las mujeres posmenopáusicas de riesgo medio cribadas con ETV y el marcador CA125 anual respecto a las no cribadas. Al contrario, en el grupo de cribado aumenta el riesgo de cirugías innecesarias. Por otro lado, los resultados publicados en 2016 sobre el cribado multimodal del estudio UKCTOCS de Reino Unido, consistente en incorporar mediciones longitudinales de CA-125 a un algoritmo ROC (Risk of Ovarian Cancer Algorithm [ROCA]) y, posteriormente, seleccionar las candi- datas a la ETV, mostraron una distribución por estadios más favorables y una tendencia a la reducción de la mortalidad. Una reciente publicación señala que esta estrategia permitiría reducir la mortalidad entre un 6 y un 9%, pero no es coste- efectiva en población sin riesgo elevado65.
Las recomendaciones del cribado del cáncer de ovario de la USPSTF, recientemente actualizadas, y sobre la base de que los daños de este cribado superan los posibles beneficios, se posicionan en contra del cribado en mujeres asin- tomáticas sin riesgo elevado de cáncer hereditario conocido (recomendación D)66 (tabla 9).
Las mujeres con una predisposición genética conocida para el cáncer de mama (mutaciones BRCA1 o BRCA2) deben ser remitidas a las unidades de consejo genético y recibir consejo sobre las diversas opciones preventivas30 (tabla 8).
En ausencia de riesgo elevado de cáncer de ovario hereditario, la detección precoz pasa necesariamente por la identificación de los síntomas y signos iniciales de la enfermedad. Diferentes estudios han demostrado que el 85-90% de las mujeres diagnosticadas de cáncer de ovario presentan algún síntoma, predominantemente de tipo gastrointestinal o genitourinario varios meses antes del diagnóstico. En mujeres, sobre todo posmenopáusicas, con síntomas inespecíficos ab- dominopélvicos o genitourinarios, persistentes o recurrentes no justificados, se requerirá examen pélvico, determinación de CA-125 y ETV (tabla 4).
- •
En las mujeres asintomáticas y sin riesgo elevado de cáncer de ovario, no se debe recomendar el cribado de cáncer de ovario (evidencia moderada, recomendación fuerte en contra)
- •
Las mujeres con antecedentes familiares de cáncer hereditario asociado a mutaciones BRCA deben ser derivadas a una unidad de consejo genético para realización del test genético, asesoramiento y vigilancia específica
En España se estima que en 2015 se diagnosticaron 24.764 nuevos CCR en varones y 16.677 en mujeres7, con una tendencia creciente hasta mediados de la década de 1990, especialmente en los varones, y se produjeron 9.085 defunciones en varones y 6.279 en mujeres8. La supervivencia relativa a 5 años en pacientes diagnosticados en el período de 2000-2007 fue del 56,6% en varones y del 58,1% en mujeres9. La reducción de las tasas de mortalidad y la mayor supervivencia del CCR observada en los últimos años se atribuyen a su identificación en fases más tempranas, favorecida por la extensión del cribado asociado a las mejoras en el tratamiento de la enfermedad. El cribado del CCR permite además identificar y tratar la lesión precursora, el pólipo adenomatoso, impidiendo su potencial progresión a cáncer67.
Las características que confieren un riesgo elevado de CCR son la historia personal o familiar de CCR o pólipos adenomatosos de riesgo (tamaño ≥ 10 mm, vellosos, displa- sia grave o múltiples ≥ 3), así como los síndromes hereditarios (poliposis adenomatosa familiar, CCR hereditario no asociado a poliposis, CCR familiar), las enfermedades relacionadas con el CCR (enfermedad inflamatoria intestinal de larga evolución o afectación colorrectal extensa) o la exposición a radiación abdominal durante la infancia. La identificación, cribado y vigilancia de las personas con riesgo elevado debe considerarse prioritaria en la prevención del CCR. La Guía de Práctica Clínica del semFYC y la Asociación Española de Gastroenterología (AEG) proponen actuaciones de seguimiento específicas en los pacientes con pólipos68 (tabla 10).
Seguimiento pospolipectomía de adenomas o pólipos serrados colorrectales
| Lesión precursora CCR | Intervalo de seguimiento pospolipectomía | |
|---|---|---|
| Primera colonoscopia | Colonoscopias sucesivas | |
| Adenoma tubular, número 1-2, tamaño < 10 mm y displasia bajo grado | 5 años | 5 años (si adenoma[s] de similares características) 10 años (si ausencia de adenomas) |
| Adenoma, número 3-4, o tamaño 10-19 mm, o componente velloso, o displasia alto grado | 3 años | 3 años (si adenoma[s] de similares características) 5 años (si ausencia de adenomas) |
| Adenoma, número ≥ 5, o al menos uno de tamaño ≥ 20 mm | 1 año | 1 año (si adenoma[s] de similares características) 3 años (si ausencia de adenomas) |
| Adenoma con resección incompleta Pólipo resecado, pero no recuperado | 3-6 meses | Según hallazgos Igual que adenoma, intervalo de vigilancia según tamaño |
| Pólipo hiperplásico < 10 mm en recto o sigma Pólipo serrado (hiperplásico, serrado sésil) proximal a rectosigma, < 10 mm, sin displasia | No necesaria 5 años (si pólipo[s] de similares características) 10 años (si ausencia de pólipos) | |
| Pólipo serrado con displasia (serrado sésil con displasia, serrado tradicional) proximal a recto-sigma, o tamaño ≥ 10 mm, o número ≥ 3 | 3 años | 3 años (si pólipo[s] de similares características) |
| Pólipo serrado con resección incompleta | 3-6 meses | 5 años (si ausencia de pólipos) Según hallazgos |
CCR: cáncer colorrectal.
Fuente: referencia 68.
Las mujeres y varones de 50 años o más sin factores de riesgo específicos de CCR presentan un riesgo medio de desarrollar CCR. En estas personas, el cribado es eficaz para reducir la mortalidad del CCR y es coste-efectivo con respecto a no realizarlo69. Las pruebas de cribado con evidencias consistentes de mayor calidad son la sangre oculta en heces, con guayaco (SOHg) o inmunológica (SOHi), y la sigmoidoscopia (SG), mientras que la colonoscopia es la prueba de elección para la confirmación diagnóstica.
La RS de la CTF70, publicada en 2016 con metaanálisis de 4 ECA de moderada calidad, muestra que el cribado con SOHg reduce la mortalidad por CCR en un 18% (RR: 0,82; IC del 95%, 0,73-0,92), pero no disminuye la mortalidad por todas las causas. Resulta necesario cribar a 337 personas (IC del 95%, 249-887) durante una mediana de 18 años para evitar una muerte por CCR. La reducción de mortalidad no es significati-va en el grupo de personas de 45 a 59 años (RR: 0,96; IC del 95%, 0,85-1,10), ni a partir de los 70 años (RR: 0,66; IC del 95%, 0,35-1,26). La reducción relativa de la incidencia del CCR avanzado es de un 8% (RR: 0,92; IC del 95%, 0,85-0,98), de manera que se evita un nuevo caso de CCR cada 876 personas cribadas (IC del 95%, 496-5.051).
La RS de la USPSTF71 sintetiza resultados de 5 ECA sobre eficacia del cribado con SOHg anual o bienal, con períodos de seguimiento de entre 11 y 30 años. La reducción de mortalidad por CCR se mantiene tras múltiples rondas de cribado bienal, tanto a los 20 años (RR: 0,91; IC del 95%, 0,84-0,98) como a los 30 años (RR: 0,78; IC del 95%, 0,650,93). Sin embargo, no se observa reducción de la incidencia de CCR (RR: 1,02; IC del 95%, 0,93-1,12).
La RS Cochrane72, actualizada en 2013, muestra resultados similares, con una reducción de mortalidad por CCR del 13% (RR: 0,87; IC del 95%, 0,82-0,92) y sin efecto beneficioso sobre la mortalidad global (RR: 1,00; IC del 95%, 0,99-1,01).
No existen ECA bien diseñados que prueben la eficacia del test de SOHi, pero los estudios de tendencia temporal en zonas geográficas donde se ha implementado el cribado apoyan su efectividad. Un estudio observacional realizado en la región de Véneto (Italia) entre 1995 y 2011 muestra una reducción del 22% de la mortalidad por CCR en las poblaciones cribadas con SOHi bienal, respecto a la población no cribada73.
La relación entre el beneficio y los riesgos del cribado con SOHi es favorable. Las pruebas de SOH carecen de efectos adversos directos graves. Los riesgos vienen determinados por las consecuencias de los resultados falsos negativos (adenomas no detectados y CCR de intervalo) y falsos positivos (efectos adversos graves de la colonoscopia de confirmación diagnóstica), con una tasa de 8 perforaciones (IC del 95%, 2-32) y 1,9 hemorragias graves (IC del 95%, 5-64) cada 10.000 colonoscopias. Asumiendo un 5% de positividad del test de SOH y un 100% de cumplimiento con la colonoscopia, se producirán de 1 a 16 perforaciones y de 2 a 32 hemorragias graves cada 100.000 personas cribadas71.
El cribado con SG flexible disminuye la incidencia y mortalidad del CCR, con resultados consistentes entre RS. Para su realización se dispone de endoscopios cortos que alcanzan hasta los 60 cm del margen anal o también puede realizarse con el tubo de colonoscopia. Requiere limpieza del colon, pero se realiza sin sedación.
En la RS de la USPSTF71, el análisis combinado de 4 ECA que incluyen 458.002 personas muestra una reducción de la mortalidad por CCR del 27% (RR: 0,73; IC del 95%, 0,66-0,82) y de la incidencia del 21% (RR: 0,79; IC del 95%, 0,75-0,85), después de 11 a 12 años de seguimiento. En ambos casos, el beneficio se limita al CCR de localización distal. El único ECA que realiza cribado periódico con SG (PLCO de Estados Unidos)74 obtiene una reducción de la mortalidad por CCR del 26% (RR: 0,74; IC del 95%, 0,63-0,87). El cribado con SG no disminuye la mortalidad por cualquier causa (RR: 1,0; IC del 95%, 0,94-1,06).
La RS de la CTF70 ofrece una reducción de mortalidad por CCR de magnitud similar (RR: 0,72; IC del 95%, 0,65-0,81), y para prevenir una muerte por CCR es necesario cribar con SG a 850 personas (IC del 95%, 673-1.205). La reducción de mortalidad por cualquier causa no es significativa (RR: 0,99; IC del 95%, 0,97-1,01). La disminución de la incidencia de CCR es del 25% (RR: 0,75; IC del 95%, 0,66-0,86) y es necesario cribar a 577 personas (IC del 95%, 422-989) para evitar un nuevo caso de CCR avanzado. Esta RS concluye que la eficacia de la SG de cribado es superior en los individuos de más de 60 años con respecto a edades inferiores, de manera que es necesario cribar a 343 (IC del 95%, 267-503) personas de 60 años o más para evitar una muerte por CCR, frente a los 1.853 (IC del 95%, 1.441-2.713) individuos de menos de 60 años. En el análisis por grupos etarios del ECA PLCO se observa que la mortalidad por CCR se reduce significativamente en las personas de 65 a 74 años (RR: 0,65; IC del 95%, 0,52-0,82), pero no en las de 55 a 64 años (RR: 0,84; IC del 95%, 0,67-1,06), probablemente por la menor incidencia de CCR en esta franja de edad74.
En la RS Cochrane de 2013, la comparación indirecta del cribado entre SG y SOH no muestra diferencias significativas sobre la mortalidad por CCR (RR: 0,85; IC del 95%, 0,72-1,01), pero la SG aporta un beneficio de mayor magnitud cuando se compara con SOH bienal (RR: 0,81; IC del 95%, 0,70-0,96)75.
Los riesgos asociados a la SG son superiores a los de la SOH, pero muy inferiores a los de la colonoscopia de cribado o diagnóstica. Las RS le atribuyen unas tasas cada 10.000 personas cribadas de 0,15 muertes (IC del 95%, 0,07-0,32), 0,1 perforaciones (IC del 95%, 0-0,3) y entre 0,93 y 5 hemorragias graves (IC del 95%, 0,4-1,5 e IC del 95%, 2,5-7,4, con y sin ingreso hospitalario, respectivamente). En las personas con SG patológica se añaden los riesgos de la colonoscopia de confirmación diagnóstica, en torno a 14 perforaciones (IC del 95%, 9-26) y 34 hemorragias graves (IC del 95%, 5-63) cada 10.000 colonoscopias70.
El cribado mediante SG tiene un efecto protector que se prolonga hasta 12 años70 71 75. Si se minimiza el riesgo de falsos negativos mediante la inserción del endoscopio por encima de los 40 cm —la prueba se realiza por un endoscopista experimentado y con una adecuada preparación intestinal—, se podría justificar un intervalo de 10 años entre SG de cribado76,77. La realización de una única SG a los 6065 años es otra opción de cribado de CCR, dado que consigue beneficio de reducción de mortalidad en 3 de los 4 ECA disponibles. No se dispone de evidencias sobre el cribado mediante SG en personas mayores de 74 años70,71.
La colonoscopia de cribado carece de evidencias directas de su efecto sobre la incidencia y mortalidad del CCR. Los ECA en marcha evalúan su eficacia en el cribado poblacional frente a no cribado (NordICC, multicéntrico europeo) o en comparación con SOHi (COLONPREV, España; SCREESCO, Suecia; CONFIRM, Estados Unidos), pero no han publicado resultados finales. Los resultados intermedios de COLONPREV muestran que la tasa de detección de CCR es similar con co- lonoscopia y SOHi, aunque la colonoscopia identifica más adenomas avanzados78. En la actualidad, la colonsocopia es la prueba de cribado de CCR menos aceptada, más costosa, menos disponible en nuestro entorno por las listas de espera y la que expone a más riesgos, además de requerir limpieza de colon y sedación, lo que puede determinar una relación coste-efectividad menos favorable que con SOH o SG.
La USPSTF79 y la CTF recomiendan el cribado CCR en la población de riesgo medio de 50-69 años (tabla 9).
En nuestro entorno, el cribado del CCR con SOH está incluido en la cartera de servicios del SNS19, por lo que las CC. AA. han implementado progresivamente el cribado poblacional mediante programas organizados que utilizan la prueba de SOHi, con el objetivo de cubrir a la totalidad de la población de 50 a 69 años19. Sin embargo, es preciso avanzar hacia una mayor cobertura de la población diana con participación superior al 60% para conseguir impacto poblacional sobre la mortalidad por CCR, con un coste-efectividad favorable80, equilibrando el efecto del sobrediagnóstico que conlleva este cribado. En este sentido, diferentes estrategias han probado su eficacia en el fomento de la participación, como el envío del test de SOH por correo postal tras la carta de invitación, junto con la implicación de AP en todo el proceso de comunicación a la población, recepción de muestras, indicación de la colonoscopia y seguimiento posterior. Por otra parte, la aplicación de técnicas de modelización en los programas poblacionales podría favorecer la monitorización de estos resultados y la corrección de sus desvíos a través de estrategias de optimización del cribado, tales como la modificación del punto de corte de positividad del SOHi o la diferenciación de estrategias de cribado por subgrupo de edad y sexo81-83.
- •
En las personas de 60 a 74 años, sin riesgo alto, debe recomendarse la SOH con el test inmunológico como prueba de cribado del CCR, con periodicidad bienal (evidencia moderada, recomendación fuerte a favor) o SG cada 10 años si está disponible (evidencia moderada, recomendación fuerte a favor)
- •
En las personas de 50 a 59 años, sin riesgo alto, debe recomendarse la SOH con el test inmunológico como prueba de cribado del CCR, con periodicidad bienal (evidencia moderada, recomendación débil a favor) o SG cada 10 años si está disponible (evidencia moderada, recomendación débil a favor)
- •
No se recomienda la colonoscopia como prueba de cribado del CCR (evidencia baja, recomendación débil en contra)
- •
Los profesionales de AP deben identificar a las personas con riesgo elevado de CCR (sospecha de CCR hereditario y familiar) y derivarlas a las unidades especializadas
- •
Los profesionales de AP deben facilitar el cumplimiento de las recomendaciones de las colonoscopias de seguimiento de los pólipos
SG: sigmoidoscopia; SOH: sangre oculta en heces.
El cáncer de próstata es el tumor más frecuente en los varones de los países occidentales. En España se estima que en 2015 se diagnosticaron un total de 33.370 nuevos casos de cáncer7. Las tasas de incidencia aumentaron de forma importante desde 1993 a 20077. Esta tendencia significa un cambio porcentual para el período 1995-2005 del 116,3% y, para el período 2005-2015, del 31,4%7. La proyección de las tasas de incidencia hasta 2015 podría verse muy afectada por los cambios en el uso del antígeno prostático específico (PSA) y su saturación, como ha sucedido en otros países7. La mortalidad por cáncer de próstata fue de 5.746 casos el año 20158. La supervivencia relativa a 5 años se estima por encima de un 84,5%9 (tabla 2).
La edad es el principal factor de riesgo del cáncer de próstata84. Asimismo, tener una historia familiar de cáncer de próstata u otros cánceres y factores genéticos, como mu- taciones en genes que reparan el ADN como el BRCA2, parece jugar un papel importante en ciertos cánceres de próstata y se han asociado con una mayor agresividad85. Otros factores relacionados con la dieta, los valores hormonales, la obesidad y el sedentarismo se asocian al cáncer de próstata, aunque su efecto parece más limitado84 (tabla 3).
Generalmente, los cánceres de próstata evolucionan lentamente y los síntomas se presentan en las etapas avanzadas de la enfermedad86,87 (tabla 6). Actualmente, la mayoría de cánceres de próstata se diagnostican a partir del cribado oportunista en la etapa presintomática, mediante la determinación del PSA. No obstante, el PSA carece de la sensibilidad y la especificidad necesarias para la detección precoz del cáncer de próstata y no ayuda a distinguir entre tumores de lento y de rápido crecimiento86. Asimismo, otras patologías benignas (hipertrofia benigna de próstata, prostatitis) pueden presentar valores de PSA en un rango de 4 a 10 ng/ml y, por otro lado, unos valores por debajo de 4 ng/ml no garantizan la ausencia de cáncer de próstata86.
El cribado poblacional del cáncer de próstata mediante la determinación del PSA ha sido y es motivo de controversia y la relación beneficio-riesgo de este cribado, como concluyen las diversas revisiones sistemáticas disponibles, no está claramente establecida Sin embargo, la facilidad de la determinación del PSA a partir de una muestra sanguínea ha facilitado la amplia utilización de este test en las consultas de AP y AE.
El ECA European Randomized Study of Screening for Prostate Cancer (ERSPC) ha mostrado una reducción de la mortalidad en el subgrupo de 55 a 69 años del 21% (RR: 0,79; IC del 95%, 0,69-0,91) a los 13 años de seguimiento88 y el US Prostate, Lung, Colorectal and Ovarian (PLCO) Screening Trial89, por el contrario, no.
La RS más reciente de la USPSTF90 muestra que los beneficios del cribado con PSA reducen las probabilidades de morir por cáncer de próstata. Estiman que por cada 1.000 varones de entre 55 y 69 años cribados, pueden evitar morir de cáncer de próstata entre 1 y 2 varones en un período de 10 a 15 años. Además, 3 varones de cada 1.000 a los que se les ofrece el cribado pueden evitar tener una enfermedad me- tastásica (RR: 0,70; IC del 95%, 0,60-0,82). Pese a todo, la magnitud del beneficio es pequeño: 6 de cada 1.000 varones > 55 años que eligen no realizar cribado morirán por este cáncer en los siguientes 10-15 años, frente a 5 de los 1.000 que eligen hacerlo. Debido a que el cáncer de próstata a menudo crece lentamente, generalmente transcurrirán años, incluso más de una década, para observar los beneficios de la detección después del diagnóstico y el tratamiento.
Por contra, el sobrediagnóstico y el sobretratamiento de este cribado no son despreciables90. Por cada 1.000 varones cribados, 250 tendrán un resultado positivo que les llevará a una posible biopsia con los posibles aspectos de dolor, hemorragia e infección, y 100 se diagnosticarán de un cáncer de próstata, de los que 65 se tratarán con cirugía o radioterapia al inicio y 15 más tardíamente, por progresión de la enfermedad tras vigilancia activa. El 75% de los tratados presentará impotencia o incontinencia90.
La observación o seguimiento activo como nueva aproximación de tratamiento, especialmente en personas de edad avanzada sin síntomas prostáticos, contrarresta el sobretratamiento que conlleva el tratamiento activo de muchos cánceres de próstata indolentes que se detectan a través del cribado. En este sentido, recientemente se han publicado los resultados a los 10 años de seguimiento del ensayo clínico PROTECT91, realizado en Estados Unidos, y a los 19,5 años de seguimiento del ensayo clínico PIVOT92, realizado en Reino Unido.
En el estudio PROTECT91 se comparó la monitorización activa (PSA) frente a la prostatectomía y la radioterapia, y los resultados mostraron que la mortalidad específica por cáncer de próstata fue baja, sin diferencias significativas entre los tratamientos. Tampoco hubo diferencias en la mortalidad global. Sin embargo, la progresión clínica de la enfermedad y la incidencia de metástasis fue mayor en el grupo de monitorización activa (22,9 y 6,3 casos por 1.000 personas-año) que en el de cirugía (8,9 y 2,4 casos por 1.000 personas-año) y en el de radioterapia (9 y 3 casos por 1.000 personas-año). El 55% de los varones del grupo de monitori- zación activa se sometió a lo largo de los 10 años a una intervención (prostatectomía, radioterapia, braquiterapia).
En el estudio PIVOT92 se comparó la observación frente a la prostatectomía y tampoco se observaron diferencias significativas en la mortalidad, excepto en la mortalidad por todas las causas de los tumores de riesgo intermedio (RR: 0,8; IC del 95%, 0,67-0,96). El 20,4% de los varones asignados a la observación se sometió a un tratamiento definitivo, aunque en la mayoría de los casos fue por progresión local (y de ellos, la mitad asintomática). Asimismo, la disfunción eréctil (RR: 2,77; IC del 95%, 1,65-4,63) y la incontinencia (RR: 4,22; IC del 95%, 2,44-7,30) fueron significativamente mayores en el grupo de prostatectomía radical.
La CTF no recomienda el cribado de cáncer de próstata. La USPSTF modifica las recomendaciones de 2012 en contra del cribado (recomendación D) y propone unas recomendaciones informadas e individualizadas (recomendación D) (tabla 9).
Los profesionales de AP deben tener en cuenta esta evidencia, compartir con el paciente el balance entre los riesgos y beneficios de la solicitud de PSA como prueba de cribado y favorecer que el paciente tome una decisión personal de acuerdo a sus preferencias.
En esta línea, otras sociedades como la American Cancer Society y el American College of Physicians no recomiendan el cribado en varones de riesgo medio, < 50 años o con una expectativa de vida < 10-15 años e insisten en la necesidad de que los varones > 50 años y expectativa de vida > 10 años sean informados por sus médicos de las incertidumbres, riesgos y potenciales beneficios del cribado de cáncer de próstata antes de tomar una decisión. En los grupos de alto riesgo, el diálogo médico-paciente para facilitar la toma de decisiones está todavía más justificado y la información debería darse antes de los 50 años.
- •
La determinación del PSA no debería recomendarse como prueba de cribado del cáncer de próstata en población asintomática, entre 55 y 69 años, de riesgo medio (evidencia moderada, recomendación débil en contra)
- •
La determinación del PSA no debe recomendarse como prueba de cribado del cáncer de próstata en población asintomática, en menores de 55 y mayores de 69 años, de riesgo medio (evidencia baja, recomendación fuerte en contra)
- •
No se ofrecerá la realización de PSA a la población asintomática de forma activa. Si la persona lo solicita como prueba de cribado será necesario informar sobre el balance entre los riesgos y beneficios
En España se estima que en 2015 se diagnosticaron un total de 28.347 nuevos casos de cáncer de pulmón (22.430 en varones y 5.917 en mujeres), incidencia estabilizada en varones y con importante aumento entre las mujeres7, y ocurrieron 21.579 defunciones (17.229 en varones y 4.350 en mujeres)8 (tabla 1). La supervivencia relativa a 5 años estandarizada por edad de los pacientes diagnosticadas de CCU fue del 10,1% en varones y del 14,7% en mujeres9 (tabla 2).
El tabaco es el principal factor de riesgo de cáncer de pulmón y es el responsable del 80% de los casos, y probablemente mayor para el cáncer de pulmón microcítico. La evolución de la tendencia del tabaquismo en España indica que todavía una importante proporción de la población es fumadora19. El consejo claro y personalizado para dejar de fumar y evitar el inicio del hábito tabáquico entre los jóvenes es la estrategia más efectiva para reducir la incidencia y mortalidad por cáncer de pulmón (prevención primaria)14. Las políticas de salud deben ir dirigidas a reforzar el abandono del hábito tabáquico19
La exposición al radón (gas radiactivo que se produce de forma natural cuando se descompone el uranio en el suelo y las rocas) es la segunda causa principal de cáncer de pulmón, y es la causa principal entre los no fumadores.
El cribado mediante la radiografía de tórax (RR: 0,99; IC del 95%, 0,91 -1,07) y la radiografía de tórax más citología de esputo (RR: 0,88; IC del 95%, 0,74-1,03) no ha demostrado reducción de la mortalidad por cáncer de pulmón93. Actualmente, y a partir de los resultados del North American NLST (National Lung Screening Trial)94, el cribado de cáncer de pulmón ha supuesto un cambio de paradigma a favor de la tomografía computarizada de baja dosis de radiación (TCBD). Sin embargo, es un cribado controvertido.
La RS Cochrane concluye que el cribado de cáncer de pulmón con TCBD reduce la mortalidad por cáncer de pulmón de forma significativa (RR: 0,80; IC del 95%, 0,70-0,92), pero es necesario investigar sobre su coste-efectividad y los beneficios y riesgos del cribado en diferentes grupos de edad y de riesgo93. La RS de la USPSTF concluye que el cribado con TCBD disminuye de forma significativa la mortalidad por cáncer de pulmón, pero que se necesitan más investigaciones que permitan identificar a las personas con mayor riesgo de cáncer de pulmón y, en consecuencia, disminuir los diagnósticos falsos positivos del cribado95. La RS de la CTF va en la misma dirección: el cribado con TCBD puede reducir la mortalidad por cáncer de pulmón en pacientes con alto riesgo, pero existen potenciales riesgos relacionados con la detección y seguimiento de las pruebas invasivas96. Una RS que analiza el coste-efectividad de este cribado concluye que este depende en gran medida de identificar apropiadamente a la población diana97.
La RS más reciente publicada por el American College of Chest Physicians98 incluye 10 ECA (North American NLST, Detection and Screening of Early Lung Cancer by Novel Imaging Technology and Molecular Essays Trial [DANTE], Danish Lung Cancer Screening Trial [DLCST], Depiscan Study [Francia], Italian Lung Cancer Screening Trial [ITALUNG], Lung Screening Study [LUSI], German Lung Cancer Screening Intervention Trial, Multi-centric Italian Lung Detection Trial [MILD], Neder- lands-Leuvens Longkanker Screenings [NELSON], Onderzoek Study y United Kingdom Lung Screening Study [UKLS]) y 13 estudios de cohortes. Esta revisión concluye que el cribado con TCBD para cáncer de pulmón muestra un balance beneficio- riesgo favorable, pero muy discreto, muy tenue, balance que se ve afectado por el riesgo basal del paciente, la calidad de las imágenes y su interpretación y la efectividad de las intervenciones para dejar de fumar98. Los autores señalan que se necesitan más investigaciones para optimizar este cribado.
Todas las revisiones señalan que el método más importante para reducir la mortalidad por cáncer de pulmón es dejar de fumar.
Las recomendaciones de la USPSTF y de la CTF se describen en la tabla 9. El American College of Chest Physicians, para fumadores asintomáticos y exfumadores de 55 a 77 años que han fumado 30 paquetes-año o más y continúen fumando o hayan dejado de fumar en los últimos 15 años, sugiere que se les ofrezca cribado anual con TCBD (recomendación débil, evidencia moderada). Otras sociedades americanas, entre ellas la American Thoracic Society, la American Society of Clinical Oncology y la National Comprehensive Cancer Network, abogan por este cribado99.
Los organismos europeos se preguntan si los servicios nacionales de salud deben seguir el ejemplo de las recomendaciones americanas. La respuesta va en la línea de la revisión Cochrane y, de momento, parece razonable posponer el cribado sistemático del cáncer de pulmón en individuos asintomáticos100. A pesar de los resultados favorables en cuanto a la disminución de la mortalidad, los potenciales daños del cribado del cáncer de pulmón con TCBD en términos de sobrediagnóstico y sobretratamiento son considerables. Implementar en un futuro estas recomendaciones en nuestro país requiere un debate científico y ético acerca de sus efectos secundarios, así como un análisis de la factibilidad y la accesibilidad a las pruebas y el coste-efectividad de este cribado.
- •
Los profesionales de AP deben realizar consejo claro y personalizado para dejar de fumar a todas las personas fumadoras (evidencia alta, recomendación fuerte a favor)
- •
La radiografía de tórax o la citología de esputo no deben recomendarse como pruebas de cribado del cáncer de pulmón (evidencia moderada, recomendación fuerte en contra)
- •
La TCBD no debería recomendarse como prueba de cribado del cáncer de pulmón (evidencia moderada, recomendación débil en contra)
El cáncer de piel engloba a un conjunto de enfermedades neoplásicas que tienen diagnóstico, tratamiento y pronóstico muy diferentes. Los 2 tipos más comunes de cáncer de piel son el carcinoma basocelular y el espinocelular, con un alto índice de curación. El melanoma, el tercero más común de los cánceres de piel, es más agresivo y puede ser causa de muerte.
En España se estima que en 2015 se diagnosticaron un total de 4.890 nuevos casos de melanoma (2.577 en varones y 2.313 en mujeres)7 y ocurrieron un total de 1.075 defunciones (572 en varones y 503 en mujeres)8 (tabla 1). La supervivencia relativa a 5 años estandarizada por edad de los pacientes diagnosticados en el período 2000-2007 fue del 79,1% en varones y del 88,9% en mujeres9 (tabla 2). Se estima que la diferencia observada entre la supervivencia de varones y mujeres se asocia a más autodetección entre las mujeres, más melanoma en localizaciones no fácilmente visibles en varones y diferencias en la regulación hormonal101102.
Los factores de riesgo del melanoma son genéticos, familiares y ambientales (tabla 4). La radiación solar (rayos ultravioleta [UV]) es el factor etiopatogénico más importante (también de los carcinomas basocelular y espinocelular). Los estudios han demostrado claramente que la exposición a la radiación UV eleva el riesgo de tener melanoma. En consecuencia, una gran parte de los casos de melanoma podría prevenirse. Las medidas preventivas del melanoma incluyen evitar la exposición intensa y continuada al sol, así como las camas de bronceado, ambas fuentes de radiación UV103. Los factores familiares y genéticos incluyen el fototipo de piel (la calidad de la respuesta a la acción de los rayos del sol es peor en el fototipo claro), el número de nevus melanocíticos, la presencia de nevus atípicos y la historia familiar de cáncer de piel. El desarrollo de melanoma es más frecuente y más agresivo en los pacientes con inmunosupresión104.
Existen diversos tipos de melanoma, según los rasgos clínicos y anatomopatológicos y el patrón de crecimiento (de extensión superficial, nodular, léntigo maligno y lentiginoso acral). La mayoría de los melanomas se localiza en la piel y rara vez se desarrolla en mucosas (boca, iris, retina y órganos internos). Pueden tener colores variados incluyendo escala de marrones, negro, azul, rojo o gris. En los varones, las localizaciones más frecuentes son el tronco, los hombros, la cabeza y el cuello, y en las mujeres los brazos y las piernas.
Por lo general, el melanoma (u otro cáncer de piel) es un cáncer que se puede detectar de forma temprana. Para ello es importante identificar y consultar cualquier lunar o úlcera de nueva aparición y los cambios en los lunares o úlceras existentes, así como los cambios en la coloración de la piel. Los criterios ABCD (asimetría, bordes, color y diámetro) ayudan a identificar una lesión como sospechosa de malignidad (tabla 4).
El cribado sistemático del cáncer de piel en la población general mediante examen de la piel de todo el cuerpo, realizado por un médico de AP, o el autoexamen de la piel no han demostrado ningún beneficio en términos de reducción de la mortalidad. Por el contrario, este examen visual puede ocasionar efectos perjudiciales, tales como el sobrediagnóstico por la identificación de lesiones benignas que de otro modo no se detectarían, la posibilidad de un diagnóstico erróneo de malignidad, las complicaciones de las intervenciones diagnósticas o terapéuticas (incluyendo cirugía extensa) y los efectos psicológicos de ser etiquetado con una enfermedad potencialmente mortal. La mayoría de las sociedades científicas orientan las recomendaciones de cribado fundamentalmente a individuos con riesgo elevado mediante autoexamen de piel y evaluación por parte de un profesional por lo menos una vez al año105.
La exposición al sol es buena para la salud, pero también implica riesgos que hay que tener presentes. El Código Europeo Contra el Cáncer recomienda evitar la exposición solar (tabla 5). Actualmente están en marcha diversos programas de protección solar y campañas comunitarias para dar a conocer los peligros de la excesiva exposición a la radiación UV y recomendar estilos de vida que frenen el aumento de este tipo de cáncer. Desde el punto de vista de la salud pública, es especialmente importante proteger a los grupos de población más vulnerables. Las recomendaciones básicas de fotoprotección se describen en la tabla 11.
Consejos sobre la exposición solar
|
Fuente: Exposición al sol. Disponible en: http://web.gencat.cat/es/actualitat/reportatges/seguretatplatges/exposicio-al-sol/index.html
A nivel poblacional, con pruebas limitadas sobre el cribado del cáncer de piel, no se puede hacer una recomendación clara sobre el beneficio del cribado (tabla 9). Las investigaciones futuras deben centrarse en evaluar la efectividad del cribado selectivo en personas consideradas con mayor riesgo de cáncer de piel106.
- •
No se recomienda el cribado sistemático del cáncer de piel en la población de riesgo medio (evidencia moderada, recomendación fuerte en contra)
- •
En individuos con factores de riesgo elevado se recomienda el examen de la piel dirigido a la identificación de lesiones sugestivas de cáncer (evidencia moderada, recomendación fuerte a favor)
- •
Se recomienda proporcionar consejo para evitar la exposición excesiva a la radiación solar y recomendar el uso de protectores solares (evidencia moderada, recomendación fuerte a favor)
En España se estima que en el año 2015 se detectaron 2.442 nuevos casos de cáncer de tiroides en mujeres y 865 en varones (tabla 1). Las estimaciones del cambio porcentual en el número de casos para el período 1995-2005 es del 73,0% en varones y del 56,9% en mujeres, y para el período 2005-2015, del 50,7 y el 28,8%, respectivamente7. En el año 2015 ocurrieron 337 defunciones8 (tabla 1). La supervivencia relativa a los 5 años se estima en el 86,8% en las mujeres y en el 75,6% en los varones9.
En función de su origen, el cáncer de tiroides se clasifica en 3 tipos histológicos: a) cáncer derivado del epitelio tiroideo: carcinomas papilares y foliculares; b) cáncer de células parafoliculares: carcinomas medulares, y c) carcinomas anaplásicos. Los carcinomas papilares representan el 80-90% de los casos; desde 1992, la OMS incluye el término de mi- crocarcinoma papilar de tiroides para denominar al cáncer papilar < 1 cm.
Hasta hace unos años, la forma de presentación clínica del cáncer papilar de tiroides era la presencia de un nódulo tiroideo asintomático y en algunos casos la aparición de una adenopatía cervical. Actualmente, la mayoría de los casos se presenta como hallazgos en la ecografía y biopsia por aspiración con aguja fina (PAAF)107,108.
A partir de los registros de cáncer de calidad, la International Agency for Research on Cancer (IARC) observa un patrón ascendente de las tasas de incidencia de cáncer de tiroides en varios países de Europa durante los últimos 30 años107. El porcentaje estimado de casos sobrediagnosti- cados en mujeres durante el período 2003-2007 oscila entre el 70 y el 80% en Australia, Francia, Italia y Estados Unidos, mientras que es aproximadamente del 50% en Japón, los países nórdicos, Inglaterra y Escocia. Las curvas de edad muestran un patrón similar para los varones, aunque menos pronunciado que en las mujeres, y los picos se presentan a edades más avanzadas. El aumento en la incidencia se debe casi por completo a cánceres papilares pequeños (< 2 cm), el tipo histológico más indolente. Las tasas de mortalidad se han mantenido estables o han disminuido ligeramente.
En la República de Corea, en el contexto de un cribado poblacional para diversos cánceres, se incluyó la ecografía de tiroides108. En el período 2003-2007, el cáncer de tiroides pasó a ser el más común diagnosticado en mujeres, y se estima que el 90% de los casos detectados en ese período se deben a sobrediagnóstico. Asimismo, resultados de un estudio finlandés109 han mostrado que el 36% de las autopsias realizadas en personas sin antecedentes de enfermedad tiroidea tenía un carcinoma papilar, la mayoría de ellos muy pequeños.
Los factores de riesgo del cáncer de tiroides no parecen reflejar el aumento de su incidencia, aunque sí se han observado cambios en los patrones de las mutaciones somáticas108. La exposición a la radiación ionizante en el contexto de pruebas diagnósticas, el sobrepeso y la diabetes también se han descrito como factores de riesgo al alza. No obstante, el incremento del cáncer de tiroides se justifica, sobre todo, por la introducción, a mediados de la década de 1980, de la ecografía y la PAAF.
La mayoría de los casos son cánceres papilares de bajo grado de malignidad. No obstante, existen determinados factores que le confieren un peor pronóstico108: ser varón, edad mayor de 45 años, tamaño tumoral (> 1 cm), aunque algunos carcinomas micronodulares de < 1 cm pueden ser potencialmente malignos, bilateralidad, multifocalidad, presencia de metástasis linfáticas y presencia de mutación BRAF.
Recientemente, la USPSTF ha asignado una evidencia moderada con un nivel de recomendación D (recomendación en contra del cribado) al cribado de cáncer de tiroides, dado que la detección en personas asintomáticas ocasiona más daños que beneficios110. La mayoría de los cánceres se tratan con la extirpación de la glándula tiroides. Los daños quirúrgicos permanentes más frecuentes de la tiroidectomía, con o sin disección de los ganglios linfáticos, incluyen hipo- paratiroidismo (hipocalcemia) y la parálisis recurrente del nervio laríngeo (parálisis de las cuerdas vocales). Las personas que se han sometido a una tiroidectomía necesitarán tomar levotiroxina diariamente de manera indefinida.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.