Introducción
La polineuropatía diabética (PND) está considerada el factor de riesgo más importante de ulceración en el pie y es la causa del 50-75% de las amputaciones no traumáticas de pie1,2.
La PND comporta un importante padecimiento para los pacientes y un elevado coste social y económico3-5, lo que obliga a avanzar en la investigación sobre la selección de pacientes de riesgo y la detección precoz de PND en el ámbito de la atención primaria (AP) para reducir sus efectos y evitar la saturación de los servicios especializados6.
Varios estudios demuestran que el mal control metabólico, la hipertensión y la dislipidemia son factores de riesgo de PND modificables7-9.
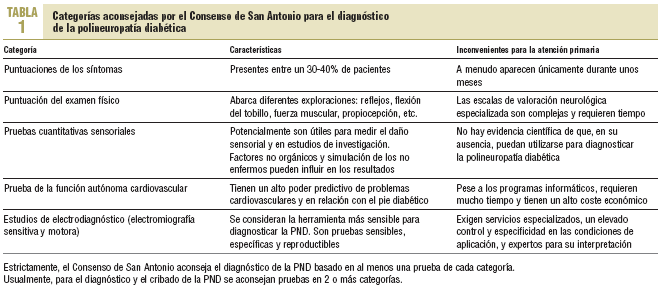
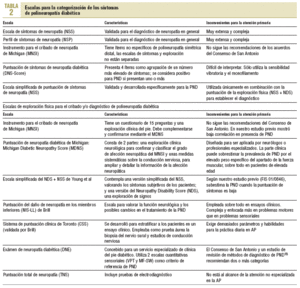
El consenso de San Antonio10 (tabla 1) aconsejó establecer su diagnóstico sobre la base de 5 categorías diferentes: síntomas, examen físico, pruebas sensoriales cuantitativas (QST), pruebas de función autónoma cardiovascular y estudios de electrodiagnóstico.
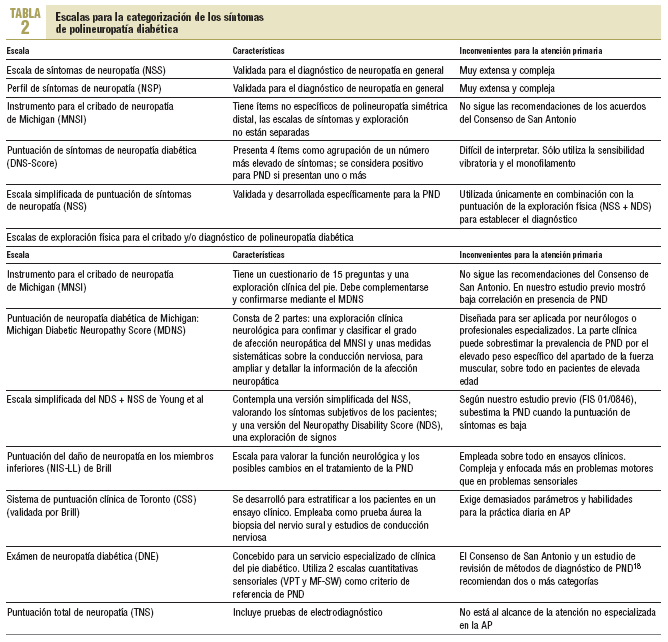
En un intento de categorizar los síntomas y la exploración física se han desarrollado diferentes escalas para el cribado o el diagnóstico de PND, generalmente combinadas con cuestionarios11-19 (tabla 2).
Aunque son útiles para la medición del daño sensorial y los estudios de investigación, los criterios de diagnóstico de PND no deben basarse únicamente en los resultados de la pruebas QST, ya que los que fingen estar enfermos y otros factores no orgánicos pueden influir en los resultados16.
Las pruebas de electrodiagnóstico suelen emplearse para la confirmación de diagnóstico o como pruebas de referencia12,17, aunque presentan severas limitaciones para su aplicación en AP.
Las pruebas de función cardiovascular autonómica (cAFT) presentan una elevada complejidad y, a pesar de que utilizan programas informáticos, requieren mucho tiempo.
Se han efectuado diferentes estudios, con técnicas consideradas útiles para el diagnóstico de la PND, para estudiar el riesgo de úlcera, y ha sido valorado en estadios finales de la PND. Algunos autores como Pham et al18 utilizan simultáneamente múltiples técnicas de cribado para identificar el riesgo de úlcera. Así, para el cribado y el diagnóstico de la PND hay diferentes técnicas11-15,17,18 que suelen ser complejas, costosas o poco apropiadas para la práctica diaria en AP. En otras más simples, como la sensibilidad vibratoria o el SW-MF, no se ha demostrado en ningún estudio particular que diagnostiquen la PND y dejan a un importante grupo de pacientes con PND sin diagnosticar20.
El objetivo esencial de este proyecto es validar 2 métodos: uno para seleccionar a los pacientes con riesgo de presentar PND (PSM) y otro para su diagnóstico (OPD).
Investigación previa: el proyecto FIS 01/0846
La necesidad de una detección precoz de la presencia y/o riesgo de PND y la exploración de nuevos métodos para su cribado y diagnóstico, válidos para la práctica real en la AP, fueron los objetivos de nuestro estudio21, realizado en una muestra aleatoria de 307 pacientes con diabetes mellitus tipo 2 y otra de referencia, en el cual observamos una prevalencia aproximada del 23%, similar a la observada en un estudio de ámbito nacional22.
En dicho estudio investigamos y desarrollamos 2 métodos: el método de selección investigado PSM (polyneuropathy selection method) permite detectar y seleccionar a pacientes con riesgo de presentar PND con un alto grado de exactitud (sensibilidad del 74,2%, especificidad del 74,9%, valor predictivo positivo [VPP] del 47,6% y valor predictivo negativo [VPN] del 90,4%)21. El método de diagnóstico investigado OPD (outpatients polyneuropathy diagnosis) mostró una sensibilidad del 77,5%, una especificidad del 94,9%, un VPP del 85,54%, un VPN del 93,6%, y un correcto diagnóstico del 90,8%21.
Ambos métodos se analizaron tomando como referencia el diagnóstico de la PND establecido mediante un exhaustivo examen de síntomas, exploración clínica y pruebas sensoriales semicuantitativas. Para su validación clínica es preciso valorar su reproducibilidad y confirmar su poder de discriminación para el diagnóstico de PND mediante estudios de electrodiagnóstico, recomendados en la bibliografía médica11,17.
Relación entre polineuropatía diabética y lesión vascular
El objetivo general de nuestra investigación previa (FIS 01/0846) consistió en estudiar la posible relación entre los componentes de síndrome metabólico (SM) y los parámetros de cuantificación de la PND. Los resultados observados presentaron una relación significativa entre la presencia de PND y varios componentes del SM (el colesterol unido a lipoproteínas de alta densidad [cHDL] como factor protector y la hipertensión arterial [HTA] y la HbA1c como factores de riesgo), también observada en otros estudios7-9, una relación que podría indicar una patogenia común con la lesión vascular.
En la patogenia de la PND parece encontrarse una lesión de los vasa nervorum como lesión inicial de la lesión neural. Ha sido definida como una entidad con un cierto grado de componente genético (p. ej., polimorfismos del gen de la aldosa reductasa), conjuntamente con un medio ambiente desfavorable, con los valores de glucemia y parece poder demostrarse que habría un componente inflamatorio semejante al encontrado en la lesión vascular del diabético. Citocinas como la proteína C reactiva, además de marcador de riesgo, parecen desempeñar un papel patogénico en procesos inflamatorios y en el SM23. Otras, como la TNF (factor estimulador de necrosis tumoral)24,25 y el TGFß-1 (factor de proliferación vascular), pueden tener un papel en la patogenia de enfermedades del sistema nervioso por un posible amortiguamiento de las respuestas normales debido a la hiperglucemia persistente, lo que promovería la muerte de células neurogliales26. Conocer si la confirmación de la polineuropatía, en nuestro caso de diagnóstico por EMG, puede guardar o no una relación con las citocinas proinflamatorias26 es un punto de crucial interés.
Objetivos
Objetivo principal
Confirmar la validez del método de selección PSM de pacientes con riesgo de PND, y la validez y el poder discriminatorio del método simplificado OPD para el diagnóstico de la PND, utilizando como patrón diagnóstico las pruebas de electrodiagnóstico y una valoración clínica neurológica objetiva.
Objetivos secundarios
Confirmar, mediante pruebas de electrodiagnóstico, la validez de la valoración clínica neurológica utilizada para el diagnóstico de la PND en el estudio previo. Estudiar la posible relación entre PND y situación proinflamatoria determinada por las concentraciones plasmáticas de citocinas de forma semejante a la arteriopatía.
Método
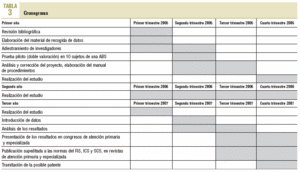
Esquema general de las fases del estudio en el cronograma en la tabla 3.
Doble diseño
Transversal de asociación cruzada para el estudio del método de selección de pacientes con riesgo de PND en una sola muestra. Con muestras emparejadas para la confirmación del diagnóstico de PND en 2 subgrupos.
Ámbito
AP de 3 comarcas con 5 áreas de salud y una población de 82.660 habitantes.
Tamaño de la muestra
Un total de 135 pacientes distribuidos en 3 submuestras calculadas para una potencia del 90%, un coeficiente de correlación de 0,850, un nivel de confianza del 95% y un error alfa del 0,05. Para el estudio piloto y las pruebas de reproducibilidad se seleccionará una muestra a conveniencia de 10 sujetos.
Criterios de inclusión
Para la muestra del grupo A, pacientes diagnosticados de diabetes mellitus no insulinodependiente según criterios diagnósticos de la OMS (1998).
Criterios de exclusión
Para todas las muestras, polineuropatía por otras causas, ingesta de alcohol é 60 g/día en mujeres y é 80 g/día en varones, o la no obtención del consentimiento informado. Para las muestras de los grupos B y C, además, tomar bloqueadores beta o antagonistas del calcio, sujetos con historia o clínica aparente de enfermedad cardíaca o llevar marcapasos o desfibrilador automático implantable (DAI).
Consentimiento informado
Se informará a los sujetos de los objetivos del estudio, los detalles de las exploraciones y las pruebas que se utilizarán durante el estudio, de la utilidad clínica esperada de la investigación y de la confidencialidad de los datos.
Número de visitas
Se realizarán 3. Las visitas podrán realizarse en 2 días para evitar pérdidas, y las determinaciones analíticas se podrán realizar dentro del plazo de una semana. Los profesionales que recogerán dichos datos estarán específicamente entrenados para dicho cometido.
Diagnóstico de la polineuropatía diabética
1. La valoración clínica neurológica objetiva de PND, tal como hicimos en el estudio previo, se establecerá por la presencia de síntomas neuropáticos (escala simplificada del Neuropathy Symptom Score [NSS]), la afección bilateral de pruebas de exploración física (reflejos aquíleos, fuerza muscular), las pruebas de sensibilidad al dolor, al frío y vibratoria (diapasón de escala graduada y neurotensiómetro) y monofilamento 5,07-10 g, y se complementará mediante pruebas de electromiografía sensitiva y motora. El diagnóstico se realizará según 3 categorías, cuando el Consenso de San Antonio y otros autores recomiendan 2 o más categorias7,13.
2. El nuevo método (PSM) de selección discriminativa del riesgo de presentar PND se estudiará, como en el estudio previo, mediante 4 parámetros de la historia clínica: edad, cHDL, HbA1c y retinopatía diabética.
3. El diagnóstico de la PND mediante el nuevo método OPD se establecerá con el algoritmo simplificado obtenido en el estudio previo, utilizando la media de los resultados de la exploración a la sensibilidad del monofilamento de Semmes-Weinstein 5,7, 10 g, la media de los resultados de la sensibilidad vibratoria obtenida con diapasón de escala graduada, la presencia o ausencia del reflejo aquíleo y la puntuación de la escala modificada del NSS.
Exploración de las variables
Los síntomas de neuropatía se valorarán mediante la escala modificada del NSS. La sensibilidad vibratoria se valorará mediante diapasón de escala graduada y neurotensiómetro. La fuerza muscular, los reflejos y el monofilamento de Semmes-Weinstein se explorarán según criterios del Michigan Diabetic Neuropathy Score (MDNS). Las pruebas de electrodiagnóstico se efectuarán en los nervios mediano, ulnar, peroneal y motor tibial, y mediano, ulnar y nervios surales sensoriales. La sensibilidad dolorosa superficial se valorará utilizando lancetas de examen y la sensibilidad al frío se determinará mediante diapasón aplicado en el dorso del pie. El diagnóstico de retinopatía diabética se realizará con imágenes digitales de fondo de ojo, obtenidas mediante una cámara de fondo no midriática.
Pruebas analíticas
Se determinarán el colesterol total, cHDL, glucemia basal, creatinina, triglicéridos, ácido úrico, cLDL, insulinemia (en no tratados con insulina), microalbuminuria, proteína C reactiva en suero, HbA1c, Na y K, TNF reacción soluble, y el TGFß-1 total.
Análisis estadístico
La concordancia entre las valoraciones de pruebas de electromiografía y la valoración clínica neurológica objetiva de la PND se estudiará mediante el índice kappa de Cohen. Para confirmar la validez del método de selección PSM, se aplicará el modelo en nuevos pacientes y se evaluará, mediante análisis de regresión logística binaria, si se mantiene la significación de los 4 parámetros, y se realizará una evaluación posterior del modelo de regresión con el área bajo la curva ROC.
Se estudiará la validez del método simplificado OPD aplicando el modelo de regresión logística de nuestro estudio previo y comparándolo con las pruebas de referencia (electromiografía y valoración clínica objetiva) se evaluará la concordancia, facilitando índices de sensibilidad, especificidad, VPP, VPN, porcentaje de correcta valoración y odds ratio (OR).
La posible relación entre la situación proinflamatoria y la presencia de PND se evaluará mediante la comparación de los valores medios de las concentraciones plasmáticas de las pruebas bioquímicas, con el test de la t de Student y posterior análisis de regresión logística para definir un modelo. Para el test de reproducibilidad se valorará el acuerdo (consistencia) interobservador e intraobservador mediante el índice kappa de Cohen. La consistencia interna de los síntomas de la escala modificada del NSS se calculará mediante el alfa de Crombach y el coeficiente de fiabilidad de rho. Se utilizarán pruebas bilaterales, con nivel de significación del 5%. Los datos se analizarán mediante el paquete SPSS/WIN 11.5.
Discusión
Limitaciones
No se efectuarán pruebas de función cardiovascular autonómica, pero sí las pruebas de electrodiagnóstico. Los cuestionarios, la exploración física y las pruebas de sensibilidad no serán aplicados por especialistas, sino por profesionales de enfermería y medicina de familia, ajustándonos a la realidad diaria.
Aplicabilidad práctica
La detección precoz de riesgo y/o presencia de PND permite la prevención secundaria al actuar sobre factores de riesgo modificables, como el control metabólico, la hipertensión o la dislipidemia7-9. La confirmación de la hipótesis de trabajo supondrá mejorar la eficiencia del proceso asistencial y aportará un método para la selección de subgrupos con riesgo de PND y un nuevo método de diagnóstico de PND, reproducible, fiable y fácil de aplicar. La exploración de una posible relación entre la presencia de PND y el estado de proinflamación de pacientes con diabets mellitus no insulinodependiente pretende ampliar información sobre la relación observada, en nuestro estudio de investigación previo (FIS 01/0846), entre la presencia de PND y varios componentes del SM.