Evaluar la eficacia y seguridad de una estrategia basal plus usando insulina glargina (GLA) como insulina basal e insulina glulisina (GLU) como insulina prandial en pacientes con diabetes mellitus tipo 2 (DM2) en la práctica clínica habitual.
Material y métodosEstudio observacional retrospectivo realizado entre noviembre de 2010 y diciembre de 2011 (periodo de observación entre enero y julio de 2010) en 65 servicios de endocrinología en España. Consecutivamente se incluyeron pacientes con DM2 tratados previamente con GLA más una inyección de GLU con la comida principal. La variable principal fue el cambio en la HbA1c desde antes de introducir GLU (visita basal) y a los 3 meses como mínimo (visita basal plus).
ResultadosSe incluyeron 363 pacientes (edad 65±10 años, 54% hombres). Después de 6 meses la HbA1c descendió de 8,5 a 7,4% (–1,1±0,8% [IC 95%: 1,0-1,2]; p<0,001). El 25,9% de los pacientes alcanzaron HbA1c inferior a 7,0% (0,8% al inicio). El porcentaje de pacientes con glucemia en ayunas inferior a 130mg/dl pasó del 51,0% al inicio al 62,8% al final. Únicamente se produjeron 3 episodios de hipoglucemia grave, ninguno de ellos nocturno.
ConclusionesUna estrategia basal plus con GLA en monodosis diaria más GLU en la comida principal es eficaz y segura para mejorar el control glucémico en la práctica clínica en pacientes con DM2 que previamente no cumplían criterios de buen control metabólico.
To evaluate the efficacy and safety of a Basal Plus strategy using insulin glargine (GLA) as basal insulin and insulin glulisine (GLU) as prandial insulin in patients with type 2 diabetes mellitus (T2DM) in everyday clinical practice.
Material and methodsObservational, retrospective study was performed between November 2010 and December 2011 (duration of observation: January-July 2010) in 65 endocrinology departments across Spain on consecutively enrolled T2DM patients previously treated with GLA, to whom one injection of GLU was added at the main meal. Primary analysis was to evaluate the change in HbA1c from baseline (start of basal plus therapy, basal visit [BV]) to endpoint (at least after 3 months, basal plus visit [BPV]).
ResultsA total of 363 patients were included (age 65±10 years old, 54% male). After 6 months, the HbA1c decreased from 8.5% to 7.4% (–1.1±.8%; 95% CI: 1.0-1.2; p<.001). More than a quarter (25.9%) of patients achieved an HbA1c<7.0% (.8% of patients at baseline). The percentage of patients with target fasting plasma glucose values (<130mg/dl) was 51.0% at baseline (BV), and 62.8% at the endpoint (BPV). Only 3 episodes of severe hypoglycemia were reported, of which none of them was nocturnal.
ConclusionsA Basal plus strategy with once daily insulin glargine plus insulin glulisine at the main meal is effective and safe in improving glycemic control in clinical practice in patients with T2DM previously not on treatment targets.
Se estima que en el año 2030 más de 365 millones de personas en todo el mundo estarán afectas de diabetes mellitus tipo 2 (DM2)1. En España también se ha incrementado su prevalencia, situándose en la actualidad alrededor del 14% de la población2, lo que implica que la atención de estos pacientes constituye un importante problema de salud pública en los países industrializados y emergentes y un aumento considerable de los recursos económicos necesarios, teniendo en cuenta por ejemplo que el paciente con diabetes en España genera un coste sanitario 1,5 veces superior al del paciente no diabético3. Las recomendaciones actuales, tanto de la Sociedad Española de Diabetes (SED) como del consenso conjunto entre la American Diabetes Association-European Association for the Study of Diabetes (ADA/EASD), consideran que el manejo del paciente se ha de efectuar en el contexto de sus necesidades, preferencias y tolerabilidad, concluyendo que la individualización del tratamiento es el punto esencial del éxito del mismo4,5. La terapia farmacológica suele ser el segundo escalón del tratamiento, después de las medidas dirigidas a modificar el estilo de vida. A pesar de conseguir inicialmente una mejoría en el control de la enfermedad con antidiabéticos orales (ADO), es difícil mantener el objetivo de control metabólico en la mayoría de pacientes después de un tiempo de tratamiento6. Por ello, en la mayoría de pacientes se requieren estrategias de intensificación y combinación de varios agentes farmacológicos7. Finalmente, la pérdida progresiva de la función de la célula β-pancreática en el paciente con DM2 hace necesario que a lo largo de su vida la mayoría de ellos requieran tratamiento con insulina en alguna modalidad8. Inicialmente se aconseja añadir al tratamiento una administración única diaria de insulina de acción intermedia o prolongada (insulinoterapia basal), preferiblemente estas últimas al poseer un perfil de absorción más homogéneo que les confiere un riesgo menor de hipoglucemia nocturna9. Esta estrategia ha demostrado ser eficaz, logrando una optimización del control en un porcentaje elevado de los pacientes, alcanzando en algún estudio una HbA1c inferior al 7% casi el 30% de los sujetos10. Sin embargo, en fases más avanzadas la insulinoterapia basal combinada con ADO puede no ser suficiente para mantener los objetivos de control, precisándose entonces la utilización de insulinas con efecto prandial11. En ese sentido, la pauta basal plus12 (adición de una dosis de insulina de acción rápida a una insulinoterapia basal ya establecida) ofrece considerables ventajas respecto a la clásica utilización de 2 dosis de insulina premezclada: posibilidad de elegir la comida principal, titulación por separado de ambas insulinas, transición ordenada a una pauta basal-bolus si es necesario, entre otras. Por estos motivos, las guías actuales de tratamiento ADA-EASD 2012 recomiendan este tipo de pautas como paso siguiente a la insulinización basal5. Sin embargo, hay pocos datos publicados, y ninguno en nuestro país, sobre la eficacia y seguridad de implementar este tipo de pauta.
El objetivo del presente estudio es evaluar, en condiciones de práctica clínica habitual, el efecto de añadir una dosis de insulina glulisina en la comida principal a pacientes con DM2 atendidos por endocrinólogos y que presentan un control glucémico insuficiente a pesar de recibir tratamiento con una insulina basal.
Material y métodosEstudio observacional multicéntrico retrospectivo, llevado a cabo entre noviembre de 2010 y diciembre de 2011, por 65 endocrinólogos de toda España en consultas externas del ámbito hospitalario o extrahospitalario en condiciones de práctica clínica habitual.
Se incluyeron pacientes con DM2, mayores de 18 años de edad, que recibiesen tratamiento con insulina glargina como insulina basal un mínimo de 3 meses antes de introducir una dosis de insulina glulisina como insulina prandial, y en los que se dispusiese de determinaciones de HbA1c antes y después de la intensificación del tratamiento con insulina prandial. Todos los pacientes fueron informados por escrito y firmaron el consentimiento informado previo a cualquier procedimiento del estudio. Se excluyeron los pacientes con otras formas de DM. El estudio recibió la aprobación del Comité Ético de Investigación Clínica del Hospital de Bellvitge.
Cada endocrinólogo registró la información clínica de 5-7 pacientes atendidos de forma consecutiva. La información se obtuvo de los registros clínicos en 2 puntos previos, a los que se han llamado visita basal (VB) y visita basal plus (VBP). La VB corresponde al momento en el que el paciente seleccionado estaba en tratamiento con insulina glargina como insulina basal y se efectúa una intensificación del tratamiento con una dosis de insulina glulisina como insulina prandial. La VBP corresponde a un momento posterior, con un intervalo mínimo de 3 meses. Se registraron en cada visita los datos demográficos y clínicos relacionados con la DM y sus complicaciones crónicas, presencia de factores de riesgo cardiovascular, los tratamientos empleados, así como el IMC, datos analíticos que incluían HbA1c (incluyendo el objetivo de control establecido por su médico) y glucemia basal, perfiles de glucemia autoanalizada registrados, y específicamente en la VBP el número y características de los episodios de hipoglucemia en el último mes.
La variable principal del estudio fue el grado de control evaluado mediante la HbA1c expresado: a) como el cambio en su concentración entre las VB y VBP;y b) como el porcentaje de pacientes que alcanzaron un valor inferior a 7,0%. Como variables secundarias se analizaron la evolución de la glucemia en ayunas y el porcentaje de pacientes con valor inferior a 130mg/dl, además de los perfiles de glucemia aportados por el paciente en la semana previa a VBP, considerando óptimo un control posprandial<180mg/dl. Respecto a la seguridad se evalúo el número de hipoglucemias totales sintomáticas (cifras inferiores a 70mg/dl con síntomas adrenérgicos típicos), asintomáticas (cifras inferiores a 70mg/dl sin síntomas de hipoglucemia), graves (definidas como la necesidad de ayuda por parte de otra persona para tratarla) y nocturnas (periodo de sueño nocturno), todo ello del mes previo a la VBP. Al tratarse de un estudio retrospectivo basado en la recogida de datos de la historia clínica del paciente, no se realizó la recogida sistemática de efectos adversos relacionados o no con un fármaco.
La descripción de variables continuas se ha realizado utilizando la media y desviación estándar. Para la descripción de variables categóricas se ha utilizado el número y porcentaje de pacientes por categoría. El análisis comparativo de las variables continuas entre la VB y la VBP se ha realizado mediante la prueba «t» de Student para datos apareados. En todas las pruebas estadísticas realizadas con las variables de resultado se ha utilizado un nivel de significación estadística (p) de 0,05.
El análisis de todas las variables consideradas se ha efectuado en la muestra total de los pacientes evaluables y en 3 grupos formados por estratificación de la concentración de HbA1c en la VB según el valor fuera <8,0%, entre 8,0-9,0%, y >9,0%. El grado de control glucémico óptimo individualizado se había definido por los médicos como HbA1c<7,0% para el 76% de los pacientes, <6,5% en el 12% y superior a 7% en el 12% restante.
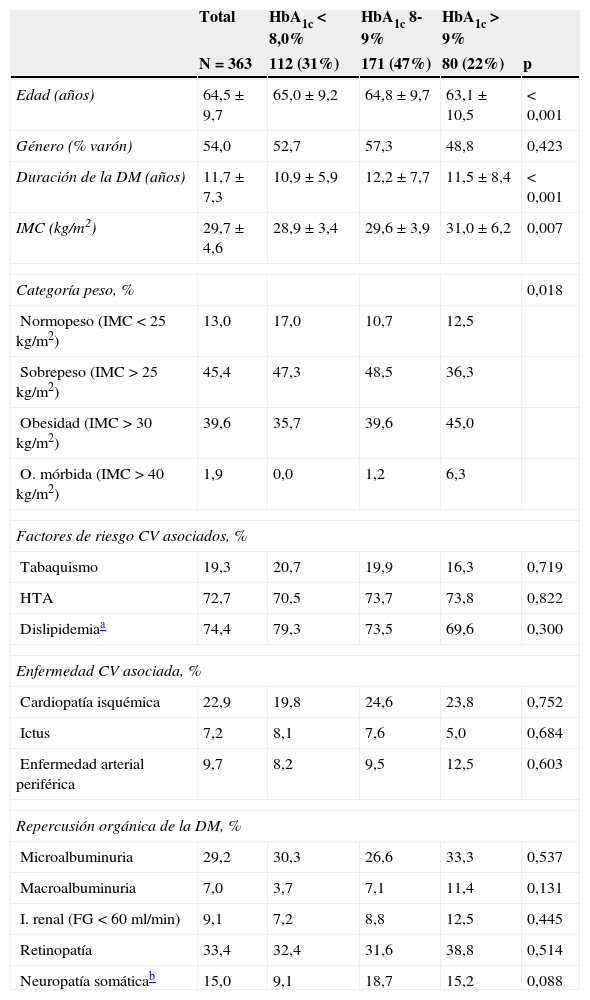
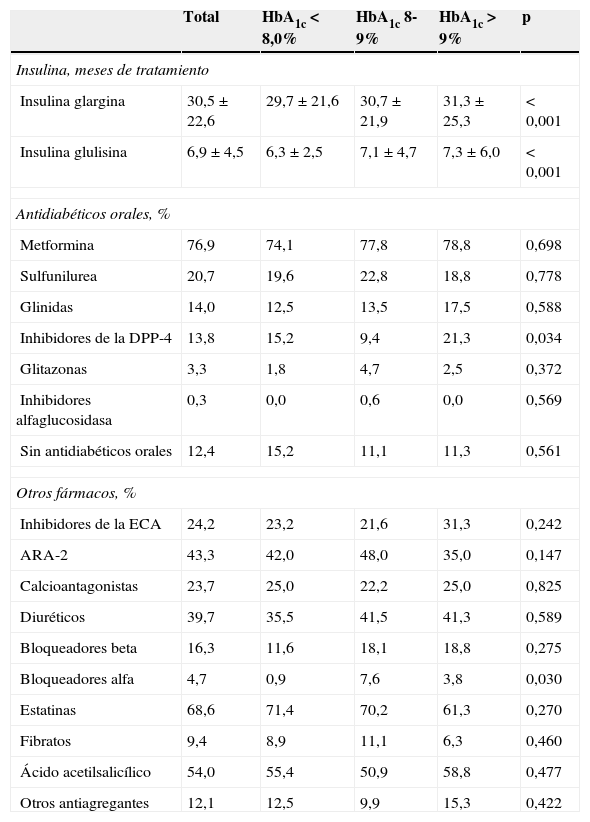
ResultadosSe incluyeron un total de 467 pacientes con DM2, de los cuales se excluyeron 104. Las causas de exclusión, algunas repetidas en el mismo paciente, fueron: no disponer del valor de la concentración de HbA1c (69 pacientes), estar menos de 3 meses con insulina glulisina como insulina prandial (28 pacientes), efectuar el inicio del tratamiento con insulina glulisina con 2 inyecciones diarias (21 pacientes), recibir insulina basal por un periodo menor de 3 meses (6 pacientes) y errores detectados en la monitorización (3 pacientes). Fueron evaluables para el estudio 363 pacientes, con una edad media de 65 años. Las características demográficas, antropomorfométricas, los factores de riesgo cardiovascular asociados y la presencia de complicaciones crónicas de la DM se muestran en la tabla 1, tanto para la muestra global como para los subgrupos. La duración del tratamiento con insulina, así como el porcentaje de pacientes en tratamiento con ADO asociados, y el uso de otros fármacos se recogen en la tabla 2. La insulina glargina se administraba mayoritariamente por la noche, en el 41,0% de los pacientes al ir a dormir y en el 31,4% antes de la cena; el 25,1% se la administraba antes del desayuno y solo el 2,5% antes de la comida de mediodía. La insulina glulisina se administraba en la comida de mediodía en 262 pacientes (72%).
Datos demográficos, antropomorfométricos y clínicos de los pacientes
| Total | HbA1c<8,0% | HbA1c 8-9% | HbA1c>9% | ||
|---|---|---|---|---|---|
| N=363 | 112 (31%) | 171 (47%) | 80 (22%) | p | |
| Edad (años) | 64,5±9,7 | 65,0±9,2 | 64,8±9,7 | 63,1±10,5 | <0,001 |
| Género (% varón) | 54,0 | 52,7 | 57,3 | 48,8 | 0,423 |
| Duración de la DM (años) | 11,7±7,3 | 10,9±5,9 | 12,2±7,7 | 11,5±8,4 | <0,001 |
| IMC (kg/m2) | 29,7±4,6 | 28,9±3,4 | 29,6±3,9 | 31,0±6,2 | 0,007 |
| Categoría peso, % | 0,018 | ||||
| Normopeso (IMC <25kg/m2) | 13,0 | 17,0 | 10,7 | 12,5 | |
| Sobrepeso (IMC >25kg/m2) | 45,4 | 47,3 | 48,5 | 36,3 | |
| Obesidad (IMC >30kg/m2) | 39,6 | 35,7 | 39,6 | 45,0 | |
| O. mórbida (IMC >40kg/m2) | 1,9 | 0,0 | 1,2 | 6,3 | |
| Factores de riesgo CV asociados, % | |||||
| Tabaquismo | 19,3 | 20,7 | 19,9 | 16,3 | 0,719 |
| HTA | 72,7 | 70,5 | 73,7 | 73,8 | 0,822 |
| Dislipidemiaa | 74,4 | 79,3 | 73,5 | 69,6 | 0,300 |
| Enfermedad CV asociada, % | |||||
| Cardiopatía isquémica | 22,9 | 19,8 | 24,6 | 23,8 | 0,752 |
| Ictus | 7,2 | 8,1 | 7,6 | 5,0 | 0,684 |
| Enfermedad arterial periférica | 9,7 | 8,2 | 9,5 | 12,5 | 0,603 |
| Repercusión orgánica de la DM, % | |||||
| Microalbuminuria | 29,2 | 30,3 | 26,6 | 33,3 | 0,537 |
| Macroalbuminuria | 7,0 | 3,7 | 7,1 | 11,4 | 0,131 |
| I. renal (FG<60 ml/min) | 9,1 | 7,2 | 8,8 | 12,5 | 0,445 |
| Retinopatía | 33,4 | 32,4 | 31,6 | 38,8 | 0,514 |
| Neuropatía somáticab | 15,0 | 9,1 | 18,7 | 15,2 | 0,088 |
Características clínicas estratificadas por nivel de HbA1c. Resultados expresados en media aritmética±desviación estándar o porcentaje.
HTA: hipertensión arterial; IMC: índice de masa corporal.
Tratamientos farmacológicos para la diabetes mellitus y enfermedades asociadas
| Total | HbA1c<8,0% | HbA1c 8-9% | HbA1c>9% | p | |
|---|---|---|---|---|---|
| Insulina, meses de tratamiento | |||||
| Insulina glargina | 30,5±22,6 | 29,7±21,6 | 30,7±21,9 | 31,3±25,3 | <0,001 |
| Insulina glulisina | 6,9±4,5 | 6,3±2,5 | 7,1±4,7 | 7,3±6,0 | <0,001 |
| Antidiabéticos orales, % | |||||
| Metformina | 76,9 | 74,1 | 77,8 | 78,8 | 0,698 |
| Sulfunilurea | 20,7 | 19,6 | 22,8 | 18,8 | 0,778 |
| Glinidas | 14,0 | 12,5 | 13,5 | 17,5 | 0,588 |
| Inhibidores de la DPP-4 | 13,8 | 15,2 | 9,4 | 21,3 | 0,034 |
| Glitazonas | 3,3 | 1,8 | 4,7 | 2,5 | 0,372 |
| Inhibidores alfaglucosidasa | 0,3 | 0,0 | 0,6 | 0,0 | 0,569 |
| Sin antidiabéticos orales | 12,4 | 15,2 | 11,1 | 11,3 | 0,561 |
| Otros fármacos, % | |||||
| Inhibidores de la ECA | 24,2 | 23,2 | 21,6 | 31,3 | 0,242 |
| ARA-2 | 43,3 | 42,0 | 48,0 | 35,0 | 0,147 |
| Calcioantagonistas | 23,7 | 25,0 | 22,2 | 25,0 | 0,825 |
| Diuréticos | 39,7 | 35,5 | 41,5 | 41,3 | 0,589 |
| Bloqueadores beta | 16,3 | 11,6 | 18,1 | 18,8 | 0,275 |
| Bloqueadores alfa | 4,7 | 0,9 | 7,6 | 3,8 | 0,030 |
| Estatinas | 68,6 | 71,4 | 70,2 | 61,3 | 0,270 |
| Fibratos | 9,4 | 8,9 | 11,1 | 6,3 | 0,460 |
| Ácido acetilsalicílico | 54,0 | 55,4 | 50,9 | 58,8 | 0,477 |
| Otros antiagregantes | 12,1 | 12,5 | 9,9 | 15,3 | 0,422 |
Resultados expresados como media aritmética±desviación estándar o porcentaje. ARA-2: antagonistas receptores de la angiotensina-2; DPP-4: dipeptidil peptidasa-4; ECA: enzima conversora de la angiotensina.
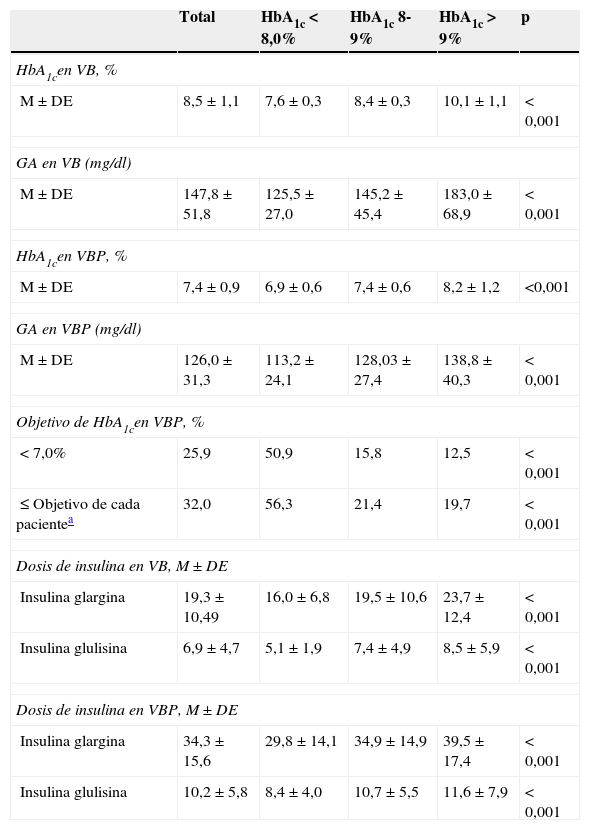
Las concentraciones de HbA1c en las VB y VBP se recogen en la tabla 3. La diferencia media fue de 1,1 (0,8) (IC 95%: 1,0-1,2%, p<0,001) en la muestra total evaluada, después de un promedio de 6,9 meses de la intensificación con insulina prandial. El 25,9% de los pacientes logró un valor <7% (solo el 0,8% en VB), entre ellos el 50,9% de los casos con HbA1c inicial <8%. El 32% de los pacientes había logrado el grado de control establecido como objetivo por su médico. En los subgrupos estratificados por concentraciones de HbA1c basal <8,0%, entre 8-9% y >9,0% las diferencias fueron de 0,7% (IC 95%: 0,6-0,8%), 1,0% (IC 95%: 0,9-1,1%), y 1,9% (IC 95%: 1,6-2,1%) respectivamente. Únicamente en el 4,4% de los pacientes no se consiguió una reducción en la concentración de HbA1c respecto a la VB. En el 44,9% de los casos se consiguió una reducción superior al 1,0%. Las dosis de insulina glargina y glulisina en la VBP se incrementaron respecto a las que se prescribieron inicialmente (tabla 3). Los ADO fueron ajustados en el 29,1% de los pacientes al introducir la insulina glulisina, y en el 87,7% de estos el ajuste consistió en una reducción de la dosis.
Concentraciones de hemoglobina glucosilada y dosis de insulina en la visista basal y la vissita basal plus. Grado de control
| Total | HbA1c<8,0% | HbA1c 8-9% | HbA1c>9% | p | |
|---|---|---|---|---|---|
| HbA1cen VB, % | |||||
| M±DE | 8,5±1,1 | 7,6±0,3 | 8,4±0,3 | 10,1±1,1 | <0,001 |
| GA en VB (mg/dl) | |||||
| M±DE | 147,8±51,8 | 125,5±27,0 | 145,2±45,4 | 183,0±68,9 | <0,001 |
| HbA1cen VBP, % | |||||
| M±DE | 7,4±0,9 | 6,9±0,6 | 7,4±0,6 | 8,2±1,2 | <0,001 |
| GA en VBP (mg/dl) | |||||
| M±DE | 126,0±31,3 | 113,2±24,1 | 128,03±27,4 | 138,8±40,3 | <0,001 |
| Objetivo de HbA1cen VBP, % | |||||
| <7,0% | 25,9 | 50,9 | 15,8 | 12,5 | <0,001 |
| ≤Objetivo de cada pacientea | 32,0 | 56,3 | 21,4 | 19,7 | <0,001 |
| Dosis de insulina en VB, M±DE | |||||
| Insulina glargina | 19,3±10,49 | 16,0±6,8 | 19,5±10,6 | 23,7±12,4 | <0,001 |
| Insulina glulisina | 6,9±4,7 | 5,1±1,9 | 7,4±4,9 | 8,5±5,9 | <0,001 |
| Dosis de insulina en VBP, M±DE | |||||
| Insulina glargina | 34,3±15,6 | 29,8±14,1 | 34,9±14,9 | 39,5±17,4 | <0,001 |
| Insulina glulisina | 10,2±5,8 | 8,4±4,0 | 10,7±5,5 | 11,6±7,9 | <0,001 |
GA: glucemia en ayunas; M±DE: media±desviación estándar.
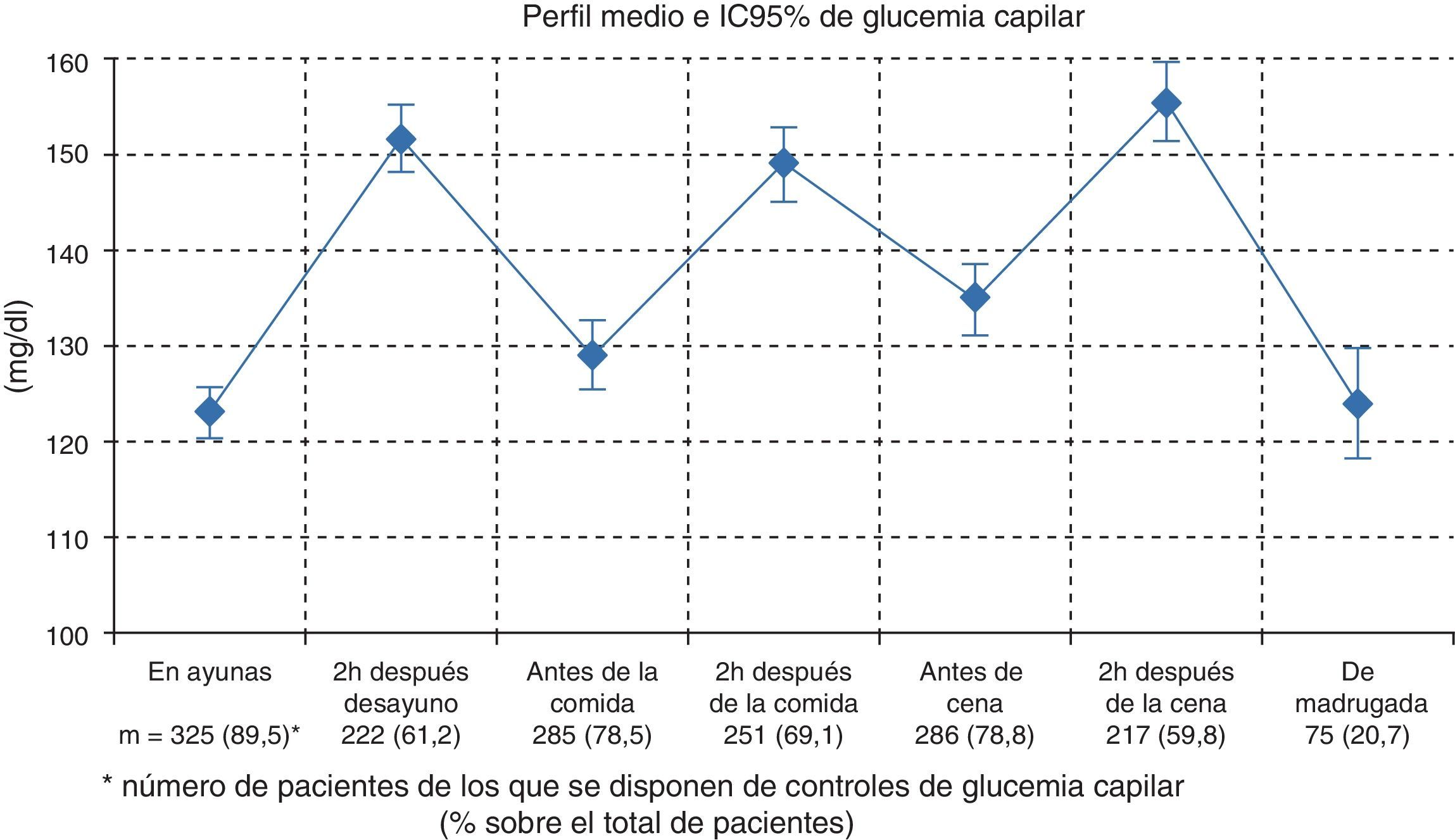
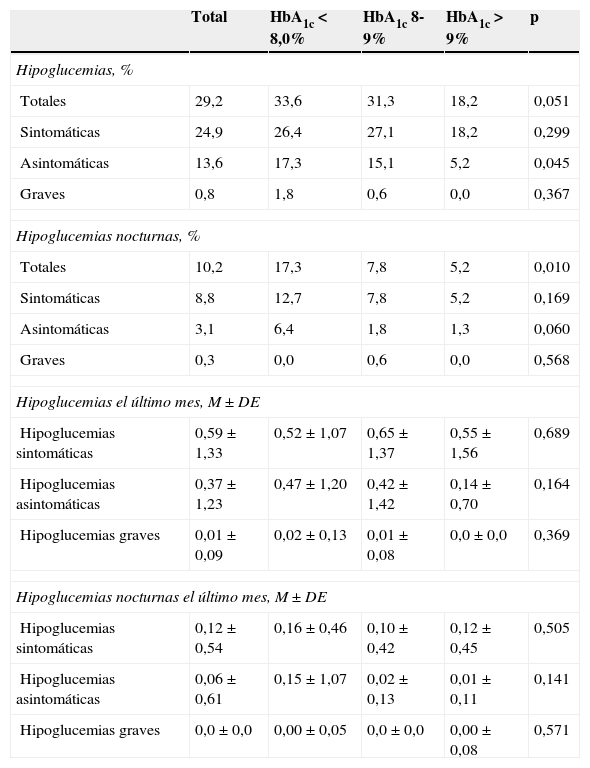
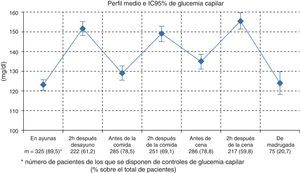
La diferencia media de GA entre la VB y la VBP fue de 21,8mg/dl (IC 95%: 16,7-27,0%, p<0,001) en la muestra total evaluada. En los grupos estratificados por concentraciones de HbA1c basal<8,0%, entre 8-9% y >9,0% las diferencias fueron de 12,4mg/dl (IC 95%: 6,8-17,9%), 17,3mg/dl (IC 95%: 11,0-26,6%) y 44,1mg/dl (IC 95%: 27,6-60,6) respectivamente. La GA<130mg/dl se observaba en la mitad de los pacientes antes de la insulinización prandial, aumentando al 62,8% de ellos tras la misma. Los valores de glucemia en los diferentes momentos del día se exponen en la figura 1. El número de hipoglucemias presentadas en el último mes antes de la VBP y sus características, en la muestra total evaluada y en los grupos estratificados por concentraciones de HbA1c basal, se recogen en la tabla 4. El 29,2% de los pacientes presentaron hipoglucemias, en su mayor parte sintomáticas, y el 10% de los pacientes tuvo episodios nocturnos. Las hipoglucemias graves solo se presentaron en 3 pacientes.
Presencia de hipoglucemias
| Total | HbA1c<8,0% | HbA1c8-9% | HbA1c>9% | p | |
|---|---|---|---|---|---|
| Hipoglucemias, % | |||||
| Totales | 29,2 | 33,6 | 31,3 | 18,2 | 0,051 |
| Sintomáticas | 24,9 | 26,4 | 27,1 | 18,2 | 0,299 |
| Asintomáticas | 13,6 | 17,3 | 15,1 | 5,2 | 0,045 |
| Graves | 0,8 | 1,8 | 0,6 | 0,0 | 0,367 |
| Hipoglucemias nocturnas, % | |||||
| Totales | 10,2 | 17,3 | 7,8 | 5,2 | 0,010 |
| Sintomáticas | 8,8 | 12,7 | 7,8 | 5,2 | 0,169 |
| Asintomáticas | 3,1 | 6,4 | 1,8 | 1,3 | 0,060 |
| Graves | 0,3 | 0,0 | 0,6 | 0,0 | 0,568 |
| Hipoglucemias el último mes, M±DE | |||||
| Hipoglucemias sintomáticas | 0,59±1,33 | 0,52±1,07 | 0,65±1,37 | 0,55±1,56 | 0,689 |
| Hipoglucemias asintomáticas | 0,37±1,23 | 0,47±1,20 | 0,42±1,42 | 0,14±0,70 | 0,164 |
| Hipoglucemias graves | 0,01±0,09 | 0,02±0,13 | 0,01±0,08 | 0,0±0,0 | 0,369 |
| Hipoglucemias nocturnas el último mes, M±DE | |||||
| Hipoglucemias sintomáticas | 0,12±0,54 | 0,16±0,46 | 0,10±0,42 | 0,12±0,45 | 0,505 |
| Hipoglucemias asintomáticas | 0,06±0,61 | 0,15±1,07 | 0,02±0,13 | 0,01±0,11 | 0,141 |
| Hipoglucemias graves | 0,0±0,0 | 0,00±0,05 | 0,0±0,0 | 0,00±0,08 | 0,571 |
Hipoglucemias registradas en la visita basal plus en la muestra total evaluada.
M±DE: media±desviación estándar.
El presente estudio muestra que en pacientes con DM2 atendidos por endocrinólogos en condiciones de práctica clínica habitual, con un control glucémico insuficiente, recibiendo tratamiento con insulina basal, la intensificación del tratamiento insulínico siguiendo la estrategia basal plus se asocia a una mejoría del control metabólico con una reducción media de HbA1c de 1,1%, alcanzando el 25,9% de los pacientes una HbA1c inferior al 7% en la visita de seguimiento. Un 29,2% de los pacientes presentaron hipoglucemias con una incidencia baja de hipoglucemias graves (<1% de los pacientes).
El tratamiento de la DM2 se basa, además de en la dieta y los cambios en el estilo de vida, en el uso de fármacos de forma escalonada desde la monoterapia con metformina hasta combinaciones de 2 o 3 fármacos hipoglucemiantes. La pérdida progresiva de la función de la célula β pancreática hace que a lo largo de su vida muchos pacientes requieran tratamiento con insulina. La pauta de inicio más habitual suele ser la adición de insulina de acción intermedia o prolongada al tratamiento previo con antidiabéticos orales (insulinoterapia basal). Esta estrategia se basa en el control de la glucemia en ayunas y ha demostrado ser eficaz, logrando una optimización del control glucémico en un elevado número de pacientes10,13. No obstante, un porcentaje significativo de pacientes no logrará alcanzar o mantener el objetivo de control glucémico debido a que presenta elevación de la glucemia posprandial. Entre las opciones terapéuticas disponibles se encuentran sustituir la insulinoterapia basal por 2 dosis de insulina premezclada de acción rápida con insulina de acción intermedia, o pasar a una estrategia bolo-basal, añadiendo a la insulina basal dosis de insulina de acción rápida antes de las comidas principales. Las insulinas premezcladas no permiten una titulación por separado de la insulina basal y la insulina rápida, y se asocian a un aumento del riesgo de hipoglucemias14. La estrategia bolo-basal es una pauta relativamente compleja que requiere frecuentes autocontroles de glucemia. Las dificultades en la implementación de esta estrategia pueden favorecer la inercia terapéutica y limitar la optimización del tratamiento. En los últimos años ha aparecido otra opción terapéutica que se basa en añadir a la insulina basal una única dosis de insulina rápida antes de la comida principal, que se define como aquella en la que hay mayor elevación de la glucemia posprandial (estrategia basal plus). La estrategia basal plus puede ser un escalón intermedio que facilite la transición entre la insulinoterapia basal y la estrategia bolo-basal15.
Los resultados de nuestro estudio son consistentes con otros estudios que han evaluado la estrategia basal-plus. En el estudio Proof of Concept16 106 pacientes con DM2 que no alcanzaron el objetivo de HbA1c≤7% tras tratamiento con insulina glargina con titulación de dosis, con el objetivo de optimizar la glucemia en ayunas, fueron aleatorizados a continuar el mismo tratamiento (grupo control) o a añadir una dosis de insulina glulisina a la comida principal (grupo intervención). A los 3 meses de tratamiento el 22% de pacientes del grupo intervención alcanzó el objetivo de HbA1c≤7%, frente al 9% del grupo control, con una reducción significativa de la HbA1c (–0,37 vs –0,11%) sin aumento del número de hipoglucemias.
En el estudio Oral Plus Apidra and Lantus12 se incluyeron 393 pacientes con DM2 mal controlada con insulina basal y antidiabéticos orales. Los pacientes se aleatorizaron a recibir una dosis de insulina glulisina antes del desayuno o antes de la comida principal. Desde una HbA1c basal de 7,4% ambos grupos alcanzaron una reducción de HbA1c de –0,4% a las 24 semanas de tratamiento, logrando una HbA1c≤7% en el 52% de pacientes del grupo tratado con glulisina antes de la comida principal, frente al 37% en el grupo de tratamiento antes del desayuno.
En el estudio 1-2-317 393 pacientes con DM2 mal controlada con insulina glargina y antidiabéticos orales fueron aleatorizados a recibir tratamiento con una, 2 o 3 dosis de insulina glulisina antes de las comidas principales. La reducción de HbA1c a los 6 meses de tratamiento fue mayor en el grupo de 3 dosis, aunque no significativa (–0,46%, –0,46% y –0,58% respectivamente). Sí fue significativamente superior el porcentaje de pacientes que lograron una HbA1c≤7% con 3 dosis de insulina rápida (30%, 33% y 45% respectivamente), aunque con el aumento del número de dosis de insulina glulisina aumentó de forma significativa la frecuencia de hipoglucemias graves (0,1, 0,3, 0,26 eventos/paciente-año respectivamente).
La reducción de HbA1c en nuestro estudio fue mayor que en los trabajos mencionados. A diferencia de estos, en el presente estudio el control de la glucemia en ayunas antes de la adición de la insulina de acción rápida era subóptimo (la glucemia plasmática en ayunas en promedio en la visita basal era 148mg/dl) y durante el desarrollo del estudio también se tituló la dosis de insulina basal. La dosis promedio de glargina aumentó de 19 unidades en la VB a 34 en VBP. La dosis promedio de insulina glulisina era de 7 unidades en VB y de 10 unidades en VBP. La intensificación de la pauta de insulina con la adición de una insulina de acción rápida tiene como objetivo principal el control de la glucemia posprandial; en nuestro estudio más del 80% de pacientes en los que se disponía de perfiles de autoanálisis de glucemia capilar tenía las glucemias capilares posprandiales en objetivos de control tras la adición de insulina glulisina.
Durante el estudio los antidiabéticos fueron ajustados en un 29,1% de los pacientes, y en la gran mayoría de estos casos (87,7%) el ajuste fue una reducción de dosis. Las recomendaciones actuales5 sobre el empleo de hipoglucemiantes junto con insulina son que la metformina se debe mantener independientemente de la pauta de insulina empleada, mientras que los secretagogos de insulina deben ser retirados cuando se introduce al tratamiento la insulina prandial. En la VB más de un 20% de los pacientes del estudio recibían tratamiento con secretagogos.
Nuestro trabajo presenta varias limitaciones. Se trata de un estudio retrospectivo, no controlado con ningún comparador y con un periodo de seguimiento relativamente corto. Asimismo, no se realizó auditoría de los datos aportados por los investigadores. Además, no se puede separar el efecto sobre la mejoría del control glucémico de la adición de insulina rápida antes de la comida principal de la titulación de la dosis de insulina basal. Sin embargo, cabe resaltar que se trata del primer estudio nacional multicéntrico que tiene como objetivo valorar la eficacia y seguridad de la estrategia basal-plus en la práctica clínica.
Por tanto, como conclusión podemos decir que la estrategia basal-plus es eficaz y segura en un amplio rango de pacientes con DM2 que no cumplen previamente criterios de correcto control metabólico. Estos resultados avalan su uso en la práctica clínica habitual.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEl estudio ha sido financiado por Sanofi España.
Conflicto de interesesManuel Pérez Maraver ha recibido honorarios por actividades de formación continuada de NovoNordisk, Lilly y Sanofi. Gracia Romero trabaja en Sanofi.
Los otros autores declaran no tener ningún conflicto de intereses.