La insulina y el glucagón son liberados por los islotes pancreáticos, y juegan un papel esencial en la regulación de la homeostasis y el metabolismo glucídico. Un delicado equilibrio entre la secreción de insulina y glucagón mantiene los niveles de glucosa en plasma dentro de un estrecho rango fisiológico. Estudios clínicos han sugerido que un incremento inapropiado del glucagón (hiperglucagonemia) desempeña un papel importante en la patogénesis de la diabetes. Sin embargo, por décadas, los esfuerzos en investigación han estado orientados a estudiar el rol de la insulina y la terapia de reemplazo con esta hormona. En esta revisión resumimos avances recientes en el entendimiento de las acciones del glucagón, su papel en la fisiopatología de la diabetes y proveemos información referente al potencial terapéutico de la inhibición del receptor de glucagón para el tratamiento de la diabetes.
Insulin and glucagon are both released from the pancreatic islets, and they play pivotal roles in regulating glucose homeostasis and metabolism. A fine balance between insulin and glucagon secretion maintains the blood glucose levels within the narrow physiological range. Clinical studies have suggested that an inappropriate increase in glucagon (hyperglucagonaemia) plays an important role in the pathogenesis of diabetes. However, for decades, research efforts have been devoted to studying the role of insulin and insulin-replacement therapy. In this review, we summarise recent advances in understanding the actions of glucagon, its role in the pathogenesis of diabetes, and provide an overview of the therapeutic potential of glucagon receptor inhibition for the treatment of diabetes.
La porción endocrina del páncreas está constituida por los islotes de Langerhans, los cuales son estructuras numerosas, de tamaño variable, que se encuentran distribuidas por todo el páncreas especialmente en la cola, y representan apenas el 2% del volumen total de este órgano. Dentro de los islotes destacan las células α y β pancreáticas encargadas de la síntesis y secreción de glucagón e insulina respectivamente, siendo estas 2 hormonas las principales reguladoras de la homeostasis y el metabolismo de la glucosa.
Desde el descubrimiento de la insulina por Banting y Best en el año 1921 se le ha otorgado un papel central y casi exclusivo a la insulina en la fisiopatología de la diabetes mellitus; sin embargo, la evidencia sugiere que la disfunción en las interacciones paracrinas dentro del islote pudieran jugar un papel clave en la aparición de trastornos en el metabolismo hidrocarbonado, y formar parte integral de un conjunto de factores que desencadenan la aparición de la diabetes mellitus.
Este artículo de revisión lo enfocaremos en las acciones biológicas del glucagón, así como su contribución en la fisiopatología de la diabetes mellitus, y las posibles intervenciones farmacológicas destinadas a modular sus efectos en el tratamiento de esta patología.
Síntesis y secreción de glucagónEl glucagón es un polipéptido de 29 aminoácidos secretado por las células α del islote pancreático, producto del procesamiento de un precursor, preproglucagón, de 180 aminoácidos de los cuales 20 constituyen el péptido señal y el resto la molécula de proglucagón, la cual además de glucagón contiene las secuencias del péptido similar al glucagón (GLP, glucagon-like peptide) tipo 1 y 2, la oxintomodulina y la glicentina. El procesamiento del preproglucagón en los diferentes tejidos es el resultado de la expresión diferencial de enzimas denominadas prohormonas convertasas (PC), de las cuales la PC1 se expresa a nivel de cerebro y células L del intestino liberando predominantemente glicentina, GLP-1 y GLP-2, y la PC2 expresada a nivel de las células α pancreáticas liberan principalmente glucagón1.
La secreción de glucagón, al igual que la de insulina, es regulada fundamentalmente por los niveles de glucosa en plasma. De esta manera, una disminución en los niveles de glucemia estimula la actividad del canal de potasio dependiente de ATP (KATP), el cual sitúa el potencial de membrana celular en un rango que permite la apertura de canales de sodio (Na+) y calcio (Ca+2) dependientes de voltaje. El aumento en la concentración intracelular de estos 2 iones despolariza la membrana, incrementando la conductancia al Ca+2, el cual favorece la exocitosis de los gránulos de glucagón. Al aumentar la glucemia, se produce un incremento en la concentración intracelular de ATP, lo cual condiciona el cierre de los canales de KATP produciéndose el cese del potencial de acción inducido por Na+ y Ca+2 y por consiguiente termina la secreción de glucagón1,2.
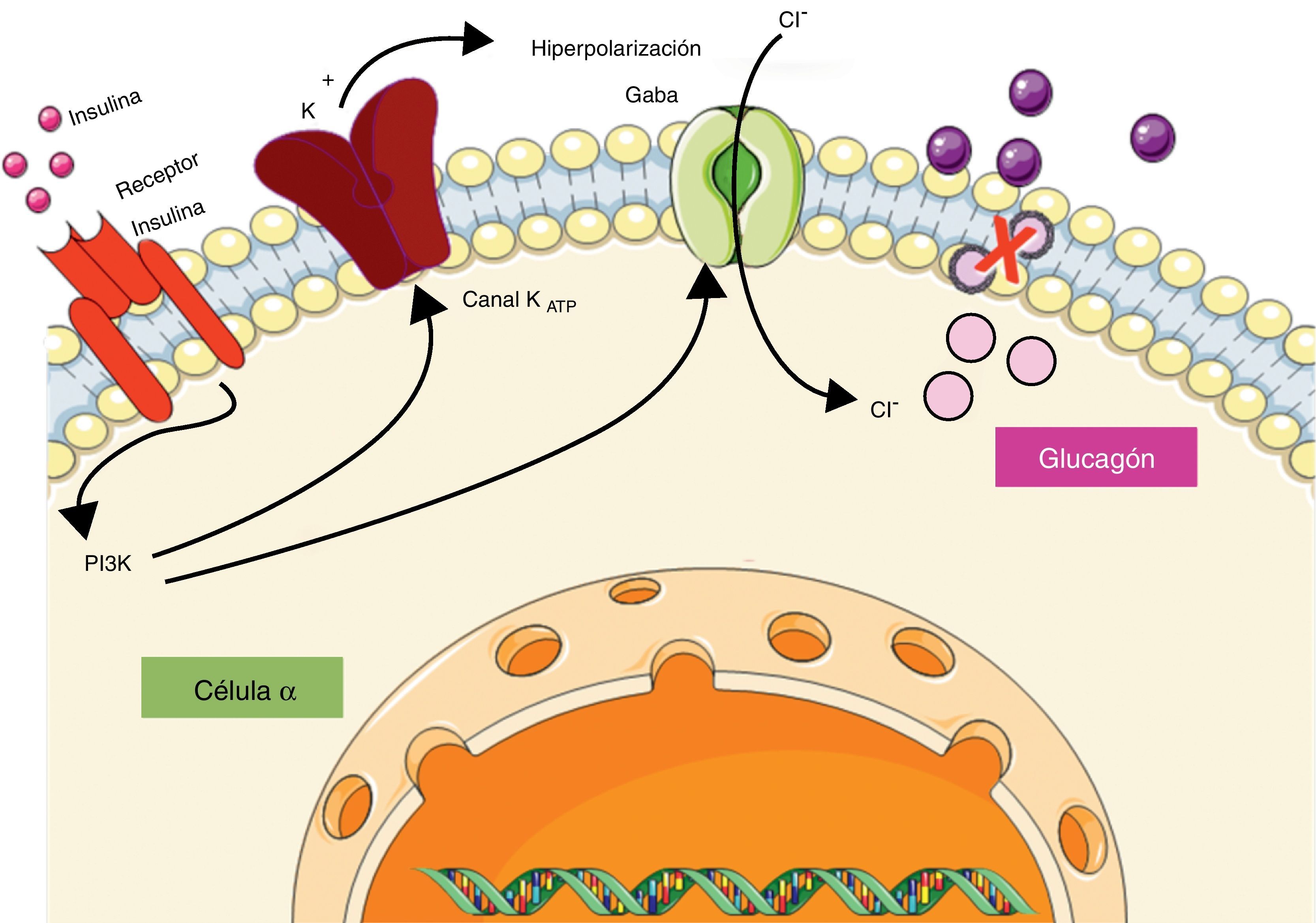
Se ha demostrado que la insulina al actuar sobre su receptor a nivel de la célula α provoca, por un lado, hiperpolarización de la membrana mediada por el canal de KATP, y por otro, transloca hacia la membrana celular un receptor tipo A de ácido gamma-aminobutírico (GABA), el cual responde al GABA secretado por las células β favoreciendo la hiperpolarización de la membrana y suprimiendo la secreción de glucagón (fig. 1)3. Kawamori et al.4 estudiaron el papel de la insulina en la secreción de glucagón creando un modelo experimental de ratón al cual se le eliminó de forma selectiva el receptor de insulina en la célula α (αIRKO), evidenciando hiperglucemia de ayuna leve pero una marcada hiperglucemia e hiperglucagonemia posprandial, lo cual sugiere un papel modulador de la insulina sobre la secreción de glucagón. De igual forma, se le atribuido un papel modulador al zinc sobre la secreción de glucagón. A nivel de la célula β, la insulina se encuentra dentro de los gránulos secretores formando hexámeros estables alrededor de 2 átomos de zinc, pero después de la exocitosis de los gránulos estos hexámeros se exponen a un cambio de pH de 5,5 a 7,4, lo cual provoca disociación y la consiguiente liberación de los átomos de zinc. Se ha postulado que el zinc de forma independiente puede inducir hiperpolarización de la membrana a través del canal de KATP, actuando de manera sinérgica con la insulina en la regulación de la secreción de glucagón3.
Regulación de la secreción de glucagón por parte de insulina a nivel de la célula α pancreática. La insulina al unirse a su receptor activa la vía de la fosfatidilinositol-3-quinasa (PI3K) provocando la apertura de los canales de potasio dependientes de ATP (KATP), y el reclutamiento de los canales de cloro (Cl−) activados por el receptor de ácido gamma-aminobutírico (GABA), los cuales en conjunto provocan hiperpolarización de la membrana e inhiben la liberación de glucagón.
Además de la glucosa y la insulina, existen otros factores capaces de regular la secreción de glucagón, entre ellos: GLP-1, GLP-2, ácidos grasos, el sistema nervioso autónomo y los aminoácidos circulantes1,5,6.
Mecanismo de acción y efectos biológicos del glucagónLos efectos del glucagón son mediados por la unión a su receptor, el cual pertenece a la familia de receptores acoplados a proteína G, y consta de 7 dominios transmembrana, siendo expresado principalmente en el hígado y en el riñón, y en menor proporción a nivel del corazón, adipocitos, páncreas endocrino, cerebro, retina y tracto gastrointestinal. Cabe destacar que en el páncreas endocrino el receptor de glucagón se expresa fundamentalmente en la célula β pancreática, lo cual sugiere que existe una fuerte interacción paracrina bidireccional entre la célula α y la célula β pancreática7,8. En ratones transgénicos con sobreexpresión del receptor de glucagón en las células β, se observó un aumento en la secreción de insulina dependiente de glucosa, así como una mejoría de la tolerancia a los carbohidratos, lo cual sugiere que el glucagón mejora la función de las células β pancreáticas9.
La unión del glucagón a su receptor activa la adenilciclasa provocando un aumento del adenosín monofosfato cíclico (AMPc) intracelular que determina la activación de la proteinquinasa A (PKA, protein kinase A), la cual fosforila enzimas claves que ponen en marcha todas las acciones biológicas del glucagón10. Además de esta vía bien descrita, el glucagón también se ha implicado en vías de señalización como la de la proteinquinasa asociada a mitógenos (MAPK, mitogen-activated protein kinase) y la proteinquinasa dependiente de adenosín monofosfato (AMPK, AMP activated protein kinase)11,12.
A nivel hepático, el glucagón aumenta la liberación de glucosa mediante la inhibición de la síntesis de glucógeno y la estimulación tanto de la glucogenólisis como de la gluconeogénesis. Además, el glucagón favorece la captación de aminoácidos tales como alanina, glicina y prolina, los cuales sirven de sustrato para la gluconeogénesis. En el adipocito, la lipasa sensible a hormona media la degradación de triglicéridos a ácidos grasos no esterificados y glicerol. El glucagón, aunque no modifica los niveles transcripcionales de esta enzima, sí aumenta la liberación de glicerol por parte del adipocito, pudiendo este servir como sustrato de la gluconeogénesis. Asimismo, el glucagón inhibe la lipogénesis al reducir las concentraciones de malonil-CoA por un mecanismo dual: por un lado inhibe la glucólisis y por otro inhibe la acetil-CoA carboxilasa, y por ende al reducir los niveles de malonil-CoA favorece la cetosis al activar la enzima carnitina-palmitoil-transferasa que permite la entrada de ácidos grasos en las mitocondrias, donde son posteriormente oxidados a cuerpos cetónicos que pueden ser usados como combustible del sistema nervioso central en algunas circunstancias como el ayuno prolongado1,13.
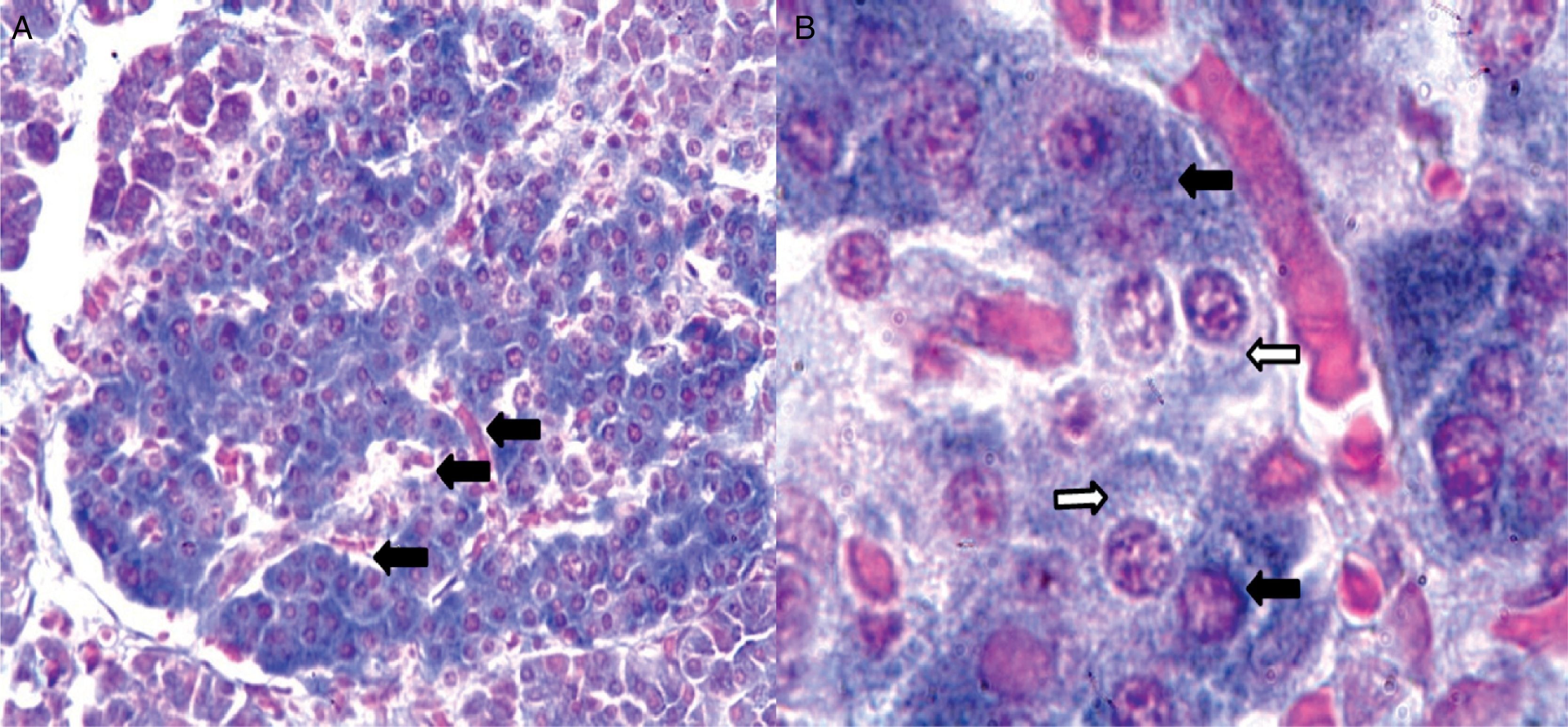
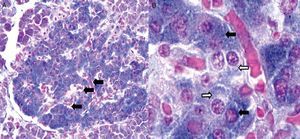
Citoarquitectura del islote de Langerhans en diabetes mellitusEn ratones las células β forman la región central o núcleo del islote, mientras que las células α tienden a ubicarse predominantemente en la periferia. La sangre arteriolar pasa por el núcleo del islote para ser enriquecida por insulina proveniente de las células β y luego alcanza las células α, donde la insulina puede regular la secreción de glucagón14; sin embargo, en islotes humanos, las células endocrinas no tienen una distribución particular, lo cual parece indicar que la microcirculación no es el único mecanismo que determina la comunicación entre ellas; pero entonces, ¿cómo ocurren las interacciones paracrinas entre las células α, β y δ? Normalmente en islotes humanos las células β no se encuentran agrupadas entre sí, sino que aproximadamente el 71% de las células β están en contacto con células no β, lo cual aumenta de forma significativa la posibilidad de interacciones paracrinas (fig. 2)15.
Imágenes tomadas con microscopio óptico de un corte de páncreas humano. 2A: vista con objetivo de bajo aumento (20X) donde se muestra uno de los islotes de Langerhans (en el centro). Las flechas señalan capilares distribuidos en toda la estructura del islote. 2B: en esta imagen del islote con objetivo de 100X se observan capilares rodeados por células que con la técnica de Gomori se distinguen como beta (azul intenso) y no beta (citoplasma rojo o pálido de aspecto granular). Las flechas negras señalan células beta, mientras que las flechas blancas señalan típicas células no beta.
La células β pancreáticas son estimuladas principalmente por la hiperglucemia y responden con un pico rápido de insulina, seguido de una fase de secreción más lenta y sostenida (secreción bifásica de insulina). Se estima que la primera fase de secreción de insulina representa solo el 7% de la insulina liberada en respuesta a un estímulo, lo cual resulta insuficiente para ejercer un efecto hipoglucemiante significativo; sin embargo, habitualmente la primera fase de secreción insulínica se acompaña de una disminución recíproca en la glucagonemia, lo cual hace pensar que posiblemente el pico de secreción rápida de insulina sea una señal paracrina que tenga como objetivo inhibir la secreción de glucagón más que controlar la glucemia16.
En la diabetes mellitus tipo 1, las células β de los islotes son destruidas como consecuencia de la autoinmunidad, lo cual priva a las células α de la inhibición provista por la insulina provocando hiperglucagonemia con efectos catabólicos letales que pudieran conllevar a la aparición de cetoacidosis diabética17,18. Resulta interesante que el nivel requerido de insulina para suprimir la secreción de glucagón a nivel de las células α sea 50 veces mayor que los niveles necesarios para la regulación de la homeostasis glucémica en los tejidos periféricos16. Esto significa que posiblemente no estemos insulinizando en el lugar correcto, y más aún que no podemos suprimir a las células α sin «sobreinsulinizar» los tejidos periféricos como el hígado y otros tejidos poshepáticos, con las consecuencias deletéreas que eso implica como la activación de señales mitogénicas y proliferadoras vía MAPK a nivel del receptor de insulina.
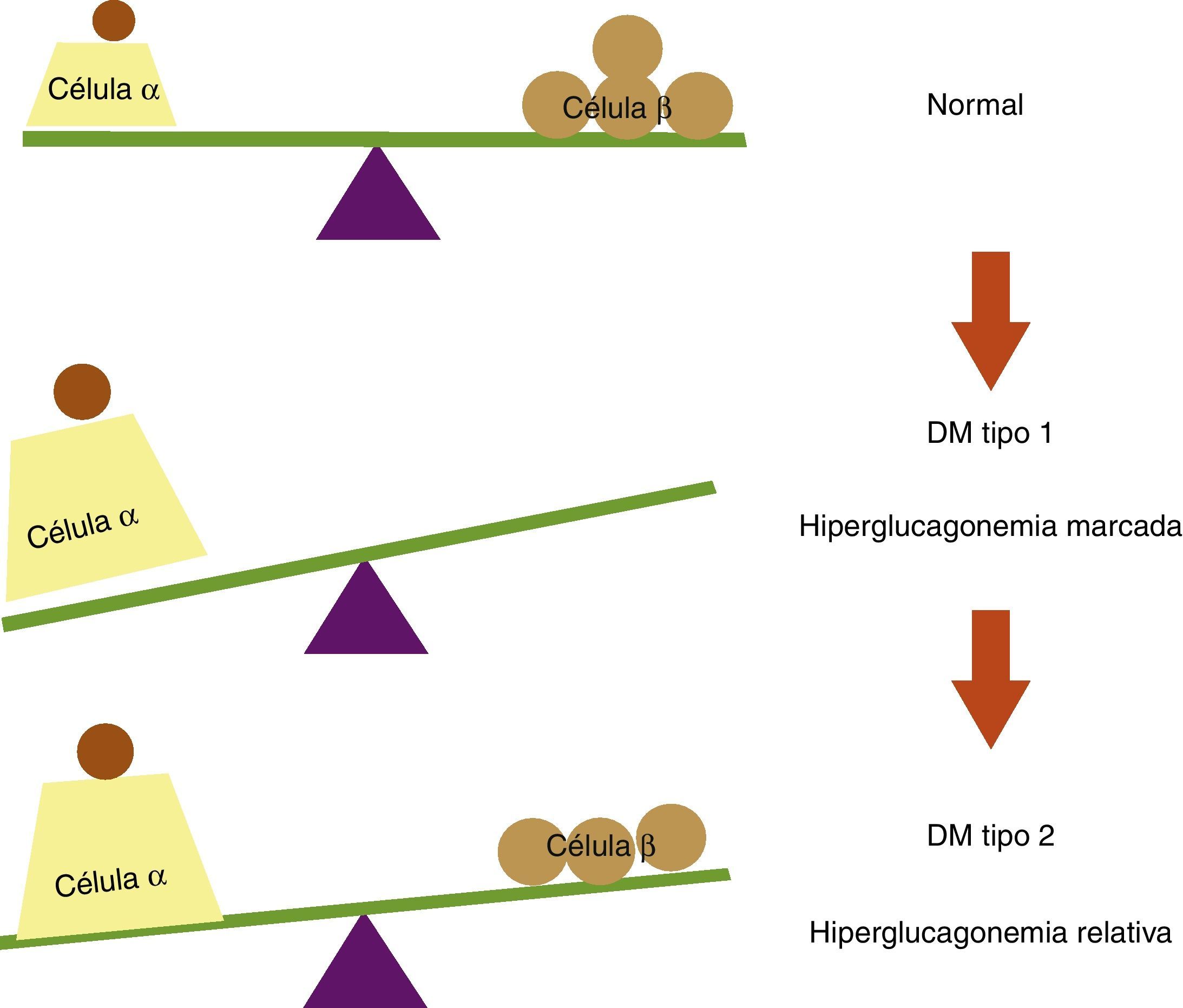
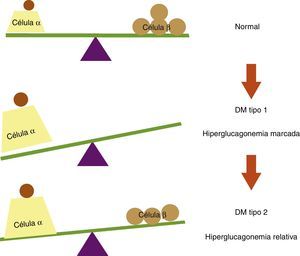
La topografía del islote en la diabetes mellitus tipo 2 en sus estadios iniciales no difiere mucho con relación al islote de pacientes no diabéticos19; sin embargo, la diabetes mellitus tipo 2 lleva implícito un fenómeno de disfunción de la célula β pancreática como consecuencia de la glucolipotoxicidad a la que es expuesta y que conlleva finalmente apoptosis con pérdida de la masa de células β, dejando de igual forma a las células α carentes de la inhibición paracrina por parte de la insulina20,21. Además como se mencionó, el pico rápido de secreción insulínica sirve como señal paracrina para suprimir a las células α vecinas, y resulta interesante que sea precisamente esta fase la que se afecta más precozmente en la diabetes mellitus tipo 2, lo cual nos lleva a sugerir que al restituir esta fase se logra un mejor control metabólico en los pacientes diabéticos debido a la inhibición de la hiperglucagonemia relativa observada en esta población (fig. 3).
Balance entre células α y células β pancreáticas en condiciones normales y en diabetes mellitus (DM). En sujetos no diabéticos existe un equilibrio entre las células α y las células β pancreáticas. En la DM tipo 1 este equilibrio se rompe debido a la destrucción autoinmune de las células β, lo cual conlleva a una hiperglucagonemia marcada por falta de inhibición paracrina de las células α. En la DM tipo 2 se observa una hiperglucagonemia relativa, ya que a pesar de la disminución en la masa de células β, se preserva cierta reserva insulínica que inhibe la secreción de glucagón en la células α pancreáticas.
Aunque la diabetes mellitus sea entendida como un «continuum», es de particular importancia tratar de dilucidar en qué momento de la historia natural de la enfermedad comienza el glucagón a jugar un papel importante. Algunos autores han presentado evidencia según la cual la hiperglucagonemia no aparece como un fenómeno precoz22; mientras que otros han encontrado un vínculo temprano entre hiperglucagonemia y diabetes mellitus, e incluso lo han logrado relacionar con estados de resistencia a la insulina previos23.
La disfunción de la célula β pancreática es un defecto importante en la patogénesis de la diabetes mellitus tipo 2. Kulkarni et al.24, demostraron en modelos de ratones con inactivación específica del receptor de insulina en la célula β, que los defectos en la señalización de esta hormona se asocian con disfunción de célula β. Por ende si en la diabetes mellitus tipo 2 existe una resistencia de la célula β a la acción de la insulina, se podría asumir que un fenómeno similar ocurre en las células α, lo cual llevaría a una incapacidad para controlar la secreción de glucagón mediada por insulina. Visto de esta forma se puede plantear la posibilidad de que una célula α «irrefrenable» pueda ser un defecto temprano que precede o aparece concomitante a la génesis del defecto secretor de insulina. Estas observaciones concuerdan con la teoría «bihormonal pancreática» de la diabetes mellitus propuesta por Unger y Orci hace varias décadas25.
Recientemente Lee et al.26 aportaron nuevos conocimientos al rol protagónico del glucagón en la patogénesis de la diabetes mellitus, al estudiar ratones knockout para el receptor de glucagón, en los cuales indujeron destrucción de las células β con streptozotocina, observando una tolerancia glucídica normal y supresión de la cetogénesis a pesar de la ausencia de insulina, lo cual sugiere que esta hormona pudiera tener un papel marginal o tal vez nulo en un hígado no expuesto a la acción del glucagón. Cabe destacar que si consideramos que estos ratones estaban funcionalmente pancreatectomizados, ¿deberíamos esperar que seres humanos pancreatectomizados mostraran de igual forma una tolerancia glucídica normal? Esto no ocurre. Es posible especular que los pacientes pancreatectomizados pudieran presentar cierta producción de glucagón proveniente del intestino, el cual contribuye a la severidad del fenotipo diabético observado en esta población.
Glucagón y complicaciones renales y cardiovascularesLas complicaciones renales y cardiovasculares forman parte importante del espectro clínico de la diabetes mellitus27. La infusión sistémica de glucagón ha demostrado que induce una marcada hiperfiltración glomerular, la cual podría ser mediada por su receptor de membrana en una vía dependiente de AMPc, prostaglandinas o incluso óxido nítrico28–31. La hiperfiltración glomerular persistente inducida por el glucagón puede causar hipertrofia y proliferación de las células mesangiales con la subsecuente expansión mesangial y el depósito de matriz extracelular7; sin embargo, es bien conocido que la hiperglucemia puede provocar también estos efectos, por ende para minimizar el efecto de la hiperglucemia secundaria a la administración de glucagón. Li et al.32,33 han usado modelos celulares in vitro de células mesangiales de rata evidenciando que el glucagón tiene efectos promotores del crecimiento y proliferación celular independientes de la hiperglucemia o factores hemodinámicos renales.
Por otra parte, es bien conocido que la hiperactivación del sistema renina angiotensina (SRA) juega un papel protagónico en la aparición y progresión de complicaciones renales y cardiovasculares en la diabetes mellitus34. En estudios in vitro se ha demostrado que el glucagón incrementa la producción de angiotensina II (AngII)33, y además el bloqueo del SRA a través de bloqueadores del receptor AT1 de AngII (BRA) también inhibe la activación de la PKA inducida por el receptor de glucagón35. Estudios in vivo han puesto en evidencia que los inhibidores de la enzima convertidora de angiotensina (IECA) como enalapril previenen la hiperfiltración glomerular inducida por glucagón en ratas anestesiadas36. Estos resultados sugieren que el receptor de glucagón puede interactuar de manera sinérgica con el receptor AT1 de AngII en el glomérulo o en las células mesangiales, y provee un nuevo mecanismo que contribuye a explicar el efecto nefroprotector de esta clase de medicamentos.
En cuanto a la asociación entre glucagón y riesgo cardiovascular, esta resulta poco clara, ya que si bien es cierto que el glucagón puede actuar de forma sinérgica con la AngII y a través de esa vía provocar efectos deletéreos en el sistema cardiovascular, también se ha descrito en modelos experimentales que la administración crónica de glucagón produce efectos hipolipemiantes con reducción en los niveles plasmáticos de triglicéridos, ácidos grasos libres y colesterol total. Estos efectos se explican por la disminución en la secreción de VLDL por parte del hígado, el aumento en la oxidación de ácidos grasos y la disminución en el acúmulo de lípidos, lo cual previene la aparición de adiposidad visceral37,38; sin embargo, en seres humanos un estudio reciente39 demostró que la administración aguda de glucagón no afecta la lipogénesis de novo ni la concentración plasmática de lipoproteínas cargadas con apolipoproteína B100 (apoB100), lo cual hace suponer que la dislipidemia propia del paciente diabético caracterizada por hipertrigliceridemia, bajos niveles de colesterol de lipoproteína de alta densidad (HDL, high density lipoprotein) y altos niveles de colesterol de lipoproteína de baja densidad (LDL, low density lipoprotein) pequeña y densa, se deben al fenómeno de resistencia insulínica y no a la hiperglucagonemia relativa presente en este grupo de pacientes.
Intervenciones farmacológicas destinadas a modular las acciones del glucagón en diabetes mellitusBasándose en el concepto de que el metabolismo y la homeostasis de la glucosa es controlado principalmente por las hormonas pancreáticas insulina y glucagón, la industria farmacéutica ha desarrollado medicamentos dirigidos a modular las acciones del glucagón a nivel de su receptor. Estudios recientes40–43 han demostrado las propiedades antidiabéticas de la leptina, un poderoso supresor del glucagón. La administración de leptina recombinante a ratones con insulinopenia absoluta demostró ser tan efectiva como la insulina para revertir el hipercatabolismo que caracteriza la diabetes mellitus tipo 1. Además, la adición de leptina a dosis bajas de insulina (10% de la dosis óptima) ha demostrado ser efectiva en suprimir la elevada variabilidad glucémica que caracteriza a esta forma de diabetes. Este efecto beneficioso fue atribuido a la supresión de la hiperglucagonemia, lo cual permitió reducir hasta el 90% de los niveles de insulina, disminuyendo por tanto el riesgo de hipoglucemia.
Otra intervención tendente a modular las acciones del glucagón ha sido el desarrollo de antagonistas selectivos de su receptor. En el año 1982 Johnson et al.44 demostraron que el antagonista peptídico del glucagón [l-N alpha-trinitrophenylhistidine, 12-homoarginine]-glucagon (THG) disminuía significativamente (30-65%) la glucemia en ratas hechas diabéticas con streptozotocina. In vitro, el THG es un antagonista potente de la adenililciclasa hepática activada por el receptor de glucagón, pero al ser un antagonista peptídico su utilidad para el tratamiento de la diabetes es restringido debido a que no puede ser utilizado por vía oral, lo cual condujo al desarrollo de antagonistas no peptídicos como el 2-(benzimidazol-2-ylthio)-1-(3,4-dihydroxyphenyl)-1-ethan (NNC 92-1687), el cual producía una inhibición competitiva del receptor de glucagón45. El antagonista no peptídico Bay 27-9955 [(+)-3,5-diisopropyl-2-(1-hydroxyethyl)-6-propyl-4’-fluoro-1,1’-biphenyl] fue el primero en demostrar eficacia en estudios doble ciego, placebo-controlado en seres humanos46. En este estudio, una dosis de 200mg de Bay 27-9955 fue capaz de reducir la hiperglucemia inducida por la hiperglucagonemia; sin embargo, el beneficio y los efectos adversos a largo plazo de este fármaco se desconocen ya que no se realizaron estudios de seguimiento.
Como se mencionó, el GLP-1 es una hormona producida por las células L del intestino, y es capaz de regular la secreción de glucagón. Este péptido tiene una vida media corta, ya que es degradado rápidamente por la enzima dipeptidil peptidasa IV (DPP-IV), la cual metaboliza tanto al GLP-1 como al glucagón47–52. En la última década ha surgido una nueva clase terapéutica para pacientes con diabetes mellitus tipo 2, dirigida a inhibir a la DPP-IV, con el fin de aumentar la vida media del GLP-1. Dentro de estos medicamentos encontramos la sitagliptina y la vildagliptina, los cuales no solamente incrementan la secreción de insulina dependiente de glucosa, sino que además suprimen la secreción de glucagón por parte de las células α50–52. El mecanismo por el cual los inhibidores de la DPP-IV disminuyen los niveles de glucagón no es bien conocido, debido a que el glucagón también es sustrato de esta enzima, y por tanto su inhibición debería conducir a un aumento en lugar de disminuir la glucagonemia. Es posible que estos inhibidores puedan inicialmente aumentar tanto los niveles de glucagón como los de GLP-1, y este último ejercer un efecto directo a nivel de la célula α que suprima la secreción de glucagón. En este sentido, los agonistas peptídicos del receptor de GLP-1 como exenatide y liraglutide han demostrado beneficios antidiabéticos tanto in vitro como in vivo al estimular la secreción de insulina y simultáneamente inhibir la secreción de glucagón53–55. Estos fármacos han sido aprobados para el tratamiento de la diabetes mellitus tipo 2; sin embargo, si sabemos que el tratamiento de la diabetes mellitus tipo 1 puede ser optimizado controlando la hiperglucagonemia marcada de esta patología, ¿no sería beneficioso el uso de intensificadores de incretinas en este grupo de pacientes debido a su efecto supresor en la célula α? Con la evidencia actual no es posible contestar esta interrogante, y solo el tiempo y la evidencia dirán si esta clase terapéutica tiene cabida en una patología que hasta hace unos años tenía un enfoque exclusivamente «insulino-céntrico».
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.