Objetivo: Evaluar la prevalencia de enfermedad tiroidea autoinmune (ETA) en pacientes con diabetes tipo 1 (DM1) y su relación con variables clínicas y analíticas. Material y métodos: Estudio observacional descriptivo en pacientes con DM1 en el que se analiza la prevalencia de ETA y los factores relacionados. Resultados: Se estudiaron 507 pacientes con DM1 (50,4% mujeres) de 33,5 ± 11,8 años de edad y 16,1 ± 9,5 años de evolución de la DM1, y con un nivel medio de HbA1c del 7,8 ± 1,4%. El 17,8% de los pacientes presentaba ETA (9,9% hipotiroidismo primario, 7,1% hipotiroidismo subclínico y 0,8% enfermedad de Graves). Los pacientes DM1 y ETA eran, con mayor frecuencia, mujeres (24,6 frente a 10,8%; p <0,001) y fumadores (15,6 frente a 2,2%; p= 0,039) y presentaban niveles séricos de colesterol LDL (c-LDL) más elevados (110,1 ± 31,4 frente a 102,9 ± 28,8 mg/dL; p <0,043). Conclusión: Observamos una elevada prevalencia de ETA en pacientes con DM1, asociándose a sexo femenino, tabaquismo activo y niveles elevados de c-LDL. Recomendamos el cribado sistemático de ETA en pacientes con DM1, que permita un precoz diagnóstico y tratamiento.
Objective: To evaluate the prevalence of autoimmune thyroid disease in type 1 diabetes patients and their association to clinical and analytical parameters. Methodology: A retrospective observational study of type 1 diabetes patients was designed to analyze the prevalence of autoimmune thyroid disease and related factors. Results: The study included 507 patients with type 1 diabetes (50.4% women), aged 33.5 ± 11.8 years with an average duration of diabetes of 16.1 ± 9.5 years. The average level of HbA1c was 7.8 ± 1.4%. The prevalence of autoimmune thyroid function disorder was 17.8% (9.9% primary hypothyroidism, 7.1% subclinical hypothyroidism, and 0.8% Graves disease). There was a positive association between thyroid disease and female gender (24.6% versus 10.8% in men, p <0.001), smoking (15.6% versus 2.2%, p= 0.039) and serum LDL levels (110.1 ± 31.4 mg/dL versus 102.9 ± 28.8 mg/dL; p <0.043). Conclusion: Prevalence of autoimmune thyroid disease in type 1 diabetes patients is high and it is associated with female gender, smoking and increased LDL levels. We suggest a systematic screening for autoimmune thyroid disease in type 1 diabetes to establish an early diagnose and treatment.
Asociación Americana de Diabetes
diabetes tipo 1
enfermedad tiroidea autoinmune
hemoglobina glucosilada
colesterol HDL
índice de masa corporal
colesterol LDL
unidad de gestión clínica.
La diabetes tipo 1 (DM1) es una enfermedad crónica que aparece como consecuencia de la destrucción selectiva de la célula beta del islote pancreático por mecanismos autoinmunes. Se asocia con cierta frecuencia a otras patologías de etiología inmunitaria, siendo la más prevalente la enfermedad tiroidea autoinmune (ETA)1. Tanto la DM1 como la ETA son enfermedades de glándulas endocrinas originadas por la estimulación de células T organoespecíficas. La asociación de ambas se presenta con más frecuencia en pacientes genéticamente predispuestos, como son los portadores del haplotipo HLA-DR32,3. Un porcentaje importante de pacientes con DM1 presenta anticuerpos antitiroideos positivos. De ellos, hasta un 50% progresa a ETA, fundamentalmente a hipotiroidismo primario, el cual se halla presente en un 2-5% de los pacientes con DM14,5. El hipertiroidismo de origen autoinmune también se ha asociado con la DM1, aunque con una prevalencia bastante menor, de alrededor del 1-2%6.
Se ha documentado que la presencia de disfunción tiroidea se asocia a un aumento de riesgo de aterosclerosis y enfermedad cardiovascular. En el caso del hipotiroidismo primario, este incremento parece relacionarse con la presencia de dislipemia, aumento de la presión arterial (PA) diastólica y disfunción endotelial7. El tratamiento con hormona tiroidea podría tener efectos beneficiosos, actuando directamente sobre la PA y disminuyendo la aterogénesis8,9. Sin embargo, no existen datos concluyentes para afirmar que el tratamiento del hipotiroidismo subclínico mejore la aterogénesis y el riesgo de enfermedad cardiovascular.
Como es bien sabido, la enfermedad aterosclerótica macro-vascular es la principal causa de morbimortalidad en los pacientes con diabetes. Es necesario, por tanto, un abordaje integral de los factores de riesgo de enfermedad cardiovascular, entre ellos el estricto control de los lípidos y de la PA. En este sentido, el diagnóstico precoz y el tratamiento de la disfunción tiroidea podrían contribuir a la disminución del riesgo cardiovascular en los pacientes con diabetes.
A pesar de la frecuente asociación de DM1 y ETA, son escasos los estudios de prevalencia de ambos procesos en nuestro país10–14. Además, la mayoría han sido realizados en un escaso número de pacientes y, por lo general, no analizan parámetros clínicos o metabólicos potencialmente relacionados. Por todo ello, con este estudio nos proponemos analizar la prevalencia de ETA en pacientes con DM1 y su relación con variables demográficas, clínicas y de control metabólico.
Material y métodosSe realizó un estudio observacional y descriptivo de la presencia de ETA en pacientes con DM1 y su relación con parámetros clínicos y de control metabólico en una amplia cohorte de pacientes en seguimiento por la Unidad de Endocrinología y Nutrición del Hospital Universitario Puerta del Mar de Cádiz.
Los datos analizados proceden de las historias clínicas informatizadas (aplicación HP-Doctor) de los pacientes con DM1, que es cumplimentada en el 100% de los pacientes atendidos tanto en el ámbito de la hospitalización como en consultas externas y en el hospital de día. En esta historia informatizada se incorporan todos los datos epidemiológicos, clínicos y analíticos, y otras exploraciones complementarias realizadas. Tanto el diagnóstico principal como los secundarios de cada paciente son seleccionados de un diccionario estandarizado en el cual se incluye, entre otros, el diagnóstico «diabetes tipo 1» según los criterios de la Asociación Americana de Diabetes (ADA)15. Para realizar el presente análisis seleccionamos a todos aquellos pacientes con diagnóstico principal o secundario de «diabetes tipo 1» mayores de 14 años atendidos en el último año.
La presencia de ETA fue detectada mediante el análisis individual de los antecedentes y diagnósticos secundarios de cada paciente, específicamente tras la identificación de los diagnósticos secundarios «hipotiroidismo primario», «hipotiroidismo subclínico», «enfermedad tiroidea autoinmune» y «enfermedad de Graves». Adicionalmente, se recogieron las determinaciones hormonales tiroideas realizadas en el último año (niveles de TSH y T4L, si estaban disponibles). Por último, la base de datos del laboratorio fue consultada para evaluar la presencia de anticuerpos antitiroperoxidasa (anti-TPO) en todos los pacientes estudiados.
Una vez identificados los pacientes con DM1, se procedió a realizar una tabulación de datos incorporando las variables demográficas, clínicas, analíticas y hormonales disponibles, descartándose los pacientes con DM1 sin determinación de hormona hipofisaria estimulante del tiroides (TSH) sérica en el último año. Dentro de las variables demográficas y clínicas se incluyeron edad, sexo, tabaquismo, tiempo de evolución de la diabetes, índice de masa corporal, presencia de hipertensión arterial conocida, comorbilidades asociadas, y tratamientos con estatinas, levotiroxina y antitiroideos de síntesis. En lo que se refiere a los parámetros analíticos, se analizaron los valores de HbA1c, colesterol total, colesterol LDL (c-LDL) y colesterol HDL (c-HDL). El nivel de HbA1c se determinó en un autoanalizador Cobas Integra 700 (Roche Diagnostics) mediante método inmunoturbidimétrico para sangre completa hemolizada anticoagulada y estandarizados según valores de DCCT, con un intervalo de referencia para sujetos sanos de 4,5-5,7% y una sensibilidad analítica (límite inferior de detección) del 3%. Los niveles de colesterol total y sus fracciones se cuantificaron por método directo en un autoanalizador de bioquímica Modular DPD (Roche Diagnostics) mediante test enzimático colorimétrico. Los niveles séricos de TSH y tiroxina libre (TL4) se analizaron mediante técnica de inmunoensayo de electroquimioluminiscencia, cuantificándose en inmunoanalizadores Cobas E. Para la TSH los valores de referencia se hallaban entre 0,27 y 4,2 μC1UI/mL, y para la TL4 entre 0,93 y 1,7 ng/dL. Se consideraron pacientes con hipotiroidismo primario aquellos en tratamiento con levotiroxina o los que presentaban niveles de TSH >10 μUI/mL y de TL4 <0,93 ng/mL, y con hipotiroidismo subclínico aquellos con TSH >4 mUI/mL y TL4 normal (0,93-1,7 ng/dL) sin tratamiento con levotiroxina. La determinación de anti-TPO se realizó mediante técnica de inmunoensayo de electroquimioluminiscencia, cuantificándose en inmunoanalizadores Cobas E, siendo considerados positivos aquellos valores >34 UI/mL.
Los datos fueron analizados mediante el programa estadístico SPSS versión 12.0 para Windows. El análisis descriptivo de las variables cualitativas se realizó mediante el cálculo de las frecuencias y los porcentajes, y el de las cuantitativas mediante la media y la desviación típica. Tras la comprobación del supuesto de normalidad en la muestra con la prueba de Shapiro-Wilk, se realizaron las siguientes pruebas: para comparar las variables cuantitativas entre grupos independientes se utilizó el test de Student, y para comparar las variables cualitativas entre grupos independientes el test de la ji al cuadrado y (cuando estaba indicado) el test exacto de Fisher. Todos los valores de significación se refieren al test de dos colas, considerando la asociación estadísticamente significativa si p <0,05.
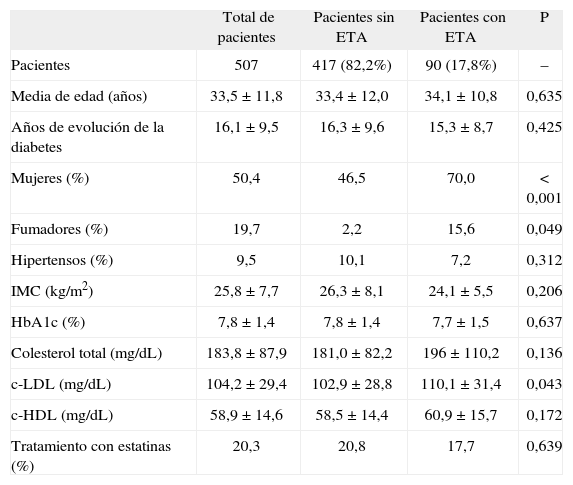
ResultadosSe incluyó a un total de 507 pacientes diagnosticados de DM1, con una media de edad de 33,5 ± 11,8 años (media ± DE), un tiempo de evolución de la DM1 de 16,1 ± 9,5 años (media ± DE) y una proporción de género muy similar (50,4% de mujeres). Los pacientes presentaron valores medios de HbA1c del 7,8 ± 1,4% (media ± DE), colesterol total de 183,8 ± 87,9 mg/dL (media ± DE), c-LDL de 104,2 ± 29,4 mg/dL (media ± DE) y c-HDL de 58,9 ± 14 mg/dL (media ± DE) (tabla 1).
Diferencias clínicas y metabólicas entre pacientes con y sin enfermedad tiroidea autoinmune (ETA)
| Total de pacientes | Pacientes sin ETA | Pacientes con ETA | P | |
| Pacientes | 507 | 417 (82,2%) | 90 (17,8%) | – |
| Media de edad (años) | 33,5 ± 11,8 | 33,4 ± 12,0 | 34,1 ± 10,8 | 0,635 |
| Años de evolución de la diabetes | 16,1 ± 9,5 | 16,3 ± 9,6 | 15,3 ± 8,7 | 0,425 |
| Mujeres (%) | 50,4 | 46,5 | 70,0 | <0,001 |
| Fumadores (%) | 19,7 | 2,2 | 15,6 | 0,049 |
| Hipertensos (%) | 9,5 | 10,1 | 7,2 | 0,312 |
| IMC (kg/m2) | 25,8 ± 7,7 | 26,3 ± 8,1 | 24,1 ± 5,5 | 0,206 |
| HbA1c (%) | 7,8 ± 1,4 | 7,8 ± 1,4 | 7,7 ± 1,5 | 0,637 |
| Colesterol total (mg/dL) | 183,8 ± 87,9 | 181,0 ± 82,2 | 196 ± 110,2 | 0,136 |
| c-LDL (mg/dL) | 104,2 ± 29,4 | 102,9 ± 28,8 | 110,1 ± 31,4 | 0,043 |
| c-HDL (mg/dL) | 58,9 ± 14,6 | 58,5 ± 14,4 | 60,9 ± 15,7 | 0,172 |
| Tratamiento con estatinas (%) | 20,3 | 20,8 | 17,7 | 0,639 |
IMC: índice de masa corporal. Datos expresados en porcentajes y media ± desviación estándar.
Un total de 90 pacientes con DM1 (17,8% del total) presentaban ETA conocida (por orden de frecuencia, hipotiroidismo primario [9,9%], hipotiroidismo subclínico [7,1%] y enfermedad de Graves [0,8%]). Entre los pacientes con enfermedad tiroidea conocida, se detectaron anti-TPO en tan sólo un 41,1% de los casos, resultando negativos en el 25,6%. En el 33,3% de los pacientes no se disponía de determinación de anti-TPO, fundamentalmente en aquellos pacientes con hipotiroidismo primario de larga evolución.
Como puede observarse en la tabla 1, la enfermedad tiroidea fue más prevalente en mujeres (70 frente a 46,5%; p <0,001) y en fumadores (15,6 frente a 2,2%; p= 0,049). No se encontraron diferencias estadísticamente significativas en función de la edad, el tiempo de evolución de la diabetes o el índice de masa corporal (IMC).
Con respecto a la relación entre la presencia de enfermedad tiroidea y el grado de control metabólico, se observó que mientras el nivel medio de HbA1c, colesterol total y c-HDL fue similar en ambos grupos de pacientes, aquellos con ETA conocida presentaban mayores niveles de c-LDL (110,1 ± 31,4 frente a 102,9 ± 28,8 mg/dL; p <0,043), a pesar de no existir diferencias significativas en el consumo de estatinas (20,8 frente a 17,7%; p= 0,639).
DiscusiónEn la actualidad es bien conocida la asociación entre DM1 y ETA, que suele manifestarse generalmente como hipotiroidismo (clínico o subclínico) o hipertiroidismo primario1–6. Esta mayor prevalencia de enfermedad tiroidea en los pacientes con DM1 está documentada por diferentes estudios clínicos, algunos de los cuales han sido realizados recientemente en nuestro país10–14. Los resultados de nuestro trabajo muestran una elevada prevalencia de ETA en pacientes con DM1 (17%). No obstante, este resultado es similar a los publicados por otros autores en estudios internacionales, la mayoría de ellos realizados en población pediátrica, en los que la prevalencia de ETA se encuentra entre el 15,8 y el 43,7%16,17. Cabe destacar en este sentido el estudio de Kordonouri et al.4, que incluye a 7.097 pacientes con DM1, una media de edad de 12 años, una prevalencia de enfermedad tiroidea del 15,8% y una prevalencia de anticuerpos antitiroideos positivos del 21,6%. En el ámbito nacional destaca el estudio de Fernán-dez-Castañer et al., realizado en 111 pacientes con reciente diagnóstico de DM1, que presentaban una prevalencia de enfermedad tiroidea del 15,3% y de anticuerpos antitiroideos positivos del 24,5%. En este estudio, de forma similar a nuestros resultados, los autores no encuentran asociación entre la presencia de enfermedad tiroidea y la evolución y presentación clínica de la diabetes10.
Es bien conocido que en pacientes con DM1 el principal marcador de riesgo para la aparición de enfermedad tiroidea es el desarrollo de anticuerpos antitiroideos (anti-TPO, anti-TG y TSI)1,6. De esta forma, se ha observado que aquellos con anticuerpos antitiroideos positivos presentan un riesgo hasta 18 veces mayor de desarrollar enfermedad tiroidea, si bien el hipotiroidismo primario puede presentarse también hasta en el 20-30% de los pacientes con anticuerpos antitiroideos negativos18, dato muy similar al obtenido en nuestro estudio, en el que el 25,6% de los pacientes con ETA presentaban anticuerpos antitiroideos negativos. Por otro lado, si bien parece que la prevalencia de enfermedad tiroidea aumenta en relación con la edad y con el tiempo de evolución de la diabetes19,20, no se ha documentado una mayor prevalencia en pacientes con mal control metabólico, aunque hay pocos estudios que evalúen esta relación.
A diferencia de otros trabajos19,20, en nuestro estudio no encontramos una asociación entre el tiempo de evolución de la diabetes y la presencia de ETA, así como tampoco con el control glucémico de la enfermedad, representado por los niveles medios de HbA1c. Sin embargo, sí evidenciamos una elevada prevalencia de ETA en mujeres (la presentaban el 24,6% frente al 10,8% de los varones), y en pacientes con hábito tabáquico. Este último hallazgo es relevante pues, si bien la frecuente asociación de ETA y DM1 en mujeres ya era bien conocida11,13,14, no tenemos constancia de estudios que relacionen el tabaquismo con el aumento de prevalencia de ETA en pacientes con DM1. En este sentido, sí está documentado en población general un aumento del riesgo de enfermedad de Graves en pacientes fumadores21.
El hipotiroidismo primario se asocia a diversas alteraciones del metabolismo lipídico, debido fundamentalmente a la disminución del aclaramiento y metabolismo de los ácidos grasos libres. Como consecuencia, es habitual detectar en estos pacientes elevaciones plasmáticas de colesterol total, c-LDL y, en ocasiones, triglicéridos22. Esta alteración también sucede en los pacientes con hipotiroidismo subclínico, en los cuales suelen detectarse niveles elevados de c-LDL y lipoproteína(a)23.
La presencia de enfermedad tiroidea se ha relacionado con un aumento del riesgo cardiovascular7, sobre todo en casos de hipotiroidismo primario. Este aumento del riesgo cardiovascular se asocia a la alteración del metabolismo lipídico subyacente, al incremento de la presión arterial diastólica y a la elevación de los niveles de homocisteína C y proteína C reactiva24. En el caso del hipotiroidismo subclínico y la enfermedad tiroidea autoinmune, esta asociación no está del todo aclarada, aunque existen estudios que relacionan la presencia de hipotiroidismo subclínico con un incremento del riesgo de aterosclerosis y enfermedad cardiovascular25–27. Se sabe que el tratamiento con levotiroxina mejora el perfil lipídico de los pacientes con hipotiroidismo primario, así como el resto de factores de riesgo cardiovascular28,29. Estos efectos beneficiosos no han sido demostrados de forma concluyente en el caso del hipotiroidismo subclínico y la enfermedad tiroidea autoinmune silente. En esta línea, hemos observado que los pacientes con ETA presentan niveles más elevados de c-LDL, independientemente del tratamiento con estatinas. Este hecho resulta importante, ya que uno de los objetivos de tratamiento en el paciente con DM1 es el estricto control lipídico, recomendándose en las guías de práctica clínica la consecución de niveles de c-LDL inferiores a 100 mg/ dL30,31. Por tanto, en pacientes con DM1 y ETA, los niveles de c-LDL, junto con los de TSH, podrían ser útiles para la monitorización del tratamiento con levotiroxina, o para el ajuste de éste (si ya lo recibían).
En cuanto a las recomendaciones actuales para el cribado de la ETA en pacientes con DM1, no está claramente establecido cuándo y cómo se debe realizar. La ADA recomienda la determinación de TSH en el momento del diagnóstico y, posteriormente, ante la existencia de síntomas de disfunción tiroidea, cada 1–2 años. No se refleja la conveniencia de la determinación de anticuerpos antitiroideos como parte del cribado30. Según la guía NICE, se debe realizar un cribado mediante la determinación de hormonas tiroideas en el momento del diagnóstico y, posteriormente, con periodicidad anual. Tampoco la guía NICE (al igual que la de la ADA) menciona la necesidad de determinación de anticuerpos antitiroideos31. Además, es importante recordar la conveniencia de descartar otras enfermedades autoinmunes frecuentes en estos pacientes, a menudo inadvertidas o paucisintomáticas, como la enfermedad celiaca, la gastritis crónica atrófica y otros procesos autoinmunes organoespecíficos.
En resumen, los resultados de nuestro estudio confirman que los pacientes con DM1 presentan una elevada prevalencia de enfermedad tiroidea (17,8%) y que ésta se asocia al sexo femenino, el tabaquismo activo y la presencia de niveles elevados de c-LDL. Estos datos apoyan la necesidad de realizar un cribado sistemático de esta patología en todos los pacientes con DM1, mediante la valoración de la función hormonal y la determinación de anticuerpos antitiroideos.
AgradecimientosEste trabajo ha sido parcialmente patrocinado por el Plan Andaluz de Investigación (PAI; CTS-368).
Declaración de potenciales conflictos de interesesM.G. Baena, F. Carral, M. M. Roca, M. Cayón, J. Ortego y M. Aguilar- Diosdado declaran que no existen conflictos de intereses en relación con el contenido del presente artículo.